引用本文: 袁南兵, 楊閻峙, 譚翠霞, 冉興無. 大氣壓低溫等離子體治療慢性皮膚潰瘍的作用機制. 中國修復重建外科雜志, 2024, 38(10): 1283-1288. doi: 10.7507/1002-1892.202404027 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
宇宙中99%以上的可見物質都是以等離子體態存在[1]。自然狀態下等離子體產生需要高溫、高壓環境,隨著人工生成等離子體技術的進步,其已廣泛應用于工業、軍事、航天航空以及能源等領域[2-4]。21世紀初,大氣壓低溫等離子體(cold atmospheric plasma,CAP)的出現為等離子體在農業、醫學和生物工程領域的應用帶來了革命性的變化,“等離子體醫學”也應運而生[5-6]。
CAP在大氣壓下產生,因溫度接近或略高于室溫,不會對生物組織和細胞造成熱傷害,含有的各種粒子具有獨特生物學活性,已經廣泛用于消毒滅菌[7]和食品改性[8],臨床上已用于惡性腫瘤[9-10]、種植牙感染[11]、特應性皮炎[12]等疾病的治療。慢性皮膚潰瘍治療難度大、費用高,嚴重影響患者生活質量,增加社會疾病負擔,臨床亟需新的有效治療手段[13]。近年來,CAP在皮膚潰瘍治療中的應用逐漸增多[14-16],但作用機制尚未完全明確。現回顧相關文獻,探討CAP治療慢性皮膚潰瘍的作用機制、有效性及安全性等,以供創面治療基礎或臨床研究者參考。
1 CAP的產生與活性成分
1.1 產生CAP的設備
氣體在高電壓下部分電離即可形成等離子體。為產生溫度在40℃以下、對活體組織及細胞不造成熱傷害,以及方便臨床使用的CAP,各種不同類型等離子體發生器相繼被開發出來。等離子體發生器在產生CAP時需要合適的激發電源、放電形式、放電結構、放電頻率、放電電壓和工作氣體(氦氣、氬氣、氧氣及氮氣等) [17]。
等離子體根據來源分為直接等離子體和間接等離子體,研究人員基于此設計了各種等離子體發生器[18]。直接等離子體發生器是將待處理的皮膚或創面作為介質置于高壓電極之間,CAP在空隙中產生,臨床常用設備是介質阻擋放電(dielectric barrier discharges,DBD)等離子發生器,如PlasmaDerm?、plasma care?等[19]。DBD放電時間10~100 ns、能量密度為1×1014~1×1016/cm3、頻率10 kHz~10 MHz [3]。間接等離子體發生器是將電離氦氣、氬氣等工作氣體形成的大氣壓等離子體射流(atmospheric pressure plasma jet,APPJ)輸送到皮膚或潰瘍表面進行治療,其相關醫療產品豐富,主要有kINPen?、MicroPlaSter?等[19]。APPJ可持續放電、能量密度1×109~1×1010/cm3、頻率40 kHz~100 MHz[3]。
目前使用的APPJ產品大多為可手持的筆式設備,實際操作非常方便,已逐漸成為科研和臨床常用的CAP設備,但治療較大面積潰瘍時耗時很長[18]。DBD的優勢是對工作氣體要求不高,治療面積較大,適用于大面積表淺創面[9];但存在設備體積較大、無法控制治療面積、治療時有電流通過皮膚組織存在安全隱患,以及治療時活性成分濃度較低等不足。為了臨床使用更方便,學者們不斷研究開發新的設備。Hong等[20]研發了一種等離子體刷,治療效率較APPJ更高,在床旁操作更方便,目前正在進行臨床前研究。
1.2 CAP的活性成分
CAP含有多種活性成分,如電子、正負離子、氧自由基(reactive oxygen species,ROS)、氮自由基(reactive nitrogen species,RNS)以及紫外線等,這些成分與空氣中的氧氣、氮氣、水蒸氣相互作用,產生多種物理、化學反應,進而引起生物學效應[21]。
不同的CAP發生器參數各異,使用的工作氣體也不同,導致產生的CAP中含有的活性成分(如電子、帶電粒子、自由基)有明顯差異,造成基于某種疾病生產的治療設備不能直接用于其他疾病的治療[22]。即使使用相同設備,通過調節工作電壓、氣流速度和治療時間也會改變活性成分的治療強度,產生不同的生物學效應[21]。因此,如何精確控制CAP中的活性成分含量是產生療效和減少副作用的關鍵。在慢性皮膚潰瘍感染期、炎癥期、增生期和修復期,活性成分對潰瘍面發揮著不同的作用,治療劑量可能需要根據潰瘍分期進行相應調整[19]。
2 CAP促進慢性皮膚潰瘍愈合的作用機制
經規范治療超過1個月未痊愈的皮膚潰瘍稱為“慢性皮膚潰瘍” [13]。臨床常見的慢性皮膚潰瘍類型包括糖尿病性潰瘍、壓力性潰瘍和血管性潰瘍,其共同病理機制包括持續存在的感染、耐藥生物膜形成、過多的炎癥反應以及局部缺血等[23-24]。CAP中含有的活性成分通過不同途徑作用于慢性皮膚潰瘍,促進潰瘍愈合。
2.1 對潰瘍表面的滅菌作用
感染是導致皮膚潰瘍延遲愈合或經久不愈的主要原因,特別是多重耐藥菌(如金黃色葡萄球菌、銅綠假單胞菌等)感染[25]。CAP產生的ROS、RNS等活性成分能有效殺滅包括細菌[26-27]、病毒[28]和真菌[29]在內的多種病原微生物,為創面修復創造條件。Nam等[30]研究發現,CAP能同時殺滅潰瘍表面的金黃色葡萄球菌和耐甲氧西林金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA),并且即使隔著醫用紗布也有滅菌效果,但效果會隨著紗布層數的增加而減弱。Mohd等[31]比較了直接和間接等離子體發生器用于殺滅來源于慢性潰瘍的3種MRSA菌株和4種銅綠假單胞菌菌株的效果,發現間接等離子體滅菌作用更快,銅綠假單胞菌對等離子體治療更敏感。
在難治性慢性皮膚潰瘍中,細菌或真菌生物膜的形成是導致治療失敗的重要原因,聚集在生物膜基質內的病原微生物能夠抵抗抗生素和機體免疫系統的攻擊[32]。Wang等[33]研究發現使用APPJ處理金黃色葡萄球菌生物膜30 min后,生物膜內80%細菌失活。體內和體外研究均發現,CAP能破壞MRSA和銅綠假單胞菌生物膜結構,改變生物膜滲透性,提高抗生素治療的敏感性,和抗生素聯合治療可能是更好的選擇[34-35]。Baz等[36]發現使用CAP處理5 min能有效控制白色念珠菌和銅綠假單胞菌生物膜的形成,但對耳念珠菌和金黃色葡萄球菌生物膜的控制作用較差,說明CAP滅菌作用也存在菌株依耐性。
CAP的滅菌機制還未完全清楚,目前認為主要依靠其含有的ROS、RNS和紫外線等活性成分。治療中CAP對細菌產生氧化損傷,破壞細菌細胞壁,改變細菌蛋白質、核酸的結構和功能,阻止細菌生物膜形成。CAP殺滅革蘭陰性菌的效果優于革蘭陽性菌,部分細菌會通過產生抗氧化應激相關蛋白而對CAP產生耐受[32, 35-36]。
此外,CAP的滅菌效果具有時間依賴性,殺滅不同菌株及生物膜的時間不同[31, 33, 37]。在達到滅菌效果的同時,CAP是否對正常皮膚組織造成傷害是活體研究需要關注的主要問題。Li等[38]研究發現使用APPJ設備分別處理金黃色葡萄球菌、大腸桿菌和銅綠假單胞菌3 min后,3種細菌均完全失活。而使用相同劑量處理人體細胞后,90%以上皮膚角質細胞和70%成纖維細胞在24 h后仍存活,說明人體細胞對CAP的耐受性明顯好于細菌。臨床研究也證實,CAP在有效減少潰瘍面細菌負荷的同時不會損傷人體組織[39],其作用機制有待深入研究。
2.2 對局部炎癥的影響
適當的炎癥反應是潰瘍愈合的基礎,但炎癥反應劇烈或不足都會影響創面愈合進程。在治療慢性皮膚潰瘍時,CAP通過氧化應激改變免疫細胞行為,下調數種細胞因子表達來抑制炎癥反應程度,減輕局部微環境持續的炎癥狀態,幫助潰瘍進入愈合期[40]。
創面炎癥過程始于嗜中性粒細胞外滲,接著是細胞滾動、黏附、爬行和傳遞,這個過程依賴選擇素和整合素的相互作用。Kupke等[41]發現通過調節細胞表面選擇素和整合素的表達,CAP處理潰瘍創面2 min就能降低嗜中性粒細胞的遷移能力,處理5 min能抑制嗜中性粒細胞誘導的炎癥反應,但不誘導細胞凋亡。
正常皮膚的保護層維持著弱酸性環境,慢性皮膚潰瘍表面由于持續存在的炎癥而呈堿性。CAP治療時,RNS、ROS在潰瘍表面會生成硝酸鹽和亞硝酸鹽,導致局部pH值下降[37],弱酸性環境除了有滅菌作用外,還能阻斷炎癥過程[42]。
2.3 促進組織再生和潰瘍愈合
清除感染、控制炎癥是潰瘍愈合的基礎,除此之外,慢性皮膚潰瘍的病理生理機制還包括組織缺血和細胞修復機制的破壞等[43],其中涉及復雜的細胞和分子機制。CAP可在不同層面對潰瘍愈合過程進行調節。
CAP通過誘導與創面愈合相關的關鍵基因表達,增加角質形成細胞中神經營養因子、表皮生長因子、VEGF、內皮素1、FGF-2及IL-8等的表達,調節成纖維細胞中血管生成素、內皮抑素、基質金屬蛋白酶9、基質金屬蛋白酶抑制劑1以及VEGF的表達,調節細胞抗氧化酶的效應,改變細胞周期,促進新生血管形成,促進角質形成細胞、成纖維細胞、內皮細胞的增殖和轉化[44-46]。
CAP還可以通過改變信號分子的磷酸化來調節黏附分子、連接蛋白和整合素的表達,促進成纖維細胞、上皮細胞、角質細胞的遷移和轉化,增加組織灌注、基質重建,誘導真皮再生[47]。
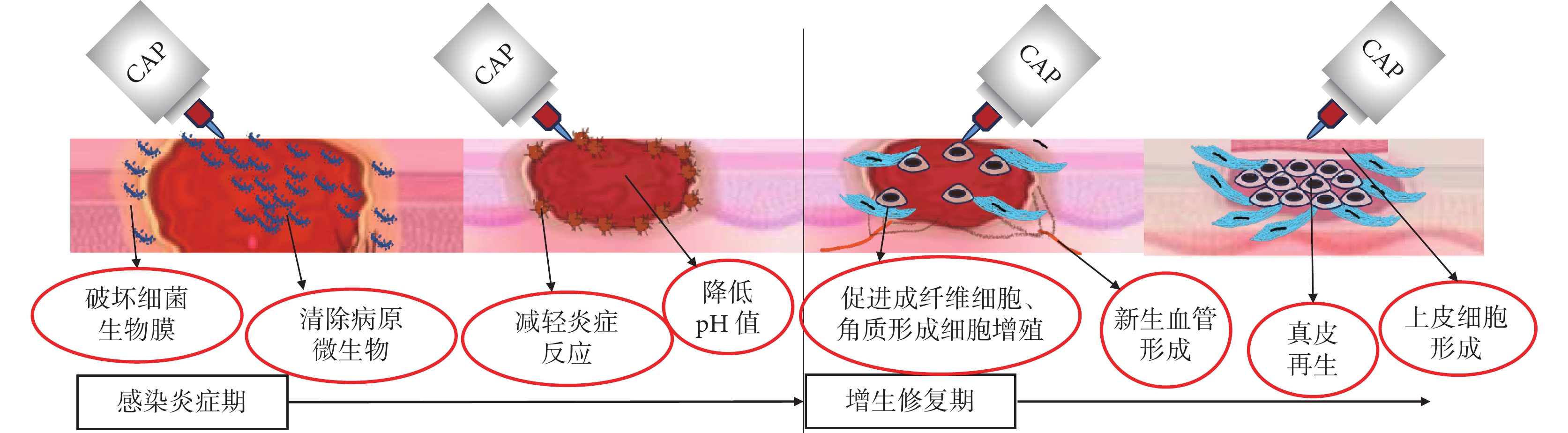
另外,表皮細胞和真皮成纖維細胞的相互交流在皮膚修復中也起著重要作用,Hippo信號通路及其下游效應物是細胞間相互交流的重要途徑[48]。CAP處理后上皮細胞和成纖維細胞中Hippo轉錄因子上調,Hippo信號通路下游的結締組織生長因子和富含半胱氨酸的血管生成蛋白表達增加,共同促進角質形成細胞的形成 [45, 49]。CAP的主要作用機制見圖1。
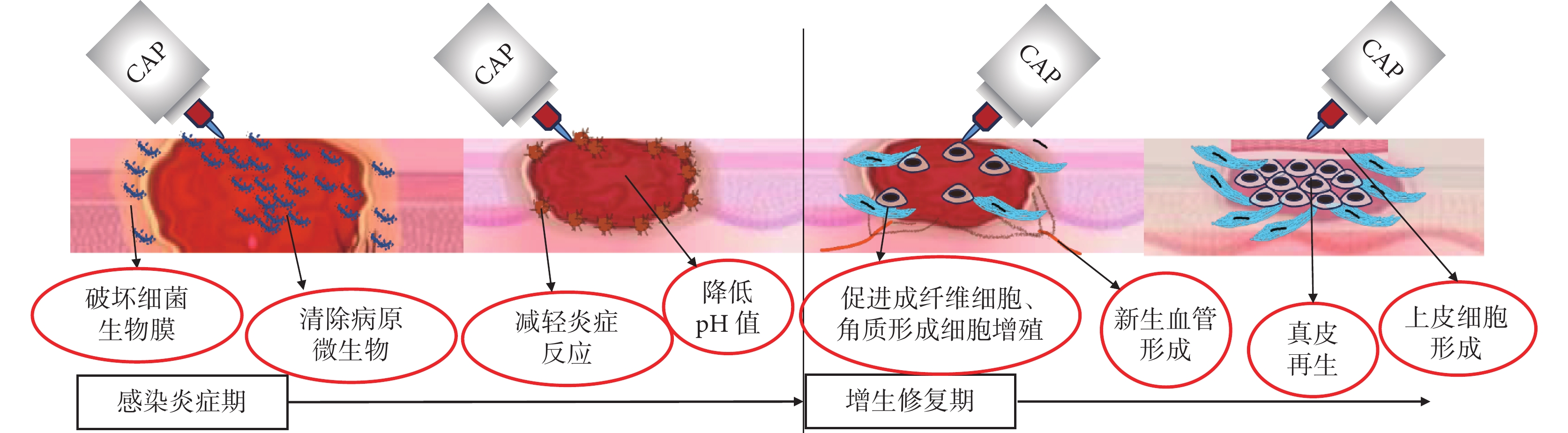 圖1
CAP治療慢性皮膚潰瘍的主要作用機制
Figure1.
The mechanism of CAP in the treatment of chronic skin ulcer
圖1
CAP治療慢性皮膚潰瘍的主要作用機制
Figure1.
The mechanism of CAP in the treatment of chronic skin ulcer
3 CAP治療慢性皮膚潰瘍的動物實驗
動物實驗主要探索CAP促進潰瘍愈合的機制以及合適的治療方式、劑量,明確CAP治療的有效性和安全性。
3.1 CAP的治療效果
早期研究發現,無論是急性還是慢性皮膚潰瘍,CAP都能促進創面收縮和上皮形成,加快創面愈合[50]。在用于慢性皮膚潰瘍模型時,CAP通過各種途徑發揮抗感染、減輕炎癥、促進增生的作用,有效促進潰瘍愈合。治療中很少出現副作用,即使因治療時間過長出現的副作用也比較輕微[51-55]。
糖尿病性潰瘍是慢性皮膚潰瘍中發病率最高的一種類型,治療難度最大。CAP用于治療糖尿病性潰瘍能調節局部細胞多種基因的表達,改善炎癥反應,增加血管形成,促進潰瘍愈合,具有良好的臨床應用前景[52-54]。
盡管各項研究使用的CAP設備各不相同,治療時間和頻率也有差異,但并沒有明顯影響治療效果,如果能找到合適的治療時間和頻率,就能在保證治療效果前提下,將副作用降至最低。近年CAP治療慢性皮膚潰瘍的動物實驗見表1。
3.2 CAP治療慢性皮膚潰瘍的優勢和不足
CAP治療慢性皮膚潰瘍的最大優勢是廣譜抗微生物效應。不同種類的細菌和真菌,無論是否耐藥,CAP都能有效進行殺滅,阻止生物膜形成,反復使用不容易產生耐藥性。在滅菌劑量下,CAP的活性成分對皮膚和組織不造成明顯傷害,具有良好的安全性[50-54]。遠期安全性方面,Rutkowski等[56]對使用CAP治療皮膚損傷患者隨訪5年結果顯示,CAP治療區皮膚未見惡性腫瘤、炎癥反應或細胞結構的病理性改變。
CAP另一個優勢是在慢性皮膚潰瘍愈合不同階段均能發揮作用,早期抗感染、抗炎,后期改善組織灌注、促進組織修復,治療適應證更廣泛。此外,與臨床使用敷料相比,CAP治療不產生醫療垃圾,對環境更加友好。
CAP治療慢性皮膚潰瘍面對的主要問題是沒有規范的治療標準。不同研究所用的設備參差不齊,如何選擇設備和治療參數、治療劑量、治療頻率還需要更多研究[57]。雖然常規治療對正常皮膚和組織損傷較少,但損傷仍然存在,過量使用有可能會適得其反。
在慢性皮膚潰瘍愈合的不同階段,CAP的治療劑量和頻率需要根據潰瘍狀態進行調整,才能達到最佳治療效果[19],使用時需要有經驗的醫師對潰瘍進行動態評估。
4 總結及展望
CAP作為一種新的慢性皮膚潰瘍治療方式有其獨特的作用機制,APPJ和DBD是兩種主要治療設備,產生的CAP含有帶電粒子、ROS、RNS、紫外線等活性成分,在治療時通過殺滅多種病原微生物及耐藥菌,破壞細菌和真菌生物膜,減輕創面感染;調節創面局部微環境的炎癥反應和酸堿度,為組織修復創造條件;通過調節創面細胞基因表達和信號分子促進血管生成,改善微循環,促進肉芽組織增生和上皮形成。目前,動物實驗已證明CAP治療各種慢性皮膚潰瘍,特別是糖尿病性潰瘍,的有效性和安全性。臨床已開展病例觀察[14-15]和小規模隨機對照研究[16, 58],顯示了其未來發展的潛力。在保證安全的基礎上,研究人員需要繼續探索CAP治療慢性皮膚潰瘍的最佳條件和治療劑量,制訂CAP應用共識和指南,規范臨床行為,以達到更好、更穩定的療效。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點
作者貢獻聲明 袁南兵:綜述構思、文獻收集、文章撰寫;楊閻峙、譚翠霞:文章修改、分析總結;冉興無:對文章的知識性內容作批評性審閱,提出重要參考思路
宇宙中99%以上的可見物質都是以等離子體態存在[1]。自然狀態下等離子體產生需要高溫、高壓環境,隨著人工生成等離子體技術的進步,其已廣泛應用于工業、軍事、航天航空以及能源等領域[2-4]。21世紀初,大氣壓低溫等離子體(cold atmospheric plasma,CAP)的出現為等離子體在農業、醫學和生物工程領域的應用帶來了革命性的變化,“等離子體醫學”也應運而生[5-6]。
CAP在大氣壓下產生,因溫度接近或略高于室溫,不會對生物組織和細胞造成熱傷害,含有的各種粒子具有獨特生物學活性,已經廣泛用于消毒滅菌[7]和食品改性[8],臨床上已用于惡性腫瘤[9-10]、種植牙感染[11]、特應性皮炎[12]等疾病的治療。慢性皮膚潰瘍治療難度大、費用高,嚴重影響患者生活質量,增加社會疾病負擔,臨床亟需新的有效治療手段[13]。近年來,CAP在皮膚潰瘍治療中的應用逐漸增多[14-16],但作用機制尚未完全明確。現回顧相關文獻,探討CAP治療慢性皮膚潰瘍的作用機制、有效性及安全性等,以供創面治療基礎或臨床研究者參考。
1 CAP的產生與活性成分
1.1 產生CAP的設備
氣體在高電壓下部分電離即可形成等離子體。為產生溫度在40℃以下、對活體組織及細胞不造成熱傷害,以及方便臨床使用的CAP,各種不同類型等離子體發生器相繼被開發出來。等離子體發生器在產生CAP時需要合適的激發電源、放電形式、放電結構、放電頻率、放電電壓和工作氣體(氦氣、氬氣、氧氣及氮氣等) [17]。
等離子體根據來源分為直接等離子體和間接等離子體,研究人員基于此設計了各種等離子體發生器[18]。直接等離子體發生器是將待處理的皮膚或創面作為介質置于高壓電極之間,CAP在空隙中產生,臨床常用設備是介質阻擋放電(dielectric barrier discharges,DBD)等離子發生器,如PlasmaDerm?、plasma care?等[19]。DBD放電時間10~100 ns、能量密度為1×1014~1×1016/cm3、頻率10 kHz~10 MHz [3]。間接等離子體發生器是將電離氦氣、氬氣等工作氣體形成的大氣壓等離子體射流(atmospheric pressure plasma jet,APPJ)輸送到皮膚或潰瘍表面進行治療,其相關醫療產品豐富,主要有kINPen?、MicroPlaSter?等[19]。APPJ可持續放電、能量密度1×109~1×1010/cm3、頻率40 kHz~100 MHz[3]。
目前使用的APPJ產品大多為可手持的筆式設備,實際操作非常方便,已逐漸成為科研和臨床常用的CAP設備,但治療較大面積潰瘍時耗時很長[18]。DBD的優勢是對工作氣體要求不高,治療面積較大,適用于大面積表淺創面[9];但存在設備體積較大、無法控制治療面積、治療時有電流通過皮膚組織存在安全隱患,以及治療時活性成分濃度較低等不足。為了臨床使用更方便,學者們不斷研究開發新的設備。Hong等[20]研發了一種等離子體刷,治療效率較APPJ更高,在床旁操作更方便,目前正在進行臨床前研究。
1.2 CAP的活性成分
CAP含有多種活性成分,如電子、正負離子、氧自由基(reactive oxygen species,ROS)、氮自由基(reactive nitrogen species,RNS)以及紫外線等,這些成分與空氣中的氧氣、氮氣、水蒸氣相互作用,產生多種物理、化學反應,進而引起生物學效應[21]。
不同的CAP發生器參數各異,使用的工作氣體也不同,導致產生的CAP中含有的活性成分(如電子、帶電粒子、自由基)有明顯差異,造成基于某種疾病生產的治療設備不能直接用于其他疾病的治療[22]。即使使用相同設備,通過調節工作電壓、氣流速度和治療時間也會改變活性成分的治療強度,產生不同的生物學效應[21]。因此,如何精確控制CAP中的活性成分含量是產生療效和減少副作用的關鍵。在慢性皮膚潰瘍感染期、炎癥期、增生期和修復期,活性成分對潰瘍面發揮著不同的作用,治療劑量可能需要根據潰瘍分期進行相應調整[19]。
2 CAP促進慢性皮膚潰瘍愈合的作用機制
經規范治療超過1個月未痊愈的皮膚潰瘍稱為“慢性皮膚潰瘍” [13]。臨床常見的慢性皮膚潰瘍類型包括糖尿病性潰瘍、壓力性潰瘍和血管性潰瘍,其共同病理機制包括持續存在的感染、耐藥生物膜形成、過多的炎癥反應以及局部缺血等[23-24]。CAP中含有的活性成分通過不同途徑作用于慢性皮膚潰瘍,促進潰瘍愈合。
2.1 對潰瘍表面的滅菌作用
感染是導致皮膚潰瘍延遲愈合或經久不愈的主要原因,特別是多重耐藥菌(如金黃色葡萄球菌、銅綠假單胞菌等)感染[25]。CAP產生的ROS、RNS等活性成分能有效殺滅包括細菌[26-27]、病毒[28]和真菌[29]在內的多種病原微生物,為創面修復創造條件。Nam等[30]研究發現,CAP能同時殺滅潰瘍表面的金黃色葡萄球菌和耐甲氧西林金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA),并且即使隔著醫用紗布也有滅菌效果,但效果會隨著紗布層數的增加而減弱。Mohd等[31]比較了直接和間接等離子體發生器用于殺滅來源于慢性潰瘍的3種MRSA菌株和4種銅綠假單胞菌菌株的效果,發現間接等離子體滅菌作用更快,銅綠假單胞菌對等離子體治療更敏感。
在難治性慢性皮膚潰瘍中,細菌或真菌生物膜的形成是導致治療失敗的重要原因,聚集在生物膜基質內的病原微生物能夠抵抗抗生素和機體免疫系統的攻擊[32]。Wang等[33]研究發現使用APPJ處理金黃色葡萄球菌生物膜30 min后,生物膜內80%細菌失活。體內和體外研究均發現,CAP能破壞MRSA和銅綠假單胞菌生物膜結構,改變生物膜滲透性,提高抗生素治療的敏感性,和抗生素聯合治療可能是更好的選擇[34-35]。Baz等[36]發現使用CAP處理5 min能有效控制白色念珠菌和銅綠假單胞菌生物膜的形成,但對耳念珠菌和金黃色葡萄球菌生物膜的控制作用較差,說明CAP滅菌作用也存在菌株依耐性。
CAP的滅菌機制還未完全清楚,目前認為主要依靠其含有的ROS、RNS和紫外線等活性成分。治療中CAP對細菌產生氧化損傷,破壞細菌細胞壁,改變細菌蛋白質、核酸的結構和功能,阻止細菌生物膜形成。CAP殺滅革蘭陰性菌的效果優于革蘭陽性菌,部分細菌會通過產生抗氧化應激相關蛋白而對CAP產生耐受[32, 35-36]。
此外,CAP的滅菌效果具有時間依賴性,殺滅不同菌株及生物膜的時間不同[31, 33, 37]。在達到滅菌效果的同時,CAP是否對正常皮膚組織造成傷害是活體研究需要關注的主要問題。Li等[38]研究發現使用APPJ設備分別處理金黃色葡萄球菌、大腸桿菌和銅綠假單胞菌3 min后,3種細菌均完全失活。而使用相同劑量處理人體細胞后,90%以上皮膚角質細胞和70%成纖維細胞在24 h后仍存活,說明人體細胞對CAP的耐受性明顯好于細菌。臨床研究也證實,CAP在有效減少潰瘍面細菌負荷的同時不會損傷人體組織[39],其作用機制有待深入研究。
2.2 對局部炎癥的影響
適當的炎癥反應是潰瘍愈合的基礎,但炎癥反應劇烈或不足都會影響創面愈合進程。在治療慢性皮膚潰瘍時,CAP通過氧化應激改變免疫細胞行為,下調數種細胞因子表達來抑制炎癥反應程度,減輕局部微環境持續的炎癥狀態,幫助潰瘍進入愈合期[40]。
創面炎癥過程始于嗜中性粒細胞外滲,接著是細胞滾動、黏附、爬行和傳遞,這個過程依賴選擇素和整合素的相互作用。Kupke等[41]發現通過調節細胞表面選擇素和整合素的表達,CAP處理潰瘍創面2 min就能降低嗜中性粒細胞的遷移能力,處理5 min能抑制嗜中性粒細胞誘導的炎癥反應,但不誘導細胞凋亡。
正常皮膚的保護層維持著弱酸性環境,慢性皮膚潰瘍表面由于持續存在的炎癥而呈堿性。CAP治療時,RNS、ROS在潰瘍表面會生成硝酸鹽和亞硝酸鹽,導致局部pH值下降[37],弱酸性環境除了有滅菌作用外,還能阻斷炎癥過程[42]。
2.3 促進組織再生和潰瘍愈合
清除感染、控制炎癥是潰瘍愈合的基礎,除此之外,慢性皮膚潰瘍的病理生理機制還包括組織缺血和細胞修復機制的破壞等[43],其中涉及復雜的細胞和分子機制。CAP可在不同層面對潰瘍愈合過程進行調節。
CAP通過誘導與創面愈合相關的關鍵基因表達,增加角質形成細胞中神經營養因子、表皮生長因子、VEGF、內皮素1、FGF-2及IL-8等的表達,調節成纖維細胞中血管生成素、內皮抑素、基質金屬蛋白酶9、基質金屬蛋白酶抑制劑1以及VEGF的表達,調節細胞抗氧化酶的效應,改變細胞周期,促進新生血管形成,促進角質形成細胞、成纖維細胞、內皮細胞的增殖和轉化[44-46]。
CAP還可以通過改變信號分子的磷酸化來調節黏附分子、連接蛋白和整合素的表達,促進成纖維細胞、上皮細胞、角質細胞的遷移和轉化,增加組織灌注、基質重建,誘導真皮再生[47]。
另外,表皮細胞和真皮成纖維細胞的相互交流在皮膚修復中也起著重要作用,Hippo信號通路及其下游效應物是細胞間相互交流的重要途徑[48]。CAP處理后上皮細胞和成纖維細胞中Hippo轉錄因子上調,Hippo信號通路下游的結締組織生長因子和富含半胱氨酸的血管生成蛋白表達增加,共同促進角質形成細胞的形成 [45, 49]。CAP的主要作用機制見圖1。
 圖1
CAP治療慢性皮膚潰瘍的主要作用機制
Figure1.
The mechanism of CAP in the treatment of chronic skin ulcer
圖1
CAP治療慢性皮膚潰瘍的主要作用機制
Figure1.
The mechanism of CAP in the treatment of chronic skin ulcer
3 CAP治療慢性皮膚潰瘍的動物實驗
動物實驗主要探索CAP促進潰瘍愈合的機制以及合適的治療方式、劑量,明確CAP治療的有效性和安全性。
3.1 CAP的治療效果
早期研究發現,無論是急性還是慢性皮膚潰瘍,CAP都能促進創面收縮和上皮形成,加快創面愈合[50]。在用于慢性皮膚潰瘍模型時,CAP通過各種途徑發揮抗感染、減輕炎癥、促進增生的作用,有效促進潰瘍愈合。治療中很少出現副作用,即使因治療時間過長出現的副作用也比較輕微[51-55]。
糖尿病性潰瘍是慢性皮膚潰瘍中發病率最高的一種類型,治療難度最大。CAP用于治療糖尿病性潰瘍能調節局部細胞多種基因的表達,改善炎癥反應,增加血管形成,促進潰瘍愈合,具有良好的臨床應用前景[52-54]。
盡管各項研究使用的CAP設備各不相同,治療時間和頻率也有差異,但并沒有明顯影響治療效果,如果能找到合適的治療時間和頻率,就能在保證治療效果前提下,將副作用降至最低。近年CAP治療慢性皮膚潰瘍的動物實驗見表1。
3.2 CAP治療慢性皮膚潰瘍的優勢和不足
CAP治療慢性皮膚潰瘍的最大優勢是廣譜抗微生物效應。不同種類的細菌和真菌,無論是否耐藥,CAP都能有效進行殺滅,阻止生物膜形成,反復使用不容易產生耐藥性。在滅菌劑量下,CAP的活性成分對皮膚和組織不造成明顯傷害,具有良好的安全性[50-54]。遠期安全性方面,Rutkowski等[56]對使用CAP治療皮膚損傷患者隨訪5年結果顯示,CAP治療區皮膚未見惡性腫瘤、炎癥反應或細胞結構的病理性改變。
CAP另一個優勢是在慢性皮膚潰瘍愈合不同階段均能發揮作用,早期抗感染、抗炎,后期改善組織灌注、促進組織修復,治療適應證更廣泛。此外,與臨床使用敷料相比,CAP治療不產生醫療垃圾,對環境更加友好。
CAP治療慢性皮膚潰瘍面對的主要問題是沒有規范的治療標準。不同研究所用的設備參差不齊,如何選擇設備和治療參數、治療劑量、治療頻率還需要更多研究[57]。雖然常規治療對正常皮膚和組織損傷較少,但損傷仍然存在,過量使用有可能會適得其反。
在慢性皮膚潰瘍愈合的不同階段,CAP的治療劑量和頻率需要根據潰瘍狀態進行調整,才能達到最佳治療效果[19],使用時需要有經驗的醫師對潰瘍進行動態評估。
4 總結及展望
CAP作為一種新的慢性皮膚潰瘍治療方式有其獨特的作用機制,APPJ和DBD是兩種主要治療設備,產生的CAP含有帶電粒子、ROS、RNS、紫外線等活性成分,在治療時通過殺滅多種病原微生物及耐藥菌,破壞細菌和真菌生物膜,減輕創面感染;調節創面局部微環境的炎癥反應和酸堿度,為組織修復創造條件;通過調節創面細胞基因表達和信號分子促進血管生成,改善微循環,促進肉芽組織增生和上皮形成。目前,動物實驗已證明CAP治療各種慢性皮膚潰瘍,特別是糖尿病性潰瘍,的有效性和安全性。臨床已開展病例觀察[14-15]和小規模隨機對照研究[16, 58],顯示了其未來發展的潛力。在保證安全的基礎上,研究人員需要繼續探索CAP治療慢性皮膚潰瘍的最佳條件和治療劑量,制訂CAP應用共識和指南,規范臨床行為,以達到更好、更穩定的療效。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點
作者貢獻聲明 袁南兵:綜述構思、文獻收集、文章撰寫;楊閻峙、譚翠霞:文章修改、分析總結;冉興無:對文章的知識性內容作批評性審閱,提出重要參考思路