引用本文: 賀新, 余海彬, 黃偉華, 張豪杰, 鄭镕毅. 基于血流動力學探究計算機有限元仿真胸主動脈腔內修復術的有效性及預測價值. 中國胸心血管外科臨床雜志, 2023, 30(12): 1731-1736. doi: 10.7507/1007-4848.202204023 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
主動脈夾層是由主動脈中膜退行性病變、外傷等因素導致的內膜和中膜之間發生的撕裂,其大致病理機制主要分為主動脈管壁滋養血管破裂導致壁間血腫和主動脈內膜潰瘍兩類。撕裂的主動脈會導致患者胸部劇痛,進行性加重,嚴重者可致休克甚至主動脈破裂而死亡[1]。因其癥狀與冠狀動脈(冠脈)粥樣硬化性心臟病相似而常發生誤診,往往需要胸腹主動脈CT血管造影(CT angiography,CTA)確診。而主動脈夾層依據撕裂累及升主動脈與否分為Stanford A型和Stanford B型主動脈夾層。目前Stanford A型主動脈夾層往往因為構型原因,撕裂口毗鄰冠脈開口而且需越過弓上分支動脈開口,因此較難開展胸主動脈腔內修復術(thoracic endovascular aortic repair,TEVAR),而B型主動脈夾層則以TEVAR術為首選治療方案[2]。但TEVAR術后患者往往并不能完全實現假腔的血栓化,有部分患者在圍手術期內仍然存在假腔殘留,從而增加了患者預后不良的風險[3]。其原因往往歸結為主動脈覆膜支架大多只覆蓋近端破口,而對遠端減壓口則未進行處理,真假腔間仍存在溝通[4-5]。而血流動力學雖然在主動脈夾層的發病、發展中起著重要作用,但因其數值較難取得,所以仍未應用于臨床。近年來隨著計算機有限元技術的興起,已經實現了基于CT影像資料對患者的主動脈進行計算機流體力學(computational fluid dynamics,CFD)分析,也實現了基于計算機進行TEVAR仿真[6-8]。因此,本研究對患者術前胸腹主動脈雙源 CTA(dual source CTA,DSCTA)結果進行三維重建以及TEVAR仿真和CFD分析,并與術后患者的主動脈三維重建及CFD分析結果進行對比來證實計算機仿真TEVAR的有效性。并且通過對計算機TEVAR仿真后的CFD數據、患者TEVAR術后CFD數據和患者TEVAR術后近期支架周圍假腔殘留與否進行統計學分析,分析血流動力學因素對手術近期支架周圍假腔殘留的影響。
1 資料與方法
1.1 臨床資料和分組
收集 2019 年 2 月—2022 年 2 月于鄭州大學第二附屬醫院接受 TEVAR 的 Stanford B 型主動脈夾層患者。診斷方法:入院時胸腹主動脈CTA提示主動脈夾層僅累及左鎖骨下動脈以遠的胸降主動脈或及其遠端。納入標準:Stanford B型主動脈夾層患者;接受TEVAR治療,且術前、術后復查胸腹主動脈CTA及臨床資料完整患者;CT圖像清晰,能夠達到評價要求。排除標準:主動脈壁潰瘍患者;采用體外開窗、分支支架等技術治療的患者[9]。
根據患者TEVAR術后1周左右支架周圍假腔存在與否將患者分為假腔閉合組和假腔殘留組。
1.2 支架的設計、主動脈夾層模型的三維重建以及網格劃分
1.2.1 支架的設計和仿真以及壓握面的創建
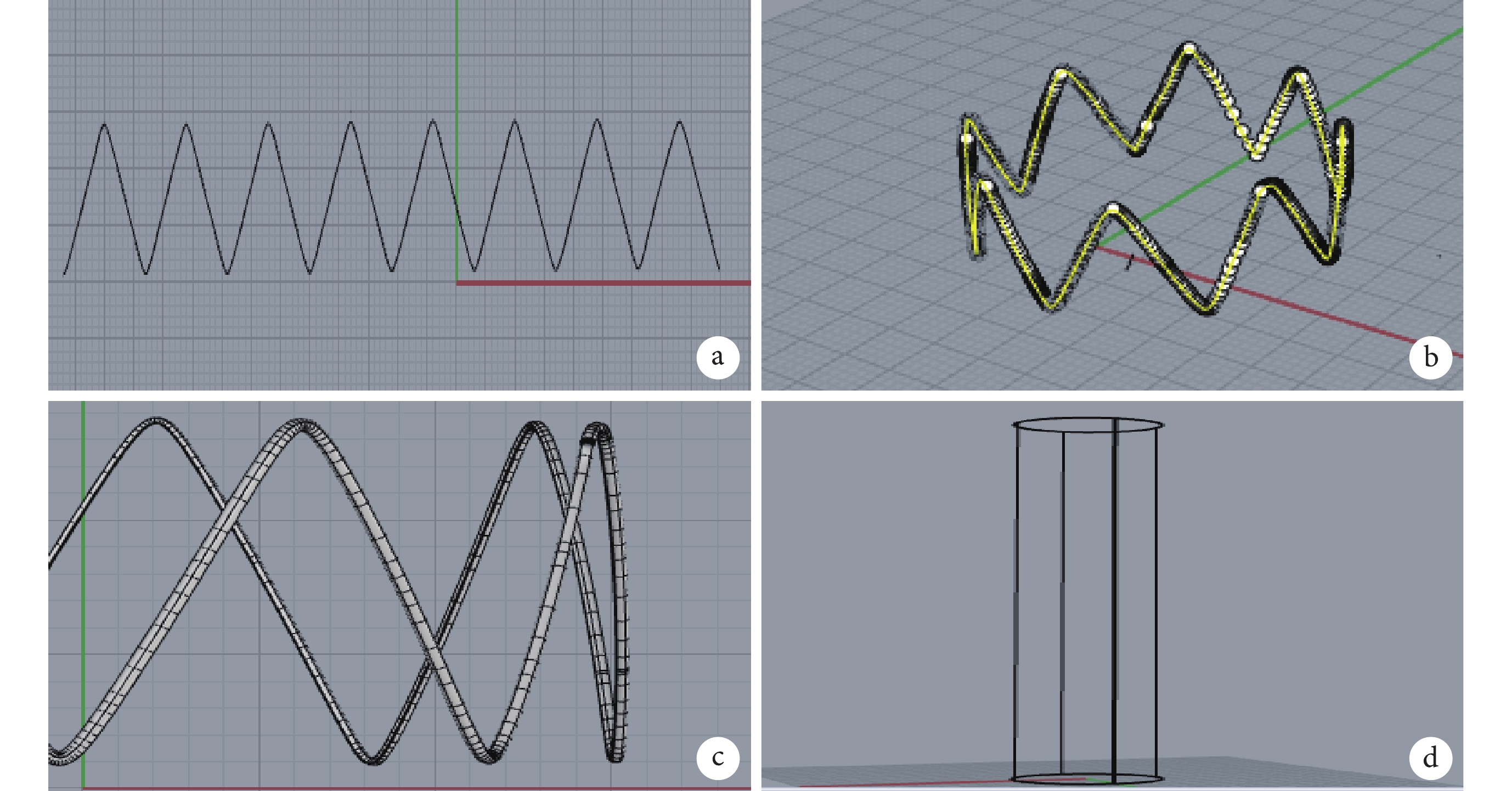
采用Rhino 7軟件,結合患者術前胸腹主動脈CTA的主動脈真假腔幾何特征,首先進行平面M型8峰支架骨架設計;見圖1a[10]。在骨架曲線的基礎上使用圓管工具從而獲得三維模型,并且支架長度設置為患者實際采用的主體支架長度,而支架直徑通常設計為大于主動脈直徑的10%~15%左右,完成對患者的個性化支架設計;見圖1b~c。而覆膜的設計則根據支架的長度和直徑進行設計;見圖1d。進一步將支架骨架和覆膜進行裝配,預覽裝配效果。將覆膜、支架骨架同時以.stl格式輸出。由于支架直徑往往大于主動脈直徑,因此如果進行仿真,需在Abaqus CAE 2021軟件中創建壓握面。對支架進行壓握,從而使支架直徑減小,以順利實現支架的植入。
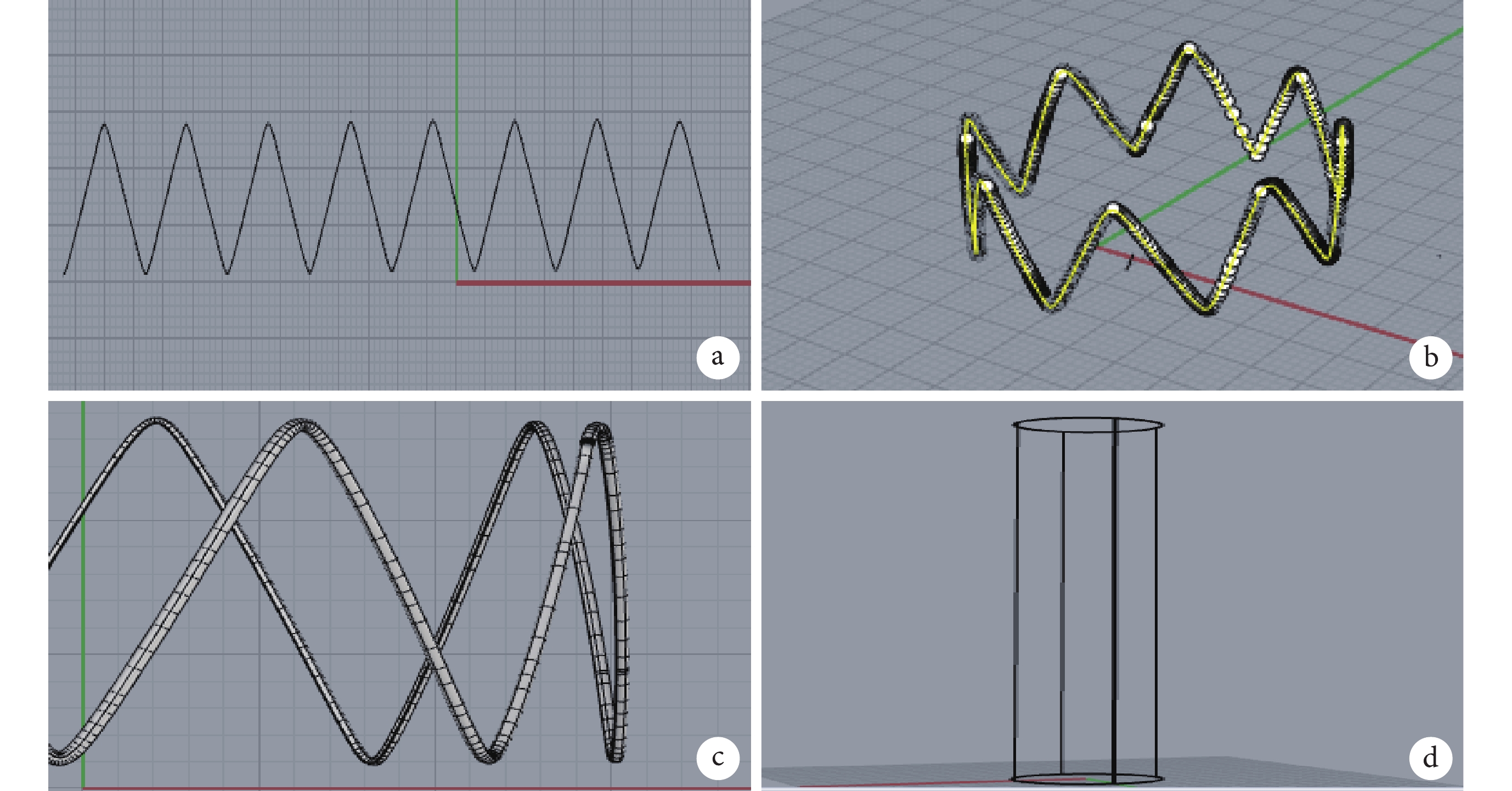 圖1
支架的設計和仿真
圖1
支架的設計和仿真
a:支架的平面設計;b:曲線彎曲的立體構型;c:支架骨架的立體構建;d:覆膜的三維構建
1.2.2 主動脈的三維重建
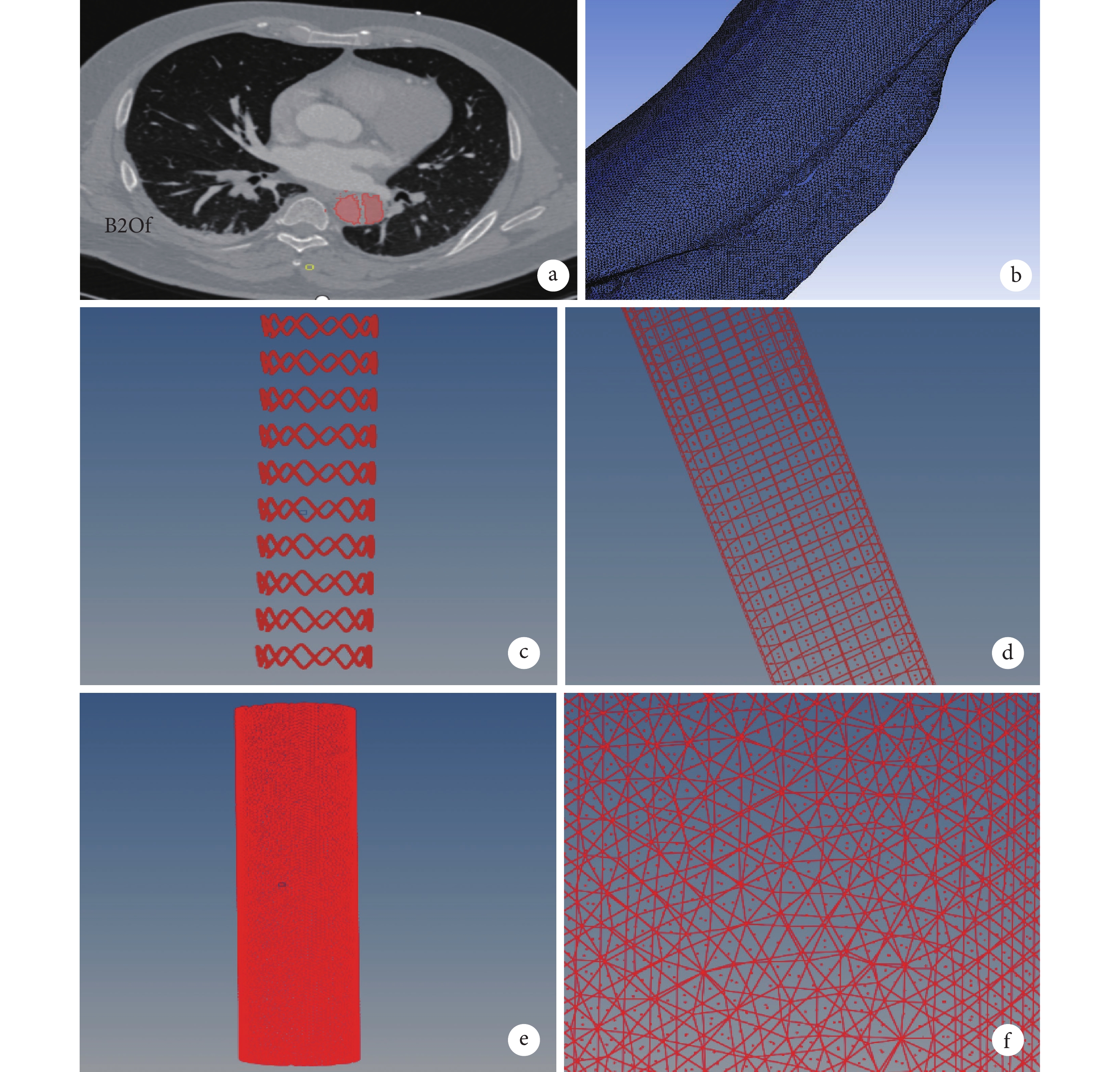
將患者胸腹主動脈CTA數據以.dicom格式導入進3D slicer軟件中,選取合適的閾值(threshold),再使用適當的編輯工具,使真假腔標記的同時盡量減少其他部分的標記;見圖2。將重建后的主動脈夾層模型以.stl格式導出。再將模型以.stl格式導入Materialise Magics 24.0進行減面、優化處理。
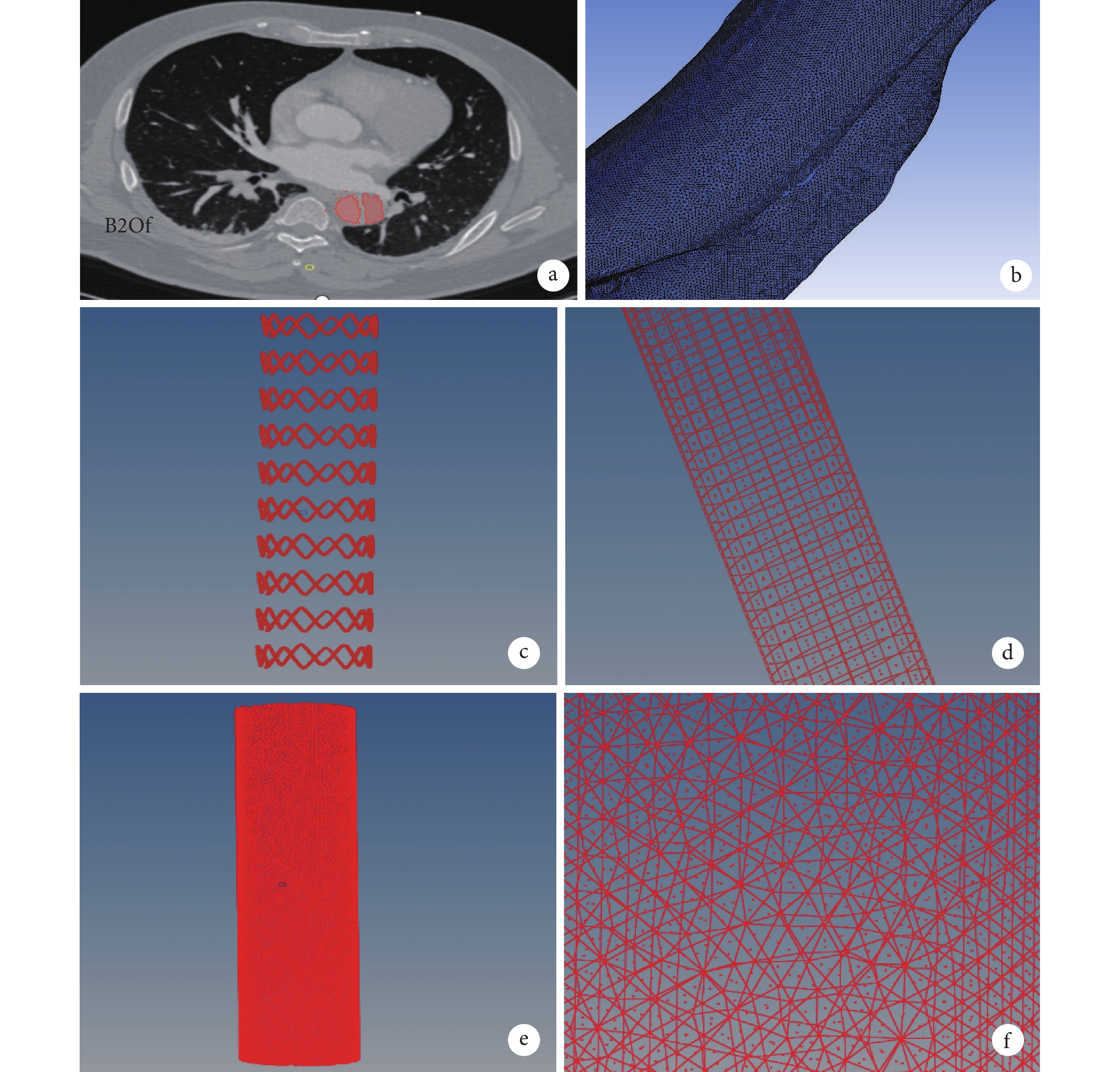 圖2
主動脈的三維重建、支架和主動脈的網格劃分
圖2
主動脈的三維重建、支架和主動脈的網格劃分
a:主動脈夾層模型的三維重建;b:主動脈夾層網格的劃分;c~d:支架骨架的網格劃分及局部放大示意圖;e~f:覆膜的網格劃分及局部放大示意圖
1.2.3 支架和主動脈的網格劃分
主動脈夾層模型、支架骨架、覆膜以.stl格式導入ICEM CFD中進行網格劃分;見圖2。將網格以.msh格式導出,再導入HyperMesh 2020進行格式轉換,最終以.inp格式進行輸出;見圖2。
1.3 支架骨架、覆膜、主動脈血管壁的材料屬性設置
采用Abaqus CAE 2021軟件,將支架骨架設置為鎳鈦合金,鎳鈦合金在特定溫度下可實現從奧氏體與馬氏體之間的互相轉換,因而成為覆膜支架骨架的首選材料。本研究材料設置主要參考熊飛翔[7]的研究。使用超彈性設置,將支架骨架設置為各向同性、均勻、不可壓縮材質,材料密度為 6 450 kg/m3,泊松比為 0.3。覆膜的材料設置為滌綸材料,厚度設置為0.1 mm,彈性模量為1.84×109 Pa,泊松比為0.35。主動脈血管壁厚度設置為1 mm,線彈性本構關系,楊氏模量2 MPa,密度為1 120 kg/m3,泊松比為0.4[11-12]。
1.4 計算機仿真覆膜支架的釋放
參照熊飛翔[7]的研究, 采用Abaqus CAE 2021軟件,首先打開幾何非線性,設置指定耗散能分數等提高仿真質量。首先完成壓握面與支架的初步接觸,隨后設置溫度場溫度為20℃,使支架材料為奧氏體狀態,易于壓縮。使支架直徑小于血管直徑,將壓握面和支架進行移動,置入主動脈夾層模型的真腔中。解除壓握面與支架的關系,將溫度設置為37℃,使支架骨架轉化為馬氏體,得以釋放與血管壁接觸。而支架骨架與覆膜支架則采用綁定約束,使支架骨架和覆膜達到理想化的裝配狀態,從而完成支架的仿真釋放。
1.5 對計算機仿真模型以及患者TEVAR術主動脈夾層模型分別進行血流動力學分析
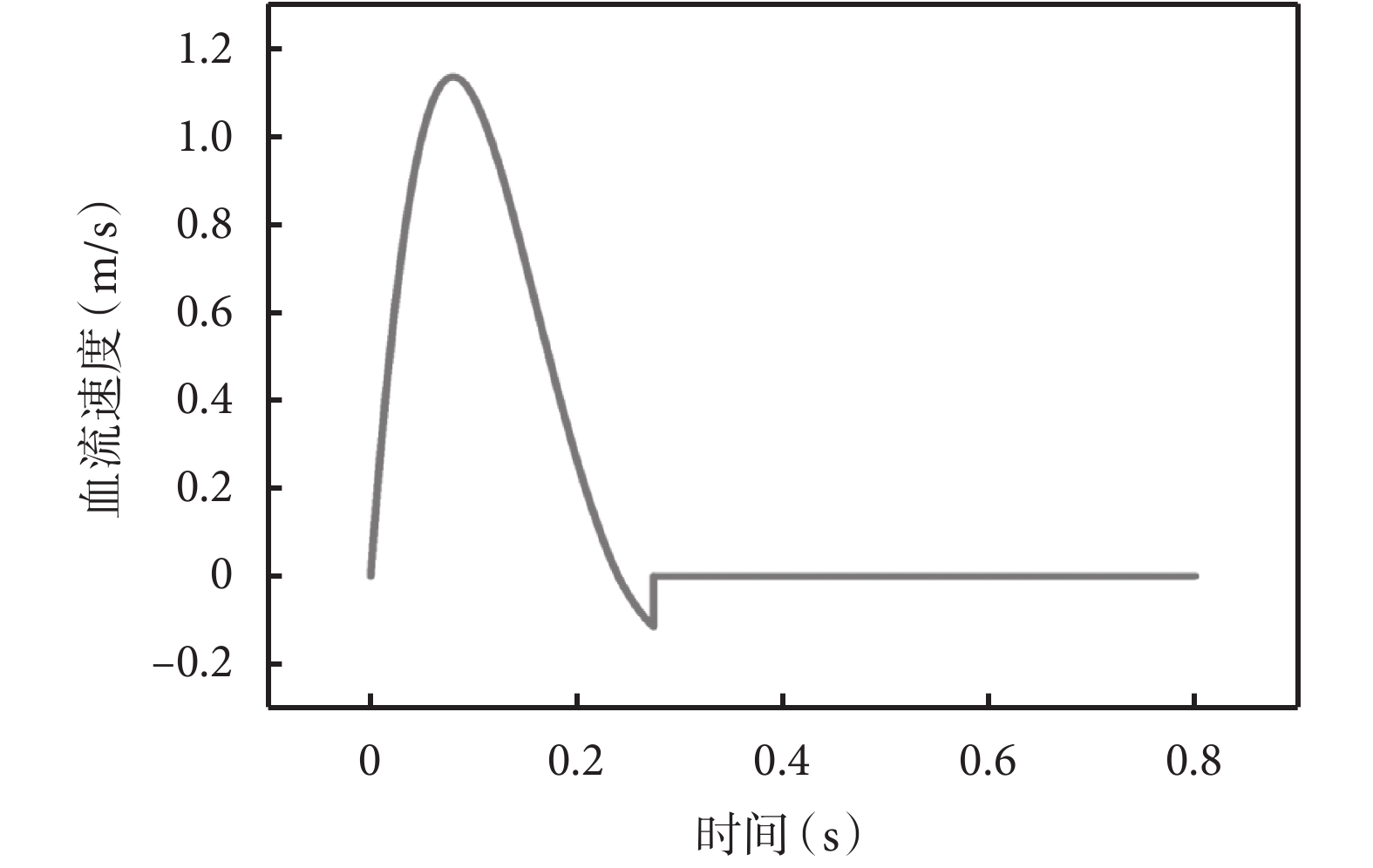
將仿真完成后的主動脈夾層模型以.inp格式導出,導入Hypermesh軟件中進行格式轉換,以.stl格式重新導入Materialise Magics 24.0軟件中,將近端撕裂口處真腔與假腔分隔開。再用ICEM CFD軟件進行網格劃分,最終以.msh格式導入Fluent軟件中進行流體力學分析。相關邊界條件和參數設置參考胡坤[13]、陳宇等[14]的研究方法。取心動周期心室收縮期快速射血期峰值時刻[15];見圖3~4。取遠端減壓口層面的假腔血流最大速度、最大管壁剪切應力。同樣方法對患者TEVAR術后的胸腹主動脈DSCTA進行三維重建和CFD處理,得到遠端減壓口層面的假腔血流最大速度、最大管壁剪切應力。將兩者進行對比,基于CFD得到計算機仿真TEVAR血流動力學的誤差率,從而探究計算機仿真的有效性。
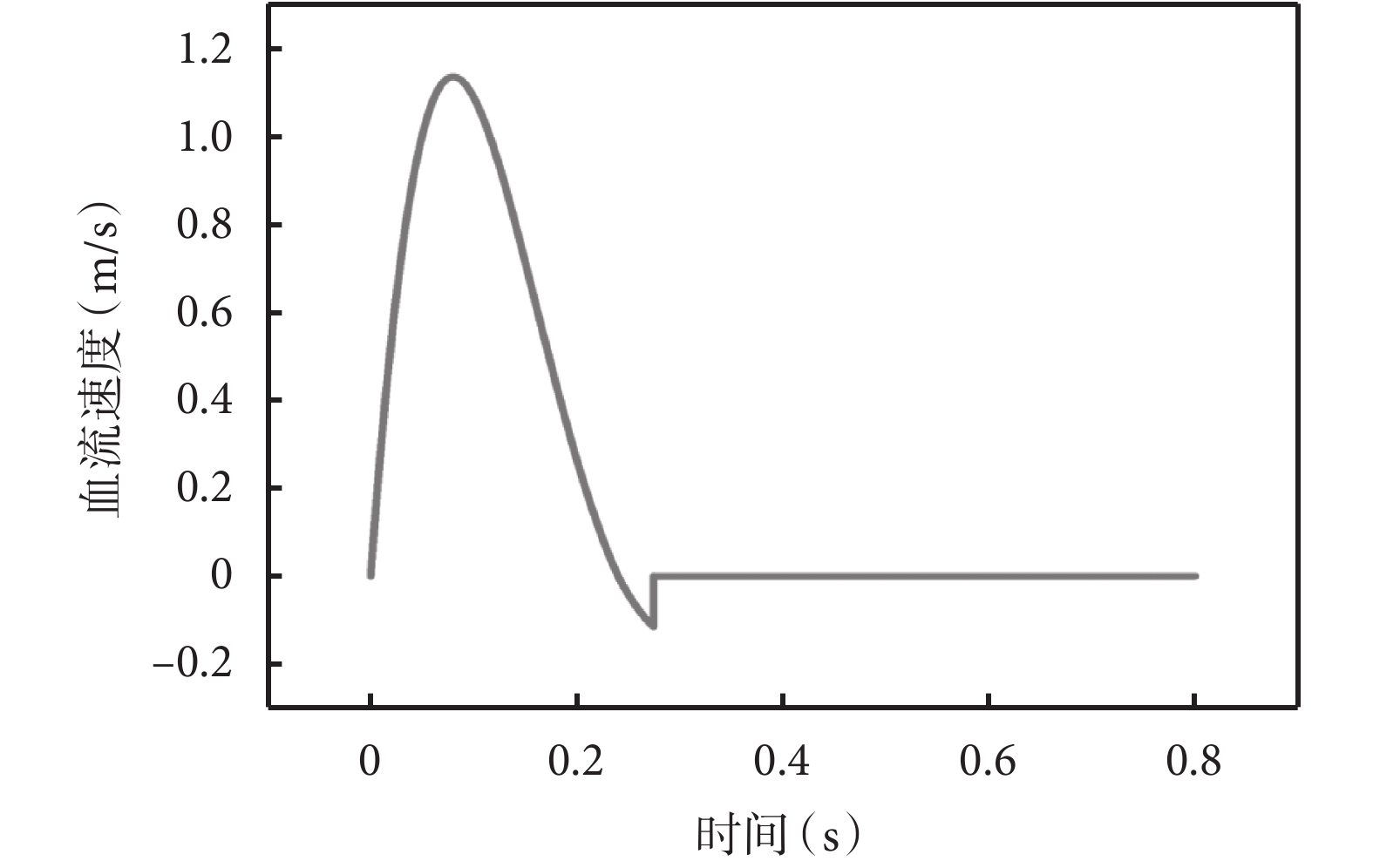 圖3
一個心動周期主動脈入口處的血流速度
圖3
一個心動周期主動脈入口處的血流速度
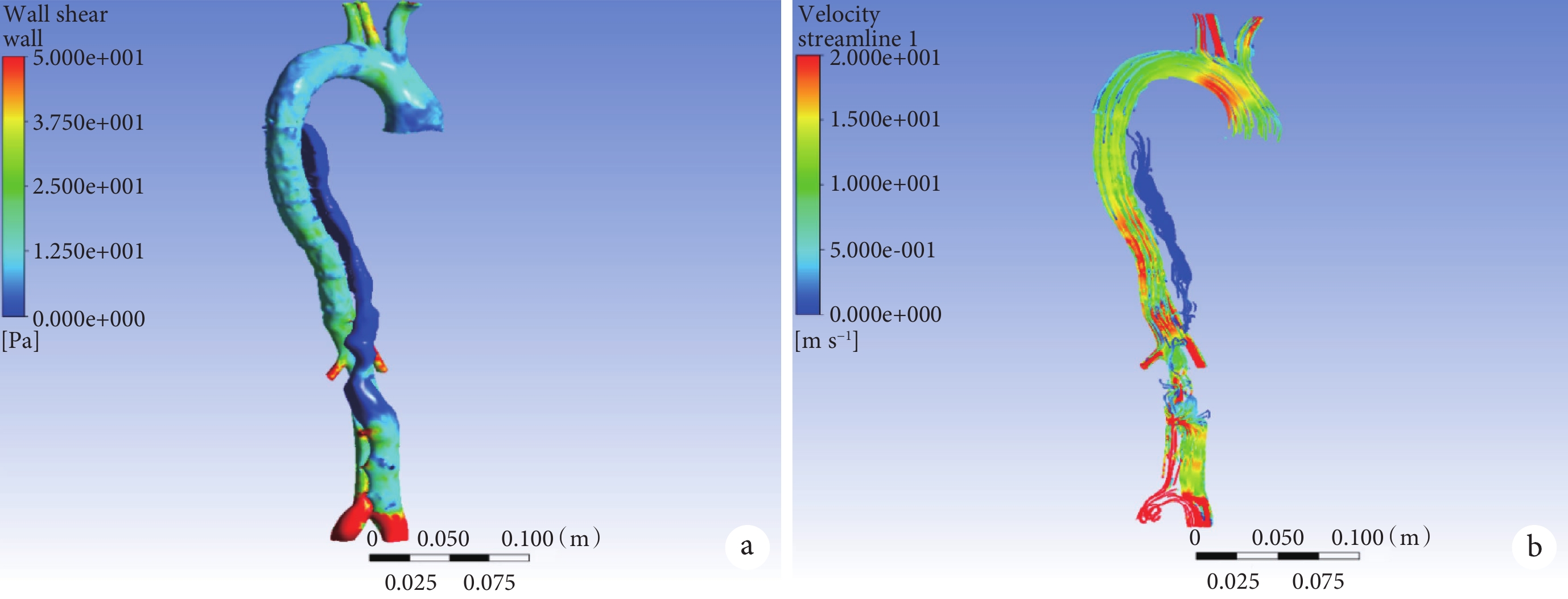 圖4
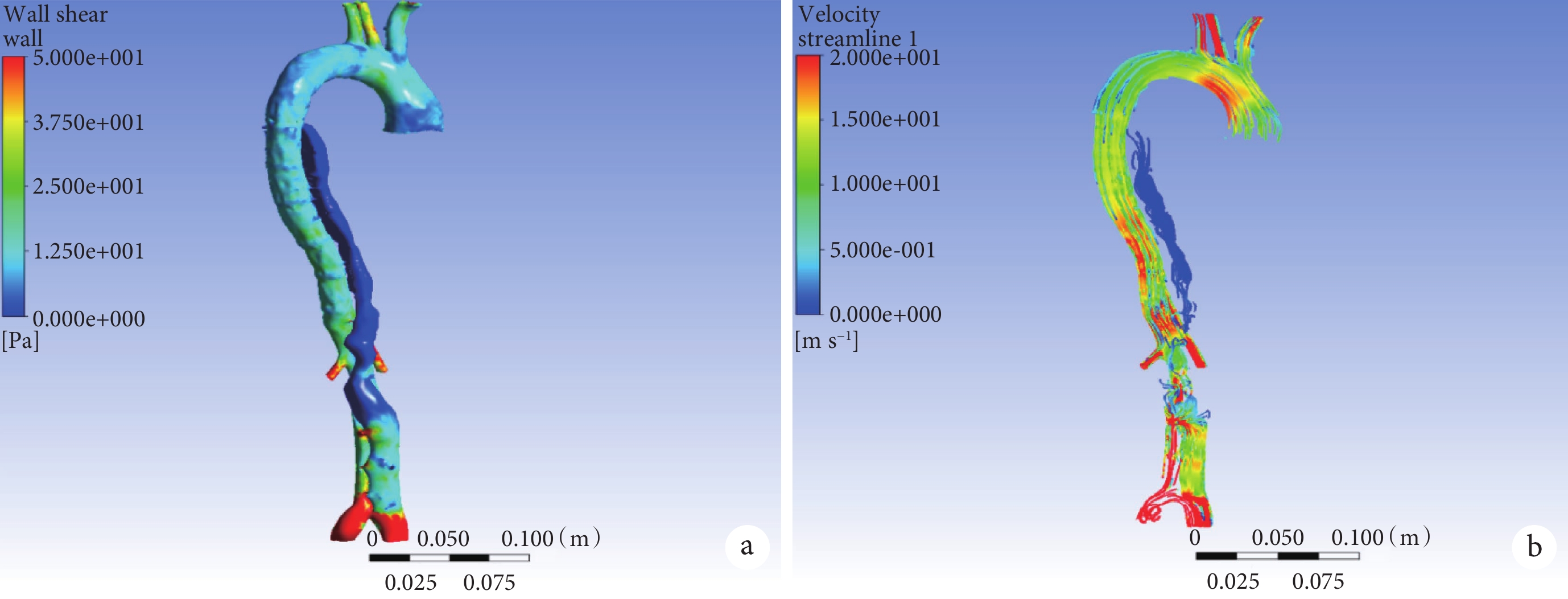
主動脈管壁血液剪切應力和主動脈血流流速
圖4
主動脈管壁血液剪切應力和主動脈血流流速
a:主動脈管壁血液剪切應力;b:主動脈血流流速
1.6 統計學分析
采用SPSS 26.0軟件進行數據分析。正態分布的計量資料以均數±標準差( ±s)描述,組間比較采用t檢驗;計數資料以例(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用二元 logistic 回歸模型分析假腔殘留的獨立危險因素。采用受試者工作特征(receiver operating characteristic,ROC)曲線分析仿真TEVAR 術后遠端減壓口層面的最大剪切應力。P≤0.05為差異有統計學意義。
±s)描述,組間比較采用t檢驗;計數資料以例(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用二元 logistic 回歸模型分析假腔殘留的獨立危險因素。采用受試者工作特征(receiver operating characteristic,ROC)曲線分析仿真TEVAR 術后遠端減壓口層面的最大剪切應力。P≤0.05為差異有統計學意義。
1.7 倫理審查
本研究經鄭州大學第二附屬醫院倫理委員會批準通過,倫理批件編號:2022167。研究對象均簽署知情同意書。
2 結果
2.1 兩組患者圍術期資料比較
納入患者 28 例,其中男 24 例、女 4 例,年齡(53.390±11.020)歲。假腔閉合組 18 例,假腔殘留組 10 例。兩組患者的年齡、性別、高血壓史、糖尿病史、吸煙史、手術前后DSCTA時間間隔、凝血酶原時間、活化部分凝血活酶時間差異均無統計學意義(P>0.05);見表1。
 /例(%)]
/例(%)]
2.2 計算機仿真的血流動力學誤差率分析
對計算機仿真TEVAR術與患者TEVAR術后CFD的血流動力學數據進行誤差率絕對值計算,其中遠端減壓口層面的最大剪切應力誤差率絕對值范圍為6%~25%,最大血流速度誤差率絕對值范圍為3%~31%。
2.3 兩組患者計算機仿真TEVAR術后的血流動力學數據比較
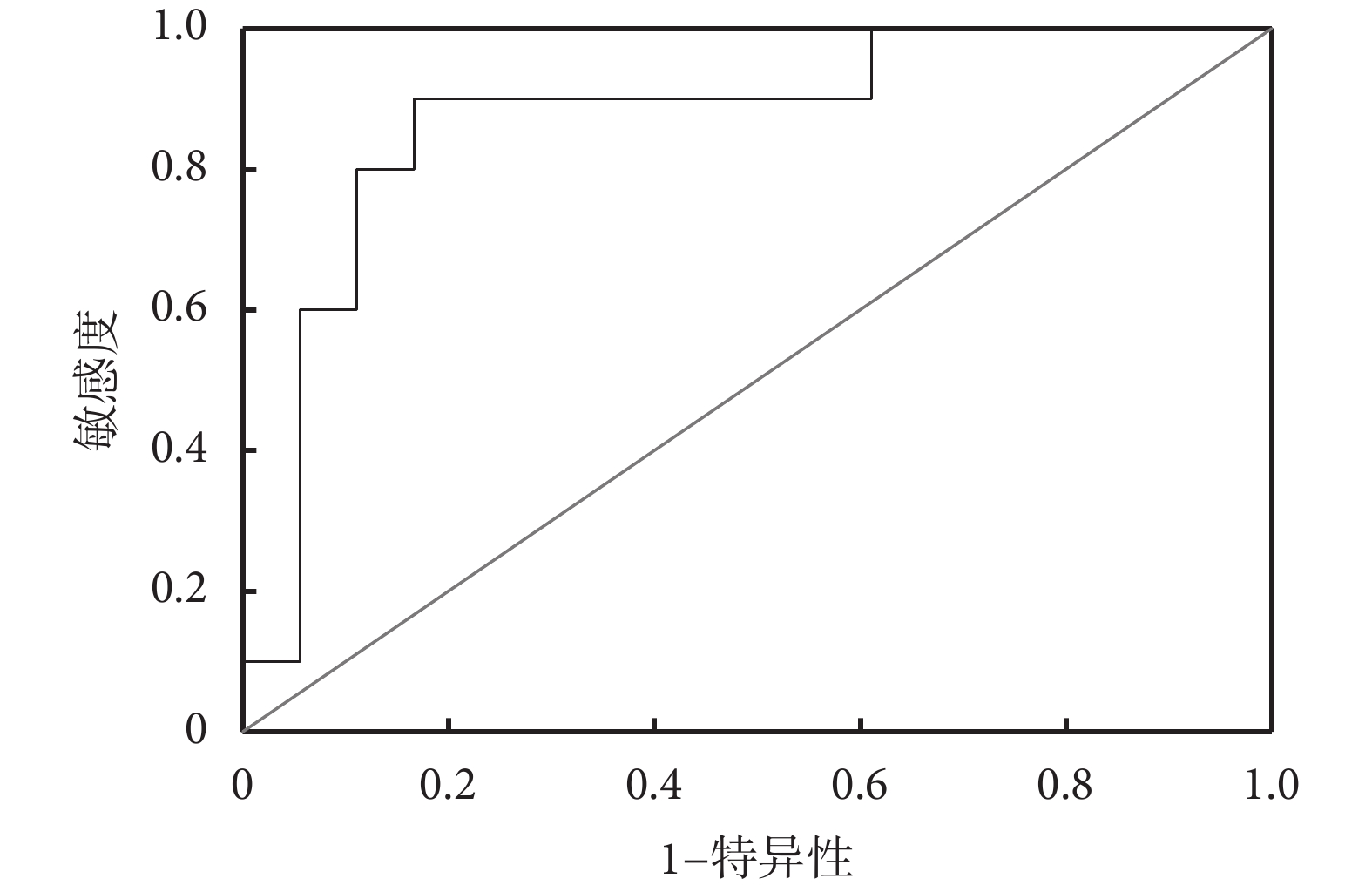
兩組患者的計算機仿真TEVAR術后遠端減壓口層面的假腔最大血流速度[(0.872±0.236)m/s vs.(1.152±0.303)m/s,P=0.012]、最大剪切應力[(7.257±2.468)Pa vs. (10.997±2.394)Pa,P=0.001]差異均有統計學意義。將兩者納入二元logistic回歸模型進行分析,仿真TEVAR術后遠端減壓口層面的最大剪切應力是假腔殘留的獨立危險因素[OR=1.823,95%CI(1.152,2.885),P=0.010]。再對壓強平衡相對位置及假腔出口剪切力進行ROC曲線分析;見圖5。仿真TEVAR術后遠端減壓口層面的最大剪切應力對應的ROC曲線下面積為0.872,最佳橫斷值為8.469 Pa,敏感度和特異度分別為90.0%和83.3%。
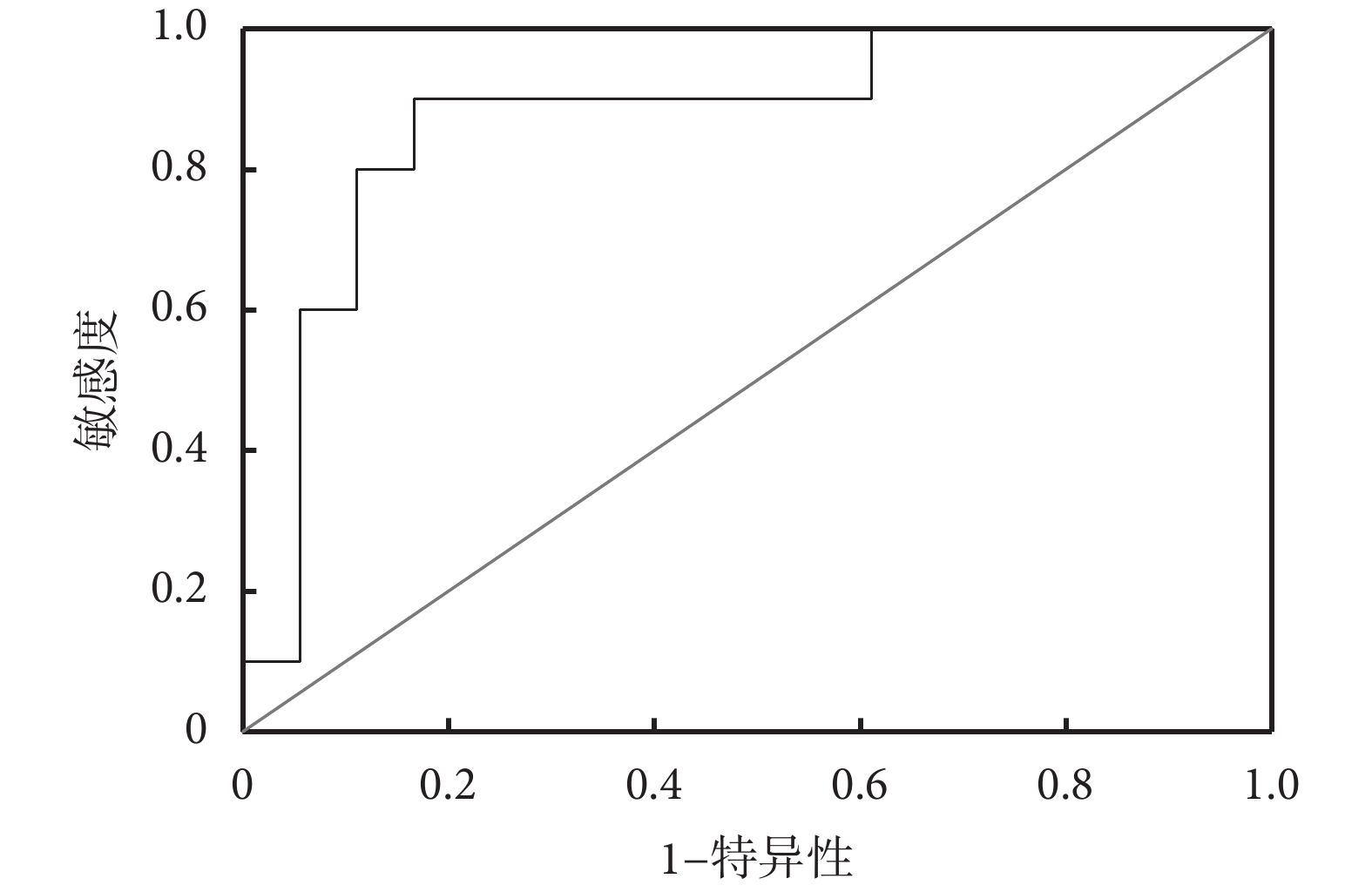 圖5
仿真胸主動脈腔內修復術后遠端減壓口層面假腔最大剪切應力的受試者工作特征曲線
圖5
仿真胸主動脈腔內修復術后遠端減壓口層面假腔最大剪切應力的受試者工作特征曲線
3 討論
隨著CFD的興起、計算機仿真技術的革新,已實現對覆膜支架的模擬及血流動力學數據提取,尤其是在冠脈、主動脈、腦血管等領域中的應用[16-17]。這種新興技術可在術前對患者進行個性化分析,并通過模擬支架釋放獲得模擬的術后模型。對模型的分析起到預測患者術后臨床結局的目的,也為介入手術的應用提供術前指導。本研究結果提示,計算機仿真TEVAR與患者TEVAR術后血流動力學相比,遠端減壓口層面最大血流速度誤差率絕對值范圍為3%~31%,遠端減壓口層面的最大剪切應力誤差率絕對值范圍為6%~25%。而基于計算機仿真TEVAR術后的CFD分析提示,仿真TEVAR術后遠端減壓口層面假腔的最大剪切應力是支架周圍假腔殘留的獨立危險因素。ROC曲線分析表明,最大剪切應力對應的ROC曲線下面積為0.872,最佳橫斷值為8.469 Pa,敏感度和特異度分別為90.0%和83.3%。當最大剪切應力>8.469 Pa時,患者TEVAR術后近期支架周圍假腔殘留的概率大大上升。
本研究證實計算機仿真有效可行,但真實情況下支架釋放要考慮的屬性參數會更復雜,這也是降低仿真誤差率的關鍵所在。本研究樣本量較小,且為單中心研究,需延長隨訪時間,擴大樣本量進一步研究。隨著研究的不斷深入,相信計算機仿真TEVAR技術以及CFD技術,會更加精確地對介入手術進行術前指導,并能拓展至其他方面的應用。
利益沖突:無。
作者貢獻:賀新負責模型建立和論文撰寫;張豪杰、鄭镕毅負責數據統計分析;余海彬、黃偉華負責論文設計和審閱。
主動脈夾層是由主動脈中膜退行性病變、外傷等因素導致的內膜和中膜之間發生的撕裂,其大致病理機制主要分為主動脈管壁滋養血管破裂導致壁間血腫和主動脈內膜潰瘍兩類。撕裂的主動脈會導致患者胸部劇痛,進行性加重,嚴重者可致休克甚至主動脈破裂而死亡[1]。因其癥狀與冠狀動脈(冠脈)粥樣硬化性心臟病相似而常發生誤診,往往需要胸腹主動脈CT血管造影(CT angiography,CTA)確診。而主動脈夾層依據撕裂累及升主動脈與否分為Stanford A型和Stanford B型主動脈夾層。目前Stanford A型主動脈夾層往往因為構型原因,撕裂口毗鄰冠脈開口而且需越過弓上分支動脈開口,因此較難開展胸主動脈腔內修復術(thoracic endovascular aortic repair,TEVAR),而B型主動脈夾層則以TEVAR術為首選治療方案[2]。但TEVAR術后患者往往并不能完全實現假腔的血栓化,有部分患者在圍手術期內仍然存在假腔殘留,從而增加了患者預后不良的風險[3]。其原因往往歸結為主動脈覆膜支架大多只覆蓋近端破口,而對遠端減壓口則未進行處理,真假腔間仍存在溝通[4-5]。而血流動力學雖然在主動脈夾層的發病、發展中起著重要作用,但因其數值較難取得,所以仍未應用于臨床。近年來隨著計算機有限元技術的興起,已經實現了基于CT影像資料對患者的主動脈進行計算機流體力學(computational fluid dynamics,CFD)分析,也實現了基于計算機進行TEVAR仿真[6-8]。因此,本研究對患者術前胸腹主動脈雙源 CTA(dual source CTA,DSCTA)結果進行三維重建以及TEVAR仿真和CFD分析,并與術后患者的主動脈三維重建及CFD分析結果進行對比來證實計算機仿真TEVAR的有效性。并且通過對計算機TEVAR仿真后的CFD數據、患者TEVAR術后CFD數據和患者TEVAR術后近期支架周圍假腔殘留與否進行統計學分析,分析血流動力學因素對手術近期支架周圍假腔殘留的影響。
1 資料與方法
1.1 臨床資料和分組
收集 2019 年 2 月—2022 年 2 月于鄭州大學第二附屬醫院接受 TEVAR 的 Stanford B 型主動脈夾層患者。診斷方法:入院時胸腹主動脈CTA提示主動脈夾層僅累及左鎖骨下動脈以遠的胸降主動脈或及其遠端。納入標準:Stanford B型主動脈夾層患者;接受TEVAR治療,且術前、術后復查胸腹主動脈CTA及臨床資料完整患者;CT圖像清晰,能夠達到評價要求。排除標準:主動脈壁潰瘍患者;采用體外開窗、分支支架等技術治療的患者[9]。
根據患者TEVAR術后1周左右支架周圍假腔存在與否將患者分為假腔閉合組和假腔殘留組。
1.2 支架的設計、主動脈夾層模型的三維重建以及網格劃分
1.2.1 支架的設計和仿真以及壓握面的創建
采用Rhino 7軟件,結合患者術前胸腹主動脈CTA的主動脈真假腔幾何特征,首先進行平面M型8峰支架骨架設計;見圖1a[10]。在骨架曲線的基礎上使用圓管工具從而獲得三維模型,并且支架長度設置為患者實際采用的主體支架長度,而支架直徑通常設計為大于主動脈直徑的10%~15%左右,完成對患者的個性化支架設計;見圖1b~c。而覆膜的設計則根據支架的長度和直徑進行設計;見圖1d。進一步將支架骨架和覆膜進行裝配,預覽裝配效果。將覆膜、支架骨架同時以.stl格式輸出。由于支架直徑往往大于主動脈直徑,因此如果進行仿真,需在Abaqus CAE 2021軟件中創建壓握面。對支架進行壓握,從而使支架直徑減小,以順利實現支架的植入。
 圖1
支架的設計和仿真
圖1
支架的設計和仿真
a:支架的平面設計;b:曲線彎曲的立體構型;c:支架骨架的立體構建;d:覆膜的三維構建
1.2.2 主動脈的三維重建
將患者胸腹主動脈CTA數據以.dicom格式導入進3D slicer軟件中,選取合適的閾值(threshold),再使用適當的編輯工具,使真假腔標記的同時盡量減少其他部分的標記;見圖2。將重建后的主動脈夾層模型以.stl格式導出。再將模型以.stl格式導入Materialise Magics 24.0進行減面、優化處理。
 圖2
主動脈的三維重建、支架和主動脈的網格劃分
圖2
主動脈的三維重建、支架和主動脈的網格劃分
a:主動脈夾層模型的三維重建;b:主動脈夾層網格的劃分;c~d:支架骨架的網格劃分及局部放大示意圖;e~f:覆膜的網格劃分及局部放大示意圖
1.2.3 支架和主動脈的網格劃分
主動脈夾層模型、支架骨架、覆膜以.stl格式導入ICEM CFD中進行網格劃分;見圖2。將網格以.msh格式導出,再導入HyperMesh 2020進行格式轉換,最終以.inp格式進行輸出;見圖2。
1.3 支架骨架、覆膜、主動脈血管壁的材料屬性設置
采用Abaqus CAE 2021軟件,將支架骨架設置為鎳鈦合金,鎳鈦合金在特定溫度下可實現從奧氏體與馬氏體之間的互相轉換,因而成為覆膜支架骨架的首選材料。本研究材料設置主要參考熊飛翔[7]的研究。使用超彈性設置,將支架骨架設置為各向同性、均勻、不可壓縮材質,材料密度為 6 450 kg/m3,泊松比為 0.3。覆膜的材料設置為滌綸材料,厚度設置為0.1 mm,彈性模量為1.84×109 Pa,泊松比為0.35。主動脈血管壁厚度設置為1 mm,線彈性本構關系,楊氏模量2 MPa,密度為1 120 kg/m3,泊松比為0.4[11-12]。
1.4 計算機仿真覆膜支架的釋放
參照熊飛翔[7]的研究, 采用Abaqus CAE 2021軟件,首先打開幾何非線性,設置指定耗散能分數等提高仿真質量。首先完成壓握面與支架的初步接觸,隨后設置溫度場溫度為20℃,使支架材料為奧氏體狀態,易于壓縮。使支架直徑小于血管直徑,將壓握面和支架進行移動,置入主動脈夾層模型的真腔中。解除壓握面與支架的關系,將溫度設置為37℃,使支架骨架轉化為馬氏體,得以釋放與血管壁接觸。而支架骨架與覆膜支架則采用綁定約束,使支架骨架和覆膜達到理想化的裝配狀態,從而完成支架的仿真釋放。
1.5 對計算機仿真模型以及患者TEVAR術主動脈夾層模型分別進行血流動力學分析
將仿真完成后的主動脈夾層模型以.inp格式導出,導入Hypermesh軟件中進行格式轉換,以.stl格式重新導入Materialise Magics 24.0軟件中,將近端撕裂口處真腔與假腔分隔開。再用ICEM CFD軟件進行網格劃分,最終以.msh格式導入Fluent軟件中進行流體力學分析。相關邊界條件和參數設置參考胡坤[13]、陳宇等[14]的研究方法。取心動周期心室收縮期快速射血期峰值時刻[15];見圖3~4。取遠端減壓口層面的假腔血流最大速度、最大管壁剪切應力。同樣方法對患者TEVAR術后的胸腹主動脈DSCTA進行三維重建和CFD處理,得到遠端減壓口層面的假腔血流最大速度、最大管壁剪切應力。將兩者進行對比,基于CFD得到計算機仿真TEVAR血流動力學的誤差率,從而探究計算機仿真的有效性。
 圖3
一個心動周期主動脈入口處的血流速度
圖3
一個心動周期主動脈入口處的血流速度
 圖4
主動脈管壁血液剪切應力和主動脈血流流速
圖4
主動脈管壁血液剪切應力和主動脈血流流速
a:主動脈管壁血液剪切應力;b:主動脈血流流速
1.6 統計學分析
采用SPSS 26.0軟件進行數據分析。正態分布的計量資料以均數±標準差( ±s)描述,組間比較采用t檢驗;計數資料以例(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用二元 logistic 回歸模型分析假腔殘留的獨立危險因素。采用受試者工作特征(receiver operating characteristic,ROC)曲線分析仿真TEVAR 術后遠端減壓口層面的最大剪切應力。P≤0.05為差異有統計學意義。
±s)描述,組間比較采用t檢驗;計數資料以例(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用二元 logistic 回歸模型分析假腔殘留的獨立危險因素。采用受試者工作特征(receiver operating characteristic,ROC)曲線分析仿真TEVAR 術后遠端減壓口層面的最大剪切應力。P≤0.05為差異有統計學意義。
1.7 倫理審查
本研究經鄭州大學第二附屬醫院倫理委員會批準通過,倫理批件編號:2022167。研究對象均簽署知情同意書。
2 結果
2.1 兩組患者圍術期資料比較
納入患者 28 例,其中男 24 例、女 4 例,年齡(53.390±11.020)歲。假腔閉合組 18 例,假腔殘留組 10 例。兩組患者的年齡、性別、高血壓史、糖尿病史、吸煙史、手術前后DSCTA時間間隔、凝血酶原時間、活化部分凝血活酶時間差異均無統計學意義(P>0.05);見表1。
 /例(%)]
/例(%)]
2.2 計算機仿真的血流動力學誤差率分析
對計算機仿真TEVAR術與患者TEVAR術后CFD的血流動力學數據進行誤差率絕對值計算,其中遠端減壓口層面的最大剪切應力誤差率絕對值范圍為6%~25%,最大血流速度誤差率絕對值范圍為3%~31%。
2.3 兩組患者計算機仿真TEVAR術后的血流動力學數據比較
兩組患者的計算機仿真TEVAR術后遠端減壓口層面的假腔最大血流速度[(0.872±0.236)m/s vs.(1.152±0.303)m/s,P=0.012]、最大剪切應力[(7.257±2.468)Pa vs. (10.997±2.394)Pa,P=0.001]差異均有統計學意義。將兩者納入二元logistic回歸模型進行分析,仿真TEVAR術后遠端減壓口層面的最大剪切應力是假腔殘留的獨立危險因素[OR=1.823,95%CI(1.152,2.885),P=0.010]。再對壓強平衡相對位置及假腔出口剪切力進行ROC曲線分析;見圖5。仿真TEVAR術后遠端減壓口層面的最大剪切應力對應的ROC曲線下面積為0.872,最佳橫斷值為8.469 Pa,敏感度和特異度分別為90.0%和83.3%。
 圖5
仿真胸主動脈腔內修復術后遠端減壓口層面假腔最大剪切應力的受試者工作特征曲線
圖5
仿真胸主動脈腔內修復術后遠端減壓口層面假腔最大剪切應力的受試者工作特征曲線
3 討論
隨著CFD的興起、計算機仿真技術的革新,已實現對覆膜支架的模擬及血流動力學數據提取,尤其是在冠脈、主動脈、腦血管等領域中的應用[16-17]。這種新興技術可在術前對患者進行個性化分析,并通過模擬支架釋放獲得模擬的術后模型。對模型的分析起到預測患者術后臨床結局的目的,也為介入手術的應用提供術前指導。本研究結果提示,計算機仿真TEVAR與患者TEVAR術后血流動力學相比,遠端減壓口層面最大血流速度誤差率絕對值范圍為3%~31%,遠端減壓口層面的最大剪切應力誤差率絕對值范圍為6%~25%。而基于計算機仿真TEVAR術后的CFD分析提示,仿真TEVAR術后遠端減壓口層面假腔的最大剪切應力是支架周圍假腔殘留的獨立危險因素。ROC曲線分析表明,最大剪切應力對應的ROC曲線下面積為0.872,最佳橫斷值為8.469 Pa,敏感度和特異度分別為90.0%和83.3%。當最大剪切應力>8.469 Pa時,患者TEVAR術后近期支架周圍假腔殘留的概率大大上升。
本研究證實計算機仿真有效可行,但真實情況下支架釋放要考慮的屬性參數會更復雜,這也是降低仿真誤差率的關鍵所在。本研究樣本量較小,且為單中心研究,需延長隨訪時間,擴大樣本量進一步研究。隨著研究的不斷深入,相信計算機仿真TEVAR技術以及CFD技術,會更加精確地對介入手術進行術前指導,并能拓展至其他方面的應用。
利益沖突:無。
作者貢獻:賀新負責模型建立和論文撰寫;張豪杰、鄭镕毅負責數據統計分析;余海彬、黃偉華負責論文設計和審閱。