引用本文: 王芬, 張騰, 袁梅, 柏根基. 基于CT影像組學鑒別伴微乳頭及實體型結構浸潤性肺腺癌. 中國胸心血管外科臨床雜志, 2024, 31(1): 65-70. doi: 10.7507/1007-4848.202308057 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌目前仍是全世界發病率及死亡率較高的惡性腫瘤,其中肺腺癌占比約50%。2015版世界衛生組織肺腫瘤分類[1]及2011年國際肺癌研究協會/美國胸科學會/歐洲呼吸學會(International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society,IASLC/ATS/ERS)國際多學科分類根據肺癌病理分型及診斷特點將浸潤性肺腺癌分為5種亞型,其中微乳頭及實體型(micropapillary/solid,MPP/SOL)肺腺癌與預后不良相關,肺腺癌若含有MPP/SOL結構術后需進行化療等管理措施。部分文獻[1-3]報道,MPP/SOL成分無論多少,患者預后均較無MPP/SOL結構浸潤性肺腺癌差。腫瘤的無創性檢查為臨床提供初步篩查依據,目前主要通過小樣本組織活檢的方法確定病理亞型,但由于其取材有限導致病變全貌反映有限,故能全面反映腫瘤特征的無創性檢查手段尤為重要。影像學檢查是術前對病變進行評估的主要方法。既往研究已經對MPP型肺腺癌影像學特征進行初探,僅基于CT影像特征診斷則存在對影像診斷醫師的主觀依賴性較強的問題,且研究數量較為局限。自Lambin等[4]提出影像組學概念后,不斷有研究挖掘影像圖像中的數據信息,對影像特征數據進行深入分析并建模,得到能夠指導疾病診療和轉歸的預測模型,目前影像組學在肺癌等相關領域的組學研究也較為廣泛[5],臨床上已有對MPP/SOL肺腺癌CT圖像數據進行挖掘探索,并建立準確性較高的預測模型[6-9]。既往研究[10]基于混雜有不同密度的肺部病灶,發現磨玻璃成分在肺結節中預示著良好的預后,故臨床工作中對于純實性密度結節的存在,常會有較差的病理診斷結果。放射學上的純實性結節即使經外科手術治療后,也存在隱匿性淋巴結轉移可能(11%~24%),并且可表現出比部分實性結節更多的惡性行為和更差的預后[11-12]。相同臨床T分期的純實體腫瘤仍然具有不同的預后。本研究基于肺部實性密度病灶的高分辨率CT(high-resolution computed tomography,HRCT)圖像,探討影像組學特征模型對伴有MPP/SOL結構浸潤性肺腺癌的預測價值。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2016年4月—2019年8月收治的表現為實性密度肺腺癌患者的臨床資料。納入標準:(1)接受手術切除及系統性淋巴結采樣或清掃術;(2)3個月內行胸部CT平掃檢查且可獲得DICOM格式HRCT圖像;(3)經病理證實的原發性浸潤性肺腺癌患者;(4)臨床資料完整。排除標準:(1)術前接受新輔助治療病史或有外科手術史;(2)存在呼吸運動偽影,影響觀察而不足以評估病變;(3)原發性微浸潤肺腺癌或浸潤性肺腺癌變體型(粘液型、胎兒型、腸型等)。伴有MPP/SOL結構肺腺癌患者為陽性(MPP/SOL+)組,無MPP/SOL結構肺腺癌者為陰性(MPP/SOL?)組。將數據集隨機抽樣以7∶3的比例分為訓練集和測試集。
1.2 圖像采集及評估
所有患者影像采集使用西門子CT(SIEMENS SOMATOM Force)及GE(GE MEDICAL SYSTEMS Revolution)掃描儀行HRCT檢查,患者CT掃描均在仰臥位進行,從胸部入口到腎臟邊緣,掃描時屏氣。管電壓100~120 kV,管電流自適應,矩陣256×256,視野252 mm×252 mm,重建層厚1 mm/1.5 mm。由1位影像診斷醫師(具有4年臨床經驗)收集患者基本信息,并在HRCT軸位圖像(肺窗)上測量病灶最大徑,測量2次取平均值。從影像歸檔和通信系統(picture archiving and communication systems,PACS)以DICOM格式導出患者的肺窗CT圖像。
1.3 病理學評估
病理學評估由本院病理科醫生根據2015年IASLC/ATS/ERS分類標準確定病理亞型及成分。所有標本均使用10%福爾馬林溶液固定,常規石蠟包埋組織,蘇木精-伊紅染色及免疫組化方法檢測確定病變病理分型,明確病變中有無MPP/SOL結構,若存在一種或兩種結構,并且含量超過5%,視為MPP/SOL+組,反之為MPP/SOL?組。
1.4 組學特征提取及標準化
將DICOM格式的HRCT肺窗圖像從PACS導出后,導入內部軟件(MultiLabel),由2位影像診斷醫師(分別具有4年及12年臨床經驗)雙盲法獨立進行三維感興趣區(volume of interest,VOI)分割:首先根據軟件所設置的閾值逐層標記出病灶所在區域,隨后根據設定CT閾值分割VOI,必要時手動校正邊界,盡量避免血管束、鈣化等區域,最終全部數據以NII格式導出用于后續影像組學特征的提取。使用R語言(version 4.1.2,
1.5 特征選擇
1.5.1 一致性檢驗
對2位影像診斷醫師分別提取的組學特征采用組內相關系數(intraclass correlation coefficient,ICC)評估觀察者內及觀察者間一致性,將重復性良好的特征(ICC>0.80)[9]用于后續特征降維、特征選擇等。
1.5.2 特征降維及特征選擇
通過過采樣技術均衡訓練集數據,接著均值歸一化處理后,通過最小絕對收縮與選擇算子(the least absolute shrinkage and selection operator,LASSO)算法進一步降維,調節權重λ,LASSO將所有回歸系數向零收縮,并將不相關特征的系數設置為零。采用5倍交叉驗證,其中λ的最終值產生最小交叉驗證誤差。非零系數值的特征被保留用于回歸模型擬合并構建影像組學模型。所有數據處理過程均在R語言中進行。
1.6 統計學分析
使用SPSS 21.0軟件進行統計學分析,當計量資料服從正態分布,采用均數±標準差(x±s)描述,組間比較采用t檢驗;非正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用非參數檢驗。計數資料采用頻數和百分比描述,組間比較采用χ2檢驗。采用二元logistic回歸進行多因素分析。受試者工作特征(receiver operating characteristic,ROC)曲線、模型及單獨組學特征的診斷效能評估在MedCalc 15.2.2軟件進行,以曲線下面積(area under the curve,AUC)作為評判標準,Delong檢驗用于比較參與建模的單一特征與影像組學評分之間的診斷效能。P≤0.05為差異有統計學意義。
1.7 倫理審查
本研究已通過淮安市第一人民醫院醫學倫理委員會審查,審批號:KY-2022-045-01。
2 結果
2.1 患者基本臨床資料
本研究共納入340例患者,其中男178例、女162例,平均年齡(60.31±6.69)歲。MPP/SOL+組172例,MPP/SOL?組168例。患者的基本臨床資料及病灶影像學特征見表1。訓練集238例患者,其中陽性組120例、陰性組118例;測試集102例患者,其中陽性組52例、陰性組50例。
2.2 影像組學特征的預測模型建立
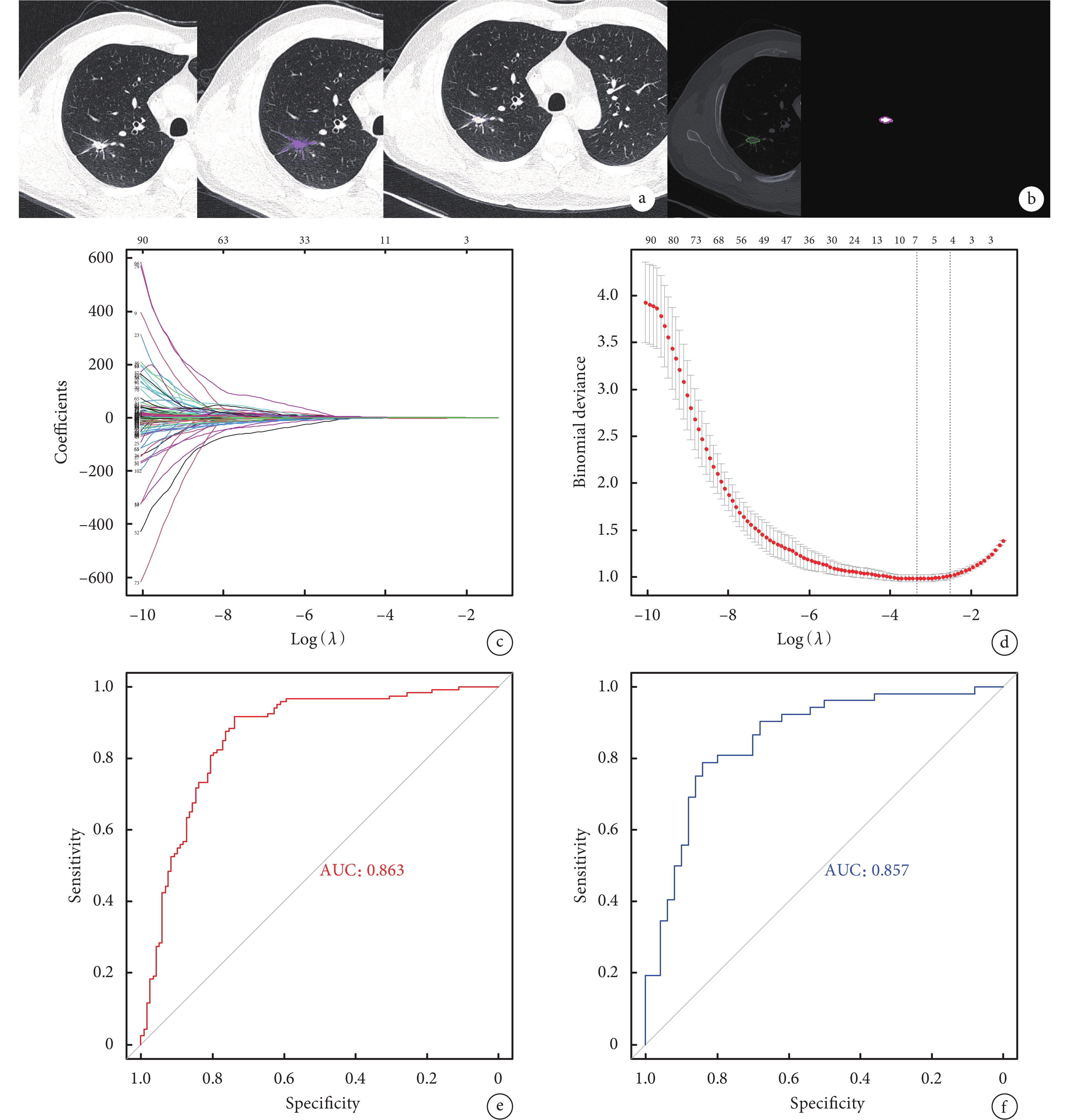
從107個浸潤性肺腺癌的影像組學特征中,經一致性檢驗(組內ICC:0.802~0.999,組間ICC:0.809~0.998)、圖像歸一化處理后,通過LASSO分析,2個特征(P<0.001)參與構建模型,其中1個為形態特征,另1個為紋理特征(GLSZM),并計算得到影像組學評分(Radscore),Radscore=?0.04149+6.6314×Original_glszm_SizeZoneNonUniformityNormalized+(?5.83413)×Original_shape_SurfaceVolumeRatio。影像組學特征的預測模型建立流程見圖1。
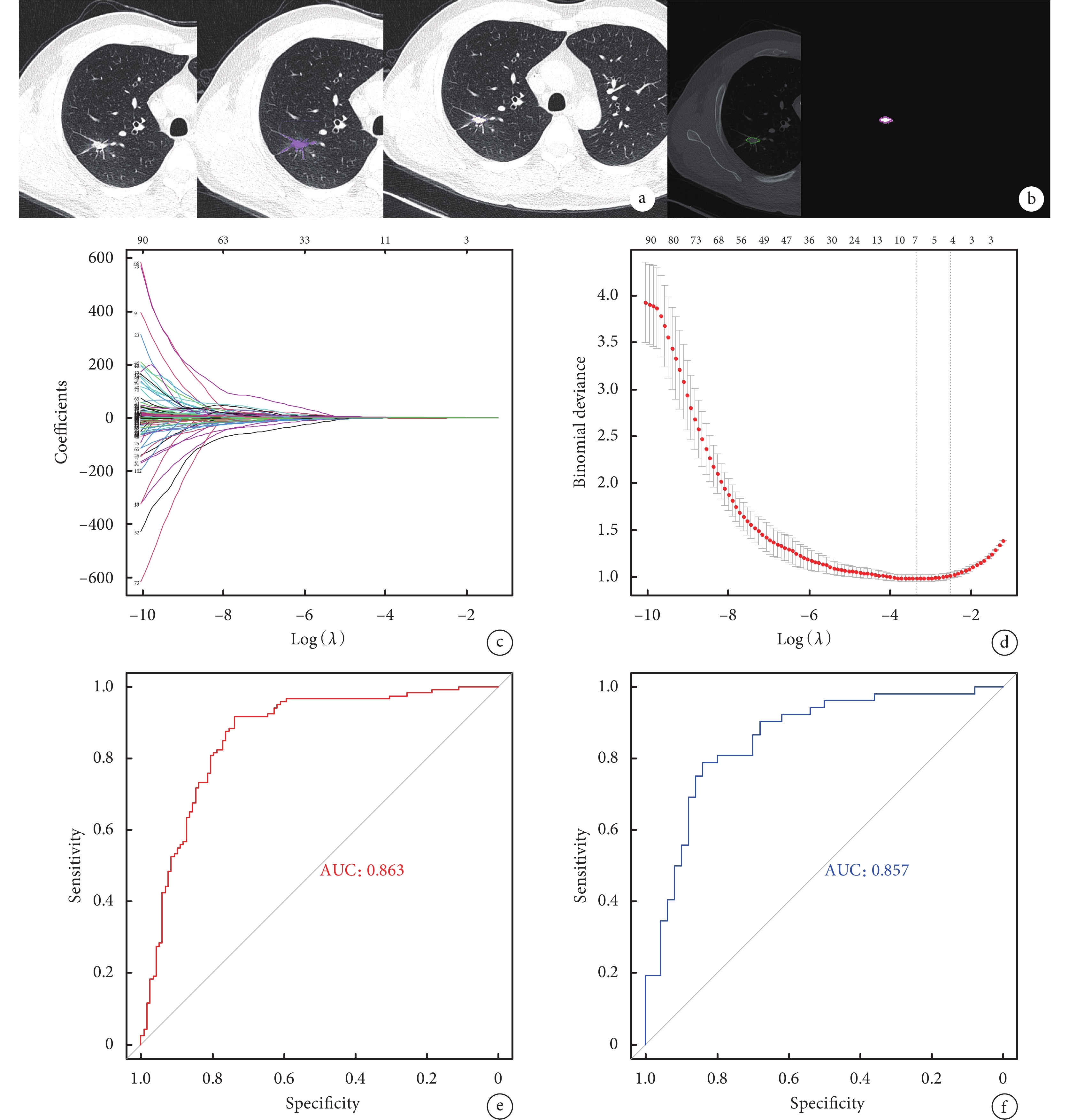 圖1
影像組學特征的預測模型建立流程
圖1
影像組學特征的預測模型建立流程
a:圖像中結節的分割,包括標記病灶;設定分割閾值;矯正分割區域,排除血管等結構干擾;b:分割后的相應層面的ROI圖像(NII格式),利用LASSO算法篩選有鑒別意義的影像組學特征;c:LASSO模型中使用5折交叉驗證方法,篩選出效能最好的特征集合,垂直虛線表示,最佳
2.3 影像組學特征的診斷效能
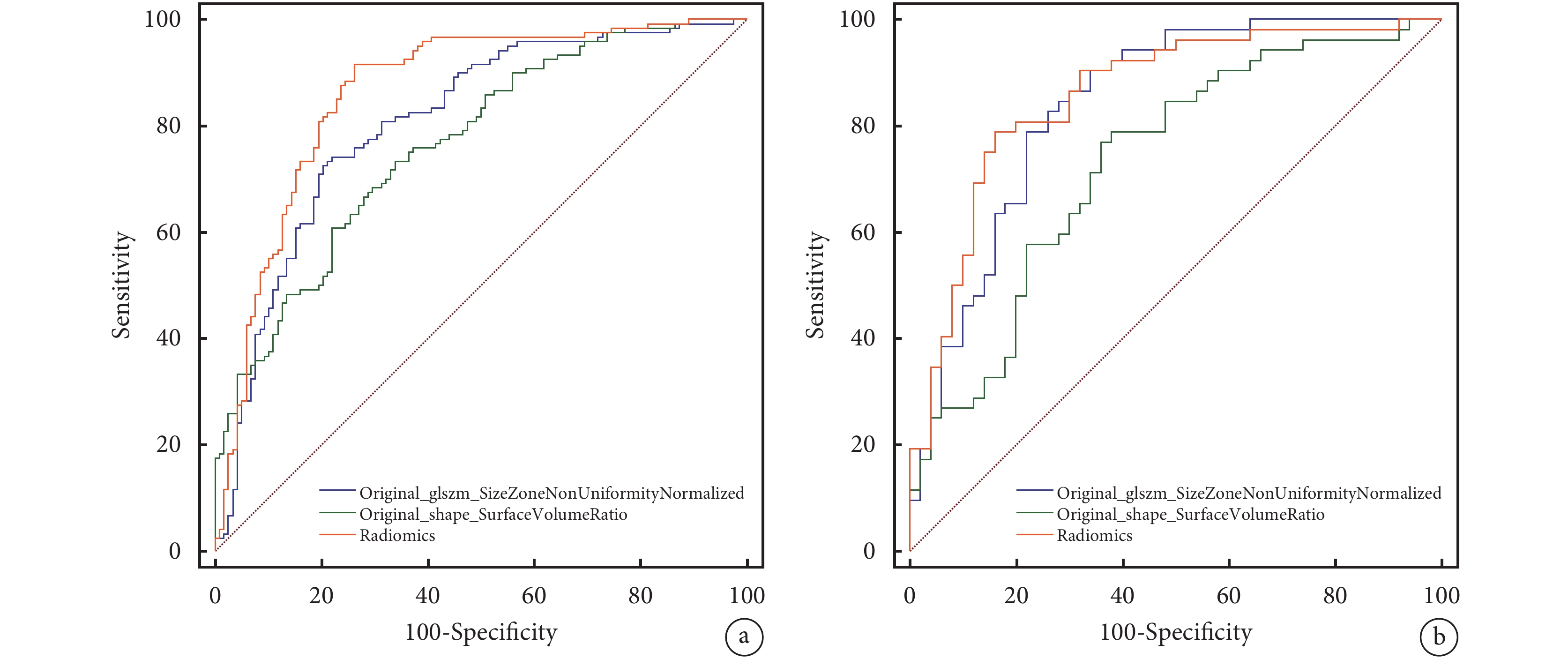
經篩選后的Original_glszm_SizeZoneNonUniformityNormalized及Original_shape_SurfaceVolumeRatio組學特征建立模型并繪制ROC曲線,并通過Delong檢驗比較兩個特征和Radscore的診斷效能。我們發現影像組學模型的結果僅優于單一組學特征Original_shape_SurfaceVolumeRatio進行預測的結果(P<0.001),與組學特征Original_glszm_SizeZoneNonUniformityNormalized預測結果相仿(P=0.583);見圖2。
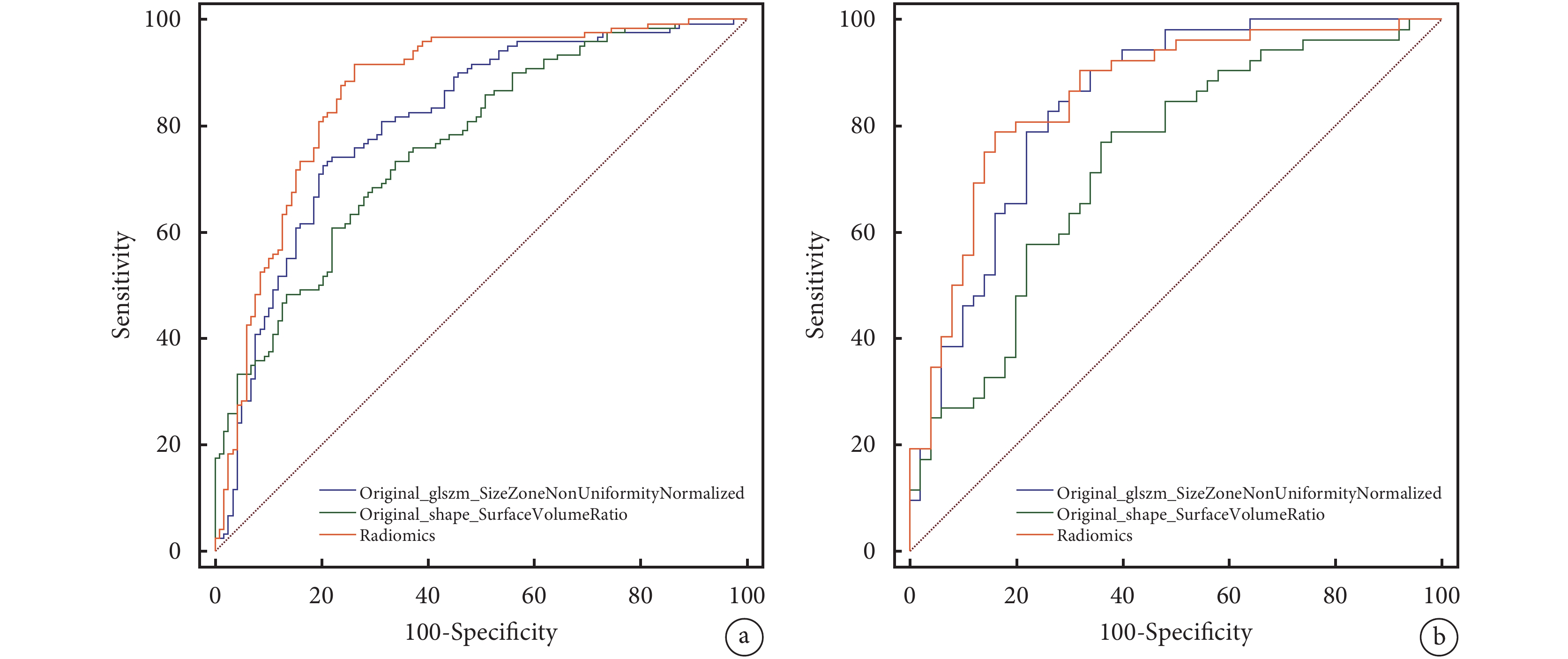 圖2
單個影像組學特征與組學模型的受試者工作特征曲線
圖2
單個影像組學特征與組學模型的受試者工作特征曲線
a:訓練集;b:測試集
組學模型在訓練集及測試集的AUC分別為0.863[95%CI(0.815,0.912)]、0.857[95%CI(0.783,0.932)];敏感性分別為91.7%、73.7%,特異性分別為78.8%、84.0%,準確性分別為85.3%、78.4%。Original_glszm_SizeZoneNonUniformityNormalized、Original_shape_SurfaceVolumeRatio在訓練集中的AUC分別為0.807[95%CI(0.751,0.855)]、0.764[95%CI(0.705,0.817)],敏感性分別為72.5%、73.3%,特異性分別為79.7%、78.0%,準確性分別為76.0%、72.2%;測試集中的AUC分別為0.841[95%CI(0.755,0.906)]、0.730[95%CI(0.633,0.813)],敏感性分別為78.8%、76.9%,特異性分別為78.0%、64.0%,準確性分別為78.4%、70.6%。
3 討論
肺腺癌發病率逐年攀升,由于肺腺癌異質性高,2011年IASLC/ATS/ERS肺腺癌國際多學科分類標準將浸潤性肺腺癌主要分為貼壁型、腺泡型、乳頭型、MPP、SOL 5種亞型,并根據成分劃分優勢型和次要型。肺部結節根治性切除已被證明是早期肺腺癌的有效治療選擇。近年來,有研究[13]發現肺腺癌患者在相同T分期情況下的預后可有不同,從而發現一些腫瘤異質性條件下病理亞型、脈管、胸膜侵犯等對預后有所影響。肺腺癌若伴有MPP/SOL結構成分,即使為次要成分,術后復發或轉移的風險也會增加。因此,伴MPP/SOL結構肺腺癌的術前診斷對于制定合適的治療方案至關重要。
從CT圖像中提取高維定量特征可進行腫瘤類型、預后等無創性預測[14]。既往研究[6-10]表明,影像組學特征模型可作為預測伴MPP/SOL成分肺腺癌的無創預測方法。Chen等[7]發現,將定量圖像分析與影像組學相結合,可以預測肺腺癌中MPP/SOL成分的存在,并取得了較高的敏感性和特異性(分別為90.00%±0.00%和77.12%±2.67%),在外部驗證集中也得到了較高靈敏度和特異度(分別為100.00%和95.35%)。Park等[8]通過CT影像組學特征劃分與預后相關的肺腺癌亞型分組(第0組:貼壁型;第1組:腺泡/乳頭型;第2組:SOL/MPP型),訓練集及驗證集中AUC分別為0.892和0.895。而Chen等[9]的研究納入502例肺部病變,首先建立影像組學模型預測MPP/SOL的含量>1%,交叉驗證集中AUC約0.85。基于實性成分比值模型的AUC約0.84,深度學習模型AUC為0.88;而實性成分比值與深度學習聯合模型AUC為0.91,外部驗證集的聯合模型AUC為0.93,顯著優于獨立模型。但研究中多混雜有不同密度的肺腺癌。Wang等[15]對592例Ⅰ期表現為純實性結節患者的1年及3年生存期進行研究,發現實性結節中并非所有患者預后均較差。本研究旨在建立純實性密度肺腺癌中存在MPP/SOL的預測模型。測試集中AUC為0.857,敏感性為73.7%,特異性為84.0%,準確性為78.4%。
磨玻璃成分在肺結節中與良好的預后相關,而實性結節中有部分結節為肺腺癌中的不良預后亞型(MPP/SOL)。已有研究[9]針對肺部腫瘤的實性密度部分(腫瘤區域CT值190 Hu)指導深度學習模型預測高級別亞型,在外部驗證集中AUC為0.93,優于影像組學模型(AUC=0.85)與無腫瘤實性成分區域指導的影像組學模型(AUC=0.85)。本研究針對純實性結節進行分割、標記、特征提取等操作后構建影像組學模型,訓練集及測試集中的AUC分別為0.863[95%CI(0.815,0.912)]、0.857[95%CI(0.783,0.932)];敏感性分別為91.7%、73.7%,特異性分別為78.8%、84.0%,準確性分別為85.3%、78.4%。本研究與既往文獻類似,通過影像組學特征來反映純實性肺部病灶中MPP/SOL結構的存在。模型建立僅納入107個影像組學特征,最終僅1個腫瘤紋理特征及1個形態特征納入影像組學模型。其中紋理特征Original_glszm_SizeZoneNonUniformityNormalized在Park等[8]的研究中有所提及,該特征尺寸區域非均勻歸一化,測量整個圖像中大小區域體積的可變性,值越低表示圖像中區域大小體積之間的同質性越高。既往研究[16]發現形態特征(表面積/體積)值較低表示更緊湊的球形形狀,側面反映了純實性結節中存在與不存在MPP/SOL結構肺腺癌之間存在差異(P<0.001)。本研究發現相較單個影像組學特征,影像組學模型的結果僅優于單一組學特征Original_shape_SurfaceVolumeRatio的預測結果(P<0.001),與組學特征Original_glszm_SizeZoneNonUniformityNormalized預測結果相仿(P=0.583),準確性也并無明顯提高(測試集:影像組學評分、Original_shape_SurfaceVolumeRatio及Original_glszm_SizeZoneNonUniformityNormalized分別為78.4%、70.6%、78.4%)。但是由于多個影像特征聯合建立的模型類似于基因組學,可以提供比單個影像特征更加全面及穩定的預測效能,故本研究通過所構建的影像組學模型,取得較為良好的診斷效能,在一定程度上相對于單一特征更有利于病變的診斷。
本研究具有一些局限性:本研究為回顧性研究,病理學評估作為參考標準。其次,本研究樣本量較小,具有一定的選擇偏倚。需進一步更多中心研究驗證,以確保結果的普遍性。在圖像數據的分割、特征提取中無法完全排除小的血管、支氣管等結構,從而對特征的準確性有一定影響,將來需要進一步使用自動勾畫病變輪廓并提取特征等方法減小該類因素的影響。
利益沖突:無。
作者貢獻:王芬、柏根基負責論文設計和撰寫,數據收集;張騰負責數據分析;袁梅負責論文部分設計。
肺癌目前仍是全世界發病率及死亡率較高的惡性腫瘤,其中肺腺癌占比約50%。2015版世界衛生組織肺腫瘤分類[1]及2011年國際肺癌研究協會/美國胸科學會/歐洲呼吸學會(International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society,IASLC/ATS/ERS)國際多學科分類根據肺癌病理分型及診斷特點將浸潤性肺腺癌分為5種亞型,其中微乳頭及實體型(micropapillary/solid,MPP/SOL)肺腺癌與預后不良相關,肺腺癌若含有MPP/SOL結構術后需進行化療等管理措施。部分文獻[1-3]報道,MPP/SOL成分無論多少,患者預后均較無MPP/SOL結構浸潤性肺腺癌差。腫瘤的無創性檢查為臨床提供初步篩查依據,目前主要通過小樣本組織活檢的方法確定病理亞型,但由于其取材有限導致病變全貌反映有限,故能全面反映腫瘤特征的無創性檢查手段尤為重要。影像學檢查是術前對病變進行評估的主要方法。既往研究已經對MPP型肺腺癌影像學特征進行初探,僅基于CT影像特征診斷則存在對影像診斷醫師的主觀依賴性較強的問題,且研究數量較為局限。自Lambin等[4]提出影像組學概念后,不斷有研究挖掘影像圖像中的數據信息,對影像特征數據進行深入分析并建模,得到能夠指導疾病診療和轉歸的預測模型,目前影像組學在肺癌等相關領域的組學研究也較為廣泛[5],臨床上已有對MPP/SOL肺腺癌CT圖像數據進行挖掘探索,并建立準確性較高的預測模型[6-9]。既往研究[10]基于混雜有不同密度的肺部病灶,發現磨玻璃成分在肺結節中預示著良好的預后,故臨床工作中對于純實性密度結節的存在,常會有較差的病理診斷結果。放射學上的純實性結節即使經外科手術治療后,也存在隱匿性淋巴結轉移可能(11%~24%),并且可表現出比部分實性結節更多的惡性行為和更差的預后[11-12]。相同臨床T分期的純實體腫瘤仍然具有不同的預后。本研究基于肺部實性密度病灶的高分辨率CT(high-resolution computed tomography,HRCT)圖像,探討影像組學特征模型對伴有MPP/SOL結構浸潤性肺腺癌的預測價值。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2016年4月—2019年8月收治的表現為實性密度肺腺癌患者的臨床資料。納入標準:(1)接受手術切除及系統性淋巴結采樣或清掃術;(2)3個月內行胸部CT平掃檢查且可獲得DICOM格式HRCT圖像;(3)經病理證實的原發性浸潤性肺腺癌患者;(4)臨床資料完整。排除標準:(1)術前接受新輔助治療病史或有外科手術史;(2)存在呼吸運動偽影,影響觀察而不足以評估病變;(3)原發性微浸潤肺腺癌或浸潤性肺腺癌變體型(粘液型、胎兒型、腸型等)。伴有MPP/SOL結構肺腺癌患者為陽性(MPP/SOL+)組,無MPP/SOL結構肺腺癌者為陰性(MPP/SOL?)組。將數據集隨機抽樣以7∶3的比例分為訓練集和測試集。
1.2 圖像采集及評估
所有患者影像采集使用西門子CT(SIEMENS SOMATOM Force)及GE(GE MEDICAL SYSTEMS Revolution)掃描儀行HRCT檢查,患者CT掃描均在仰臥位進行,從胸部入口到腎臟邊緣,掃描時屏氣。管電壓100~120 kV,管電流自適應,矩陣256×256,視野252 mm×252 mm,重建層厚1 mm/1.5 mm。由1位影像診斷醫師(具有4年臨床經驗)收集患者基本信息,并在HRCT軸位圖像(肺窗)上測量病灶最大徑,測量2次取平均值。從影像歸檔和通信系統(picture archiving and communication systems,PACS)以DICOM格式導出患者的肺窗CT圖像。
1.3 病理學評估
病理學評估由本院病理科醫生根據2015年IASLC/ATS/ERS分類標準確定病理亞型及成分。所有標本均使用10%福爾馬林溶液固定,常規石蠟包埋組織,蘇木精-伊紅染色及免疫組化方法檢測確定病變病理分型,明確病變中有無MPP/SOL結構,若存在一種或兩種結構,并且含量超過5%,視為MPP/SOL+組,反之為MPP/SOL?組。
1.4 組學特征提取及標準化
將DICOM格式的HRCT肺窗圖像從PACS導出后,導入內部軟件(MultiLabel),由2位影像診斷醫師(分別具有4年及12年臨床經驗)雙盲法獨立進行三維感興趣區(volume of interest,VOI)分割:首先根據軟件所設置的閾值逐層標記出病灶所在區域,隨后根據設定CT閾值分割VOI,必要時手動校正邊界,盡量避免血管束、鈣化等區域,最終全部數據以NII格式導出用于后續影像組學特征的提取。使用R語言(version 4.1.2,
1.5 特征選擇
1.5.1 一致性檢驗
對2位影像診斷醫師分別提取的組學特征采用組內相關系數(intraclass correlation coefficient,ICC)評估觀察者內及觀察者間一致性,將重復性良好的特征(ICC>0.80)[9]用于后續特征降維、特征選擇等。
1.5.2 特征降維及特征選擇
通過過采樣技術均衡訓練集數據,接著均值歸一化處理后,通過最小絕對收縮與選擇算子(the least absolute shrinkage and selection operator,LASSO)算法進一步降維,調節權重λ,LASSO將所有回歸系數向零收縮,并將不相關特征的系數設置為零。采用5倍交叉驗證,其中λ的最終值產生最小交叉驗證誤差。非零系數值的特征被保留用于回歸模型擬合并構建影像組學模型。所有數據處理過程均在R語言中進行。
1.6 統計學分析
使用SPSS 21.0軟件進行統計學分析,當計量資料服從正態分布,采用均數±標準差(x±s)描述,組間比較采用t檢驗;非正態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用非參數檢驗。計數資料采用頻數和百分比描述,組間比較采用χ2檢驗。采用二元logistic回歸進行多因素分析。受試者工作特征(receiver operating characteristic,ROC)曲線、模型及單獨組學特征的診斷效能評估在MedCalc 15.2.2軟件進行,以曲線下面積(area under the curve,AUC)作為評判標準,Delong檢驗用于比較參與建模的單一特征與影像組學評分之間的診斷效能。P≤0.05為差異有統計學意義。
1.7 倫理審查
本研究已通過淮安市第一人民醫院醫學倫理委員會審查,審批號:KY-2022-045-01。
2 結果
2.1 患者基本臨床資料
本研究共納入340例患者,其中男178例、女162例,平均年齡(60.31±6.69)歲。MPP/SOL+組172例,MPP/SOL?組168例。患者的基本臨床資料及病灶影像學特征見表1。訓練集238例患者,其中陽性組120例、陰性組118例;測試集102例患者,其中陽性組52例、陰性組50例。
2.2 影像組學特征的預測模型建立
從107個浸潤性肺腺癌的影像組學特征中,經一致性檢驗(組內ICC:0.802~0.999,組間ICC:0.809~0.998)、圖像歸一化處理后,通過LASSO分析,2個特征(P<0.001)參與構建模型,其中1個為形態特征,另1個為紋理特征(GLSZM),并計算得到影像組學評分(Radscore),Radscore=?0.04149+6.6314×Original_glszm_SizeZoneNonUniformityNormalized+(?5.83413)×Original_shape_SurfaceVolumeRatio。影像組學特征的預測模型建立流程見圖1。
 圖1
影像組學特征的預測模型建立流程
圖1
影像組學特征的預測模型建立流程
a:圖像中結節的分割,包括標記病灶;設定分割閾值;矯正分割區域,排除血管等結構干擾;b:分割后的相應層面的ROI圖像(NII格式),利用LASSO算法篩選有鑒別意義的影像組學特征;c:LASSO模型中使用5折交叉驗證方法,篩選出效能最好的特征集合,垂直虛線表示,最佳
2.3 影像組學特征的診斷效能
經篩選后的Original_glszm_SizeZoneNonUniformityNormalized及Original_shape_SurfaceVolumeRatio組學特征建立模型并繪制ROC曲線,并通過Delong檢驗比較兩個特征和Radscore的診斷效能。我們發現影像組學模型的結果僅優于單一組學特征Original_shape_SurfaceVolumeRatio進行預測的結果(P<0.001),與組學特征Original_glszm_SizeZoneNonUniformityNormalized預測結果相仿(P=0.583);見圖2。
 圖2
單個影像組學特征與組學模型的受試者工作特征曲線
圖2
單個影像組學特征與組學模型的受試者工作特征曲線
a:訓練集;b:測試集
組學模型在訓練集及測試集的AUC分別為0.863[95%CI(0.815,0.912)]、0.857[95%CI(0.783,0.932)];敏感性分別為91.7%、73.7%,特異性分別為78.8%、84.0%,準確性分別為85.3%、78.4%。Original_glszm_SizeZoneNonUniformityNormalized、Original_shape_SurfaceVolumeRatio在訓練集中的AUC分別為0.807[95%CI(0.751,0.855)]、0.764[95%CI(0.705,0.817)],敏感性分別為72.5%、73.3%,特異性分別為79.7%、78.0%,準確性分別為76.0%、72.2%;測試集中的AUC分別為0.841[95%CI(0.755,0.906)]、0.730[95%CI(0.633,0.813)],敏感性分別為78.8%、76.9%,特異性分別為78.0%、64.0%,準確性分別為78.4%、70.6%。
3 討論
肺腺癌發病率逐年攀升,由于肺腺癌異質性高,2011年IASLC/ATS/ERS肺腺癌國際多學科分類標準將浸潤性肺腺癌主要分為貼壁型、腺泡型、乳頭型、MPP、SOL 5種亞型,并根據成分劃分優勢型和次要型。肺部結節根治性切除已被證明是早期肺腺癌的有效治療選擇。近年來,有研究[13]發現肺腺癌患者在相同T分期情況下的預后可有不同,從而發現一些腫瘤異質性條件下病理亞型、脈管、胸膜侵犯等對預后有所影響。肺腺癌若伴有MPP/SOL結構成分,即使為次要成分,術后復發或轉移的風險也會增加。因此,伴MPP/SOL結構肺腺癌的術前診斷對于制定合適的治療方案至關重要。
從CT圖像中提取高維定量特征可進行腫瘤類型、預后等無創性預測[14]。既往研究[6-10]表明,影像組學特征模型可作為預測伴MPP/SOL成分肺腺癌的無創預測方法。Chen等[7]發現,將定量圖像分析與影像組學相結合,可以預測肺腺癌中MPP/SOL成分的存在,并取得了較高的敏感性和特異性(分別為90.00%±0.00%和77.12%±2.67%),在外部驗證集中也得到了較高靈敏度和特異度(分別為100.00%和95.35%)。Park等[8]通過CT影像組學特征劃分與預后相關的肺腺癌亞型分組(第0組:貼壁型;第1組:腺泡/乳頭型;第2組:SOL/MPP型),訓練集及驗證集中AUC分別為0.892和0.895。而Chen等[9]的研究納入502例肺部病變,首先建立影像組學模型預測MPP/SOL的含量>1%,交叉驗證集中AUC約0.85。基于實性成分比值模型的AUC約0.84,深度學習模型AUC為0.88;而實性成分比值與深度學習聯合模型AUC為0.91,外部驗證集的聯合模型AUC為0.93,顯著優于獨立模型。但研究中多混雜有不同密度的肺腺癌。Wang等[15]對592例Ⅰ期表現為純實性結節患者的1年及3年生存期進行研究,發現實性結節中并非所有患者預后均較差。本研究旨在建立純實性密度肺腺癌中存在MPP/SOL的預測模型。測試集中AUC為0.857,敏感性為73.7%,特異性為84.0%,準確性為78.4%。
磨玻璃成分在肺結節中與良好的預后相關,而實性結節中有部分結節為肺腺癌中的不良預后亞型(MPP/SOL)。已有研究[9]針對肺部腫瘤的實性密度部分(腫瘤區域CT值190 Hu)指導深度學習模型預測高級別亞型,在外部驗證集中AUC為0.93,優于影像組學模型(AUC=0.85)與無腫瘤實性成分區域指導的影像組學模型(AUC=0.85)。本研究針對純實性結節進行分割、標記、特征提取等操作后構建影像組學模型,訓練集及測試集中的AUC分別為0.863[95%CI(0.815,0.912)]、0.857[95%CI(0.783,0.932)];敏感性分別為91.7%、73.7%,特異性分別為78.8%、84.0%,準確性分別為85.3%、78.4%。本研究與既往文獻類似,通過影像組學特征來反映純實性肺部病灶中MPP/SOL結構的存在。模型建立僅納入107個影像組學特征,最終僅1個腫瘤紋理特征及1個形態特征納入影像組學模型。其中紋理特征Original_glszm_SizeZoneNonUniformityNormalized在Park等[8]的研究中有所提及,該特征尺寸區域非均勻歸一化,測量整個圖像中大小區域體積的可變性,值越低表示圖像中區域大小體積之間的同質性越高。既往研究[16]發現形態特征(表面積/體積)值較低表示更緊湊的球形形狀,側面反映了純實性結節中存在與不存在MPP/SOL結構肺腺癌之間存在差異(P<0.001)。本研究發現相較單個影像組學特征,影像組學模型的結果僅優于單一組學特征Original_shape_SurfaceVolumeRatio的預測結果(P<0.001),與組學特征Original_glszm_SizeZoneNonUniformityNormalized預測結果相仿(P=0.583),準確性也并無明顯提高(測試集:影像組學評分、Original_shape_SurfaceVolumeRatio及Original_glszm_SizeZoneNonUniformityNormalized分別為78.4%、70.6%、78.4%)。但是由于多個影像特征聯合建立的模型類似于基因組學,可以提供比單個影像特征更加全面及穩定的預測效能,故本研究通過所構建的影像組學模型,取得較為良好的診斷效能,在一定程度上相對于單一特征更有利于病變的診斷。
本研究具有一些局限性:本研究為回顧性研究,病理學評估作為參考標準。其次,本研究樣本量較小,具有一定的選擇偏倚。需進一步更多中心研究驗證,以確保結果的普遍性。在圖像數據的分割、特征提取中無法完全排除小的血管、支氣管等結構,從而對特征的準確性有一定影響,將來需要進一步使用自動勾畫病變輪廓并提取特征等方法減小該類因素的影響。
利益沖突:無。
作者貢獻:王芬、柏根基負責論文設計和撰寫,數據收集;張騰負責數據分析;袁梅負責論文部分設計。