近期,Cell Research發表了關于“肺腺癌外科治愈窗口期”的社論,患者在此窗口期內接受手術切除后5年或10年無復發生存率達100.0%。病理學上的原位腺癌和微浸潤腺癌及影像學上的純磨玻璃結節可視為肺腺癌外科治愈窗口期。不是所有肺癌患者均可捕捉到治愈窗口期,正確理解和把握治愈窗口期,不僅可提高治愈率,也能避免過度診斷和過度治療。本文就如何正確認識和把握肺腺癌外科治愈窗口期,提出早期肺腺癌的臨床處理流程,闡明肺腺癌外科治愈窗口期的具體使用方法,為肺腺癌手術時機的選擇提供重要理論依據。
引用本文: 傅方求, 張揚, 陳海泉. 如何認識和理解肺腺癌外科治愈窗口期. 中國胸心血管外科臨床雜志, 2023, 30(12): 1674-1677. doi: 10.7507/1007-4848.202310004 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌是死亡率最高的惡性腫瘤[1]。目前,雖然靶向治療、免疫治療等方式大幅提高了肺癌患者的生存率,但是外科手術仍然是早期非小細胞肺癌(non-small cell lung cancer,NSCLC)的主要治療方式[2]。部分早期肺癌患者即使在接受肺癌根治術后仍會出現復發,因此早期肺癌患者術后仍有復發風險。如何準確尋找出術后不會復發的肺癌患者群體,是臨床上亟待解決的重要問題。2020年,一項基于全國6家醫院8 392名職工體檢數據的低劑量螺旋CT(low-dose computed tomography,LDCT)肺癌篩查研究[3]發現,肺癌的發病率高達2.1%,女性的肺癌發病率顯著高于男性,非吸煙者的發病率高于吸煙者,年輕人群的發病率也較高。篩查發現95.5%的肺癌在影像學上表現為磨玻璃結節(ground-glass opacity,GGO),95.0%的肺癌為0期或ⅠA期[3]。隨著篩查的普及,越來越多的“極早期”肺癌被發現。近來,Cell Research雜志提出了“肺腺癌外科治愈窗口期”的理念[4],本文將進一步闡明此理念的臨床應用,幫助讀者進一步正確認識和理解肺腺癌外科治愈窗口期。
1 肺腺癌外科治愈窗口期的定義
惡性腫瘤遵循逐漸進展的生物學規律。肺腺癌外科治愈窗口期應定義為肺腺癌患者能被徹底治愈的階段,在肺腺癌的發展過程中應處于極早期。在臨床上,肺腺癌外科治愈窗口期應為手術后5年或10年無復發生存率達100.0%的臨床或病理階段[4]。根據既往研究[5-6],治愈窗口期包括直徑<3 cm的病理學上的原位腺癌(adenocarcinoma in situ,AIS)和微浸潤腺癌(minimally invasive adenocarcinoma,MIA)以及影像學上的純GGO。肺癌病理診斷應遵循2011年國際肺癌研究協會所提出的肺腺癌病理分類[7]。其中,AIS被定義為只含貼壁成分而無浸潤性成分且直徑≤3 cm的肺部病灶,MIA被定義為以貼壁成分為主、浸潤成分≤5 mm且直徑≤3 cm的肺部病灶。影像學上的診斷應基于薄層CT(thin-section computed tomography,TSCT)結果,層厚較寬的CT可能會對GGO成分進行誤判。純GGO被定義為在TSCT上只有GGO成分而無實性成分的肺部病灶[8]。
上述影像及病理角度的定義已有較多文獻支持,且在臨床上易于使用。目前,部分新興的方法對肺癌患者預后的判斷也有重要價值。液體活檢是一種無創檢測方法,可以通過檢測血液中的腫瘤外泌體、循環腫瘤DNA、特定位點的DNA甲基化水平、循環腫瘤細胞等方法[9-11]來判斷肺癌患者的預后。然而,目前基于液體活檢的研究集中于中晚期肺癌,早期肺癌血液的液體活檢陽性率較低,因此還需要研究發現更多早期肺癌的液體活檢指標。另外,基于CT圖像的影像組學和人工智能也是具有發展前景的預后判斷方法[12-13],不過目前還無預測術后生存的準確率能夠達100.0%的研究。
2 基于外科治愈窗口期的肺癌患者臨床管理策略
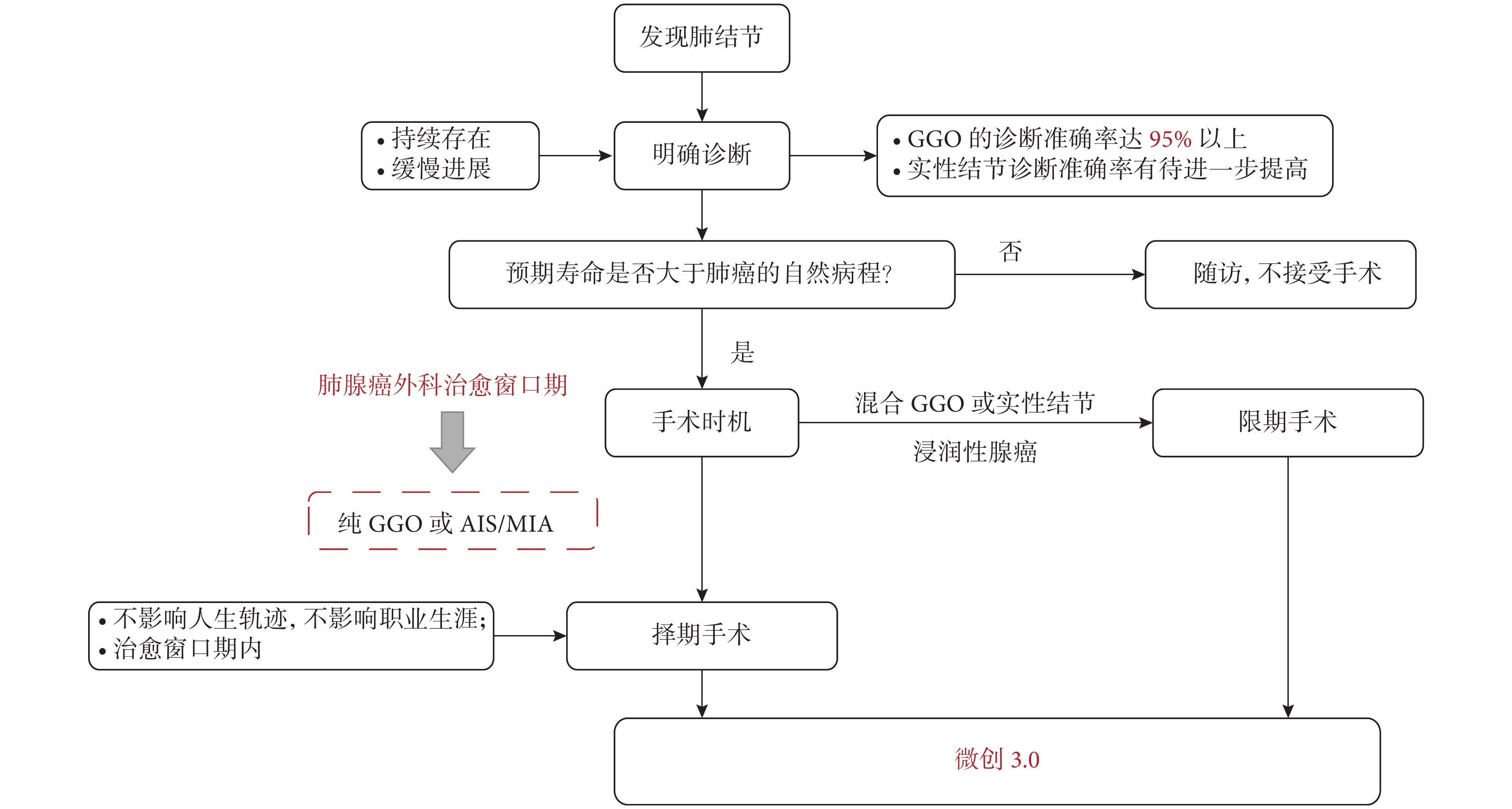
過度診斷是指篩查發現了早期肺癌,而這部分肺癌如果不進行篩查的話也不會影響患者壽命[14]。對過度診斷的病例采取任何治療方式,均為過度治療。另外,“過大”的手術范圍也可以被認為是過度治療,例如對于亞肺葉切除可以治愈的肺結節行肺葉切除術,對不需行縱隔淋巴結清掃的患者行系統性縱隔淋巴結清掃。因此,如何在不導致過度診斷和過度治療的前提下治療處于治愈窗口期的肺癌是重要的臨床問題。基于“外科治愈窗口期”的理念,筆者提出了以100.0%無復發生存率為目標的肺癌患者臨床管理策略(圖1)。
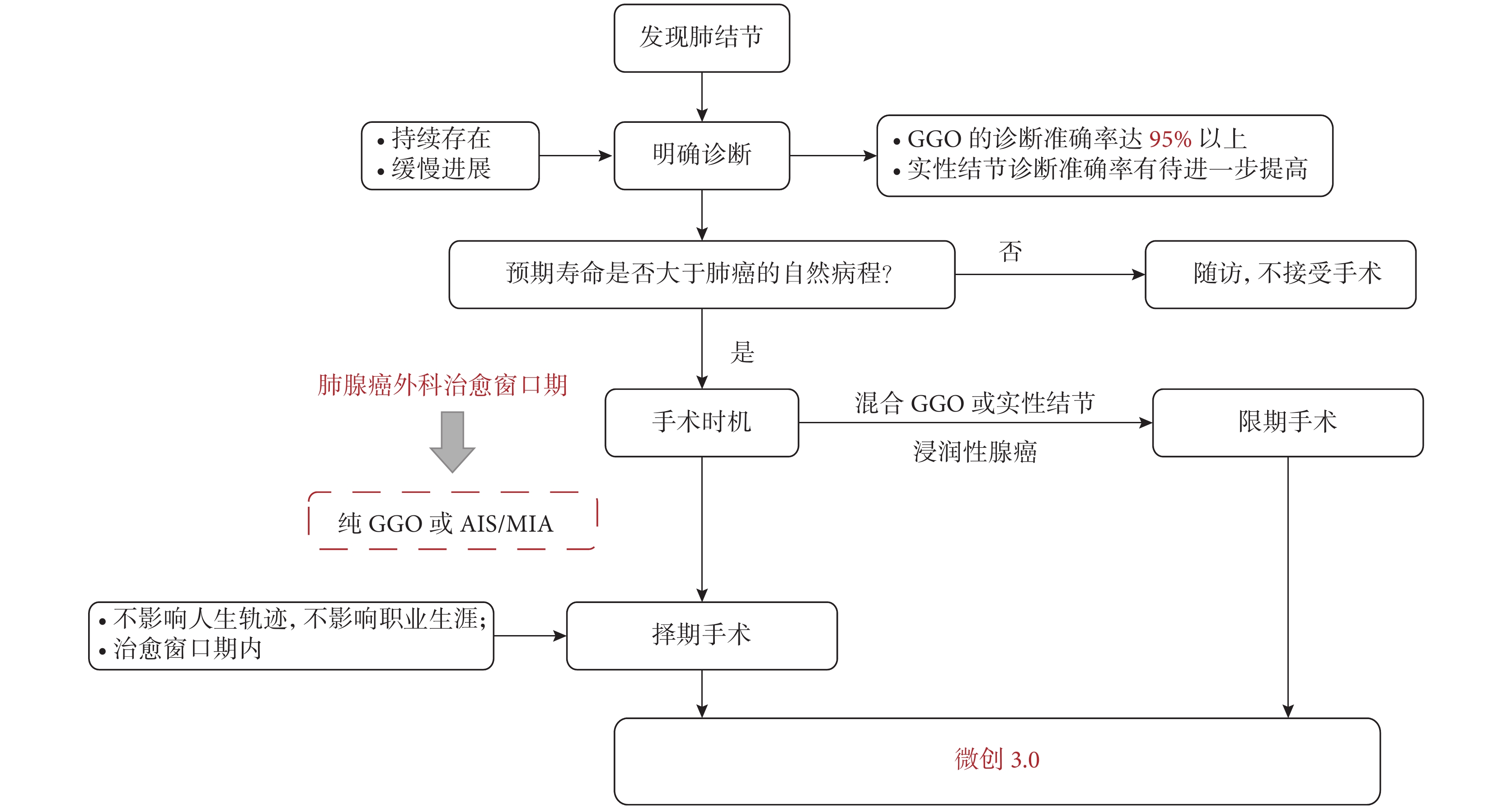 圖1
基于“外科治愈窗口期”理念的肺癌患者臨床管理策略
圖1
基于“外科治愈窗口期”理念的肺癌患者臨床管理策略
GGO: 磨玻璃結節;AIS:原位腺癌;MIA:微浸潤腺癌
(1)明確診斷。對于首次發現的GGO,需再次隨訪來判斷其是否持續存在和是否進展。CT的隨訪頻次需要根據結節大小及影像學表現來決定。超過90%持續存在的GGO病理上為惡性[8,15-16],因此持續存在GGO的惡性可能性較大。然而,部分持續存在的GGO具有惰性的生物學行為,可以在較長時間內保持穩定。所以,只有那些緩慢進展或出現實性成分的結節才需要進一步評估。因此,在發現肺結節后,首先需通過定期的隨訪來確定其是否持續存在和緩慢進展。
(2)比較結節的自然病程和患者的預期壽命。為了降低過度診斷的可能性,在手術前必須比較結節的自然病程與患者的預期壽命。GGO的自然病程可以根據患者的基線特征、結節直徑和影像學表現來綜合判斷,吸煙史、>60歲、既往肺癌病史、較大的結節直徑、出現實性成分均預示著GGO進展的可能性較大[17]。預期壽命則可根據患者的合并癥、地區醫療水平、人群的預期壽命進行大概估算。如果患者的預期壽命遠遠超肺癌的自然病程,那么應該積極在治愈窗口期內行外科手術。相反,如果患者因年齡較大或嚴重合并癥導致預計生存期較短,那么不推薦外科手術。
(3)選擇合適的手術時機。如果手術醫師評估結節仍處于治愈窗口期內,那么手術僅需遵循擇期手術的原則即可。在不影響人生軌跡和職業生涯的前提下,患者可自由選擇在治愈窗口期內的任意適宜時機行手術治療。如果患者選擇暫不行手術治療,那么他需要接受TSCT的定期復查,以免結節超出肺腺癌的治愈窗口期。對于懷疑為惡性的混合GGO和實性結節以及浸潤性腺癌,則需遵循限期手術的原則,盡快行手術治療。
(4)應用微創3.0的理念。在外科治愈窗口期的手術治療需要遵循微創手術3.0的原則,包括切口微創、器官微創和系統微創[18]。切口微創通過減少切口創傷來減輕患者的術后疼痛和加快術后恢復,治愈窗口期內病灶的手術治療應盡量選擇電視胸腔鏡手術,并盡量減少切口數量。器官微創是指縮小肺組織切除范圍和淋巴結清掃范圍。為了避免過度治療,推薦亞肺葉切除及不清掃淋巴結來治療治愈窗口期內的GGO。亞肺葉切除包括楔形切除和肺段切除,在兩者均可的情況下,如果腫瘤位置允許,楔形切除是首選手術方式。系統微創則是通過縮短手術時間等方法來減少手術應激帶來的全身性損傷,這種損傷包括手術期間炎癥因子的釋放和隨后的免疫功能受損。因此,手術醫生應針對患者的基本情況和肺結節的具體特征選擇較小的手術切口、肺組織切除范圍及淋巴結清掃范圍,縮短手術時間,將微創理念應用至手術的各個方面。
3 展望
隨著肺癌篩查的普及,越來越多極早期肺癌患者在臨床上被發現,肺癌治療的目標也逐漸從“提高生存率”向“治愈”轉變。本文提出的基于“外科治愈窗口期”理念的肺癌患者臨床管理策略,可以讓部分肺腺癌患者在避免過度診斷和過度治療的基礎上實現絕對治愈,從而使他們在術后免于復發的擔憂。針對肺腺癌外科治愈窗口期,未來的研究將進行更廣領域、更深層次的探討,將鑒別出更多的具有100.0%無復發生存率的患者亞組,最終使更多的肺癌患者獲益。
利益沖突:無。
作者貢獻:傅方求負責文獻搜集,數據分析;張揚、陳海泉負責文章選題設計,主導研究實施;全體作者參與文章撰寫及審閱。
肺癌是死亡率最高的惡性腫瘤[1]。目前,雖然靶向治療、免疫治療等方式大幅提高了肺癌患者的生存率,但是外科手術仍然是早期非小細胞肺癌(non-small cell lung cancer,NSCLC)的主要治療方式[2]。部分早期肺癌患者即使在接受肺癌根治術后仍會出現復發,因此早期肺癌患者術后仍有復發風險。如何準確尋找出術后不會復發的肺癌患者群體,是臨床上亟待解決的重要問題。2020年,一項基于全國6家醫院8 392名職工體檢數據的低劑量螺旋CT(low-dose computed tomography,LDCT)肺癌篩查研究[3]發現,肺癌的發病率高達2.1%,女性的肺癌發病率顯著高于男性,非吸煙者的發病率高于吸煙者,年輕人群的發病率也較高。篩查發現95.5%的肺癌在影像學上表現為磨玻璃結節(ground-glass opacity,GGO),95.0%的肺癌為0期或ⅠA期[3]。隨著篩查的普及,越來越多的“極早期”肺癌被發現。近來,Cell Research雜志提出了“肺腺癌外科治愈窗口期”的理念[4],本文將進一步闡明此理念的臨床應用,幫助讀者進一步正確認識和理解肺腺癌外科治愈窗口期。
1 肺腺癌外科治愈窗口期的定義
惡性腫瘤遵循逐漸進展的生物學規律。肺腺癌外科治愈窗口期應定義為肺腺癌患者能被徹底治愈的階段,在肺腺癌的發展過程中應處于極早期。在臨床上,肺腺癌外科治愈窗口期應為手術后5年或10年無復發生存率達100.0%的臨床或病理階段[4]。根據既往研究[5-6],治愈窗口期包括直徑<3 cm的病理學上的原位腺癌(adenocarcinoma in situ,AIS)和微浸潤腺癌(minimally invasive adenocarcinoma,MIA)以及影像學上的純GGO。肺癌病理診斷應遵循2011年國際肺癌研究協會所提出的肺腺癌病理分類[7]。其中,AIS被定義為只含貼壁成分而無浸潤性成分且直徑≤3 cm的肺部病灶,MIA被定義為以貼壁成分為主、浸潤成分≤5 mm且直徑≤3 cm的肺部病灶。影像學上的診斷應基于薄層CT(thin-section computed tomography,TSCT)結果,層厚較寬的CT可能會對GGO成分進行誤判。純GGO被定義為在TSCT上只有GGO成分而無實性成分的肺部病灶[8]。
上述影像及病理角度的定義已有較多文獻支持,且在臨床上易于使用。目前,部分新興的方法對肺癌患者預后的判斷也有重要價值。液體活檢是一種無創檢測方法,可以通過檢測血液中的腫瘤外泌體、循環腫瘤DNA、特定位點的DNA甲基化水平、循環腫瘤細胞等方法[9-11]來判斷肺癌患者的預后。然而,目前基于液體活檢的研究集中于中晚期肺癌,早期肺癌血液的液體活檢陽性率較低,因此還需要研究發現更多早期肺癌的液體活檢指標。另外,基于CT圖像的影像組學和人工智能也是具有發展前景的預后判斷方法[12-13],不過目前還無預測術后生存的準確率能夠達100.0%的研究。
2 基于外科治愈窗口期的肺癌患者臨床管理策略
過度診斷是指篩查發現了早期肺癌,而這部分肺癌如果不進行篩查的話也不會影響患者壽命[14]。對過度診斷的病例采取任何治療方式,均為過度治療。另外,“過大”的手術范圍也可以被認為是過度治療,例如對于亞肺葉切除可以治愈的肺結節行肺葉切除術,對不需行縱隔淋巴結清掃的患者行系統性縱隔淋巴結清掃。因此,如何在不導致過度診斷和過度治療的前提下治療處于治愈窗口期的肺癌是重要的臨床問題。基于“外科治愈窗口期”的理念,筆者提出了以100.0%無復發生存率為目標的肺癌患者臨床管理策略(圖1)。
 圖1
基于“外科治愈窗口期”理念的肺癌患者臨床管理策略
圖1
基于“外科治愈窗口期”理念的肺癌患者臨床管理策略
GGO: 磨玻璃結節;AIS:原位腺癌;MIA:微浸潤腺癌
(1)明確診斷。對于首次發現的GGO,需再次隨訪來判斷其是否持續存在和是否進展。CT的隨訪頻次需要根據結節大小及影像學表現來決定。超過90%持續存在的GGO病理上為惡性[8,15-16],因此持續存在GGO的惡性可能性較大。然而,部分持續存在的GGO具有惰性的生物學行為,可以在較長時間內保持穩定。所以,只有那些緩慢進展或出現實性成分的結節才需要進一步評估。因此,在發現肺結節后,首先需通過定期的隨訪來確定其是否持續存在和緩慢進展。
(2)比較結節的自然病程和患者的預期壽命。為了降低過度診斷的可能性,在手術前必須比較結節的自然病程與患者的預期壽命。GGO的自然病程可以根據患者的基線特征、結節直徑和影像學表現來綜合判斷,吸煙史、>60歲、既往肺癌病史、較大的結節直徑、出現實性成分均預示著GGO進展的可能性較大[17]。預期壽命則可根據患者的合并癥、地區醫療水平、人群的預期壽命進行大概估算。如果患者的預期壽命遠遠超肺癌的自然病程,那么應該積極在治愈窗口期內行外科手術。相反,如果患者因年齡較大或嚴重合并癥導致預計生存期較短,那么不推薦外科手術。
(3)選擇合適的手術時機。如果手術醫師評估結節仍處于治愈窗口期內,那么手術僅需遵循擇期手術的原則即可。在不影響人生軌跡和職業生涯的前提下,患者可自由選擇在治愈窗口期內的任意適宜時機行手術治療。如果患者選擇暫不行手術治療,那么他需要接受TSCT的定期復查,以免結節超出肺腺癌的治愈窗口期。對于懷疑為惡性的混合GGO和實性結節以及浸潤性腺癌,則需遵循限期手術的原則,盡快行手術治療。
(4)應用微創3.0的理念。在外科治愈窗口期的手術治療需要遵循微創手術3.0的原則,包括切口微創、器官微創和系統微創[18]。切口微創通過減少切口創傷來減輕患者的術后疼痛和加快術后恢復,治愈窗口期內病灶的手術治療應盡量選擇電視胸腔鏡手術,并盡量減少切口數量。器官微創是指縮小肺組織切除范圍和淋巴結清掃范圍。為了避免過度治療,推薦亞肺葉切除及不清掃淋巴結來治療治愈窗口期內的GGO。亞肺葉切除包括楔形切除和肺段切除,在兩者均可的情況下,如果腫瘤位置允許,楔形切除是首選手術方式。系統微創則是通過縮短手術時間等方法來減少手術應激帶來的全身性損傷,這種損傷包括手術期間炎癥因子的釋放和隨后的免疫功能受損。因此,手術醫生應針對患者的基本情況和肺結節的具體特征選擇較小的手術切口、肺組織切除范圍及淋巴結清掃范圍,縮短手術時間,將微創理念應用至手術的各個方面。
3 展望
隨著肺癌篩查的普及,越來越多極早期肺癌患者在臨床上被發現,肺癌治療的目標也逐漸從“提高生存率”向“治愈”轉變。本文提出的基于“外科治愈窗口期”理念的肺癌患者臨床管理策略,可以讓部分肺腺癌患者在避免過度診斷和過度治療的基礎上實現絕對治愈,從而使他們在術后免于復發的擔憂。針對肺腺癌外科治愈窗口期,未來的研究將進行更廣領域、更深層次的探討,將鑒別出更多的具有100.0%無復發生存率的患者亞組,最終使更多的肺癌患者獲益。
利益沖突:無。
作者貢獻:傅方求負責文獻搜集,數據分析;張揚、陳海泉負責文章選題設計,主導研究實施;全體作者參與文章撰寫及審閱。