引用本文: 陳紅領, 周強, 楊斌, 蔡慶慧, 周志明. 兒童心臟移植22例近遠期療效的單中心回顧性研究. 中國胸心血管外科臨床雜志, 2024, 31(11): 1589-1593. doi: 10.7507/1007-4848.202403004 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
兒童終末期心力衰竭最有效的治療手段是心臟移植,然而報道主要集中于歐洲。國際心肺移植第二十四期兒科心臟移植報告[1]顯示:1992—2000年兒童心臟移植數量為
1 資料與方法
1.1 臨床資料
回顧性分析2018年5月—2023年8月鄭州市第七人民醫院心臟移植中心行心臟移植的受者和供者的臨床資料。受者納入標準:移植手術時年齡<18周歲;排除標準:(1)多器官聯合移植;(2)家屬不愿意進行移植隨訪登記或隨訪過程中脫落。收集受者和供者臨床特征、手術資料、術后并發癥和生存率等。
1.2 免疫移植用藥及維持方案
所有受者均采用舒萊(巴利昔單抗)行免疫誘導治療。對于體重<35 kg的受者,總劑量為20 mg;體重>35 kg的受者,總劑量為40 mg,分兩次輸注,首次于移植術前2 h 內,第2次于移植術后4 d。免疫抑制維持方案為他克莫司+嗎替麥考酚+甲潑尼龍,并根據感染及淋巴細胞亞群調整用藥劑量。
1.3 統計學分析
采用IBM SPSS 26.0軟件行統計學分析。正態分布的計量資料以均數±標準差(x±s)描述,偏態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述;計數資料用頻數和百分比描述。采用Kaplan-Meier曲線行生存分析,生存率的比較采用log-rank檢驗。雙側檢驗,P≤0.05為差異有統計學意義。
1.4 倫理審查
所有供體心臟均來自器官捐獻,由中國人體器官分配與共享計算機分配。手術方案經醫院醫學倫理委員會審核通過,倫理審批號:20221215001。受者及家屬簽署知情同意書。
2 結果
2.1 患者一般臨床資料
2018年5月—2023年8月我院共完成230例心臟移植,參考《中國兒童心臟移植操作規范(2019版)》[2],其中受者年齡<18歲兒童心臟移植22例,男14例、女8例。22例受者中位年齡13.5(10.0,15.0)歲,中位體重41.9(30.5,55.4)kg。供者中位年齡21.0(13.0,29.0)歲,中位體重50.5(47.3,75.0)kg,其中男19例、女3例。患者原發病包括:擴張性心肌病16例,肥厚型心肌病1例,心肌致密化不全3例,致右室發育不良心肌病1例,先天性心臟病冠狀動脈(冠脈)起源異常1例。供受體血型相同,A型10例,B型5例,O型5例,AB型2例,移植前患兒紐約心臟協會(New York Heart Association,NYHA)心功能分級均為Ⅳ級,移植前主動脈內球囊反搏(intra-aortic balloon pump,IABP)輔助1例,體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)輔助3例,連續性腎臟替代治療(continuous renal replacement therapy,CRRT)輔助2例,機械通氣2例。9例符合兒童緊急狀態分配,患者群體反應性抗體均<10%。
2.2 手術結果
供體心臟冷缺血時間355.0(262.0,395.5)min,升主動脈阻斷時間45.0(38.3,51.3)min,機械通氣時間22.5(16.8,52.5)h,術后住院時間29.5(20.0,43.0)d。22例患者均行房房吻合術。術后重癥監護室停留時間6.0(5.0,8.3)d,22例患兒術后行ECMO輔助4例,CRRT輔助2例。
特別病例:1例供受體體重比>3.0的供體心臟放入左側胸腔,壓迫約50%肺葉,術中嘗試關胸,發現心率需控制在140~160次/min,經過調整成功關胸,避免了延遲關胸的風險。1例術前呼吸機、CRRT、ECMO輔助11 d,術后2 d,ECMO撤離,呼吸機輔助呼吸,患者并發多器官衰竭,家屬放棄治療出院。1例術前ECMO輔助橋接移植,術后肝腎功能不全行血漿置換,ECMO輔助3 d撤機,術后4 d脫離呼吸機,術后11 d因肺部真菌感染重新氣管插管,呼吸機輔助呼吸,后好轉出院。1例冠脈起源異常患兒冠脈搭橋術后,心臟移植術前3次上機ECMO,術前存在神經系統并發癥,四肢存在肢體障礙,語言不辯,術后ECMO輔助3 d,受體心臟病理檢查顯示已經出現纖維化,術后進行康復治療,現生活與成人無異。
2.3 術后并發癥及生存率
術后7例患者出現并發癥,包括肺部真菌感染6例,肝腎功能不全1例,局部傷口不愈合、縱隔感染1例,多器官衰竭1例。
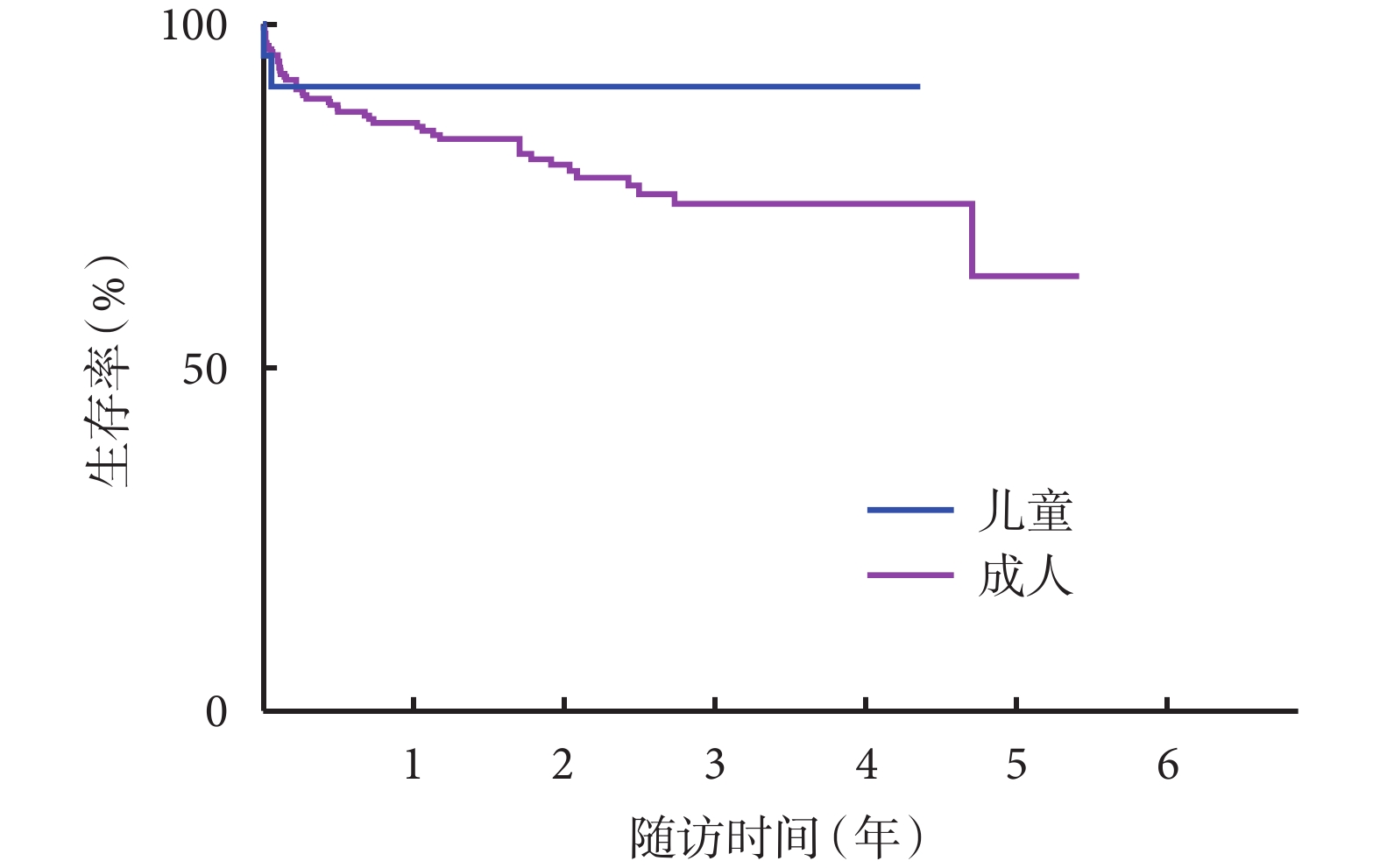
所有出院患兒心功能恢復至NYHAⅠ~Ⅱ級,院外隨訪時間截至2023年8月30日,22例患兒均進行門診或電話隨訪。Kaplan-Meier生存曲線分析顯示,術后1、3年生存率為91.3%;我中心成人心臟移植術后1、3年生存率分別為86.7%、73.8%。從生存曲線觀察,兒童心臟移植生存率高于成人(χ2=1.391,P=0.238);見圖1。
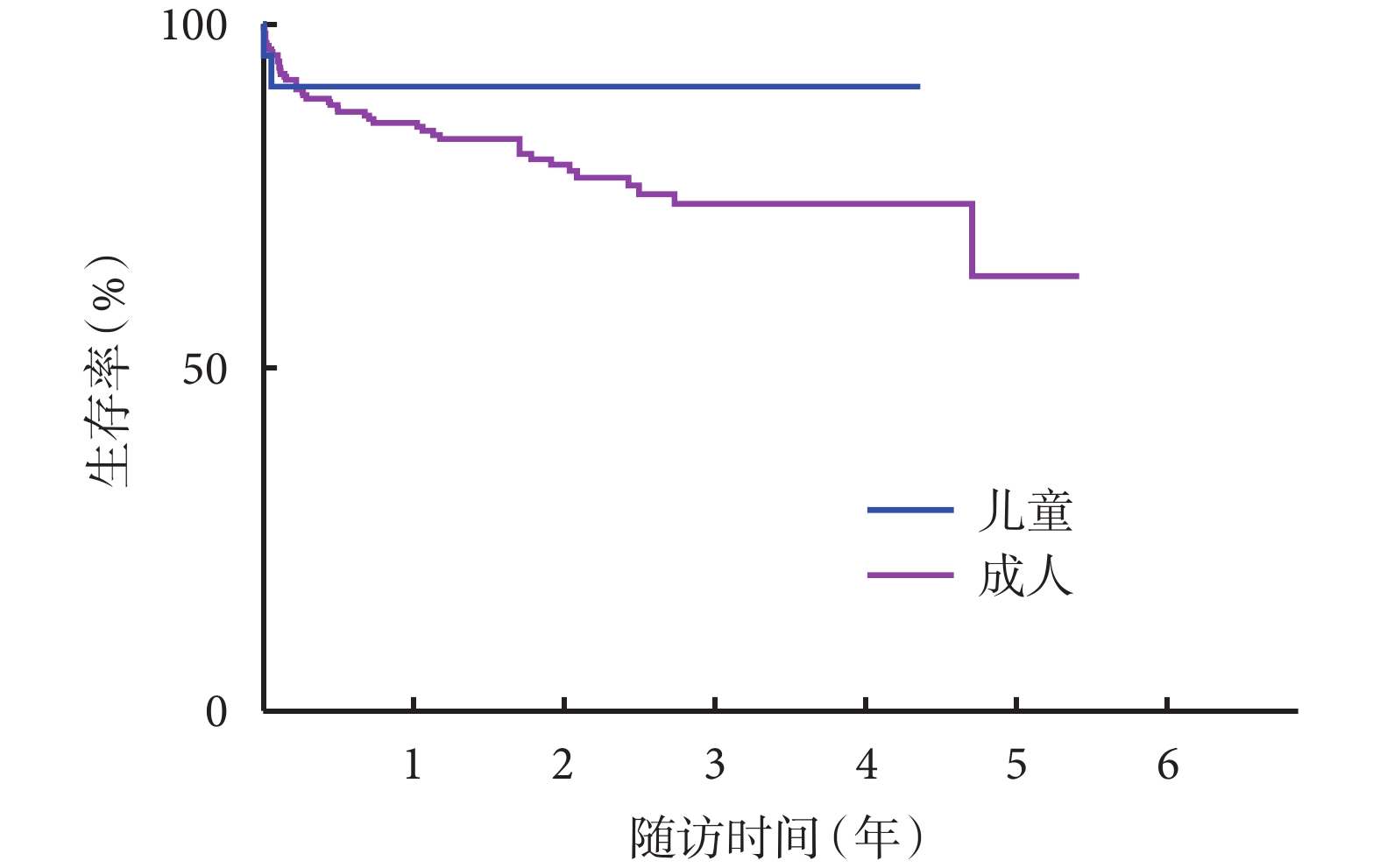 圖1
兒童與成人心臟移植患者Kaplan-Meier生存曲線圖
圖1
兒童與成人心臟移植患者Kaplan-Meier生存曲線圖
3 討論
自1967年美國實施第1例兒童心臟移植以來,全球每年約開展500例兒童心臟移植,根據國際心肺移植協會報道,兒童心臟移植術后1、5、10年生存率分別為87.2%、77%和68.5%[1]。近年來,我國成人心臟移植質量和數量都取得了較好的成績,但我國兒童心臟移植發展晚,起步慢。我中心自2018年5月開展心臟移植,截至2023年8月已完成心臟移植230例,本研究分析了我中心22例兒童心臟移植的近遠期療效及臨床經驗。
兒童心臟移植的適應證包括:晚期心肌病、無法矯正伴嚴重心力衰竭的先天性心臟病以及經姑息治療或常規矯正仍不能改善癥狀的不可逆心臟病。我國兒童心臟移植受者原發病占比依次為心肌病73%,先天性心臟病13.5%,其他2.7%。與以往國內其他中心研究[3- 4]報道一致,與國外不同,擴張性心肌病仍然是我國兒童心臟移植的主要人群。國際心肺移植協會報道嬰幼兒心臟移植(2010—2018年),先天性心臟病占57%,擴張性心肌病占35%[5]。
目前制約兒童心臟移植發展的原因主要有:(1)供體心臟匹配困難,尤其是嬰幼兒受者難以等到尺寸合適的供體心臟,面臨延遲關胸的特點;(2)嬰幼兒圍手術期管理特殊;(3)在兒童中,免疫系統仍在發育,因此免疫抑制治療的管理更加復雜,需要權衡抑制免疫反應和維護免疫系統的功能;(4)先天性心臟病患兒二次開胸或多次開胸造成心臟移植手術困難;(5)生長和發育問題,特別是免疫抑制劑的應用,這些藥物可以影響機體的免疫功能,也可能導致一些副作用,如減弱機體對感染的抵抗力、影響骨骼健康和抑制生長激素的分泌;(6)長期護理,這包括定期心臟功能評估、免疫抑制藥物管理、并發癥監測以及心理和社會支持。要成功克服這些難點,兒童心臟移植需要跨學科的醫療團隊,包括心臟外科醫生、心臟移植專家、免疫學家、心臟病專家、心理健康專家和社會工作者等,以確保患兒得到全面的護理和支持。
在兒童心臟移植中,心臟匹配性仍然是主要問題,提高供體心臟利用率可在一定程度上解決這一困境,如ABO血型不相容供體心臟的使用,具有免疫學原理的支持,即新生兒不會產生針對主要血型抗原的抗體[6-7]。另外一項研究[8]顯示,在過去10年中,被列為ABO不相容并被移植的嬰兒數量逐漸增加,O型血的ABO不相容移植使等待時間顯著縮短。移植1年后,ABO不相容組和ABO相容組的排斥反應具有可比性,存活率沒有顯著差異,這是在兒童心臟移植中的重大創新。供受體大小不匹配供體心臟的選擇也是一個重要方案,目前供體-受體體重比表示的心臟大小匹配是被廣泛接受的,以前的研究使用供體-受體重量比主要選擇標準為0.8~2.5,>3.0的病例非常少見。有研究[9]表明,供體-受體的尺寸范圍可以擴大到3倍,因為較大的供體-受體重量比容易發生較高的右心室衰竭和肺葉塌陷事件。提高供體心臟大小尺寸的評估,非常考驗外科團隊的技術,個案文獻報道,供/受體重量比可達7.5[10] 和6.25[11]。一項大規模兒童心臟移植研究[12]顯示,總心臟容量(total cardiac volume,TCV)和供/受體身高不匹配才是心臟移植物存活的獨立預測因素。
機械輔助橋接在兒童心臟移植中扮演重要角色,可以延長等待供體心臟的時間,提供重要的生命支持,從而增加成功移植機會。常見的機械輔助裝置包括左心室輔助裝置(left ventricular assist devices,LVADs)[13]和ECMO[14],由于管道原因與患兒身高原因,IABP在兒童心臟移植中較少使用。使用機械輔助最大的問題是感染,但研究[15]表明,使用LVADs與ECMO形成的感染并不會對兒童心臟移植后的生存率產生負面影響。本中心1例患者3次上機ECMO,術前已經存在腦部缺血癥狀,術后1個月仍然存在肢體障礙,不能言語,后進行1年的功能康復鍛煉,現極大好轉,生活能夠自理,語言表達清晰,活動自如。本中心移植經驗:若患兒術前已行ECMO輔助,術中觀察心功能情況,建議觀察病情,術后1~2 d內撤離ECMO,這并不會影響患兒的遠期生存率。對于術中懷疑出現早期移植物衰竭的患者,主要考慮心臟缺血-再灌注損傷,需要逐漸進行心臟功能恢復,復查心肌酶等指標,建議ECMO輔助3~5 d,逐漸下調流量,嘗試脫離ECMO。
本中心常規使用他克莫司+嗎替麥考酚+甲潑尼龍進行維持免疫治療。對于免疫抑制劑的使用,我們認為最佳的免疫抑制療法是組合不同的藥物,以增強其免疫抑制潛力,避免使用單一藥物降低其毒性作用,如在使用他克莫司的基礎上使用西羅莫司,對于免疫維持較好的患者,逐漸減停甲潑尼龍等皮質類固醇類藥物。皮質類固醇類仍然是心臟移植中誘導、挽救和維持的主要藥物,然而其有顯著的副作用,尤其在兒童心臟移植中是否使用皮質類固醇類行抗免疫排斥治療仍然存在爭議,通常與使用的劑量和治療持續時間有關。Baraldo等[16]報道了30例接受皮質類固醇類治療的兒童心臟移植患者的1、5、10年總生存率分別為80%、76%和76%,平均排斥率為1.2次/例,感染發生率為0.2次/例。Singh等[17]報道了6~12個月撤離類固醇藥物治療的可行性,在類固醇藥物撤離后,21例患者中有4例(24%)發生排斥,6個月生存率為88%。Bergmann等[18]的一項回顧性研究得到類似結果:77例兒童心臟移植患者的1、5、10年生存率分別為88%、85%和70%,總體排斥率為0.03次/(例·年)。我中心1例4個月兒童在術后1個月停用甲潑尼龍,術后隨訪1年未發現移植排斥反應,同時我們建議患兒在術后1~3個月不常規使用激素類藥物進行抗排斥治療。在調整免疫藥物中,我們根據感染、免疫學檢查和淋巴細胞亞群調整用藥劑量。
心內膜活檢仍然是檢測心臟移植后排斥反應的金標準,然而受到各方面的限制,對于不能進行心內膜活檢患者,我們主要進行經驗評估,這些經驗包括發熱、呼吸困難、咳嗽、嘔吐、腹痛、厭食、易激惹、活動耐量下降、精神萎靡、心電圖、心臟彩色超聲、免疫學檢查變化等。國際心肺移植協會也表明:兒童常規進行心內膜活檢監測是有爭議的,一般而言,急性細胞排斥在5歲以下的嬰兒和兒童中較少發生,并且移植后第1年的治療排斥反應頻率在不斷下降[19]。基于對這個年齡段的身體發育等考慮,心內膜活檢并發癥的風險更高,而且手術總是需要全身麻醉或深度鎮靜,從而增加了風險和經濟成本。因此,一些中心不對某個年齡(如1或2歲)或體重(如10 kg)以下兒童進行任何常規心內膜活檢監測,更加強調非侵入性排斥監測。
在生存率方面,我中心兒童心臟移植術后1年生存率為91.3%,這與國際報道相似。成人心臟移植術后1年生存率為86.7%,兒童心臟移植的遠期生存率也高于成人心臟移植。
綜上所述,隨著科學研究和醫療技術的不斷進步,兒童心臟移植的前景將變得更加光明。然而,仍然需要解決供體器官短缺、免疫排斥反應和治療效果長期追蹤等挑戰。醫療界將繼續努力改進兒童心臟移植的治療方法,以提高成功率并改善患者的生活質量。
利益沖突:無。
作者貢獻:陳紅領負責數據收集、分析,論文撰寫;周強負責數據收集,統計學指導;楊斌、蔡慶慧負責論文審閱,資料查詢;周志明負責論文整體設計,審閱、修改論文,基金支持。
兒童終末期心力衰竭最有效的治療手段是心臟移植,然而報道主要集中于歐洲。國際心肺移植第二十四期兒科心臟移植報告[1]顯示:1992—2000年兒童心臟移植數量為
1 資料與方法
1.1 臨床資料
回顧性分析2018年5月—2023年8月鄭州市第七人民醫院心臟移植中心行心臟移植的受者和供者的臨床資料。受者納入標準:移植手術時年齡<18周歲;排除標準:(1)多器官聯合移植;(2)家屬不愿意進行移植隨訪登記或隨訪過程中脫落。收集受者和供者臨床特征、手術資料、術后并發癥和生存率等。
1.2 免疫移植用藥及維持方案
所有受者均采用舒萊(巴利昔單抗)行免疫誘導治療。對于體重<35 kg的受者,總劑量為20 mg;體重>35 kg的受者,總劑量為40 mg,分兩次輸注,首次于移植術前2 h 內,第2次于移植術后4 d。免疫抑制維持方案為他克莫司+嗎替麥考酚+甲潑尼龍,并根據感染及淋巴細胞亞群調整用藥劑量。
1.3 統計學分析
采用IBM SPSS 26.0軟件行統計學分析。正態分布的計量資料以均數±標準差(x±s)描述,偏態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述;計數資料用頻數和百分比描述。采用Kaplan-Meier曲線行生存分析,生存率的比較采用log-rank檢驗。雙側檢驗,P≤0.05為差異有統計學意義。
1.4 倫理審查
所有供體心臟均來自器官捐獻,由中國人體器官分配與共享計算機分配。手術方案經醫院醫學倫理委員會審核通過,倫理審批號:20221215001。受者及家屬簽署知情同意書。
2 結果
2.1 患者一般臨床資料
2018年5月—2023年8月我院共完成230例心臟移植,參考《中國兒童心臟移植操作規范(2019版)》[2],其中受者年齡<18歲兒童心臟移植22例,男14例、女8例。22例受者中位年齡13.5(10.0,15.0)歲,中位體重41.9(30.5,55.4)kg。供者中位年齡21.0(13.0,29.0)歲,中位體重50.5(47.3,75.0)kg,其中男19例、女3例。患者原發病包括:擴張性心肌病16例,肥厚型心肌病1例,心肌致密化不全3例,致右室發育不良心肌病1例,先天性心臟病冠狀動脈(冠脈)起源異常1例。供受體血型相同,A型10例,B型5例,O型5例,AB型2例,移植前患兒紐約心臟協會(New York Heart Association,NYHA)心功能分級均為Ⅳ級,移植前主動脈內球囊反搏(intra-aortic balloon pump,IABP)輔助1例,體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)輔助3例,連續性腎臟替代治療(continuous renal replacement therapy,CRRT)輔助2例,機械通氣2例。9例符合兒童緊急狀態分配,患者群體反應性抗體均<10%。
2.2 手術結果
供體心臟冷缺血時間355.0(262.0,395.5)min,升主動脈阻斷時間45.0(38.3,51.3)min,機械通氣時間22.5(16.8,52.5)h,術后住院時間29.5(20.0,43.0)d。22例患者均行房房吻合術。術后重癥監護室停留時間6.0(5.0,8.3)d,22例患兒術后行ECMO輔助4例,CRRT輔助2例。
特別病例:1例供受體體重比>3.0的供體心臟放入左側胸腔,壓迫約50%肺葉,術中嘗試關胸,發現心率需控制在140~160次/min,經過調整成功關胸,避免了延遲關胸的風險。1例術前呼吸機、CRRT、ECMO輔助11 d,術后2 d,ECMO撤離,呼吸機輔助呼吸,患者并發多器官衰竭,家屬放棄治療出院。1例術前ECMO輔助橋接移植,術后肝腎功能不全行血漿置換,ECMO輔助3 d撤機,術后4 d脫離呼吸機,術后11 d因肺部真菌感染重新氣管插管,呼吸機輔助呼吸,后好轉出院。1例冠脈起源異常患兒冠脈搭橋術后,心臟移植術前3次上機ECMO,術前存在神經系統并發癥,四肢存在肢體障礙,語言不辯,術后ECMO輔助3 d,受體心臟病理檢查顯示已經出現纖維化,術后進行康復治療,現生活與成人無異。
2.3 術后并發癥及生存率
術后7例患者出現并發癥,包括肺部真菌感染6例,肝腎功能不全1例,局部傷口不愈合、縱隔感染1例,多器官衰竭1例。
所有出院患兒心功能恢復至NYHAⅠ~Ⅱ級,院外隨訪時間截至2023年8月30日,22例患兒均進行門診或電話隨訪。Kaplan-Meier生存曲線分析顯示,術后1、3年生存率為91.3%;我中心成人心臟移植術后1、3年生存率分別為86.7%、73.8%。從生存曲線觀察,兒童心臟移植生存率高于成人(χ2=1.391,P=0.238);見圖1。
 圖1
兒童與成人心臟移植患者Kaplan-Meier生存曲線圖
圖1
兒童與成人心臟移植患者Kaplan-Meier生存曲線圖
3 討論
自1967年美國實施第1例兒童心臟移植以來,全球每年約開展500例兒童心臟移植,根據國際心肺移植協會報道,兒童心臟移植術后1、5、10年生存率分別為87.2%、77%和68.5%[1]。近年來,我國成人心臟移植質量和數量都取得了較好的成績,但我國兒童心臟移植發展晚,起步慢。我中心自2018年5月開展心臟移植,截至2023年8月已完成心臟移植230例,本研究分析了我中心22例兒童心臟移植的近遠期療效及臨床經驗。
兒童心臟移植的適應證包括:晚期心肌病、無法矯正伴嚴重心力衰竭的先天性心臟病以及經姑息治療或常規矯正仍不能改善癥狀的不可逆心臟病。我國兒童心臟移植受者原發病占比依次為心肌病73%,先天性心臟病13.5%,其他2.7%。與以往國內其他中心研究[3- 4]報道一致,與國外不同,擴張性心肌病仍然是我國兒童心臟移植的主要人群。國際心肺移植協會報道嬰幼兒心臟移植(2010—2018年),先天性心臟病占57%,擴張性心肌病占35%[5]。
目前制約兒童心臟移植發展的原因主要有:(1)供體心臟匹配困難,尤其是嬰幼兒受者難以等到尺寸合適的供體心臟,面臨延遲關胸的特點;(2)嬰幼兒圍手術期管理特殊;(3)在兒童中,免疫系統仍在發育,因此免疫抑制治療的管理更加復雜,需要權衡抑制免疫反應和維護免疫系統的功能;(4)先天性心臟病患兒二次開胸或多次開胸造成心臟移植手術困難;(5)生長和發育問題,特別是免疫抑制劑的應用,這些藥物可以影響機體的免疫功能,也可能導致一些副作用,如減弱機體對感染的抵抗力、影響骨骼健康和抑制生長激素的分泌;(6)長期護理,這包括定期心臟功能評估、免疫抑制藥物管理、并發癥監測以及心理和社會支持。要成功克服這些難點,兒童心臟移植需要跨學科的醫療團隊,包括心臟外科醫生、心臟移植專家、免疫學家、心臟病專家、心理健康專家和社會工作者等,以確保患兒得到全面的護理和支持。
在兒童心臟移植中,心臟匹配性仍然是主要問題,提高供體心臟利用率可在一定程度上解決這一困境,如ABO血型不相容供體心臟的使用,具有免疫學原理的支持,即新生兒不會產生針對主要血型抗原的抗體[6-7]。另外一項研究[8]顯示,在過去10年中,被列為ABO不相容并被移植的嬰兒數量逐漸增加,O型血的ABO不相容移植使等待時間顯著縮短。移植1年后,ABO不相容組和ABO相容組的排斥反應具有可比性,存活率沒有顯著差異,這是在兒童心臟移植中的重大創新。供受體大小不匹配供體心臟的選擇也是一個重要方案,目前供體-受體體重比表示的心臟大小匹配是被廣泛接受的,以前的研究使用供體-受體重量比主要選擇標準為0.8~2.5,>3.0的病例非常少見。有研究[9]表明,供體-受體的尺寸范圍可以擴大到3倍,因為較大的供體-受體重量比容易發生較高的右心室衰竭和肺葉塌陷事件。提高供體心臟大小尺寸的評估,非常考驗外科團隊的技術,個案文獻報道,供/受體重量比可達7.5[10] 和6.25[11]。一項大規模兒童心臟移植研究[12]顯示,總心臟容量(total cardiac volume,TCV)和供/受體身高不匹配才是心臟移植物存活的獨立預測因素。
機械輔助橋接在兒童心臟移植中扮演重要角色,可以延長等待供體心臟的時間,提供重要的生命支持,從而增加成功移植機會。常見的機械輔助裝置包括左心室輔助裝置(left ventricular assist devices,LVADs)[13]和ECMO[14],由于管道原因與患兒身高原因,IABP在兒童心臟移植中較少使用。使用機械輔助最大的問題是感染,但研究[15]表明,使用LVADs與ECMO形成的感染并不會對兒童心臟移植后的生存率產生負面影響。本中心1例患者3次上機ECMO,術前已經存在腦部缺血癥狀,術后1個月仍然存在肢體障礙,不能言語,后進行1年的功能康復鍛煉,現極大好轉,生活能夠自理,語言表達清晰,活動自如。本中心移植經驗:若患兒術前已行ECMO輔助,術中觀察心功能情況,建議觀察病情,術后1~2 d內撤離ECMO,這并不會影響患兒的遠期生存率。對于術中懷疑出現早期移植物衰竭的患者,主要考慮心臟缺血-再灌注損傷,需要逐漸進行心臟功能恢復,復查心肌酶等指標,建議ECMO輔助3~5 d,逐漸下調流量,嘗試脫離ECMO。
本中心常規使用他克莫司+嗎替麥考酚+甲潑尼龍進行維持免疫治療。對于免疫抑制劑的使用,我們認為最佳的免疫抑制療法是組合不同的藥物,以增強其免疫抑制潛力,避免使用單一藥物降低其毒性作用,如在使用他克莫司的基礎上使用西羅莫司,對于免疫維持較好的患者,逐漸減停甲潑尼龍等皮質類固醇類藥物。皮質類固醇類仍然是心臟移植中誘導、挽救和維持的主要藥物,然而其有顯著的副作用,尤其在兒童心臟移植中是否使用皮質類固醇類行抗免疫排斥治療仍然存在爭議,通常與使用的劑量和治療持續時間有關。Baraldo等[16]報道了30例接受皮質類固醇類治療的兒童心臟移植患者的1、5、10年總生存率分別為80%、76%和76%,平均排斥率為1.2次/例,感染發生率為0.2次/例。Singh等[17]報道了6~12個月撤離類固醇藥物治療的可行性,在類固醇藥物撤離后,21例患者中有4例(24%)發生排斥,6個月生存率為88%。Bergmann等[18]的一項回顧性研究得到類似結果:77例兒童心臟移植患者的1、5、10年生存率分別為88%、85%和70%,總體排斥率為0.03次/(例·年)。我中心1例4個月兒童在術后1個月停用甲潑尼龍,術后隨訪1年未發現移植排斥反應,同時我們建議患兒在術后1~3個月不常規使用激素類藥物進行抗排斥治療。在調整免疫藥物中,我們根據感染、免疫學檢查和淋巴細胞亞群調整用藥劑量。
心內膜活檢仍然是檢測心臟移植后排斥反應的金標準,然而受到各方面的限制,對于不能進行心內膜活檢患者,我們主要進行經驗評估,這些經驗包括發熱、呼吸困難、咳嗽、嘔吐、腹痛、厭食、易激惹、活動耐量下降、精神萎靡、心電圖、心臟彩色超聲、免疫學檢查變化等。國際心肺移植協會也表明:兒童常規進行心內膜活檢監測是有爭議的,一般而言,急性細胞排斥在5歲以下的嬰兒和兒童中較少發生,并且移植后第1年的治療排斥反應頻率在不斷下降[19]。基于對這個年齡段的身體發育等考慮,心內膜活檢并發癥的風險更高,而且手術總是需要全身麻醉或深度鎮靜,從而增加了風險和經濟成本。因此,一些中心不對某個年齡(如1或2歲)或體重(如10 kg)以下兒童進行任何常規心內膜活檢監測,更加強調非侵入性排斥監測。
在生存率方面,我中心兒童心臟移植術后1年生存率為91.3%,這與國際報道相似。成人心臟移植術后1年生存率為86.7%,兒童心臟移植的遠期生存率也高于成人心臟移植。
綜上所述,隨著科學研究和醫療技術的不斷進步,兒童心臟移植的前景將變得更加光明。然而,仍然需要解決供體器官短缺、免疫排斥反應和治療效果長期追蹤等挑戰。醫療界將繼續努力改進兒童心臟移植的治療方法,以提高成功率并改善患者的生活質量。
利益沖突:無。
作者貢獻:陳紅領負責數據收集、分析,論文撰寫;周強負責數據收集,統計學指導;楊斌、蔡慶慧負責論文審閱,資料查詢;周志明負責論文整體設計,審閱、修改論文,基金支持。