心臟移植是終末期心力衰竭患者最有效的治療方式。近10年來,心臟移植外科領域取得了巨大進展,但供體心臟的嚴重不足始終是限制心臟移植廣泛應用的關鍵問題。隨著供心復蘇、保存與評估技術的革新,擴展標準供體和循環死亡供體的應用日益增加,供心缺血的安全時限和獲取地域范圍不斷擴大,均顯著擴充了供體庫,推動了心臟移植數量的迅速增長。同時,心臟移植外科技術和受體圍手術期管理領域也涌現出許多新技術,特別是機械循環支持和人工智能的迅猛發展,有望為心臟移植領域帶來革命性的變革。本文對近年來美國成人心臟移植的現狀與外科主要進展進行綜述和討論,以期為讀者提供啟示,激發在該領域的持續探索與創新思路。
引用本文: 梁宏亮. 美國成人心臟移植現狀與外科進展. 中國胸心血管外科臨床雜志, 2024, 31(11): 1567-1588. doi: 10.7507/1007-4848.202406032 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
目前,美國≥20歲心力衰竭(心衰)患者超過670萬例。預計到2030年,美國心衰患者占總人口的比例將從2012年的2.4%上升至3.0%,影響超過800萬名≥18歲人群[1]。1967年,Christiaan Barnard 醫生在南非成功實施了人類第1例同種異體心臟移植[2]。1968年,Norman Shumway醫生在斯坦福大學醫院完成了美國首例心臟移植[3]。經過50多年的發展,心臟移植已被公認為治療終末期心衰的最佳療法。當前,北美地區心臟移植患者的1年生存率已超過91%[4],中位生存時間超過14.8年[5]。然而,可用于移植的心臟數量仍然遠遠無法滿足終末期心衰患者的巨大需求。近年來,心臟移植領域取得了顯著的技術進步,特別是在供體捐獻技術方面的進展,顯著擴大了供心來源,使更多患者得以接受心臟移植。在受體端也涌現出一些新的外科和圍手術期管理技術,提高了心臟移植療效。本文旨在綜述美國成人心臟移植的現狀與外科方面的進展,包括循環死亡供體的應用,新的供心獲取、復蘇、評估與保存技術,移植新技術,多器官聯合移植,圍手術期機械循環和人工智能應用等外科醫師關注的領域。
1 美國心臟移植現狀概覽
根據美國器官共享聯合網絡(United Network for Organ Sharing,UNOS)提供的公開數據(
2018年UNOS對供體分配系統進行了重大改革,相較于接受持久機械循環支持(mechanical circulatory support,MCS)的候選受體,強調將供心優先分配給使用短期MCS的候選受體,因其醫療需求更迫切[9]。此次改革顯著縮短了使用體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)候選受體的等待移植時間,中位等待時間由10 d縮短至5 d,并將30 d與6個月生存率分別從76.4%和74.6%提升至94.2%和90.6%。同時,使用持久左心室輔助裝置(left ventricular assist device,LVAD)的心臟移植受體比例由41.8%下降至21.2%,在等待名單上接受LVAD的候選受體比例也從14.5%降低至10.8%。此外,對于病情更為危重的一級和二級候選受體,供心的來源范圍擴大到500英里(約805 km),以期更公平地利用心臟移植資源。此次系統改革對候選受體的等待時間、心臟獲取距離及缺血時間等方面產生了顯著影響:中位等待時間從93 d縮短至41 d;供心中位獲取距離從83英里(約134 km)增加至225英里(約410 km);供心中位缺血時間從3.0 h延長至3.5 h。盡管受體的住院時間有所延長,但出院前的急性排斥發生率基本持平(11.9% vs. 11.7%)。術后30 d、90 d和180 d的生存率在政策變更前后基本相同,消除了對于高危患者可能會惡化心臟移植結果的擔憂。
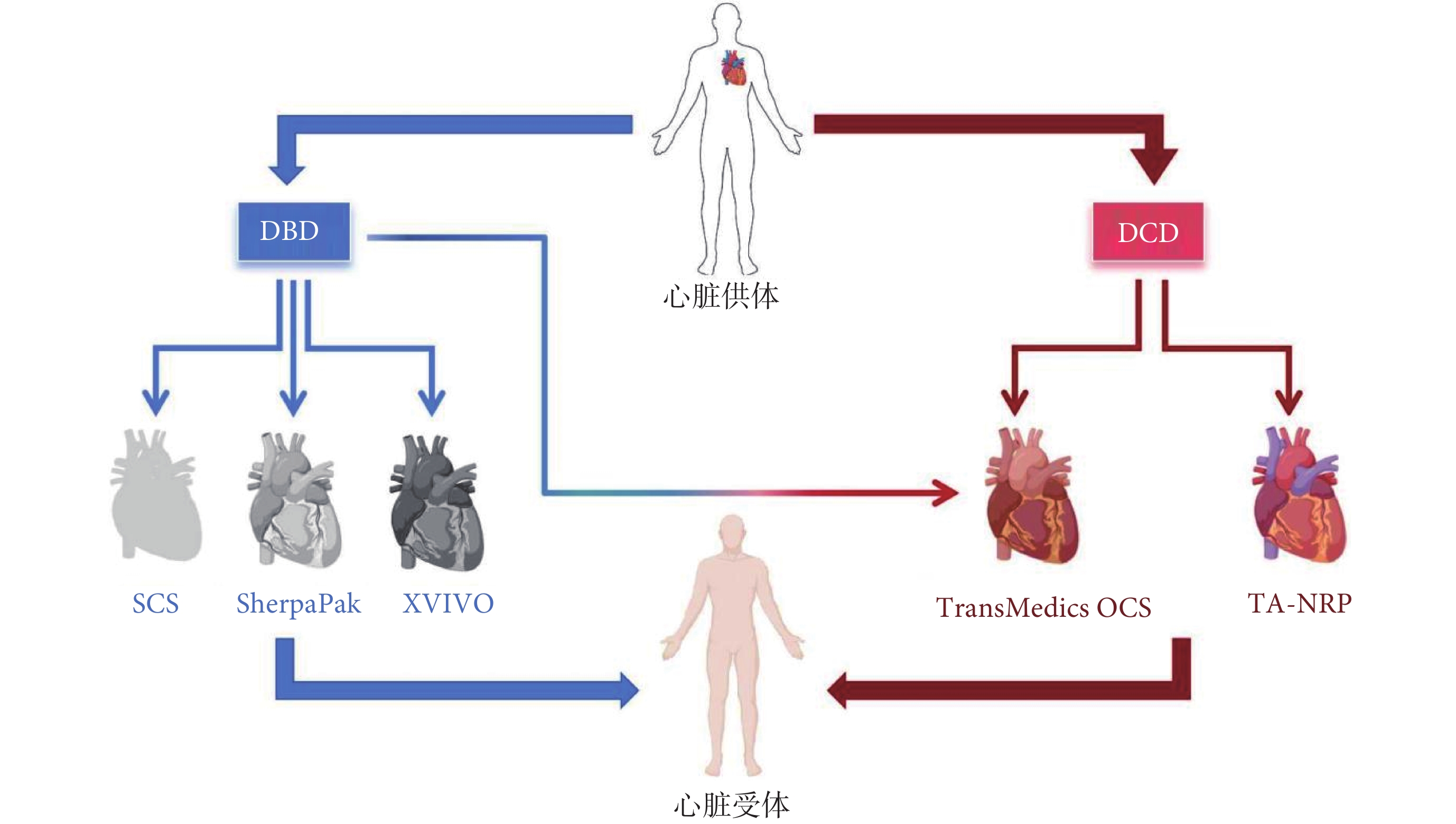
2 心臟移植供體捐獻技術的現狀與進展
2.1 循環死亡后捐獻供體心臟的應用
器官捐贈可以在患者死亡后進行,醫學和法律上的定義有兩種方式:(1)不可逆的腦功能停止;(2)永久性血液循環停止[10]。腦死亡后捐獻(donation after brain death,DBD)供體是通過反復神經學檢查確認包括腦干反射消失和腦血流缺失的捐獻者。循環死亡后捐獻(donation after circulatory death,DCD)供體則是那些具有不可逆重度神經損傷但未完全符合腦死亡標準的捐獻者,通過體檢或動脈內壓力監測確定循環停止[10]。1967年Christiaan Barnard完成的首次心臟移植手術使用了DCD捐獻者的心臟[2]。但由于對DCD供體心跳停止所導致的缺血損傷的擔憂,DCD心臟的應用被暫停,成人心臟移植長期僅采用DBD供體心臟。但為減少等待移植患者與可用心臟之間的巨大差距,2014年澳大利亞醫師開始重新采用DCD心臟移植[11]。之后,進行DCD心臟移植的醫療機構和手術案例逐步增加。美國關于DCD心臟移植的主要經驗源自器官護理系統(Organ Care System,OCS)的臨床試驗,2023年發布的試驗[12]結果顯示,DCD與DBD心臟移植的早期生存率相似。該試驗報道了180例患者的臨床結果,這些患者按3∶1的比例隨機分配到DCD心臟移植組或常規DBD心臟移植組。DCD供心使用TransMedics OCS進行離體供心機械常溫灌注(后文介紹)。DCD組受體6個月生存率為94%,DBD組為90%。DCD組嚴重原發性移植物功能障礙(primary graft dysfunction,PGD)發生率為15%,而DBD心臟組為5%。其他研究[13-16]結果也證實,使用DCD心臟的6個月生存率、并發癥發生率與傳統DBD心臟相似,為91%~95%。重要的是,應用DCD供體的醫療機構可顯著增加心臟移植數量,縮短患者等待移植的時間[17]。Madan等[16]估算DCD供體應用可使美國每年增加300例成人心臟移植。近5年美國DCD心臟使用量迅速增加,2018—2023年分別為0例、7例、107例、205例、343例、612例(數據來源于UNOS公開資料,
DCD心臟捐獻的過程通常在控制性撤除生命維持治療(withdrawal of life-sustaining therapy,WLST)后進行[10]。由與移植團隊或器官潛在受體無關的醫療專業人員做出WLST的決定,該決定必須是獨立于器官捐獻可能性的。在WLST之前3~5 min給予患者3萬單位普通肝素抗凝。在WLST過程中要給予患者完善的治療,保障患者舒適。患者循環停止(無脈搏或動脈線平坦)時首次宣告死亡。若繼續器官捐獻,設有5 min觀察期以排除自發生命跡象恢復可能,無生命體征則第二次宣告死亡。5 min觀察期足以排除自發生命逆轉可能[18]。只有第二次宣告死亡后,移植團隊才能接管供體的捐獻工作,啟動外科獲取器官程序。美國各醫療機構根據自定DCD政策執行,但遵循上述基本原則[19]。WLST可在ICU、麻醉恢復室或手術室進行,根據機構規定而異。WLST后的觀察時間窗為60~120 min不等,僅在此期內宣告死亡者可進入器官獲取流程;否則,患者將繼續接受治療,不可進行器官捐獻。
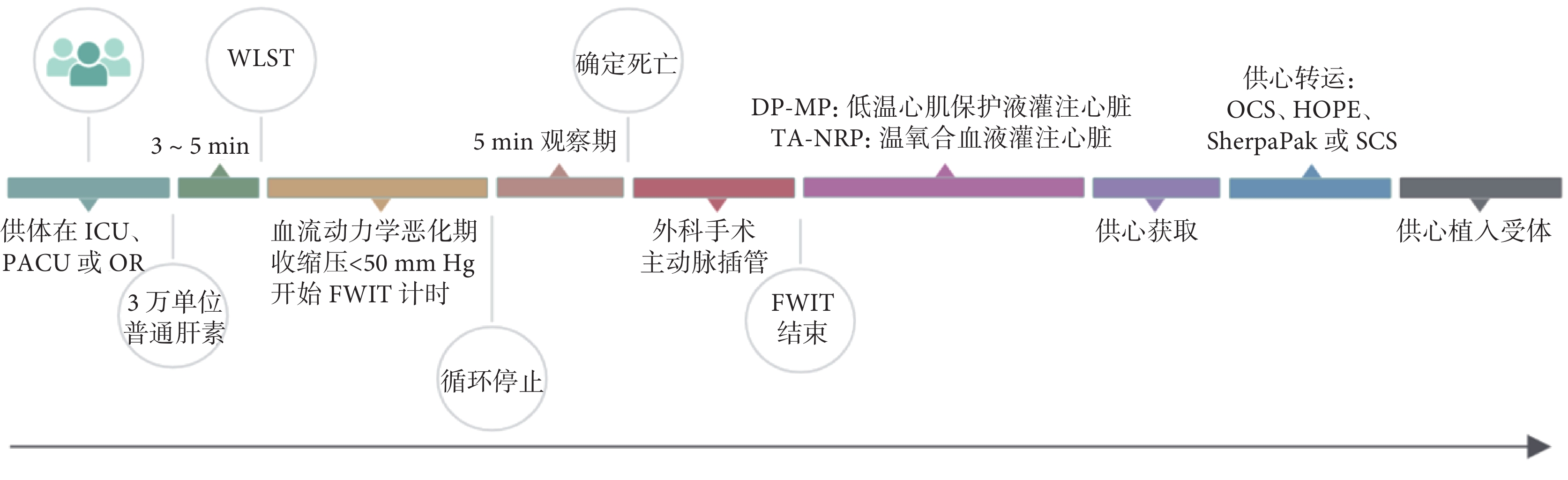
對于心臟熱缺血的標準及其容許時間窗,不同醫療機構有各自的規定[20]。例如,斯坦福大學心胸外科將WLST后收縮壓下降至50 mm Hg(1 mm Hg=0.133 kPa)視為功能性熱缺血(functional warm ischemic time,FWIT)的起始,灌注低溫心肌保護液時刻為終止,其容許的時間窗限定在≤30 min[21]。這表示,如果供體的收縮壓降至50 mm Hg后的30 min內未被宣布死亡,則必然超出了FWIT的允許時限,該供體心臟不再適用。倘若供體的收縮壓在降至50 mm Hg后反彈升高超過該值,FWIT的計時將重置,從下次收縮壓降至50 mm Hg時刻起重新計算。FWIT對器官質量有顯著的負面影響。大部分FWIT發生在宣布患者死亡前,移植團隊無法改變。但患者宣布死亡后至心臟開始灌注(DP-MP技術灌注低溫心肌保護液,TA-NRP技術灌注氧合溫血)的間隔時間可通過嫻熟的外科技術和團隊協作而縮短。因此,DCD心臟獲取、復蘇與評估需要由經驗豐富的外科團隊實施[10]。DCD心臟獲取流程示意圖見圖1。
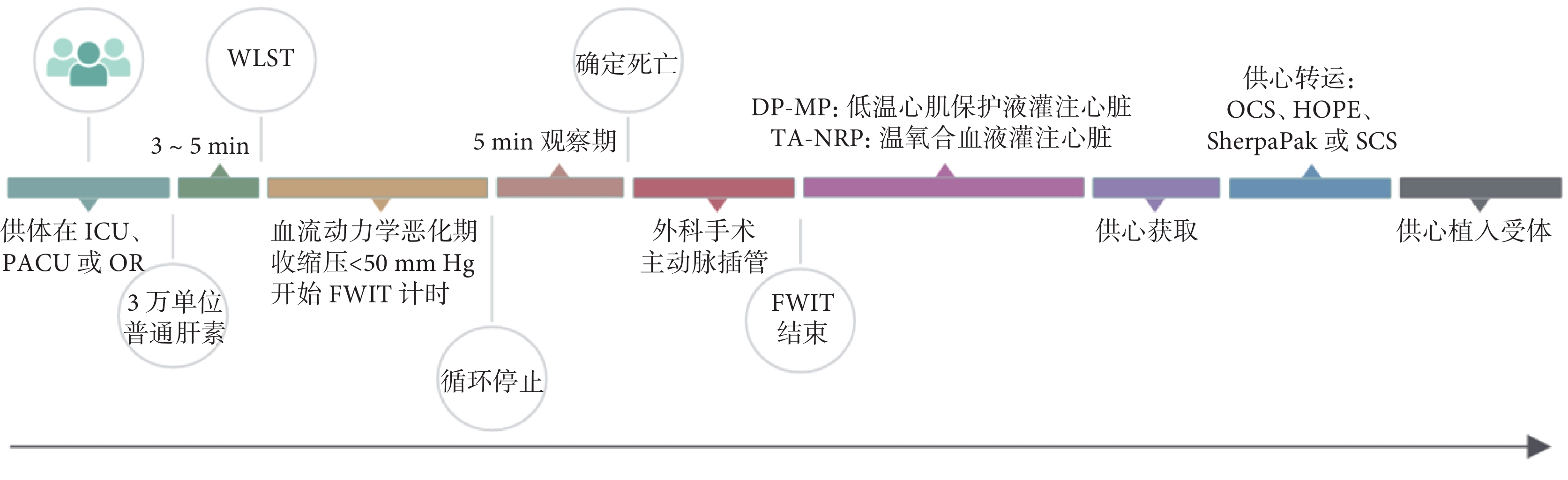 圖1
循環死亡后捐獻供體心臟獲取流程示意圖
圖1
循環死亡后捐獻供體心臟獲取流程示意圖
ICU:重癥監護室;PACU:麻醉恢復室;OR:手術室;WLST:撤除生命維持治療;FWIT:功能性熱缺血;DP-MP:直接獲取后機器灌注;TA-NRP:胸腹常溫區域灌注;OCS:器官護理系統;HOPE:低溫氧合灌注;SCS:靜態低溫保存
2.2 離體供心常溫機械灌注—TransMedics器官護理系統
TransMedics OCS(TransMedics Inc.,美國)是美國食品藥品監督管理局(Food and Drug Administration,FDA)唯一批準臨床應用的離體心臟機械常溫灌注平臺[22]。該系統能夠實現心臟復蘇、優化組織內環境、縮短冷缺血時間、評估供心狀態和功能,進行冠狀動脈造影。TransMedics OCS為DCD心臟DP-MP提供了技術支持,是DCD心臟應用最廣泛的技術;延長了DBD和DCD供心離體的安全時限,為實現長途運輸提供了新手段。
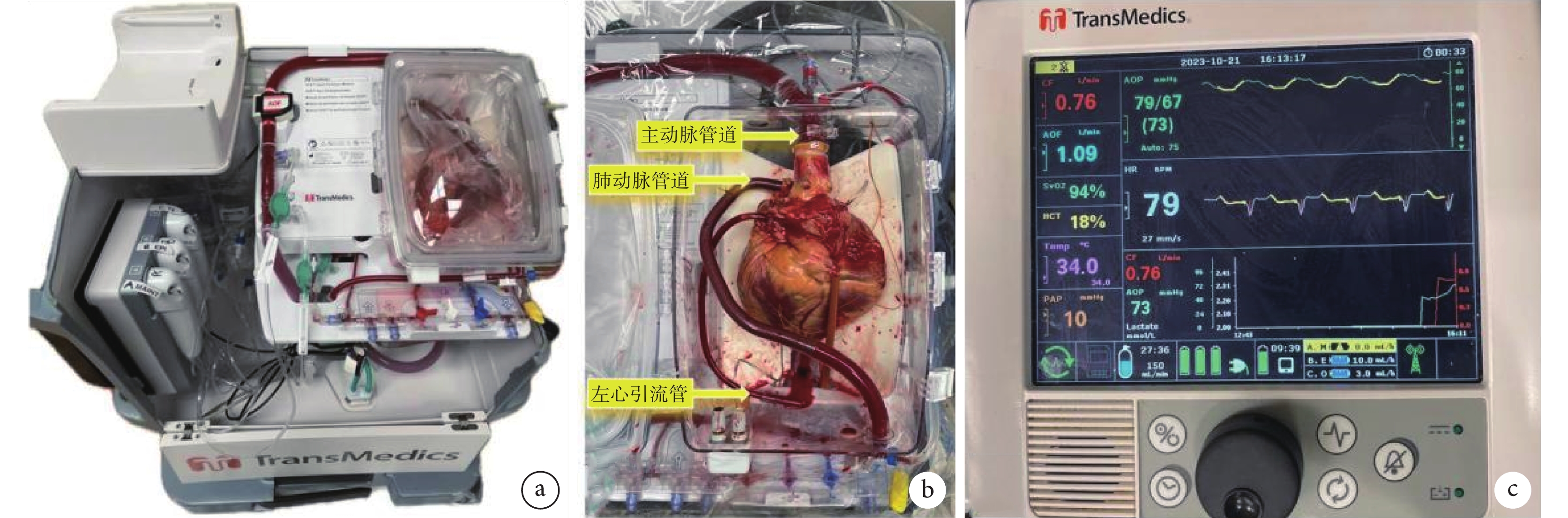
TransMedics OCS由心臟控制單元、心臟灌注單元與心臟灌注液體套裝3大功能單元構成,包括無線監控器、液體輸送系統、灌注模塊、除顫器、血氣分析儀、血液采集套裝、心臟停搏液套裝等部件;見圖2a~c。不論是DBD還是DCD心臟,使用該系統前,需通過供體右心房插管收集1.2~1.5 L血液。切除供心前,使用TransMedics推薦的心肌保護液(Bretschneider HTK液或del Nido液)順行性灌注心臟。供心切除和檢查后,需閉合未閉的卵圓孔、上腔與下腔靜脈、右心房插管處,然后將供心主動脈與OCS主動脈接口連接,主肺動脈通過插管連接至血液貯液器。供體血液在加溫至34℃并氧合后,泵入升主動脈以實現冠狀動脈灌注,之后通過冠狀靜脈竇、右心房、右心室、肺動脈流回貯液器,再次經過OCS氧合后泵回主動脈,建立血液循環;見圖2d。灌注回路中加入胰島素、抗生素、白蛋白、甲基強的松龍、碳酸氫鈉、多種維生素、電解質、葡萄糖和甲狀腺素等。供心通常在溫血灌注后短時間內恢復跳動,若發生心室顫動可施以直流電擊。此外,放置雙心室外膜起搏導線并連接起搏器,設置心室按需起搏(VVI)模式下心率80次/min。監控器實時顯示主動脈壓、冠狀動脈流量、溫度、血氧飽和度、肺動脈壓、血細胞比容和心電圖等參數;見圖3。供心在OCS溫血灌注期間,通過監測血流動力學參數、心電圖和生化參數(血氣分析、電解質和葡萄糖)進行評估。為調整血流動力學以及擴張冠狀動脈,可泵入適量的腎上腺素和腺苷,并通過調整主動脈灌注流量,將冠狀動脈流量維持在650~850 mL/min(并非真實的生理流量),主動脈壓維持在65~90 mm Hg。同時,需及時糾正電解質紊亂和酸堿失衡,補充能量物質。監測動、靜脈血的乳酸水平及其變化趨勢和差值,以確定心肌乳酸攝取率,這是評估供心可用性的重要指標。最終判斷OCS復蘇的供心是否適合移植的標準包括:視覺評估心臟收縮力良好、血流動力學參數穩定、動脈和靜脈血乳酸持續下降,以及動脈乳酸高于靜脈乳酸[12]。相對較低的靜脈乳酸水平表明乳酸吸收良好,反映心肌灌注充足[23]。但如供心收縮能力降低,伴隨持續的血流動力學不穩定如主動脈壓力增加,乳酸持續上升并>5 mmol/L,這提示心肌損傷及其相關的冠狀血管阻力增加,這樣的心臟應該被棄用。當供心被運送至受體的手術室且受體已準備好進行植入時,首先降溫并移除主肺動脈插管,打開下腔靜脈。接著關閉OCS血泵,通過主動脈接口灌注冷心肌保護液,迅速使心臟停搏。完成這些步驟后,將供心從OCS中取出,轉移到受體手術區。
 圖2
TransMedics OCS示意圖(引用美國FDA公開資料,https://www.fda.gov/media/147298/download)
圖2
TransMedics OCS示意圖(引用美國FDA公開資料,https://www.fda.gov/media/147298/download)
a:設備外形;b:設備去除上蓋后內部構造,心臟灌注單元尚未組裝;c:心臟灌注單元前面觀,該單元為一次性使用耗材,組裝于OCS設備中;d:OCS灌注血液流動模式圖;OCS:器官護理系統;FDA:美國食品藥品監督管理局;圖片經TransMedics Inc.授權使用
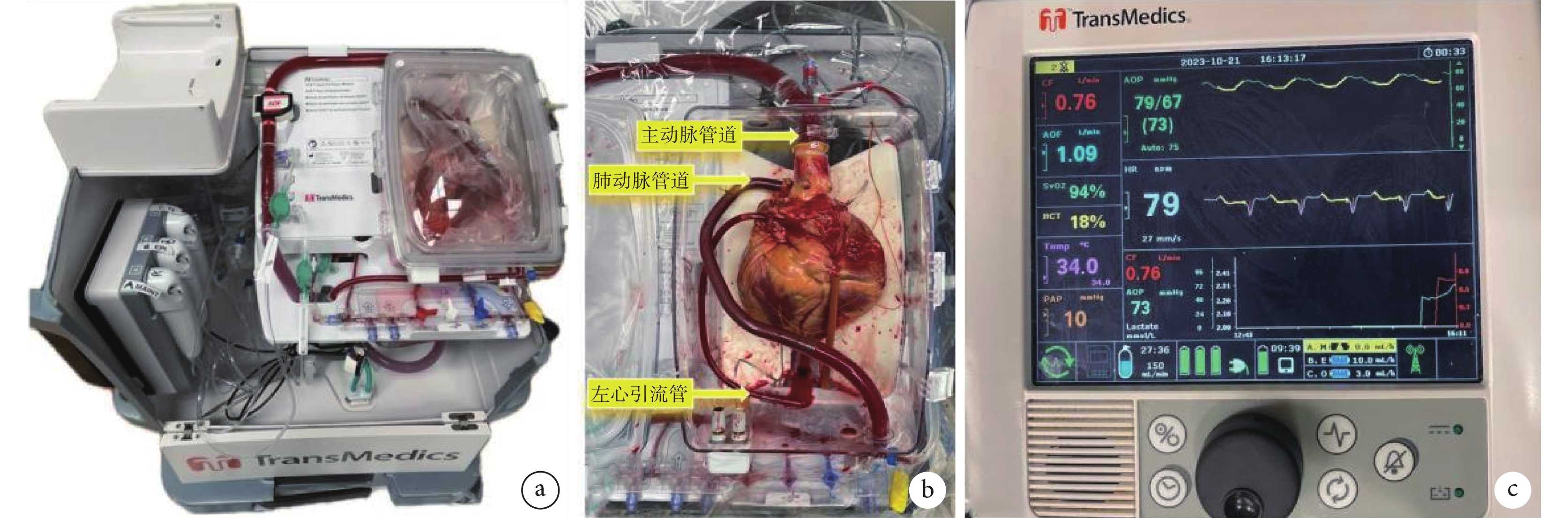 圖3
TransMedics OCS實物圖
圖3
TransMedics OCS實物圖
a:心臟已置于心臟座艙,無線監控器被移除;b:心臟在座艙內已連接于TransMedics OCS進行灌注;c:TransMedics OCS心臟灌注系統的無線監控器;OCS:器官護理系統
TransMedics OCS的應用推動了DCD心臟移植的發展,允許在供體停止循環一段時間后優化心臟內環境并評估心臟的適用性[24]。不僅如此,不論對DBD或DCD供心,該技術的顯著優勢包括:縮短冷缺血時間以提高移植成功率、對擴展標準供心進行評估、延長供心離體的安全時限、擴大供體庫。筆者的1個病例,供體醫院距離受體醫院超過
盡管TransMedics OCS心臟移植病例在美國增長迅速,但也存在一些問題。比如其設備成本高昂(每次約需
2.3 胸腹常溫區域灌注技術
TA-NRP是一種復蘇DCD供心和評估供心活力的技術。不同于TransMedics OCS為代表的DP-MP技術,TA-NRP可實現在體內復蘇心臟,并在生理條件下進行評估,是DP-MP的有效替代方法。
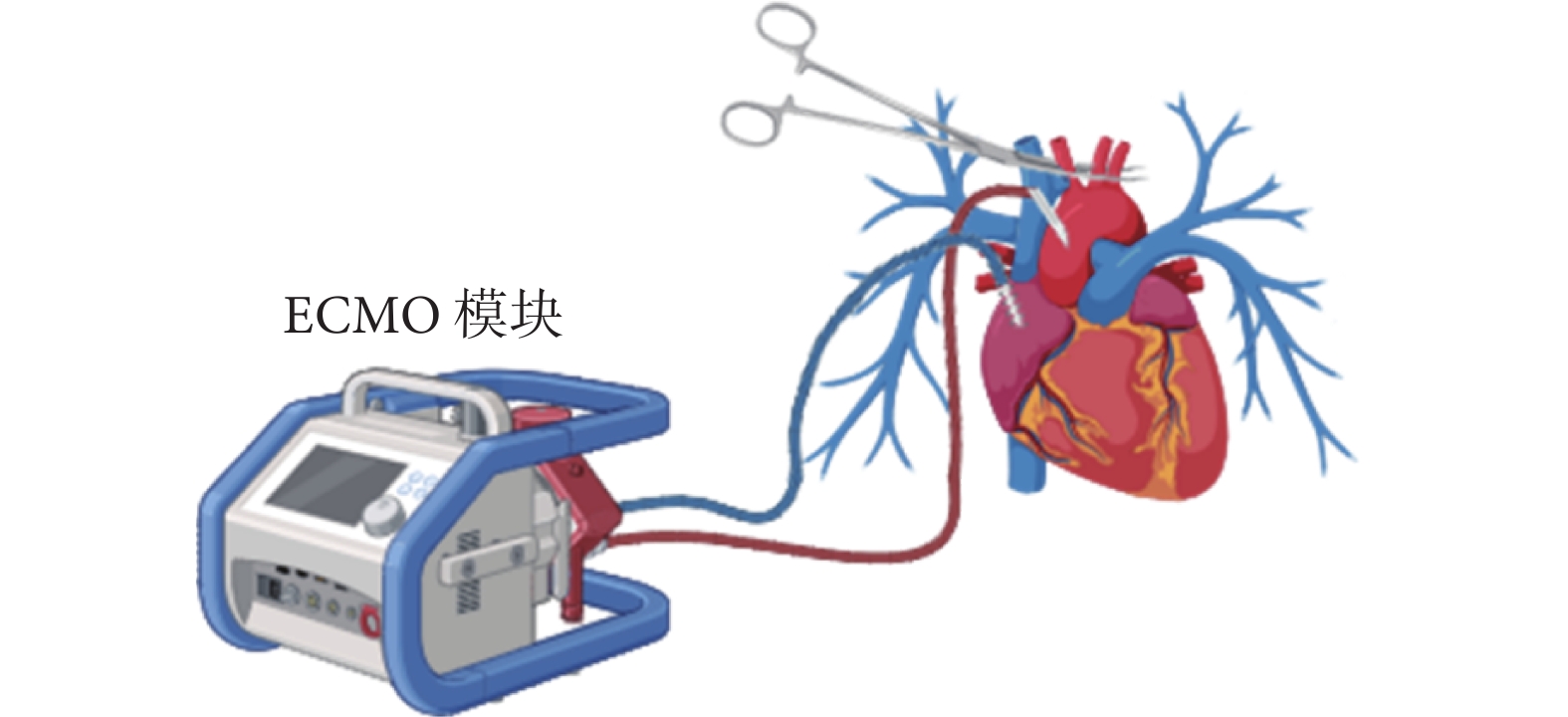
TA-NRP的外科手術方法在細節上因醫療機構而異,但基本步驟相同[30]。在DCD供體被二次宣布死亡后,外科團隊迅速開胸并打開心包,進行右心房插管引流靜脈血并排空心臟。之后阻斷全部主動脈弓部血管防止大腦再次供血,升主動脈插管后連接靜脈-動脈體外膜肺氧合(veno-arterial ECMO,VA-ECMO)建立體外循環,恢復全身除大腦以外的常溫有氧血液灌注;見圖4。可在弓部血管阻閉鉗遠端的無名動脈插管引流,以進一步排空大腦血供;也可在肺動脈主干插管引流以減輕左心負荷。建立VA-ECMO后,進行氣管插管并連接呼吸機,恢復供體的肺部通氣。TA-NRP的起始目標流量通常設定為5 L/min。若發生心室顫動,可進行體內除顫。心臟通常在恢復灌注后不久即可恢復竇性心律,隨后進入并行循環階段。此階段,可糾正供體內環境紊亂及酸堿失衡,適當使用血管收縮藥物以維持平均動脈血壓>60 mm Hg。根據心臟功能恢復情況,TA-NRP一般持續30~60 min,供體脫機后評估心臟獨立工作的功能。有些醫療機構通過Swan-Ganz導管和食管超聲進行評估,而有些則完全依賴于外科醫生的視覺和觸覺評估。若供心被認為適合使用,將灌注冷心肌保護液以停止心臟跳動,隨后的心臟獲取流程與DBD心臟獲取相同。心臟切取后,可以使用傳統SCS技術保存心臟,但越來越多的醫生選擇使用SCTS。
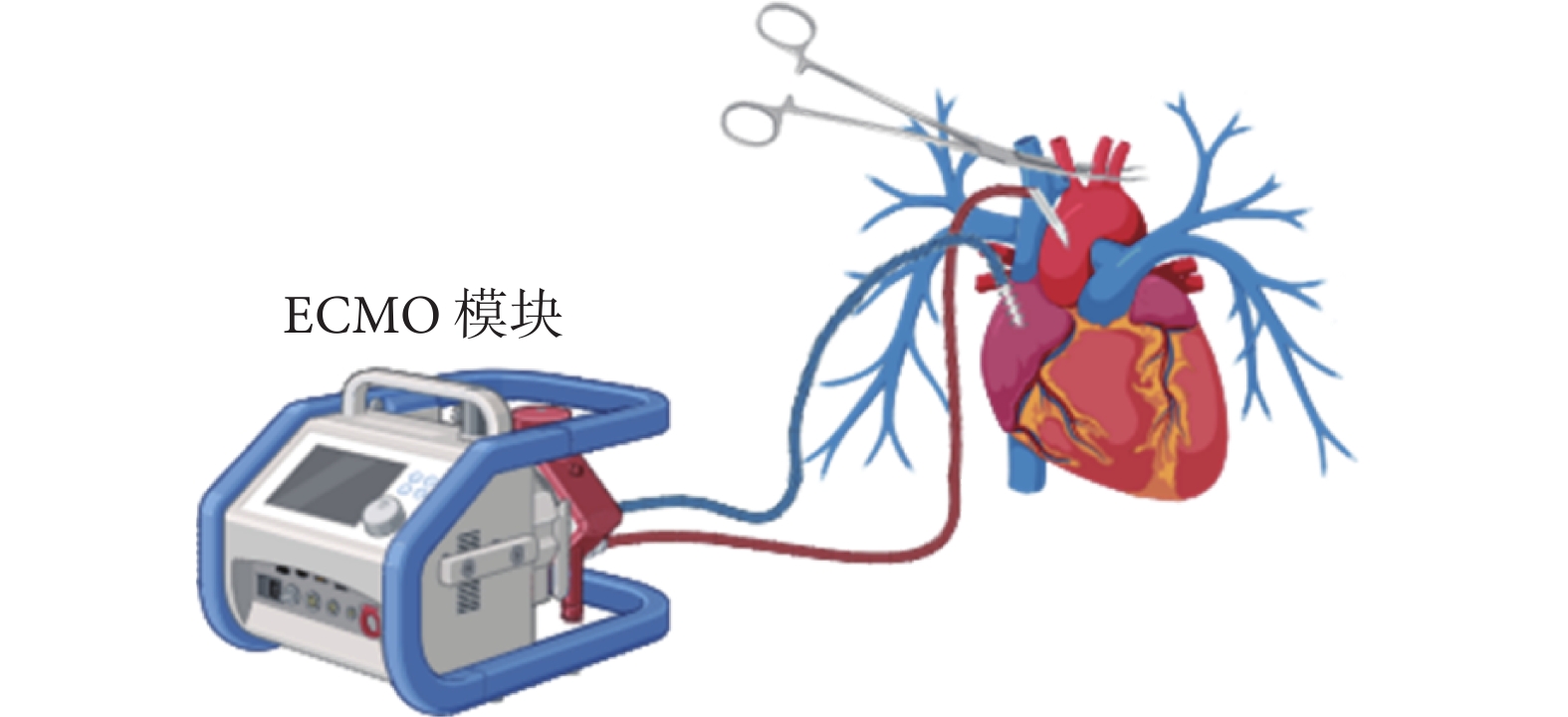 圖4
胸腹常溫區域灌注技術工作模式圖
圖4
胸腹常溫區域灌注技術工作模式圖
ECMO:體外膜肺氧合
TA-NRP技術與以TransMedics OCS為代表的DP-MP技術相比,可顯著縮短從供體循環停止到供心復跳之間的缺血時間,可實現心臟在生理條件下的功能評估,且經濟成本也更低[20,31]。Urban等[28]分析了內布拉斯加大學醫學中心進行DCD心臟獲取的成本和效益,結果顯示,TA-NRP獲取每顆心臟的直接成本為
2.4 控制低溫保存技術—SherpaPak心臟運輸系統
自1967年世界第1例心臟移植開始,在過去50余年中傳統SCS是最為廣泛采用的供心保存技術[29]。SCS將供心置于充滿冷心肌保護液的無菌容器后,在容器周圍覆蓋冰屑。SCS的優點是簡便、經濟,但缺點是快速、不均勻降溫,存在不可預測的溫度波動,以及冰與心肌之間可能發生近距離或直接接觸的風險[35]。心臟在低于2℃時會引起蛋白質變性、細胞損傷、舒張功能不可逆抑制以及心臟傳導系統損害,從而可能導致移植物失敗的風險[36]。供心在較高溫度(>12℃)中,代謝氧需求增加[37]。因此,國際心肺移植學會(International Society for Heart and Lung Transplantation,ISHLT)的指南[38]推薦在運輸過程中將供心溫度維持在4~8℃,但這一溫度范圍通過傳統SCS方法無法可靠地實現。而且,越來越多的供心通過TA-NRP技術獲取,這樣的供心已經歷一次缺血-再灌注損傷,心肌組織更加脆弱易損,因而對保存技術的要求更高。
2018年美國FDA批準了一種新型控制低溫心臟保存系統—SCTS(Paragonix Technologies Inc.,美國)。這是商業化的一次性使用設備,操作簡便,專門設計用于在運輸過程中將供心溫度穩定維持在4~8℃之間,最長可達40 h[37]。SherpaPak的冷卻機制采用了特殊相變材料(一種能夠儲存和釋放大量能量的物質),提供均勻冷卻,有效防止因凍結引起的心肌組織損傷[37]。使用過程中,首先通過連接器將供心的主動脈連接到內罐頂部,然后將供心完全浸沒在裝滿心肌保護液的內罐中。再將內罐放入外罐中,外罐周圍配備了冷卻包(相變材料)和保護性聚苯乙烯外殼;見圖5。該設備提供連續的實時供心溫度監控,并能通過藍牙將溫度和地理位置數據傳輸至用戶的移動電話,這些數據可通過應用程序在移植醫療團隊內部實時共享。
 圖5
SherpaPak心臟運輸系統
圖5
SherpaPak心臟運輸系統
a:SherpaPak結構示意圖(引用Paragonix公開資料,https://www.paragonixtechnologies.com/sherpapak),圖片經Paragonix Technologies Inc.授權使用;b:SherpaPak實物正面觀;c:SherpaPak實物上面觀(去除上蓋);d:內罐實物,供心已置入內罐
2020年Radakovic等[39]報道了首個臨床研究結果,證實使用 SherpaPak 進行供心保存安全且無害。隨后,多項臨床研究[40-41]評估了使用 SherpaPak 進行供心保存的臨床結果,數據顯示 SherpaPak 能夠降低PGD發生率、減少起搏器的使用和術后紅細胞的用量。目前還沒有使用SherpaPak的隨機臨床試驗。GUARDIAN-Heart是一個國際多中心注冊試驗[42],比較了用SherpaPak與傳統SCS保存供心的臨床結果。從2015—2022年,共255例受體使用SherpaPak,314例受體使用SCS。兩組的基線特征相似,但SherpaPak組供體和受體的距離更長。傾向性評分匹配結果顯示,與SCS相比,SherpaPak顯著降低了嚴重PGD發生率(3.4% vs. 12.1%,P=0.005),并提高了1年生存率(96.4% vs. 88.7%,P=0.03)。在缺血時間>4 h的患者中,SherpaPak與降低嚴重PGD發生率(3.7% vs. 18.0%,P=0.01)和提高30 d生存率(100% vs. 94.0%,P=0.02)相關。盡管SherpaPak的直接設備成本(約
2.5 低溫氧合灌注技術
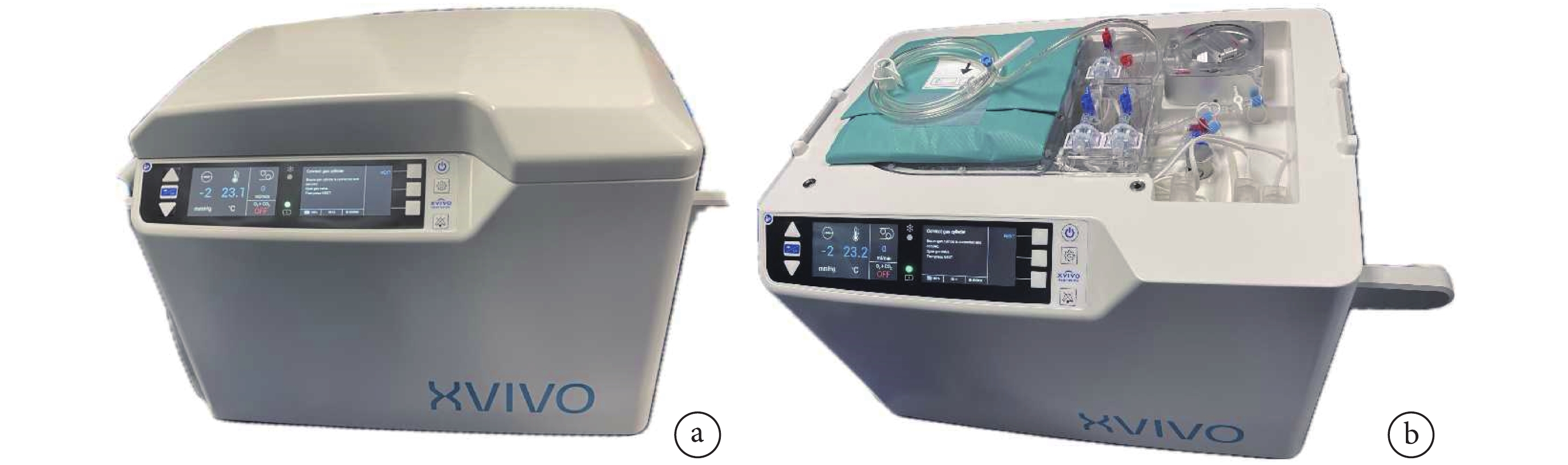
雖然與傳統SCS相比,SCTS顯著改善了心臟保存效果。但與SCS相同,SCTS仍然是一種冷缺血儲存方法。冷缺血儲存法進行心肌保護存在多種負面效應,如出現代謝底物耗盡、缺血-再灌注損傷和內皮細胞損傷,其中細胞膨脹、水腫和細胞酸中毒最為突出[44]。美國目前正在進行一項創新的低溫氧合灌注臨床試驗,該技術通過XVIVO心臟灌注系統(XVIVO Inc.,瑞典)實現,希望能進一步解決上述問題,提高供心的保護效果。XVIVO是一款便攜式設備(圖6),功能類似于小型心肺旁路機,其以低溫將心肌代謝水平降低的同時,用富氧、含血的心肌保護液對供心進行連續灌注[45]。XVIVO系統由心臟座艙、一次性灌注單元、XVIVO灌注液和灌注添加劑組成。心臟座艙的功能組件包括壓力/流量自動控制的保存系統、氣體交換系統、白細胞濾器、冷卻單元、電池和軟件。XVIVO灌注溶液是一種基于白蛋白的高滲、富含營養并添加了激素和抗生素的心肌保護液。使用XVIVO灌注溶液2.5 L和300~500 mL與心臟受體血型匹配的紅細胞進行混合,使血細胞比容達到10%~15%。供心獲取后,升主動脈插入XVIVO特制管道與血泵相連;經二尖瓣口插入左心室引流管,防止灌注過程中左心膨脹。心臟被置于儲液器中,通過升主動脈插管對冠狀動脈進行順行性灌注,灌注壓力設定為20 mm Hg,溫度為8℃,此時冠狀動脈流量通常為150~200 mL/min。整個灌注過程供心處在靜止、非跳動狀態。
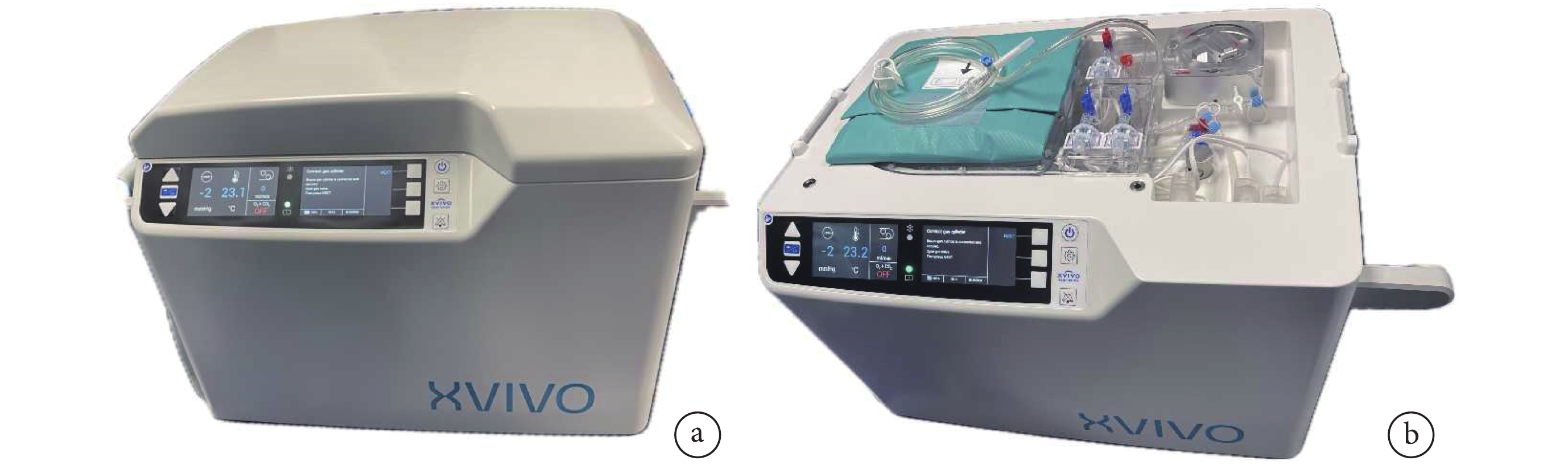 圖6
XVIVO實物圖
圖6
XVIVO實物圖
a:正面觀;b:上面觀(去除上蓋后)
臨床前研究[46]已證實,使用XVIVO系統進行24 h的心臟保存是安全的,可以很好地維持心肌的收縮力和內皮功能的完整性。一項非隨機化的二期臨床試驗[47]比較了6顆使用XVIVO灌注的供心與25顆采用SCS保存的供心,其中XVIVO組的中位保存時間為223 min,SCS組為194 min。結果顯示,XVIVO組受體在6個月時無重大事件發生率(包括PGD、7 d內需要ECMO支持或急性排斥反應超過2R)達到100%,而SCS組為72%。另一項來自大洋洲的非隨機、單臂、多中心研究[45]旨在評估低溫氧合灌注在延長供心保存時間(預計6~8 h)對30 d受體生存率及移植后供心功能的影響。該研究中,長期保存組的平均保存時間為414 min,最長達527 min。30 d內受體生存率達到100%。與ISHLT登記系統的對照組相比,即使保存時間明顯延長,30 d生存率仍顯著優于對照組。該研究表明,低溫氧合灌注技術能有效延長心臟保存時間至近9 h,有助于超遠距離獲取器官。XVIVO還被用于2022年1月7日由馬里蘭大學完成的首例豬-人異種心臟移植中的供心保存。相比于離體供心常溫機械灌注技術OCS系統,低溫氧合灌注技術在長時間保存DBD供心時具有潛在優勢[45]。常溫機械灌注技術保存供心時間越長,PGD發生率越高,這可能是由心肌水腫所致,而這一現象在XVIVO系統中并不明顯。假如TransMedics OCS設備發生故障會導致災難性供心損失,而即使XVIVO發生故障也會將保存方式從低溫氧合灌注轉換為SCS,因此在運輸過程中更加安全。此外,XVIVO在灌注過程中無需像OCS一樣進行及時且復雜的參數調整,因此使用更加簡便。由于上述優勢,低溫氧合灌注技術有良好的臨床應用前景。然而,與常溫機械灌注技術相比,低溫氧合灌注技術無法通過評估乳酸水平、血流動力學或心臟收縮力評估移植物。目前,在美國針對XVIVO的臨床試驗(PRESERVE Heart Study)正在進行,尚未廣泛使用。
2.6 擴展標準供體、心肺復蘇后供體與高風險供體的應用
擴展標準供體(extended criteria donors,ECDs)心臟,也稱為邊緣供體心臟,包括缺血時間延長、年齡較大、有冠狀動脈疾病史和LVEF降低的供心[48]。既往研究[49]認為,與使用標準供心相比,使用ECDs供心與術后并發癥發生率和死亡率增加相關。然而,由于醫療技術的發展和供心的持續短缺,使用ECDs心臟的做法正在被重新評估,在美國,越來越多的心臟移植使用了ECDs。目前的共識是針對特定受體人群,使用ECDs心臟可以提供生存獲益。研究[50]表明,使用>40歲供體的心臟與受體較差的移植后生存相關。供體年齡對受體生存的負面影響隨著年齡的增加而增加,使用>55歲供體心臟的受體生存率最差[50]。然而,對于瀕臨死亡的受體,使用年齡較大的供體心臟已被證明可以提供生存獲益[50]。一項來自斯坦福大學醫院的研究[51]表明,對于>60歲的受體,使用>50歲供體心臟的平均生存期和移植失敗率與使用年輕供心相似。總的來說,供體年齡與移植后受體生存較差有關,這很可能是由于心臟移植物血管病風險的增加。然而,這些供心仍可以考慮用于特定的候選受體。合并CAD的供體是另一大類ECDs。有研究[52]表明,似乎供心合并中度以下CAD并不影響受體生存,也沒有導致移植物血管病的加速發展。Jahanyar等[53]研究了1987—2017年的UNOS數據庫發現,接受合并(n=650,7.5%)或不合并(n=
在美國大部分供體在器官捐獻前都經歷過時間不等的心肺復蘇術(cardiopulmonary resuscitation,CPR)。盡管供體進行CPR會降低供心的接受率,但大量研究[57]數據表明CPR并不影響供心質量或受體的臨床結果。UNOS數據分析[58-59]顯示,進行過CPR的供心與未進行CPR的供心相比,心臟移植受體30 d(95.2% vs. 94.7%)、1年(88.2% vs. 87.7%)和5年(72.8% vs. 74.2%)生存率相似。雖然近期有研究[60]顯示,CPR時間>55 min可能預示著心臟移植后生存率較差,但此結論仍值得商榷[61]。目前的共識為全面心臟超聲心動圖評估是決定是否接受供心的最關鍵因素。CPR持續時間是一個考慮因素,但不應是決定性因素。ISHLT指南[62]建議即使供體CPR時間>30 min,如果超聲心動圖顯示心臟功能和血流動力學滿意,則不會對移植后受體的生存或結果產生負面影響。該指南強調了進行CPR后供心的全面評估,而非嚴格的CPR持續時間。CPR持續時間是否能獨立預測受體的不良結果仍需要更深入的研究。
高風險器官供體是指對受體傳播感染病風險高的供體。隨著人類免疫缺陷病毒和丙型肝炎病毒(hepatitis C virus,HCV)治療的最新進展,使用高風險供體器官的情況有所增加。多項研究[63-64]顯示,使用高風險供體心臟和標準風險供體心臟,受體在心臟移植后1年(84.3% vs. 83%)和5年(71.2% vs. 65.5%)的生存率相似。以HCV供體為例,2006年接受HCV陽性供體心臟的受體1年、5年和10年死亡率是非HCV供心受體的2倍多[65]。受體死因通常是肝病和移植物血管病。當時,干擾素和利巴韋林是治療HCV感染的唯一療法。2014年推出了新一代抗病毒藥物治療方案,對多種HCV基因型的抗病毒效能更高,副作用更小,可使90%~95%的HCV患者達到無病毒血癥[66]。鑒于此,越來越多美國移植機構開始使用HCV陽性供體的實體器官。2016年僅有7個心臟移植機構使用HCV陽性供體,但到2019年迅速增加到57個[67]。HCV陽性的心臟供體從2016年的0.6%增加至2019年的11.45%[67]。心臟移植候選受體同意接受HCV陽性供體的比例從2016年前的<20%增加至2018年的接近40%[68]。根據UNOS數據,2021—2023年每年獲取自HCV陽性供體的供心分別是:387例、420例、458例(
近期美國在供心來源方面另一個重大突破是將基因編輯豬心應用于臨床。2022年1月,馬里蘭大學的Griffith 醫師團隊完成了世界首例 10 基因編輯豬到人的心臟移植手術[70],該團隊在2023年9月進行了第2例豬-人異種心臟移植手術。但是2例手術的受體都沒有長期存活。死亡原因復雜,可能與病毒血癥、抗體介導的免疫排斥反應與缺血-再灌注損傷有關[71-72]。因該技術距離廣泛臨床應用尚有很大的距離,所以本文不再詳述。但這是未來心臟移植發展的重要方向,可能從根本上解決供體短缺的問題。綜上所述,近10年心臟供體捐獻、復蘇與保存技術的進展巨大,可根據供體是DBD還是DCD、受體與供體之間的距離/預期供心缺血時間、供體年齡、供心狀況、受體手術的復雜性、經濟成本以及外科器官獲取團隊的經驗等因素,選擇不同的技術路徑實現最佳的移植臨床效果;見圖7。DCD、ECDs、CPR供體、高風險供體、異種供體的應用是美國心臟移植領域最顯著的臨床進展。
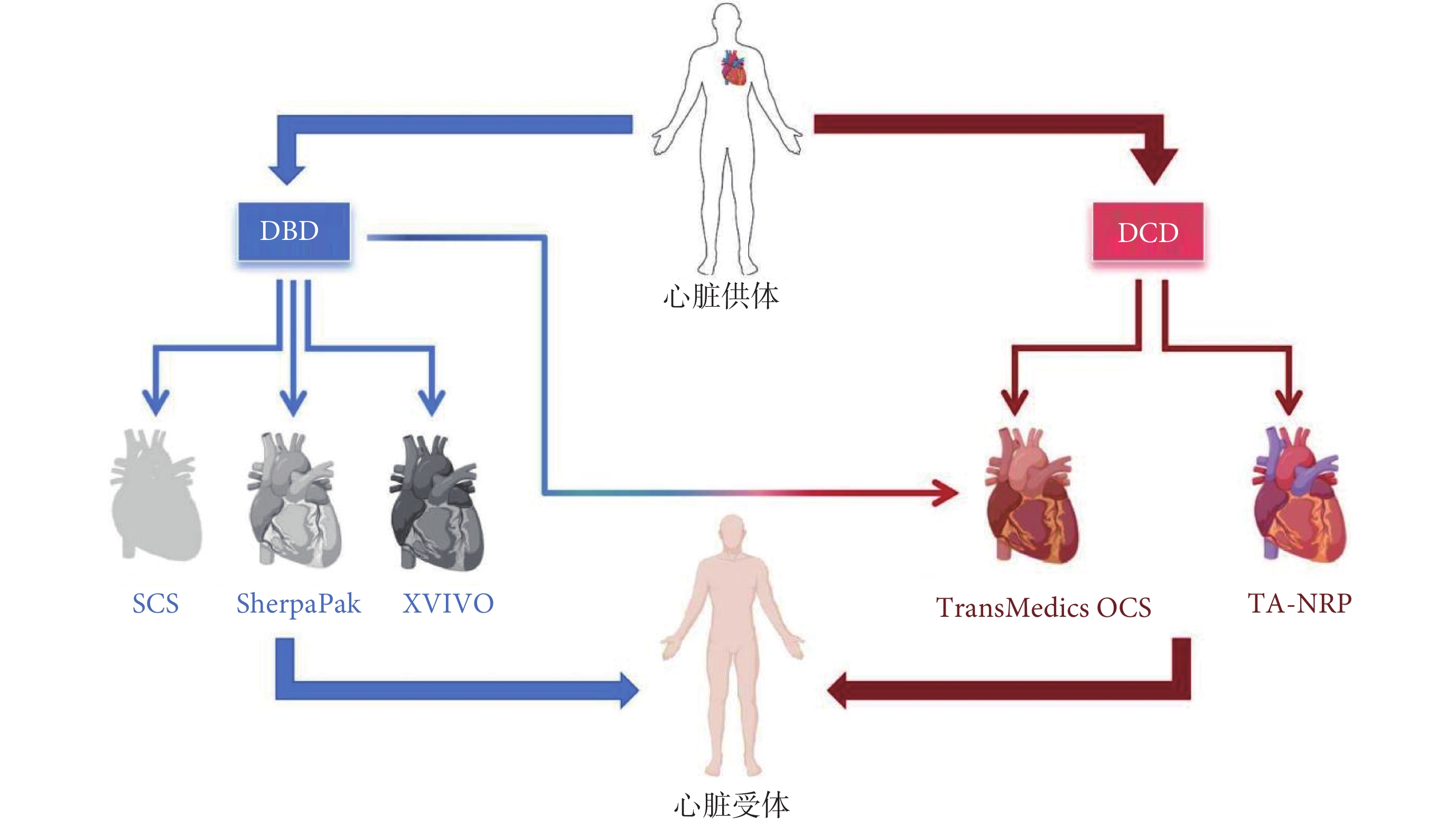 圖7
移植心臟從供體到受體的常見技術路徑
圖7
移植心臟從供體到受體的常見技術路徑
DBD供心儲存技術有SCS、SherpaPak,部分預計缺血時間長或需要進一步評估功能的擴展標準供心也可以使用TransMedics OCS。DBD供心使用XVIVO的臨床試驗正在進行;對于DCD供心的復蘇技術有TransMedics OCS或TA-NRP,使用TA-NRP后需采用SCS或SherpaPak轉運供心;DBD:腦死亡后捐獻;SCS:靜態低溫保存;OCS:器官護理系統;DCD:循環死亡后捐獻;TA-NRP:胸腹常溫區域灌注
3 心臟移植外科技術與受體圍手術期管理的現狀與進展
3.1 不停跳心臟移植技術
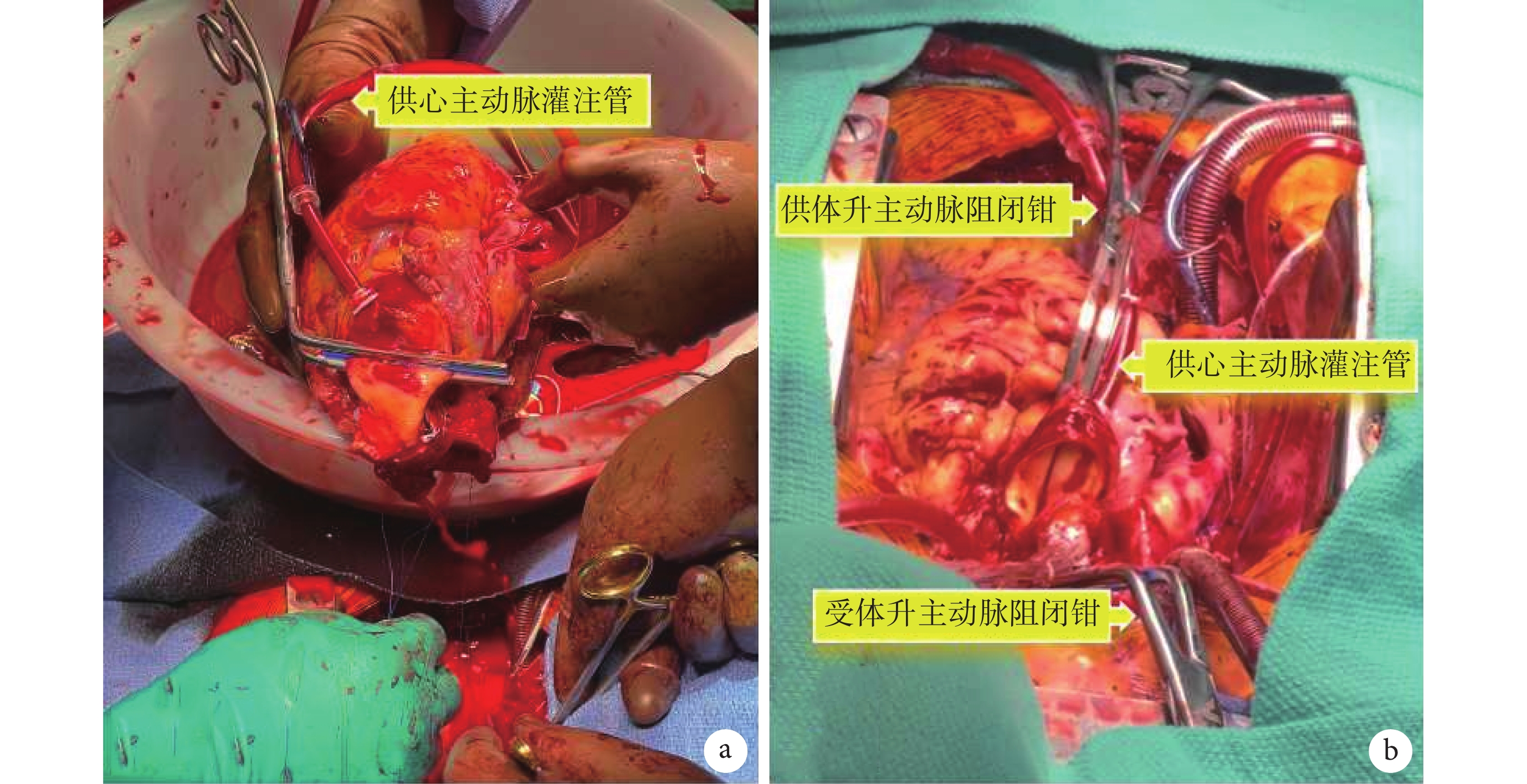
近年,使用離體供心常溫機械灌注TransMedics OCS的心臟移植病例在美國增長迅速。經典的手術方法需要對心臟進行二次停跳。第1次心臟停搏發生在供心獲取時,當供心安裝入OCS開始溫血灌注后心臟復跳。第2次心臟停搏發生在受體手術室。首先給OCS中的供心降溫,在主動脈根部灌注冷心肌保護液使供心停跳,之后將供心移出OCS用于移植。當供心左心房與主動脈吻合入受體后開放升主動脈阻閉鉗,供心恢復灌注后逐步復跳。因此,這樣的方法造成了供心產生兩次缺血-再灌注損傷。2022年10月斯坦福大學醫院心胸外科團隊啟動了一項新技術策略,即針對OCS病例在不進行第二次心臟停搏的情況下進行心臟跳動下的移植[73]。以避免心臟獲取后額外的缺血時間,減少潛在的缺血-再灌注損傷。
不停跳心臟移植技術在供心獲取、復蘇與評估等環節與常規OCS病例基本相同,可應用于DCD或DBD病例,唯一需要注意的是,需預留較長的供體升主動脈以便后續操作。在供心植入環節,需將1根額外的管道連接入受體的體外循環機,用以將氧合血液灌注于供心主動脈根部。當供心抵達受體手術室,受體準備就緒后,將供心在OCS座艙中旋轉180°,恢復到左心房在后的解剖位置。供心主動脈根部插入“心肌保護液灌注管”并通過管道連接體外循環機。之后放置雙極心外膜臨時起搏導線,進行心臟起搏(90次/min)。通過體外循環機逐步向供心主動脈根部灌注氧合血液,并減少OCS對主動脈的灌注流量。當OCS停止灌注后,在“心肌保護液灌注管”遠端放置升主動脈阻閉鉗。此時可將供心從OCS內移出,放入特制容器內以便血液回收入體外循環系統。此時主動脈根部的灌注氧合血流量一般為250~300 mL/min,溫度為34℃。外科醫師在心臟跳動下完成左心房與主動脈吻合;見圖8。之后可移除升主動脈阻閉鉗,后續步驟與常規心臟移植術相同[74]。對于DCD供心采用不停跳心臟移植技術,熱缺血只發生在供體收縮壓<50 mm Hg到灌注心肌保護液之間,冷缺血僅發生在灌注心肌保護液后到供心裝入OCS恢復溫血灌注期間。此后供心不間斷地接受氧合溫血灌注,持續跳動,顯著縮短缺血時間,理論上可產生更好的心肌保護效果。
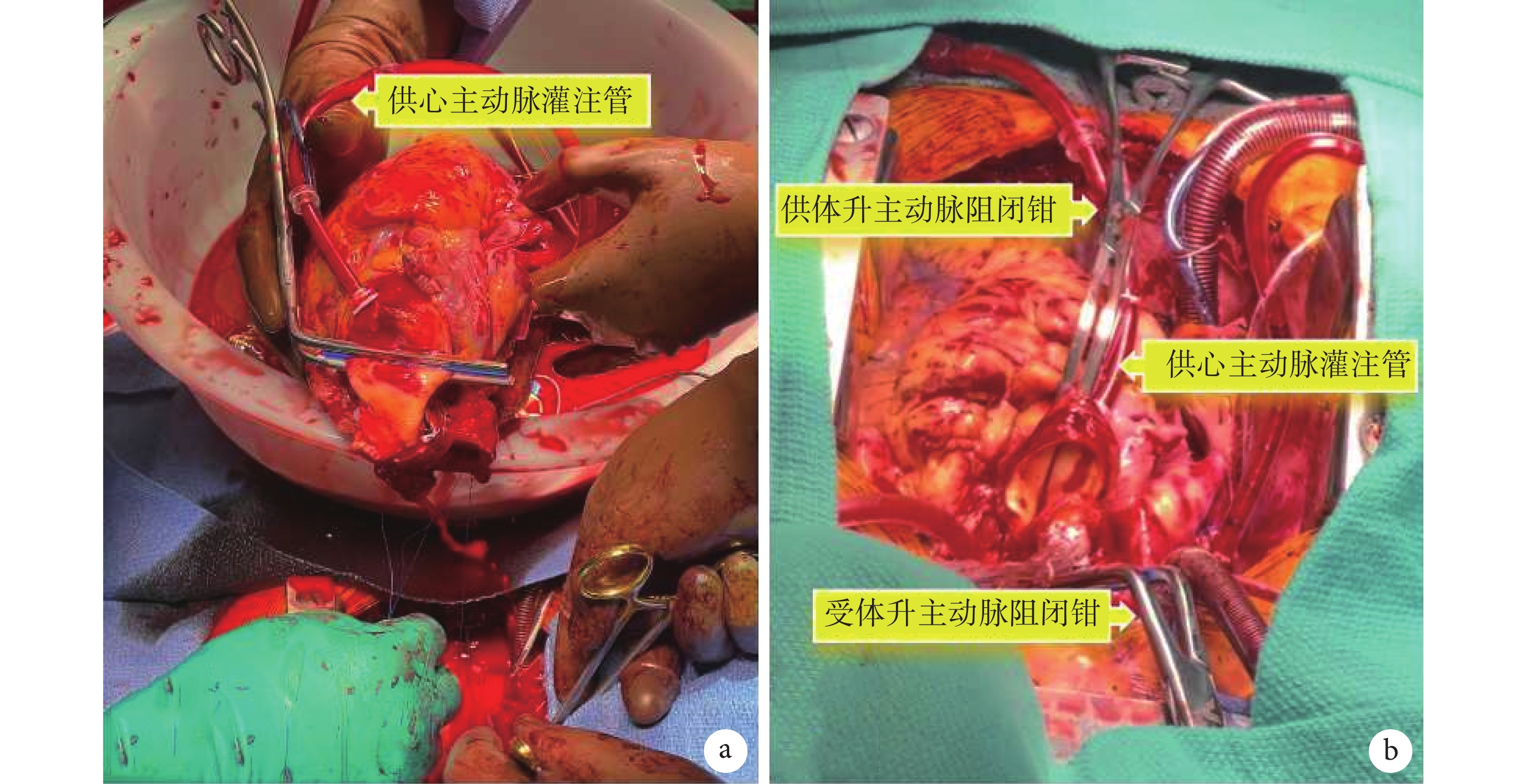 圖8
不停跳心臟移植術中圖
圖8
不停跳心臟移植術中圖
a:外科醫師在進行左心房吻合,心臟尚未放入胸腔中,應用阻閉鉗夾閉供體升主動脈遠端,通過升主動脈近端的灌注管持續向供心灌注氧合溫血,維持供心跳動;b:升主動脈吻合,完成升主動脈吻合并排氣后,可移除供體與受體的兩把升主動脈阻閉鉗。后續手術操作與常規心臟移植相同
斯坦福團隊[75]報道了早期10例不停跳心臟移植的初步臨床數據,早期療效滿意。全組為DCD病例,供心平均熱缺血時間20.9 min,平均冷缺血時間40.4 min,平均OCS機器灌注時間355 min。10例受體全部存活,無受體術后需使用ECMO、主動脈內球囊反搏(intra-aortic balloon pump,IABP)或右心室輔助裝置,無受體出現急性排斥反應;中位隨訪時間97.5(14.0,293.0)d,患者均恢復良好。但由于該技術的新穎性,目前病例數仍較少,僅在美國幾個較大的心臟移植中心逐步推廣使用。因此該技術是否會顯著提高心臟移植療效目前尚不清楚,需繼續進行深入的臨床與基礎研究證實[76]。
3.2 部分心臟移植技術
部分心臟移植(partial heart transplantation)是指僅移植部分供體心臟的手術技術,實質上是一種活體同種移植物手術,可實施主動脈根部替換術、二尖瓣瓣葉片補片植入術等[77]。
部分心臟移植技術最初設計是為嬰幼兒與兒童提供可生長的心臟移植物,特別是位于心室流出道的瓣膜。傳統上適合嬰幼兒與兒童瓣膜置換的小型植入物是來自尸體的同種移植物。同種移植物瓣膜儲存在?135℃以下,雖保留了瓣膜的細胞外基質,但未采取任何措施來維持瓣膜細胞的活力。因此同種移植物在移植后即使可能保留少量的供體活細胞,但這些細胞高度異常,無法參與瓣膜的生物功能。這造成同種移植物無法生長或自我修復,隨著患兒的成長,同種移植物仍然會衰敗[78]。使用自體心包的Ozaki手術也存在相似的問題[79]。Ross手術利用自體肺動脈瓣移植,保留了瓣膜細胞活力,使得瓣膜在主動脈瓣位能夠生長和自我修復。然而Ross手術也有一些缺點:首先,只有在肺動脈瓣膜功能正常的情況下Ross手術才可行;其次,Ross手術需要在肺動脈瓣位置使用同種移植物瓣膜替換,而該植入物無法生長或自我修復;第三,Ross手術將肺動脈瓣置于主動脈系統壓力下,導致一些患者晚期自體移植物發生擴張與反流。為解決以上問題,美國心臟外科醫師首先設計并實施部分心臟移植手術,即僅移植供體心臟中的瓣膜部分,而保留受體的自身心肌組織。與傳統的同種移植物不同,這種活體同種移植物的細胞活性得以維持,可以生長與自我修復,實現減少抗凝強度甚至無需抗凝,在兒童心臟外科領域逐步開展后已顯示出良好的早期療效[77-78]。而且,該技術在成人心臟外科領域也有一定的應用場景,特別是對于那些抗凝治療存在問題的年輕患者有潛在的應用價值,如有妊娠需求的女性、有出血障礙的患者以及生活方式活躍的患者[80-81]。
從外科技術上講,部分心臟移植的供心獲取與常規心臟移植相同。比如計劃移植主動脈根部,在心臟切取后轉運至受體手術室,繼續解剖并切取供心主動脈根部,植入技術與McGiffin和Kirklin描述的經典主動脈同種移植物技術相同[82]。但與Ross手術使用自體肺動脈瓣不同,由于部分心臟移植使用的是活體組織,因此不需要使用人工血管對主動脈根部進行加固[81]。部分心臟移植與常規心臟移植相同,術前需要進行供體與受體間的組織配型,術后需要接受免疫抑制治療,這是該技術的一個潛在缺點。但由于心臟瓣膜具有免疫“特惠性”[83],所以部分心臟移植術后可能并不需要與常規原位心臟移植同樣強度和時間的免疫抑制治療,僅需要低強度和短期的免疫抑制。部分心臟移植技術具有顯著的潛在優勢,如移植物具有活性、可自我修復、術后無需抗凝、耐久性好、血流動力學好等。而且,心臟瓣膜可耐受長達48 h的缺血[84],這極大地擴展了供體獲取的地域范圍。特別是由于功能不全或CAD等原因,大量供體的心臟被舍棄使用,但多數被舍棄心臟的瓣膜形態與功能仍然正常。如果部分心臟移植技術得以推廣,那將有可能積極利用這一部分供心,在供體嚴重短缺的情況下顯著提高供體的利用率[77]。此外,應用部分心臟移植技術還可以實現“多米諾骨牌”移植。比如患者A因擴張性心肌病需要進行心臟移植,但其主動脈瓣結構與功能正常。患者B是20歲女性,患有主動脈瓣狹窄,且2~3年內有妊娠需求。在A的心臟移植手術中,切除病變心臟接受心臟移植同時,A病變心臟的主動脈根部可被解剖、切取,移植給患者B。這樣的做法可最大限度使更多的患者受益。
部分心臟移植技術作為一項新技術目前開展例數仍然有限,且主要是嬰幼兒與兒童病例。其仍有很多問題需要繼續研究,如部分心臟移植物的保存方法、術后最優的免疫抑制方案、其長期療效如何等。但該技術由于其特有的優勢,因此不論在兒童還是成人心臟外科領域均有其特定的應用場景,值得心臟外科醫師進一步關注與研究。
3.3 心臟與其他器官聯合移植
心臟與其他器官的聯合移植例數較多的是心肺聯合移植、心肝聯合移植與心腎聯合移植;見表2。
針對終末期心肺功能衰竭患者,雖然已經開發了多種治療方法,但心肺聯合移植仍然是最終解決方案。世界第1例成功的心肺聯合移植于1981年在斯坦福大學醫院完成,受體是1例原發性肺動脈高壓末期45歲女性患者[85]。由于雙肺移植正逐漸取代心肺聯合移植的角色,尤其對于終末期肺病和右心室衰竭患者,因此心肺聯合移植的病例數量并未有顯著增加。近年全美心肺聯合移植的數量維持在每年50例左右,術后1年生存率約為66%[86]。研究[86]顯示,供體年齡較大、較早的移植年份、受體為男性、受體肌酐水平、受體糖尿病史、移植時受體使用ECMO支持以及醫療機構移植手術量是受體預后的顯著影響因素;供體年齡較大、受體為男性、較早的移植年份、受體使用ECMO支持以及在移植手術量較少的醫療機構進行心肺聯合移植是受體死亡或再移植的獨立預測因素。斯坦福大學醫院作為全美頂尖移植醫療機構,1981—2022年間共完成271例心肺聯合移植病例。2001年以后在斯坦福大學醫院實施的心肺聯合移植患者,術后30 d生存率達97%,1年生存率達89%,10年生存率達53%[87],療效滿意。
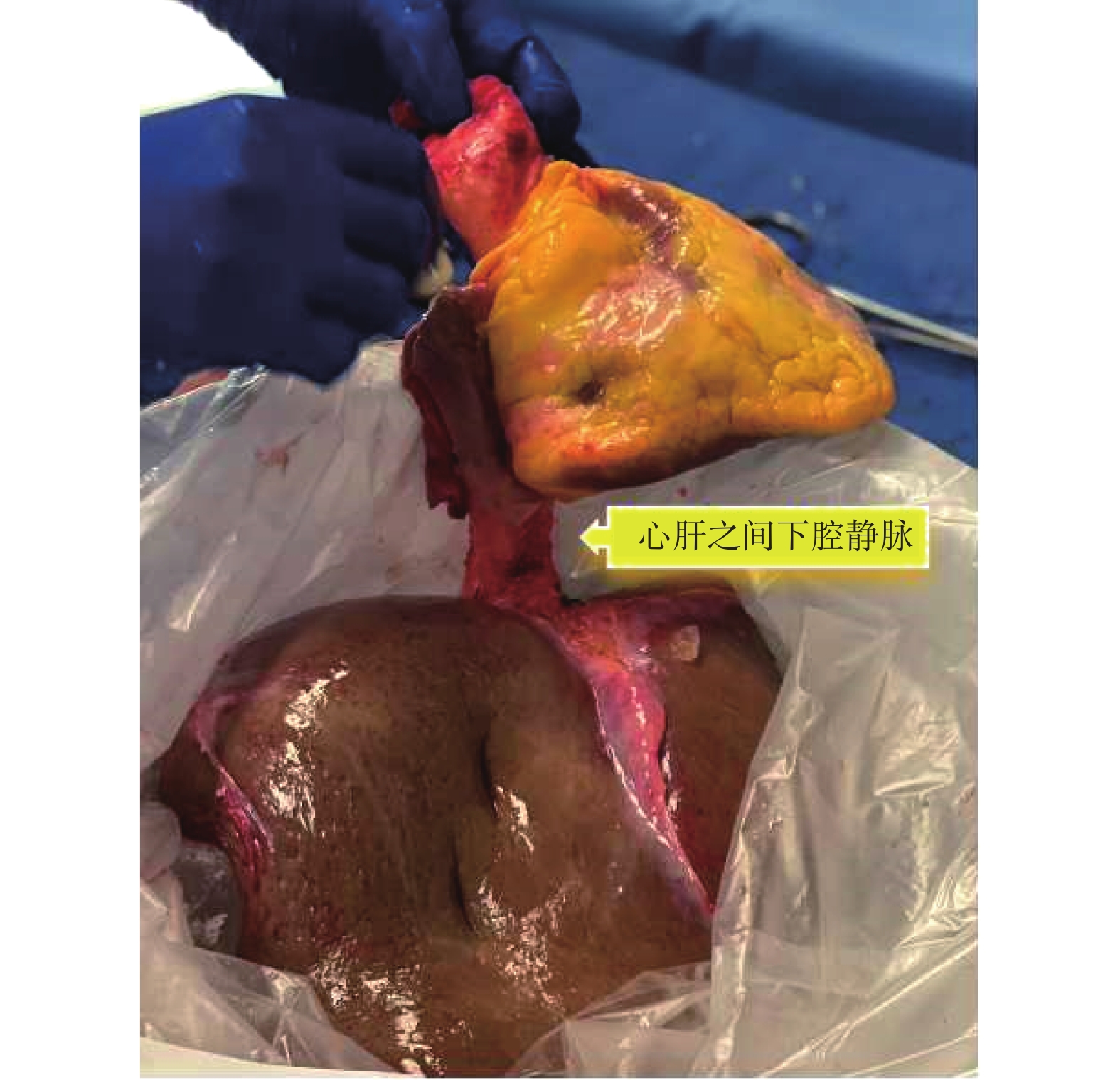
成人接受心肝聯合移植的病因學,除家族性淀粉樣變性、家族性高膽固醇血癥等以外,很多患者是早年因患先天性心臟病接受Fontan手術,隨著時間推移發生了Fontan循環衰竭以及終末期Fontan相關肝病(Fontan-associated liver disease,FALD)[88]。關于Fontan術后患者選擇單獨的心臟移植還是心肝聯合移植,美國移植學會建議:對于FALD出現肝功能衰竭或纖維化跡象且肝臟結節明顯的患者,應強烈考慮進行心肝聯合移植[89]。由于心肝聯合移植病例并不常見,目前尚未建立統一的手術方法。各機構有不同的手術方式,如順序移植與整塊移植等。Starzl醫生團隊在匹茲堡進行的首例手術是從中線開腹,完全松解肝臟之后進行胸部手術,全程使用體外循環。首先完成心臟移植,隨后進行肝切除術,通過血泵氧合器轉流門靜脈血流。肝臟通過腔靜脈中段插入術進行移植,膽管通過T形管進行重建,整個手術耗時15 h[90]。南加州大學Keck醫學中心通常先完成心臟移植,之后進行超聲心動圖檢查,確保血流動力學穩定,盡可能止血,并中和肝素。胸腔暫時不閉合,以備需要重新啟動體外循環。肝臟團隊隨后采用背馱式肝移植[91]。斯坦福大學醫院采用的整塊心肝聯合移植方法,要求供體器官獲取中保持下腔靜脈的完整性,供心連同下腔靜脈和供肝整塊取出;見圖9[92]。移植手術時首先切除病肝,在肝切除術快完成時,心臟團隊開始解剖心臟,患者置于體外循環狀態下,整塊切除心臟和肝臟。心臟的吻合與肝下腔靜脈吻合同時進行。然后夾住門靜脈轉流插管,完成門靜脈系統和肝動脈的吻合,之后恢復器官灌注。整塊移植技術的優點有:手術過程中相對穩定的血流動力學、單次再灌注事件、縮短吻合口和肝臟缺血時間[93]。然而,這種方法的缺點是心臟缺血時間延長,并且需要兩支手術團隊同時工作。心肝聯合移植的優勢在于肝臟的免疫保護作用,移植心臟的急性排斥反應與移植物血管病的發生風險均較低[94]。因此接受心肝聯合移植的患者可能僅需要較低強度的免疫抑制治療[95]。一項納入99例患者的Meta分析[96]結果顯示,心肝聯合移植術后1年和5年生存率分別為87.5%和84.3%。
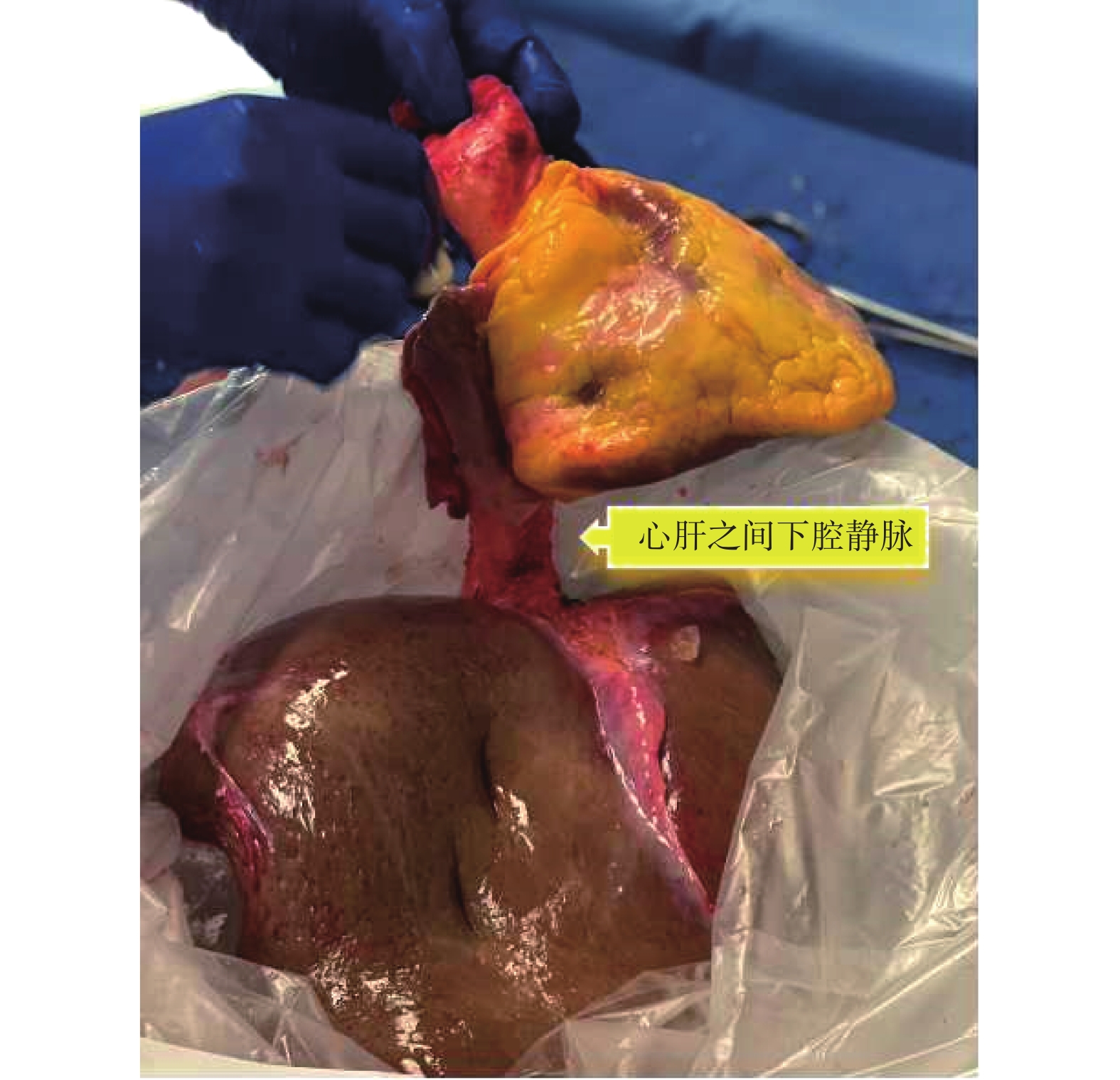 圖9
整塊取出的供心和供肝的術中圖
圖9
整塊取出的供心和供肝的術中圖
近年來,美國心腎聯合移植的例數持續上升,2001—2021年病例數量增加了近14倍[97]。心腎聯合移植數量持續大幅增加的原因可能是多方面的,主要包括:心衰和腎功能不全的合并癥患病率增加、2018年UNOS分配政策改革后優先考慮急重癥患者,以及接受者群體的擴大等[97]。進行心腎聯合移植主要是由于擔心單純心臟移植后發生腎功能衰竭的不良后果。2016年ISHLT建議腎小球濾過率估算值(estimated glomerular filtration rate,eGFR)<30 mL/(min·1.73 m2)為不可逆的腎功能不全,是心臟移植的相對禁忌證[98]。心胸外科和腎移植專家2019年在波士頓達成了共識:心臟移植候選人如果eGFR<30 mL/(min·1.73 m2)應考慮進行心腎聯合移植,eGFR在30~44 mL/(min·1.73 m2)之間且有慢性腎病證據(如蛋白尿或腎臟體積減小)的患者也應考慮心腎聯合移植,而eGFR>45 mL/(min·1.73 m2)的患者不適合進行心腎聯合移植[99]。心腎聯合移植手術規劃中主要考慮因素是腎移植的時機。手術可一站式進行,即在心臟移植后立即植入腎臟;或分站式進行,即在心臟移植一段時間后進行腎移植手術。目前認為分站式移植可能是更優的方法,其優點是腎移植前血流動力學穩定,可避免心臟移植期間體外循環的炎癥級聯反應與血管收縮藥物對腎移植物產生負面影響[100]。一般腎移植在心臟移植后24~48 h進行。一項研究[101]分析了7例分站式心腎移植患者臨床數據,結果顯示本組病例的平均腎臟冷缺血時間為53 h,最長腎臟冷缺血時間為69 h,這種分站移植對腎功能無顯著負面影響。一項基于分析UNOS數據的研究[97]表明,心腎聯合移植術后1年存活率從2001—2006年的86.7%提高至2017—2021年的89.0%;術后死亡預測因素包括較高的總膽紅素水平、較高的肺動脈壓、較長的心臟缺血時間和移植前患者需要機械通氣。Agarwal等[102]發現,UNOS數據庫中所有心腎聯合移植和單純心臟移植患者的中位長期存活率相似(12.4年vs. 11.3年,P=0.053),其中eGFR<45 mL/(min·1.73 m2)的患者(13年vs. 10.2年,P<0.001)以及移植前需要透析的患者(12.4年vs. 9.9年,P<0.01)可從心腎聯合移植中獲得更顯著的生存獲益。
3.4 心臟移植術后原發性移植物功能障礙
PGD是心臟移植術后患者30 d內死亡的主要原因[103]。2014年ISHLT共識工作組制定了PGD的標準化定義和分類[104]。定義PGD為發生在心臟移植后的前24 h內,不是由超急性排斥反應、肺動脈高壓或手術出血等原因造成的心臟移植物功能障礙。嚴重PGD診斷標準為需要MCS治療,如ECMO;輕度至中度PGD通過超聲心動圖標準識別,血流動力學惡化需要高劑量正性肌力藥物或IABP支持[104]。在過去10年中這一診斷標準被廣泛采用,提高了PGD研究和臨床管理質量。然而,PGD的真實本質仍然模糊,文獻[105]報道的發病率和死亡率差異較大,分別為1.0%~31%和3%~75%不等;嚴重PGD的發病率和院內死亡率分別為8%~49%和3%~65%不等。這些顯著差異突顯了PGD病因學和診斷的復雜性,以及目前對PGD的臨床管理缺乏一致標準,這些問題是近年本領域的研究與討論熱點。
首先,目前對PGD的診斷與嚴重程度的評估依賴于影像學、血流動力學和治療方式,而不是病理和病因學證據。PGD的治療主要是通過正性肌力藥物和MCS維持受體的血流動力學穩定[106]。而目前在美國對心臟移植后MCS的啟動時機與設備選擇尚無統一指南,更多是由主治醫生根據經驗決定,而PGD的診斷又依賴于MCS的使用,這就造成了PGD診斷的差異很大。其次,嚴重PGD的年發病率顯著增加,從2010年的2.0%到2020年的12.2%[107]。這種趨勢可能歸因于當前的醫療實踐,包括使用更多的DCD、ECDs心臟。此外,更多受體在移植前就應用了MCS,這些都是PGD的關鍵風險因素[107]。盡管新技術如SherpaPak和XVIVO可降低嚴重PGD發生率[35,42,45],但這些技術未能抵消嚴重PGD發病率的上升趨勢。另一個更關鍵的原因是,目前心臟移植后越來越積極地使用ECMO,因而提高了嚴重PGD的診斷率。與10年前相比,ECMO的管理技術取得巨大進步,如嚴格的抗凝管理策略、更小的灌注管以及常規使用遠端灌注導管,已顯著減少了ECMO的卒中和肢體缺血等重大并發癥,使得積極使用ECMO更為安全。考慮到ECMO可提供更廣泛的“安全”邊界,外科醫生們越來越傾向于跳過最初的IABP或高劑量正性肌力藥物,直接升級到ECMO治療。積極使用ECMO確實可顯著降低嚴重PGD的死亡率。哥倫比亞大學的研究[108]發現:早期積極植入ECMO的策略可使心臟移植后嚴重PGD的院內死亡率由28%下降到5%。然而,積極使用ECMO增加了嚴重PGD的診斷率,并可能導致過度診斷。再者,當前臨床實踐中難以尋求PGD的病因學。引起PGD的原因可能涉及炎癥反應、缺血-再灌注損傷、激肽系統的激活等因素,或多種因素的組合[109]。有研究[103]顯示,輕度或中度PGD的風險因素與嚴重PGD不同,表明其潛在病因不同。例如胺碘酮、β-腎上腺素能受體拮抗劑的使用和延長的缺血時間增加了所有PGD分類的風險;而供體死亡原因、受者糖尿病狀態與輕度至中度PGD有關,術中血液制品的使用與嚴重PGD相關。這些發現強調了PGD病因與嚴重程度之間的因果關系,突顯了尋求病因在PGD臨床管理中的重要性。有研究[110]表明:人類白細胞抗原(human leucocyte antigen,HLA)-A的特定位點估算群體反應抗體(cPRA)可預測PGD的嚴重程度,這一現象提示針對特定患者進行血漿置換或靜脈注射免疫球蛋白可降低PGD風險。最后,人工智能可在革新PGD的診斷和風險分層方面發揮重要作用。有研究人員[111]開發了一個非線性人工神經網絡模型用于評估供體、受體狀況與心臟移植后PGD發生的關系。結果顯示在
綜上所述,PGD是影響心臟移植療效的關鍵因素。然而,當前在PGD的診斷、風險分層、治療管理方案方面仍未達成共識,這可能對PGD的客觀評估造成挑戰,進而影響多中心臨床研究的可靠性和指南的制定。但隨著研究的深入與新技術的出現,該問題有望得到改善。
3.5 心臟移植圍手術期機械循環支持的應用與再次心臟移植
隨著MCS技術的進展,越來越多的終末期心衰患者在心臟移植前即接受了臨時或持久MCS治療作為移植橋梁。MCS治療的目標是提供足夠的器官灌注并減輕心室負擔。目前在美國有多種臨時MCS設備可使用;見表3。2018年UNOS改革供心分配政策后,使用臨時MCS治療的患者被分配了更高的優先級。因此移植前應用了臨時MCS的患者接受心臟移植的數量增加。2018年后,移植前使用IABP支持的患者占所有心臟移植病例的27%,使用臨時心室輔助裝置支持的占4%。使用VA-ECMO支持的占5.3%[112]。IABP是最常見的臨時MCS設備,可使心輸出量增加約0.5 L/min,并增加冠狀動脈灌注、減少心臟后負荷和降低心肌氧耗[113]。與其他臨時MCS設備相比,IABP提供的血流動力學支持較低,但其優點包括易于植入和成本低。其他臨時MCS設備之間的植入方式、血流動力學特點和血流量支持都有所不同。例如Impella 5.5(Abiomed,美國)可提供高達6.2 L/min的流量。VA-ECMO提供雙心室支持和氧合,可提供最高達10 L/min的血流量,在所有臨時MCS設備中,其可提供最強的血流動力學支持。在使用臨時MCS支持期間,患者可能面臨許多并發癥,會增加后期心臟移植的風險。如使用Impella 5.5的經驗發現,超過1/3的患者因出血需要輸血[114],這可能導致心臟移植候選人免疫致敏。然而,研究[115]發現,使用臨時MCS作為橋梁進行心臟移植的患者術后生存率滿意,與非橋接受者相似。
在美國,接近1/4的安裝了持久左心室輔助裝置(durable LVAD,dLVAD)的患者是為等待心臟移植進行的橋接治療[116]。dLVAD可為心衰患者提供有效的血流動力學支持。然而,安裝dLVAD手術導致的胸腔內組織粘連,使后續心臟移植手術面臨潛在風險。研究[117]表明,dLVAD對心臟移植后結果有負面影響,顯著增加術后早期死亡,尤其是存在腎功能不全和體重指數較高的患者。另外一個討論熱點是dLVAD后進行心臟移植的最佳時機。早期一項對468例安裝HeartMateⅡLVAD(Thoratec Corp,美國)后進行心臟移植患者的研究[118]發現,dLVAD支持時間對心臟移植后存活率無顯著影響;然而在dLVAD支持期間24 h內需要輸注超過2單位紅細胞的患者,其1年存活率顯著降低。dLVAD安裝手術對心衰患者是一次重大“打擊”,患者完全恢復后再進行心臟移植是更穩妥的選擇。目前的觀點是:如在患者完全恢復之前,或植入dLVAD不到30 d內進行心臟移植,將可能導致不良結果[119]。然而,隨著dLVAD支持時間的延長,發生dLAVD相關不良事件的可能性也會增加。因此,在dLVAD植入后9~12個月內(甚至1~3個月)進行心臟移植,可減少并發癥并改善移植后結果;另外,具有心肌恢復潛力的患者通常會在6~9個月內顯現出來,因此這時將更有助于判斷心臟移植的風險與獲益[119]。最后,許多動態的社會與心理因素也會影響dLVAD支持時間和移植候選名單的資格,這增加了探討這個問題的復雜性。總之,對于重度心衰患者,雖然dLVAD支持可以在等待心臟移植期間提高生存率,改善器官灌注與功能,但必須權衡其本身的并發癥,如感染、出血、卒中和給心臟移植手術造成的風險。因此,使用dLVAD支持的患者可能需要更謹慎地評估其心臟移植的資格。
對于心臟移植后MCS的應用,目前美國并沒有相關指南規范MCS的啟用時機與設備選擇,更多地取決于醫療組的經驗和偏好,但共識是盡量早期使用[106]。心臟移植后IABP和ECMO是最常用的設備。如前所述,近年ECMO的應用越來越積極與廣泛。VA-ECMO提供強大的雙心室支持與氧合,使其成為多數嚴重PGD患者的首選。關于ECMO的插管部位尚存在爭議。有移植機構優選中心插管的ECMO支持,除非患者在術前已經使用外周插管ECMO或在ICU床旁緊急安裝ECMO[120]。中心插管可以避免外周血管并發癥,提供滿意的循環支持、左心室卸負荷和上半身氧合,而且不增加死亡率[121]。相比之下,更多機構偏好外周插管,因為關胸后移除ECMO設備時無需重新開胸,降低了感染風險。一項來自歐洲的研究[122]顯示,外周插管可提高心臟移植后3個月和1年生存率。應用VA-ECMO時另一個值得注意的問題是左心室后負荷增加,導致左心室舒張末期壓升高,從而可能引起肺水腫。目前有多種技術可以解決這個問題[123]:(1)經皮插入左心房引流管(通過房間隔)并連接到靜脈管道;(2)通過左心房引流管(通過房間隔)直接連接到TandemHeart;(3)經皮植入左心室豬尾巴導管進行主動的左心室引流;(4)ECMELLA技術,即聯合使用VA-ECMO和Impella進行主動的左心室引流;(5)使用IABP卸載左心室后負荷,間接實現左心室引流;(6)通過經皮球囊房間隔造口術實現被動左心房引流。這些技術中,IABP最易行,應用最廣泛,但效果相對有限。結合使用ECMO和Impella的ECMELLA技術是一種更強大的雙心室支持策略,無需左心房引流即可提供充分的左心室減負荷,但其可能增加VA-ECMO的并發癥,特別是出血和溶血[124]。目前該技術的應用雖不廣泛,但正被逐步推廣。
對于已經使用MCS治療的PGD患者,如果供心最終無法恢復,則再次心臟移植手術被認為是一種選擇。UNOS數據庫顯示,2023年度美國再次心臟移植數量為123例。由于初次供心的失效,受體處于不理想的生理狀態,可能出現肺水腫、腎衰竭、肝衰竭、血管麻痹和凝血障礙,這些情況都是再次移植的巨大障礙。Iribarne等[125]利用UNOS數據研究了在初次移植后90 d內進行再移植手術。1995—2008年
3.6 人工智能在心臟移植領域的應用
近年人工智能在心臟移植領域的應用是研究熱點,研究主要集中在預測死亡率、PGD和心臟移植的結果[127]。大多數證據集中在使用機器學習(machine learning,ML)模型預測移植后死亡率和生存率。ML模型能夠識別非線性關系,并整合多種變量預測患者的結果。與傳統的回歸模型相比,ML模型具有優勢,因為其可分析復雜結構的數據,創建新的動態關系,并篩選出對特定結果影響最大的變量。傳統的線性模型確定某個事件發生的概率是基于特定變量的影響,而ML可基于多種變量輸入構建模型,并根據最有影響力的因素進行調整。
Medved等[128]建立了一個兩層神經網絡模型,用于預測患者在心臟移植等待名單上180 d、365 d和730 d后的臨床結果(仍在等待、已移植或在等待名單中死亡)。研究使用了UNOS的成人患者數據,該神經網絡模型在這3個時間點的F1分數分別為0.674、0.680和0.680,相比基線的0.271顯著提高。這意味著模型在這3個時間點上預測的準確度和靈敏度表現較為一致,且都在一個相對較高的水平。Yoon等[129]使用決策樹技術開發了一個生存模型,用于預測心臟移植后的生存。該研究使用稱為“預測樹”的預測因子簇,輸入變量包括受體、供體的臨床特征以及供體-受體的匹配屬性,如年齡、性別、既往移植、輸血、肝腎功能、呼吸機輔助、HLA不匹配和血型。該模型在3個月生存預測中的C-統計量為0.66,3年生存預測的敏感性為0.8,這提示該模型有66%的概率正確區分實際生存和未生存患者;在所有實際存活3年以上的患者中,該模型能夠正確識別出80%的患者。這個結果表明,該模型在3個月生存預測中有一定的準確性,但還有改進空間。同時,模型預測3年生存的能力較強,能夠有效識別出大多數長期生存的患者。因此,該模型在預測心臟移植患者的短期和長期生存方面都有一定的實用價值。Kampaktsis等[130]應用UNOS數據庫中
總之,在心臟移植領域中人工智能模型在預測患者臨床結果方面比傳統的線性模型更準確。人工智能模型有助于評估移植手術風險和預后,確定心臟移植的候選資格。人工智能可為臨床決策提供更有力的工具。但目前的人工智能模型仍存在偏倚風險、需要外部驗證以及實用性較低的問題,而且用于訓練模型的數據庫沒有關于免疫抑制方案的詳細數據。因此,今后我們需要更多來自不同人群的高質量、完整和準確的數據進行此方面的研究。但人工智能引領的“智慧”心臟移植一定是未來發展的方向。
近些年在心臟移植受體管理方面的進展還包括新的虛擬配型技術、術后無創免疫監測技術、新的免疫誘導、免疫調節與免疫抑制療法等。然而,這些工作主要由心臟專科醫師完成,因此不在本文討論的外科進展范圍內。心臟移植的手術技術已經相當成熟。過去10年,盡管在受體端的外科領域也取得了一些新的技術進展,然而總體不如供體端的技術革新顯著。與10年前相比,雖然目前心臟移植的術后生存率沒有顯著提升,但我們要認識到,當今醫療實踐中涵蓋了更多的危重患者,而心臟移植的療效并沒有下降,依然非常滿意,這正是技術進步帶來的效果。
4 總結與展望
近年來,美國在心臟移植的供體捐獻、外科技術、圍手術期管理等方面取得了顯著進展。在供體嚴重短缺的情況下,供體獲取和保存技術的革新以及DCD、ECDs的應用顯著擴展了供體庫,增加了移植手術量。不斷涌現出的新外科技術有望進一步改善心臟移植療效。特別是MCS和人工智能的快速發展,可能為本領域帶來革命性的變革。總之,未來心臟移植領域必然迎來更多突破,為終末期心衰患者提供更有效的治療選擇。
利益沖突:無。
作者貢獻:梁宏亮負責論文選題、設計、撰寫和修改,文獻資料的檢索、評估和篩選,圖表制作等。
目前,美國≥20歲心力衰竭(心衰)患者超過670萬例。預計到2030年,美國心衰患者占總人口的比例將從2012年的2.4%上升至3.0%,影響超過800萬名≥18歲人群[1]。1967年,Christiaan Barnard 醫生在南非成功實施了人類第1例同種異體心臟移植[2]。1968年,Norman Shumway醫生在斯坦福大學醫院完成了美國首例心臟移植[3]。經過50多年的發展,心臟移植已被公認為治療終末期心衰的最佳療法。當前,北美地區心臟移植患者的1年生存率已超過91%[4],中位生存時間超過14.8年[5]。然而,可用于移植的心臟數量仍然遠遠無法滿足終末期心衰患者的巨大需求。近年來,心臟移植領域取得了顯著的技術進步,特別是在供體捐獻技術方面的進展,顯著擴大了供心來源,使更多患者得以接受心臟移植。在受體端也涌現出一些新的外科和圍手術期管理技術,提高了心臟移植療效。本文旨在綜述美國成人心臟移植的現狀與外科方面的進展,包括循環死亡供體的應用,新的供心獲取、復蘇、評估與保存技術,移植新技術,多器官聯合移植,圍手術期機械循環和人工智能應用等外科醫師關注的領域。
1 美國心臟移植現狀概覽
根據美國器官共享聯合網絡(United Network for Organ Sharing,UNOS)提供的公開數據(
2018年UNOS對供體分配系統進行了重大改革,相較于接受持久機械循環支持(mechanical circulatory support,MCS)的候選受體,強調將供心優先分配給使用短期MCS的候選受體,因其醫療需求更迫切[9]。此次改革顯著縮短了使用體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)候選受體的等待移植時間,中位等待時間由10 d縮短至5 d,并將30 d與6個月生存率分別從76.4%和74.6%提升至94.2%和90.6%。同時,使用持久左心室輔助裝置(left ventricular assist device,LVAD)的心臟移植受體比例由41.8%下降至21.2%,在等待名單上接受LVAD的候選受體比例也從14.5%降低至10.8%。此外,對于病情更為危重的一級和二級候選受體,供心的來源范圍擴大到500英里(約805 km),以期更公平地利用心臟移植資源。此次系統改革對候選受體的等待時間、心臟獲取距離及缺血時間等方面產生了顯著影響:中位等待時間從93 d縮短至41 d;供心中位獲取距離從83英里(約134 km)增加至225英里(約410 km);供心中位缺血時間從3.0 h延長至3.5 h。盡管受體的住院時間有所延長,但出院前的急性排斥發生率基本持平(11.9% vs. 11.7%)。術后30 d、90 d和180 d的生存率在政策變更前后基本相同,消除了對于高危患者可能會惡化心臟移植結果的擔憂。
2 心臟移植供體捐獻技術的現狀與進展
2.1 循環死亡后捐獻供體心臟的應用
器官捐贈可以在患者死亡后進行,醫學和法律上的定義有兩種方式:(1)不可逆的腦功能停止;(2)永久性血液循環停止[10]。腦死亡后捐獻(donation after brain death,DBD)供體是通過反復神經學檢查確認包括腦干反射消失和腦血流缺失的捐獻者。循環死亡后捐獻(donation after circulatory death,DCD)供體則是那些具有不可逆重度神經損傷但未完全符合腦死亡標準的捐獻者,通過體檢或動脈內壓力監測確定循環停止[10]。1967年Christiaan Barnard完成的首次心臟移植手術使用了DCD捐獻者的心臟[2]。但由于對DCD供體心跳停止所導致的缺血損傷的擔憂,DCD心臟的應用被暫停,成人心臟移植長期僅采用DBD供體心臟。但為減少等待移植患者與可用心臟之間的巨大差距,2014年澳大利亞醫師開始重新采用DCD心臟移植[11]。之后,進行DCD心臟移植的醫療機構和手術案例逐步增加。美國關于DCD心臟移植的主要經驗源自器官護理系統(Organ Care System,OCS)的臨床試驗,2023年發布的試驗[12]結果顯示,DCD與DBD心臟移植的早期生存率相似。該試驗報道了180例患者的臨床結果,這些患者按3∶1的比例隨機分配到DCD心臟移植組或常規DBD心臟移植組。DCD供心使用TransMedics OCS進行離體供心機械常溫灌注(后文介紹)。DCD組受體6個月生存率為94%,DBD組為90%。DCD組嚴重原發性移植物功能障礙(primary graft dysfunction,PGD)發生率為15%,而DBD心臟組為5%。其他研究[13-16]結果也證實,使用DCD心臟的6個月生存率、并發癥發生率與傳統DBD心臟相似,為91%~95%。重要的是,應用DCD供體的醫療機構可顯著增加心臟移植數量,縮短患者等待移植的時間[17]。Madan等[16]估算DCD供體應用可使美國每年增加300例成人心臟移植。近5年美國DCD心臟使用量迅速增加,2018—2023年分別為0例、7例、107例、205例、343例、612例(數據來源于UNOS公開資料,
DCD心臟捐獻的過程通常在控制性撤除生命維持治療(withdrawal of life-sustaining therapy,WLST)后進行[10]。由與移植團隊或器官潛在受體無關的醫療專業人員做出WLST的決定,該決定必須是獨立于器官捐獻可能性的。在WLST之前3~5 min給予患者3萬單位普通肝素抗凝。在WLST過程中要給予患者完善的治療,保障患者舒適。患者循環停止(無脈搏或動脈線平坦)時首次宣告死亡。若繼續器官捐獻,設有5 min觀察期以排除自發生命跡象恢復可能,無生命體征則第二次宣告死亡。5 min觀察期足以排除自發生命逆轉可能[18]。只有第二次宣告死亡后,移植團隊才能接管供體的捐獻工作,啟動外科獲取器官程序。美國各醫療機構根據自定DCD政策執行,但遵循上述基本原則[19]。WLST可在ICU、麻醉恢復室或手術室進行,根據機構規定而異。WLST后的觀察時間窗為60~120 min不等,僅在此期內宣告死亡者可進入器官獲取流程;否則,患者將繼續接受治療,不可進行器官捐獻。
對于心臟熱缺血的標準及其容許時間窗,不同醫療機構有各自的規定[20]。例如,斯坦福大學心胸外科將WLST后收縮壓下降至50 mm Hg(1 mm Hg=0.133 kPa)視為功能性熱缺血(functional warm ischemic time,FWIT)的起始,灌注低溫心肌保護液時刻為終止,其容許的時間窗限定在≤30 min[21]。這表示,如果供體的收縮壓降至50 mm Hg后的30 min內未被宣布死亡,則必然超出了FWIT的允許時限,該供體心臟不再適用。倘若供體的收縮壓在降至50 mm Hg后反彈升高超過該值,FWIT的計時將重置,從下次收縮壓降至50 mm Hg時刻起重新計算。FWIT對器官質量有顯著的負面影響。大部分FWIT發生在宣布患者死亡前,移植團隊無法改變。但患者宣布死亡后至心臟開始灌注(DP-MP技術灌注低溫心肌保護液,TA-NRP技術灌注氧合溫血)的間隔時間可通過嫻熟的外科技術和團隊協作而縮短。因此,DCD心臟獲取、復蘇與評估需要由經驗豐富的外科團隊實施[10]。DCD心臟獲取流程示意圖見圖1。
 圖1
循環死亡后捐獻供體心臟獲取流程示意圖
圖1
循環死亡后捐獻供體心臟獲取流程示意圖
ICU:重癥監護室;PACU:麻醉恢復室;OR:手術室;WLST:撤除生命維持治療;FWIT:功能性熱缺血;DP-MP:直接獲取后機器灌注;TA-NRP:胸腹常溫區域灌注;OCS:器官護理系統;HOPE:低溫氧合灌注;SCS:靜態低溫保存
2.2 離體供心常溫機械灌注—TransMedics器官護理系統
TransMedics OCS(TransMedics Inc.,美國)是美國食品藥品監督管理局(Food and Drug Administration,FDA)唯一批準臨床應用的離體心臟機械常溫灌注平臺[22]。該系統能夠實現心臟復蘇、優化組織內環境、縮短冷缺血時間、評估供心狀態和功能,進行冠狀動脈造影。TransMedics OCS為DCD心臟DP-MP提供了技術支持,是DCD心臟應用最廣泛的技術;延長了DBD和DCD供心離體的安全時限,為實現長途運輸提供了新手段。
TransMedics OCS由心臟控制單元、心臟灌注單元與心臟灌注液體套裝3大功能單元構成,包括無線監控器、液體輸送系統、灌注模塊、除顫器、血氣分析儀、血液采集套裝、心臟停搏液套裝等部件;見圖2a~c。不論是DBD還是DCD心臟,使用該系統前,需通過供體右心房插管收集1.2~1.5 L血液。切除供心前,使用TransMedics推薦的心肌保護液(Bretschneider HTK液或del Nido液)順行性灌注心臟。供心切除和檢查后,需閉合未閉的卵圓孔、上腔與下腔靜脈、右心房插管處,然后將供心主動脈與OCS主動脈接口連接,主肺動脈通過插管連接至血液貯液器。供體血液在加溫至34℃并氧合后,泵入升主動脈以實現冠狀動脈灌注,之后通過冠狀靜脈竇、右心房、右心室、肺動脈流回貯液器,再次經過OCS氧合后泵回主動脈,建立血液循環;見圖2d。灌注回路中加入胰島素、抗生素、白蛋白、甲基強的松龍、碳酸氫鈉、多種維生素、電解質、葡萄糖和甲狀腺素等。供心通常在溫血灌注后短時間內恢復跳動,若發生心室顫動可施以直流電擊。此外,放置雙心室外膜起搏導線并連接起搏器,設置心室按需起搏(VVI)模式下心率80次/min。監控器實時顯示主動脈壓、冠狀動脈流量、溫度、血氧飽和度、肺動脈壓、血細胞比容和心電圖等參數;見圖3。供心在OCS溫血灌注期間,通過監測血流動力學參數、心電圖和生化參數(血氣分析、電解質和葡萄糖)進行評估。為調整血流動力學以及擴張冠狀動脈,可泵入適量的腎上腺素和腺苷,并通過調整主動脈灌注流量,將冠狀動脈流量維持在650~850 mL/min(并非真實的生理流量),主動脈壓維持在65~90 mm Hg。同時,需及時糾正電解質紊亂和酸堿失衡,補充能量物質。監測動、靜脈血的乳酸水平及其變化趨勢和差值,以確定心肌乳酸攝取率,這是評估供心可用性的重要指標。最終判斷OCS復蘇的供心是否適合移植的標準包括:視覺評估心臟收縮力良好、血流動力學參數穩定、動脈和靜脈血乳酸持續下降,以及動脈乳酸高于靜脈乳酸[12]。相對較低的靜脈乳酸水平表明乳酸吸收良好,反映心肌灌注充足[23]。但如供心收縮能力降低,伴隨持續的血流動力學不穩定如主動脈壓力增加,乳酸持續上升并>5 mmol/L,這提示心肌損傷及其相關的冠狀血管阻力增加,這樣的心臟應該被棄用。當供心被運送至受體的手術室且受體已準備好進行植入時,首先降溫并移除主肺動脈插管,打開下腔靜脈。接著關閉OCS血泵,通過主動脈接口灌注冷心肌保護液,迅速使心臟停搏。完成這些步驟后,將供心從OCS中取出,轉移到受體手術區。
 圖2
TransMedics OCS示意圖(引用美國FDA公開資料,https://www.fda.gov/media/147298/download)
圖2
TransMedics OCS示意圖(引用美國FDA公開資料,https://www.fda.gov/media/147298/download)
a:設備外形;b:設備去除上蓋后內部構造,心臟灌注單元尚未組裝;c:心臟灌注單元前面觀,該單元為一次性使用耗材,組裝于OCS設備中;d:OCS灌注血液流動模式圖;OCS:器官護理系統;FDA:美國食品藥品監督管理局;圖片經TransMedics Inc.授權使用
 圖3
TransMedics OCS實物圖
圖3
TransMedics OCS實物圖
a:心臟已置于心臟座艙,無線監控器被移除;b:心臟在座艙內已連接于TransMedics OCS進行灌注;c:TransMedics OCS心臟灌注系統的無線監控器;OCS:器官護理系統
TransMedics OCS的應用推動了DCD心臟移植的發展,允許在供體停止循環一段時間后優化心臟內環境并評估心臟的適用性[24]。不僅如此,不論對DBD或DCD供心,該技術的顯著優勢包括:縮短冷缺血時間以提高移植成功率、對擴展標準供心進行評估、延長供心離體的安全時限、擴大供體庫。筆者的1個病例,供體醫院距離受體醫院超過
盡管TransMedics OCS心臟移植病例在美國增長迅速,但也存在一些問題。比如其設備成本高昂(每次約需
2.3 胸腹常溫區域灌注技術
TA-NRP是一種復蘇DCD供心和評估供心活力的技術。不同于TransMedics OCS為代表的DP-MP技術,TA-NRP可實現在體內復蘇心臟,并在生理條件下進行評估,是DP-MP的有效替代方法。
TA-NRP的外科手術方法在細節上因醫療機構而異,但基本步驟相同[30]。在DCD供體被二次宣布死亡后,外科團隊迅速開胸并打開心包,進行右心房插管引流靜脈血并排空心臟。之后阻斷全部主動脈弓部血管防止大腦再次供血,升主動脈插管后連接靜脈-動脈體外膜肺氧合(veno-arterial ECMO,VA-ECMO)建立體外循環,恢復全身除大腦以外的常溫有氧血液灌注;見圖4。可在弓部血管阻閉鉗遠端的無名動脈插管引流,以進一步排空大腦血供;也可在肺動脈主干插管引流以減輕左心負荷。建立VA-ECMO后,進行氣管插管并連接呼吸機,恢復供體的肺部通氣。TA-NRP的起始目標流量通常設定為5 L/min。若發生心室顫動,可進行體內除顫。心臟通常在恢復灌注后不久即可恢復竇性心律,隨后進入并行循環階段。此階段,可糾正供體內環境紊亂及酸堿失衡,適當使用血管收縮藥物以維持平均動脈血壓>60 mm Hg。根據心臟功能恢復情況,TA-NRP一般持續30~60 min,供體脫機后評估心臟獨立工作的功能。有些醫療機構通過Swan-Ganz導管和食管超聲進行評估,而有些則完全依賴于外科醫生的視覺和觸覺評估。若供心被認為適合使用,將灌注冷心肌保護液以停止心臟跳動,隨后的心臟獲取流程與DBD心臟獲取相同。心臟切取后,可以使用傳統SCS技術保存心臟,但越來越多的醫生選擇使用SCTS。
 圖4
胸腹常溫區域灌注技術工作模式圖
圖4
胸腹常溫區域灌注技術工作模式圖
ECMO:體外膜肺氧合
TA-NRP技術與以TransMedics OCS為代表的DP-MP技術相比,可顯著縮短從供體循環停止到供心復跳之間的缺血時間,可實現心臟在生理條件下的功能評估,且經濟成本也更低[20,31]。Urban等[28]分析了內布拉斯加大學醫學中心進行DCD心臟獲取的成本和效益,結果顯示,TA-NRP獲取每顆心臟的直接成本為
2.4 控制低溫保存技術—SherpaPak心臟運輸系統
自1967年世界第1例心臟移植開始,在過去50余年中傳統SCS是最為廣泛采用的供心保存技術[29]。SCS將供心置于充滿冷心肌保護液的無菌容器后,在容器周圍覆蓋冰屑。SCS的優點是簡便、經濟,但缺點是快速、不均勻降溫,存在不可預測的溫度波動,以及冰與心肌之間可能發生近距離或直接接觸的風險[35]。心臟在低于2℃時會引起蛋白質變性、細胞損傷、舒張功能不可逆抑制以及心臟傳導系統損害,從而可能導致移植物失敗的風險[36]。供心在較高溫度(>12℃)中,代謝氧需求增加[37]。因此,國際心肺移植學會(International Society for Heart and Lung Transplantation,ISHLT)的指南[38]推薦在運輸過程中將供心溫度維持在4~8℃,但這一溫度范圍通過傳統SCS方法無法可靠地實現。而且,越來越多的供心通過TA-NRP技術獲取,這樣的供心已經歷一次缺血-再灌注損傷,心肌組織更加脆弱易損,因而對保存技術的要求更高。
2018年美國FDA批準了一種新型控制低溫心臟保存系統—SCTS(Paragonix Technologies Inc.,美國)。這是商業化的一次性使用設備,操作簡便,專門設計用于在運輸過程中將供心溫度穩定維持在4~8℃之間,最長可達40 h[37]。SherpaPak的冷卻機制采用了特殊相變材料(一種能夠儲存和釋放大量能量的物質),提供均勻冷卻,有效防止因凍結引起的心肌組織損傷[37]。使用過程中,首先通過連接器將供心的主動脈連接到內罐頂部,然后將供心完全浸沒在裝滿心肌保護液的內罐中。再將內罐放入外罐中,外罐周圍配備了冷卻包(相變材料)和保護性聚苯乙烯外殼;見圖5。該設備提供連續的實時供心溫度監控,并能通過藍牙將溫度和地理位置數據傳輸至用戶的移動電話,這些數據可通過應用程序在移植醫療團隊內部實時共享。
 圖5
SherpaPak心臟運輸系統
圖5
SherpaPak心臟運輸系統
a:SherpaPak結構示意圖(引用Paragonix公開資料,https://www.paragonixtechnologies.com/sherpapak),圖片經Paragonix Technologies Inc.授權使用;b:SherpaPak實物正面觀;c:SherpaPak實物上面觀(去除上蓋);d:內罐實物,供心已置入內罐
2020年Radakovic等[39]報道了首個臨床研究結果,證實使用 SherpaPak 進行供心保存安全且無害。隨后,多項臨床研究[40-41]評估了使用 SherpaPak 進行供心保存的臨床結果,數據顯示 SherpaPak 能夠降低PGD發生率、減少起搏器的使用和術后紅細胞的用量。目前還沒有使用SherpaPak的隨機臨床試驗。GUARDIAN-Heart是一個國際多中心注冊試驗[42],比較了用SherpaPak與傳統SCS保存供心的臨床結果。從2015—2022年,共255例受體使用SherpaPak,314例受體使用SCS。兩組的基線特征相似,但SherpaPak組供體和受體的距離更長。傾向性評分匹配結果顯示,與SCS相比,SherpaPak顯著降低了嚴重PGD發生率(3.4% vs. 12.1%,P=0.005),并提高了1年生存率(96.4% vs. 88.7%,P=0.03)。在缺血時間>4 h的患者中,SherpaPak與降低嚴重PGD發生率(3.7% vs. 18.0%,P=0.01)和提高30 d生存率(100% vs. 94.0%,P=0.02)相關。盡管SherpaPak的直接設備成本(約
2.5 低溫氧合灌注技術
雖然與傳統SCS相比,SCTS顯著改善了心臟保存效果。但與SCS相同,SCTS仍然是一種冷缺血儲存方法。冷缺血儲存法進行心肌保護存在多種負面效應,如出現代謝底物耗盡、缺血-再灌注損傷和內皮細胞損傷,其中細胞膨脹、水腫和細胞酸中毒最為突出[44]。美國目前正在進行一項創新的低溫氧合灌注臨床試驗,該技術通過XVIVO心臟灌注系統(XVIVO Inc.,瑞典)實現,希望能進一步解決上述問題,提高供心的保護效果。XVIVO是一款便攜式設備(圖6),功能類似于小型心肺旁路機,其以低溫將心肌代謝水平降低的同時,用富氧、含血的心肌保護液對供心進行連續灌注[45]。XVIVO系統由心臟座艙、一次性灌注單元、XVIVO灌注液和灌注添加劑組成。心臟座艙的功能組件包括壓力/流量自動控制的保存系統、氣體交換系統、白細胞濾器、冷卻單元、電池和軟件。XVIVO灌注溶液是一種基于白蛋白的高滲、富含營養并添加了激素和抗生素的心肌保護液。使用XVIVO灌注溶液2.5 L和300~500 mL與心臟受體血型匹配的紅細胞進行混合,使血細胞比容達到10%~15%。供心獲取后,升主動脈插入XVIVO特制管道與血泵相連;經二尖瓣口插入左心室引流管,防止灌注過程中左心膨脹。心臟被置于儲液器中,通過升主動脈插管對冠狀動脈進行順行性灌注,灌注壓力設定為20 mm Hg,溫度為8℃,此時冠狀動脈流量通常為150~200 mL/min。整個灌注過程供心處在靜止、非跳動狀態。
 圖6
XVIVO實物圖
圖6
XVIVO實物圖
a:正面觀;b:上面觀(去除上蓋后)
臨床前研究[46]已證實,使用XVIVO系統進行24 h的心臟保存是安全的,可以很好地維持心肌的收縮力和內皮功能的完整性。一項非隨機化的二期臨床試驗[47]比較了6顆使用XVIVO灌注的供心與25顆采用SCS保存的供心,其中XVIVO組的中位保存時間為223 min,SCS組為194 min。結果顯示,XVIVO組受體在6個月時無重大事件發生率(包括PGD、7 d內需要ECMO支持或急性排斥反應超過2R)達到100%,而SCS組為72%。另一項來自大洋洲的非隨機、單臂、多中心研究[45]旨在評估低溫氧合灌注在延長供心保存時間(預計6~8 h)對30 d受體生存率及移植后供心功能的影響。該研究中,長期保存組的平均保存時間為414 min,最長達527 min。30 d內受體生存率達到100%。與ISHLT登記系統的對照組相比,即使保存時間明顯延長,30 d生存率仍顯著優于對照組。該研究表明,低溫氧合灌注技術能有效延長心臟保存時間至近9 h,有助于超遠距離獲取器官。XVIVO還被用于2022年1月7日由馬里蘭大學完成的首例豬-人異種心臟移植中的供心保存。相比于離體供心常溫機械灌注技術OCS系統,低溫氧合灌注技術在長時間保存DBD供心時具有潛在優勢[45]。常溫機械灌注技術保存供心時間越長,PGD發生率越高,這可能是由心肌水腫所致,而這一現象在XVIVO系統中并不明顯。假如TransMedics OCS設備發生故障會導致災難性供心損失,而即使XVIVO發生故障也會將保存方式從低溫氧合灌注轉換為SCS,因此在運輸過程中更加安全。此外,XVIVO在灌注過程中無需像OCS一樣進行及時且復雜的參數調整,因此使用更加簡便。由于上述優勢,低溫氧合灌注技術有良好的臨床應用前景。然而,與常溫機械灌注技術相比,低溫氧合灌注技術無法通過評估乳酸水平、血流動力學或心臟收縮力評估移植物。目前,在美國針對XVIVO的臨床試驗(PRESERVE Heart Study)正在進行,尚未廣泛使用。
2.6 擴展標準供體、心肺復蘇后供體與高風險供體的應用
擴展標準供體(extended criteria donors,ECDs)心臟,也稱為邊緣供體心臟,包括缺血時間延長、年齡較大、有冠狀動脈疾病史和LVEF降低的供心[48]。既往研究[49]認為,與使用標準供心相比,使用ECDs供心與術后并發癥發生率和死亡率增加相關。然而,由于醫療技術的發展和供心的持續短缺,使用ECDs心臟的做法正在被重新評估,在美國,越來越多的心臟移植使用了ECDs。目前的共識是針對特定受體人群,使用ECDs心臟可以提供生存獲益。研究[50]表明,使用>40歲供體的心臟與受體較差的移植后生存相關。供體年齡對受體生存的負面影響隨著年齡的增加而增加,使用>55歲供體心臟的受體生存率最差[50]。然而,對于瀕臨死亡的受體,使用年齡較大的供體心臟已被證明可以提供生存獲益[50]。一項來自斯坦福大學醫院的研究[51]表明,對于>60歲的受體,使用>50歲供體心臟的平均生存期和移植失敗率與使用年輕供心相似。總的來說,供體年齡與移植后受體生存較差有關,這很可能是由于心臟移植物血管病風險的增加。然而,這些供心仍可以考慮用于特定的候選受體。合并CAD的供體是另一大類ECDs。有研究[52]表明,似乎供心合并中度以下CAD并不影響受體生存,也沒有導致移植物血管病的加速發展。Jahanyar等[53]研究了1987—2017年的UNOS數據庫發現,接受合并(n=650,7.5%)或不合并(n=
在美國大部分供體在器官捐獻前都經歷過時間不等的心肺復蘇術(cardiopulmonary resuscitation,CPR)。盡管供體進行CPR會降低供心的接受率,但大量研究[57]數據表明CPR并不影響供心質量或受體的臨床結果。UNOS數據分析[58-59]顯示,進行過CPR的供心與未進行CPR的供心相比,心臟移植受體30 d(95.2% vs. 94.7%)、1年(88.2% vs. 87.7%)和5年(72.8% vs. 74.2%)生存率相似。雖然近期有研究[60]顯示,CPR時間>55 min可能預示著心臟移植后生存率較差,但此結論仍值得商榷[61]。目前的共識為全面心臟超聲心動圖評估是決定是否接受供心的最關鍵因素。CPR持續時間是一個考慮因素,但不應是決定性因素。ISHLT指南[62]建議即使供體CPR時間>30 min,如果超聲心動圖顯示心臟功能和血流動力學滿意,則不會對移植后受體的生存或結果產生負面影響。該指南強調了進行CPR后供心的全面評估,而非嚴格的CPR持續時間。CPR持續時間是否能獨立預測受體的不良結果仍需要更深入的研究。
高風險器官供體是指對受體傳播感染病風險高的供體。隨著人類免疫缺陷病毒和丙型肝炎病毒(hepatitis C virus,HCV)治療的最新進展,使用高風險供體器官的情況有所增加。多項研究[63-64]顯示,使用高風險供體心臟和標準風險供體心臟,受體在心臟移植后1年(84.3% vs. 83%)和5年(71.2% vs. 65.5%)的生存率相似。以HCV供體為例,2006年接受HCV陽性供體心臟的受體1年、5年和10年死亡率是非HCV供心受體的2倍多[65]。受體死因通常是肝病和移植物血管病。當時,干擾素和利巴韋林是治療HCV感染的唯一療法。2014年推出了新一代抗病毒藥物治療方案,對多種HCV基因型的抗病毒效能更高,副作用更小,可使90%~95%的HCV患者達到無病毒血癥[66]。鑒于此,越來越多美國移植機構開始使用HCV陽性供體的實體器官。2016年僅有7個心臟移植機構使用HCV陽性供體,但到2019年迅速增加到57個[67]。HCV陽性的心臟供體從2016年的0.6%增加至2019年的11.45%[67]。心臟移植候選受體同意接受HCV陽性供體的比例從2016年前的<20%增加至2018年的接近40%[68]。根據UNOS數據,2021—2023年每年獲取自HCV陽性供體的供心分別是:387例、420例、458例(
近期美國在供心來源方面另一個重大突破是將基因編輯豬心應用于臨床。2022年1月,馬里蘭大學的Griffith 醫師團隊完成了世界首例 10 基因編輯豬到人的心臟移植手術[70],該團隊在2023年9月進行了第2例豬-人異種心臟移植手術。但是2例手術的受體都沒有長期存活。死亡原因復雜,可能與病毒血癥、抗體介導的免疫排斥反應與缺血-再灌注損傷有關[71-72]。因該技術距離廣泛臨床應用尚有很大的距離,所以本文不再詳述。但這是未來心臟移植發展的重要方向,可能從根本上解決供體短缺的問題。綜上所述,近10年心臟供體捐獻、復蘇與保存技術的進展巨大,可根據供體是DBD還是DCD、受體與供體之間的距離/預期供心缺血時間、供體年齡、供心狀況、受體手術的復雜性、經濟成本以及外科器官獲取團隊的經驗等因素,選擇不同的技術路徑實現最佳的移植臨床效果;見圖7。DCD、ECDs、CPR供體、高風險供體、異種供體的應用是美國心臟移植領域最顯著的臨床進展。
 圖7
移植心臟從供體到受體的常見技術路徑
圖7
移植心臟從供體到受體的常見技術路徑
DBD供心儲存技術有SCS、SherpaPak,部分預計缺血時間長或需要進一步評估功能的擴展標準供心也可以使用TransMedics OCS。DBD供心使用XVIVO的臨床試驗正在進行;對于DCD供心的復蘇技術有TransMedics OCS或TA-NRP,使用TA-NRP后需采用SCS或SherpaPak轉運供心;DBD:腦死亡后捐獻;SCS:靜態低溫保存;OCS:器官護理系統;DCD:循環死亡后捐獻;TA-NRP:胸腹常溫區域灌注
3 心臟移植外科技術與受體圍手術期管理的現狀與進展
3.1 不停跳心臟移植技術
近年,使用離體供心常溫機械灌注TransMedics OCS的心臟移植病例在美國增長迅速。經典的手術方法需要對心臟進行二次停跳。第1次心臟停搏發生在供心獲取時,當供心安裝入OCS開始溫血灌注后心臟復跳。第2次心臟停搏發生在受體手術室。首先給OCS中的供心降溫,在主動脈根部灌注冷心肌保護液使供心停跳,之后將供心移出OCS用于移植。當供心左心房與主動脈吻合入受體后開放升主動脈阻閉鉗,供心恢復灌注后逐步復跳。因此,這樣的方法造成了供心產生兩次缺血-再灌注損傷。2022年10月斯坦福大學醫院心胸外科團隊啟動了一項新技術策略,即針對OCS病例在不進行第二次心臟停搏的情況下進行心臟跳動下的移植[73]。以避免心臟獲取后額外的缺血時間,減少潛在的缺血-再灌注損傷。
不停跳心臟移植技術在供心獲取、復蘇與評估等環節與常規OCS病例基本相同,可應用于DCD或DBD病例,唯一需要注意的是,需預留較長的供體升主動脈以便后續操作。在供心植入環節,需將1根額外的管道連接入受體的體外循環機,用以將氧合血液灌注于供心主動脈根部。當供心抵達受體手術室,受體準備就緒后,將供心在OCS座艙中旋轉180°,恢復到左心房在后的解剖位置。供心主動脈根部插入“心肌保護液灌注管”并通過管道連接體外循環機。之后放置雙極心外膜臨時起搏導線,進行心臟起搏(90次/min)。通過體外循環機逐步向供心主動脈根部灌注氧合血液,并減少OCS對主動脈的灌注流量。當OCS停止灌注后,在“心肌保護液灌注管”遠端放置升主動脈阻閉鉗。此時可將供心從OCS內移出,放入特制容器內以便血液回收入體外循環系統。此時主動脈根部的灌注氧合血流量一般為250~300 mL/min,溫度為34℃。外科醫師在心臟跳動下完成左心房與主動脈吻合;見圖8。之后可移除升主動脈阻閉鉗,后續步驟與常規心臟移植術相同[74]。對于DCD供心采用不停跳心臟移植技術,熱缺血只發生在供體收縮壓<50 mm Hg到灌注心肌保護液之間,冷缺血僅發生在灌注心肌保護液后到供心裝入OCS恢復溫血灌注期間。此后供心不間斷地接受氧合溫血灌注,持續跳動,顯著縮短缺血時間,理論上可產生更好的心肌保護效果。
 圖8
不停跳心臟移植術中圖
圖8
不停跳心臟移植術中圖
a:外科醫師在進行左心房吻合,心臟尚未放入胸腔中,應用阻閉鉗夾閉供體升主動脈遠端,通過升主動脈近端的灌注管持續向供心灌注氧合溫血,維持供心跳動;b:升主動脈吻合,完成升主動脈吻合并排氣后,可移除供體與受體的兩把升主動脈阻閉鉗。后續手術操作與常規心臟移植相同
斯坦福團隊[75]報道了早期10例不停跳心臟移植的初步臨床數據,早期療效滿意。全組為DCD病例,供心平均熱缺血時間20.9 min,平均冷缺血時間40.4 min,平均OCS機器灌注時間355 min。10例受體全部存活,無受體術后需使用ECMO、主動脈內球囊反搏(intra-aortic balloon pump,IABP)或右心室輔助裝置,無受體出現急性排斥反應;中位隨訪時間97.5(14.0,293.0)d,患者均恢復良好。但由于該技術的新穎性,目前病例數仍較少,僅在美國幾個較大的心臟移植中心逐步推廣使用。因此該技術是否會顯著提高心臟移植療效目前尚不清楚,需繼續進行深入的臨床與基礎研究證實[76]。
3.2 部分心臟移植技術
部分心臟移植(partial heart transplantation)是指僅移植部分供體心臟的手術技術,實質上是一種活體同種移植物手術,可實施主動脈根部替換術、二尖瓣瓣葉片補片植入術等[77]。
部分心臟移植技術最初設計是為嬰幼兒與兒童提供可生長的心臟移植物,特別是位于心室流出道的瓣膜。傳統上適合嬰幼兒與兒童瓣膜置換的小型植入物是來自尸體的同種移植物。同種移植物瓣膜儲存在?135℃以下,雖保留了瓣膜的細胞外基質,但未采取任何措施來維持瓣膜細胞的活力。因此同種移植物在移植后即使可能保留少量的供體活細胞,但這些細胞高度異常,無法參與瓣膜的生物功能。這造成同種移植物無法生長或自我修復,隨著患兒的成長,同種移植物仍然會衰敗[78]。使用自體心包的Ozaki手術也存在相似的問題[79]。Ross手術利用自體肺動脈瓣移植,保留了瓣膜細胞活力,使得瓣膜在主動脈瓣位能夠生長和自我修復。然而Ross手術也有一些缺點:首先,只有在肺動脈瓣膜功能正常的情況下Ross手術才可行;其次,Ross手術需要在肺動脈瓣位置使用同種移植物瓣膜替換,而該植入物無法生長或自我修復;第三,Ross手術將肺動脈瓣置于主動脈系統壓力下,導致一些患者晚期自體移植物發生擴張與反流。為解決以上問題,美國心臟外科醫師首先設計并實施部分心臟移植手術,即僅移植供體心臟中的瓣膜部分,而保留受體的自身心肌組織。與傳統的同種移植物不同,這種活體同種移植物的細胞活性得以維持,可以生長與自我修復,實現減少抗凝強度甚至無需抗凝,在兒童心臟外科領域逐步開展后已顯示出良好的早期療效[77-78]。而且,該技術在成人心臟外科領域也有一定的應用場景,特別是對于那些抗凝治療存在問題的年輕患者有潛在的應用價值,如有妊娠需求的女性、有出血障礙的患者以及生活方式活躍的患者[80-81]。
從外科技術上講,部分心臟移植的供心獲取與常規心臟移植相同。比如計劃移植主動脈根部,在心臟切取后轉運至受體手術室,繼續解剖并切取供心主動脈根部,植入技術與McGiffin和Kirklin描述的經典主動脈同種移植物技術相同[82]。但與Ross手術使用自體肺動脈瓣不同,由于部分心臟移植使用的是活體組織,因此不需要使用人工血管對主動脈根部進行加固[81]。部分心臟移植與常規心臟移植相同,術前需要進行供體與受體間的組織配型,術后需要接受免疫抑制治療,這是該技術的一個潛在缺點。但由于心臟瓣膜具有免疫“特惠性”[83],所以部分心臟移植術后可能并不需要與常規原位心臟移植同樣強度和時間的免疫抑制治療,僅需要低強度和短期的免疫抑制。部分心臟移植技術具有顯著的潛在優勢,如移植物具有活性、可自我修復、術后無需抗凝、耐久性好、血流動力學好等。而且,心臟瓣膜可耐受長達48 h的缺血[84],這極大地擴展了供體獲取的地域范圍。特別是由于功能不全或CAD等原因,大量供體的心臟被舍棄使用,但多數被舍棄心臟的瓣膜形態與功能仍然正常。如果部分心臟移植技術得以推廣,那將有可能積極利用這一部分供心,在供體嚴重短缺的情況下顯著提高供體的利用率[77]。此外,應用部分心臟移植技術還可以實現“多米諾骨牌”移植。比如患者A因擴張性心肌病需要進行心臟移植,但其主動脈瓣結構與功能正常。患者B是20歲女性,患有主動脈瓣狹窄,且2~3年內有妊娠需求。在A的心臟移植手術中,切除病變心臟接受心臟移植同時,A病變心臟的主動脈根部可被解剖、切取,移植給患者B。這樣的做法可最大限度使更多的患者受益。
部分心臟移植技術作為一項新技術目前開展例數仍然有限,且主要是嬰幼兒與兒童病例。其仍有很多問題需要繼續研究,如部分心臟移植物的保存方法、術后最優的免疫抑制方案、其長期療效如何等。但該技術由于其特有的優勢,因此不論在兒童還是成人心臟外科領域均有其特定的應用場景,值得心臟外科醫師進一步關注與研究。
3.3 心臟與其他器官聯合移植
心臟與其他器官的聯合移植例數較多的是心肺聯合移植、心肝聯合移植與心腎聯合移植;見表2。
針對終末期心肺功能衰竭患者,雖然已經開發了多種治療方法,但心肺聯合移植仍然是最終解決方案。世界第1例成功的心肺聯合移植于1981年在斯坦福大學醫院完成,受體是1例原發性肺動脈高壓末期45歲女性患者[85]。由于雙肺移植正逐漸取代心肺聯合移植的角色,尤其對于終末期肺病和右心室衰竭患者,因此心肺聯合移植的病例數量并未有顯著增加。近年全美心肺聯合移植的數量維持在每年50例左右,術后1年生存率約為66%[86]。研究[86]顯示,供體年齡較大、較早的移植年份、受體為男性、受體肌酐水平、受體糖尿病史、移植時受體使用ECMO支持以及醫療機構移植手術量是受體預后的顯著影響因素;供體年齡較大、受體為男性、較早的移植年份、受體使用ECMO支持以及在移植手術量較少的醫療機構進行心肺聯合移植是受體死亡或再移植的獨立預測因素。斯坦福大學醫院作為全美頂尖移植醫療機構,1981—2022年間共完成271例心肺聯合移植病例。2001年以后在斯坦福大學醫院實施的心肺聯合移植患者,術后30 d生存率達97%,1年生存率達89%,10年生存率達53%[87],療效滿意。
成人接受心肝聯合移植的病因學,除家族性淀粉樣變性、家族性高膽固醇血癥等以外,很多患者是早年因患先天性心臟病接受Fontan手術,隨著時間推移發生了Fontan循環衰竭以及終末期Fontan相關肝病(Fontan-associated liver disease,FALD)[88]。關于Fontan術后患者選擇單獨的心臟移植還是心肝聯合移植,美國移植學會建議:對于FALD出現肝功能衰竭或纖維化跡象且肝臟結節明顯的患者,應強烈考慮進行心肝聯合移植[89]。由于心肝聯合移植病例并不常見,目前尚未建立統一的手術方法。各機構有不同的手術方式,如順序移植與整塊移植等。Starzl醫生團隊在匹茲堡進行的首例手術是從中線開腹,完全松解肝臟之后進行胸部手術,全程使用體外循環。首先完成心臟移植,隨后進行肝切除術,通過血泵氧合器轉流門靜脈血流。肝臟通過腔靜脈中段插入術進行移植,膽管通過T形管進行重建,整個手術耗時15 h[90]。南加州大學Keck醫學中心通常先完成心臟移植,之后進行超聲心動圖檢查,確保血流動力學穩定,盡可能止血,并中和肝素。胸腔暫時不閉合,以備需要重新啟動體外循環。肝臟團隊隨后采用背馱式肝移植[91]。斯坦福大學醫院采用的整塊心肝聯合移植方法,要求供體器官獲取中保持下腔靜脈的完整性,供心連同下腔靜脈和供肝整塊取出;見圖9[92]。移植手術時首先切除病肝,在肝切除術快完成時,心臟團隊開始解剖心臟,患者置于體外循環狀態下,整塊切除心臟和肝臟。心臟的吻合與肝下腔靜脈吻合同時進行。然后夾住門靜脈轉流插管,完成門靜脈系統和肝動脈的吻合,之后恢復器官灌注。整塊移植技術的優點有:手術過程中相對穩定的血流動力學、單次再灌注事件、縮短吻合口和肝臟缺血時間[93]。然而,這種方法的缺點是心臟缺血時間延長,并且需要兩支手術團隊同時工作。心肝聯合移植的優勢在于肝臟的免疫保護作用,移植心臟的急性排斥反應與移植物血管病的發生風險均較低[94]。因此接受心肝聯合移植的患者可能僅需要較低強度的免疫抑制治療[95]。一項納入99例患者的Meta分析[96]結果顯示,心肝聯合移植術后1年和5年生存率分別為87.5%和84.3%。
 圖9
整塊取出的供心和供肝的術中圖
圖9
整塊取出的供心和供肝的術中圖
近年來,美國心腎聯合移植的例數持續上升,2001—2021年病例數量增加了近14倍[97]。心腎聯合移植數量持續大幅增加的原因可能是多方面的,主要包括:心衰和腎功能不全的合并癥患病率增加、2018年UNOS分配政策改革后優先考慮急重癥患者,以及接受者群體的擴大等[97]。進行心腎聯合移植主要是由于擔心單純心臟移植后發生腎功能衰竭的不良后果。2016年ISHLT建議腎小球濾過率估算值(estimated glomerular filtration rate,eGFR)<30 mL/(min·1.73 m2)為不可逆的腎功能不全,是心臟移植的相對禁忌證[98]。心胸外科和腎移植專家2019年在波士頓達成了共識:心臟移植候選人如果eGFR<30 mL/(min·1.73 m2)應考慮進行心腎聯合移植,eGFR在30~44 mL/(min·1.73 m2)之間且有慢性腎病證據(如蛋白尿或腎臟體積減小)的患者也應考慮心腎聯合移植,而eGFR>45 mL/(min·1.73 m2)的患者不適合進行心腎聯合移植[99]。心腎聯合移植手術規劃中主要考慮因素是腎移植的時機。手術可一站式進行,即在心臟移植后立即植入腎臟;或分站式進行,即在心臟移植一段時間后進行腎移植手術。目前認為分站式移植可能是更優的方法,其優點是腎移植前血流動力學穩定,可避免心臟移植期間體外循環的炎癥級聯反應與血管收縮藥物對腎移植物產生負面影響[100]。一般腎移植在心臟移植后24~48 h進行。一項研究[101]分析了7例分站式心腎移植患者臨床數據,結果顯示本組病例的平均腎臟冷缺血時間為53 h,最長腎臟冷缺血時間為69 h,這種分站移植對腎功能無顯著負面影響。一項基于分析UNOS數據的研究[97]表明,心腎聯合移植術后1年存活率從2001—2006年的86.7%提高至2017—2021年的89.0%;術后死亡預測因素包括較高的總膽紅素水平、較高的肺動脈壓、較長的心臟缺血時間和移植前患者需要機械通氣。Agarwal等[102]發現,UNOS數據庫中所有心腎聯合移植和單純心臟移植患者的中位長期存活率相似(12.4年vs. 11.3年,P=0.053),其中eGFR<45 mL/(min·1.73 m2)的患者(13年vs. 10.2年,P<0.001)以及移植前需要透析的患者(12.4年vs. 9.9年,P<0.01)可從心腎聯合移植中獲得更顯著的生存獲益。
3.4 心臟移植術后原發性移植物功能障礙
PGD是心臟移植術后患者30 d內死亡的主要原因[103]。2014年ISHLT共識工作組制定了PGD的標準化定義和分類[104]。定義PGD為發生在心臟移植后的前24 h內,不是由超急性排斥反應、肺動脈高壓或手術出血等原因造成的心臟移植物功能障礙。嚴重PGD診斷標準為需要MCS治療,如ECMO;輕度至中度PGD通過超聲心動圖標準識別,血流動力學惡化需要高劑量正性肌力藥物或IABP支持[104]。在過去10年中這一診斷標準被廣泛采用,提高了PGD研究和臨床管理質量。然而,PGD的真實本質仍然模糊,文獻[105]報道的發病率和死亡率差異較大,分別為1.0%~31%和3%~75%不等;嚴重PGD的發病率和院內死亡率分別為8%~49%和3%~65%不等。這些顯著差異突顯了PGD病因學和診斷的復雜性,以及目前對PGD的臨床管理缺乏一致標準,這些問題是近年本領域的研究與討論熱點。
首先,目前對PGD的診斷與嚴重程度的評估依賴于影像學、血流動力學和治療方式,而不是病理和病因學證據。PGD的治療主要是通過正性肌力藥物和MCS維持受體的血流動力學穩定[106]。而目前在美國對心臟移植后MCS的啟動時機與設備選擇尚無統一指南,更多是由主治醫生根據經驗決定,而PGD的診斷又依賴于MCS的使用,這就造成了PGD診斷的差異很大。其次,嚴重PGD的年發病率顯著增加,從2010年的2.0%到2020年的12.2%[107]。這種趨勢可能歸因于當前的醫療實踐,包括使用更多的DCD、ECDs心臟。此外,更多受體在移植前就應用了MCS,這些都是PGD的關鍵風險因素[107]。盡管新技術如SherpaPak和XVIVO可降低嚴重PGD發生率[35,42,45],但這些技術未能抵消嚴重PGD發病率的上升趨勢。另一個更關鍵的原因是,目前心臟移植后越來越積極地使用ECMO,因而提高了嚴重PGD的診斷率。與10年前相比,ECMO的管理技術取得巨大進步,如嚴格的抗凝管理策略、更小的灌注管以及常規使用遠端灌注導管,已顯著減少了ECMO的卒中和肢體缺血等重大并發癥,使得積極使用ECMO更為安全。考慮到ECMO可提供更廣泛的“安全”邊界,外科醫生們越來越傾向于跳過最初的IABP或高劑量正性肌力藥物,直接升級到ECMO治療。積極使用ECMO確實可顯著降低嚴重PGD的死亡率。哥倫比亞大學的研究[108]發現:早期積極植入ECMO的策略可使心臟移植后嚴重PGD的院內死亡率由28%下降到5%。然而,積極使用ECMO增加了嚴重PGD的診斷率,并可能導致過度診斷。再者,當前臨床實踐中難以尋求PGD的病因學。引起PGD的原因可能涉及炎癥反應、缺血-再灌注損傷、激肽系統的激活等因素,或多種因素的組合[109]。有研究[103]顯示,輕度或中度PGD的風險因素與嚴重PGD不同,表明其潛在病因不同。例如胺碘酮、β-腎上腺素能受體拮抗劑的使用和延長的缺血時間增加了所有PGD分類的風險;而供體死亡原因、受者糖尿病狀態與輕度至中度PGD有關,術中血液制品的使用與嚴重PGD相關。這些發現強調了PGD病因與嚴重程度之間的因果關系,突顯了尋求病因在PGD臨床管理中的重要性。有研究[110]表明:人類白細胞抗原(human leucocyte antigen,HLA)-A的特定位點估算群體反應抗體(cPRA)可預測PGD的嚴重程度,這一現象提示針對特定患者進行血漿置換或靜脈注射免疫球蛋白可降低PGD風險。最后,人工智能可在革新PGD的診斷和風險分層方面發揮重要作用。有研究人員[111]開發了一個非線性人工神經網絡模型用于評估供體、受體狀況與心臟移植后PGD發生的關系。結果顯示在
綜上所述,PGD是影響心臟移植療效的關鍵因素。然而,當前在PGD的診斷、風險分層、治療管理方案方面仍未達成共識,這可能對PGD的客觀評估造成挑戰,進而影響多中心臨床研究的可靠性和指南的制定。但隨著研究的深入與新技術的出現,該問題有望得到改善。
3.5 心臟移植圍手術期機械循環支持的應用與再次心臟移植
隨著MCS技術的進展,越來越多的終末期心衰患者在心臟移植前即接受了臨時或持久MCS治療作為移植橋梁。MCS治療的目標是提供足夠的器官灌注并減輕心室負擔。目前在美國有多種臨時MCS設備可使用;見表3。2018年UNOS改革供心分配政策后,使用臨時MCS治療的患者被分配了更高的優先級。因此移植前應用了臨時MCS的患者接受心臟移植的數量增加。2018年后,移植前使用IABP支持的患者占所有心臟移植病例的27%,使用臨時心室輔助裝置支持的占4%。使用VA-ECMO支持的占5.3%[112]。IABP是最常見的臨時MCS設備,可使心輸出量增加約0.5 L/min,并增加冠狀動脈灌注、減少心臟后負荷和降低心肌氧耗[113]。與其他臨時MCS設備相比,IABP提供的血流動力學支持較低,但其優點包括易于植入和成本低。其他臨時MCS設備之間的植入方式、血流動力學特點和血流量支持都有所不同。例如Impella 5.5(Abiomed,美國)可提供高達6.2 L/min的流量。VA-ECMO提供雙心室支持和氧合,可提供最高達10 L/min的血流量,在所有臨時MCS設備中,其可提供最強的血流動力學支持。在使用臨時MCS支持期間,患者可能面臨許多并發癥,會增加后期心臟移植的風險。如使用Impella 5.5的經驗發現,超過1/3的患者因出血需要輸血[114],這可能導致心臟移植候選人免疫致敏。然而,研究[115]發現,使用臨時MCS作為橋梁進行心臟移植的患者術后生存率滿意,與非橋接受者相似。
在美國,接近1/4的安裝了持久左心室輔助裝置(durable LVAD,dLVAD)的患者是為等待心臟移植進行的橋接治療[116]。dLVAD可為心衰患者提供有效的血流動力學支持。然而,安裝dLVAD手術導致的胸腔內組織粘連,使后續心臟移植手術面臨潛在風險。研究[117]表明,dLVAD對心臟移植后結果有負面影響,顯著增加術后早期死亡,尤其是存在腎功能不全和體重指數較高的患者。另外一個討論熱點是dLVAD后進行心臟移植的最佳時機。早期一項對468例安裝HeartMateⅡLVAD(Thoratec Corp,美國)后進行心臟移植患者的研究[118]發現,dLVAD支持時間對心臟移植后存活率無顯著影響;然而在dLVAD支持期間24 h內需要輸注超過2單位紅細胞的患者,其1年存活率顯著降低。dLVAD安裝手術對心衰患者是一次重大“打擊”,患者完全恢復后再進行心臟移植是更穩妥的選擇。目前的觀點是:如在患者完全恢復之前,或植入dLVAD不到30 d內進行心臟移植,將可能導致不良結果[119]。然而,隨著dLVAD支持時間的延長,發生dLAVD相關不良事件的可能性也會增加。因此,在dLVAD植入后9~12個月內(甚至1~3個月)進行心臟移植,可減少并發癥并改善移植后結果;另外,具有心肌恢復潛力的患者通常會在6~9個月內顯現出來,因此這時將更有助于判斷心臟移植的風險與獲益[119]。最后,許多動態的社會與心理因素也會影響dLVAD支持時間和移植候選名單的資格,這增加了探討這個問題的復雜性。總之,對于重度心衰患者,雖然dLVAD支持可以在等待心臟移植期間提高生存率,改善器官灌注與功能,但必須權衡其本身的并發癥,如感染、出血、卒中和給心臟移植手術造成的風險。因此,使用dLVAD支持的患者可能需要更謹慎地評估其心臟移植的資格。
對于心臟移植后MCS的應用,目前美國并沒有相關指南規范MCS的啟用時機與設備選擇,更多地取決于醫療組的經驗和偏好,但共識是盡量早期使用[106]。心臟移植后IABP和ECMO是最常用的設備。如前所述,近年ECMO的應用越來越積極與廣泛。VA-ECMO提供強大的雙心室支持與氧合,使其成為多數嚴重PGD患者的首選。關于ECMO的插管部位尚存在爭議。有移植機構優選中心插管的ECMO支持,除非患者在術前已經使用外周插管ECMO或在ICU床旁緊急安裝ECMO[120]。中心插管可以避免外周血管并發癥,提供滿意的循環支持、左心室卸負荷和上半身氧合,而且不增加死亡率[121]。相比之下,更多機構偏好外周插管,因為關胸后移除ECMO設備時無需重新開胸,降低了感染風險。一項來自歐洲的研究[122]顯示,外周插管可提高心臟移植后3個月和1年生存率。應用VA-ECMO時另一個值得注意的問題是左心室后負荷增加,導致左心室舒張末期壓升高,從而可能引起肺水腫。目前有多種技術可以解決這個問題[123]:(1)經皮插入左心房引流管(通過房間隔)并連接到靜脈管道;(2)通過左心房引流管(通過房間隔)直接連接到TandemHeart;(3)經皮植入左心室豬尾巴導管進行主動的左心室引流;(4)ECMELLA技術,即聯合使用VA-ECMO和Impella進行主動的左心室引流;(5)使用IABP卸載左心室后負荷,間接實現左心室引流;(6)通過經皮球囊房間隔造口術實現被動左心房引流。這些技術中,IABP最易行,應用最廣泛,但效果相對有限。結合使用ECMO和Impella的ECMELLA技術是一種更強大的雙心室支持策略,無需左心房引流即可提供充分的左心室減負荷,但其可能增加VA-ECMO的并發癥,特別是出血和溶血[124]。目前該技術的應用雖不廣泛,但正被逐步推廣。
對于已經使用MCS治療的PGD患者,如果供心最終無法恢復,則再次心臟移植手術被認為是一種選擇。UNOS數據庫顯示,2023年度美國再次心臟移植數量為123例。由于初次供心的失效,受體處于不理想的生理狀態,可能出現肺水腫、腎衰竭、肝衰竭、血管麻痹和凝血障礙,這些情況都是再次移植的巨大障礙。Iribarne等[125]利用UNOS數據研究了在初次移植后90 d內進行再移植手術。1995—2008年
3.6 人工智能在心臟移植領域的應用
近年人工智能在心臟移植領域的應用是研究熱點,研究主要集中在預測死亡率、PGD和心臟移植的結果[127]。大多數證據集中在使用機器學習(machine learning,ML)模型預測移植后死亡率和生存率。ML模型能夠識別非線性關系,并整合多種變量預測患者的結果。與傳統的回歸模型相比,ML模型具有優勢,因為其可分析復雜結構的數據,創建新的動態關系,并篩選出對特定結果影響最大的變量。傳統的線性模型確定某個事件發生的概率是基于特定變量的影響,而ML可基于多種變量輸入構建模型,并根據最有影響力的因素進行調整。
Medved等[128]建立了一個兩層神經網絡模型,用于預測患者在心臟移植等待名單上180 d、365 d和730 d后的臨床結果(仍在等待、已移植或在等待名單中死亡)。研究使用了UNOS的成人患者數據,該神經網絡模型在這3個時間點的F1分數分別為0.674、0.680和0.680,相比基線的0.271顯著提高。這意味著模型在這3個時間點上預測的準確度和靈敏度表現較為一致,且都在一個相對較高的水平。Yoon等[129]使用決策樹技術開發了一個生存模型,用于預測心臟移植后的生存。該研究使用稱為“預測樹”的預測因子簇,輸入變量包括受體、供體的臨床特征以及供體-受體的匹配屬性,如年齡、性別、既往移植、輸血、肝腎功能、呼吸機輔助、HLA不匹配和血型。該模型在3個月生存預測中的C-統計量為0.66,3年生存預測的敏感性為0.8,這提示該模型有66%的概率正確區分實際生存和未生存患者;在所有實際存活3年以上的患者中,該模型能夠正確識別出80%的患者。這個結果表明,該模型在3個月生存預測中有一定的準確性,但還有改進空間。同時,模型預測3年生存的能力較強,能夠有效識別出大多數長期生存的患者。因此,該模型在預測心臟移植患者的短期和長期生存方面都有一定的實用價值。Kampaktsis等[130]應用UNOS數據庫中
總之,在心臟移植領域中人工智能模型在預測患者臨床結果方面比傳統的線性模型更準確。人工智能模型有助于評估移植手術風險和預后,確定心臟移植的候選資格。人工智能可為臨床決策提供更有力的工具。但目前的人工智能模型仍存在偏倚風險、需要外部驗證以及實用性較低的問題,而且用于訓練模型的數據庫沒有關于免疫抑制方案的詳細數據。因此,今后我們需要更多來自不同人群的高質量、完整和準確的數據進行此方面的研究。但人工智能引領的“智慧”心臟移植一定是未來發展的方向。
近些年在心臟移植受體管理方面的進展還包括新的虛擬配型技術、術后無創免疫監測技術、新的免疫誘導、免疫調節與免疫抑制療法等。然而,這些工作主要由心臟專科醫師完成,因此不在本文討論的外科進展范圍內。心臟移植的手術技術已經相當成熟。過去10年,盡管在受體端的外科領域也取得了一些新的技術進展,然而總體不如供體端的技術革新顯著。與10年前相比,雖然目前心臟移植的術后生存率沒有顯著提升,但我們要認識到,當今醫療實踐中涵蓋了更多的危重患者,而心臟移植的療效并沒有下降,依然非常滿意,這正是技術進步帶來的效果。
4 總結與展望
近年來,美國在心臟移植的供體捐獻、外科技術、圍手術期管理等方面取得了顯著進展。在供體嚴重短缺的情況下,供體獲取和保存技術的革新以及DCD、ECDs的應用顯著擴展了供體庫,增加了移植手術量。不斷涌現出的新外科技術有望進一步改善心臟移植療效。特別是MCS和人工智能的快速發展,可能為本領域帶來革命性的變革。總之,未來心臟移植領域必然迎來更多突破,為終末期心衰患者提供更有效的治療選擇。
利益沖突:無。
作者貢獻:梁宏亮負責論文選題、設計、撰寫和修改,文獻資料的檢索、評估和篩選,圖表制作等。