群體藥代動力學是基于計算機模擬和數據分析技術,用于研究不同目標人群的體內藥物代謝動力學行為的研究方法。其可以改善傳統藥物臨床試驗周期長、成本高、難度大等現實問題,綜合分析不同生理、病理狀態下人群的體內藥物代謝過程差異,成為優化藥物研發和臨床應用的有效技術手段。本文將對群體藥代動力學的內涵、在臨床試驗中的應用及未來的發展趨勢進行初步綜述,旨在為新技術、新方法在臨床試驗中的應用提供參考和借鑒。
引用本文: 張玉明, 劉懿賢, 鄭莉. 群體藥代動力學技術在虛擬臨床試驗中的應用與發展趨勢. 中國胸心血管外科臨床雜志, 2024, 31(10): 1400-1406. doi: 10.7507/1007-4848.202405021 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
藥物臨床試驗是評估新藥的藥代動力學(pharmacokinetics,PK)、安全性及有效性的醫學科學研究[1]。藥物臨床試驗既是確保新藥物安全有效的重要步驟,也是藥物研發過程中不可或缺的環節,可以為臨床提供更多的治療選擇,改善患者的生活質量。然而,傳統臨床試驗具有成本高昂、研發周期漫長等問題。臨床試驗的投入約占藥物研發總費用的67%[2]。同時,其是新藥研發過程中耗時最長的階段,藥物在臨床試驗階段往往需要6~10年。實際情況可能因藥物特性、疾病類型、患者招募等因素而有所差異。此外,當受試者個體差異較大或臨床樣本難以獲得時,臨床試驗的實施將更加困難。因此,迫切需要新方法、技術服務于臨床試驗。在這樣的背景下,虛擬臨床試驗(virtual clinical trials,VCT)應運而生。VCT是指通過數學模型模擬臨床試驗過程,獲取藥物PK、有效性和安全性相關數據,對影響因素進行分析,進而使用計算機模擬的方式開展或輔助臨床試驗[3]。當前,群體藥代動力學(population pharmacokinetics,PopPK)作為其中一種重要的方法,在VCT領域已廣泛應用[4]。PopPK是一種用于研究藥物在不同個體(或群體)體內的吸收、分布、代謝和排泄(absorption,distribution,metabolism and excretion,ADME)過程的研究方法[5]。其核心在于識別和量化影響藥物PK的內在和外在因素,如性別、年齡、病理狀態和合并用藥情況等。目前,PopPK主要采用非線性混合效應模型方法(nonlinear mixed-effects modeling,NLME)構建模型,以獲得PK參數的群體典型值,同時量化影響群體參數的協變量[6](圖1)。目前,PopPK在模型引導的藥物研發和VCT中發揮重要作用。其通過計算機模擬實現對真實世界數據的高效利用,不僅可以實現對目標人群代謝數據的整合,還可以個體化地分析藥物代謝差異,豁免或減少臨床試驗風險、提高結果準確性。PopPK在提供個體化治療方案、優化藥物療效和安全性、特殊人群藥物管理、降低試驗成本和風險以及提高試驗效率等多個方面發揮重要作用,對藥物研發和臨床應用具有重要的指導意義和推動作用。
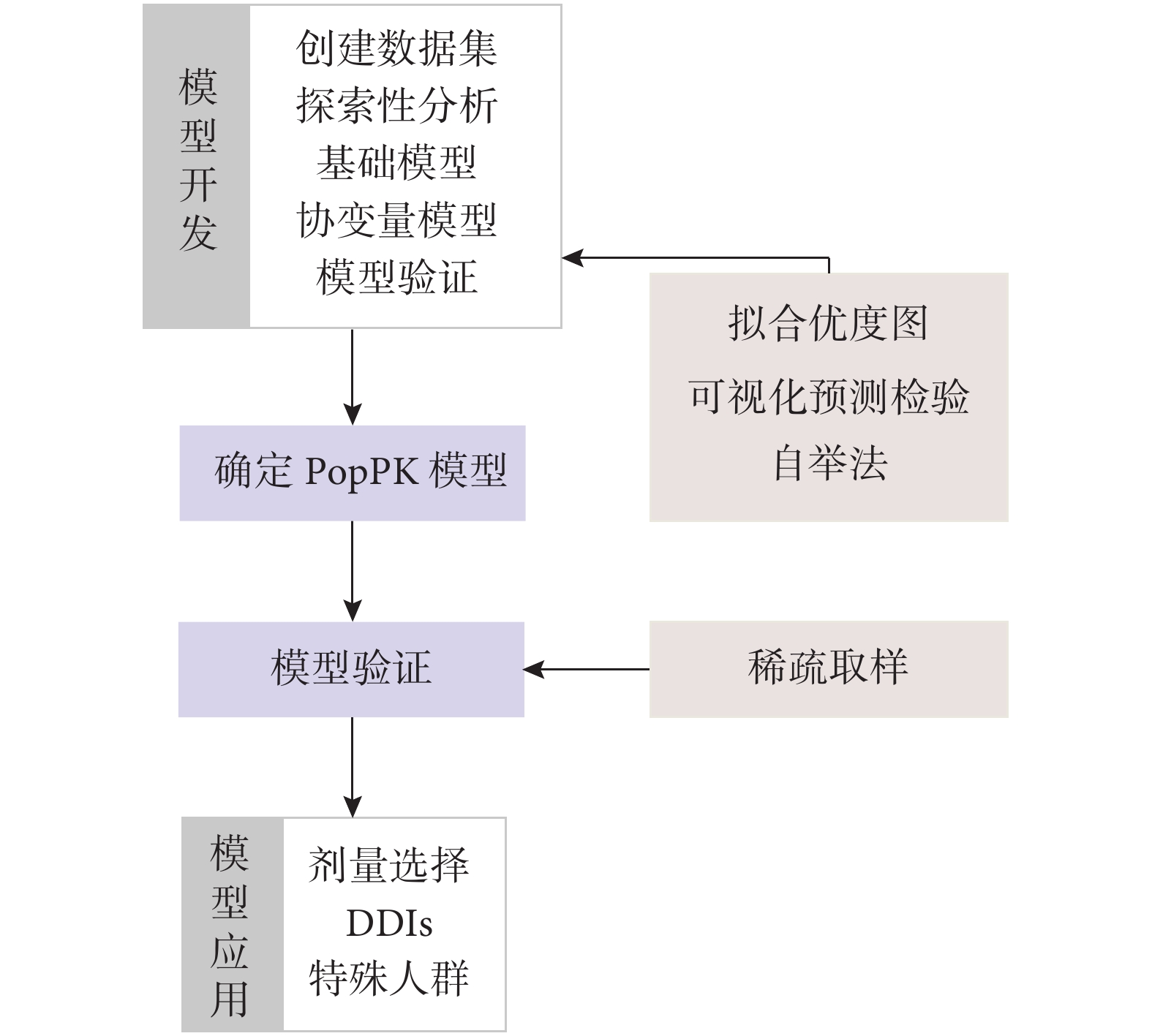
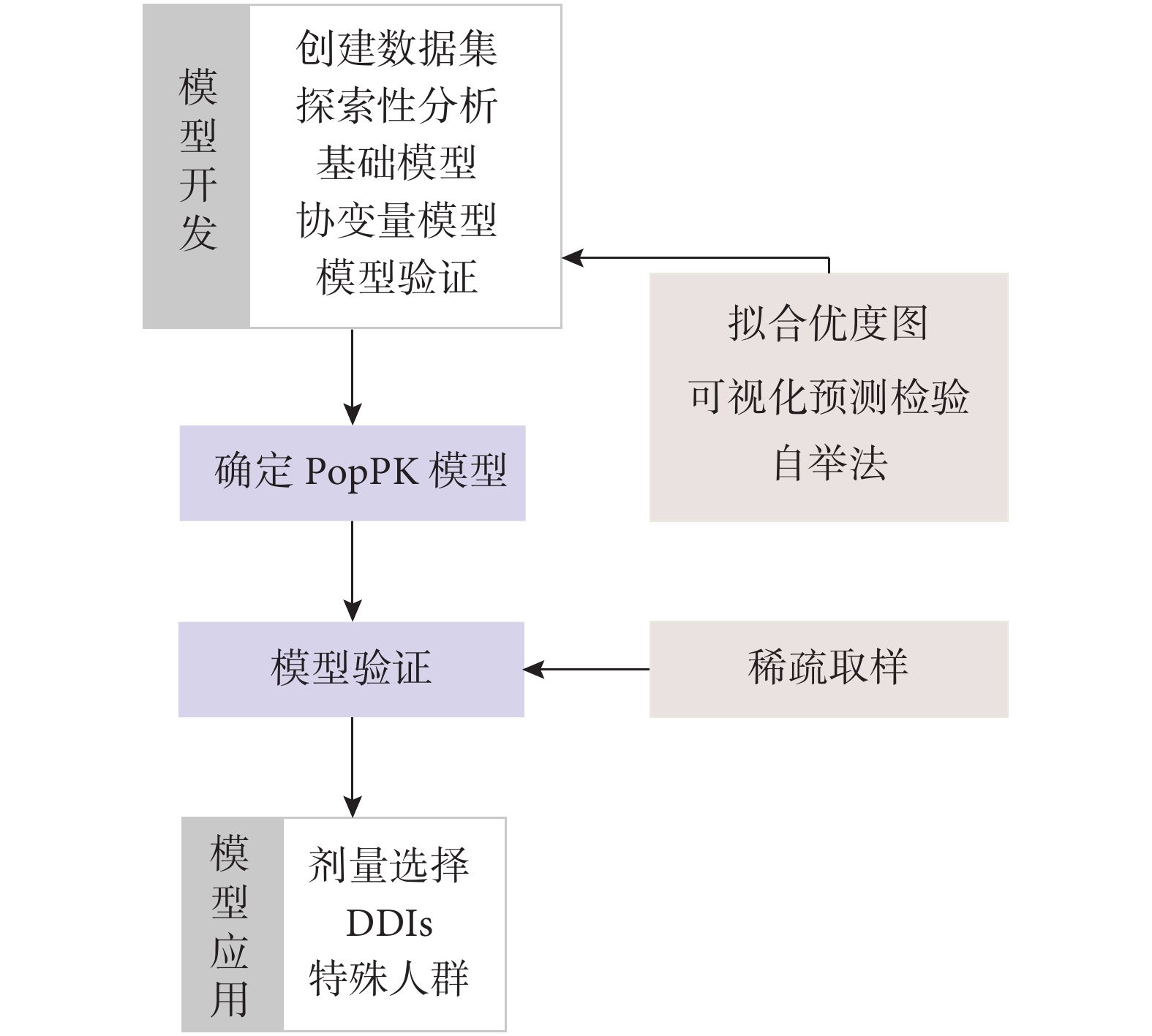 圖1
模型建立過程
圖1
模型建立過程
PopPK:群體藥代動力學;DDIs:藥物-藥物相互作用
PopPK技術為臨床試驗中的重要研究方法之一。通過PopPK分析,研究人員可以更好地理解藥物在不同特征群體中的動力學特點。PopPK在優化劑量方案、個體化用藥等方面有重要應用。此外,PopPK可協助識別潛在的藥物-藥物相互作用(drug-drug interactions,DDIs),預測特定人群(如兒童、老年人、腎臟或肝臟功能不全患者)中藥物的ADME等特點,為個體化精準用藥提供參考與借鑒。
1 PopPK的產生和內涵
藥物在人體內發揮藥理作用受到藥物代謝過程的影響,而藥物的PK行為在不同個體之間可能存在差異。眾多內在、外在因素(協變量)如性別、年齡、體重、基礎疾病或聯合用藥等都可改變PK行為。因此,當這些影響因素具有臨床意義時,根據患者具體生理、病理情況調整給藥方案十分必要[6]。傳統的PK研究是試驗性的,可以證明藥物的作用機制,并粗略地定量分析劑量與藥物代謝、藥效之間的聯系。然而,這種依托于臨床試驗的研究模式具有研究周期長、經費數額大、安全風險高、臨床樣本收集困難等諸多問題。同時,為盡量減少個體差異,PK研究通常在健康志愿者或經過嚴格篩選的患者身上進行,這導致所獲得數據與實際患者體內藥物行為的偏差。此外,傳統PK研究需多次采集靜脈血樣,受試者體驗差、依從性低。因此,開發臨床試驗新技術、新方法以降低研究難度成為亟待解決的問題。近年來,隨著計算機科學技術的發展,PopPK等建模與模擬技術逐漸成為藥物臨床試驗方法發展的重要方向。PopPK的方法最早由Sheiner及其同事[7]于20世紀70年代首次提出,并應用在地高辛的小樣本PK行為分析中。此方法并不依賴于傳統手段中的多點密集采樣,使得基于少量血漿樣本分析藥物濃度-時間曲線和人群變異性成為可能[8]。PopPK采用非線性混合效應模型基于群體水平研究PK,不僅可獲得目標群體的典型PK參數,還可識別并量化影響PK參數的協變量因素,具備對復雜影響因素的良好整合能力。非線性指因變量(如濃度)與模型參數和自變量呈非線性關系,混合效應指參數化:不因個體差異變化的參數稱固定效應,因個體差異變化的參數稱隨機效應[9]。PopPK模型在臨床試驗中有一定優勢:(1)允許海量不同虛擬給藥方案的快速探索,從而輔助確定臨床試驗方案[10];(2)可捕獲由于人群差異導致的PK參數分布差異;(3)預測不同劑量對血漿生物標志物水平的影響以及協變量在人群層面的影響,促進個性化給藥方案的提出[11]。
2 PopPK在臨床試驗中的應用
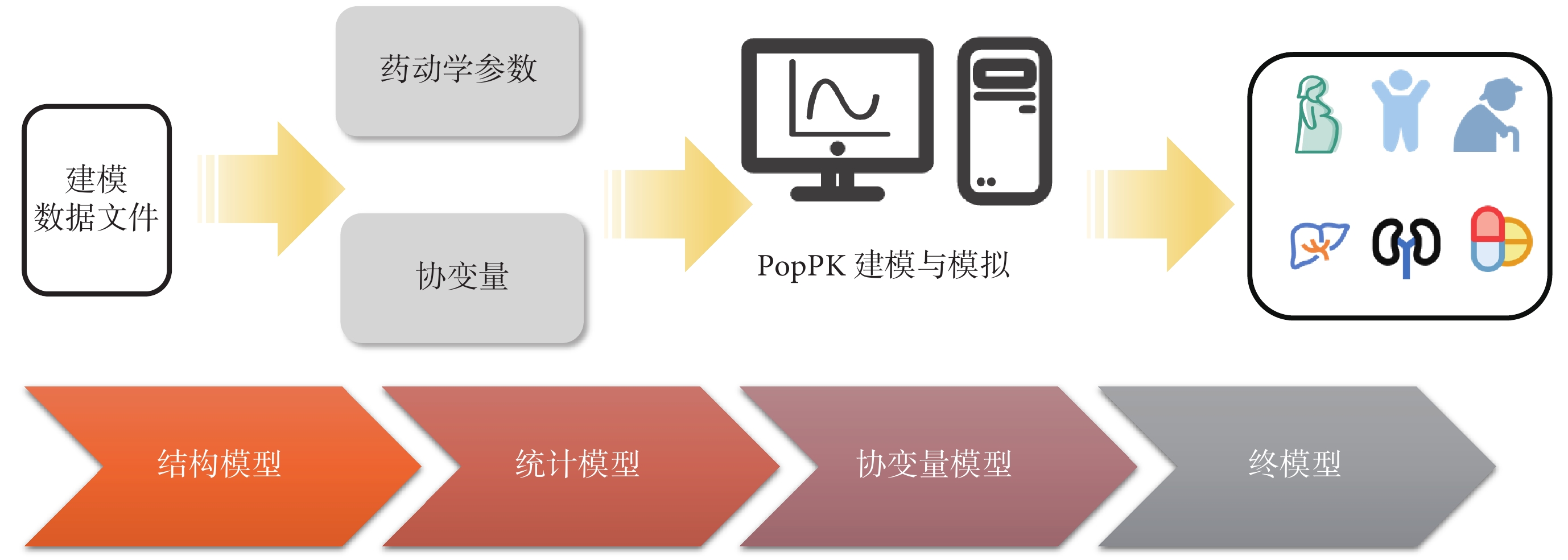
基于上述提及的眾多優勢,PopPK逐漸成為新藥臨床試驗中的重要方法,在藥物的劑量選擇、特殊人群部分豁免、DDIs及種族差異分析等傳統PK試驗難以開展的方面發揮重要作用(圖2)。
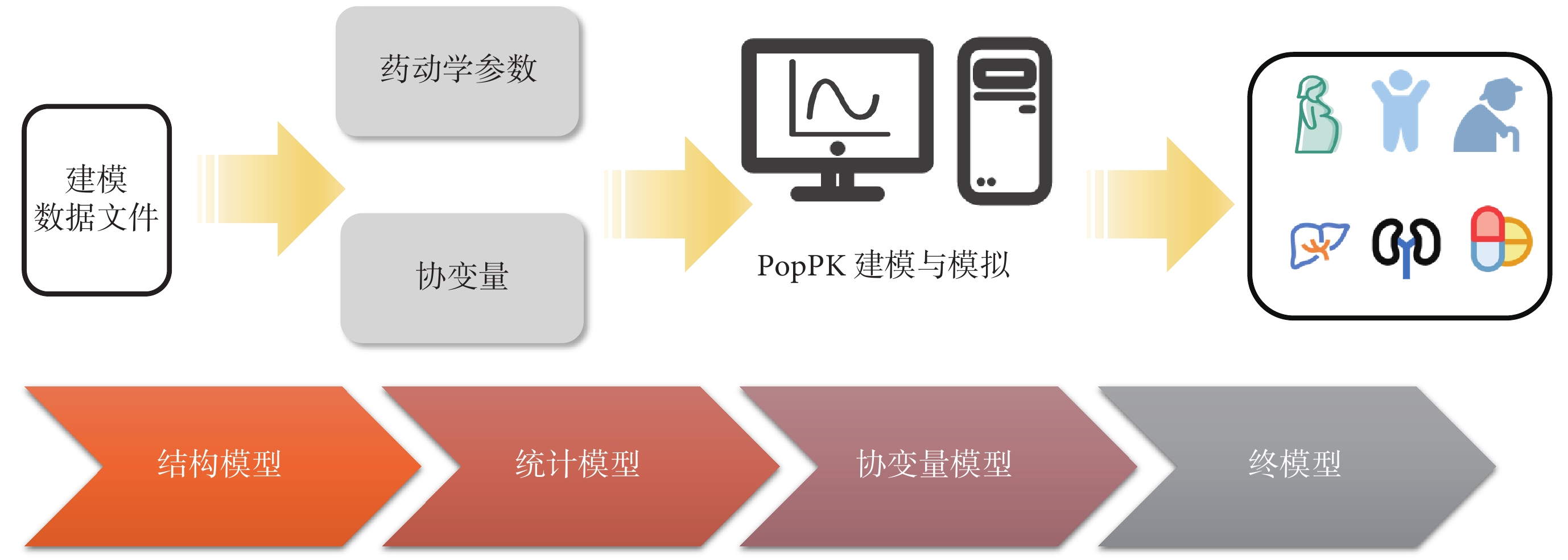 圖2
群體藥代動力學(PopPK)在虛擬臨床試驗中的應用
圖2
群體藥代動力學(PopPK)在虛擬臨床試驗中的應用
2.1 劑量選擇
利用PopPK進行建模與模擬是新藥臨床試驗中Ⅱ、Ⅲ期劑量選擇的重要參考工具。PopPK通過使用數學模型來定量描述血藥濃度與各種協變量之間的關系,可以模擬不同給藥劑量、給藥頻率以及協變量變化時的藥物暴露量情況,為藥物臨床試驗的劑量選擇提供有效信息。
案例1:Li等[12]基于76名健康的中國志愿者進行隨機、雙盲、安慰劑對照的劑量遞增試驗建立相關PopPK模型,探索磷脂酸丙戊酸(DP-VPA)的劑量選擇。該模型使用二室模型描述DP-VPA及其代謝產物的PK行為,并采用中樞神經系統不良藥物反應來評估安全性。研究結果顯示,DP-VPA及其代謝產物的PK行為受給藥劑量及性別的顯著影響,且高劑量給藥(2 400 mg)易引發嚴重的神經系統不良反應。最終,由于DP-VPA在600~2 400 mg的單次給藥劑量下表現良好的耐受性,且表現非線性PK行為,研究推薦在后續安全性和有效性研究中使用900~1 200 mg劑量。此研究為DP-VPA的臨床試驗劑量選擇做出初步建議,有助于后期進一步研究的開展。
案例2:Kloop-Schulze等[13]基于一項隨機雙盲安慰劑對照的Ⅰ期臨床試驗(NCT03676322),總結了免疫抑制劑恩帕塔蘭的PopPK模型。該模型基于帶有吸收滯后時間的一級消除過程,采用二室模型描述了恩帕塔蘭的PK行為,描述了不同給藥方案對其免疫抑制有效血漿藥物濃度維持時間的影響。研究結果顯示,在健康受試者中100 mg一日兩次的恩帕塔蘭可以實現24 h有效濃度的維持。而對于新型冠狀病毒肺炎(新冠)患者,50 mg一日兩次的方案更為推薦,有利于避免對抗病毒免疫的干擾和細胞因子風暴。此項PopPK 研究結果為后續確證性臨床試驗劑量選擇,以及新冠感染人群用藥方案選擇提供了基礎,加速了該藥的臨床研發。
案例3:Stanczyk等[14]采用了先前一項隨機臨床試驗ATI-CL14(NCT01243580)中36位健康受試者的數據,基于PopPK模型預測了在健康女性中長期使用經皮避孕貼TWIRLA?(LNG/EE TDS)后左炔諾孕酮(LNG)和乙炔雌二醇(EE)的暴露情況,進而判斷長期使用LNG/EE TDS的有效性和安全性。結果發現,連續12周、3個周期的LNG/EE TDS(每周使用1片透皮貼劑,連續3周后間歇1周)可以達到傳統避孕藥物的使用效果,同時安全性良好、使用者依從性高。此項PopPK研究豐富了原有Ⅰ期臨床試驗結果,為LNG/EE TDS的后續研究開展提供劑量選擇基礎。
2.2 特殊人群給藥劑量和試驗設計
PopPK也可用于特殊群體的劑量設計。由于此模型可以在臨床數據中分析年齡、生理病理狀態等多種協變量對目標藥物PK參數的影響,故而可以獲得有關特定疾病中藥物暴露的寶貴信息,例如妊娠婦女、兒童、老年人、肝臟或腎功能受損患者的藥物暴露情況,并幫助確定這些人群最合適的治療和劑量方案[15]。
2.2.1 妊娠婦女
女性在妊娠期間應盡量避免使用藥物,但90%的孕婦在妊娠期仍至少使用過一種藥物[16]。由于妊娠婦女的特殊性,這類人群普遍被排除在藥物臨床試驗之外,導致妊娠婦女相關臨床研究的數據空缺。首先,由于妊娠婦女的生理特點較未懷孕健康女性使用同等劑量藥物后會產生差異性后果[17-18],簡單地套用男性或非妊娠婦女的用藥方案是不合理的。在妊娠期間,女性會經歷各種生理適應,包括血容量、心輸出量和心率的增加、氧氣消耗量和潮氣量的增加、黃體酮和雌激素水平的升高、葡萄糖代謝、脂質代謝和能量消耗的改變等[19]。其次,胎兒的發育尚不完全,腦組織發育尚不成熟,且許多藥物可以穿透胎盤屏障,藥物暴露可能對胎兒造成嚴重毒副作用[20]。此外,妊娠婦女相關藥物臨床試驗還存在倫理問題,如受試者招募的困難性、臨床獲益和風險平衡以及受試者保護體系的不完善等。這些問題進一步限制了相關臨床試驗的開展。在過去幾年中,PopPK的應用得到了快速發展,為妊娠婦女患者群體的用藥提供指導[21]。
案例4:Wang等[22]基于51例接受拉莫三嗪治療的妊娠癲癇患者的臨床數據,建立了拉莫三嗪在癲癇孕婦中的PopPK模型,并使用額外的11例患者數據進行模型驗證。PopPK分析表明,妊娠期間雌激素譜的變化是拉莫三嗪清除率顯著變異的主要原因。UGT2B7 rs4356975 CT或TT基因型攜帶者所需的拉莫三嗪劑量需要增加33%~50%才能達到治療目標濃度。此項研究的PopPK模型結果表明,為最大可能減少孕期癲癇發作和藥物的子宮內暴露,1.37~3.44 mg/L的給藥濃度相較于傳統的2.5~15.0 mg/L更為合理。本研究為癲癇孕婦的藥物治療提供參考,基于雌激素譜和藥物遺傳學建立的模型可作為妊娠期拉莫三嗪給藥方案的基礎,進一步降低孕婦群體暴露在臨床試驗中風險。
2.2.2 兒童人群
兒童的生理特點與成年人有較大差距。首先,兒童的血腦屏障尚未發育完善,藥物穿透血腦屏障相對容易;其次,從新生兒到嬰兒,其體內含水量從80%逐漸下降至60%,而脂肪含量由2%上升至25%,影響水溶性藥物和脂溶性藥物的分布;此外,新生兒腎血流量僅占心輸出量5%,遠低于成年人,影響藥物的代謝和排出速度等[23-24]。總的來看,兒童的給藥除體重、年齡等因素還應綜合考量其特異的生理狀態,制定區別于成人的給藥方案。然而,兒童臨床試驗的展開具有眾多難點。在倫理要求層面,在兒童臨床試驗中應尊重受試者的意愿,長期隨訪以評估長期影響,格外關注受試者的心理狀態和監護人的意愿等,使得臨床數據的收集較成年人困難[25]。此外,大型兒科試驗的開展受限、適合兒童的劑型欠缺以及漫長的審查過程同樣是現如今兒童臨床試驗開展的困境[26]。近年來,PopPK模型技術的成熟和應用可以優化試驗方案,減輕患者負擔,指導兒科用藥,為兒童藥物臨床試驗帶來更多可能[27]。
案例5:Maharaj等[28]基于一項兒童奧氮平的臨床試驗(NCT01431326),收集了45例奧氮平的兒童使用者的83份血漿樣本,采用線性消除的一室模型對數據擬合,建立了奧氮平在兒童中腸道給藥的PopPK模型,描述了不同發育階段兒童的奧氮平PK行為變異。初步研究顯示,體重和經后年齡(postmenstrual age,PMA)為表征奧氮平表觀清除率變化的關鍵協變量,對年齡≤6個月或體重<15 kg的兒童使用體重標準化劑量:年齡≤6個月者,推薦使用
2.2.3 老年人群
老年人群的具體年齡劃分長期受到爭議。根據最廣泛認可的標準,老年人被定義為年齡>65周歲的群體[29]。由于身體機能退化如免疫力下降、心腎功能下降等[30],以及身體構成改變,如脂肪含量的上升和骨骼肌肉的顯著損失等[31],老年人群用藥后藥物的PK行為與65歲以下成年人群有較大差異。與此同時,老年人群用藥普遍,且容易出現合并癥,用藥需求大[32]。然而,由于研究機構的排斥,以及健康受損的風險、服藥依從度不高等問題,老年人群,尤其是65歲以上老年人很少參與藥物臨床試驗,不利于老年患者治療和護理水平的提升[33]。近年來,PopPK技術憑借其較小的樣本需求和對協變量的優異處理能力,為老年人群的藥物臨床試驗以及精準用藥提供了新思路。
案例6:Usman等[34]基于178例65~94歲使用美羅培南的老年患者血藥濃度數據,建立二室模型模擬美羅培南在老年人群中的PK行為。研究顯示,老年人群對美羅培南的清除率為5.27 L/h,低于健康志愿者的15.2 L/h。但美羅培南為親水藥物,主要通過腎臟代謝,通過數據分析發現這種清除率的下降主要與其腎功能下降有關,年齡對清除率沒有額外影響。因此,對高齡患者的美羅培南使用應主要依據其腎功能狀態而非年齡進行劑量調整。
2.2.4 肝、腎功能不全患者
肝、腎功能損害是普通人群中常見的病癥。據估計,2017年全球肝病發病率約為1.5億人,慢性腎病發病率約為0.7億[35]。同時,由于肝、腎功能是決定藥物暴露量的重要因素,肝、腎功能受損患者用藥的PK特征常發生改變,從而需要調整給藥方案。對于通過腎臟排出或部分排出的藥物,腎功能減退將減少藥物或其代謝物的排泄,進而導致藥物蓄積和暴露增加,產生毒副作用;肝臟對藥物的代謝激活、毒性代謝物的解毒以及藥物的排泄等過程都至關重要,肝臟代謝能力下降將對藥物暴露劑量產生深遠影響[36]。對肝、腎功能不全人群進行特異的PK行為評估,調整給藥方案是合理且必要的。然而,肝、腎功能不全人群的臨床藥理試驗開展具有諸多難點:(1)已有的臨床數據基礎小,且肝、腎功能不全人群較為分散,很難大規模地開展臨床試驗;(2)試驗設計具有倫理難點,減少藥物劑量可能導致暴露不足、病情進展,而全劑量治療可能產生嚴重的毒副作用;(3)患者的PK行為還受到藥物相互作用、年齡、生活習慣、種族等多種因素影響,對數據的分析容易受到其他因素干擾,且很難實現針對性個體化給藥等。由于PopPK模型僅需要較少的臨床樣本,且可以同時處理眾多協變量,其在肝、腎功能不全相關藥物臨床試驗中的應用可以突破上述的諸多困難和限制,因此受到了越來越多的關注。
案例7:Purohit等[37]基于5項臨床試驗(NCT04037865,NCT04016077,NCT02309827,NCT02684760,NCT02969044)分別分析了JAK3/TEC抑制劑利特昔替尼在肝、腎功能不全患者和健康群體的PK數據,采用二室模型對PK特征進行模擬,最終得到利特昔替尼在肝、腎功能不全人群中的PopPK模型。基于PopPK模型,利特昔替尼在輕、中度肝、腎功能不全受試者及健康受試者之間的血藥濃度-時間曲線下面積(area under the plasma concentration curve, AUC)和最大血漿濃度(peak concentration,Cmax)均無明顯差異,不需要對在肝、腎功能不全患者中進行劑量調整。該研究豁免了利特昔替尼在肝、腎功能不全患者的臨床試驗。
2.3 藥物-藥物相互作用
在臨床治療中,常常同時或先后使用兩種或多種藥物(即藥物組合)進行治療,以提升療效或減少藥物副作用。然而,不同藥物組合可能影響藥物的吸收、分布、代謝和排泄等體內動力學過程,進而影響療效。因此,對DDIs的全面深入了解是合理高效聯合用藥的基礎[38]。然而,由于傳統試驗方法成本高、周期長,因此,開發有效的計算模型來推斷潛在的DDIs具有重要意義。近年來,為了預測未知的 DDIs,研究人員建立了許多計算模型,比如PopPK模型。將伴隨藥物視作潛在的協變量,PopPK模型可以預測伴隨藥物對目標藥物的PK行為影響程度,進而預測藥物相互作用[39]。
案例8: Kirschbrown等[40]基于72例HER2陽性早期乳腺癌化療患者的數據,使用兩室線性PopPK模型評估了帕妥珠單抗和曲妥珠單抗之間的藥代動力學DDIs,以及早期乳腺癌患者化療過程中兩種化療藥物之間可能存在的相互作用。研究結果顯示,帕妥珠單抗與曲妥珠單抗之間不存在有臨床意義的DDIs。因此,與曲妥珠單抗和早期乳腺癌化療方案聯合使用時,無需調整帕妥珠單抗劑量。
2.4 種族差異
在當前藥物研發和臨床試驗全球化的背景下,探討種族差異對藥物代謝和清除等PK行為的影響非常重要。由于遺傳因素和生活環境差異,不同種族群體體內的藥物代謝酶和轉運蛋白具有多態性,或對藥物的PK特性以及藥效產生影響[41]。因此,在藥物通過特定種族群體的臨床試驗后,將推薦劑量直接套用至另一種族可能會提高或降低療效和不良反應。然而,在不同種族群體之間展開臨床試驗需要大量的時間成本和資金投入,傳統的實驗學方法難以滿足試驗需求。因此, PopPK逐漸發展為藥物種族PK行為差異研究的重要手段。
案例9:Li等[42]基于671例不同種族的HER2 陽性局部晚期或轉移性乳腺癌患者的臨床數據,采用非房室模型擬合,得到其不同種族間的曲妥珠單抗埃坦新(trastuzumab emtansine,T-DM1)PK參數,描述種族間變異性。根據研究結果,種族并非影響T-DM1的PK行為的重要參數,大多數亞洲人都可以繼續使用T-DM1的全球人群推薦劑量。該研究為藥物的跨種族用藥方案優化提供了研究基礎,有利于全球視角下精準用藥的推進。
3 目前存在的問題
PopPK模型在藥物臨床試驗中應用范圍廣泛,可以通過綜合分析復雜協變量來探索不同群體之間由于年齡、性別、病理生理狀態等因素差異帶來的藥物PK行為變異性。這為藥物臨床試驗提供了有效信息,同時促進了精準用藥和個性化治療。同時,作為學習模型,PopPK在建模后可以通過數據驗證和擬合修正不斷地優化模型,進而提升準確性。然而,PopPK模型的發展仍處于起步階段,其臨床應用還存在一些局限。
首先,在技術層面上。PopPK研究依賴于群體PK數據而非個體患者完整PK數據,并且模型通常基于假設和簡化,無法完全反映藥物PK行為的全部變異性,對特定患者的藥物PK行為代表性有限。PopPK模型通常基于一些假設和簡化來處理數據。例如,其可能假設患者之間的藥物分布和消除過程是相似的,忽略了個體差異。第二,為了充分模擬研究人群的PK特點,盡管比傳統臨床試驗需要的受試者數量少,模型仍然需要一定的樣本量,從而在罕見疾病或特定亞群的研究中,數據收集也可能會面臨困難[43]。第三,模型的驗證對于確保其準確性和可靠性至關重要,但由于現實世界數據的有限性和模型的復雜性,模型的驗證過程也具有挑戰。構建PopPK模型的數據可能包含各種不確定性和噪聲。因此,確保基礎數據的質量和準確性對于模型的可靠性至關重要。如果數據質量不高,模型的預測結果可能會受到影響。由于PopPK模型的復雜性,其內部結構和參數設置可能相對較難理解,導致模型的解釋和解讀更加困難,特別是對于非專業人士來說。這也增加了在臨床應用中解釋和傳達模型結果的挑戰。第四,在國家監管和政策規定層面上。目前,不同國家和地區對于PopPK模型的應用可能存在不同的要求和審批流程。一些國家可能要求模型通過臨床試驗驗證,而另一些國家可能在審核后接受模型的推斷結果作為輔助決策依據。此外,一些國家還可能要求模型的可解釋性和透明度。這給PopPK模型的臨床應用帶來了一定的限制和挑戰。最后,需要注意的是,并非所有藥物都適用于PopPK模型。某些藥物的PK特征可能與人群之間的差異較大,或者數據收集方面存在困難,這可能導致PopPK模型的應用受到限制。
4 結語
隨著時代發展,醫學、藥學和計算機等多學科交叉和融合成為必然趨勢,個性化醫療和精準用藥日益受到關注。在藥物的臨床試驗中,以PopPK為代表的VCT技術的應用可以分析目標人群的PK行為差異,優化給藥方案,實現基于少量樣本的有效數據分析。譬如,案例4基于51例臨床數據構建的PopPK模型分析了妊娠婦女的拉莫三嗪PK行為特點,提出了相較傳統給藥方案更低的劑量推薦方案,減少了胎兒的暴露風險。然而,由于較簡化的數據處理方式、對復雜情況的模擬難度等因素,PopPK技術領域仍存在諸多問題亟待解決。此外,國內外尚缺乏對于PopPK倫理學問題的詳細闡述。加之上述提到的技術難題,PopPK技術目前只能替代少部分傳統臨床試驗。整體而言,PopPK技術的發展尚處于起步階段,需要通過廣泛的臨床實踐驗證、優化、完善。在未來,隨著技術的不斷進步和研究方法的不斷創新,PopPK技術將在臨床試驗中發揮越來越重要的作用。
利益沖突:無。
作者貢獻:張玉明整理文獻、撰寫論文;劉懿賢提出文章初步構思、設計文章框架、修改論文;鄭莉提出文章選題、修改論文、終審文章。所有作者均參與本文章框架討論及修訂。所有作者都閱讀并同意本文章的最終文本。
藥物臨床試驗是評估新藥的藥代動力學(pharmacokinetics,PK)、安全性及有效性的醫學科學研究[1]。藥物臨床試驗既是確保新藥物安全有效的重要步驟,也是藥物研發過程中不可或缺的環節,可以為臨床提供更多的治療選擇,改善患者的生活質量。然而,傳統臨床試驗具有成本高昂、研發周期漫長等問題。臨床試驗的投入約占藥物研發總費用的67%[2]。同時,其是新藥研發過程中耗時最長的階段,藥物在臨床試驗階段往往需要6~10年。實際情況可能因藥物特性、疾病類型、患者招募等因素而有所差異。此外,當受試者個體差異較大或臨床樣本難以獲得時,臨床試驗的實施將更加困難。因此,迫切需要新方法、技術服務于臨床試驗。在這樣的背景下,虛擬臨床試驗(virtual clinical trials,VCT)應運而生。VCT是指通過數學模型模擬臨床試驗過程,獲取藥物PK、有效性和安全性相關數據,對影響因素進行分析,進而使用計算機模擬的方式開展或輔助臨床試驗[3]。當前,群體藥代動力學(population pharmacokinetics,PopPK)作為其中一種重要的方法,在VCT領域已廣泛應用[4]。PopPK是一種用于研究藥物在不同個體(或群體)體內的吸收、分布、代謝和排泄(absorption,distribution,metabolism and excretion,ADME)過程的研究方法[5]。其核心在于識別和量化影響藥物PK的內在和外在因素,如性別、年齡、病理狀態和合并用藥情況等。目前,PopPK主要采用非線性混合效應模型方法(nonlinear mixed-effects modeling,NLME)構建模型,以獲得PK參數的群體典型值,同時量化影響群體參數的協變量[6](圖1)。目前,PopPK在模型引導的藥物研發和VCT中發揮重要作用。其通過計算機模擬實現對真實世界數據的高效利用,不僅可以實現對目標人群代謝數據的整合,還可以個體化地分析藥物代謝差異,豁免或減少臨床試驗風險、提高結果準確性。PopPK在提供個體化治療方案、優化藥物療效和安全性、特殊人群藥物管理、降低試驗成本和風險以及提高試驗效率等多個方面發揮重要作用,對藥物研發和臨床應用具有重要的指導意義和推動作用。
 圖1
模型建立過程
圖1
模型建立過程
PopPK:群體藥代動力學;DDIs:藥物-藥物相互作用
PopPK技術為臨床試驗中的重要研究方法之一。通過PopPK分析,研究人員可以更好地理解藥物在不同特征群體中的動力學特點。PopPK在優化劑量方案、個體化用藥等方面有重要應用。此外,PopPK可協助識別潛在的藥物-藥物相互作用(drug-drug interactions,DDIs),預測特定人群(如兒童、老年人、腎臟或肝臟功能不全患者)中藥物的ADME等特點,為個體化精準用藥提供參考與借鑒。
1 PopPK的產生和內涵
藥物在人體內發揮藥理作用受到藥物代謝過程的影響,而藥物的PK行為在不同個體之間可能存在差異。眾多內在、外在因素(協變量)如性別、年齡、體重、基礎疾病或聯合用藥等都可改變PK行為。因此,當這些影響因素具有臨床意義時,根據患者具體生理、病理情況調整給藥方案十分必要[6]。傳統的PK研究是試驗性的,可以證明藥物的作用機制,并粗略地定量分析劑量與藥物代謝、藥效之間的聯系。然而,這種依托于臨床試驗的研究模式具有研究周期長、經費數額大、安全風險高、臨床樣本收集困難等諸多問題。同時,為盡量減少個體差異,PK研究通常在健康志愿者或經過嚴格篩選的患者身上進行,這導致所獲得數據與實際患者體內藥物行為的偏差。此外,傳統PK研究需多次采集靜脈血樣,受試者體驗差、依從性低。因此,開發臨床試驗新技術、新方法以降低研究難度成為亟待解決的問題。近年來,隨著計算機科學技術的發展,PopPK等建模與模擬技術逐漸成為藥物臨床試驗方法發展的重要方向。PopPK的方法最早由Sheiner及其同事[7]于20世紀70年代首次提出,并應用在地高辛的小樣本PK行為分析中。此方法并不依賴于傳統手段中的多點密集采樣,使得基于少量血漿樣本分析藥物濃度-時間曲線和人群變異性成為可能[8]。PopPK采用非線性混合效應模型基于群體水平研究PK,不僅可獲得目標群體的典型PK參數,還可識別并量化影響PK參數的協變量因素,具備對復雜影響因素的良好整合能力。非線性指因變量(如濃度)與模型參數和自變量呈非線性關系,混合效應指參數化:不因個體差異變化的參數稱固定效應,因個體差異變化的參數稱隨機效應[9]。PopPK模型在臨床試驗中有一定優勢:(1)允許海量不同虛擬給藥方案的快速探索,從而輔助確定臨床試驗方案[10];(2)可捕獲由于人群差異導致的PK參數分布差異;(3)預測不同劑量對血漿生物標志物水平的影響以及協變量在人群層面的影響,促進個性化給藥方案的提出[11]。
2 PopPK在臨床試驗中的應用
基于上述提及的眾多優勢,PopPK逐漸成為新藥臨床試驗中的重要方法,在藥物的劑量選擇、特殊人群部分豁免、DDIs及種族差異分析等傳統PK試驗難以開展的方面發揮重要作用(圖2)。
 圖2
群體藥代動力學(PopPK)在虛擬臨床試驗中的應用
圖2
群體藥代動力學(PopPK)在虛擬臨床試驗中的應用
2.1 劑量選擇
利用PopPK進行建模與模擬是新藥臨床試驗中Ⅱ、Ⅲ期劑量選擇的重要參考工具。PopPK通過使用數學模型來定量描述血藥濃度與各種協變量之間的關系,可以模擬不同給藥劑量、給藥頻率以及協變量變化時的藥物暴露量情況,為藥物臨床試驗的劑量選擇提供有效信息。
案例1:Li等[12]基于76名健康的中國志愿者進行隨機、雙盲、安慰劑對照的劑量遞增試驗建立相關PopPK模型,探索磷脂酸丙戊酸(DP-VPA)的劑量選擇。該模型使用二室模型描述DP-VPA及其代謝產物的PK行為,并采用中樞神經系統不良藥物反應來評估安全性。研究結果顯示,DP-VPA及其代謝產物的PK行為受給藥劑量及性別的顯著影響,且高劑量給藥(2 400 mg)易引發嚴重的神經系統不良反應。最終,由于DP-VPA在600~2 400 mg的單次給藥劑量下表現良好的耐受性,且表現非線性PK行為,研究推薦在后續安全性和有效性研究中使用900~1 200 mg劑量。此研究為DP-VPA的臨床試驗劑量選擇做出初步建議,有助于后期進一步研究的開展。
案例2:Kloop-Schulze等[13]基于一項隨機雙盲安慰劑對照的Ⅰ期臨床試驗(NCT03676322),總結了免疫抑制劑恩帕塔蘭的PopPK模型。該模型基于帶有吸收滯后時間的一級消除過程,采用二室模型描述了恩帕塔蘭的PK行為,描述了不同給藥方案對其免疫抑制有效血漿藥物濃度維持時間的影響。研究結果顯示,在健康受試者中100 mg一日兩次的恩帕塔蘭可以實現24 h有效濃度的維持。而對于新型冠狀病毒肺炎(新冠)患者,50 mg一日兩次的方案更為推薦,有利于避免對抗病毒免疫的干擾和細胞因子風暴。此項PopPK 研究結果為后續確證性臨床試驗劑量選擇,以及新冠感染人群用藥方案選擇提供了基礎,加速了該藥的臨床研發。
案例3:Stanczyk等[14]采用了先前一項隨機臨床試驗ATI-CL14(NCT01243580)中36位健康受試者的數據,基于PopPK模型預測了在健康女性中長期使用經皮避孕貼TWIRLA?(LNG/EE TDS)后左炔諾孕酮(LNG)和乙炔雌二醇(EE)的暴露情況,進而判斷長期使用LNG/EE TDS的有效性和安全性。結果發現,連續12周、3個周期的LNG/EE TDS(每周使用1片透皮貼劑,連續3周后間歇1周)可以達到傳統避孕藥物的使用效果,同時安全性良好、使用者依從性高。此項PopPK研究豐富了原有Ⅰ期臨床試驗結果,為LNG/EE TDS的后續研究開展提供劑量選擇基礎。
2.2 特殊人群給藥劑量和試驗設計
PopPK也可用于特殊群體的劑量設計。由于此模型可以在臨床數據中分析年齡、生理病理狀態等多種協變量對目標藥物PK參數的影響,故而可以獲得有關特定疾病中藥物暴露的寶貴信息,例如妊娠婦女、兒童、老年人、肝臟或腎功能受損患者的藥物暴露情況,并幫助確定這些人群最合適的治療和劑量方案[15]。
2.2.1 妊娠婦女
女性在妊娠期間應盡量避免使用藥物,但90%的孕婦在妊娠期仍至少使用過一種藥物[16]。由于妊娠婦女的特殊性,這類人群普遍被排除在藥物臨床試驗之外,導致妊娠婦女相關臨床研究的數據空缺。首先,由于妊娠婦女的生理特點較未懷孕健康女性使用同等劑量藥物后會產生差異性后果[17-18],簡單地套用男性或非妊娠婦女的用藥方案是不合理的。在妊娠期間,女性會經歷各種生理適應,包括血容量、心輸出量和心率的增加、氧氣消耗量和潮氣量的增加、黃體酮和雌激素水平的升高、葡萄糖代謝、脂質代謝和能量消耗的改變等[19]。其次,胎兒的發育尚不完全,腦組織發育尚不成熟,且許多藥物可以穿透胎盤屏障,藥物暴露可能對胎兒造成嚴重毒副作用[20]。此外,妊娠婦女相關藥物臨床試驗還存在倫理問題,如受試者招募的困難性、臨床獲益和風險平衡以及受試者保護體系的不完善等。這些問題進一步限制了相關臨床試驗的開展。在過去幾年中,PopPK的應用得到了快速發展,為妊娠婦女患者群體的用藥提供指導[21]。
案例4:Wang等[22]基于51例接受拉莫三嗪治療的妊娠癲癇患者的臨床數據,建立了拉莫三嗪在癲癇孕婦中的PopPK模型,并使用額外的11例患者數據進行模型驗證。PopPK分析表明,妊娠期間雌激素譜的變化是拉莫三嗪清除率顯著變異的主要原因。UGT2B7 rs4356975 CT或TT基因型攜帶者所需的拉莫三嗪劑量需要增加33%~50%才能達到治療目標濃度。此項研究的PopPK模型結果表明,為最大可能減少孕期癲癇發作和藥物的子宮內暴露,1.37~3.44 mg/L的給藥濃度相較于傳統的2.5~15.0 mg/L更為合理。本研究為癲癇孕婦的藥物治療提供參考,基于雌激素譜和藥物遺傳學建立的模型可作為妊娠期拉莫三嗪給藥方案的基礎,進一步降低孕婦群體暴露在臨床試驗中風險。
2.2.2 兒童人群
兒童的生理特點與成年人有較大差距。首先,兒童的血腦屏障尚未發育完善,藥物穿透血腦屏障相對容易;其次,從新生兒到嬰兒,其體內含水量從80%逐漸下降至60%,而脂肪含量由2%上升至25%,影響水溶性藥物和脂溶性藥物的分布;此外,新生兒腎血流量僅占心輸出量5%,遠低于成年人,影響藥物的代謝和排出速度等[23-24]。總的來看,兒童的給藥除體重、年齡等因素還應綜合考量其特異的生理狀態,制定區別于成人的給藥方案。然而,兒童臨床試驗的展開具有眾多難點。在倫理要求層面,在兒童臨床試驗中應尊重受試者的意愿,長期隨訪以評估長期影響,格外關注受試者的心理狀態和監護人的意愿等,使得臨床數據的收集較成年人困難[25]。此外,大型兒科試驗的開展受限、適合兒童的劑型欠缺以及漫長的審查過程同樣是現如今兒童臨床試驗開展的困境[26]。近年來,PopPK模型技術的成熟和應用可以優化試驗方案,減輕患者負擔,指導兒科用藥,為兒童藥物臨床試驗帶來更多可能[27]。
案例5:Maharaj等[28]基于一項兒童奧氮平的臨床試驗(NCT01431326),收集了45例奧氮平的兒童使用者的83份血漿樣本,采用線性消除的一室模型對數據擬合,建立了奧氮平在兒童中腸道給藥的PopPK模型,描述了不同發育階段兒童的奧氮平PK行為變異。初步研究顯示,體重和經后年齡(postmenstrual age,PMA)為表征奧氮平表觀清除率變化的關鍵協變量,對年齡≤6個月或體重<15 kg的兒童使用體重標準化劑量:年齡≤6個月者,推薦使用
2.2.3 老年人群
老年人群的具體年齡劃分長期受到爭議。根據最廣泛認可的標準,老年人被定義為年齡>65周歲的群體[29]。由于身體機能退化如免疫力下降、心腎功能下降等[30],以及身體構成改變,如脂肪含量的上升和骨骼肌肉的顯著損失等[31],老年人群用藥后藥物的PK行為與65歲以下成年人群有較大差異。與此同時,老年人群用藥普遍,且容易出現合并癥,用藥需求大[32]。然而,由于研究機構的排斥,以及健康受損的風險、服藥依從度不高等問題,老年人群,尤其是65歲以上老年人很少參與藥物臨床試驗,不利于老年患者治療和護理水平的提升[33]。近年來,PopPK技術憑借其較小的樣本需求和對協變量的優異處理能力,為老年人群的藥物臨床試驗以及精準用藥提供了新思路。
案例6:Usman等[34]基于178例65~94歲使用美羅培南的老年患者血藥濃度數據,建立二室模型模擬美羅培南在老年人群中的PK行為。研究顯示,老年人群對美羅培南的清除率為5.27 L/h,低于健康志愿者的15.2 L/h。但美羅培南為親水藥物,主要通過腎臟代謝,通過數據分析發現這種清除率的下降主要與其腎功能下降有關,年齡對清除率沒有額外影響。因此,對高齡患者的美羅培南使用應主要依據其腎功能狀態而非年齡進行劑量調整。
2.2.4 肝、腎功能不全患者
肝、腎功能損害是普通人群中常見的病癥。據估計,2017年全球肝病發病率約為1.5億人,慢性腎病發病率約為0.7億[35]。同時,由于肝、腎功能是決定藥物暴露量的重要因素,肝、腎功能受損患者用藥的PK特征常發生改變,從而需要調整給藥方案。對于通過腎臟排出或部分排出的藥物,腎功能減退將減少藥物或其代謝物的排泄,進而導致藥物蓄積和暴露增加,產生毒副作用;肝臟對藥物的代謝激活、毒性代謝物的解毒以及藥物的排泄等過程都至關重要,肝臟代謝能力下降將對藥物暴露劑量產生深遠影響[36]。對肝、腎功能不全人群進行特異的PK行為評估,調整給藥方案是合理且必要的。然而,肝、腎功能不全人群的臨床藥理試驗開展具有諸多難點:(1)已有的臨床數據基礎小,且肝、腎功能不全人群較為分散,很難大規模地開展臨床試驗;(2)試驗設計具有倫理難點,減少藥物劑量可能導致暴露不足、病情進展,而全劑量治療可能產生嚴重的毒副作用;(3)患者的PK行為還受到藥物相互作用、年齡、生活習慣、種族等多種因素影響,對數據的分析容易受到其他因素干擾,且很難實現針對性個體化給藥等。由于PopPK模型僅需要較少的臨床樣本,且可以同時處理眾多協變量,其在肝、腎功能不全相關藥物臨床試驗中的應用可以突破上述的諸多困難和限制,因此受到了越來越多的關注。
案例7:Purohit等[37]基于5項臨床試驗(NCT04037865,NCT04016077,NCT02309827,NCT02684760,NCT02969044)分別分析了JAK3/TEC抑制劑利特昔替尼在肝、腎功能不全患者和健康群體的PK數據,采用二室模型對PK特征進行模擬,最終得到利特昔替尼在肝、腎功能不全人群中的PopPK模型。基于PopPK模型,利特昔替尼在輕、中度肝、腎功能不全受試者及健康受試者之間的血藥濃度-時間曲線下面積(area under the plasma concentration curve, AUC)和最大血漿濃度(peak concentration,Cmax)均無明顯差異,不需要對在肝、腎功能不全患者中進行劑量調整。該研究豁免了利特昔替尼在肝、腎功能不全患者的臨床試驗。
2.3 藥物-藥物相互作用
在臨床治療中,常常同時或先后使用兩種或多種藥物(即藥物組合)進行治療,以提升療效或減少藥物副作用。然而,不同藥物組合可能影響藥物的吸收、分布、代謝和排泄等體內動力學過程,進而影響療效。因此,對DDIs的全面深入了解是合理高效聯合用藥的基礎[38]。然而,由于傳統試驗方法成本高、周期長,因此,開發有效的計算模型來推斷潛在的DDIs具有重要意義。近年來,為了預測未知的 DDIs,研究人員建立了許多計算模型,比如PopPK模型。將伴隨藥物視作潛在的協變量,PopPK模型可以預測伴隨藥物對目標藥物的PK行為影響程度,進而預測藥物相互作用[39]。
案例8: Kirschbrown等[40]基于72例HER2陽性早期乳腺癌化療患者的數據,使用兩室線性PopPK模型評估了帕妥珠單抗和曲妥珠單抗之間的藥代動力學DDIs,以及早期乳腺癌患者化療過程中兩種化療藥物之間可能存在的相互作用。研究結果顯示,帕妥珠單抗與曲妥珠單抗之間不存在有臨床意義的DDIs。因此,與曲妥珠單抗和早期乳腺癌化療方案聯合使用時,無需調整帕妥珠單抗劑量。
2.4 種族差異
在當前藥物研發和臨床試驗全球化的背景下,探討種族差異對藥物代謝和清除等PK行為的影響非常重要。由于遺傳因素和生活環境差異,不同種族群體體內的藥物代謝酶和轉運蛋白具有多態性,或對藥物的PK特性以及藥效產生影響[41]。因此,在藥物通過特定種族群體的臨床試驗后,將推薦劑量直接套用至另一種族可能會提高或降低療效和不良反應。然而,在不同種族群體之間展開臨床試驗需要大量的時間成本和資金投入,傳統的實驗學方法難以滿足試驗需求。因此, PopPK逐漸發展為藥物種族PK行為差異研究的重要手段。
案例9:Li等[42]基于671例不同種族的HER2 陽性局部晚期或轉移性乳腺癌患者的臨床數據,采用非房室模型擬合,得到其不同種族間的曲妥珠單抗埃坦新(trastuzumab emtansine,T-DM1)PK參數,描述種族間變異性。根據研究結果,種族并非影響T-DM1的PK行為的重要參數,大多數亞洲人都可以繼續使用T-DM1的全球人群推薦劑量。該研究為藥物的跨種族用藥方案優化提供了研究基礎,有利于全球視角下精準用藥的推進。
3 目前存在的問題
PopPK模型在藥物臨床試驗中應用范圍廣泛,可以通過綜合分析復雜協變量來探索不同群體之間由于年齡、性別、病理生理狀態等因素差異帶來的藥物PK行為變異性。這為藥物臨床試驗提供了有效信息,同時促進了精準用藥和個性化治療。同時,作為學習模型,PopPK在建模后可以通過數據驗證和擬合修正不斷地優化模型,進而提升準確性。然而,PopPK模型的發展仍處于起步階段,其臨床應用還存在一些局限。
首先,在技術層面上。PopPK研究依賴于群體PK數據而非個體患者完整PK數據,并且模型通常基于假設和簡化,無法完全反映藥物PK行為的全部變異性,對特定患者的藥物PK行為代表性有限。PopPK模型通常基于一些假設和簡化來處理數據。例如,其可能假設患者之間的藥物分布和消除過程是相似的,忽略了個體差異。第二,為了充分模擬研究人群的PK特點,盡管比傳統臨床試驗需要的受試者數量少,模型仍然需要一定的樣本量,從而在罕見疾病或特定亞群的研究中,數據收集也可能會面臨困難[43]。第三,模型的驗證對于確保其準確性和可靠性至關重要,但由于現實世界數據的有限性和模型的復雜性,模型的驗證過程也具有挑戰。構建PopPK模型的數據可能包含各種不確定性和噪聲。因此,確保基礎數據的質量和準確性對于模型的可靠性至關重要。如果數據質量不高,模型的預測結果可能會受到影響。由于PopPK模型的復雜性,其內部結構和參數設置可能相對較難理解,導致模型的解釋和解讀更加困難,特別是對于非專業人士來說。這也增加了在臨床應用中解釋和傳達模型結果的挑戰。第四,在國家監管和政策規定層面上。目前,不同國家和地區對于PopPK模型的應用可能存在不同的要求和審批流程。一些國家可能要求模型通過臨床試驗驗證,而另一些國家可能在審核后接受模型的推斷結果作為輔助決策依據。此外,一些國家還可能要求模型的可解釋性和透明度。這給PopPK模型的臨床應用帶來了一定的限制和挑戰。最后,需要注意的是,并非所有藥物都適用于PopPK模型。某些藥物的PK特征可能與人群之間的差異較大,或者數據收集方面存在困難,這可能導致PopPK模型的應用受到限制。
4 結語
隨著時代發展,醫學、藥學和計算機等多學科交叉和融合成為必然趨勢,個性化醫療和精準用藥日益受到關注。在藥物的臨床試驗中,以PopPK為代表的VCT技術的應用可以分析目標人群的PK行為差異,優化給藥方案,實現基于少量樣本的有效數據分析。譬如,案例4基于51例臨床數據構建的PopPK模型分析了妊娠婦女的拉莫三嗪PK行為特點,提出了相較傳統給藥方案更低的劑量推薦方案,減少了胎兒的暴露風險。然而,由于較簡化的數據處理方式、對復雜情況的模擬難度等因素,PopPK技術領域仍存在諸多問題亟待解決。此外,國內外尚缺乏對于PopPK倫理學問題的詳細闡述。加之上述提到的技術難題,PopPK技術目前只能替代少部分傳統臨床試驗。整體而言,PopPK技術的發展尚處于起步階段,需要通過廣泛的臨床實踐驗證、優化、完善。在未來,隨著技術的不斷進步和研究方法的不斷創新,PopPK技術將在臨床試驗中發揮越來越重要的作用。
利益沖突:無。
作者貢獻:張玉明整理文獻、撰寫論文;劉懿賢提出文章初步構思、設計文章框架、修改論文;鄭莉提出文章選題、修改論文、終審文章。所有作者均參與本文章框架討論及修訂。所有作者都閱讀并同意本文章的最終文本。