引用本文: 蔣捷, 劉鋒, 王波, 王芹, 鐘健. CT聯合腫瘤標志物預測肺結節低分化腺癌的模型構建. 中國胸心血管外科臨床雜志, 2025, 32(1): 73-79. doi: 10.7507/1007-4848.202408069 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
在我國,肺癌已經成為發病率以及死亡率最高的惡性腫瘤[1],其病理類型復雜多樣,最常見的為肺腺癌。2021年第5版《WHO胸部腫瘤分類》[2]根據腫瘤中的高級別成分,包括實性、微乳頭和/或復雜腺體等,將肺浸潤性腺癌分為高分化、中分化、低分化腺癌,其中高級別成分占比超過20%的腫瘤為低分化腺癌。肺低分化腺癌患者預后最差,更容易發生淋巴結轉移,該部分患者需行肺癌根治手術。因此術前篩查出低分化腺癌患者尤為重要[2-3]。目前常用的肺癌檢查方法包括血液腫瘤標志物檢驗及CT檢查。近年來多項研究已證實血液腫瘤標志物在肺癌的分期診斷中具有重要意義,包括癌胚抗原(CEA)、細胞角蛋白19片段抗原(CYFRA21-1)、神經元特異性烯醇化酶(NSE)、胃泌素釋放前體(ProGRP)、鱗狀上皮細胞癌抗原(SCC)、糖類抗原125(CA125)、糖類抗原153(CA153)、糖類抗原242(CA242)、糖類抗原199(CA199)等。另外p53、PGP9.5、SOX2、GAGE、GBU4-5、MAGE和CAGE等腫瘤相關自身抗體(autoantibodies,AABs)也對肺癌具有較好的診斷價值,部分歐美國家已將其常規用于肺癌診斷,其在中國高危人群中的篩查敏感性和特異性也達61%和90%[4-6]。
除血液檢驗外,CT由于其無創、便捷的特點已成為肺癌最有效的檢查手段,近年來由于計算機硬件的發展,人工智能在肺癌的診斷方面也開始嶄露頭角,其能力甚至可趕超傳統醫師閱片,相比于人腦,人工智能在計算力方面有極大優勢[7-8],尤其是對于人眼無法準確計算的實性成分占比、腫瘤體積等。因此本研究將聯合CT人工智能與多項腫瘤標志物,構建低分化腺癌的預測模型,以期以簡單的方法從實性或亞實性肺結節患者中預測肺低分化腺癌患者,以便盡早干預。
1 資料與方法
1.1 臨床資料和分組
納入南京醫科大學附屬腦科醫院胸外科2023年行肺結節手術患者。納入標準:(1)年齡≥18周歲;(2)結節為實性或部分實性,孤立性且最大直徑≤50 mm;(3)術后常規病理明確診斷為低分化腺癌。排除標準:(1)臨床資料缺失;(2)病理為轉移性惡性腫瘤;(3)術前接受抗腫瘤治療;(4)出現遠處轉移。按照7∶3比例將患者隨機分為訓練集和驗證集。依據術后病理結果,將患者分為低分化腺癌組和非低分化腺癌組。
1.2 研究方法
1.2.1 腫瘤標志物檢測
患者入院后術前抽取空腹晨血2 mL,在1 h內離心樣本。腫瘤標志物CEA、NSE、CYFRA21-1、SCC、ProGRP的測定采用電發光法測定試劑盒(上海羅氏診斷產品有限公司);肺癌相關抗體p53、PGP9.5、SOX2、GAGE、GBU4-5、MAGE、CAGE的測定采用酶聯免疫法七種肺癌相關抗體檢測試劑盒(杭州凱保羅生物科技有限公司)。后從電子檢驗系統采集結果。
1.2.2 CT檢查
患者入院后術前均行薄層胸部CT檢查,機器型號:Philips Incisive CT;電壓:120 kV;管電流:自動電流調節;螺距:1.0;旋轉時間:0.75 s;劑量指數:22;層厚:1 mm;建像間隔:0.75 mm;建像矩陣:512;視野:350 mm。掃描時取仰臥位,囑患者配合吸氣及屏氣,掃描范圍為頸根部至肋膈角。圖像人工智能系統為Deepwise MetAI睿影人工智能醫學輔助診斷/評估系統,其能自動檢測肺部結節,并計算生成結節大小、平均密度等指標。CT結果由2名具有10年以上經驗影像科醫師讀片、并對人工智能結果進行審核。依據CT結果記錄結節最大直徑、平均密度、是否有胸膜凹陷征以及支氣管充氣征。
1.2.3 病理檢測
所有標本均由外科手術獲得,術后立即經4%中性甲醛固定,送往病理科包埋、制片,常規蘇木精-伊紅染色,由2名具有10年以上經驗病理科醫師做出診斷,若有疑難病例,送至南京鼓樓醫院由多名專家協同診斷。部分病灶加做免疫組織化學檢測進一步明確腫瘤分化程度。術后依據常規病理結果,判斷是否為低分化腺癌。
1.3 統計學分析
采用SPSS 20.0軟件進行數據分析,符合正態分布的計量資料采用均數±標準差(x±s)表示,組間比較采用獨立樣本t檢驗;偏態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]表示,組間比較采用秩和檢驗。計數資料采用例數和百分比(%)表示,組間比較采用χ2檢驗。使用R語言行預測模型分析,對所有可能的危險因素行單因素分析,對P<0.1的因素行二元logistic回歸分析。使用“rms”程序繪制列線圖,“pROC”程序繪制受試者工作特征(receiver operating characteristic,ROC)曲線并計算曲線下面積(area under the curve,AUC),“CalibrationCurves”程序繪制校準曲線,“ggDCA”程序繪制臨床決策曲線。雙側檢驗水準α=0.05。
1.4 倫理審查
本研究通過南京腦科醫院醫學倫理委員會審批,審批號:2023-KY077-01。
2 結果
2.1 單因素分析結果
共納入299例患者,其中男103例、女196例,中位年齡57.00(51.00,67.25)歲;訓練集211例,驗證集88例。訓練集低分化腺癌組24例,非低分化腺癌組187例。對訓練集各因子采用單因素分析,結果顯示,兩組患者性別、PGP9.5、SOX2、GAGE、GBU4-5、MAGE、CAGE、NSE、SCC、ProGRP、胸膜凹陷征、支氣管充氣征差異無統計學意義(P>0.05);而年齡、p53、CEA、CYFRA21-1、腫瘤最大直徑、腫瘤平均密度差異有統計學意義(P<0.05);見表1。
2.2 多因素分析結果
將以上P<0.1的因子納入多因素回歸分析,結果顯示CEA(P=0.002)、CYFRA21-1(P=0.035)、腫瘤最大直徑(P=0.017)以及腫瘤平均密度(P=0.040)是實性或部分實性肺結節為低分化腺癌的危險因素,均呈正相關;見表2。
2.3 列線圖構建
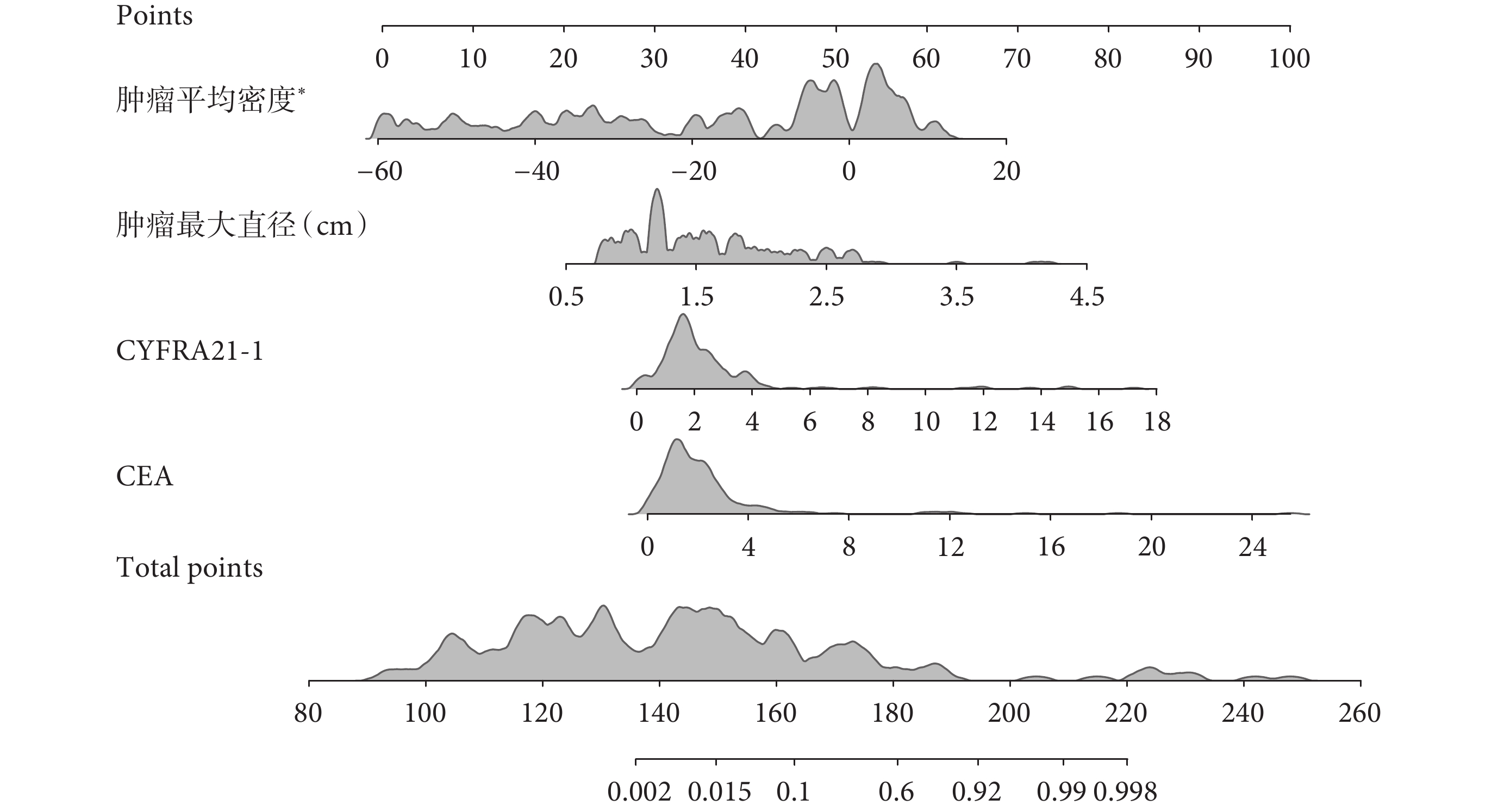
將上述獨立危險因素納入列線圖模型,記錄患者CEA、CYFRA21-1、腫瘤最大直徑以及腫瘤平均密度值,及其對應的列線圖評分,可根據總分預測患者低分化腺癌概率;見圖1。
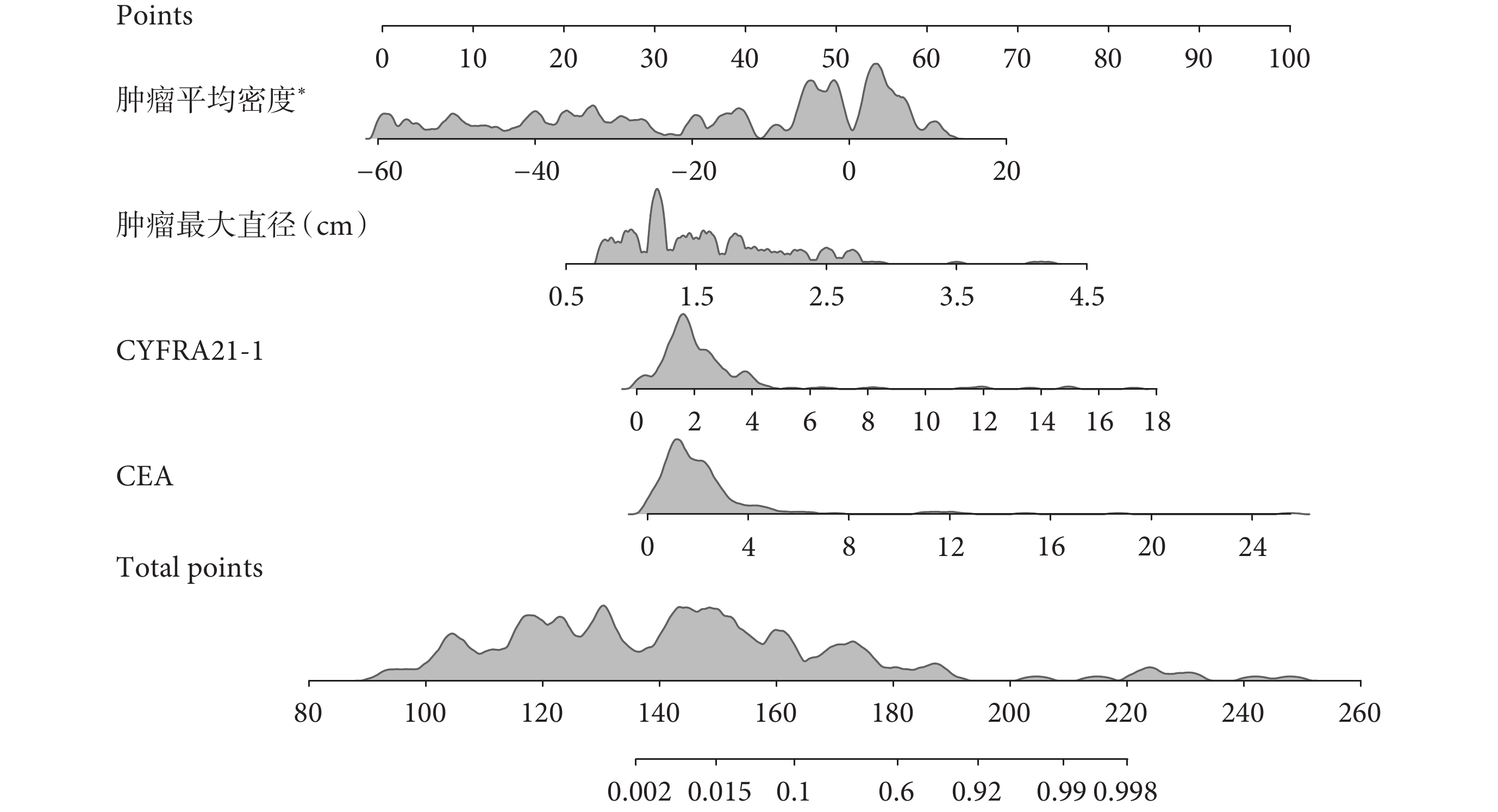 圖1
實性或部分實性肺結節低分化腺癌列線圖模型
圖1
實性或部分實性肺結節低分化腺癌列線圖模型
*:單位為每10 HU;CEA:癌胚抗原;CYFRA21-1:細胞角蛋白19片段抗原
2.4 模型的驗證及效能
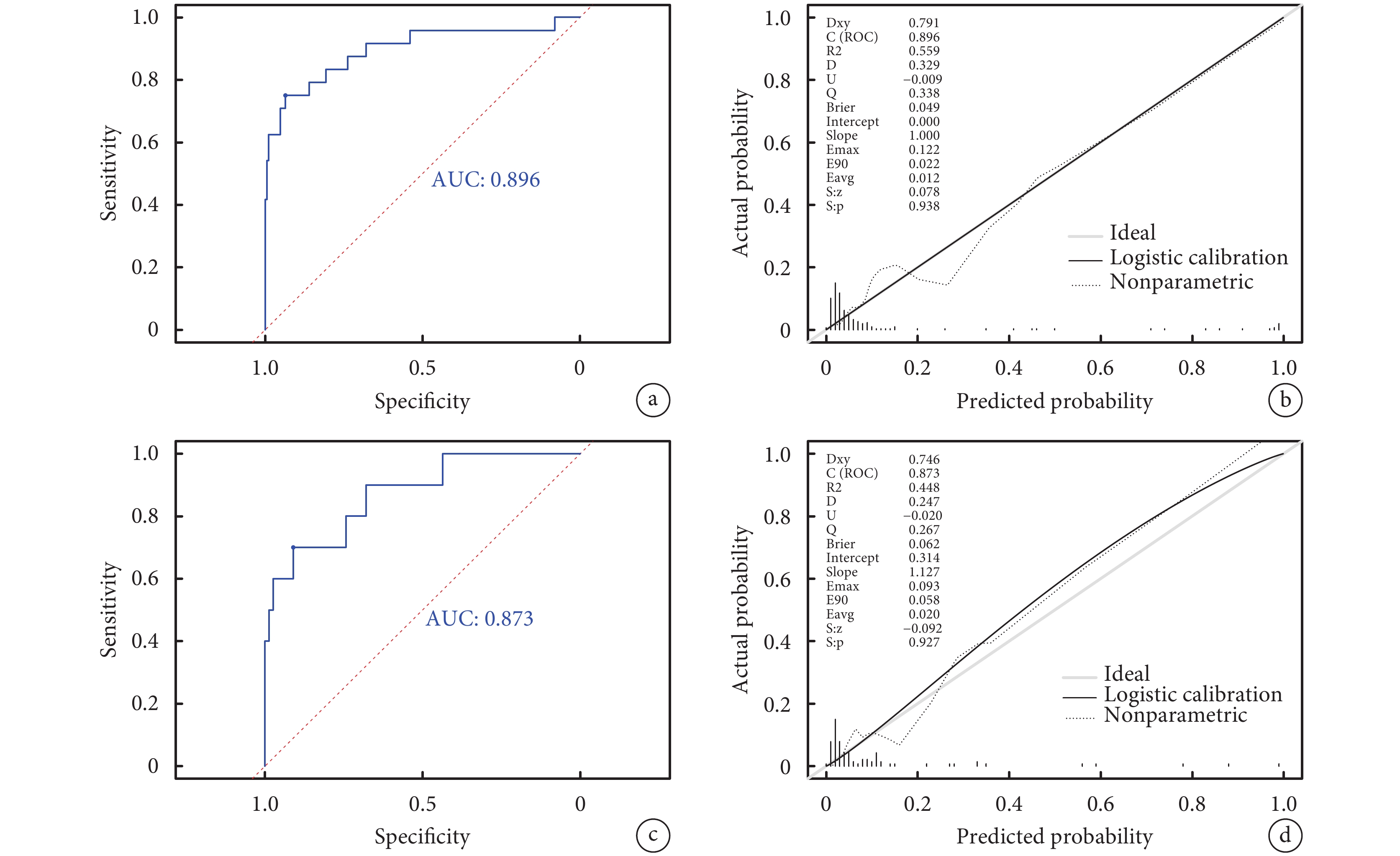
訓練集AUC為0.896[95%CI(0.810,0.982)],最大約登指數對應截點值為0.103,靈敏度為0.750,特異度為0.936。校準曲線Brier值為0.049,P>0.05。將訓練集模型置入驗證集中進行驗證,驗證集AUC為0.873[95%CI(0.750,0.998)],最大約登指數對應截點值為0.122,靈敏度為0.700,特異度為0.910。校準曲線Brier值為0.062,P>0.05。提示本預測模型具有良好的區分度及校準度;見圖2。
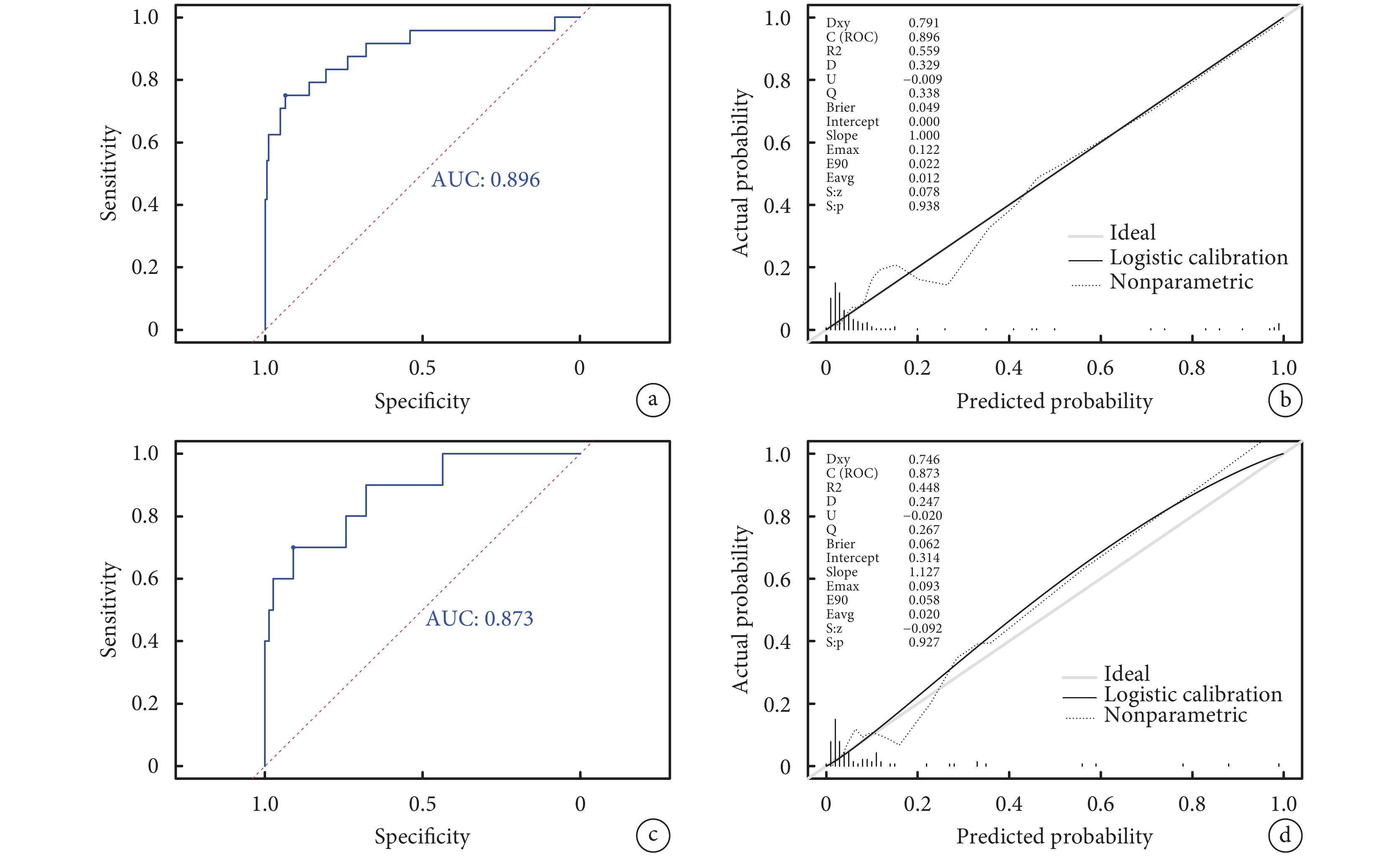 圖2
實性或部分實性肺結節低分化腺癌模型ROC曲線及校準曲線
圖2
實性或部分實性肺結節低分化腺癌模型ROC曲線及校準曲線
a:訓練集ROC曲線;b:訓練集校準曲線;c:驗證集ROC曲線;d:驗證集校準曲線;AUC:曲線下面積;ROC:受試者工作特征
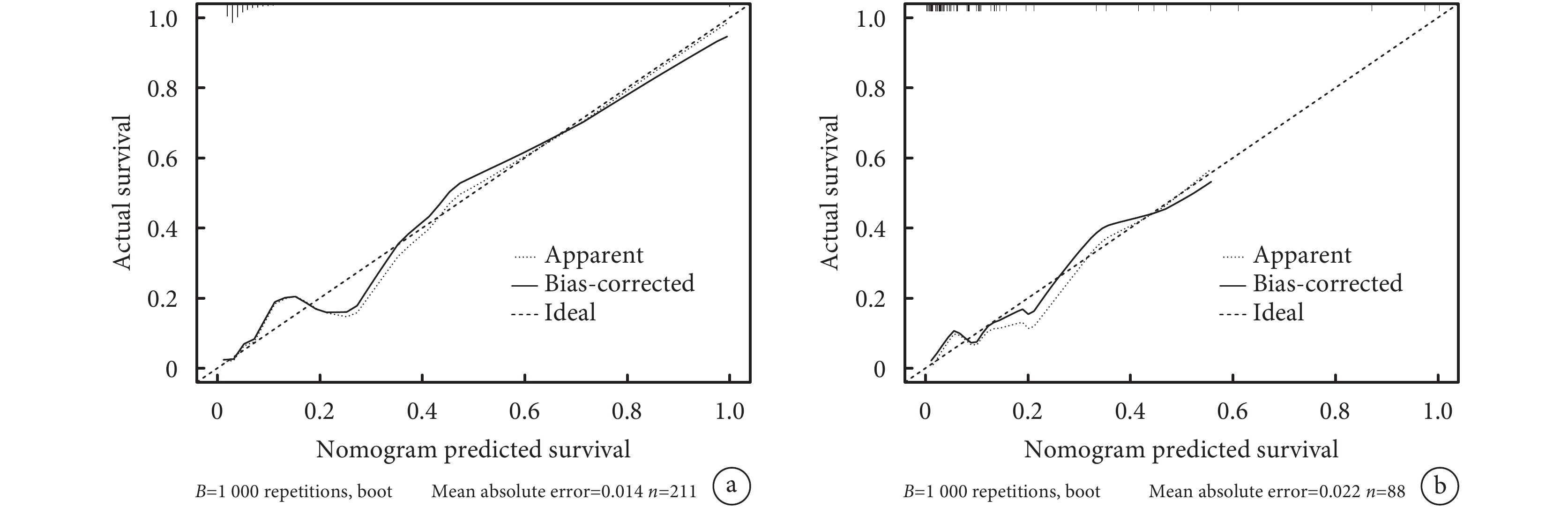
通過Bootstrap法重復抽樣
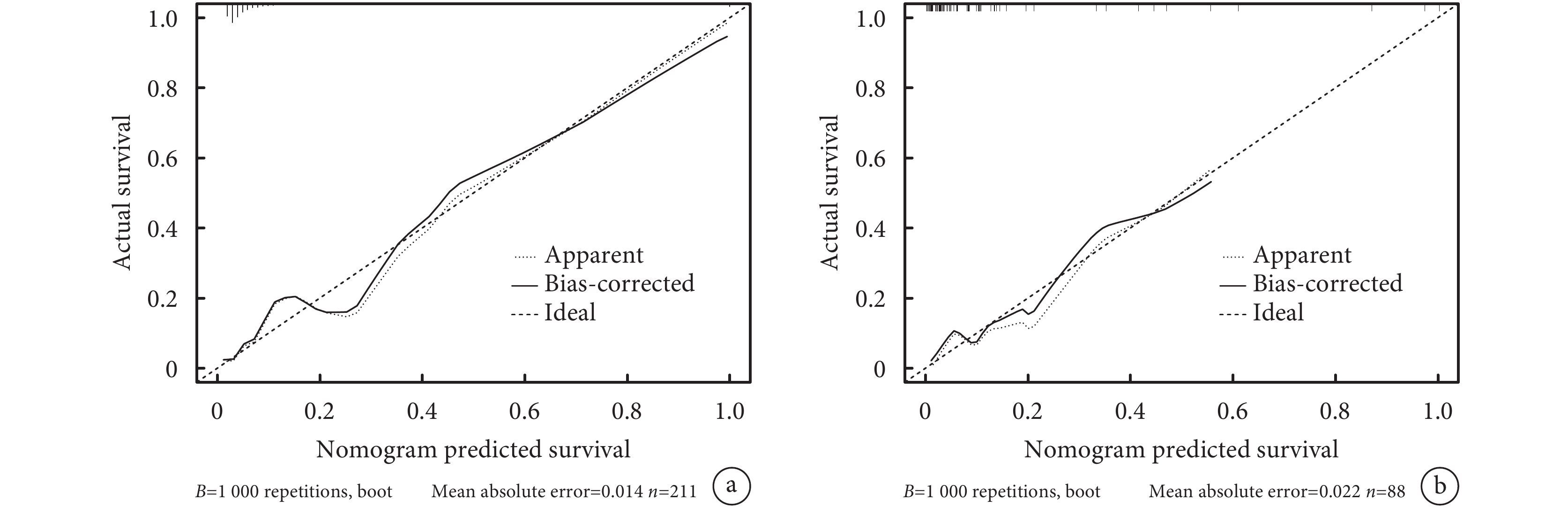 圖3
實性或部分實性肺結節低分化腺癌模型Bootstrap校準曲線
圖3
實性或部分實性肺結節低分化腺癌模型Bootstrap校準曲線
a:訓練集;b:驗證集
2.5 臨床決策分析
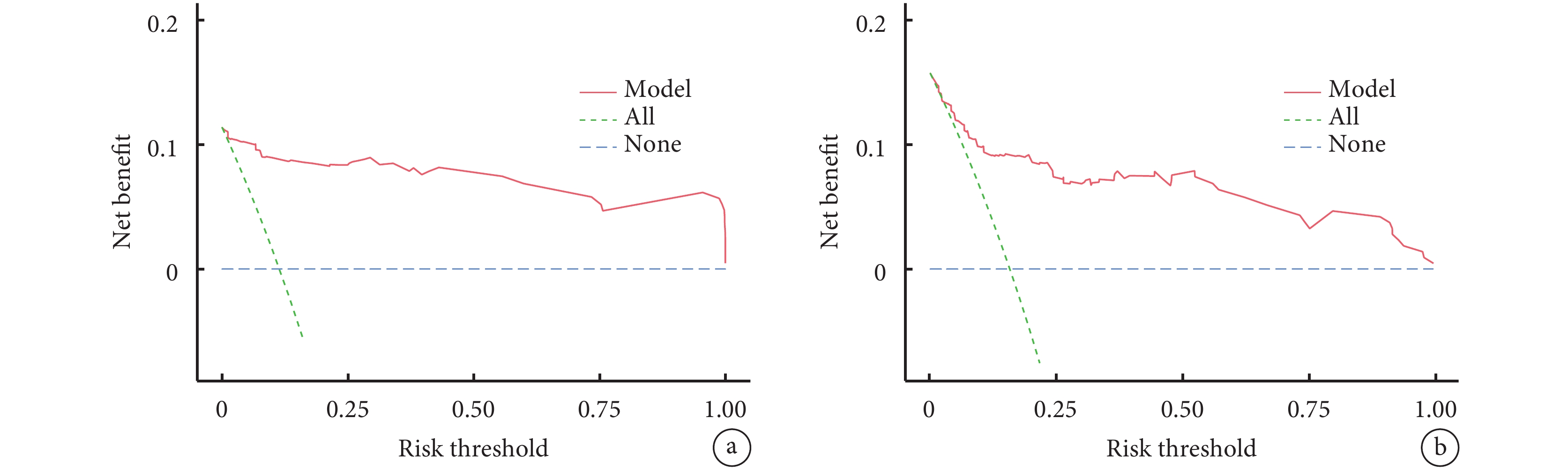
訓練集的決策曲線顯示,本預測模型在全概率下均表現為正臨床收益;驗證集的決策曲線也顯示有較好臨床收益;見圖4。
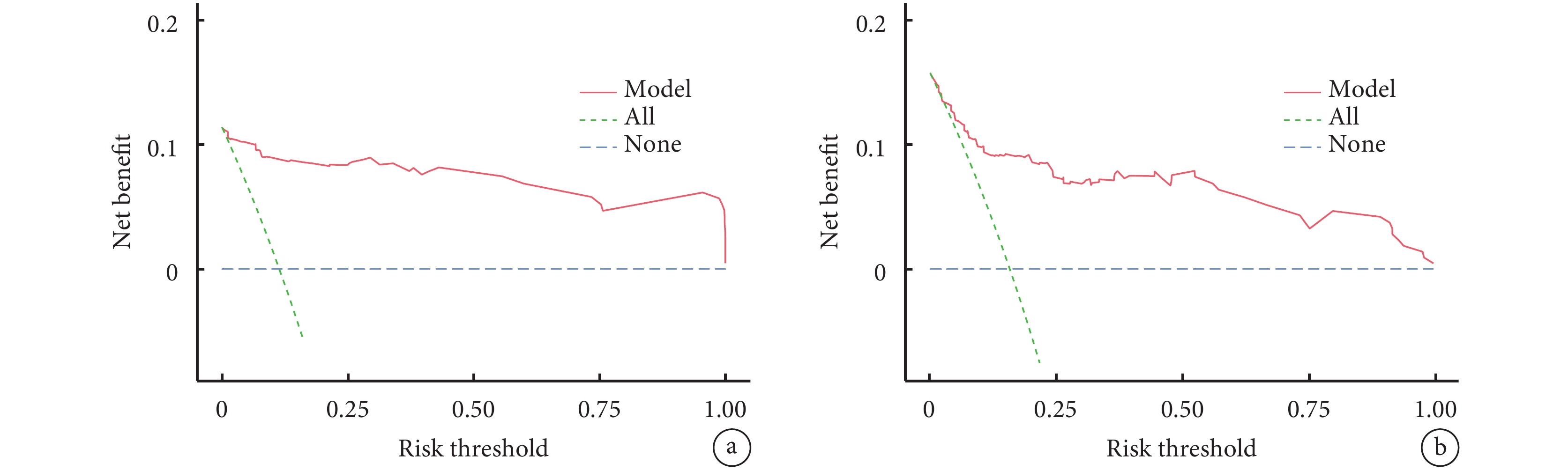 圖4
實性或部分實性肺結節低分化腺癌預測模型的臨床決策曲線
圖4
實性或部分實性肺結節低分化腺癌預測模型的臨床決策曲線
a:訓練集;b:驗證集
3 討論
肺腺癌是肺癌中最多見的病理類型,每年造成超過50萬人死亡[9]。肺低分化腺癌對患者危害極大,其術后5年復發率達44%,明顯高于高分化及中分化腺癌患者[10]。因此,術前對低分化腺癌的預測意義重大,不僅可以告知患者盡早干預,還能幫助外科醫師術前制定手術方式以及切除范圍。然而目前相關預測模型較少,因此本研究通過納入術前血液腫瘤標志物及CT人工智能結果,以期通過簡單的方法建立肺低分化腺癌的預測模型。
血液腫瘤標志物已被證實與肺癌的分化密切相關,在分化后期腫瘤細胞增殖、遷移可導致機體出現炎癥、浸潤以及組織粘連,使得腫瘤標志物大量生成并釋放入血。除常規腫瘤標志物外,大量研究[11-12]表明AABs也對肺癌的發生、發展有較好的診斷價值,在腫瘤發展早期,腫瘤細胞會分泌多種異常蛋白和蛋白酶,刺激機體產生大量相關抗體。因此本研究也將p53、PGP9.5、SOX2、GAGE、GBU4-5、MAGE和CAGE納入模型。
CT作為最常用的肺癌檢查手段,其結果對肺癌分期的診斷有重大意義。首先,在惡性腫瘤的發生、發展過程中,腫瘤細胞會逐漸從貼壁生長向浸潤性生長模式演變,這可導致肺結節邊緣出現胸膜凹陷征,內部也有可能出現支氣管充氣征。胸膜凹陷征在CT圖像上為線形影,從腫瘤連接至胸膜,并在胸膜上呈現“喇叭口”狀。支氣管充氣征表現為肺結節內或周圍支氣管管腔擴張淤曲[13-14]。本研究納入結節平均密度值、最大直徑、胸膜牽拉征、支氣管充氣征4種CT結果。隨著人工智能的快速發展,相比于人腦,人工智能在計算能力方面有極大優勢[7-8]。目前人工智能對于肺結節的篩查能力已逐漸趕超傳統醫師,其對數據的強大計算能力可幫助醫師迅速計算結節的大小、密度等數值。
本研究結果顯示,CEA、CYFRA21-1、腫瘤最大直徑以及腫瘤平均密度均對低分化腺癌的預測有良好效能。CEA是人類胚胎抗原一種特異性酸性糖蛋白,在惡性腫瘤患者血清中,腫瘤細胞的增殖、合成可導致其大量存在。且隨著腫瘤分化程度的增高,其指標也明顯上升。低分化以及中分化、伴淋巴結轉移的患者CEA水平明顯高于高分化、無淋巴結轉移患者[15-16]。CYFRA21-1是細胞角蛋白19的可溶性片段,類似于CEA,其也與肺癌的進展密切相關。有研究[17]認為,隨著腫瘤分化程度降低,腫瘤細胞內角蛋白含量可能呈升高趨勢,而隨著腫瘤細胞壞死后溶解,其內含的角蛋白片段可釋放入血,使CYFRA21-1升高。
本研究中,7種AABs對肺低分化腺癌均無明顯預測意義,這可能與本模型病例數較少有關,且目前對AABs的研究只表明其對肺癌早期有良好診斷價值,其指標是否受肺癌分化程度的影響,值得進一步探究。
本研究結果還表明,CT結果中腫瘤最大直徑以及腫瘤平均密度也具有良好的預測能力。這可能是由于腫瘤大小和密度均與其侵襲能力相關。浸潤性肺癌的生長,首先是向四周侵襲,并且Lee等[18]發現,實性成分是肺癌具有侵襲性的重要因素,實性成分越多,腫瘤侵襲力越強,患者預后越差。然而胸膜牽拉征和支氣管充氣征在本研究中差異均無統計學意義,這可能的原因有:(1)本研究納入的病例數較少;(2)在腫瘤分化早期,該征象也大量存在,因此無法與低分化腺癌區分。
本研究為單中心回顧性研究,樣本量小,有待多中心、大樣本研究進一步證實。肺低分化腺癌的預測因子多樣,有待納入更多影響因子以完善模型。本研究為單中心內部驗證,需要其他中心樣本進行外部驗證以進一步證實結果。
綜上所述,通過篩查患者血清CEA、CYFRA21-1水平,以及通過CT人工智能測量腫瘤最大直徑、平均密度,可較好預測純實性以及部分實性肺結節為肺低分化腺癌的概率,這有利于盡早干預,并可幫助臨床醫師術前制定手術方式以及手術范圍。
利益沖突:無。
作者貢獻:蔣捷負責試驗設計,數據整理、分析,初稿撰寫;劉鋒負責項目管理;王波負責圖表制作;王芹負責軟件操作和數據整理;鐘健負責試驗設計和監督。
在我國,肺癌已經成為發病率以及死亡率最高的惡性腫瘤[1],其病理類型復雜多樣,最常見的為肺腺癌。2021年第5版《WHO胸部腫瘤分類》[2]根據腫瘤中的高級別成分,包括實性、微乳頭和/或復雜腺體等,將肺浸潤性腺癌分為高分化、中分化、低分化腺癌,其中高級別成分占比超過20%的腫瘤為低分化腺癌。肺低分化腺癌患者預后最差,更容易發生淋巴結轉移,該部分患者需行肺癌根治手術。因此術前篩查出低分化腺癌患者尤為重要[2-3]。目前常用的肺癌檢查方法包括血液腫瘤標志物檢驗及CT檢查。近年來多項研究已證實血液腫瘤標志物在肺癌的分期診斷中具有重要意義,包括癌胚抗原(CEA)、細胞角蛋白19片段抗原(CYFRA21-1)、神經元特異性烯醇化酶(NSE)、胃泌素釋放前體(ProGRP)、鱗狀上皮細胞癌抗原(SCC)、糖類抗原125(CA125)、糖類抗原153(CA153)、糖類抗原242(CA242)、糖類抗原199(CA199)等。另外p53、PGP9.5、SOX2、GAGE、GBU4-5、MAGE和CAGE等腫瘤相關自身抗體(autoantibodies,AABs)也對肺癌具有較好的診斷價值,部分歐美國家已將其常規用于肺癌診斷,其在中國高危人群中的篩查敏感性和特異性也達61%和90%[4-6]。
除血液檢驗外,CT由于其無創、便捷的特點已成為肺癌最有效的檢查手段,近年來由于計算機硬件的發展,人工智能在肺癌的診斷方面也開始嶄露頭角,其能力甚至可趕超傳統醫師閱片,相比于人腦,人工智能在計算力方面有極大優勢[7-8],尤其是對于人眼無法準確計算的實性成分占比、腫瘤體積等。因此本研究將聯合CT人工智能與多項腫瘤標志物,構建低分化腺癌的預測模型,以期以簡單的方法從實性或亞實性肺結節患者中預測肺低分化腺癌患者,以便盡早干預。
1 資料與方法
1.1 臨床資料和分組
納入南京醫科大學附屬腦科醫院胸外科2023年行肺結節手術患者。納入標準:(1)年齡≥18周歲;(2)結節為實性或部分實性,孤立性且最大直徑≤50 mm;(3)術后常規病理明確診斷為低分化腺癌。排除標準:(1)臨床資料缺失;(2)病理為轉移性惡性腫瘤;(3)術前接受抗腫瘤治療;(4)出現遠處轉移。按照7∶3比例將患者隨機分為訓練集和驗證集。依據術后病理結果,將患者分為低分化腺癌組和非低分化腺癌組。
1.2 研究方法
1.2.1 腫瘤標志物檢測
患者入院后術前抽取空腹晨血2 mL,在1 h內離心樣本。腫瘤標志物CEA、NSE、CYFRA21-1、SCC、ProGRP的測定采用電發光法測定試劑盒(上海羅氏診斷產品有限公司);肺癌相關抗體p53、PGP9.5、SOX2、GAGE、GBU4-5、MAGE、CAGE的測定采用酶聯免疫法七種肺癌相關抗體檢測試劑盒(杭州凱保羅生物科技有限公司)。后從電子檢驗系統采集結果。
1.2.2 CT檢查
患者入院后術前均行薄層胸部CT檢查,機器型號:Philips Incisive CT;電壓:120 kV;管電流:自動電流調節;螺距:1.0;旋轉時間:0.75 s;劑量指數:22;層厚:1 mm;建像間隔:0.75 mm;建像矩陣:512;視野:350 mm。掃描時取仰臥位,囑患者配合吸氣及屏氣,掃描范圍為頸根部至肋膈角。圖像人工智能系統為Deepwise MetAI睿影人工智能醫學輔助診斷/評估系統,其能自動檢測肺部結節,并計算生成結節大小、平均密度等指標。CT結果由2名具有10年以上經驗影像科醫師讀片、并對人工智能結果進行審核。依據CT結果記錄結節最大直徑、平均密度、是否有胸膜凹陷征以及支氣管充氣征。
1.2.3 病理檢測
所有標本均由外科手術獲得,術后立即經4%中性甲醛固定,送往病理科包埋、制片,常規蘇木精-伊紅染色,由2名具有10年以上經驗病理科醫師做出診斷,若有疑難病例,送至南京鼓樓醫院由多名專家協同診斷。部分病灶加做免疫組織化學檢測進一步明確腫瘤分化程度。術后依據常規病理結果,判斷是否為低分化腺癌。
1.3 統計學分析
采用SPSS 20.0軟件進行數據分析,符合正態分布的計量資料采用均數±標準差(x±s)表示,組間比較采用獨立樣本t檢驗;偏態分布的計量資料采用中位數(上下四分位數)[M(P25,P75)]表示,組間比較采用秩和檢驗。計數資料采用例數和百分比(%)表示,組間比較采用χ2檢驗。使用R語言行預測模型分析,對所有可能的危險因素行單因素分析,對P<0.1的因素行二元logistic回歸分析。使用“rms”程序繪制列線圖,“pROC”程序繪制受試者工作特征(receiver operating characteristic,ROC)曲線并計算曲線下面積(area under the curve,AUC),“CalibrationCurves”程序繪制校準曲線,“ggDCA”程序繪制臨床決策曲線。雙側檢驗水準α=0.05。
1.4 倫理審查
本研究通過南京腦科醫院醫學倫理委員會審批,審批號:2023-KY077-01。
2 結果
2.1 單因素分析結果
共納入299例患者,其中男103例、女196例,中位年齡57.00(51.00,67.25)歲;訓練集211例,驗證集88例。訓練集低分化腺癌組24例,非低分化腺癌組187例。對訓練集各因子采用單因素分析,結果顯示,兩組患者性別、PGP9.5、SOX2、GAGE、GBU4-5、MAGE、CAGE、NSE、SCC、ProGRP、胸膜凹陷征、支氣管充氣征差異無統計學意義(P>0.05);而年齡、p53、CEA、CYFRA21-1、腫瘤最大直徑、腫瘤平均密度差異有統計學意義(P<0.05);見表1。
2.2 多因素分析結果
將以上P<0.1的因子納入多因素回歸分析,結果顯示CEA(P=0.002)、CYFRA21-1(P=0.035)、腫瘤最大直徑(P=0.017)以及腫瘤平均密度(P=0.040)是實性或部分實性肺結節為低分化腺癌的危險因素,均呈正相關;見表2。
2.3 列線圖構建
將上述獨立危險因素納入列線圖模型,記錄患者CEA、CYFRA21-1、腫瘤最大直徑以及腫瘤平均密度值,及其對應的列線圖評分,可根據總分預測患者低分化腺癌概率;見圖1。
 圖1
實性或部分實性肺結節低分化腺癌列線圖模型
圖1
實性或部分實性肺結節低分化腺癌列線圖模型
*:單位為每10 HU;CEA:癌胚抗原;CYFRA21-1:細胞角蛋白19片段抗原
2.4 模型的驗證及效能
訓練集AUC為0.896[95%CI(0.810,0.982)],最大約登指數對應截點值為0.103,靈敏度為0.750,特異度為0.936。校準曲線Brier值為0.049,P>0.05。將訓練集模型置入驗證集中進行驗證,驗證集AUC為0.873[95%CI(0.750,0.998)],最大約登指數對應截點值為0.122,靈敏度為0.700,特異度為0.910。校準曲線Brier值為0.062,P>0.05。提示本預測模型具有良好的區分度及校準度;見圖2。
 圖2
實性或部分實性肺結節低分化腺癌模型ROC曲線及校準曲線
圖2
實性或部分實性肺結節低分化腺癌模型ROC曲線及校準曲線
a:訓練集ROC曲線;b:訓練集校準曲線;c:驗證集ROC曲線;d:驗證集校準曲線;AUC:曲線下面積;ROC:受試者工作特征
通過Bootstrap法重復抽樣
 圖3
實性或部分實性肺結節低分化腺癌模型Bootstrap校準曲線
圖3
實性或部分實性肺結節低分化腺癌模型Bootstrap校準曲線
a:訓練集;b:驗證集
2.5 臨床決策分析
訓練集的決策曲線顯示,本預測模型在全概率下均表現為正臨床收益;驗證集的決策曲線也顯示有較好臨床收益;見圖4。
 圖4
實性或部分實性肺結節低分化腺癌預測模型的臨床決策曲線
圖4
實性或部分實性肺結節低分化腺癌預測模型的臨床決策曲線
a:訓練集;b:驗證集
3 討論
肺腺癌是肺癌中最多見的病理類型,每年造成超過50萬人死亡[9]。肺低分化腺癌對患者危害極大,其術后5年復發率達44%,明顯高于高分化及中分化腺癌患者[10]。因此,術前對低分化腺癌的預測意義重大,不僅可以告知患者盡早干預,還能幫助外科醫師術前制定手術方式以及切除范圍。然而目前相關預測模型較少,因此本研究通過納入術前血液腫瘤標志物及CT人工智能結果,以期通過簡單的方法建立肺低分化腺癌的預測模型。
血液腫瘤標志物已被證實與肺癌的分化密切相關,在分化后期腫瘤細胞增殖、遷移可導致機體出現炎癥、浸潤以及組織粘連,使得腫瘤標志物大量生成并釋放入血。除常規腫瘤標志物外,大量研究[11-12]表明AABs也對肺癌的發生、發展有較好的診斷價值,在腫瘤發展早期,腫瘤細胞會分泌多種異常蛋白和蛋白酶,刺激機體產生大量相關抗體。因此本研究也將p53、PGP9.5、SOX2、GAGE、GBU4-5、MAGE和CAGE納入模型。
CT作為最常用的肺癌檢查手段,其結果對肺癌分期的診斷有重大意義。首先,在惡性腫瘤的發生、發展過程中,腫瘤細胞會逐漸從貼壁生長向浸潤性生長模式演變,這可導致肺結節邊緣出現胸膜凹陷征,內部也有可能出現支氣管充氣征。胸膜凹陷征在CT圖像上為線形影,從腫瘤連接至胸膜,并在胸膜上呈現“喇叭口”狀。支氣管充氣征表現為肺結節內或周圍支氣管管腔擴張淤曲[13-14]。本研究納入結節平均密度值、最大直徑、胸膜牽拉征、支氣管充氣征4種CT結果。隨著人工智能的快速發展,相比于人腦,人工智能在計算能力方面有極大優勢[7-8]。目前人工智能對于肺結節的篩查能力已逐漸趕超傳統醫師,其對數據的強大計算能力可幫助醫師迅速計算結節的大小、密度等數值。
本研究結果顯示,CEA、CYFRA21-1、腫瘤最大直徑以及腫瘤平均密度均對低分化腺癌的預測有良好效能。CEA是人類胚胎抗原一種特異性酸性糖蛋白,在惡性腫瘤患者血清中,腫瘤細胞的增殖、合成可導致其大量存在。且隨著腫瘤分化程度的增高,其指標也明顯上升。低分化以及中分化、伴淋巴結轉移的患者CEA水平明顯高于高分化、無淋巴結轉移患者[15-16]。CYFRA21-1是細胞角蛋白19的可溶性片段,類似于CEA,其也與肺癌的進展密切相關。有研究[17]認為,隨著腫瘤分化程度降低,腫瘤細胞內角蛋白含量可能呈升高趨勢,而隨著腫瘤細胞壞死后溶解,其內含的角蛋白片段可釋放入血,使CYFRA21-1升高。
本研究中,7種AABs對肺低分化腺癌均無明顯預測意義,這可能與本模型病例數較少有關,且目前對AABs的研究只表明其對肺癌早期有良好診斷價值,其指標是否受肺癌分化程度的影響,值得進一步探究。
本研究結果還表明,CT結果中腫瘤最大直徑以及腫瘤平均密度也具有良好的預測能力。這可能是由于腫瘤大小和密度均與其侵襲能力相關。浸潤性肺癌的生長,首先是向四周侵襲,并且Lee等[18]發現,實性成分是肺癌具有侵襲性的重要因素,實性成分越多,腫瘤侵襲力越強,患者預后越差。然而胸膜牽拉征和支氣管充氣征在本研究中差異均無統計學意義,這可能的原因有:(1)本研究納入的病例數較少;(2)在腫瘤分化早期,該征象也大量存在,因此無法與低分化腺癌區分。
本研究為單中心回顧性研究,樣本量小,有待多中心、大樣本研究進一步證實。肺低分化腺癌的預測因子多樣,有待納入更多影響因子以完善模型。本研究為單中心內部驗證,需要其他中心樣本進行外部驗證以進一步證實結果。
綜上所述,通過篩查患者血清CEA、CYFRA21-1水平,以及通過CT人工智能測量腫瘤最大直徑、平均密度,可較好預測純實性以及部分實性肺結節為肺低分化腺癌的概率,這有利于盡早干預,并可幫助臨床醫師術前制定手術方式以及手術范圍。
利益沖突:無。
作者貢獻:蔣捷負責試驗設計,數據整理、分析,初稿撰寫;劉鋒負責項目管理;王波負責圖表制作;王芹負責軟件操作和數據整理;鐘健負責試驗設計和監督。