引用本文: 劉碩, 朱麗慧, 廖天一, 張翔, 蔡輝. 基于雙硫死亡相關基因的胃癌預后預測模型的構建及驗證. 中國普外基礎與臨床雜志, 2023, 30(11): 1333-1340. doi: 10.7507/1007-9424.202307041 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胃癌(gastric cancer)是世界上最常見的癌癥之一,其進展快、治療效果不理想、死亡率高,已對人類的生命安全構成嚴重威脅[1]。盡管隨著醫學的不斷發展,胃癌的治療手段有了長足的進步,但其生存率仍無法令人滿意[2]。如何進一步改善胃癌患者的預后,提高生活質量,是一個亟待解決的健康問題。因此,開發出一些有效的腫瘤標志物用來指導胃癌患者的早期診斷和預后評價意義重大[3]。雙硫死亡(disulfidptosis)是一種最新發現的程序性死亡(programmed cell death,PCD)形式,研究[4]表明,細胞內二硫化物的異常積累,如胱氨酸,會誘導二硫化物應激,并對細胞產生高度毒性。在高表達SLC7A11的腫瘤細胞中,氧化還原狀態被改變,二硫化物積累破壞細胞組蛋白骨架間二硫鍵的正常結合,使其從細胞質膜上剝離,最終導致細胞死亡。因此,雙硫死亡與癌癥之間存在著密切的聯系。許多癌細胞通過氧化應激,導致二硫化物代謝紊亂,從而影響癌細胞的生存和增殖[5-6]。除此之外,雙硫死亡作為一種新的PCD模式,可能與腫瘤免疫反應有一定的相關性。雙硫死亡產生的細胞死亡信號能夠被腫瘤免疫細胞識別,從而激活腫瘤特異性T細胞的免疫反應,增強體液免疫和細胞免疫的有效性,最終提高腫瘤的治療效果[7]。在本研究中,筆者利用生物信息學的方法,建立了一個雙硫死亡相關的預后評分模型,以期為臨床免疫治療和預后評估提供新的思路。
1 方法
1.1 數據收集和處理
胃癌患者的轉錄組數據和臨床信息分別來自于TCGA(412例胃癌組織和36例正常對照)和GEO(483例胃癌組織)數據庫。TCGA數據庫選擇TCGA-STAD數據集中的mRNA表達數據,數據類型選擇FPKM;GEO數據庫選擇GSE84437數據集。數據庫樣本中的37%甲醛溶液浸泡樣本和轉移樣本被剔除,臨床病理數據缺失的個體在分析過程中也被排除。使用R軟件中的“SVA”包對數據去除批次效應。
1.2 雙硫死亡相關基因(disulfidptosis-related genes,DRGs)的表達與預后
從最近發表的一篇文獻[4]中獲得了24個DRGs用于后續的分析研究,分別為:SLC7A11、SLC3A2、RPN1、NCKAP1、NUBPL、NDUFA11、LRPPRC、OXSM、NDUFS1、GYS1、FLNA、FLNB、MYH9、TLN1、ACTB、MYL6、MYH10、CAPZB、DSTN、IQGAP1、ACTN4、PDLIM1、CD2AP和INF2。使用R軟件中的“ggpubr”包分析TCGA-STAD數據集并繪制DRGs表達箱線圖。之后,將上述2個數據集與生存數據合并,以供后續分析。其中總生存期(overall survival,OS)不明的樣本被剔除,此時TCGA-STAD和GSE84437數據集中剩余的樣本數分別為404例和433例,共計 837例樣本。R軟件中的“survival”包用于分析DRGs與OS之間的關系。根據Cox比例風險回歸計算其風險比(hazard ratio,HR)及其95%可信區間(confidence interval,95%CI)。本研究檢驗水準α=0.05。
1.3 樣本聚類分析
使用R軟件中的“Consensus Cluster Plus”包對24個DRGs表達進行無監督聚類分析,以識別不同的DRGs相關聚類[8]。應用“K-Means”算法,并使用“歐幾里得”作為距離單位,同時對80%的項目進行重新采樣和1 000次復制[9]。根據模糊聚類比例(proportion of ambiguous clustering,PAC)確定最佳k值(本研究為 2)。對兩個DRGs簇進行主成分分析(principal component analysis,PCA),以確定聚類結果的可靠性。使用對數秩檢驗比較兩類間OS的差異。
1.4 DRGs相關差異表達基因(differentially expressed genes,DEGs)的篩選和富集分析
采用R軟件的“limma”包用于探索兩個DRGs集群之間的DEGs,使用|log2 FC|>1 [FC為差異倍數(fold change)]和FDR<0.05 [FDR為錯誤發現率(false discovery rate)] 作為截止值[10]。使用“clusterProfiler”和“annotation”包對DRGs相關的DEGs進行基因本體(gene ontology,GO)和京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)富集分析[11]。
1.5 預后模型的建立
將整體集隨機平均分組為訓練集(n=419)和驗證集(n=418)。首先,在訓練集中使用R軟件中的“glmnet”包進行LASSO-Cox回歸分析,以縮小并選擇最理想的雙硫死亡相關的預后特征(disulfidptosis-related prognostic signature,DRPS)基因。根據模型中關鍵基因的表達譜,使用模型方程計算雙硫死亡風險評分。模型公式:風險評分= (expi為基因表達,coef為基因風險系數)。之后,根據訓練集的中位風險評分將所有參與研究的胃癌樣本分為高風險組和低風險組,并采用Cox比例風險回歸比較高低風險組的OS差異。
(expi為基因表達,coef為基因風險系數)。之后,根據訓練集的中位風險評分將所有參與研究的胃癌樣本分為高風險組和低風險組,并采用Cox比例風險回歸比較高低風險組的OS差異。
1.6 預測價值的驗證
在整體集、訓練集和驗證集中驗證預測模型的準確度。將所有樣本按照風險評分進行升序排列,并繪制生存狀況散點圖,以觀察風險評分與生存狀態的關系。分別繪制整體集、訓練集和驗證集的OS曲線和受試者工作特征(receiver operating characteristic,ROC)曲線,用于驗證模型的準確性。使用“rms”軟件包建立包含臨床參數的風險評分相關列線圖。為了評估實際生存率和列線圖預測生存率之間的擬合效果,生成了校準曲線。
1.7 免疫相關性分析
為了進一步觀察胃癌患者不同風險評分之間的潛在差異,使用CIBERSORT算法探索免疫細胞浸潤與風險的關聯。使用R包“CIBERSORT”計算每個胃癌樣本中免疫細胞亞群的比例,使用Spearman秩相關性分析計算風險評分、模型基因表達量和免疫細胞的相關性,使用R軟件的“ggplot”包將結果可視化。
2 結果
2.1 DRGs在胃癌中的表達譜
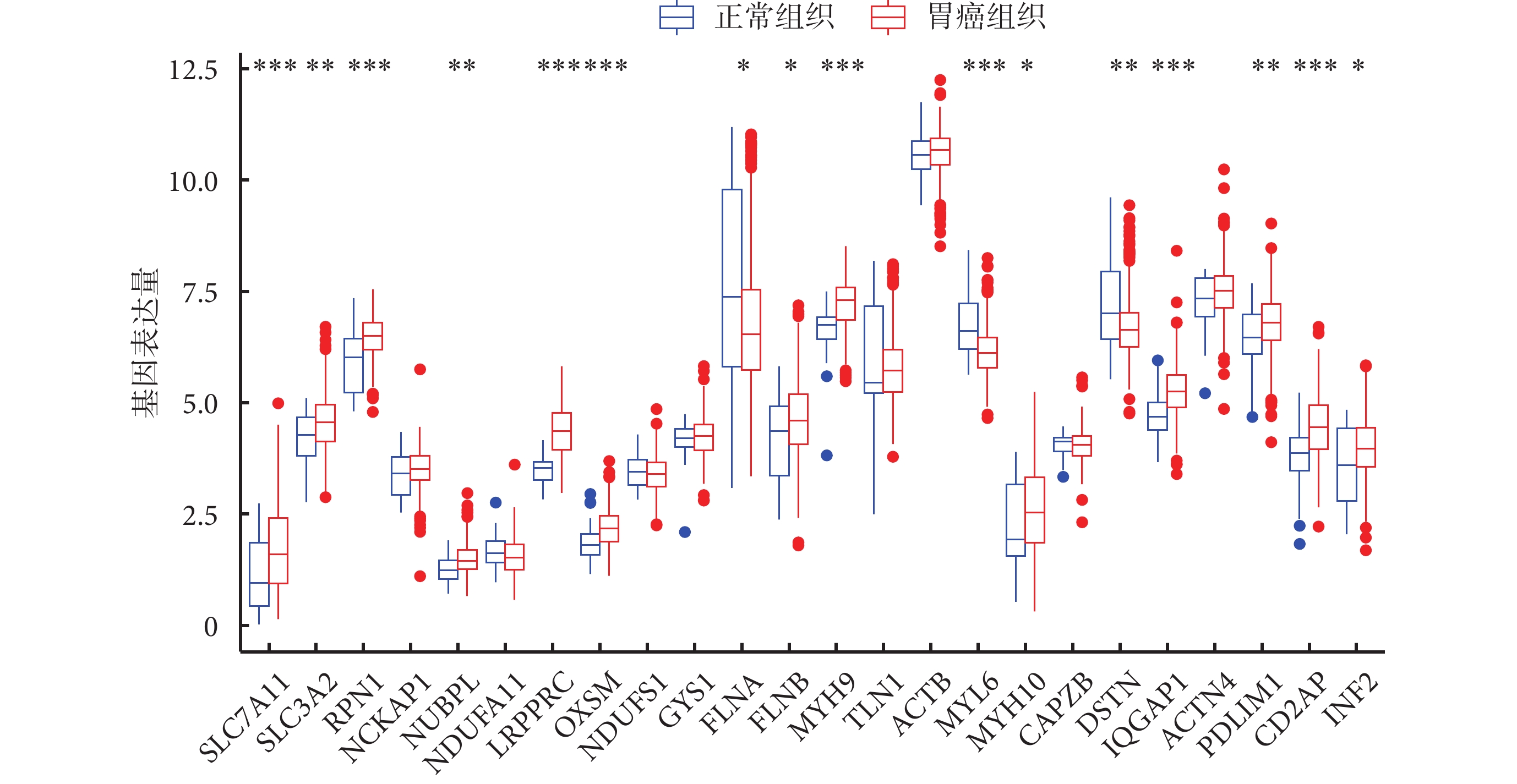
首先,在TCGA-STAD數據集中,與正常組織相比,胃癌組織中SLC7A11、SLC3A2、RPN1、NUBPL、LRPPRC、OXSM、FLNB、MYH9、MYH10、IQGAP1、PDLIM1、CD2AP和INF2共13種基因表達上調,FLNA、MYL6和DSTN表達下調,剩余8種基因則無統計學意義(圖1)。之后,使用整體集對所有胃癌樣本進行分析,單因素Cox比例風險回歸分析結果顯示,有9種基因影響OS:LRPPRC [HR=0.792,95%CI(0.649,0.968),P=0.023]、OXSM [HR=0.653,95%CI(0.509,0.838),P<0.001]、NDUFS1 [HR=0.729,95%CI(0.575,0.924),P=0.009]、GYS1 [HR=0.756,95%CI(0.591,0.967),P=0.026]、FLNA [HR=1.192,95%CI(1.095,1.297),P<0.001]、TLN1 [HR=1.188,95% CI(1.021,1.382),P=0.025]、MYL6 [HR=1.460,95%CI(1.158,1.839),P<0.001]、MYH10 [HR=1.191,95%CI(1.073,1.323),P=0.001] 和DSTN [HR=1.219,95%CI(1.048,1.417),P=0.010]。具體見表1。
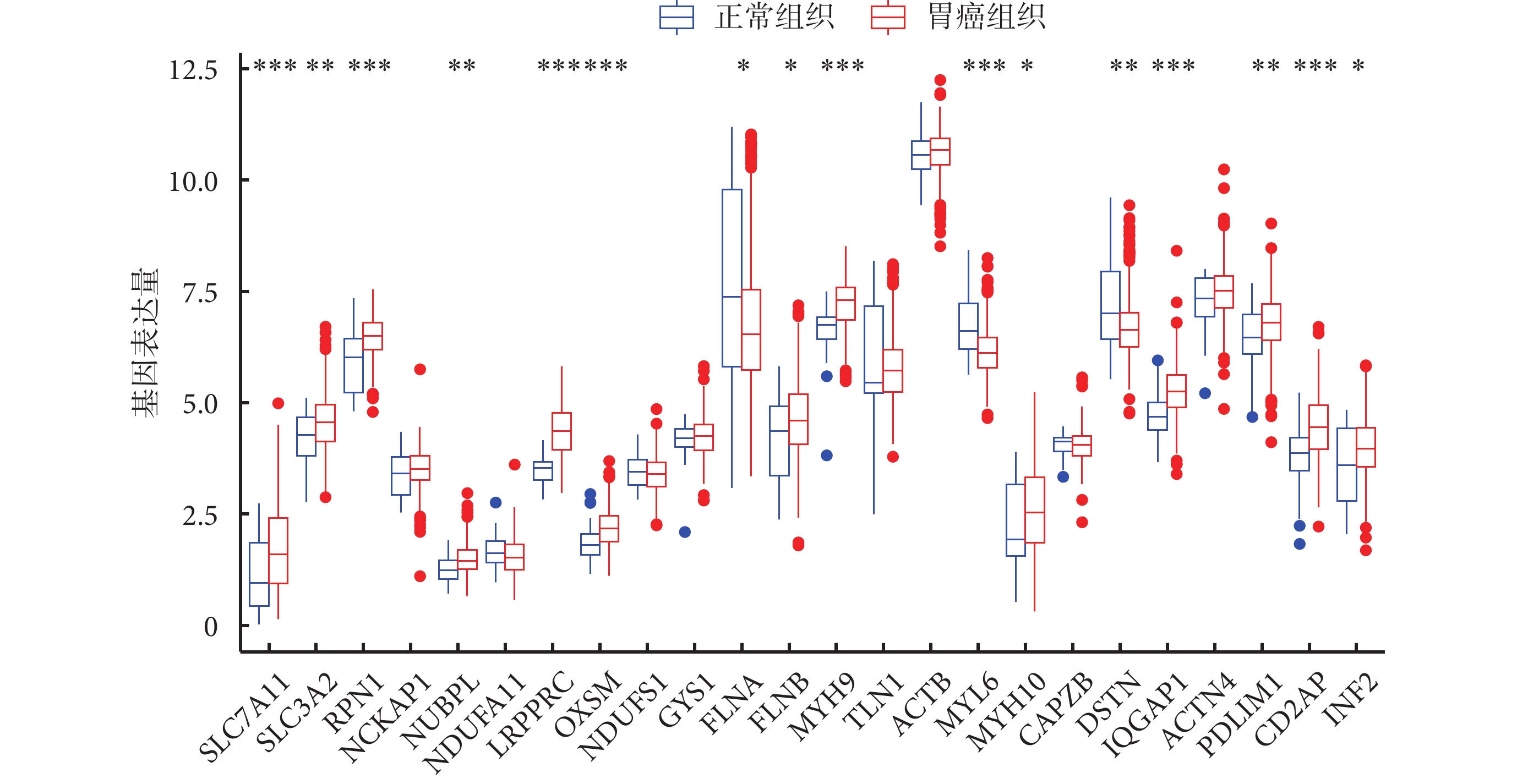 圖1
示DRGs在胃癌組織與正常組織間的表達差異,*P<0.05,**P<0.01,***P<0.001
圖1
示DRGs在胃癌組織與正常組織間的表達差異,*P<0.05,**P<0.01,***P<0.001
2.2 胃癌的DRGs簇識別
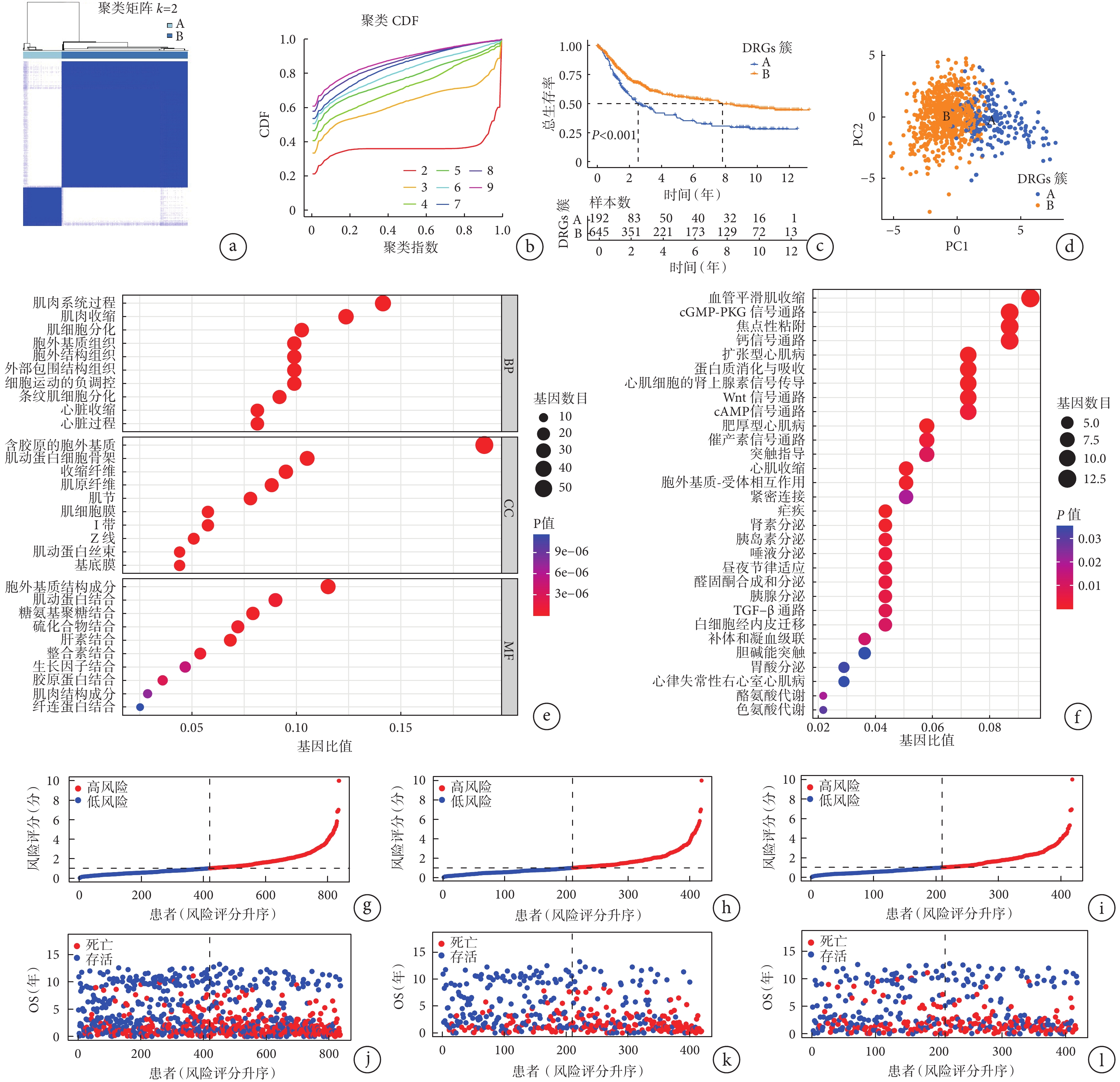
為全面了解胃癌中DRGs的表達模式,將來自TCGA-STAD和GSE84437數據集的樣本進行了整合。使用基于24個DRGs的一致聚類算法,在837個胃癌樣本中確定了兩種不同的亞型(圖2a),累積分布函數圖(cumulative distribution function,CDF)同樣表明,集群的最佳數量為2(圖2b)。因此,整合數據集被分為兩個DRGs集群,其中集群B表現出顯著的生存優勢(圖2c)。PCA結果顯示,兩個DRGs亞群能夠較明顯地將837例胃癌樣本區分開來(圖2d)。
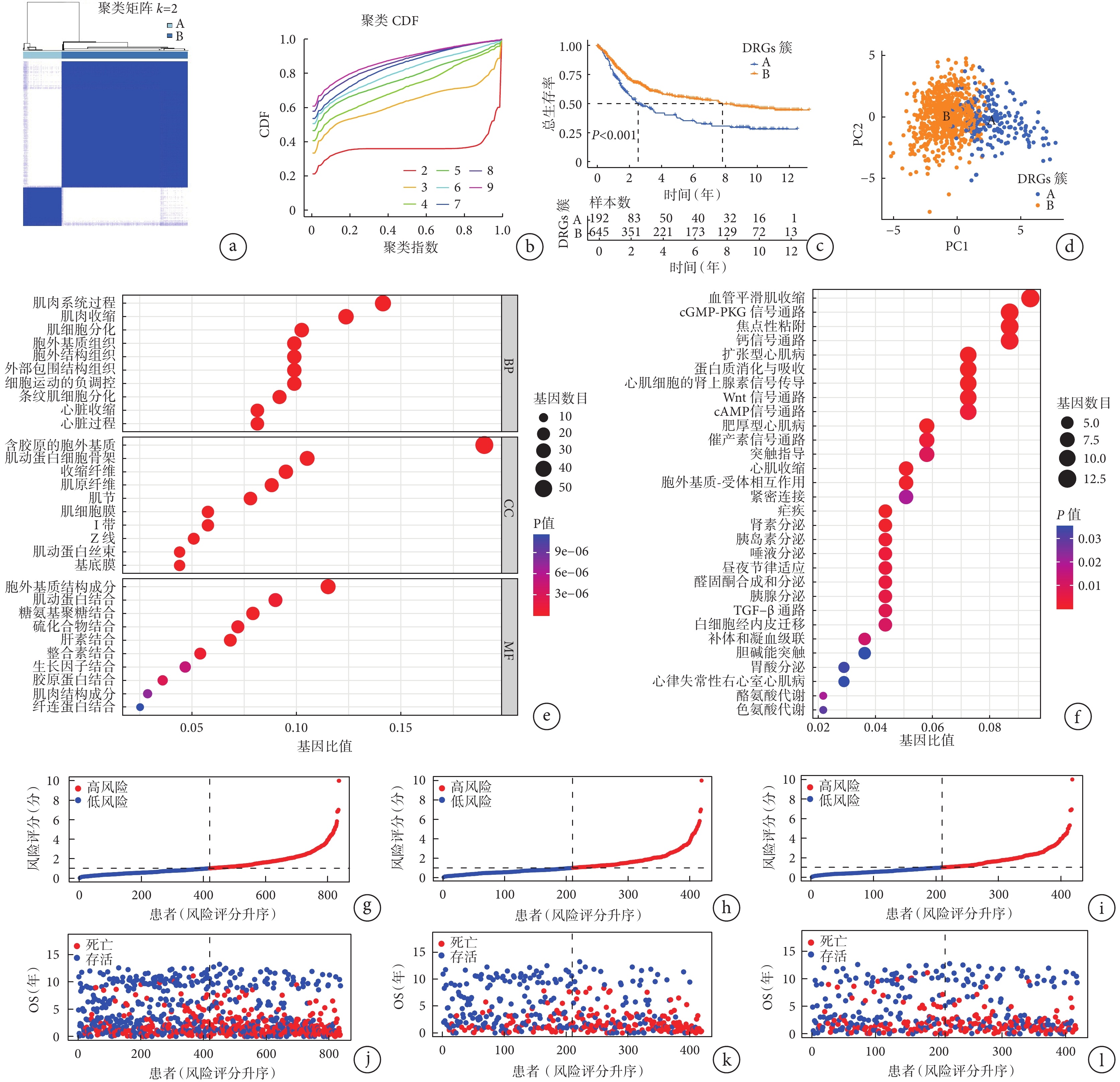 圖2
示胃癌的DRGs簇識別及驗證、GO富集分析和KEGG富集分析結果,以及風險評分與生存的關系
圖2
示胃癌的DRGs簇識別及驗證、GO富集分析和KEGG富集分析結果,以及風險評分與生存的關系
a:通過一致性聚類鑒定出雙硫死亡相關的兩種亞型;b:從
2.3 DRGs簇差異基因表達譜的富集分析
使用R軟件的“limma”包鑒定出2個DRGs集群之間的299個DEGs,并對299個DEGs進行GO和KEGG分析,以探索相關功能通路。GO富集分析結果顯示,DEGs與細胞外基質組織、硫化物結合、生長因子結合、整合素結合等功能有關。KEGG分析結果表明,血管平滑肌收縮、環磷酸鳥苷酸-蛋白激酶G(cyclic guanosine monophosphate-protein kinase G,cGMP-PKG)信號通路、Wnt信號通路、細胞外基質-受體相互作用、環磷酸腺苷(cyclic adenosine monophosphate,cAMP)信號通路、轉化生長因子β(transforming growth factor-β,TGF-β)信號通路等腫瘤相關通路顯著富集(圖2e和2f)。
2.4 雙硫死亡相關預后模型的構建
將299個DEGs作為種子基因,使用LASSO回歸識別出14個DEGs參與模型的構建,其相關風險系數見表2。通過中位風險值將所有患者(N總=837)分為高風險和低風險兩組。分別在整體集、訓練集和驗證集中,將所有樣本按照風險評分進行升序排列(圖2g~2l)。結果顯示,隨著風險的增加,生存期達到5年以上的患者逐漸減少、死亡患者逐漸增多,高低風險組之間具有較明顯的差異。
2.5 預后模型預測效果的驗證
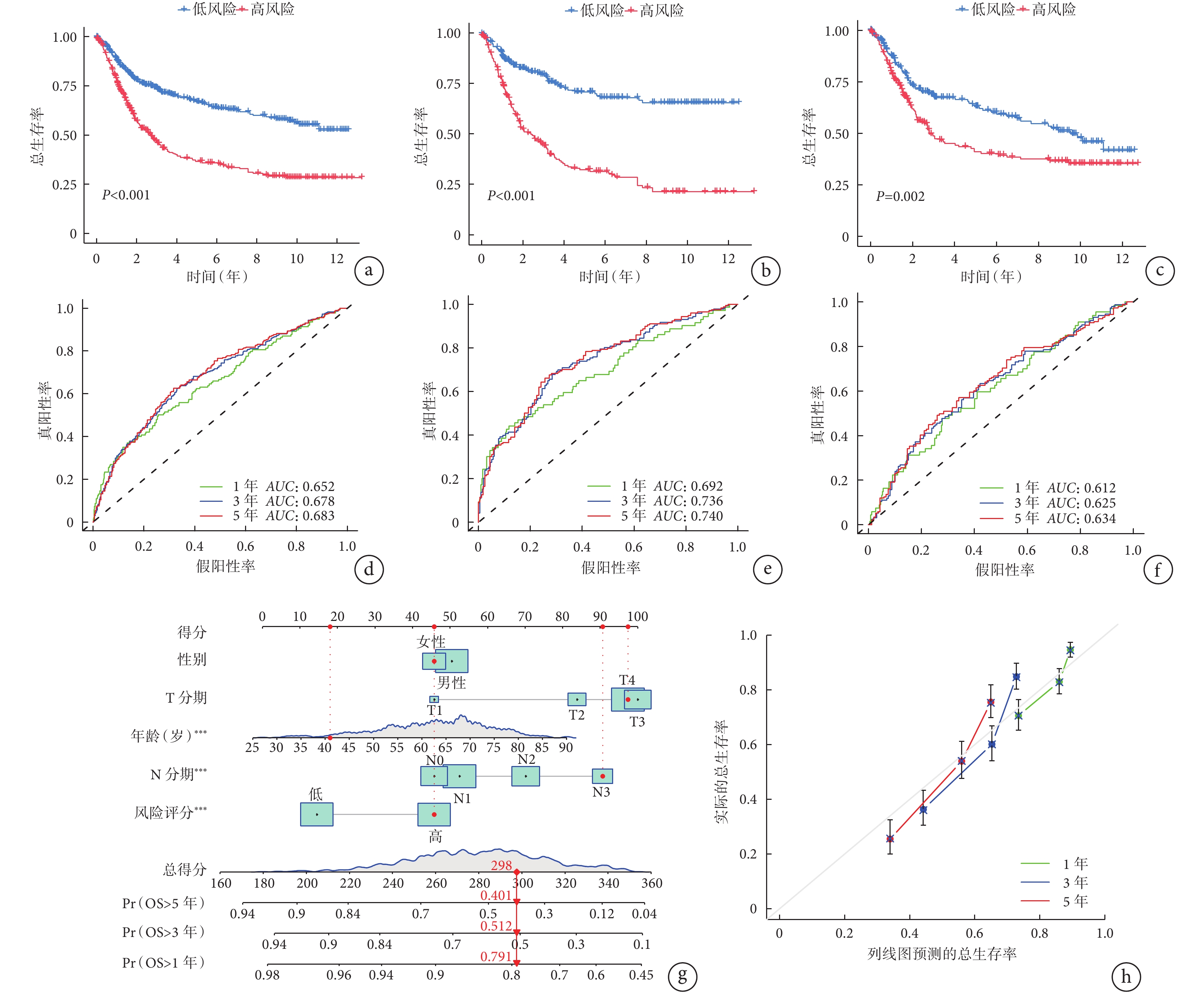
本研究進一步驗證了預測模型對OS的預測效果,結果表明,在整體集、訓練集和驗證集中,高風險組的OS均差于低風險組(圖3a~3c),差異有統計學意義(P<0.05)。ROC曲線顯示,在整體集、訓練集和驗證集中,模型預測的1、3、5年生存率均顯示出了較好的靈敏度(圖3d~3f)。
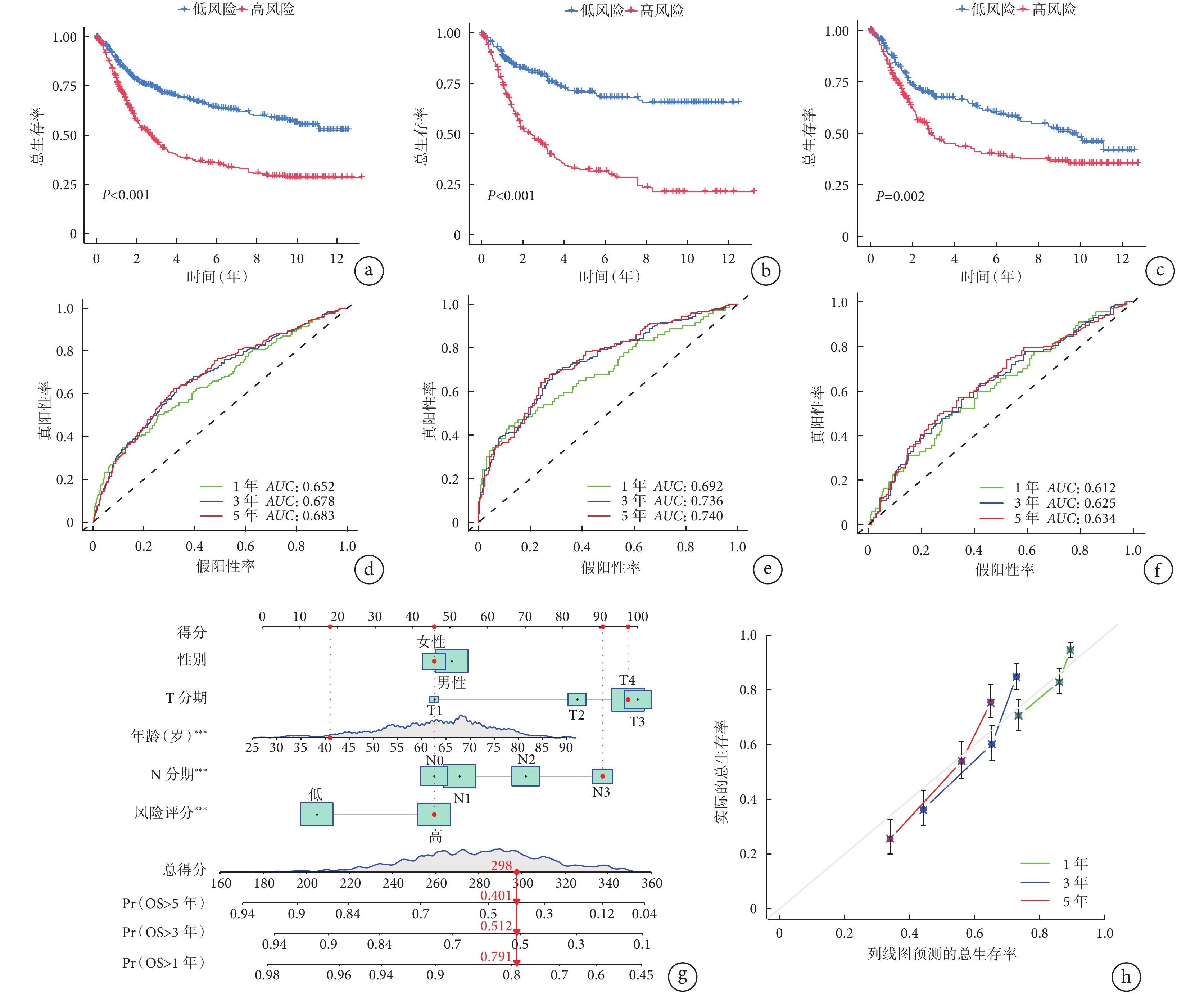 圖3
示不同風險胃癌患者的OS曲線及預后風險模型的ROC曲線、OS預測列線圖及其效能評估結果
圖3
示不同風險胃癌患者的OS曲線及預后風險模型的ROC曲線、OS預測列線圖及其效能評估結果
a、b、c:整體集(a)、訓練集(b)和驗證集(c)中高風險和低風險胃癌患者的OS曲線;d、e、f:預后風險模型預測整體集(d)、訓練集(e)和驗證集(f)中胃癌患者1、3、5 年總生存率的ROC曲線;g、h:OS預測列線圖(g)及其效能評估結果(h),***
2.6 預后模型的預測價值
使用整體集的數據,本研究通過“rms”軟件包創建了一個列線圖來預測胃癌患者1年、3年和5年的預期存活率(圖3g)。每例患者的總積分值是根據其性別、年齡、風險水平(低風險表示低DRGs評分,高風險表示高DRGs評分)以及腫瘤T和N分期來確定的。預后的程度與患者的總體評分直接相關。校準曲線圖顯示,列線圖的預測效果較好(圖3h)。
2.7 免疫相關性分析
本研究進一步探索了風險評分對腫瘤免疫治療的影響,結果顯示,風險評分與濾泡輔助性T細胞、CD8+T細胞、記憶性CD4+T細胞激活、漿細胞和M1巨噬細胞所占比例呈負相關(P<0.05),風險評分與記憶性CD4+T細胞休眠、中性粒細胞、單核細胞、肥大細胞休眠、M2巨噬細胞和樹突狀細胞激活呈正相關(P<0.05),見圖4。
3 討論
胃癌作為一種常見的惡性腫瘤,被發現時通常已是晚期,患者的預后普遍不理想[12]。早期胃癌通常采用傳統治療方法即手術切除,其中胃大部切除術+化療是公認最有效的胃癌治療方法,但由于其較多的并發癥,患者生活質量通常較差[13-14]。對于晚期的患者,中位OS為3~4個月,5年生存率僅為3.17%,總體預后難以令人滿意。近年來,隨著免疫療法的不斷進步,晚期胃癌的治療效果有了顯著提高[15]。研究[16]表明,胃癌患者的治療反應和預后與免疫細胞成分密切相關。
雙硫死亡作為一種新的細胞死亡方式,在腫瘤發生中的作用尚不明確。之前的研究表明,二硫化物在癌癥中起到促進復發作用[17],線粒體中二硫鍵的聚合可以改變腫瘤的進展,激活細胞壞死性凋亡[18]。當二硫化鉬(molybdenum disulfide,MoS2)與金屬有機骨架結合時,可以形成針對腫瘤的多功能診斷治療納米平臺[19]。Liu等[4]提出二硫化物在腫瘤細胞中的積累導致細胞解體和死亡,為腫瘤的治療提供了新的方向。
目前對胃癌的分類方法主要是基于腫瘤細胞的病理特征,根據許多研究,基于不同特征的胃癌亞型也可以揭示臨床相關性和預后價值[20]。本研究基于無監督聚類將患者分為兩種雙硫死亡亞型,試圖為胃癌診斷和治療的新特征模式提供理論依據。本研究發現,24個DRGs中有16個基因與預后有關。這可能是由于,當組織和細胞中的二硫鍵集聚時,腫瘤細胞的氧化還原系統被激活,進而使腫瘤細胞免于降解和死亡[21],這揭示了雙硫死亡是一種抗腫瘤細胞的關鍵方式。GO和KEGG分析也顯示,DEGs 在多種腫瘤相關通路顯著富集,這與甲狀腺癌[22]、乳腺癌[23]和肝癌[24]的研究結果是一致的。
為了探索雙硫死亡在胃癌中的作用,筆者從不同亞型的DEGs中篩選了14個關鍵基因構建了OS預測模型,并從內部和外部驗證了其準確性,結果顯示該模型能夠較準確地預測患者的預后。隨后,筆者探索了風險評分與免疫細胞浸潤的關系,結果顯示,大部分特異性免疫細胞比例與風險評分呈負相關,尤其是高風險評分時的CD8+T細胞浸潤降低,往往預示著更差的預后[25]。
對于這14個DRGs相關的mRNAs,既往的研究[26]發現,FLNA能夠通過抑制血管內皮生長因子的表達水平,進一步遏制腫瘤新血管的生成,最終抑制胃癌細胞的局部復發和遠處轉移;ALDH1B1是醛脫氫酶家族的成員,在促進結直腸癌和胰腺癌的進展中起到重要作用[27];除此之外,有研究[28]表明,EIF4E依賴性ALDH1B1抑制能夠增強鐵死亡誘導劑在體外和體內的抗癌活性;IL-33可使巨噬細胞向腫瘤起始細胞發送旁分泌TGF-β信號,誘導侵入性和耐藥性,并進一步上調IL-33表達[29]。TGFBR3、AHNAK2、THBS1和PDK4為甲狀腺癌[30]、結直腸癌[31]、胰腺癌[32]或胃癌[33]診斷和預后的治療靶點和潛在生物標志物,此外CHRNA3是肺癌中的顯著致癌基因,但在胃癌中的作用尚不明確[34];目前尚未發現PDE1A、OMD、DPT和PI16在癌癥預后中作用的相關報道。
然而,本研究也存在一些局限性。首先,本研究所有數據均來自于公共數據庫,缺乏基礎實驗驗證;第二,本研究結果需要更多的獨立隊列和更大的樣本量來驗證模型的準確性;第三,本研究是對胃癌的回顧性研究,未涉及基因的功能和機制驗證,這將是我們未來努力的方向。
總的來說,本研究在胃癌樣本中定量構建了雙硫死亡風險評分模型,該評分對腫瘤患者的預后評估具有一定的預測價值,是一種新的預后生物標志物。
重要聲明
利益沖突聲明:本文所有作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:蔡輝,指導研究;劉碩,分析數據及撰寫初稿;朱麗慧,整理數據并修改手稿;廖天一和張翔,技術支持及圖片制作。所有作者均審閱了此文稿并同意最終文稿。
胃癌(gastric cancer)是世界上最常見的癌癥之一,其進展快、治療效果不理想、死亡率高,已對人類的生命安全構成嚴重威脅[1]。盡管隨著醫學的不斷發展,胃癌的治療手段有了長足的進步,但其生存率仍無法令人滿意[2]。如何進一步改善胃癌患者的預后,提高生活質量,是一個亟待解決的健康問題。因此,開發出一些有效的腫瘤標志物用來指導胃癌患者的早期診斷和預后評價意義重大[3]。雙硫死亡(disulfidptosis)是一種最新發現的程序性死亡(programmed cell death,PCD)形式,研究[4]表明,細胞內二硫化物的異常積累,如胱氨酸,會誘導二硫化物應激,并對細胞產生高度毒性。在高表達SLC7A11的腫瘤細胞中,氧化還原狀態被改變,二硫化物積累破壞細胞組蛋白骨架間二硫鍵的正常結合,使其從細胞質膜上剝離,最終導致細胞死亡。因此,雙硫死亡與癌癥之間存在著密切的聯系。許多癌細胞通過氧化應激,導致二硫化物代謝紊亂,從而影響癌細胞的生存和增殖[5-6]。除此之外,雙硫死亡作為一種新的PCD模式,可能與腫瘤免疫反應有一定的相關性。雙硫死亡產生的細胞死亡信號能夠被腫瘤免疫細胞識別,從而激活腫瘤特異性T細胞的免疫反應,增強體液免疫和細胞免疫的有效性,最終提高腫瘤的治療效果[7]。在本研究中,筆者利用生物信息學的方法,建立了一個雙硫死亡相關的預后評分模型,以期為臨床免疫治療和預后評估提供新的思路。
1 方法
1.1 數據收集和處理
胃癌患者的轉錄組數據和臨床信息分別來自于TCGA(412例胃癌組織和36例正常對照)和GEO(483例胃癌組織)數據庫。TCGA數據庫選擇TCGA-STAD數據集中的mRNA表達數據,數據類型選擇FPKM;GEO數據庫選擇GSE84437數據集。數據庫樣本中的37%甲醛溶液浸泡樣本和轉移樣本被剔除,臨床病理數據缺失的個體在分析過程中也被排除。使用R軟件中的“SVA”包對數據去除批次效應。
1.2 雙硫死亡相關基因(disulfidptosis-related genes,DRGs)的表達與預后
從最近發表的一篇文獻[4]中獲得了24個DRGs用于后續的分析研究,分別為:SLC7A11、SLC3A2、RPN1、NCKAP1、NUBPL、NDUFA11、LRPPRC、OXSM、NDUFS1、GYS1、FLNA、FLNB、MYH9、TLN1、ACTB、MYL6、MYH10、CAPZB、DSTN、IQGAP1、ACTN4、PDLIM1、CD2AP和INF2。使用R軟件中的“ggpubr”包分析TCGA-STAD數據集并繪制DRGs表達箱線圖。之后,將上述2個數據集與生存數據合并,以供后續分析。其中總生存期(overall survival,OS)不明的樣本被剔除,此時TCGA-STAD和GSE84437數據集中剩余的樣本數分別為404例和433例,共計 837例樣本。R軟件中的“survival”包用于分析DRGs與OS之間的關系。根據Cox比例風險回歸計算其風險比(hazard ratio,HR)及其95%可信區間(confidence interval,95%CI)。本研究檢驗水準α=0.05。
1.3 樣本聚類分析
使用R軟件中的“Consensus Cluster Plus”包對24個DRGs表達進行無監督聚類分析,以識別不同的DRGs相關聚類[8]。應用“K-Means”算法,并使用“歐幾里得”作為距離單位,同時對80%的項目進行重新采樣和1 000次復制[9]。根據模糊聚類比例(proportion of ambiguous clustering,PAC)確定最佳k值(本研究為 2)。對兩個DRGs簇進行主成分分析(principal component analysis,PCA),以確定聚類結果的可靠性。使用對數秩檢驗比較兩類間OS的差異。
1.4 DRGs相關差異表達基因(differentially expressed genes,DEGs)的篩選和富集分析
采用R軟件的“limma”包用于探索兩個DRGs集群之間的DEGs,使用|log2 FC|>1 [FC為差異倍數(fold change)]和FDR<0.05 [FDR為錯誤發現率(false discovery rate)] 作為截止值[10]。使用“clusterProfiler”和“annotation”包對DRGs相關的DEGs進行基因本體(gene ontology,GO)和京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)富集分析[11]。
1.5 預后模型的建立
將整體集隨機平均分組為訓練集(n=419)和驗證集(n=418)。首先,在訓練集中使用R軟件中的“glmnet”包進行LASSO-Cox回歸分析,以縮小并選擇最理想的雙硫死亡相關的預后特征(disulfidptosis-related prognostic signature,DRPS)基因。根據模型中關鍵基因的表達譜,使用模型方程計算雙硫死亡風險評分。模型公式:風險評分= (expi為基因表達,coef為基因風險系數)。之后,根據訓練集的中位風險評分將所有參與研究的胃癌樣本分為高風險組和低風險組,并采用Cox比例風險回歸比較高低風險組的OS差異。
(expi為基因表達,coef為基因風險系數)。之后,根據訓練集的中位風險評分將所有參與研究的胃癌樣本分為高風險組和低風險組,并采用Cox比例風險回歸比較高低風險組的OS差異。
1.6 預測價值的驗證
在整體集、訓練集和驗證集中驗證預測模型的準確度。將所有樣本按照風險評分進行升序排列,并繪制生存狀況散點圖,以觀察風險評分與生存狀態的關系。分別繪制整體集、訓練集和驗證集的OS曲線和受試者工作特征(receiver operating characteristic,ROC)曲線,用于驗證模型的準確性。使用“rms”軟件包建立包含臨床參數的風險評分相關列線圖。為了評估實際生存率和列線圖預測生存率之間的擬合效果,生成了校準曲線。
1.7 免疫相關性分析
為了進一步觀察胃癌患者不同風險評分之間的潛在差異,使用CIBERSORT算法探索免疫細胞浸潤與風險的關聯。使用R包“CIBERSORT”計算每個胃癌樣本中免疫細胞亞群的比例,使用Spearman秩相關性分析計算風險評分、模型基因表達量和免疫細胞的相關性,使用R軟件的“ggplot”包將結果可視化。
2 結果
2.1 DRGs在胃癌中的表達譜
首先,在TCGA-STAD數據集中,與正常組織相比,胃癌組織中SLC7A11、SLC3A2、RPN1、NUBPL、LRPPRC、OXSM、FLNB、MYH9、MYH10、IQGAP1、PDLIM1、CD2AP和INF2共13種基因表達上調,FLNA、MYL6和DSTN表達下調,剩余8種基因則無統計學意義(圖1)。之后,使用整體集對所有胃癌樣本進行分析,單因素Cox比例風險回歸分析結果顯示,有9種基因影響OS:LRPPRC [HR=0.792,95%CI(0.649,0.968),P=0.023]、OXSM [HR=0.653,95%CI(0.509,0.838),P<0.001]、NDUFS1 [HR=0.729,95%CI(0.575,0.924),P=0.009]、GYS1 [HR=0.756,95%CI(0.591,0.967),P=0.026]、FLNA [HR=1.192,95%CI(1.095,1.297),P<0.001]、TLN1 [HR=1.188,95% CI(1.021,1.382),P=0.025]、MYL6 [HR=1.460,95%CI(1.158,1.839),P<0.001]、MYH10 [HR=1.191,95%CI(1.073,1.323),P=0.001] 和DSTN [HR=1.219,95%CI(1.048,1.417),P=0.010]。具體見表1。
 圖1
示DRGs在胃癌組織與正常組織間的表達差異,*P<0.05,**P<0.01,***P<0.001
圖1
示DRGs在胃癌組織與正常組織間的表達差異,*P<0.05,**P<0.01,***P<0.001
2.2 胃癌的DRGs簇識別
為全面了解胃癌中DRGs的表達模式,將來自TCGA-STAD和GSE84437數據集的樣本進行了整合。使用基于24個DRGs的一致聚類算法,在837個胃癌樣本中確定了兩種不同的亞型(圖2a),累積分布函數圖(cumulative distribution function,CDF)同樣表明,集群的最佳數量為2(圖2b)。因此,整合數據集被分為兩個DRGs集群,其中集群B表現出顯著的生存優勢(圖2c)。PCA結果顯示,兩個DRGs亞群能夠較明顯地將837例胃癌樣本區分開來(圖2d)。
 圖2
示胃癌的DRGs簇識別及驗證、GO富集分析和KEGG富集分析結果,以及風險評分與生存的關系
圖2
示胃癌的DRGs簇識別及驗證、GO富集分析和KEGG富集分析結果,以及風險評分與生存的關系
a:通過一致性聚類鑒定出雙硫死亡相關的兩種亞型;b:從
2.3 DRGs簇差異基因表達譜的富集分析
使用R軟件的“limma”包鑒定出2個DRGs集群之間的299個DEGs,并對299個DEGs進行GO和KEGG分析,以探索相關功能通路。GO富集分析結果顯示,DEGs與細胞外基質組織、硫化物結合、生長因子結合、整合素結合等功能有關。KEGG分析結果表明,血管平滑肌收縮、環磷酸鳥苷酸-蛋白激酶G(cyclic guanosine monophosphate-protein kinase G,cGMP-PKG)信號通路、Wnt信號通路、細胞外基質-受體相互作用、環磷酸腺苷(cyclic adenosine monophosphate,cAMP)信號通路、轉化生長因子β(transforming growth factor-β,TGF-β)信號通路等腫瘤相關通路顯著富集(圖2e和2f)。
2.4 雙硫死亡相關預后模型的構建
將299個DEGs作為種子基因,使用LASSO回歸識別出14個DEGs參與模型的構建,其相關風險系數見表2。通過中位風險值將所有患者(N總=837)分為高風險和低風險兩組。分別在整體集、訓練集和驗證集中,將所有樣本按照風險評分進行升序排列(圖2g~2l)。結果顯示,隨著風險的增加,生存期達到5年以上的患者逐漸減少、死亡患者逐漸增多,高低風險組之間具有較明顯的差異。
2.5 預后模型預測效果的驗證
本研究進一步驗證了預測模型對OS的預測效果,結果表明,在整體集、訓練集和驗證集中,高風險組的OS均差于低風險組(圖3a~3c),差異有統計學意義(P<0.05)。ROC曲線顯示,在整體集、訓練集和驗證集中,模型預測的1、3、5年生存率均顯示出了較好的靈敏度(圖3d~3f)。
 圖3
示不同風險胃癌患者的OS曲線及預后風險模型的ROC曲線、OS預測列線圖及其效能評估結果
圖3
示不同風險胃癌患者的OS曲線及預后風險模型的ROC曲線、OS預測列線圖及其效能評估結果
a、b、c:整體集(a)、訓練集(b)和驗證集(c)中高風險和低風險胃癌患者的OS曲線;d、e、f:預后風險模型預測整體集(d)、訓練集(e)和驗證集(f)中胃癌患者1、3、5 年總生存率的ROC曲線;g、h:OS預測列線圖(g)及其效能評估結果(h),***
2.6 預后模型的預測價值
使用整體集的數據,本研究通過“rms”軟件包創建了一個列線圖來預測胃癌患者1年、3年和5年的預期存活率(圖3g)。每例患者的總積分值是根據其性別、年齡、風險水平(低風險表示低DRGs評分,高風險表示高DRGs評分)以及腫瘤T和N分期來確定的。預后的程度與患者的總體評分直接相關。校準曲線圖顯示,列線圖的預測效果較好(圖3h)。
2.7 免疫相關性分析
本研究進一步探索了風險評分對腫瘤免疫治療的影響,結果顯示,風險評分與濾泡輔助性T細胞、CD8+T細胞、記憶性CD4+T細胞激活、漿細胞和M1巨噬細胞所占比例呈負相關(P<0.05),風險評分與記憶性CD4+T細胞休眠、中性粒細胞、單核細胞、肥大細胞休眠、M2巨噬細胞和樹突狀細胞激活呈正相關(P<0.05),見圖4。
3 討論
胃癌作為一種常見的惡性腫瘤,被發現時通常已是晚期,患者的預后普遍不理想[12]。早期胃癌通常采用傳統治療方法即手術切除,其中胃大部切除術+化療是公認最有效的胃癌治療方法,但由于其較多的并發癥,患者生活質量通常較差[13-14]。對于晚期的患者,中位OS為3~4個月,5年生存率僅為3.17%,總體預后難以令人滿意。近年來,隨著免疫療法的不斷進步,晚期胃癌的治療效果有了顯著提高[15]。研究[16]表明,胃癌患者的治療反應和預后與免疫細胞成分密切相關。
雙硫死亡作為一種新的細胞死亡方式,在腫瘤發生中的作用尚不明確。之前的研究表明,二硫化物在癌癥中起到促進復發作用[17],線粒體中二硫鍵的聚合可以改變腫瘤的進展,激活細胞壞死性凋亡[18]。當二硫化鉬(molybdenum disulfide,MoS2)與金屬有機骨架結合時,可以形成針對腫瘤的多功能診斷治療納米平臺[19]。Liu等[4]提出二硫化物在腫瘤細胞中的積累導致細胞解體和死亡,為腫瘤的治療提供了新的方向。
目前對胃癌的分類方法主要是基于腫瘤細胞的病理特征,根據許多研究,基于不同特征的胃癌亞型也可以揭示臨床相關性和預后價值[20]。本研究基于無監督聚類將患者分為兩種雙硫死亡亞型,試圖為胃癌診斷和治療的新特征模式提供理論依據。本研究發現,24個DRGs中有16個基因與預后有關。這可能是由于,當組織和細胞中的二硫鍵集聚時,腫瘤細胞的氧化還原系統被激活,進而使腫瘤細胞免于降解和死亡[21],這揭示了雙硫死亡是一種抗腫瘤細胞的關鍵方式。GO和KEGG分析也顯示,DEGs 在多種腫瘤相關通路顯著富集,這與甲狀腺癌[22]、乳腺癌[23]和肝癌[24]的研究結果是一致的。
為了探索雙硫死亡在胃癌中的作用,筆者從不同亞型的DEGs中篩選了14個關鍵基因構建了OS預測模型,并從內部和外部驗證了其準確性,結果顯示該模型能夠較準確地預測患者的預后。隨后,筆者探索了風險評分與免疫細胞浸潤的關系,結果顯示,大部分特異性免疫細胞比例與風險評分呈負相關,尤其是高風險評分時的CD8+T細胞浸潤降低,往往預示著更差的預后[25]。
對于這14個DRGs相關的mRNAs,既往的研究[26]發現,FLNA能夠通過抑制血管內皮生長因子的表達水平,進一步遏制腫瘤新血管的生成,最終抑制胃癌細胞的局部復發和遠處轉移;ALDH1B1是醛脫氫酶家族的成員,在促進結直腸癌和胰腺癌的進展中起到重要作用[27];除此之外,有研究[28]表明,EIF4E依賴性ALDH1B1抑制能夠增強鐵死亡誘導劑在體外和體內的抗癌活性;IL-33可使巨噬細胞向腫瘤起始細胞發送旁分泌TGF-β信號,誘導侵入性和耐藥性,并進一步上調IL-33表達[29]。TGFBR3、AHNAK2、THBS1和PDK4為甲狀腺癌[30]、結直腸癌[31]、胰腺癌[32]或胃癌[33]診斷和預后的治療靶點和潛在生物標志物,此外CHRNA3是肺癌中的顯著致癌基因,但在胃癌中的作用尚不明確[34];目前尚未發現PDE1A、OMD、DPT和PI16在癌癥預后中作用的相關報道。
然而,本研究也存在一些局限性。首先,本研究所有數據均來自于公共數據庫,缺乏基礎實驗驗證;第二,本研究結果需要更多的獨立隊列和更大的樣本量來驗證模型的準確性;第三,本研究是對胃癌的回顧性研究,未涉及基因的功能和機制驗證,這將是我們未來努力的方向。
總的來說,本研究在胃癌樣本中定量構建了雙硫死亡風險評分模型,該評分對腫瘤患者的預后評估具有一定的預測價值,是一種新的預后生物標志物。
重要聲明
利益沖突聲明:本文所有作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:蔡輝,指導研究;劉碩,分析數據及撰寫初稿;朱麗慧,整理數據并修改手稿;廖天一和張翔,技術支持及圖片制作。所有作者均審閱了此文稿并同意最終文稿。