引用本文: 趙凱, 張輝, 馬艷波. 微小RNA調控肝細胞癌鐵死亡的研究進展. 中國普外基礎與臨床雜志, 2023, 30(12): 1522-1528. doi: 10.7507/1007-9424.202308046 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
肝細胞癌(hepatocellular carcinoma,HCC)是全球第6大最常見的惡性腫瘤,也是全球癌癥死亡的第3大原因[1],雖然HCC在綜合治療上取得了可觀的進展,但總體預后并不樂觀,診斷延遲以及高轉移率和復發率是導致HCC預后不良的主要原因[2],因此早診斷和早治療對改善HCC患者的預后極其重要。然而目前還沒有有效的生物學標志物,因此,探索與HCC相關的分子機制,開發HCC新的臨床生物學標志物是迫切需要的。
微小RNA(microRNAs,miRNA)是一類非編碼小分子RNA,調控基因在轉錄后及翻譯水平的表達,主要參與多種生物過程,包括腫瘤的發生發展、細胞分化、信號級聯傳導和致癌作用[3]。miRNA高度穩定,可以在血液、唾液、尿液等多種生物體液中進行定量檢測,是一種優秀的腫瘤生物學標志物[4]。有研究[5-6]已經證實,miRNA作為一種新興的生物學標志物,在HCC的診斷和治療方面具備潛在的廣泛應用前景。
鐵死亡是一種由鐵依賴性脂質過氧化反應引起的細胞死亡形式,在2012年被確定為一種獨特的現象[7]。鐵死亡在廣泛的生物學背景中扮演重要角色,涵蓋了從發育到衰老、免疫、腫瘤等多個領域。近年來,鐵死亡在腫瘤研究中備受關注,部分原因是因為它代表一種獨特的細胞死亡方式,其機制和形態與其他類型的細胞死亡(如凋亡)截然不同,因此在腫瘤治療中極具潛力[8]。近年來,鐵死亡及其相關的非編碼RNA(特別是miRNA)在HCC的發生發展、耐藥及預后中的作用越來越受到人們的重視。在此,筆者就鐵死亡及其相關的miRNA在HCC的發生發展、耐藥性和預后中的作用作一綜述,以此作為臨床HCC的腫瘤標志物篩查和相關治療靶點提供新的思路和方向。
1 miRNA
1.1 miRNA與HCC
在過去的幾十年里,關于miRNA在腫瘤中的作用的研究越來越多,HCC中存在大量異常表達的miRNA[9]。 miRNA可作為HCC診斷和預后的生物學標志物。 血清甲胎蛋白(alpha-fetoprotein,AFP)表達與潛在的生物學標志物miR-122聯合檢測,有助于減少因特異性不足而導致的AFP檢測錯誤的缺點[10]。據報道,尿液中檢測到的5種miRNAs(miR-516-5P、miR-532、miR-618、miR-625和miR-650)可用于篩查HCC高危患者[9]。miRNA也可通過調控自噬(miR-423-5p、miR-142-3p)、作用于細胞凋亡(miR-221、miR-193b)、調控蛋白激酶B(protein kinase B,AKT)激活(miR-30a-5p、miR-375)等方面參與HCC的索拉非尼耐藥的調控[11]。慢性肝病中異常表達的miRNAs也可作為HCC的預后指標。HCC患者的miR-122水平顯著降低,而miR-122含量較高的患者術后復發率較低[9]。
1.2 miRNA與競爭性內源性RNA(competing endogenous RNAs,ceRNA)網絡
非編碼RNA相關的ceRNA 調控網絡是HCC診斷和治療的新機遇,主要包括兩類:一類是LncRNA/miRNA/mRNA 網絡(如LncRNA LINC00160/miR- 132/mRNA PIK3R3網絡);另一類是環狀RNA (Circular RNA,CircRNA)/miRNA/mRNA 網絡(如CircRNA TRIM33-12/miR- 191/mRNA TET1網絡)。通過ceRNA機制,miRNA可參與調控HCC細胞增殖失控、抵抗細胞死亡、代謝重編程、免疫逃逸、血管生成、轉移等眾多表型的調控[12]。
1.3 miRNA與外泌體
作為一種新的細胞間信號交流方式,外泌體通過定向傳遞多種生物活性物質(包含脂質、蛋白質、DNA、miRNA等其他分子)參與介導多種病理、生理過程[13-14]。不同來源外泌體具有異質性,在HCC的診斷與治療中發揮不同作用,如骨髓間充質干細胞分泌的外泌體mi-croRNA-205-5p能調節細胞周期依賴性激酶3(cyclin-dependent kinase-like 3,CDKL3),進而抑制HCC進展[15]。先前的研究[16]表明,某些miRNA通過RNA結合蛋白輸出到外泌體中,而對于其他miRNA,其輸出機制有待進一步研究。外泌體傳遞到受體細胞的途徑有3種:受體-配體相互作用、膜直接融合和內吞/吞噬作用[17]。外泌體miRNA參與調控HCC細胞與腫瘤微環境之間復雜的相互作用,并通過特定的方法如腫瘤血管生成、細胞外基質重塑、上皮-間充質轉化(epithelial-mesenchymal transition,EMT)、耐藥、免疫逃逸等介導HCC的發展[18]。
1.4 miRNA與免疫
miRNA參與調控HCC腫瘤微環境中相關的免疫細胞。T細胞激活過程復雜,涉及許多轉錄和轉錄后調節因子,也包括miRNAs[19]。miR-144/451a簇可促進HCC中M1巨噬細胞極化和抗腫瘤活性。HCC患者的自然殺傷(natural killer,NK)細胞中miR-615-5p的表達上調,沉默miR-615-5p的表達會削弱NK細胞的毒性[19]。另外,miR-378a-3p直接靶向程序性死亡配體-1(programmed death-ligand 1,PD-L1),并通過抑制HCC細胞中的信號轉導與轉錄激活子3(signal transducer and activator of transcription 3,STAT3)信號誘導凋亡[20]。
2 鐵死亡
2.1 鐵死亡概述
鐵死亡是一種新的程序性細胞死亡方式,它依賴于鐵離子,由脂質過氧化物累積引起。這種死亡方式與細胞壞死、凋亡和自噬截然不同,在許多疾病如腫瘤、神經疾病、腎衰竭和血液系統疾病中發揮著關鍵作用[21]。溶質載體家族7成員11(solute carrier family 7 member 11,SLC7A11)、谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)、二氫乳清酸脫氫酶(dihydroorotate dehydrogenase,DHODH)和線粒體相關凋亡誘導因子2(apoptosis-inducing factor 2,AIFM2)是目前發現的調控細胞鐵死亡的關鍵基因[22]。鐵死亡的主要過程見圖1。越來越多的研究[23-24]表明,腫瘤細胞可表現出對鐵死亡的抵抗性,因此誘導腫瘤細胞發生鐵死亡有望成為一種新的抗癌治療方法。
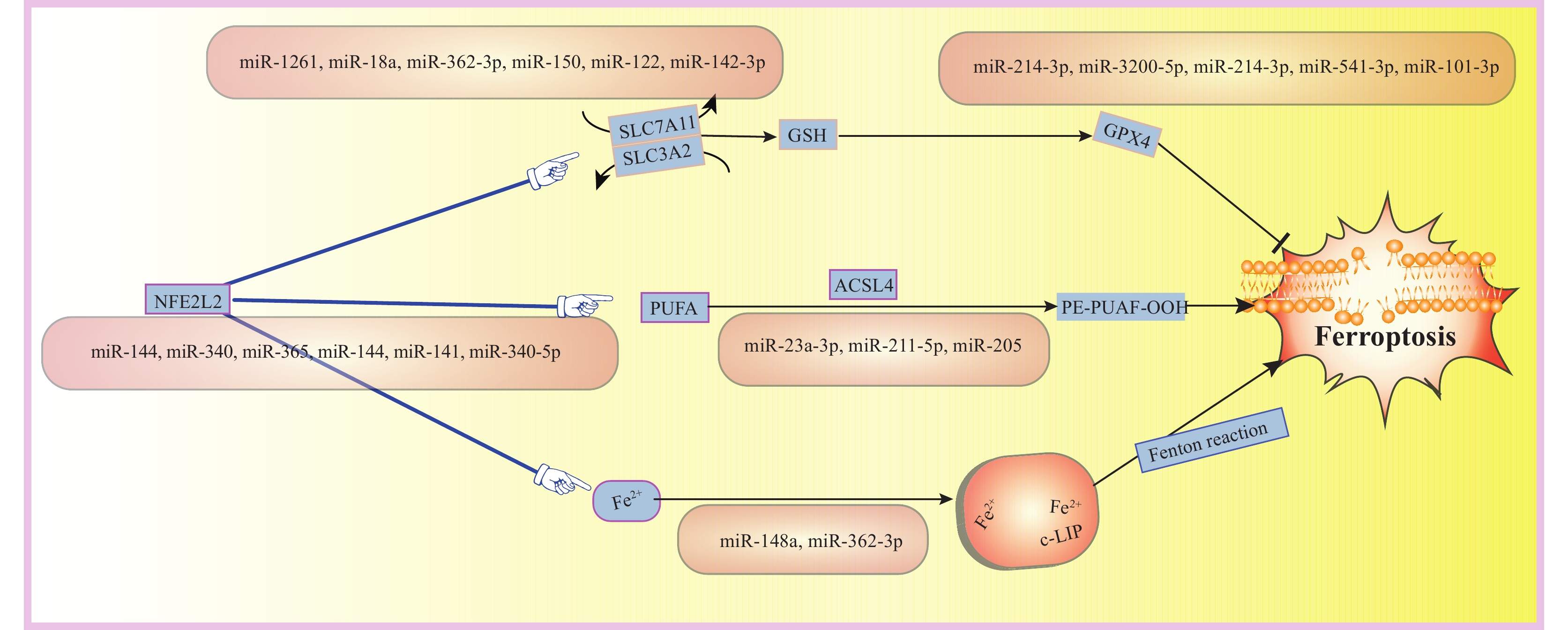
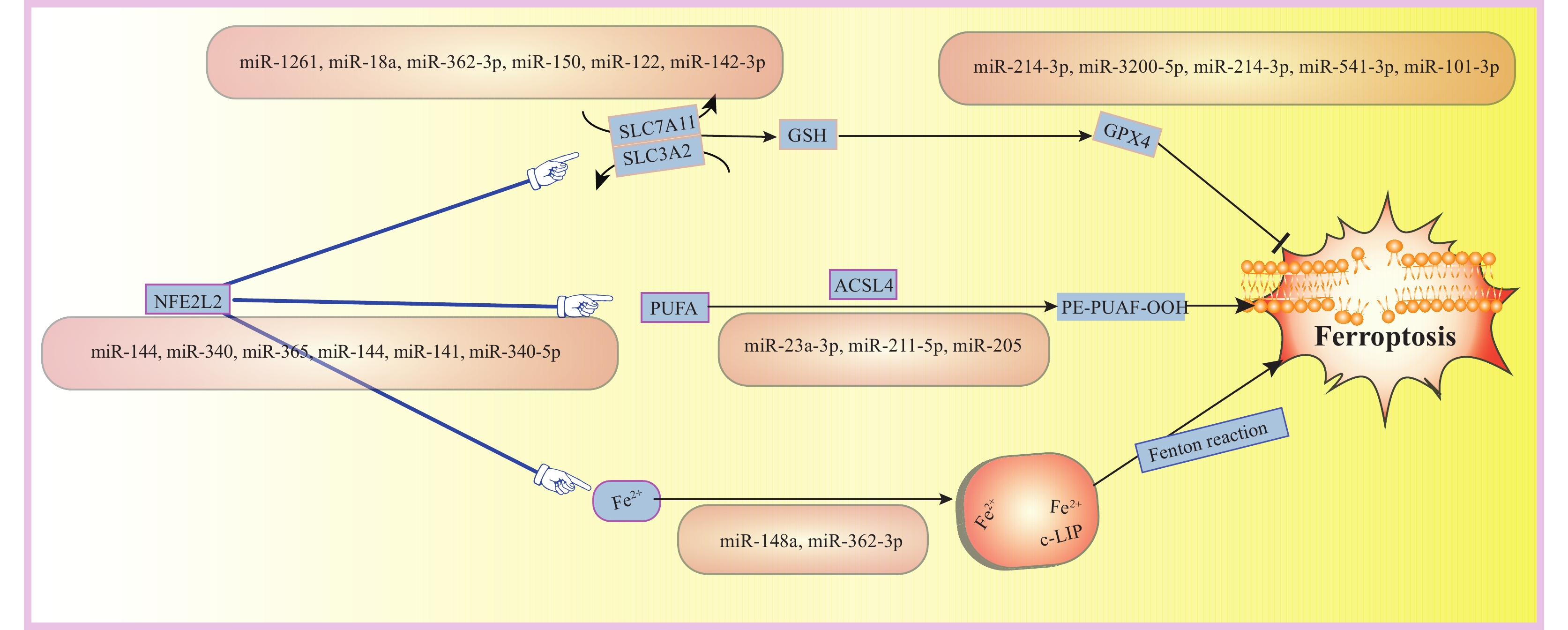 圖1
示鐵死亡主要機制以及HCC中涉及鐵死亡的相關miRNAs
圖1
示鐵死亡主要機制以及HCC中涉及鐵死亡的相關miRNAs
NFE2L2(NRF2):核因子E2相關因子2;SLC7A11:溶質載體家族7成員11;SLC3A2:溶質載體族3成員2;GSH:谷胱甘肽還原型;GPX4:谷胱甘肽過氧化物酶4;PUFA:多不飽和脂肪酸;ACSL4:乙酰輔酶A合成酶長鏈家族成員4;PE-PUFAs-OOH:脂質過氧化;c-LIP:胞質不穩定鐵池;Fenton reaction:芬頓反應;Ferroptosis:鐵死亡
2.2 鐵死亡在腫瘤疾病中的潛在價值
腫瘤性疾病對鐵死亡的敏感性對于潛在的治療策略非常重要。腫瘤細胞的新陳代謝實質上被重組,以滿足其增加的生物能量和生物合成需求,并支持其快速增殖。這種新陳代謝重編程通常會導致獨特的新陳代謝特征,例如多不飽和脂肪酸磷脂(polyunsaturated fatty acid phospholipid,PUFA-PL)的富集、鐵超載和不平衡的鐵死亡防御系統,這可能會產生針對性鐵死亡的脆弱性,并為發現腫瘤新的治療靶點提供了一個的機會[8]。近年來,鐵死亡誘導劑(ferroptosis inducers,FINs)因其巨大的治療潛力而在腫瘤研究中引起了極大的興趣。越來越多的證據[25-28]表明,鐵死亡至少部分地介導了幾種傳統腫瘤治療的腫瘤抑制效應,包括放射治療、化學治療、靶向治療和免疫治療,FINs可以通過增強腫瘤的鐵死亡來增強這些療法的療效。此外,已經開發出多種納米材料來局部誘導鐵死亡或增強FINs的活性[22]。
3 HCC中介導鐵死亡的miRNA
近年來,一些研究集中于HCC中的鐵死亡,并對其分子機制進行了深入探討,進一步揭示了miRNA在HCC中調節鐵死亡的作用,以此為開發和研究新型HCC治療模式提供新的視角(圖1)。 針對介導HCC鐵死亡的miRNA已經在HCC的研究中被發現,這些相關miRNA主要通過上游調節作用于各種靶點/通路,從而調節HCC的鐵死亡,影響HCC的發生發展,為miRNA治療HCC提供了理論基礎(表1)。
3.1 鐵死亡、miRNA和HCC三者之間相關調控機制
鐵死亡與細胞代謝密切相關,而腫瘤細胞的發展過程中伴隨有多種代謝異常,因此,腫瘤的發生發展與鐵死亡密切相關[29],誘導鐵死亡可能成為一種新的腫瘤治療方法。近年來,有許多關于HCC與鐵死亡的相關研究,鐵死亡在HCC中主要受胱氨酸/谷氨酸反向轉運蛋白(cystine/glutamate antiporter,system Xc?)和GPX4調控,影響system Xc?或GPX4活性能誘導HCC細胞鐵死亡[30]。此外,腫瘤抑制基因p53可通過調控鐵死亡影響HCC發生發展[31]。miRNA-214通過抑制激動轉錄因子4表達,抑制谷胱甘肽合成,誘導HCC細胞鐵死亡[32]。磷酸烯醇吡啶酸酶1(enolase 1,ENO1)結合并降解鐵調蛋白(iron regulatory protein 1,IRP1)基因的mRNA,從而調控細胞內鐵離子的代謝穩態,影響鐵死亡而促進HCC的發生發展[33]。總之,這些鐵死亡在HCC中的分子機制均提示鐵死亡與HCC的發生發展密切相關。
研究[34]表明,在腫瘤細胞中miRNA可以通過對mRNA的轉錄或轉錄后水平進行調控,從而影響細胞的鐵死亡,其機制涉及到脂質過氧化、鐵代謝、谷胱甘肽代謝、線粒體相關蛋白、谷氨酰胺分解、p53信號通路等,在腫瘤的發生和發展中發揮著至關重要的作用。在HCC中,miRNA的表達量變化可直接表現為一種原癌基因或抑癌基因的作用。這些致癌與抑癌的miRNA通過正向或負向調控腫瘤抑制基因、原癌基因或者控制細胞周期進程、分化或凋亡的基因,從而直接調控腫瘤細胞的增殖、分化和凋亡,參與腫瘤的生成、發展甚至侵襲轉移[3]。
3.2 ceRNA機制
ceRNA網絡廣泛參與調控HCC細胞的鐵死亡過程。其中,臨床常用的靜脈全麻藥物氯胺酮可通過靶向LncRNA PVT1/miR-214-3p/GPX4軸,誘導HCC細胞鐵死亡[35]。Circ0097009通過吸附miR-1261,作為ceRNA調節癌細胞鐵死亡的關鍵調節因子SLC7A11的表達。Circ0097009可作為HCC的診斷標志物和治療的潛在靶點[36]。CircIL4R通過調節miR-541-3p/Gpx4軸,抑制鐵死亡,促進HCC的發生[37]。 LncRNA核富集豐度轉錄物1(nuclear enriched abundant transcript 1,NEAT1)參與了腫瘤細胞周期、增殖、凋亡和遷移的調控。LncRNA NEAT1通過調控miR-362-3p/腎內氧化還原酶(myo-inositol oxygenase,MIOX)軸作為ceRNA促進鐵死亡[38]。LncRNA肝癌高表達 (highly upregulated in liver cancer,HULC) 是miR-3200-5p的ceRNA,miR-3200-5p通過靶向激活轉錄因子4(activating transcription factor 4,ATF4)調控鐵死亡,從而抑制HCC細胞的增殖和轉移[39]。LncRNA漿細胞瘤轉化遷移基因1(plasmacytoma variant translocation 1,PVT1)在HCC組織和細胞系中表達上調,通過PVT1/miR-150/低氧誘導因子1α誘導基因2(hypoxia-inducible factor 1 alpha-inducible gene 2,HIG2)軸調節HCC的的增殖、侵襲和鐵代謝平衡[40]。Wu等[41]通過采用細胞增殖實驗、Western印跡分析、qRT-PCR和RNA免疫沉淀等方法,研究KRAL介導5-氟尿嘧啶(5-fluorouracil,5-FU)耐藥的機制,研究發現LncRNA KRAL通過充當針對miR-141的ceRNA來逆轉HCC細胞中的5-FU抗性。此外,Wu等[42]在研究中發現一種名為NRAL的新型LncRNA,并且發現可通過NRAL/miR-340-5p/核轉錄因子紅系2相關因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)軸介導HCC的順鉑耐藥,這可能為克服HCC細胞的順鉑耐藥提供新的靶點。
3.3 靶向Nrf2依賴的抗氧化途徑
Nrf2是抗氧化防御的關鍵因子,它可以增強抗氧化反應以對抗氧化應激。Nrf2在鐵代謝和谷胱甘肽合成中起著至關重要的作用[22]。miR-144和miR-340可以通過靶向Nrf2依賴的抗氧化途徑逆轉HCC細胞株的化療耐藥性[43-44]。LncRNA MT1DP,依賴于與miR-365的相互作用,抑制Nrf2的功能加重鎘誘導HCC細胞的氧化應激[45]。miR-141通過下調抗氧化蛋白1(kelch-like ECH-associated protein 1,Keap1)的表達激活Nrf2依賴的抗氧化途徑,使HCC細胞對5-FU耐藥[46]。
3.4 其他
除上述機制外,miRNA也通過影響鐵死亡過程調節HCC的增殖、耐藥等相關表型。激活轉錄因子家族成員之一的ATF4能促進腫瘤生長,提高腫瘤在缺氧條件下的耐受能力,并可通過多種機制參與腫瘤細胞的浸潤及轉移,在腫瘤的發生發展中起重要作用[47]。 miR-214-3p過表達可增加鐵死亡誘導劑Erastin處理的HepG2和Hep3B HCC細胞內Fe2+的濃度,還可增加了HCC細胞對Erastin誘導的鐵死亡的敏感性。有研究[32]還證明了這一過程與miR-214-3p直接靶向ATF4并抑制其活性有關,并將miR-214高表達的HCC細胞接種于裸鼠皮下,發現腫瘤組織中miR-214的表達增加,而ATF4的表達降低,miR-214增強了Erastin的作用,進一步縮小了腫瘤體積。該研究結果提示,miR-214通過直接靶向ATF4增強了Erastin誘導的HCC細胞鐵死亡,miR-214-ATF4軸可能是HCC鐵死亡治療的新靶點。
此外,有研究還發現miR-142-3p通過載體蛋白 3A2(solute carrier family 3 member 2,SLC3A2)促進乙肝病毒感染的M1型巨噬細胞鐵凋亡,影響還原型谷胱甘肽、丙二醛和Fe2+的產生,加速HCC的進展[48]。miR-23a-3p是HCC中顯著的miRNA,在索拉非尼耐藥患者中高表達,提示HCC復發和生存不良。脂肪酸輔酶A合成酶4(acyl-CoA synthetase 4,ACSL4)是鐵死亡的關鍵正調控因子,miR-23a-3p可以直接靶向ACSL4的3-非翻譯區[49]。一種納米藥物,可以將miR-101-3p運送到體內的腫瘤細胞中,通過直接靶向TBL1相關蛋白1(transducin beta-like 1 related protein 1,TBLR1)恢復腫瘤細胞的鐵死亡,進而促進腫瘤細胞的凋亡并抑制其增殖[50]。miR-122調控肝臟谷氨酰胺代謝[51]。乙型肝炎病毒X蛋白通過上調miR-205靶向ACSL4誘導HCC細胞脂質代謝異常[52]。細胞周期調控蛋白MYC是一種作用廣泛的轉錄因子,它通過多種機制調節細胞的分化和增殖。MYC驅動的谷氨酸-半胱氨酸連接酶抑制促進HCC中谷胱甘肽的消耗[53]。ACSL4是HCC中miR-211-5p的直接下游靶點,而miR-211-5p通過抑制ACSL4的表達來抑制惡性表型[54]。轉鐵蛋白受體1(transferrin receptor 1,TFR1)是跨膜糖蛋白,其允許哺乳動物細胞中轉鐵蛋白結合的鐵攝取。它在各種腫瘤中過表達以滿足快速增殖細胞的高鐵需求。miR-148a調節TFR1在HCC中的表達[55]。
4 展望
作為一種獨特的調節性細胞死亡形式,鐵死亡與許多疾病相關,尤其是與腫瘤相關。已有許多研究集中于探索通過鐵死亡途徑調控腫瘤進展的具體機制。在過去,miRNA在腫瘤中的作用往往與細胞周期調控基因有關,但近年來發現一些miRNA可通過鐵死亡途徑調控腫瘤的發生發展。筆者就鐵死亡及其相關的miRNA在HCC的發生發展和預后中的作用及功能作了概括,有助于進一步了解HCC的發病機制,并證明了與鐵死亡相關的一系列miRNA可能作為腫瘤生長調節劑來調控腫瘤細胞生長,或逆轉腫瘤細胞的耐藥性。但我們對鐵死亡調控機制的了解仍相當有限,仍需進一步研究。與鐵死亡相關的miRNA通過調節鐵死亡,具有作為抗癌治療靶點的巨大潛力。針對這些關鍵的miRNA,可能發現診斷HCC的生物標志物或為HCC患者的治療提供新方法以改善其預后。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:趙凱,負責選題、文獻檢索和初稿撰寫工作;張輝,負責文獻檢索及文章修改;馬艷波,指導選題、審閱文章并及提出修改意見。
肝細胞癌(hepatocellular carcinoma,HCC)是全球第6大最常見的惡性腫瘤,也是全球癌癥死亡的第3大原因[1],雖然HCC在綜合治療上取得了可觀的進展,但總體預后并不樂觀,診斷延遲以及高轉移率和復發率是導致HCC預后不良的主要原因[2],因此早診斷和早治療對改善HCC患者的預后極其重要。然而目前還沒有有效的生物學標志物,因此,探索與HCC相關的分子機制,開發HCC新的臨床生物學標志物是迫切需要的。
微小RNA(microRNAs,miRNA)是一類非編碼小分子RNA,調控基因在轉錄后及翻譯水平的表達,主要參與多種生物過程,包括腫瘤的發生發展、細胞分化、信號級聯傳導和致癌作用[3]。miRNA高度穩定,可以在血液、唾液、尿液等多種生物體液中進行定量檢測,是一種優秀的腫瘤生物學標志物[4]。有研究[5-6]已經證實,miRNA作為一種新興的生物學標志物,在HCC的診斷和治療方面具備潛在的廣泛應用前景。
鐵死亡是一種由鐵依賴性脂質過氧化反應引起的細胞死亡形式,在2012年被確定為一種獨特的現象[7]。鐵死亡在廣泛的生物學背景中扮演重要角色,涵蓋了從發育到衰老、免疫、腫瘤等多個領域。近年來,鐵死亡在腫瘤研究中備受關注,部分原因是因為它代表一種獨特的細胞死亡方式,其機制和形態與其他類型的細胞死亡(如凋亡)截然不同,因此在腫瘤治療中極具潛力[8]。近年來,鐵死亡及其相關的非編碼RNA(特別是miRNA)在HCC的發生發展、耐藥及預后中的作用越來越受到人們的重視。在此,筆者就鐵死亡及其相關的miRNA在HCC的發生發展、耐藥性和預后中的作用作一綜述,以此作為臨床HCC的腫瘤標志物篩查和相關治療靶點提供新的思路和方向。
1 miRNA
1.1 miRNA與HCC
在過去的幾十年里,關于miRNA在腫瘤中的作用的研究越來越多,HCC中存在大量異常表達的miRNA[9]。 miRNA可作為HCC診斷和預后的生物學標志物。 血清甲胎蛋白(alpha-fetoprotein,AFP)表達與潛在的生物學標志物miR-122聯合檢測,有助于減少因特異性不足而導致的AFP檢測錯誤的缺點[10]。據報道,尿液中檢測到的5種miRNAs(miR-516-5P、miR-532、miR-618、miR-625和miR-650)可用于篩查HCC高危患者[9]。miRNA也可通過調控自噬(miR-423-5p、miR-142-3p)、作用于細胞凋亡(miR-221、miR-193b)、調控蛋白激酶B(protein kinase B,AKT)激活(miR-30a-5p、miR-375)等方面參與HCC的索拉非尼耐藥的調控[11]。慢性肝病中異常表達的miRNAs也可作為HCC的預后指標。HCC患者的miR-122水平顯著降低,而miR-122含量較高的患者術后復發率較低[9]。
1.2 miRNA與競爭性內源性RNA(competing endogenous RNAs,ceRNA)網絡
非編碼RNA相關的ceRNA 調控網絡是HCC診斷和治療的新機遇,主要包括兩類:一類是LncRNA/miRNA/mRNA 網絡(如LncRNA LINC00160/miR- 132/mRNA PIK3R3網絡);另一類是環狀RNA (Circular RNA,CircRNA)/miRNA/mRNA 網絡(如CircRNA TRIM33-12/miR- 191/mRNA TET1網絡)。通過ceRNA機制,miRNA可參與調控HCC細胞增殖失控、抵抗細胞死亡、代謝重編程、免疫逃逸、血管生成、轉移等眾多表型的調控[12]。
1.3 miRNA與外泌體
作為一種新的細胞間信號交流方式,外泌體通過定向傳遞多種生物活性物質(包含脂質、蛋白質、DNA、miRNA等其他分子)參與介導多種病理、生理過程[13-14]。不同來源外泌體具有異質性,在HCC的診斷與治療中發揮不同作用,如骨髓間充質干細胞分泌的外泌體mi-croRNA-205-5p能調節細胞周期依賴性激酶3(cyclin-dependent kinase-like 3,CDKL3),進而抑制HCC進展[15]。先前的研究[16]表明,某些miRNA通過RNA結合蛋白輸出到外泌體中,而對于其他miRNA,其輸出機制有待進一步研究。外泌體傳遞到受體細胞的途徑有3種:受體-配體相互作用、膜直接融合和內吞/吞噬作用[17]。外泌體miRNA參與調控HCC細胞與腫瘤微環境之間復雜的相互作用,并通過特定的方法如腫瘤血管生成、細胞外基質重塑、上皮-間充質轉化(epithelial-mesenchymal transition,EMT)、耐藥、免疫逃逸等介導HCC的發展[18]。
1.4 miRNA與免疫
miRNA參與調控HCC腫瘤微環境中相關的免疫細胞。T細胞激活過程復雜,涉及許多轉錄和轉錄后調節因子,也包括miRNAs[19]。miR-144/451a簇可促進HCC中M1巨噬細胞極化和抗腫瘤活性。HCC患者的自然殺傷(natural killer,NK)細胞中miR-615-5p的表達上調,沉默miR-615-5p的表達會削弱NK細胞的毒性[19]。另外,miR-378a-3p直接靶向程序性死亡配體-1(programmed death-ligand 1,PD-L1),并通過抑制HCC細胞中的信號轉導與轉錄激活子3(signal transducer and activator of transcription 3,STAT3)信號誘導凋亡[20]。
2 鐵死亡
2.1 鐵死亡概述
鐵死亡是一種新的程序性細胞死亡方式,它依賴于鐵離子,由脂質過氧化物累積引起。這種死亡方式與細胞壞死、凋亡和自噬截然不同,在許多疾病如腫瘤、神經疾病、腎衰竭和血液系統疾病中發揮著關鍵作用[21]。溶質載體家族7成員11(solute carrier family 7 member 11,SLC7A11)、谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)、二氫乳清酸脫氫酶(dihydroorotate dehydrogenase,DHODH)和線粒體相關凋亡誘導因子2(apoptosis-inducing factor 2,AIFM2)是目前發現的調控細胞鐵死亡的關鍵基因[22]。鐵死亡的主要過程見圖1。越來越多的研究[23-24]表明,腫瘤細胞可表現出對鐵死亡的抵抗性,因此誘導腫瘤細胞發生鐵死亡有望成為一種新的抗癌治療方法。
 圖1
示鐵死亡主要機制以及HCC中涉及鐵死亡的相關miRNAs
圖1
示鐵死亡主要機制以及HCC中涉及鐵死亡的相關miRNAs
NFE2L2(NRF2):核因子E2相關因子2;SLC7A11:溶質載體家族7成員11;SLC3A2:溶質載體族3成員2;GSH:谷胱甘肽還原型;GPX4:谷胱甘肽過氧化物酶4;PUFA:多不飽和脂肪酸;ACSL4:乙酰輔酶A合成酶長鏈家族成員4;PE-PUFAs-OOH:脂質過氧化;c-LIP:胞質不穩定鐵池;Fenton reaction:芬頓反應;Ferroptosis:鐵死亡
2.2 鐵死亡在腫瘤疾病中的潛在價值
腫瘤性疾病對鐵死亡的敏感性對于潛在的治療策略非常重要。腫瘤細胞的新陳代謝實質上被重組,以滿足其增加的生物能量和生物合成需求,并支持其快速增殖。這種新陳代謝重編程通常會導致獨特的新陳代謝特征,例如多不飽和脂肪酸磷脂(polyunsaturated fatty acid phospholipid,PUFA-PL)的富集、鐵超載和不平衡的鐵死亡防御系統,這可能會產生針對性鐵死亡的脆弱性,并為發現腫瘤新的治療靶點提供了一個的機會[8]。近年來,鐵死亡誘導劑(ferroptosis inducers,FINs)因其巨大的治療潛力而在腫瘤研究中引起了極大的興趣。越來越多的證據[25-28]表明,鐵死亡至少部分地介導了幾種傳統腫瘤治療的腫瘤抑制效應,包括放射治療、化學治療、靶向治療和免疫治療,FINs可以通過增強腫瘤的鐵死亡來增強這些療法的療效。此外,已經開發出多種納米材料來局部誘導鐵死亡或增強FINs的活性[22]。
3 HCC中介導鐵死亡的miRNA
近年來,一些研究集中于HCC中的鐵死亡,并對其分子機制進行了深入探討,進一步揭示了miRNA在HCC中調節鐵死亡的作用,以此為開發和研究新型HCC治療模式提供新的視角(圖1)。 針對介導HCC鐵死亡的miRNA已經在HCC的研究中被發現,這些相關miRNA主要通過上游調節作用于各種靶點/通路,從而調節HCC的鐵死亡,影響HCC的發生發展,為miRNA治療HCC提供了理論基礎(表1)。
3.1 鐵死亡、miRNA和HCC三者之間相關調控機制
鐵死亡與細胞代謝密切相關,而腫瘤細胞的發展過程中伴隨有多種代謝異常,因此,腫瘤的發生發展與鐵死亡密切相關[29],誘導鐵死亡可能成為一種新的腫瘤治療方法。近年來,有許多關于HCC與鐵死亡的相關研究,鐵死亡在HCC中主要受胱氨酸/谷氨酸反向轉運蛋白(cystine/glutamate antiporter,system Xc?)和GPX4調控,影響system Xc?或GPX4活性能誘導HCC細胞鐵死亡[30]。此外,腫瘤抑制基因p53可通過調控鐵死亡影響HCC發生發展[31]。miRNA-214通過抑制激動轉錄因子4表達,抑制谷胱甘肽合成,誘導HCC細胞鐵死亡[32]。磷酸烯醇吡啶酸酶1(enolase 1,ENO1)結合并降解鐵調蛋白(iron regulatory protein 1,IRP1)基因的mRNA,從而調控細胞內鐵離子的代謝穩態,影響鐵死亡而促進HCC的發生發展[33]。總之,這些鐵死亡在HCC中的分子機制均提示鐵死亡與HCC的發生發展密切相關。
研究[34]表明,在腫瘤細胞中miRNA可以通過對mRNA的轉錄或轉錄后水平進行調控,從而影響細胞的鐵死亡,其機制涉及到脂質過氧化、鐵代謝、谷胱甘肽代謝、線粒體相關蛋白、谷氨酰胺分解、p53信號通路等,在腫瘤的發生和發展中發揮著至關重要的作用。在HCC中,miRNA的表達量變化可直接表現為一種原癌基因或抑癌基因的作用。這些致癌與抑癌的miRNA通過正向或負向調控腫瘤抑制基因、原癌基因或者控制細胞周期進程、分化或凋亡的基因,從而直接調控腫瘤細胞的增殖、分化和凋亡,參與腫瘤的生成、發展甚至侵襲轉移[3]。
3.2 ceRNA機制
ceRNA網絡廣泛參與調控HCC細胞的鐵死亡過程。其中,臨床常用的靜脈全麻藥物氯胺酮可通過靶向LncRNA PVT1/miR-214-3p/GPX4軸,誘導HCC細胞鐵死亡[35]。Circ0097009通過吸附miR-1261,作為ceRNA調節癌細胞鐵死亡的關鍵調節因子SLC7A11的表達。Circ0097009可作為HCC的診斷標志物和治療的潛在靶點[36]。CircIL4R通過調節miR-541-3p/Gpx4軸,抑制鐵死亡,促進HCC的發生[37]。 LncRNA核富集豐度轉錄物1(nuclear enriched abundant transcript 1,NEAT1)參與了腫瘤細胞周期、增殖、凋亡和遷移的調控。LncRNA NEAT1通過調控miR-362-3p/腎內氧化還原酶(myo-inositol oxygenase,MIOX)軸作為ceRNA促進鐵死亡[38]。LncRNA肝癌高表達 (highly upregulated in liver cancer,HULC) 是miR-3200-5p的ceRNA,miR-3200-5p通過靶向激活轉錄因子4(activating transcription factor 4,ATF4)調控鐵死亡,從而抑制HCC細胞的增殖和轉移[39]。LncRNA漿細胞瘤轉化遷移基因1(plasmacytoma variant translocation 1,PVT1)在HCC組織和細胞系中表達上調,通過PVT1/miR-150/低氧誘導因子1α誘導基因2(hypoxia-inducible factor 1 alpha-inducible gene 2,HIG2)軸調節HCC的的增殖、侵襲和鐵代謝平衡[40]。Wu等[41]通過采用細胞增殖實驗、Western印跡分析、qRT-PCR和RNA免疫沉淀等方法,研究KRAL介導5-氟尿嘧啶(5-fluorouracil,5-FU)耐藥的機制,研究發現LncRNA KRAL通過充當針對miR-141的ceRNA來逆轉HCC細胞中的5-FU抗性。此外,Wu等[42]在研究中發現一種名為NRAL的新型LncRNA,并且發現可通過NRAL/miR-340-5p/核轉錄因子紅系2相關因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)軸介導HCC的順鉑耐藥,這可能為克服HCC細胞的順鉑耐藥提供新的靶點。
3.3 靶向Nrf2依賴的抗氧化途徑
Nrf2是抗氧化防御的關鍵因子,它可以增強抗氧化反應以對抗氧化應激。Nrf2在鐵代謝和谷胱甘肽合成中起著至關重要的作用[22]。miR-144和miR-340可以通過靶向Nrf2依賴的抗氧化途徑逆轉HCC細胞株的化療耐藥性[43-44]。LncRNA MT1DP,依賴于與miR-365的相互作用,抑制Nrf2的功能加重鎘誘導HCC細胞的氧化應激[45]。miR-141通過下調抗氧化蛋白1(kelch-like ECH-associated protein 1,Keap1)的表達激活Nrf2依賴的抗氧化途徑,使HCC細胞對5-FU耐藥[46]。
3.4 其他
除上述機制外,miRNA也通過影響鐵死亡過程調節HCC的增殖、耐藥等相關表型。激活轉錄因子家族成員之一的ATF4能促進腫瘤生長,提高腫瘤在缺氧條件下的耐受能力,并可通過多種機制參與腫瘤細胞的浸潤及轉移,在腫瘤的發生發展中起重要作用[47]。 miR-214-3p過表達可增加鐵死亡誘導劑Erastin處理的HepG2和Hep3B HCC細胞內Fe2+的濃度,還可增加了HCC細胞對Erastin誘導的鐵死亡的敏感性。有研究[32]還證明了這一過程與miR-214-3p直接靶向ATF4并抑制其活性有關,并將miR-214高表達的HCC細胞接種于裸鼠皮下,發現腫瘤組織中miR-214的表達增加,而ATF4的表達降低,miR-214增強了Erastin的作用,進一步縮小了腫瘤體積。該研究結果提示,miR-214通過直接靶向ATF4增強了Erastin誘導的HCC細胞鐵死亡,miR-214-ATF4軸可能是HCC鐵死亡治療的新靶點。
此外,有研究還發現miR-142-3p通過載體蛋白 3A2(solute carrier family 3 member 2,SLC3A2)促進乙肝病毒感染的M1型巨噬細胞鐵凋亡,影響還原型谷胱甘肽、丙二醛和Fe2+的產生,加速HCC的進展[48]。miR-23a-3p是HCC中顯著的miRNA,在索拉非尼耐藥患者中高表達,提示HCC復發和生存不良。脂肪酸輔酶A合成酶4(acyl-CoA synthetase 4,ACSL4)是鐵死亡的關鍵正調控因子,miR-23a-3p可以直接靶向ACSL4的3-非翻譯區[49]。一種納米藥物,可以將miR-101-3p運送到體內的腫瘤細胞中,通過直接靶向TBL1相關蛋白1(transducin beta-like 1 related protein 1,TBLR1)恢復腫瘤細胞的鐵死亡,進而促進腫瘤細胞的凋亡并抑制其增殖[50]。miR-122調控肝臟谷氨酰胺代謝[51]。乙型肝炎病毒X蛋白通過上調miR-205靶向ACSL4誘導HCC細胞脂質代謝異常[52]。細胞周期調控蛋白MYC是一種作用廣泛的轉錄因子,它通過多種機制調節細胞的分化和增殖。MYC驅動的谷氨酸-半胱氨酸連接酶抑制促進HCC中谷胱甘肽的消耗[53]。ACSL4是HCC中miR-211-5p的直接下游靶點,而miR-211-5p通過抑制ACSL4的表達來抑制惡性表型[54]。轉鐵蛋白受體1(transferrin receptor 1,TFR1)是跨膜糖蛋白,其允許哺乳動物細胞中轉鐵蛋白結合的鐵攝取。它在各種腫瘤中過表達以滿足快速增殖細胞的高鐵需求。miR-148a調節TFR1在HCC中的表達[55]。
4 展望
作為一種獨特的調節性細胞死亡形式,鐵死亡與許多疾病相關,尤其是與腫瘤相關。已有許多研究集中于探索通過鐵死亡途徑調控腫瘤進展的具體機制。在過去,miRNA在腫瘤中的作用往往與細胞周期調控基因有關,但近年來發現一些miRNA可通過鐵死亡途徑調控腫瘤的發生發展。筆者就鐵死亡及其相關的miRNA在HCC的發生發展和預后中的作用及功能作了概括,有助于進一步了解HCC的發病機制,并證明了與鐵死亡相關的一系列miRNA可能作為腫瘤生長調節劑來調控腫瘤細胞生長,或逆轉腫瘤細胞的耐藥性。但我們對鐵死亡調控機制的了解仍相當有限,仍需進一步研究。與鐵死亡相關的miRNA通過調節鐵死亡,具有作為抗癌治療靶點的巨大潛力。針對這些關鍵的miRNA,可能發現診斷HCC的生物標志物或為HCC患者的治療提供新方法以改善其預后。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:趙凱,負責選題、文獻檢索和初稿撰寫工作;張輝,負責文獻檢索及文章修改;馬艷波,指導選題、審閱文章并及提出修改意見。