引用本文: 李銀鑫, 李智宇, 陳創, 孫圣榮. 肉芽腫性小葉性乳腺炎的診斷與治療進展. 中國普外基礎與臨床雜志, 2023, 30(12): 1514-1521. doi: 10.7507/1007-9424.202307060 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
肉芽腫性小葉性乳腺炎(granulomatous lobular mastitis,GLM),又稱特發性肉芽腫性乳腺炎,常見于經產的育齡期女性,該病由Kessler和Wolloch在1972年首次提出[1],其病因及發病機制目前尚不明確,主要認為與自身免疫、細菌感染等因素有關;其臨床表現及影像學特征缺乏特異性,易與乳腺結核、炎性乳腺癌、乳腺導管擴張癥等混淆,組織病理學是其診斷“金標準” [2]。GLM確切的發病原因及發病機制尚未達成共識,其診斷和治療也暫無統一的參考標準,以致GLM治療后復發率偏高。近幾年來,考慮到病理活檢作為一種有創操作,它有可能加重GLM的嚴重程度,從而導致病灶經久不愈。筆者歸納并總結了既往對GLM可能的病因、發病機制、診斷、鑒別診斷及治療的固有認識以及近年來新的研究與探索成果,以期進一步加深對該疾病的認識。
1 GLM的病因及發病機制
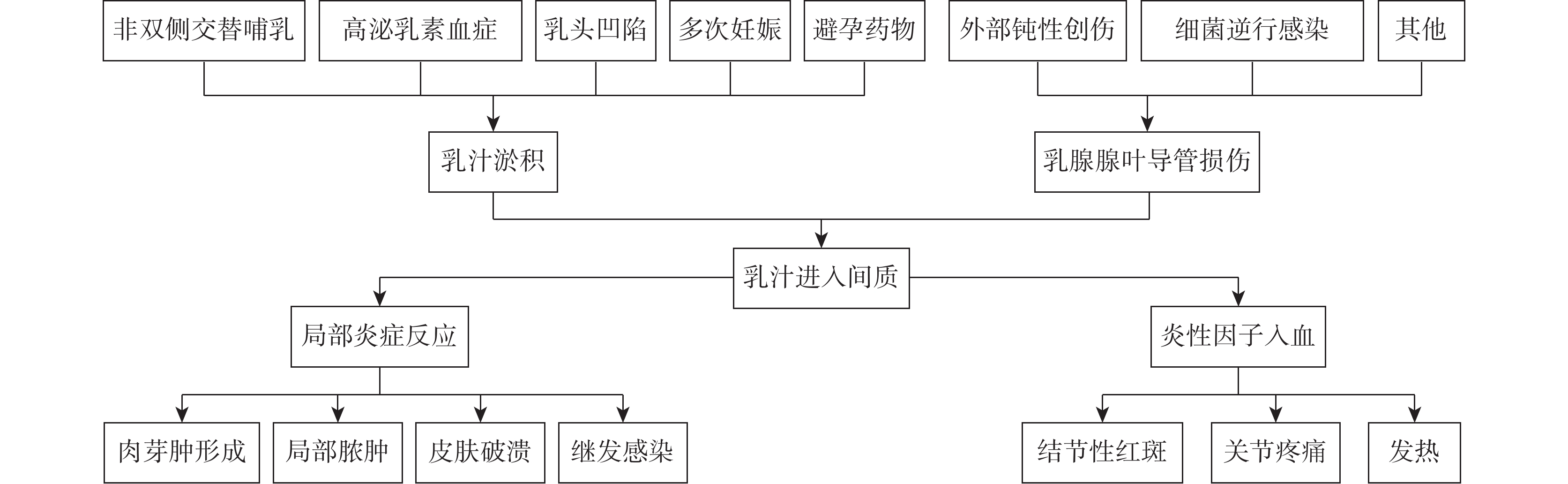
近年來,GLM的患病人數不斷增多,但其病因及發病機制仍不清楚。在過去幾十年里,研究者們圍繞著多種可能的因素展開了研究與討論,如自身免疫、細菌感染(尤其是克氏棒狀桿菌)、乳頭凹陷、使用避孕藥、服用抗精神病藥物、高泌乳素血癥、泌乳障礙、吸煙、種族地區分布、α-1抗胰蛋白酶缺乏等[3–6]。由創傷、細菌感染或化學刺激等因素引起乳腺導管損傷,導致淤積的乳汁蛋白進入乳腺間質引起與乳汁蛋白相關的自身免疫反應似乎是目前相對比較認可的解釋GLM發病機制的假說(圖1) [7]。
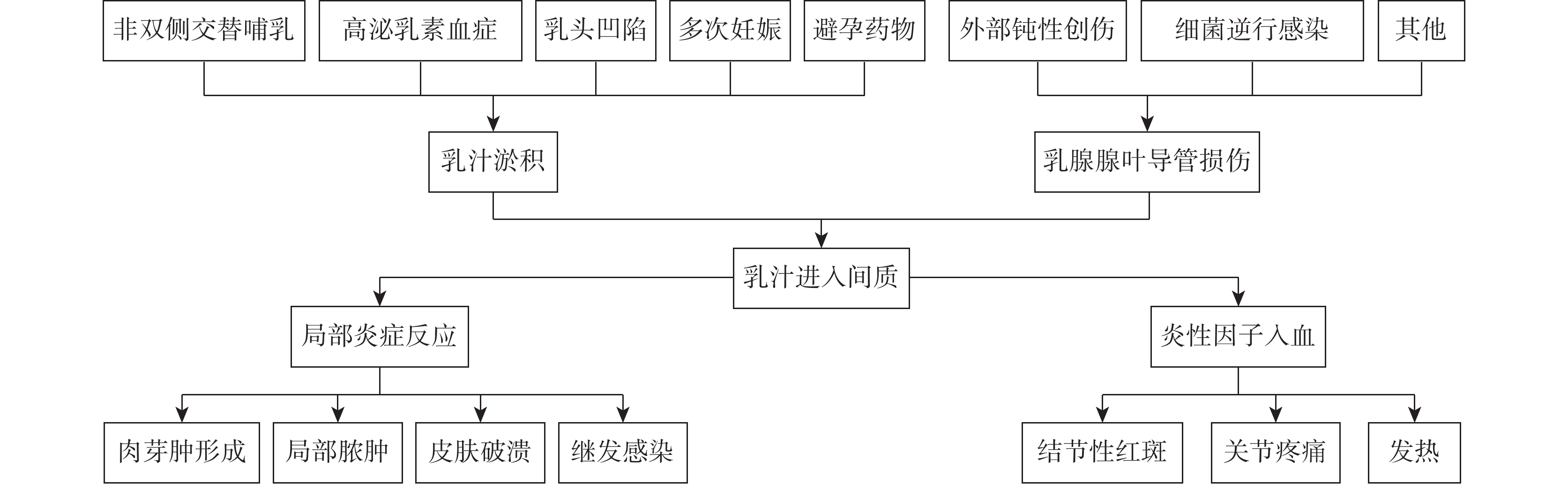 圖1
示GLM的病因和發病機制假說
圖1
示GLM的病因和發病機制假說
目前,有關GLM多是以回顧臨床特征及療效分析為主的臨床研究,基礎研究相對較少。Albayrak等[8]從蛋白組學層面揭示了GLM的癌癥樣行為及它與免疫系統的關系后指出,與免疫缺陷相關的蛋白質可能具有作為診斷GLM標志物的價值。Li等[9]研究表明,補體成分C3/C3a/C3a受體和C5/C5a/C5a受體1參與了炎癥進展,可能是通過參與漿細胞和中性粒細胞的抗凋亡機制以及通過旁分泌參與中性粒細胞的激活、招募和炎癥因子分泌。Chen等[3]研究表明,克氏棒狀桿菌感染可預測GLM的發病,尤其是在催乳素水平較高或近期有哺乳史的患者中。另有Ong等[10]通過16S核糖體RNA對GLM患者的膿液和皮膚拭子中的微生物豐度進行了分析,發現膿液樣本比相應的皮膚拭子樣本更具多樣性,但在GLM樣本中沒有觀察到特征優勢屬,認為患者間變異性和多微生物GLM膿液樣本不能將特定屬或種作為GLM的感染原因。
總之,還需要通過進一步的臨床聯合基礎研究來進一步探索GLM的病因和發病機制。
2 GLM的診斷
GLM的診斷應結合病史特征、臨床表現、影像學表現、實驗室結果及病理表現,建立GLM診療的多學科協作團隊,對提高診斷準確率和減少誤診至關重要[11]。
2.1 病史特征
GLM多見于30歲左右經產女性,于末次分娩后5年內發病[12-13]。對于既往無生育史的患者,多有服用抗精神病類藥物及垂體泌乳素瘤所致高催乳素血癥史[14-15]。此外,Tang等[6]報道吸煙者更易患GLM;另有一項多中心回顧性研究[16]也顯示,4.9%的患者有吸煙接觸史且該部分患者的GLM復發風險是無吸煙接觸史患者的48.5倍(P=0.005)。
2.2 臨床表現
GLM主要表現為乳腺腫塊伴或不伴紅腫或疼痛,腫塊常位于單側,以乳房外周部位多見,進展迅速,后期可形成膿腫、竇道或破潰,部分患者伴有先天性乳頭凹陷,伴或不伴同側腋下淋巴結炎性腫大,早期腫塊形態多不規則、質地硬,與正常組織間界限模糊;乳房外表現主要包括結節性紅斑及關節炎,病程可遷延不愈、反復發作[3, 17]。
2.3 影像學表現
GLM的影像學檢查并無特異性,但它對鑒別惡性腫瘤、評估病變范圍、術前定位病變部位和數目有幫助。
2.3.1 超聲
GLM的超聲聲像圖具有多樣性,根據超聲不同分型其表現不同,最常見的表現特點為:多發條狀、片狀、不規則的低回聲區,邊界不清,可相互延續,跨越多個象限,但長軸常平行于皮膚,病變內可見密集的點狀回聲,部分探頭加壓可有流動性,有時可有竇道形成,鈣化少見,有時可合并腋窩淋巴結腫大;超聲彩色多普勒血流顯像常可見病變內部粗大且較為豐富的血流信號,血流阻力指數常小于0.7[18]。常規超聲對于觀察病灶形態學特征方面有一定優勢,但由于GLM的乳腺超聲表現與乳腺癌相似,難以鑒別診斷。王娟等[19]報道,基于超聲造影定量參數聯合常規超聲圖像特征構建的診斷模型對鑒別診斷GLM與早期炎性乳腺癌有一定的價值。Makal等[20]報道,超聲剪切波彈性成像在區分GLM與乳腺癌方面具有較高的敏感度和特異度。然而莫慧端等[21]認為,對于某些特殊類型的GLM,如乳腺影像報告和數據系統評分極高且超聲剪切波彈性成像評分也極高的GLM來說,超聲剪切波彈性成像評分并不能降低GLM的誤診率。綜合而言,GLM的乳腺超聲特征多種多樣,常規超聲、超聲造影等方法可輔助診斷,但與乳腺癌的區分仍具有挑戰性。
2.3.2 X射線
在乳腺X射線檢查中,GLM常表現為局灶性不對稱致密影,邊緣模糊,鈣化罕見,伴或不伴皮膚增厚或水腫及實質扭曲[22]。由于鉬靶即乳房X射線更多用來檢測乳腺癌是否存在砂礫狀細小的鈣化,它在 GLM 診斷中的應用與研究相對B超及磁共振較少。
2.3.3 計算機斷層掃描(computed tomography,CT)
同X射線檢查一樣,CT在GLM中的應用較為罕見。僅檢索到Lin等[23]的研究,其結果表明,錐形束乳腺CT能以高密度分辨率和血流動力學特征有效顯示GLM的詳細特征,在錐形束乳腺CT上最常見的GLM病變形態是彌漫性斑塊或局灶性結節形態,其次是乳腺導管擴張、假性囊腫和蜂窩囊腫型。這些特征值得進一步探索并驗證。
2.3.4 磁共振
GLM的磁共振平掃以長T1、稍長T2為主,病灶中央呈更長T1、T2信號表現,病灶鄰近皮下區、灶周水腫較為明顯;動態增強掃描可表現為多發環形強化、均勻或不均勻強化、腫塊樣或非腫塊樣強化[24],最常見的表現是不均勻的腫塊型強化、節段性或局灶性的非腫塊型強化或環形強化病灶[25]。若有融合或邊界清晰的微小病變,伴T2高信號和邊緣強化,可能為微膿腫,在彌散加權成像上表觀彌散系數序列信號減低,與炎性乳腺癌鑒別價值不大[22]。GLM的時間-信號強度曲線以Ⅰ型和Ⅱ型多見,而Ⅲ型則多見于乳腺癌[25]。
2.4 組織病理學表現
組織病理學為診斷GLM的“金標準” [2]。在超聲引導下開展空心針穿刺活檢,能夠準確獲得可疑組織的標本,以便于臨床開展病理活檢,從而明確病理類型,提高疾病診斷的準確性,且超聲引導下穿刺創傷小且精準[26]。GLM大體觀多數表現為質地較硬的乳腺腫塊,以非干酪樣壞死為病理特征,切面呈灰白或灰黃色,邊界不清,局部可伴膿腫形成,部分可伴皮膚破潰、流膿及竇道形成;鏡下觀表現為非干酪樣壞死,以終末小葉為中心的肉芽腫性炎癥,伴上皮樣細胞、多核巨細胞、淋巴細胞、中性粒細胞等多種炎性細胞浸潤,其中央常可見脂質空泡形成,部分病例可見小的膿腫或壞死灶形成,病灶小葉結構通常存在,小葉內腺管上皮可萎縮、減少或消失,亦可有導管上皮增生,增生的上皮并無明顯異型[1-2, 27]。
2.5 實驗室檢查
2.5.1 血液學檢查
血液學檢查常用的評估指標有血常規指標、C反應蛋白、細胞因子譜、補體C3和C5以及血清泌乳素[4, 9, 14, 28]。鄭碧連等[28]研究表明,克氏棒狀桿菌陽性GLM患者的外周血白細胞計數及其異常率均高于克氏棒狀桿菌陰性患者,同時克氏棒狀桿菌陽性晚期患者的外周血白細胞計數及其異常率高于早期患者。Huang等[29]研究表明,血清白細胞介素-6和C反應蛋白水平在GLM疾病嚴重程度的評估方面有一定價值,其中白細胞介素-6在GLM中的免疫病理反應可能起到至關重要的作用。盡管GLM被認為與自身免疫相關,但 Koksal[30]的研究不支持類風濕因子、抗核抗體、抗雙鏈DNA抗體、抗環瓜氨酸肽抗體、核周型抗中性粒細胞胞質抗體等自身抗體在GLM中發揮作用。Aksan等[31]認為,除了組織病理學和放射學證據外,驗證miR-21表達和第10號染色體缺失的磷酸酶及張力蛋白同源基因水平可考慮作為鑒別診斷GLM和炎性乳腺癌的常規無創分析方法。Ciftci等[32]認為,血清白蛋白與球蛋白比可作為炎癥性疾病的生物標志物,首次入院時白蛋白與球蛋白比值低于1.179及吸煙的GLM患者更易復發。綜上,炎性因子、補體、白蛋白與球蛋白比值等可用于GLM病情嚴重程度評估,能為臨床診療提供重要信息。
2.5.2 細菌檢測
目前細菌檢測重點是針對棒狀桿菌的檢測。Williams等[33]認為,克氏棒狀桿菌在GLM的發病過程中至關重要,建議臨床醫生在將樣本送至實驗室時提醒實驗室工作人員注意可能的細菌感染,并要求對培養回收的任何棒狀桿菌進行物種鑒定。Li等[34]研究認為,相較于細菌培養,納米孔測序技術能夠快速準確地檢測病原菌,GLM并非無菌性炎癥,與克氏棒狀桿菌密切相關。而Wang等[35]通過下一代測序技術分析了GLM患者的微生物群發現,幾乎所有的GLM病例均可檢出病原體,且每例GLM可能涉及多種病原體感染,但其克氏棒狀桿菌的檢出率與以往大多數報道認為克氏棒狀桿菌為GLM的主要病原體有所不同,雖無法區分初次感染和繼發感染的病原體,但無論初次或繼發感染,任何病原菌檢出均有助于臨床醫生合理選擇敏感抗生素。
3 GLM的鑒別診斷
GLM發病率相對較低,在早期階段不具備特異性,易被誤診。臨床上在診斷GLM時應重點與炎性乳腺癌鑒別;此外,還應仔細同乳腺結核、結節病、硬化性淋巴細胞性乳腺炎、韋格納肉芽腫等疾病相鑒別。
3.1 炎性乳腺癌
炎性乳腺癌與GLM在影像學上表現極為相似, 極易引起誤診。炎性乳腺癌常見于40~60歲婦女,多為單發無痛性腫塊,生長迅速,具有高度侵襲性,質地硬,可與皮膚形成粘連,活動度欠佳,晚期時皮膚可呈現為“酒窩征”或“橘皮樣”改變,多伴有腋窩淋巴結腫大或乳頭血性溢液,晚期癌性潰瘍呈菜花樣或邊緣隆起基底凹陷[36-37]。B超檢查結果往往表現為低回聲腫塊,內部回聲不均勻,邊緣不清,包膜不完整,腫塊內部可見血流信號[19, 38]。乳腺鉬靶檢查可見不規則高密度腫塊影,邊緣有毛刺、尖角等改變,腫塊內可見不規則鈣化灶,顆粒細小、密集[39]。粗針穿刺組織學活檢發現異型增生的癌細胞有助于確診[26]。
3.2 乳腺結核
乳腺結核多見于已婚體弱的中青年婦女,既往有結核病史,發病緩慢,乳房可及1個或數個腫塊,化膿時腫塊增大,與皮膚形成粘連,局部發紅,可有輕微波動感[40-41]。破潰后流出稀薄膿液,后期可形成竇道,愈合緩慢,可伴有潮熱、盜汗、消瘦等全身癥狀,膿液培養有結核菌生長,抗酸染色可查見結核桿菌,病理學檢查可見乳腺組織中有典型結核結節及干酪樣壞死,結節不以小葉為中心[42-43]。
3.3 結節病
結節病常表現為侵犯肺和胸部淋巴結,可累及乳腺引起非干酪樣肉芽腫性炎癥,皮膚表現以結節性紅斑最多見,關節受累時有關節炎表現,胸片常見肺門和(或)縱隔淋巴結對稱性腫大[44]。
3.4 硬化性淋巴細胞性乳腺炎
硬化性淋巴細胞性乳腺炎是一種少見的以乳腺間質纖維化為主的非化膿性炎癥乳腺疾病,常伴有糖尿病病史,因為病變質地較硬,術前易誤診為乳腺癌而行手術切除[45],病理組織學表現為乳腺小葉內及導管周圍有大量淋巴細胞(主要為B淋巴細胞且淋巴細胞主要表達CD20)、漿細胞浸潤,間質纖維化透明樣變,晚期小葉萎縮或消失,可伴有淋巴濾泡形成、玻璃樣變性[45-46]。
3.5 韋格納肉芽腫
韋格納肉芽腫可發生在全身各個系統和器官,但以上呼吸道、肺部和腎臟最為常見,患者肌肉和骨骼受累時主要表現為肌痛和關節痛,關節痛可呈游走性、單發或多發,皮膚受損時可表現為紫癜、疣狀丘疹、皮下結節、潰瘍等;病理改變表現為常出現血管壁損傷和纖維素樣壞死,炎細胞浸潤以中性粒細胞、淋巴細胞、單核細胞為主,嗜酸性粒細胞較少,其繼發性改變包括微膿腫和纖維化[47]。伴關節腫痛及肢體紅斑的GLM患者應注意與該病進行鑒別。
4 GLM的治療
隨著GLM的發病率不斷上升,但因其病因和發病機制不明,目前具體治療選擇和治療時機仍無統一標準。如今針對GLM的治療方法主要以保守治療和手術治療為主,包括隨訪觀察、抗生素治療、抗結核藥物治療、糖皮質激素治療、免疫抑制劑治療、手術治療、中醫藥治療、聯合治療等。
4.1 隨訪觀察
近年來,隨著對GLM的進一步認識,部分研究者對該疾病的認識發生了轉變,認為GLM是一種自限性的良性疾病,在不切切除乳房情況下,雖患者病情可能會持續較長時間甚至加重,但隨著時間推移會自行康復,因此可以隨訪觀察。Bouton等[48]報道了27 例GLM,經觀察平均時間7.4 個月后得到緩解,期間未使用皮質類固醇,并且提出對GLM自然病程的耐心很重要,因為該過程通常包括緩解前的進展期。Davis等[49]隨訪了120例未行任何治療的GLM患者,其中112例GLM患者在平均5個月(0~20個月)后自行痊愈,指出隨訪觀察的關鍵是宣教,讓患者放心,以避免可能會導致乳房畸形的手術以及不必要的藥物潛在副作用和額外費用給患者和醫療護理造成的額外負擔。
4.2 藥物治療
4.2.1 抗生素
一般認為,單獨應用抗生素治療GLM并無明顯效果[33]。如果合并膿腫或對有膿腫破潰、竇道形成等急性感染癥狀者,應先根據藥敏結果或經驗性使用抗生素治療,防止激素治療后免疫功能降低加重感染[50]。相較于水溶性抗生素,強力霉素、克拉霉素、利福平等親脂性抗生素更易在病灶中達到足夠的治療濃度[51]。近年來,國內外有越來越多關于親脂類抗生素在GLM治療中應用的報道。王華等[52]研究表明,抗分枝桿菌三聯藥物(異煙肼0.3 g/d、利福平0.45 g/d、乙胺丁醇0.75 g/d,總療程6~12個月)治療GLM能使大部分患者治愈而避免手術,明顯縮小部分患者的原發病灶,減小手術切除范圍,保留乳房外形,復發率低;而抗結核藥物最常見的不良反應是肝腎損害,因此服藥期間應每1~2個月定期復查肝腎功能。Williams等[33]研究認為,延長親脂性抗生素(如克拉霉素)的療程可能是一種可行的治療方案,這種方法有可能減少長期使用類固醇或手術等干預措施的應用。綜上,單獨使用抗生素治療GLM通常效果有限。在存在膿腫、感染癥狀或其他并發癥的情況下,抗生素治療可作為一種必要的補充,但應根據藥敏結果或經驗性選擇合適的抗生素。親脂性抗生素可能更適合在GLM治療中使用,因為它們能夠在病灶中達到足夠的治療濃度。
4.2.2 激素
目前國內外多數學者認為激素是治療GLM的一線治療方法,尤其對處于急性期伴有疼痛的患者,起效快且療效明顯。推薦小劑量起始治療,待癥狀好轉后可逐漸減量;若有較為明顯的全身伴隨癥狀,可使用糖皮質激素短療程沖擊治療,若1~2周疾病無明顯改善,建議盡早更換治療方案[53]。長期使用糖皮質激素可能會引起明顯不良反應,如出現閉經、體質量增加、痤瘡、消化道潰瘍、骨質疏松癥、骨髓抑制、股骨頭壞死甚至機會性感染。因此,密切關注在激素應用過程中的療效及減少劑量相關所引起的副作用至關重要。Ece等[54]通過基于超聲剪切波彈性成像組織硬度測量評估GLM病例中減少皮質類固醇激素劑量后的療效,結果表明,剪切波彈性成像相關的劑量調整技術可以減少皮質類固醇激素的副作用,而未明顯影響治療效果。與全身應用相比,局部應用更小劑量類固醇作用于靶組織效果較好,這為減少其副作用提供了一種解決方法[55]。
4.2.3 免疫抑制劑
相關研究[56-57]表明,對于糖皮質激素耐藥以及無法耐受長期激素治療的患者,免疫抑制劑甲氨蝶呤、硫唑嘌呤和環孢素A對治療GLM有一定效果,甲氨蝶呤的使用劑量為每周7.5~15.0 mg,單獨治療維持1年,癥狀緩解后可逐漸減量,治療期間應密切觀察不良反應,如肝腎功能損傷、骨髓抑制、胃腸道反應、間質性肺炎、葉酸缺乏。此外,Kaya等[58]在甲氨蝶呤治療出現不良反應或效果不佳時應用環孢素A和硫唑嘌呤可以獲得較高的緩解率,且在獲得緩解后使用免疫抑制劑治療約1年,可實現長期無藥緩解。趙婷婷等[59]的研究結果顯示,秋水仙堿可抑制中性粒細胞的趨化、黏附及吞噬,對伴有下肢結節性紅斑的GLM患者在常規治療基礎上聯合秋水仙堿治療的效果較為理想,可顯著提高治療有效率,且具備較高安全性。
4.2.4 中醫中藥
不同于西醫從微觀層面關注疾病的病因學,中醫強調利用疏肝健脾補腎等理論對患者進行宏觀調控和辯證論治,強調內外合治,初期以消為貴,中期以托為法,后期以補為宜,認為進行臨床分型可以更好地指導臨床治療[60]。針對腫塊型(以局部塊為主要表現而臨床檢查無明顯膿腫),治療以消為貴,辨證聯合使用活血化瘀、化痰散結、疏肝行氣法等[60]。胡珊等[61]研究表明,疏肝健脾針刺法可有效改善腫塊型GLM患者血清免疫指標,平衡免疫功能;對于膿腫型(局部腫塊已成膿,以膿腫為主要表現),治療以托為法,包括托里透膿、益氣托毒、溫陽托毒法等[60]。韓旭等[62]研究顯示,加減透膿散聯合乳癰散外敷治療可促進膿腐液化、排出,加速恢復期潰口愈合;對于潰后型(膿腫破潰或局部切開引流后,以竇道、滲液為主要表現),治療以補為宜,包括益氣健脾、溫陽消腫、益氣養血等[60]。鄧佩等[63]認為,GLM患者多因體虛弱,臟腑功能失調、經絡氣血運行不暢所致,當疾病進展至潰后期時病久耗氣傷津,正氣虧虛無力托毒肌,膿水淋漓,遷延難愈,因此在治療上以益氣健脾法為核心,旨在通過培補后天之本來提高免疫功能。
4.2.5 其他藥物
針對病因采取相應的治療措施。如針對高泌乳素患者降低其泌乳素水平。有研究[14]表明,溴隱亭聯合糖皮質激素治療高泌乳素血癥GLM患者有效,若患者合并垂體瘤則需采取手術切除或溴隱亭抑制治療;對于服用抗精神病藥物引起的高泌乳素血癥患者需與精神科等多學科會診后調整抗精神病藥物的用量或是考慮加用溴隱亭治療[14];長期應用避孕藥的患者應減少或停止使用該類藥物,以避免造成體內激素紊亂[6]。
4.3 手術治療
針對GLM何時采取手術治療及采取何種手術方式尚無統一標準。
目前文獻[64-65]報道的主要手術方式有膿腫穿刺或切開引流術、單純腫塊切除術、病變組織擴大切除術、腺體區段切除術、皮下腺體全切除術等,并根據患者意愿進行乳房的Ⅰ期整形。中醫外治法與西醫外科治療則有異曲同工之處,主要包括貼敷療法、穿刺抽膿術、火針洞式烙口引流術、切開引流術、祛腐清創術、導管灌注、竇道灌注等[61, 66];若患者存在膿腫,需適當緩解膿腫等癥狀,首先考慮采用穿刺抽膿,一般不宜輕易選擇膿腫切開引流或全乳切除[67]。單純腫塊切除手術治療GLM時,因腫物邊界不清晰,采用此術式治療時陰性切緣無法保障,繼而無法保證治療效果,極易出現術后復發,在實施二次手術治療時損傷和愈合難度均增大,增加患者的心理壓力和經濟負擔[68]。目前臨床上常使用病變組織擴大切除聯合術后整形修復的方法,手術時應切除皮膚病變的炎癥病灶、膿腫、擴張的導管及部分病灶周圍的正常乳腺組織,保證切緣炎癥組織陰性,也能避免多次復發或多次手術導致乳房外形損傷[68]。具體選擇何種手術方式應視患者具體情況及患者意愿而定,根據每例患者的特殊情況選擇相應的手術方式以達到良好的治療效果。
GLM手術時機盡量選擇在慢性遷延期進行,避免在發生急性感染癥狀或檢出致病菌的急性期進行,但應視具體情況而定,急性期并不是手術的絕對禁忌證[64]。手術治療具有長效性、安全性、有效性等優點,但存在部分患者由于病灶清除不徹底、手術時機把握欠佳等,導致術后傷口延遲愈合、膿腫或竇道反復形成,若復發則需多次手術,而且手術切除范圍過大可能導致乳房變形或缺失,美容效果差等缺點,無論是在經濟上還是肉體和心靈上都對患者造成巨大傷害[64]。
4.4 聯合治療
越來越多的研究表明,無論是單獨的藥物治療或是手術治療,其療效均不及聯合治療。術前激素輔助治療一方面可以在術前使腫塊縮小從而減少術中切除的乳腺組織量,另一方面可以加快術后傷口愈合并降低術后復發風險[69]。對于激素治療不敏感的患者,可以考慮聯合免疫抑制劑如甲氨蝶呤進行治療,待病灶不再進展或縮小后再予以手術治療[57]。對于合并克氏棒狀桿菌感染的患者,抗結核藥物輔助治療在一定程度上有助于病情控制[52]。此外,中醫中藥治療對病灶的消退也具有一定的促進作用。 Zuo等[70]研究顯示,與單純進行西醫手術治療相比,中西醫結合治療GLM可顯著降低復發率,改善雙側乳房的對稱性和美觀性。
4.5 其他治療方法
越來越多不同學科的臨床醫生與研究者在治療方面進行了新的研究與探索。Chen等[71]認為,克氏棒狀桿菌的最適生長溫度為37 ℃,在42 ℃時其生長受到明顯抑制,局部溫度控制可能導致生長停滯。局部熱療作為一種治療炎癥和加速傷口愈合的方法,通過使用自動加熱貼將乳房局部溫度維持在42~65 ℃可取得良好的治療效果,不良反應輕微,愈合時間縮短,但仍需進一步研究證實。Cabioglu等[72]研究表明,臭氧治療對激素抵抗型GLM患者有效,臭氧治療后免疫系統的變化可以改善難治性GLM患者的傷口愈合和恢復免疫功能障礙,認為與既往研究通過激素或免疫抑制劑來抑制免疫反應不同,臭氧治療不是通過抑制免疫系統,而是通過恢復激素抵抗型GLM中的1型T輔助淋巴細胞反應和免疫調節來發揮治療作用。因此,需要進一步的研究來探討臭氧治療在大樣本GLM患者中的療效。腫瘤壞死因子-α抑制劑被認為是安全有效的慢性自身免疫性肉芽腫疾病的長期治療藥物,有研究者們[73-74]將腫瘤壞死因子-α抑制劑阿達木單抗應用于GLM患者,認為它可能是治療難治性GLM的一種非類固醇、非抗微生物和非手術的替代療法。
總之,對于GLM治療的研究正在不斷進行,這些新方法為GLM治療提供了新的選擇,但需要更多的研究來驗證其療效。未來應繼續尋求新的方法并改進已有的治療方法,以期能讓患者更大程度獲益并且提高患者的生活質量。
5 總結與展望
GLM是一種良性乳腺疾病,近年來此病在我國的發病人數不斷增加,其診療方案仍缺乏統一的標準,因此,在臨床工作中選擇治療方案時應充分結合醫生的經驗及患者的意愿。過去二三十年間,GLM的治療方式以手術為主,但手術治療后仍有較高的復發率且給患者帶來軀體與精神上的雙重打擊。近些年來,更多的研究者推薦將隨訪觀察或口服糖皮質激素等保守治療作為一線治療方式。對于難治性GLM患者,保守治療的病程長、療效不顯著且長期服用糖皮質激素可能會帶來一系列的副作用,故而對于難治性GLM仍建議行手術治療。由于目前針對GLM的診療研究多以回顧性研究為主,缺乏足夠的循證醫學證據,臨床上對本病的認識仍不足,常導致誤診和誤治,這可能會導致病程延長、療效不佳、乳房美觀度明顯受損、醫療費用增加等不良后果,嚴重影響患者的身心健康。未來仍需開展前瞻性高質量多中心的臨床試驗和進行循證醫學實踐,以進一步完善GLM的診療方案。提高對GLM的認識、制定臨床診斷標準及規范診療行為是目前亟待解決的重要問題。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:李銀鑫負責查閱文獻、撰寫論文;李智宇對論文撰寫和論文修改給予指導;孫圣榮和陳創對選題和論文修改給予指導。
肉芽腫性小葉性乳腺炎(granulomatous lobular mastitis,GLM),又稱特發性肉芽腫性乳腺炎,常見于經產的育齡期女性,該病由Kessler和Wolloch在1972年首次提出[1],其病因及發病機制目前尚不明確,主要認為與自身免疫、細菌感染等因素有關;其臨床表現及影像學特征缺乏特異性,易與乳腺結核、炎性乳腺癌、乳腺導管擴張癥等混淆,組織病理學是其診斷“金標準” [2]。GLM確切的發病原因及發病機制尚未達成共識,其診斷和治療也暫無統一的參考標準,以致GLM治療后復發率偏高。近幾年來,考慮到病理活檢作為一種有創操作,它有可能加重GLM的嚴重程度,從而導致病灶經久不愈。筆者歸納并總結了既往對GLM可能的病因、發病機制、診斷、鑒別診斷及治療的固有認識以及近年來新的研究與探索成果,以期進一步加深對該疾病的認識。
1 GLM的病因及發病機制
近年來,GLM的患病人數不斷增多,但其病因及發病機制仍不清楚。在過去幾十年里,研究者們圍繞著多種可能的因素展開了研究與討論,如自身免疫、細菌感染(尤其是克氏棒狀桿菌)、乳頭凹陷、使用避孕藥、服用抗精神病藥物、高泌乳素血癥、泌乳障礙、吸煙、種族地區分布、α-1抗胰蛋白酶缺乏等[3–6]。由創傷、細菌感染或化學刺激等因素引起乳腺導管損傷,導致淤積的乳汁蛋白進入乳腺間質引起與乳汁蛋白相關的自身免疫反應似乎是目前相對比較認可的解釋GLM發病機制的假說(圖1) [7]。
 圖1
示GLM的病因和發病機制假說
圖1
示GLM的病因和發病機制假說
目前,有關GLM多是以回顧臨床特征及療效分析為主的臨床研究,基礎研究相對較少。Albayrak等[8]從蛋白組學層面揭示了GLM的癌癥樣行為及它與免疫系統的關系后指出,與免疫缺陷相關的蛋白質可能具有作為診斷GLM標志物的價值。Li等[9]研究表明,補體成分C3/C3a/C3a受體和C5/C5a/C5a受體1參與了炎癥進展,可能是通過參與漿細胞和中性粒細胞的抗凋亡機制以及通過旁分泌參與中性粒細胞的激活、招募和炎癥因子分泌。Chen等[3]研究表明,克氏棒狀桿菌感染可預測GLM的發病,尤其是在催乳素水平較高或近期有哺乳史的患者中。另有Ong等[10]通過16S核糖體RNA對GLM患者的膿液和皮膚拭子中的微生物豐度進行了分析,發現膿液樣本比相應的皮膚拭子樣本更具多樣性,但在GLM樣本中沒有觀察到特征優勢屬,認為患者間變異性和多微生物GLM膿液樣本不能將特定屬或種作為GLM的感染原因。
總之,還需要通過進一步的臨床聯合基礎研究來進一步探索GLM的病因和發病機制。
2 GLM的診斷
GLM的診斷應結合病史特征、臨床表現、影像學表現、實驗室結果及病理表現,建立GLM診療的多學科協作團隊,對提高診斷準確率和減少誤診至關重要[11]。
2.1 病史特征
GLM多見于30歲左右經產女性,于末次分娩后5年內發病[12-13]。對于既往無生育史的患者,多有服用抗精神病類藥物及垂體泌乳素瘤所致高催乳素血癥史[14-15]。此外,Tang等[6]報道吸煙者更易患GLM;另有一項多中心回顧性研究[16]也顯示,4.9%的患者有吸煙接觸史且該部分患者的GLM復發風險是無吸煙接觸史患者的48.5倍(P=0.005)。
2.2 臨床表現
GLM主要表現為乳腺腫塊伴或不伴紅腫或疼痛,腫塊常位于單側,以乳房外周部位多見,進展迅速,后期可形成膿腫、竇道或破潰,部分患者伴有先天性乳頭凹陷,伴或不伴同側腋下淋巴結炎性腫大,早期腫塊形態多不規則、質地硬,與正常組織間界限模糊;乳房外表現主要包括結節性紅斑及關節炎,病程可遷延不愈、反復發作[3, 17]。
2.3 影像學表現
GLM的影像學檢查并無特異性,但它對鑒別惡性腫瘤、評估病變范圍、術前定位病變部位和數目有幫助。
2.3.1 超聲
GLM的超聲聲像圖具有多樣性,根據超聲不同分型其表現不同,最常見的表現特點為:多發條狀、片狀、不規則的低回聲區,邊界不清,可相互延續,跨越多個象限,但長軸常平行于皮膚,病變內可見密集的點狀回聲,部分探頭加壓可有流動性,有時可有竇道形成,鈣化少見,有時可合并腋窩淋巴結腫大;超聲彩色多普勒血流顯像常可見病變內部粗大且較為豐富的血流信號,血流阻力指數常小于0.7[18]。常規超聲對于觀察病灶形態學特征方面有一定優勢,但由于GLM的乳腺超聲表現與乳腺癌相似,難以鑒別診斷。王娟等[19]報道,基于超聲造影定量參數聯合常規超聲圖像特征構建的診斷模型對鑒別診斷GLM與早期炎性乳腺癌有一定的價值。Makal等[20]報道,超聲剪切波彈性成像在區分GLM與乳腺癌方面具有較高的敏感度和特異度。然而莫慧端等[21]認為,對于某些特殊類型的GLM,如乳腺影像報告和數據系統評分極高且超聲剪切波彈性成像評分也極高的GLM來說,超聲剪切波彈性成像評分并不能降低GLM的誤診率。綜合而言,GLM的乳腺超聲特征多種多樣,常規超聲、超聲造影等方法可輔助診斷,但與乳腺癌的區分仍具有挑戰性。
2.3.2 X射線
在乳腺X射線檢查中,GLM常表現為局灶性不對稱致密影,邊緣模糊,鈣化罕見,伴或不伴皮膚增厚或水腫及實質扭曲[22]。由于鉬靶即乳房X射線更多用來檢測乳腺癌是否存在砂礫狀細小的鈣化,它在 GLM 診斷中的應用與研究相對B超及磁共振較少。
2.3.3 計算機斷層掃描(computed tomography,CT)
同X射線檢查一樣,CT在GLM中的應用較為罕見。僅檢索到Lin等[23]的研究,其結果表明,錐形束乳腺CT能以高密度分辨率和血流動力學特征有效顯示GLM的詳細特征,在錐形束乳腺CT上最常見的GLM病變形態是彌漫性斑塊或局灶性結節形態,其次是乳腺導管擴張、假性囊腫和蜂窩囊腫型。這些特征值得進一步探索并驗證。
2.3.4 磁共振
GLM的磁共振平掃以長T1、稍長T2為主,病灶中央呈更長T1、T2信號表現,病灶鄰近皮下區、灶周水腫較為明顯;動態增強掃描可表現為多發環形強化、均勻或不均勻強化、腫塊樣或非腫塊樣強化[24],最常見的表現是不均勻的腫塊型強化、節段性或局灶性的非腫塊型強化或環形強化病灶[25]。若有融合或邊界清晰的微小病變,伴T2高信號和邊緣強化,可能為微膿腫,在彌散加權成像上表觀彌散系數序列信號減低,與炎性乳腺癌鑒別價值不大[22]。GLM的時間-信號強度曲線以Ⅰ型和Ⅱ型多見,而Ⅲ型則多見于乳腺癌[25]。
2.4 組織病理學表現
組織病理學為診斷GLM的“金標準” [2]。在超聲引導下開展空心針穿刺活檢,能夠準確獲得可疑組織的標本,以便于臨床開展病理活檢,從而明確病理類型,提高疾病診斷的準確性,且超聲引導下穿刺創傷小且精準[26]。GLM大體觀多數表現為質地較硬的乳腺腫塊,以非干酪樣壞死為病理特征,切面呈灰白或灰黃色,邊界不清,局部可伴膿腫形成,部分可伴皮膚破潰、流膿及竇道形成;鏡下觀表現為非干酪樣壞死,以終末小葉為中心的肉芽腫性炎癥,伴上皮樣細胞、多核巨細胞、淋巴細胞、中性粒細胞等多種炎性細胞浸潤,其中央常可見脂質空泡形成,部分病例可見小的膿腫或壞死灶形成,病灶小葉結構通常存在,小葉內腺管上皮可萎縮、減少或消失,亦可有導管上皮增生,增生的上皮并無明顯異型[1-2, 27]。
2.5 實驗室檢查
2.5.1 血液學檢查
血液學檢查常用的評估指標有血常規指標、C反應蛋白、細胞因子譜、補體C3和C5以及血清泌乳素[4, 9, 14, 28]。鄭碧連等[28]研究表明,克氏棒狀桿菌陽性GLM患者的外周血白細胞計數及其異常率均高于克氏棒狀桿菌陰性患者,同時克氏棒狀桿菌陽性晚期患者的外周血白細胞計數及其異常率高于早期患者。Huang等[29]研究表明,血清白細胞介素-6和C反應蛋白水平在GLM疾病嚴重程度的評估方面有一定價值,其中白細胞介素-6在GLM中的免疫病理反應可能起到至關重要的作用。盡管GLM被認為與自身免疫相關,但 Koksal[30]的研究不支持類風濕因子、抗核抗體、抗雙鏈DNA抗體、抗環瓜氨酸肽抗體、核周型抗中性粒細胞胞質抗體等自身抗體在GLM中發揮作用。Aksan等[31]認為,除了組織病理學和放射學證據外,驗證miR-21表達和第10號染色體缺失的磷酸酶及張力蛋白同源基因水平可考慮作為鑒別診斷GLM和炎性乳腺癌的常規無創分析方法。Ciftci等[32]認為,血清白蛋白與球蛋白比可作為炎癥性疾病的生物標志物,首次入院時白蛋白與球蛋白比值低于1.179及吸煙的GLM患者更易復發。綜上,炎性因子、補體、白蛋白與球蛋白比值等可用于GLM病情嚴重程度評估,能為臨床診療提供重要信息。
2.5.2 細菌檢測
目前細菌檢測重點是針對棒狀桿菌的檢測。Williams等[33]認為,克氏棒狀桿菌在GLM的發病過程中至關重要,建議臨床醫生在將樣本送至實驗室時提醒實驗室工作人員注意可能的細菌感染,并要求對培養回收的任何棒狀桿菌進行物種鑒定。Li等[34]研究認為,相較于細菌培養,納米孔測序技術能夠快速準確地檢測病原菌,GLM并非無菌性炎癥,與克氏棒狀桿菌密切相關。而Wang等[35]通過下一代測序技術分析了GLM患者的微生物群發現,幾乎所有的GLM病例均可檢出病原體,且每例GLM可能涉及多種病原體感染,但其克氏棒狀桿菌的檢出率與以往大多數報道認為克氏棒狀桿菌為GLM的主要病原體有所不同,雖無法區分初次感染和繼發感染的病原體,但無論初次或繼發感染,任何病原菌檢出均有助于臨床醫生合理選擇敏感抗生素。
3 GLM的鑒別診斷
GLM發病率相對較低,在早期階段不具備特異性,易被誤診。臨床上在診斷GLM時應重點與炎性乳腺癌鑒別;此外,還應仔細同乳腺結核、結節病、硬化性淋巴細胞性乳腺炎、韋格納肉芽腫等疾病相鑒別。
3.1 炎性乳腺癌
炎性乳腺癌與GLM在影像學上表現極為相似, 極易引起誤診。炎性乳腺癌常見于40~60歲婦女,多為單發無痛性腫塊,生長迅速,具有高度侵襲性,質地硬,可與皮膚形成粘連,活動度欠佳,晚期時皮膚可呈現為“酒窩征”或“橘皮樣”改變,多伴有腋窩淋巴結腫大或乳頭血性溢液,晚期癌性潰瘍呈菜花樣或邊緣隆起基底凹陷[36-37]。B超檢查結果往往表現為低回聲腫塊,內部回聲不均勻,邊緣不清,包膜不完整,腫塊內部可見血流信號[19, 38]。乳腺鉬靶檢查可見不規則高密度腫塊影,邊緣有毛刺、尖角等改變,腫塊內可見不規則鈣化灶,顆粒細小、密集[39]。粗針穿刺組織學活檢發現異型增生的癌細胞有助于確診[26]。
3.2 乳腺結核
乳腺結核多見于已婚體弱的中青年婦女,既往有結核病史,發病緩慢,乳房可及1個或數個腫塊,化膿時腫塊增大,與皮膚形成粘連,局部發紅,可有輕微波動感[40-41]。破潰后流出稀薄膿液,后期可形成竇道,愈合緩慢,可伴有潮熱、盜汗、消瘦等全身癥狀,膿液培養有結核菌生長,抗酸染色可查見結核桿菌,病理學檢查可見乳腺組織中有典型結核結節及干酪樣壞死,結節不以小葉為中心[42-43]。
3.3 結節病
結節病常表現為侵犯肺和胸部淋巴結,可累及乳腺引起非干酪樣肉芽腫性炎癥,皮膚表現以結節性紅斑最多見,關節受累時有關節炎表現,胸片常見肺門和(或)縱隔淋巴結對稱性腫大[44]。
3.4 硬化性淋巴細胞性乳腺炎
硬化性淋巴細胞性乳腺炎是一種少見的以乳腺間質纖維化為主的非化膿性炎癥乳腺疾病,常伴有糖尿病病史,因為病變質地較硬,術前易誤診為乳腺癌而行手術切除[45],病理組織學表現為乳腺小葉內及導管周圍有大量淋巴細胞(主要為B淋巴細胞且淋巴細胞主要表達CD20)、漿細胞浸潤,間質纖維化透明樣變,晚期小葉萎縮或消失,可伴有淋巴濾泡形成、玻璃樣變性[45-46]。
3.5 韋格納肉芽腫
韋格納肉芽腫可發生在全身各個系統和器官,但以上呼吸道、肺部和腎臟最為常見,患者肌肉和骨骼受累時主要表現為肌痛和關節痛,關節痛可呈游走性、單發或多發,皮膚受損時可表現為紫癜、疣狀丘疹、皮下結節、潰瘍等;病理改變表現為常出現血管壁損傷和纖維素樣壞死,炎細胞浸潤以中性粒細胞、淋巴細胞、單核細胞為主,嗜酸性粒細胞較少,其繼發性改變包括微膿腫和纖維化[47]。伴關節腫痛及肢體紅斑的GLM患者應注意與該病進行鑒別。
4 GLM的治療
隨著GLM的發病率不斷上升,但因其病因和發病機制不明,目前具體治療選擇和治療時機仍無統一標準。如今針對GLM的治療方法主要以保守治療和手術治療為主,包括隨訪觀察、抗生素治療、抗結核藥物治療、糖皮質激素治療、免疫抑制劑治療、手術治療、中醫藥治療、聯合治療等。
4.1 隨訪觀察
近年來,隨著對GLM的進一步認識,部分研究者對該疾病的認識發生了轉變,認為GLM是一種自限性的良性疾病,在不切切除乳房情況下,雖患者病情可能會持續較長時間甚至加重,但隨著時間推移會自行康復,因此可以隨訪觀察。Bouton等[48]報道了27 例GLM,經觀察平均時間7.4 個月后得到緩解,期間未使用皮質類固醇,并且提出對GLM自然病程的耐心很重要,因為該過程通常包括緩解前的進展期。Davis等[49]隨訪了120例未行任何治療的GLM患者,其中112例GLM患者在平均5個月(0~20個月)后自行痊愈,指出隨訪觀察的關鍵是宣教,讓患者放心,以避免可能會導致乳房畸形的手術以及不必要的藥物潛在副作用和額外費用給患者和醫療護理造成的額外負擔。
4.2 藥物治療
4.2.1 抗生素
一般認為,單獨應用抗生素治療GLM并無明顯效果[33]。如果合并膿腫或對有膿腫破潰、竇道形成等急性感染癥狀者,應先根據藥敏結果或經驗性使用抗生素治療,防止激素治療后免疫功能降低加重感染[50]。相較于水溶性抗生素,強力霉素、克拉霉素、利福平等親脂性抗生素更易在病灶中達到足夠的治療濃度[51]。近年來,國內外有越來越多關于親脂類抗生素在GLM治療中應用的報道。王華等[52]研究表明,抗分枝桿菌三聯藥物(異煙肼0.3 g/d、利福平0.45 g/d、乙胺丁醇0.75 g/d,總療程6~12個月)治療GLM能使大部分患者治愈而避免手術,明顯縮小部分患者的原發病灶,減小手術切除范圍,保留乳房外形,復發率低;而抗結核藥物最常見的不良反應是肝腎損害,因此服藥期間應每1~2個月定期復查肝腎功能。Williams等[33]研究認為,延長親脂性抗生素(如克拉霉素)的療程可能是一種可行的治療方案,這種方法有可能減少長期使用類固醇或手術等干預措施的應用。綜上,單獨使用抗生素治療GLM通常效果有限。在存在膿腫、感染癥狀或其他并發癥的情況下,抗生素治療可作為一種必要的補充,但應根據藥敏結果或經驗性選擇合適的抗生素。親脂性抗生素可能更適合在GLM治療中使用,因為它們能夠在病灶中達到足夠的治療濃度。
4.2.2 激素
目前國內外多數學者認為激素是治療GLM的一線治療方法,尤其對處于急性期伴有疼痛的患者,起效快且療效明顯。推薦小劑量起始治療,待癥狀好轉后可逐漸減量;若有較為明顯的全身伴隨癥狀,可使用糖皮質激素短療程沖擊治療,若1~2周疾病無明顯改善,建議盡早更換治療方案[53]。長期使用糖皮質激素可能會引起明顯不良反應,如出現閉經、體質量增加、痤瘡、消化道潰瘍、骨質疏松癥、骨髓抑制、股骨頭壞死甚至機會性感染。因此,密切關注在激素應用過程中的療效及減少劑量相關所引起的副作用至關重要。Ece等[54]通過基于超聲剪切波彈性成像組織硬度測量評估GLM病例中減少皮質類固醇激素劑量后的療效,結果表明,剪切波彈性成像相關的劑量調整技術可以減少皮質類固醇激素的副作用,而未明顯影響治療效果。與全身應用相比,局部應用更小劑量類固醇作用于靶組織效果較好,這為減少其副作用提供了一種解決方法[55]。
4.2.3 免疫抑制劑
相關研究[56-57]表明,對于糖皮質激素耐藥以及無法耐受長期激素治療的患者,免疫抑制劑甲氨蝶呤、硫唑嘌呤和環孢素A對治療GLM有一定效果,甲氨蝶呤的使用劑量為每周7.5~15.0 mg,單獨治療維持1年,癥狀緩解后可逐漸減量,治療期間應密切觀察不良反應,如肝腎功能損傷、骨髓抑制、胃腸道反應、間質性肺炎、葉酸缺乏。此外,Kaya等[58]在甲氨蝶呤治療出現不良反應或效果不佳時應用環孢素A和硫唑嘌呤可以獲得較高的緩解率,且在獲得緩解后使用免疫抑制劑治療約1年,可實現長期無藥緩解。趙婷婷等[59]的研究結果顯示,秋水仙堿可抑制中性粒細胞的趨化、黏附及吞噬,對伴有下肢結節性紅斑的GLM患者在常規治療基礎上聯合秋水仙堿治療的效果較為理想,可顯著提高治療有效率,且具備較高安全性。
4.2.4 中醫中藥
不同于西醫從微觀層面關注疾病的病因學,中醫強調利用疏肝健脾補腎等理論對患者進行宏觀調控和辯證論治,強調內外合治,初期以消為貴,中期以托為法,后期以補為宜,認為進行臨床分型可以更好地指導臨床治療[60]。針對腫塊型(以局部塊為主要表現而臨床檢查無明顯膿腫),治療以消為貴,辨證聯合使用活血化瘀、化痰散結、疏肝行氣法等[60]。胡珊等[61]研究表明,疏肝健脾針刺法可有效改善腫塊型GLM患者血清免疫指標,平衡免疫功能;對于膿腫型(局部腫塊已成膿,以膿腫為主要表現),治療以托為法,包括托里透膿、益氣托毒、溫陽托毒法等[60]。韓旭等[62]研究顯示,加減透膿散聯合乳癰散外敷治療可促進膿腐液化、排出,加速恢復期潰口愈合;對于潰后型(膿腫破潰或局部切開引流后,以竇道、滲液為主要表現),治療以補為宜,包括益氣健脾、溫陽消腫、益氣養血等[60]。鄧佩等[63]認為,GLM患者多因體虛弱,臟腑功能失調、經絡氣血運行不暢所致,當疾病進展至潰后期時病久耗氣傷津,正氣虧虛無力托毒肌,膿水淋漓,遷延難愈,因此在治療上以益氣健脾法為核心,旨在通過培補后天之本來提高免疫功能。
4.2.5 其他藥物
針對病因采取相應的治療措施。如針對高泌乳素患者降低其泌乳素水平。有研究[14]表明,溴隱亭聯合糖皮質激素治療高泌乳素血癥GLM患者有效,若患者合并垂體瘤則需采取手術切除或溴隱亭抑制治療;對于服用抗精神病藥物引起的高泌乳素血癥患者需與精神科等多學科會診后調整抗精神病藥物的用量或是考慮加用溴隱亭治療[14];長期應用避孕藥的患者應減少或停止使用該類藥物,以避免造成體內激素紊亂[6]。
4.3 手術治療
針對GLM何時采取手術治療及采取何種手術方式尚無統一標準。
目前文獻[64-65]報道的主要手術方式有膿腫穿刺或切開引流術、單純腫塊切除術、病變組織擴大切除術、腺體區段切除術、皮下腺體全切除術等,并根據患者意愿進行乳房的Ⅰ期整形。中醫外治法與西醫外科治療則有異曲同工之處,主要包括貼敷療法、穿刺抽膿術、火針洞式烙口引流術、切開引流術、祛腐清創術、導管灌注、竇道灌注等[61, 66];若患者存在膿腫,需適當緩解膿腫等癥狀,首先考慮采用穿刺抽膿,一般不宜輕易選擇膿腫切開引流或全乳切除[67]。單純腫塊切除手術治療GLM時,因腫物邊界不清晰,采用此術式治療時陰性切緣無法保障,繼而無法保證治療效果,極易出現術后復發,在實施二次手術治療時損傷和愈合難度均增大,增加患者的心理壓力和經濟負擔[68]。目前臨床上常使用病變組織擴大切除聯合術后整形修復的方法,手術時應切除皮膚病變的炎癥病灶、膿腫、擴張的導管及部分病灶周圍的正常乳腺組織,保證切緣炎癥組織陰性,也能避免多次復發或多次手術導致乳房外形損傷[68]。具體選擇何種手術方式應視患者具體情況及患者意愿而定,根據每例患者的特殊情況選擇相應的手術方式以達到良好的治療效果。
GLM手術時機盡量選擇在慢性遷延期進行,避免在發生急性感染癥狀或檢出致病菌的急性期進行,但應視具體情況而定,急性期并不是手術的絕對禁忌證[64]。手術治療具有長效性、安全性、有效性等優點,但存在部分患者由于病灶清除不徹底、手術時機把握欠佳等,導致術后傷口延遲愈合、膿腫或竇道反復形成,若復發則需多次手術,而且手術切除范圍過大可能導致乳房變形或缺失,美容效果差等缺點,無論是在經濟上還是肉體和心靈上都對患者造成巨大傷害[64]。
4.4 聯合治療
越來越多的研究表明,無論是單獨的藥物治療或是手術治療,其療效均不及聯合治療。術前激素輔助治療一方面可以在術前使腫塊縮小從而減少術中切除的乳腺組織量,另一方面可以加快術后傷口愈合并降低術后復發風險[69]。對于激素治療不敏感的患者,可以考慮聯合免疫抑制劑如甲氨蝶呤進行治療,待病灶不再進展或縮小后再予以手術治療[57]。對于合并克氏棒狀桿菌感染的患者,抗結核藥物輔助治療在一定程度上有助于病情控制[52]。此外,中醫中藥治療對病灶的消退也具有一定的促進作用。 Zuo等[70]研究顯示,與單純進行西醫手術治療相比,中西醫結合治療GLM可顯著降低復發率,改善雙側乳房的對稱性和美觀性。
4.5 其他治療方法
越來越多不同學科的臨床醫生與研究者在治療方面進行了新的研究與探索。Chen等[71]認為,克氏棒狀桿菌的最適生長溫度為37 ℃,在42 ℃時其生長受到明顯抑制,局部溫度控制可能導致生長停滯。局部熱療作為一種治療炎癥和加速傷口愈合的方法,通過使用自動加熱貼將乳房局部溫度維持在42~65 ℃可取得良好的治療效果,不良反應輕微,愈合時間縮短,但仍需進一步研究證實。Cabioglu等[72]研究表明,臭氧治療對激素抵抗型GLM患者有效,臭氧治療后免疫系統的變化可以改善難治性GLM患者的傷口愈合和恢復免疫功能障礙,認為與既往研究通過激素或免疫抑制劑來抑制免疫反應不同,臭氧治療不是通過抑制免疫系統,而是通過恢復激素抵抗型GLM中的1型T輔助淋巴細胞反應和免疫調節來發揮治療作用。因此,需要進一步的研究來探討臭氧治療在大樣本GLM患者中的療效。腫瘤壞死因子-α抑制劑被認為是安全有效的慢性自身免疫性肉芽腫疾病的長期治療藥物,有研究者們[73-74]將腫瘤壞死因子-α抑制劑阿達木單抗應用于GLM患者,認為它可能是治療難治性GLM的一種非類固醇、非抗微生物和非手術的替代療法。
總之,對于GLM治療的研究正在不斷進行,這些新方法為GLM治療提供了新的選擇,但需要更多的研究來驗證其療效。未來應繼續尋求新的方法并改進已有的治療方法,以期能讓患者更大程度獲益并且提高患者的生活質量。
5 總結與展望
GLM是一種良性乳腺疾病,近年來此病在我國的發病人數不斷增加,其診療方案仍缺乏統一的標準,因此,在臨床工作中選擇治療方案時應充分結合醫生的經驗及患者的意愿。過去二三十年間,GLM的治療方式以手術為主,但手術治療后仍有較高的復發率且給患者帶來軀體與精神上的雙重打擊。近些年來,更多的研究者推薦將隨訪觀察或口服糖皮質激素等保守治療作為一線治療方式。對于難治性GLM患者,保守治療的病程長、療效不顯著且長期服用糖皮質激素可能會帶來一系列的副作用,故而對于難治性GLM仍建議行手術治療。由于目前針對GLM的診療研究多以回顧性研究為主,缺乏足夠的循證醫學證據,臨床上對本病的認識仍不足,常導致誤診和誤治,這可能會導致病程延長、療效不佳、乳房美觀度明顯受損、醫療費用增加等不良后果,嚴重影響患者的身心健康。未來仍需開展前瞻性高質量多中心的臨床試驗和進行循證醫學實踐,以進一步完善GLM的診療方案。提高對GLM的認識、制定臨床診斷標準及規范診療行為是目前亟待解決的重要問題。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:李銀鑫負責查閱文獻、撰寫論文;李智宇對論文撰寫和論文修改給予指導;孫圣榮和陳創對選題和論文修改給予指導。