引用本文: 李治仝, 孔祥琳, 劉冰熔, 劉丹, 王盟, 李德亮. 胃食管反流致大鼠食管良性狹窄動物模型的初步驗證. 中國普外基礎與臨床雜志, 2024, 31(6): 690-694. doi: 10.7507/1007-9424.202309076 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胃食管反流病(gastroesophageal reflux disease,GERD)是比較常見的消化道疾病,所引起的食管疾病占所有食管疾病的75%[1-2]。長期的胃食管反流可以導致食管黏膜炎癥、糜爛、潰瘍和狹窄[3]。下食管括約肌功能缺失或喪失以及食管清除能力下降是導致胃食管反流的根本原因。胃內容物倒流引起食管固有層的炎癥,在長期的慢性炎癥反應過程中,損傷的程度可能超過固有層的再生能力,細胞凋亡,從而導致瘢痕組織形成,引起食管的狹窄[4]。臨床中不管是質子泵抑制劑藥物[5]、還是球囊擴張[6],甚至抗反流手術[7]治療反流引起的食管狹窄,都有很高的復發傾向。構建合適的疾病動物模型,對研究疾病的發病機制和治療方法具有重要作用。 已經有各種研究模型包括慢性胃食管反流、食管炎、腸上皮化生、不典型增生和食管腺癌的發病機制已被廣泛報道[8-9]。免疫介導的炎性細胞因子在動物實驗中也被大量發現。在食管炎癥動物模型和GERD患者的食管黏膜及和肌層中發現白細胞介素(interleukin,IL)-1β水平升高[10]。在GERD患者中形成的食管狹窄除了胃內容物的刺激外,免疫介導的炎性細胞因子也可能直接或者間接參與了引起食管黏膜的損傷、細胞凋亡和纖維化的發生[11-12]。所以關于胃酸、胃蛋白酶和炎癥細胞因子在食管狹窄形成中各自的作用尚未被廣泛接受。為了更科學的明確胃酸、胃蛋白酶和炎癥細胞因子在食管良性狹窄形成中的作用機制,有必要建立穩定可靠的、不太復雜的動物模型。本研究旨在建立胃食管反流致食管狹窄的大鼠模型,以進一步探討食管狹窄形成的機制。
1 材料與方法
1.1 實驗動物、設備及材料
本實驗動物為30只遠交( Sprague-Dawley,SD)大鼠,4~6周齡,均為雄性,體質量(300±50)g,購自斯貝福(北京)生物技術有限公司,合格證書為SCXK(京)2019-0010號。用標準飼料和5%葡萄糖溶液喂養,飼養環境溫度為25~27 ℃,濕度為40%~50%。所有動物實驗的方案均得到了康泰醫學檢驗服務河北有限公司實驗動物倫理委員會的批準(批文編號:MDL20220111-01),并符合國際最高的人文關懷標準。鹽酸-胃蛋白酶(貨號:ZLI-9064)和磷酸緩沖鹽溶液(貨號:ZLI-9061)均購于中杉金橋公司;腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)檢測試劑盒(型號:SEA133Hu)、IL-1β檢測試劑盒(型號:SEA124Hu)和IL-18檢測試劑盒(型號:SEA073Hu)均購于武漢優爾生公司;正置熒光顯微鏡(型號:DM3000)購于德國Leica公司。
1.2 實驗動物分組
30只SD大鼠采用隨機數字表法隨機分為3組:① 手術+酸灌注組(n=10),于胃食管連接處向近口側縱向切開食管下括約肌肌層約1.5 cm長,切開膈肌左側的食管裂孔,制備食管下括約肌松弛合并食管裂孔疝模型,然后再用1 mg/mL鹽酸-胃蛋白酶(hydrochloric acid-pepsin,HCl-P)灌注食管;② 酸灌注組(n=10),直接用1 mg/mL HCl-P灌注食管;③ 對照組(n=10),用等量生理鹽水灌注食管。根據文獻 [13]報道 的方法配制HCl-P灌注液,該灌注液是含有1 mg/mL胃蛋白酶的HCl溶液(pH=1.0),其酸度與人胃液的酸度相近。加入胃蛋白酶是為了模擬消化過程中的胃內容物。
1.3 實驗方法
手術+酸灌注組手術程序遵循適用于動物研究的技術標準和國際權利。SD大鼠術前禁食8 h,但可以隨意進水。用10%鹽酸氯胺酮(40 mg/kg,北京中山生物)和5%甲苯噻嗪(5 mg/kg,北京中山生物)通過腹部注射麻醉后,將動物仰臥至30° 抬頭角的加熱手術臺以減少灌注液的回流,并固定。取腹正中5 cm長切口,進腹顯露胃食管壁,于胃食管交界處向近口側縱向切開食管下括約肌肌層約1.5 cm長的條狀切口;隨后向左側切開食管裂孔處的膈肌擴大食管裂孔,長約1.5 cm,制備下食管括約肌松弛及食管裂孔疝模型。用0號尼龍縫線常規關閉腹部切口。大鼠麻醉清醒后先給予流質飲食喂食,術后第2天正常飲食,密切觀察大鼠反應。出現食管和(或)胃穿孔和(或)出血的動物被排除在外。
待大鼠可以正常飲食后,再次用10%鹽酸氯胺酮(40 mg/kg)和5%甲苯噻嗪(5 mg/kg)行腹部注射麻醉,麻醉以大鼠無明顯抵抗即可,將麻醉后的大鼠平臥固定在動物板上,然后將頭抬高成微角度(20°~30°),經口將5-F導管插入食管中下段,使用蠕動泵以0.3 mL/min的流速將配制好的HCL-P混合液經導管灌注,60 min/d;酸灌注組用同樣方法直接等量灌注配制好的HCL-P混合液,對照組則用等量生理鹽水灌注。灌注完畢后及時拔出灌注導管,讓大鼠正常飲食。3組大鼠均連續灌注4周實驗結束。
1.4 檢測指標及方法
實驗結束后處死大鼠,切除胃食管連接處以上(近口側)1 cm長食管,或切除距食管狹窄上下0.5 cm范圍的食管。觀察食管直徑并與正常食管直徑進行比較;然后取0.5 cm長病變食管石蠟包埋組織,行全層8 μm切片經蘇木精和伊紅染色(MDL公司)后在正置熒光顯微鏡下觀察食管黏膜損傷情況。剩余的食管組織標本使用磷酸緩沖鹽溶液進行均質化,將勻漿在4 ℃下以 3 000 r/min 離心15 min(離心半徑13.5 cm)。采用酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)法檢測上清液中TNF-α、IL-1β和IL-18的濃度。
對每只大鼠食管組織的2張切片進行編碼,隨后由不知情的觀察者根據文獻 [14] 報道的標準化損傷評分方法對食管黏膜損傷情況進行評分,該評分分別對上皮損傷、黏膜下水腫和炎癥浸潤的程度進行了分級(表1)。
1.5 統計學方法
使用SPSS 17.0和GraphPad Prism 5統計軟件分析。用正態曲線直方圖檢驗計量數據符合正態分布,用均數±標準差( ±s)表示,采用方差分析(ANOVA),兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
±s)表示,采用方差分析(ANOVA),兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
2 結果
2.1 食管灌注后大鼠一般情況
手術+酸灌注組術后第1天死亡2只大鼠,酸灌注組和對照組大鼠均生存良好。灌注期間手術+酸灌注組和酸灌注組各有1只大鼠死亡。灌注4周后,手術+酸灌注組與酸灌注組大鼠進食量較灌注前明顯減少,在手術+酸灌注組中3只大鼠出現嘔吐、反食癥狀。與對照組大鼠的體質量 [(371.10±18.98)g] 比較,手術+酸灌注組 [(343.00±16.68)g] 和酸灌注組 [(351.00±17.32)g] 大鼠的體質量均下降,其差異有統計學意義(P=0.007,P=0.028),手術+酸灌注組大鼠的體質量低于酸灌注組大鼠,但差異無統計學意義(P=0.368)。手術+酸灌注組存活的7只大鼠中有2只形成食管良性狹窄,酸灌注組和對照組大鼠沒有發生食管狹窄(圖1)。
 圖1
示灌注4周后獲取的食管組織,對照組大鼠食管未見狹窄(a),手術+酸灌注組大鼠食管直徑變小(b)
圖1
示灌注4周后獲取的食管組織,對照組大鼠食管未見狹窄(a),手術+酸灌注組大鼠食管直徑變小(b)
2.2 食管灌注后食管組織中TNF-α、IL-1β和IL-18濃度檢測結果
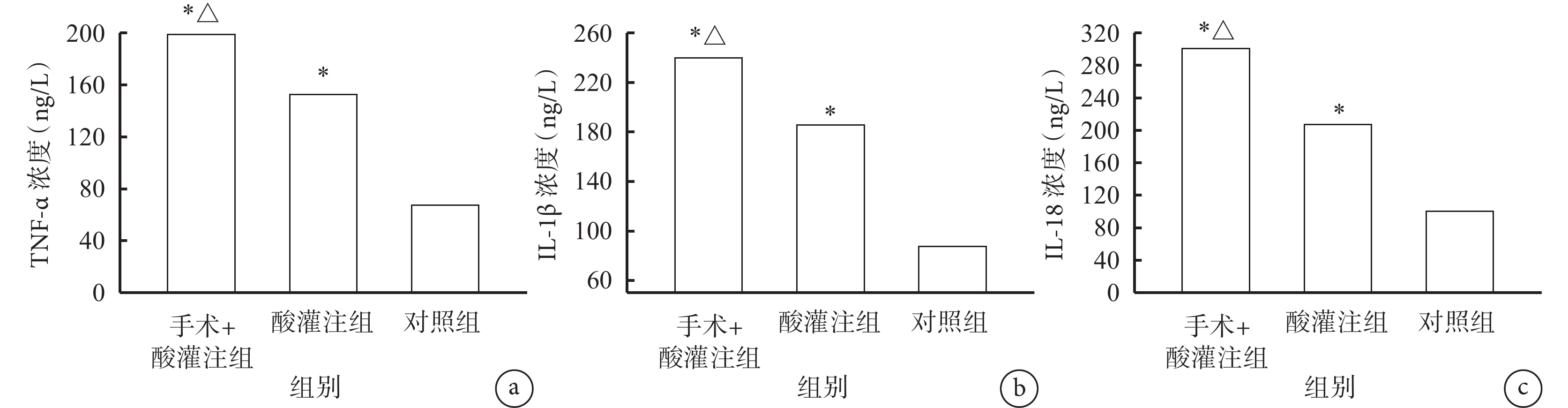
大鼠食管組織中TNF-α、IL-1β和IL-18的濃度手術+酸灌注組和酸灌注組均高于對照組(P<0.001),手術+酸灌注組又高于酸灌注組(P<0.001)。具體見圖2。
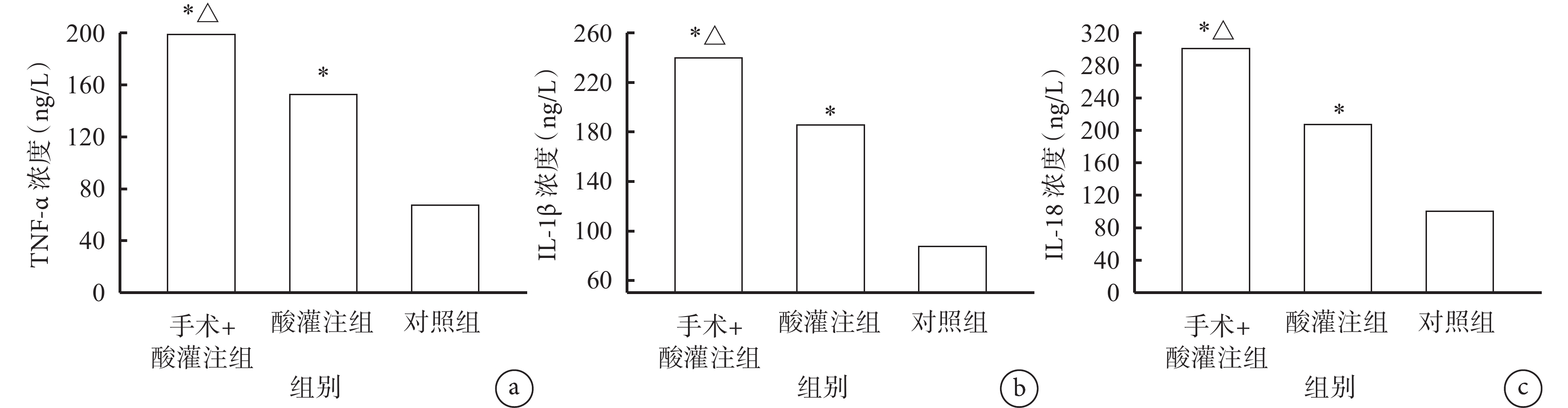 圖2
示食管灌注后食管組織中TNF-α(a)、IL-1β(b)和IL-18(c)檢測結果
圖2
示食管灌注后食管組織中TNF-α(a)、IL-1β(b)和IL-18(c)檢測結果
與對照組比較,*
2.3 食管灌注后食管黏膜損傷評分結果
在灌注4周后,對照組大鼠的食管黏膜未見明顯的病理變化(圖3a);酸灌注組大鼠食管黏膜出現明顯的炎癥反應,見大量壞死組織,炎性細胞增多,基底細胞稍增生(圖3b);手術+酸灌注組除了食管黏膜出現明顯的炎癥反應外,同時觀察到其基底細胞過度增殖、乳頭肥大、上皮過度角化以及鱗狀細胞擴張(圖3c)。食管黏膜組織損傷評分對照組為(0.60±0.52)分,酸灌注組為(1.67±0.71)分,手術+酸灌注組為(2.57±0.53)分,酸灌注組和手術+酸灌注組均高于對照組(P<0.001),手術+酸灌注組又高于酸灌注組(P=0.014)。具體見圖3d。
 圖3
示3組大鼠食管灌注后食管黏膜組織的病理改變(HE ×200)及食管黏膜損傷評分結果
圖3
示3組大鼠食管灌注后食管黏膜組織的病理改變(HE ×200)及食管黏膜損傷評分結果
a:為對照組的正常食管黏膜組織;b:為酸灌注組的食管黏膜組織病理改變,見大量壞死組織,炎性細胞增多,基底細胞稍增生; c:為手術+酸灌注組的食管黏膜組織病理改變,見明顯的基底細胞增生、乳頭肥大和上皮過度角化;d:為3組大鼠的食管黏膜損傷評分結果,與對照組比較,*
3 討論
GERD是當今臨床實踐中最常見的問題之一,可導致食管黏膜潰瘍、狹窄、柱狀化生(巴雷特食管)和癌變[3, 15]。GERD的病理生理學復雜,涉及多種因素,如抗反流屏障功能障礙、胃排空障礙和食管防御機制異常。大多GERD動物模型是通過手術建立的,如食管下括約肌縱向切開或合并食管裂孔疝形成、幽門結扎、食管胃吻合術、食管空腸吻合術等[9, 16]。還有研究[17-18]通過導管或預埋微型泵在動物體內不斷將外源性酸、胃蛋白酶或膽汁灌入食管,直接通過化學刺激損傷食管黏膜,短時間即可誘導食管黏膜潰瘍和嚴重的食管炎。此類方法受灌注持續時間、灌注物及復雜的體內反流物的影響,單純通過化學刺激損傷食管黏膜可引起食管炎的產生,但無法模擬人的胃食管反流性食管良性狹窄模型,且人反流性食管良性狹窄的產生是一涉及多方面因素的慢性過程,因為它需要相似的發病機制和充足的反流刺激時間。為研究胃食管反流性食管良性狹窄的發生機制,本研究以SD大鼠為研究對象分為3組構建食管狹窄模型:手術+酸灌注組,先行食管下括約肌離斷和食管裂孔橫切后形成下食管括約肌松弛合并食管裂孔疝的模型,再用HCl-P灌注;酸灌注組直接用HCl-P灌注;對照組則用生理鹽水灌注。本研究結果顯示:手術+酸灌注組與其他2組比較不但可引起更嚴重的食管炎性反應,還能造成部分大鼠食管狹窄。有研究[17-19]報道,在大鼠模型中連續往食管灌注胃腸反流物質可成功誘導出食管潰瘍和嚴重食管炎,但在7 d和4周的實驗過程中未誘導出食管狹窄。本研究結果提示:手術造成抗反流屏障減弱后再酸灌注比單純的外源性灌酸或膽汁可引起更嚴重的食管損傷。 既往有食管裂孔疝、消化性潰瘍疾病及大量飲酒可顯著增加潰瘍性食管狹窄風險的報道[20]。因此,食管下括約肌離斷合并食管裂孔疝模型可加重HCl-P灌注誘導的食管病變,引起食管狹窄的形成。
體質量下降是胃食管反流動物模型常見的并發癥。在Gaia Filho等[21]的研究中觀察到接受食管下括約肌全肌切除術的大鼠體質量明顯減輕,但與部分切除和對照組相比差異無統計學意義。在本研究中,觀察到手術+酸灌注組與酸灌注組大鼠的體質量顯著減輕,與對照組相比差異有統計學意義(P<0.05),以手術+酸灌注組體質量下降明顯。這可能與反流和食管狹窄有關,食管狹窄的形成造成大鼠進食困難,體質量下降。本研究結果提示,該實驗中使用的技術干擾了大鼠的營養狀況,與另外兩項研究[22-23]中觀察到分布在不同組中的所有大鼠體質量均不同程度減輕結果相似。
炎癥觸發的食管狹窄不僅取決于損傷后的纖維增生,可能還取決于免疫介質如炎性細胞因子和趨化因子的作用[24]。在GERD患者的食管黏膜活檢標本中檢測到大量細胞因子和趨化因子增加,包括IL-1β、IL-6、IL-8、IL-10、TNF-α和單核細胞趨化蛋-1[25-26]。本研究檢測了3組大鼠食管組織中TNF-α、IL-1β和IL-18的濃度,結果顯示手術+酸灌注組的TNF-α、IL-1β和IL-18的濃度高于其他2組(P<0.001)。既往研究[27]表明,手術+酸灌注組食管組織中TNF-α、IL-1β和IL-6的濃度明顯高于假手術+鹽水灌注組。炎性細胞的浸潤和活化可產生一系列細胞因子及炎性介質,從而激發組織內成纖維細胞的增殖、活化,分泌大量細胞外基質,最終導致纖維化及狹窄形成[28]。本研究中食管下括約肌離斷和食管裂孔橫切后再用HCl-P灌注食管更能體現胃食管反流的發病機制,進而誘導出食管狹窄。
本研究結果驗證了抗反流屏障的缺失、HCl-P灌注和炎性細胞因子活化三者共同參與誘導食管病變,甚至造成食管狹窄。但仍存在以下局限性:一是誘導食管狹窄的成功率較低,缺乏大樣本實驗的隨機對照;二是食管狹窄形成原因可能是多種因素相互作用的結果,本研究只驗證了抗反流屏障缺失加HCl-P灌注誘導的食管狹窄,可能還有食管內定植細菌參與了食管狹窄的形成。另外,食管狹窄形成的分子機制不明確,需要我們進一步深入地研究。
重要聲明
利益沖突聲明: 所有作者聲明不存在利益沖突。
作者貢獻聲明:所有作者都已閱讀并批準了這篇文章的版本。這篇文章的任何部分都沒有在其他地方發表。
倫理聲明:本研究通過了康泰醫學檢驗服務河北有限公司實驗動物倫理委員會的審批,批文編號:MDL20220111-01。
胃食管反流病(gastroesophageal reflux disease,GERD)是比較常見的消化道疾病,所引起的食管疾病占所有食管疾病的75%[1-2]。長期的胃食管反流可以導致食管黏膜炎癥、糜爛、潰瘍和狹窄[3]。下食管括約肌功能缺失或喪失以及食管清除能力下降是導致胃食管反流的根本原因。胃內容物倒流引起食管固有層的炎癥,在長期的慢性炎癥反應過程中,損傷的程度可能超過固有層的再生能力,細胞凋亡,從而導致瘢痕組織形成,引起食管的狹窄[4]。臨床中不管是質子泵抑制劑藥物[5]、還是球囊擴張[6],甚至抗反流手術[7]治療反流引起的食管狹窄,都有很高的復發傾向。構建合適的疾病動物模型,對研究疾病的發病機制和治療方法具有重要作用。 已經有各種研究模型包括慢性胃食管反流、食管炎、腸上皮化生、不典型增生和食管腺癌的發病機制已被廣泛報道[8-9]。免疫介導的炎性細胞因子在動物實驗中也被大量發現。在食管炎癥動物模型和GERD患者的食管黏膜及和肌層中發現白細胞介素(interleukin,IL)-1β水平升高[10]。在GERD患者中形成的食管狹窄除了胃內容物的刺激外,免疫介導的炎性細胞因子也可能直接或者間接參與了引起食管黏膜的損傷、細胞凋亡和纖維化的發生[11-12]。所以關于胃酸、胃蛋白酶和炎癥細胞因子在食管狹窄形成中各自的作用尚未被廣泛接受。為了更科學的明確胃酸、胃蛋白酶和炎癥細胞因子在食管良性狹窄形成中的作用機制,有必要建立穩定可靠的、不太復雜的動物模型。本研究旨在建立胃食管反流致食管狹窄的大鼠模型,以進一步探討食管狹窄形成的機制。
1 材料與方法
1.1 實驗動物、設備及材料
本實驗動物為30只遠交( Sprague-Dawley,SD)大鼠,4~6周齡,均為雄性,體質量(300±50)g,購自斯貝福(北京)生物技術有限公司,合格證書為SCXK(京)2019-0010號。用標準飼料和5%葡萄糖溶液喂養,飼養環境溫度為25~27 ℃,濕度為40%~50%。所有動物實驗的方案均得到了康泰醫學檢驗服務河北有限公司實驗動物倫理委員會的批準(批文編號:MDL20220111-01),并符合國際最高的人文關懷標準。鹽酸-胃蛋白酶(貨號:ZLI-9064)和磷酸緩沖鹽溶液(貨號:ZLI-9061)均購于中杉金橋公司;腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)檢測試劑盒(型號:SEA133Hu)、IL-1β檢測試劑盒(型號:SEA124Hu)和IL-18檢測試劑盒(型號:SEA073Hu)均購于武漢優爾生公司;正置熒光顯微鏡(型號:DM3000)購于德國Leica公司。
1.2 實驗動物分組
30只SD大鼠采用隨機數字表法隨機分為3組:① 手術+酸灌注組(n=10),于胃食管連接處向近口側縱向切開食管下括約肌肌層約1.5 cm長,切開膈肌左側的食管裂孔,制備食管下括約肌松弛合并食管裂孔疝模型,然后再用1 mg/mL鹽酸-胃蛋白酶(hydrochloric acid-pepsin,HCl-P)灌注食管;② 酸灌注組(n=10),直接用1 mg/mL HCl-P灌注食管;③ 對照組(n=10),用等量生理鹽水灌注食管。根據文獻 [13]報道 的方法配制HCl-P灌注液,該灌注液是含有1 mg/mL胃蛋白酶的HCl溶液(pH=1.0),其酸度與人胃液的酸度相近。加入胃蛋白酶是為了模擬消化過程中的胃內容物。
1.3 實驗方法
手術+酸灌注組手術程序遵循適用于動物研究的技術標準和國際權利。SD大鼠術前禁食8 h,但可以隨意進水。用10%鹽酸氯胺酮(40 mg/kg,北京中山生物)和5%甲苯噻嗪(5 mg/kg,北京中山生物)通過腹部注射麻醉后,將動物仰臥至30° 抬頭角的加熱手術臺以減少灌注液的回流,并固定。取腹正中5 cm長切口,進腹顯露胃食管壁,于胃食管交界處向近口側縱向切開食管下括約肌肌層約1.5 cm長的條狀切口;隨后向左側切開食管裂孔處的膈肌擴大食管裂孔,長約1.5 cm,制備下食管括約肌松弛及食管裂孔疝模型。用0號尼龍縫線常規關閉腹部切口。大鼠麻醉清醒后先給予流質飲食喂食,術后第2天正常飲食,密切觀察大鼠反應。出現食管和(或)胃穿孔和(或)出血的動物被排除在外。
待大鼠可以正常飲食后,再次用10%鹽酸氯胺酮(40 mg/kg)和5%甲苯噻嗪(5 mg/kg)行腹部注射麻醉,麻醉以大鼠無明顯抵抗即可,將麻醉后的大鼠平臥固定在動物板上,然后將頭抬高成微角度(20°~30°),經口將5-F導管插入食管中下段,使用蠕動泵以0.3 mL/min的流速將配制好的HCL-P混合液經導管灌注,60 min/d;酸灌注組用同樣方法直接等量灌注配制好的HCL-P混合液,對照組則用等量生理鹽水灌注。灌注完畢后及時拔出灌注導管,讓大鼠正常飲食。3組大鼠均連續灌注4周實驗結束。
1.4 檢測指標及方法
實驗結束后處死大鼠,切除胃食管連接處以上(近口側)1 cm長食管,或切除距食管狹窄上下0.5 cm范圍的食管。觀察食管直徑并與正常食管直徑進行比較;然后取0.5 cm長病變食管石蠟包埋組織,行全層8 μm切片經蘇木精和伊紅染色(MDL公司)后在正置熒光顯微鏡下觀察食管黏膜損傷情況。剩余的食管組織標本使用磷酸緩沖鹽溶液進行均質化,將勻漿在4 ℃下以 3 000 r/min 離心15 min(離心半徑13.5 cm)。采用酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)法檢測上清液中TNF-α、IL-1β和IL-18的濃度。
對每只大鼠食管組織的2張切片進行編碼,隨后由不知情的觀察者根據文獻 [14] 報道的標準化損傷評分方法對食管黏膜損傷情況進行評分,該評分分別對上皮損傷、黏膜下水腫和炎癥浸潤的程度進行了分級(表1)。
1.5 統計學方法
使用SPSS 17.0和GraphPad Prism 5統計軟件分析。用正態曲線直方圖檢驗計量數據符合正態分布,用均數±標準差( ±s)表示,采用方差分析(ANOVA),兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
±s)表示,采用方差分析(ANOVA),兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
2 結果
2.1 食管灌注后大鼠一般情況
手術+酸灌注組術后第1天死亡2只大鼠,酸灌注組和對照組大鼠均生存良好。灌注期間手術+酸灌注組和酸灌注組各有1只大鼠死亡。灌注4周后,手術+酸灌注組與酸灌注組大鼠進食量較灌注前明顯減少,在手術+酸灌注組中3只大鼠出現嘔吐、反食癥狀。與對照組大鼠的體質量 [(371.10±18.98)g] 比較,手術+酸灌注組 [(343.00±16.68)g] 和酸灌注組 [(351.00±17.32)g] 大鼠的體質量均下降,其差異有統計學意義(P=0.007,P=0.028),手術+酸灌注組大鼠的體質量低于酸灌注組大鼠,但差異無統計學意義(P=0.368)。手術+酸灌注組存活的7只大鼠中有2只形成食管良性狹窄,酸灌注組和對照組大鼠沒有發生食管狹窄(圖1)。
 圖1
示灌注4周后獲取的食管組織,對照組大鼠食管未見狹窄(a),手術+酸灌注組大鼠食管直徑變小(b)
圖1
示灌注4周后獲取的食管組織,對照組大鼠食管未見狹窄(a),手術+酸灌注組大鼠食管直徑變小(b)
2.2 食管灌注后食管組織中TNF-α、IL-1β和IL-18濃度檢測結果
大鼠食管組織中TNF-α、IL-1β和IL-18的濃度手術+酸灌注組和酸灌注組均高于對照組(P<0.001),手術+酸灌注組又高于酸灌注組(P<0.001)。具體見圖2。
 圖2
示食管灌注后食管組織中TNF-α(a)、IL-1β(b)和IL-18(c)檢測結果
圖2
示食管灌注后食管組織中TNF-α(a)、IL-1β(b)和IL-18(c)檢測結果
與對照組比較,*
2.3 食管灌注后食管黏膜損傷評分結果
在灌注4周后,對照組大鼠的食管黏膜未見明顯的病理變化(圖3a);酸灌注組大鼠食管黏膜出現明顯的炎癥反應,見大量壞死組織,炎性細胞增多,基底細胞稍增生(圖3b);手術+酸灌注組除了食管黏膜出現明顯的炎癥反應外,同時觀察到其基底細胞過度增殖、乳頭肥大、上皮過度角化以及鱗狀細胞擴張(圖3c)。食管黏膜組織損傷評分對照組為(0.60±0.52)分,酸灌注組為(1.67±0.71)分,手術+酸灌注組為(2.57±0.53)分,酸灌注組和手術+酸灌注組均高于對照組(P<0.001),手術+酸灌注組又高于酸灌注組(P=0.014)。具體見圖3d。
 圖3
示3組大鼠食管灌注后食管黏膜組織的病理改變(HE ×200)及食管黏膜損傷評分結果
圖3
示3組大鼠食管灌注后食管黏膜組織的病理改變(HE ×200)及食管黏膜損傷評分結果
a:為對照組的正常食管黏膜組織;b:為酸灌注組的食管黏膜組織病理改變,見大量壞死組織,炎性細胞增多,基底細胞稍增生; c:為手術+酸灌注組的食管黏膜組織病理改變,見明顯的基底細胞增生、乳頭肥大和上皮過度角化;d:為3組大鼠的食管黏膜損傷評分結果,與對照組比較,*
3 討論
GERD是當今臨床實踐中最常見的問題之一,可導致食管黏膜潰瘍、狹窄、柱狀化生(巴雷特食管)和癌變[3, 15]。GERD的病理生理學復雜,涉及多種因素,如抗反流屏障功能障礙、胃排空障礙和食管防御機制異常。大多GERD動物模型是通過手術建立的,如食管下括約肌縱向切開或合并食管裂孔疝形成、幽門結扎、食管胃吻合術、食管空腸吻合術等[9, 16]。還有研究[17-18]通過導管或預埋微型泵在動物體內不斷將外源性酸、胃蛋白酶或膽汁灌入食管,直接通過化學刺激損傷食管黏膜,短時間即可誘導食管黏膜潰瘍和嚴重的食管炎。此類方法受灌注持續時間、灌注物及復雜的體內反流物的影響,單純通過化學刺激損傷食管黏膜可引起食管炎的產生,但無法模擬人的胃食管反流性食管良性狹窄模型,且人反流性食管良性狹窄的產生是一涉及多方面因素的慢性過程,因為它需要相似的發病機制和充足的反流刺激時間。為研究胃食管反流性食管良性狹窄的發生機制,本研究以SD大鼠為研究對象分為3組構建食管狹窄模型:手術+酸灌注組,先行食管下括約肌離斷和食管裂孔橫切后形成下食管括約肌松弛合并食管裂孔疝的模型,再用HCl-P灌注;酸灌注組直接用HCl-P灌注;對照組則用生理鹽水灌注。本研究結果顯示:手術+酸灌注組與其他2組比較不但可引起更嚴重的食管炎性反應,還能造成部分大鼠食管狹窄。有研究[17-19]報道,在大鼠模型中連續往食管灌注胃腸反流物質可成功誘導出食管潰瘍和嚴重食管炎,但在7 d和4周的實驗過程中未誘導出食管狹窄。本研究結果提示:手術造成抗反流屏障減弱后再酸灌注比單純的外源性灌酸或膽汁可引起更嚴重的食管損傷。 既往有食管裂孔疝、消化性潰瘍疾病及大量飲酒可顯著增加潰瘍性食管狹窄風險的報道[20]。因此,食管下括約肌離斷合并食管裂孔疝模型可加重HCl-P灌注誘導的食管病變,引起食管狹窄的形成。
體質量下降是胃食管反流動物模型常見的并發癥。在Gaia Filho等[21]的研究中觀察到接受食管下括約肌全肌切除術的大鼠體質量明顯減輕,但與部分切除和對照組相比差異無統計學意義。在本研究中,觀察到手術+酸灌注組與酸灌注組大鼠的體質量顯著減輕,與對照組相比差異有統計學意義(P<0.05),以手術+酸灌注組體質量下降明顯。這可能與反流和食管狹窄有關,食管狹窄的形成造成大鼠進食困難,體質量下降。本研究結果提示,該實驗中使用的技術干擾了大鼠的營養狀況,與另外兩項研究[22-23]中觀察到分布在不同組中的所有大鼠體質量均不同程度減輕結果相似。
炎癥觸發的食管狹窄不僅取決于損傷后的纖維增生,可能還取決于免疫介質如炎性細胞因子和趨化因子的作用[24]。在GERD患者的食管黏膜活檢標本中檢測到大量細胞因子和趨化因子增加,包括IL-1β、IL-6、IL-8、IL-10、TNF-α和單核細胞趨化蛋-1[25-26]。本研究檢測了3組大鼠食管組織中TNF-α、IL-1β和IL-18的濃度,結果顯示手術+酸灌注組的TNF-α、IL-1β和IL-18的濃度高于其他2組(P<0.001)。既往研究[27]表明,手術+酸灌注組食管組織中TNF-α、IL-1β和IL-6的濃度明顯高于假手術+鹽水灌注組。炎性細胞的浸潤和活化可產生一系列細胞因子及炎性介質,從而激發組織內成纖維細胞的增殖、活化,分泌大量細胞外基質,最終導致纖維化及狹窄形成[28]。本研究中食管下括約肌離斷和食管裂孔橫切后再用HCl-P灌注食管更能體現胃食管反流的發病機制,進而誘導出食管狹窄。
本研究結果驗證了抗反流屏障的缺失、HCl-P灌注和炎性細胞因子活化三者共同參與誘導食管病變,甚至造成食管狹窄。但仍存在以下局限性:一是誘導食管狹窄的成功率較低,缺乏大樣本實驗的隨機對照;二是食管狹窄形成原因可能是多種因素相互作用的結果,本研究只驗證了抗反流屏障缺失加HCl-P灌注誘導的食管狹窄,可能還有食管內定植細菌參與了食管狹窄的形成。另外,食管狹窄形成的分子機制不明確,需要我們進一步深入地研究。
重要聲明
利益沖突聲明: 所有作者聲明不存在利益沖突。
作者貢獻聲明:所有作者都已閱讀并批準了這篇文章的版本。這篇文章的任何部分都沒有在其他地方發表。
倫理聲明:本研究通過了康泰醫學檢驗服務河北有限公司實驗動物倫理委員會的審批,批文編號:MDL20220111-01。