引用本文: 張翔, 蔣微琴, 華漢巨, 劉碩, 廖天一, 蔡輝. Ⅰ~Ⅲ期MSS型結直腸癌患者RAS/BRAF基因不同密碼子突變的臨床病理特征、轉移部位及臨床預后比較. 中國普外基礎與臨床雜志, 2024, 31(6): 682-689. doi: 10.7507/1007-9424.202312043 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
結直腸癌已成為全世界第3常見的癌癥相關死亡原因[1]。隨著對癌癥發病機制的深入研究,針對結直腸癌的各種靶向治療方式取得了階段性進展[2],例如表皮生長因子受體(epidermal growth factor receptor,EGFR)抑制劑(西妥昔單抗和帕尼單抗)、血管內皮生長因子 (vascular endothelial growth factor,VEGF)抑制劑(貝伐珠單抗)、酪氨酸激酶抑制劑(瑞戈非尼)、 BRAF 抑制劑(恩考芬尼)等。靶向治療目前已成為轉移性結直腸癌治療的重要部分[3]。然而不幸的是,部分耐藥性基因的突變例如 KRAS、NRAS 和 BRAF,影響了患者癌癥的進展與預后[4]。
RAS/BRAF癌基因突變發生在50%~60%的結直腸癌患者中[5-6],與抗表皮生長因子受體(anti-EGFR)治療耐藥性和結直腸癌患者預后不良相關[7]。 RAS/BRAF基因及其等位基因突變頻率在不同類型腫瘤中差異很大[8],對于大多數腫瘤如結直腸癌、胰腺癌和肺癌,KRAS基因突變比較常見,但在黑色素瘤和甲狀腺癌中,NRAS基因突變更為常見[9]。在肺癌中,KRAS G12C位點是發生頻率最高的突變,而在結直腸癌中, RAS/BRAF位點突變發生頻率依次是:KRAS G12D、KRAS G12V、KRAS G13D、BRAFV600E和KRAS G12C[8,10]。因此,隨著第二代測序技術(next-generation sequencingtechnology,NGS)的普及,我們對 RAS/BRAF>突變的關注不應局限于基因水平,而是應細化到密碼子以及等位基因水平。
從分子功能上看,KRAS是一種鳥嘌呤核苷酸的膜結合調節蛋白(G蛋白),屬于鳥嘌呤三磷酸酶(guanosine triphosphatases,GTPases)家族,其作為二磷酸鹽(guanosine diphosphate,GDP)/三磷酸鹽(guanosine triphosphate,GTP)二元分子開關,控制從活化的膜受體到細胞內分子的重要信號轉導,活化的KRAS蛋白可激活多種信號通路,包括RAF-MEK-ERK信號通路、PI3K-AKT-mTOR信號通路和其他信號通路,從而參與細胞增殖、分化和遷移的調控[11-12]。
既往研究[13]表明,在結直腸癌中,KRAS密碼子12突變,而不是密碼子13突變,與預后較差有關。然而,其他研究[14]卻顯示了相反的結果,認為KRAS G13D突變的預后最差。還有一些異質性的回顧性研究[15-16]評估了KRAS G12D突變的預后價值,但結果并不一致。上述很多研究只關注 RAS/BRAF位點突變對Ⅳ期結直腸癌癌患者的影響,而對于Ⅰ ~Ⅲ期結直腸癌患者的研究比較少。為探究 RAS/BRAF不同位點突變在Ⅰ ~Ⅲ期結直腸癌患者中的價值,并為根治術后的治療和隨訪提供參考依據,本研究回顧性分析了415例結直腸癌患者的臨床病理資料,對Ⅰ ~Ⅲ期結直腸癌患者 RAS/BRAF基因不同密碼子突變的臨床病理特征和預后及其影響因素進行探討。
1 資料與方法
1.1 研究對象
回顧性收集 2017 年 3 月 1 日至 2022 年 10 月 1 日期間在浙江大學第一附屬醫院結直腸外科以及甘肅省人民醫院普外科行根治術的415例Ⅰ ~Ⅲ期結直腸癌且有NGS 數據的患者作為研究對象。 納入標準:① 術后病理學檢查證實為結直腸腺癌或黏液腺癌;② 已行結直腸癌根治術,術后病理分期為 Ⅰ ~Ⅲ期,微衛星穩定(microsatellite stability,MSS)型;③ 有NGS數據且臨床重要資料完整并規律隨訪。排除標準:① 確診有肝、肺、腹膜、遠處淋巴結等1處或多處轉移;② 有其他多原發惡性腫瘤病史或合并心、肺、肝、腎等臟器功能不全者;③ 術后免疫組化證實為錯配修復缺陷(mismatch repair-deficient,dMMR)或NGS檢測為高度微衛星不穩定(microsatellite instability-high,MSI-H)的患者;④ RAS/BRAF雙位點或者多位點突變。
1.2 臨床資料收集和隨訪
1.2.1 基因檢測資料收集
通過電子病歷系統收集納入研究的結直腸癌患者術后病理標本行NGS檢測的數據,包括41個基因或520個基因兩種NGS數據以及MSS/MSI狀態。檢測精度要求:① KRAS,2 號外顯子上的 12 號密碼子(G12C、G12S、G12R、G12V、G12D、G12A)和 13 號密碼子 G13D。② BRAF,15 號 外 顯 子 上 第 600 位 密 碼 子 V600E。③ NRAS,第 2、3和4號外顯子的突變情況。
1.2.2 隨訪
通過門診電子病歷系統、影像檢查系統以及電話隨訪的形式對納入研究患者進行生存隨訪,記錄局部復發、遠處轉移等信息。本研究隨訪從患者術后開始,直至患者復發或死亡結束。無病生存期(disease-free survival,DFS)為手術后第1天至腫瘤發生進展或死亡之間的時間。
1.3 統計學方法
使用SPSS統計軟件(版本26,IBM)進行統計分析。分類變量采用卡方檢驗或Fisher精確概率法進行比較;采用Kaplan-Meier方法繪制生存曲線,差異分析采用log-rank檢驗,當生存曲線出現交叉時使用Gehan-Breslow-Wilcoxon 檢驗代替log-rank檢驗;采用Cox模型進行多變量分析。 檢驗水準α=0.05。
2 結果
2.1 一般情況
本研究納入的415例Ⅰ ~Ⅲ期MSS型結直腸癌患者均獲隨訪,隨訪時間10~96個月,中位隨訪時間為23個月,發生復發轉移182例(43.9%),無復發轉移233例(56.1%);DFS 為3~96個月,中位DFS為24個月。415例中 RAS/BRAF未發生突變即野生型166例(40.0%);KRAS G12突變124例(29.9%);KRAS G13突變55例(13.3%); BRAFV600E突變23例(5.5%);其他RAS密碼子突變47例(11.3%),包括KRAS Q61突變13例(3.1%),KRAS A146突變9例(2.2%),NRAS突變20例(4.8%),其他KRAS突變5例(1.2%)。根據 RAS/BRAF有無突變及突變位點的不同將415例患者分為5組:RAS/BRAF野生型組(簡稱野生組,n=166)、KRAS G12密碼子突變組(簡稱KRAS G12突變組,n=124)、KRAS G13密碼子突變組(KRAS G13突變組,n=55)、BRAFV600E突變組(n=23)和其他RAS密碼子突變組(簡稱其他RAS突變組,n=47)。
2.2 RAS/BRAF不同突變位點患者的臨床病理特征分析結果
RAS/BRAF不同突變位點患者的臨床病理特征見表1。由表1可見:與野生組患者相比,只有BRAFV600E突變與黏液腺癌相關(P=0.033)。KRAS G12突變組、KRAS G13突變組和其他RAS突變組在年齡、性別、原發灶部位、T/N分期、分化程度、神經侵犯、脈管癌栓等方面的差異均無統計學意義(P>0.05)。
2.3 RAS/BRAF不同突變位點患者的腫瘤轉移部位分析結果
RAS/BRAF不同突變位點患者的腫瘤轉移部位結果見表2。由表2可見,與野生組比較,突變組患者在發生異時性肺轉移方面的差異有統計學意義(P=0.001)。突變組亞組與野生組比較結果顯示:KRAS G12突變患者在發生異時性肝轉移和肺轉移方面的差異均有統計學意義(P<0.05);KRAS G13突變組和其他RAS突變組在發生異時性肺轉移方面的差異均有統計學意義(P<0.05)。提示RAS各密碼子突變均可能增加肺轉移發生的概率,KRAS G12突變可能降低肝轉移發生的概率
2.4 RAS/BRAF不同突變位點患者的 DFS 分析結果
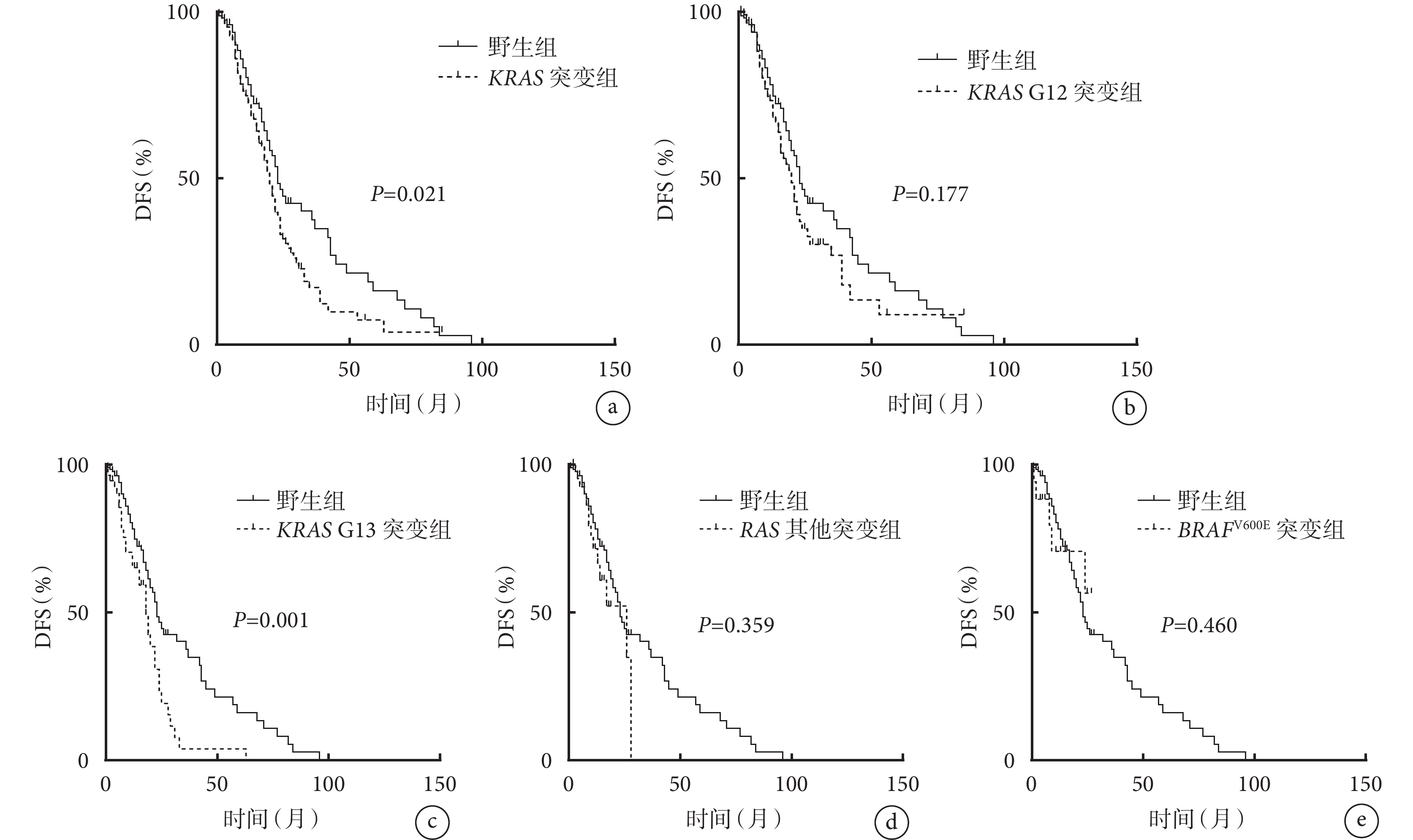
采用Kaplan-Meier方法繪制的RAS/BRAF不同突變位點Ⅰ ~Ⅲ期結直腸癌患者的生存曲線見圖1。 由圖1可見:與野生組比較,KRAS突變組和KRAS G13突變組患者的生存情況(DFS)較差,其差異有統計學意義(P=0.021,P=0.001);KRAS G12突變組、 BRAFV600E突變組及其他RAS突變組患者的生存情況(DFS)與野生組比較差異無統計學意義(P>0.05)。
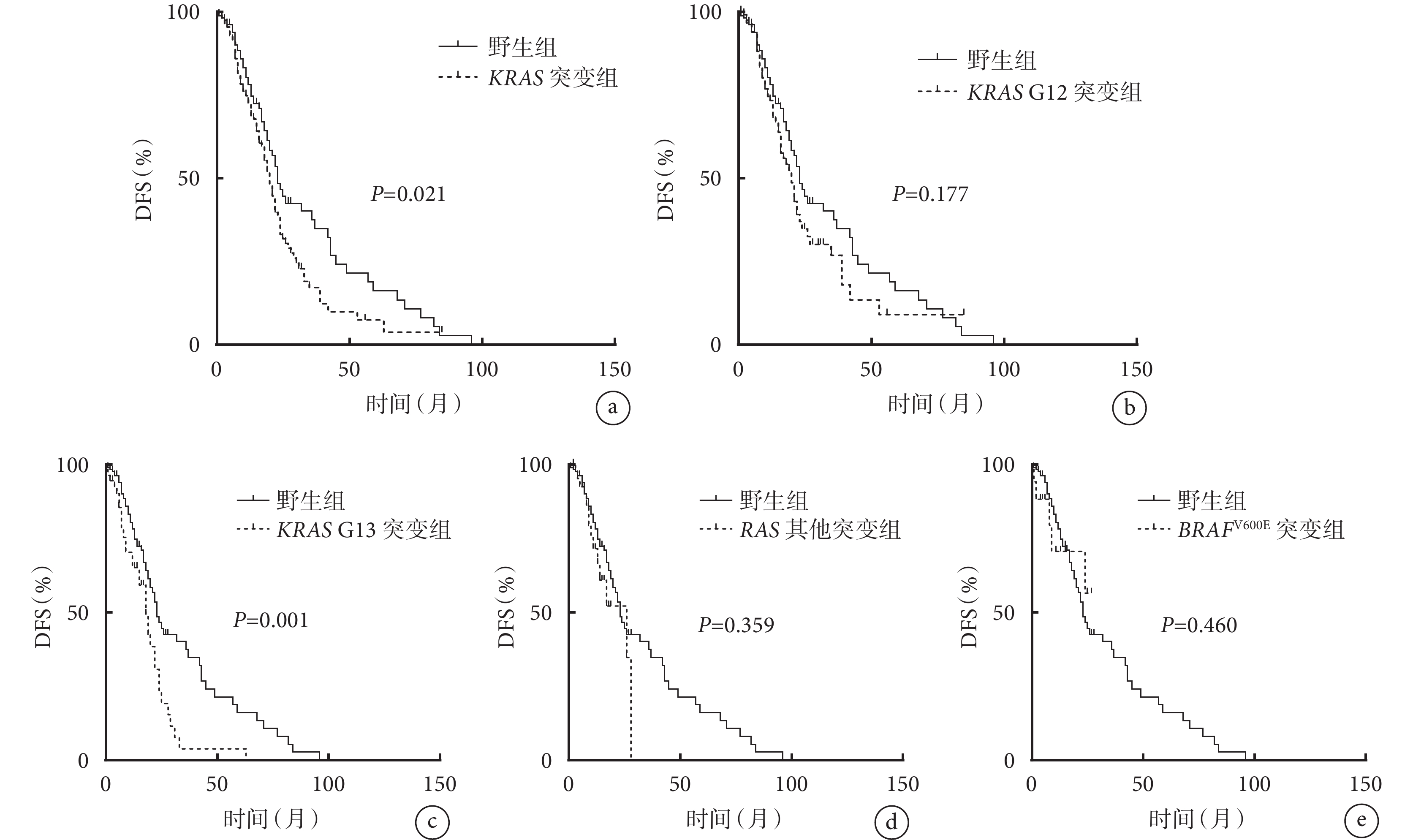 圖1
RAS/BRAF不同突變位點Ⅰ~Ⅲ期結直腸癌患者的DFS曲線,a~e分別是KRAS突變組、KRAS G12突變組、KRAS G13突變組、其他RAS突變組和BRAFV600E突變組與與野生組比較的生存曲線
圖1
RAS/BRAF不同突變位點Ⅰ~Ⅲ期結直腸癌患者的DFS曲線,a~e分別是KRAS突變組、KRAS G12突變組、KRAS G13突變組、其他RAS突變組和BRAFV600E突變組與與野生組比較的生存曲線
2.5 影響Ⅰ ~Ⅲ期結直腸癌患者DFS的單因素和多因素分析結果
影響Ⅰ ~Ⅲ期結直腸癌患者DFS的單因素 Cox 比例風險回歸分析結果顯示:淋巴結轉移、KRAS突變和KRAS G13突變是影響Ⅰ ~Ⅲ結直腸癌患者DFS 的因素(P<0.05); 進一步行多因素 Cox 比例風險回歸分析其結果顯示:只有KRAS G13突變是影響Ⅰ ~Ⅲ期結直腸癌患者DFS 的危險因素(P=0.003)。具體見表3。
3 討論
本研究回顧性分析了Ⅰ ~Ⅲ期MSS型結直腸癌患者中 RAS/BRAF密碼子突變與其臨床病理特征、腫瘤轉移部位以及臨床預后之間的關系。RAS/BRAF密碼子突變發生頻率與以往發表的研究結果[17]一致。 隨著免疫治療在MSI-H型結直腸癌晚期一線和直腸癌新輔助治療中的廣泛應用,結直腸癌的預后得到了較大的改善,同時MSI-H型結直腸癌屬于“熱腫瘤”,往往伴隨著較高的腫瘤突變負荷(tumor mutational burden,TMB)和免疫浸潤評分較高[18],MSI-H在Ⅰ ~Ⅲ期結直腸癌中的發生率高且預后較好[19]。為了避免MSI-H對于 RAS/BRAF突變的影響,本研究排除了所有的MSI-H患者,最終納入分析基于所有的MSS型結直腸癌。
利用 NGS檢測結直腸癌患者中 RAS/BRAF的突變情況,得到了美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)發布的《結直腸癌臨床實踐指南》的推薦,該指南認為所有轉移性結直腸癌患者均應進行 RAS和 BRAF 突變基因分型,并作為 NGS檢測組合的一部分進行檢測[20],以便在晚期一線治療中選擇抗EGFR的藥物,但是在Ⅰ ~Ⅲ期未轉移的結直腸癌患者中較少推薦。
在臨床病理特征分析中本研究發現,與野生組相比,BRAFV600E突變者中黏液腺癌占比較高,這意味著更差的腫瘤生物學行為,這和以往的研究結果[21-22]相符。但是在本研究進一步的生存預后分析中未觀察到BRAFV600E突變出現更差的DFS,可能原因是BRAFV600E突變者較少,后續需要更大樣本量的臨床研究來驗證。在比較不同 RAS/BRAF基因位點突變者之間的異時性腫瘤轉移部位時,本研究發現RAS/BRAF不同的突變位點發生腫瘤轉移的部位也不相同,RAS位點突變有可能增加發生肺轉移的概率,KRAS G12突變有可能降低發生肝轉移的概率,這和同時性結直腸癌轉移部位的研究結果一致[23],提示結直腸癌患者的復發模式部分取決于原發腫瘤的體細胞突變特征,需根據不同的 RAS/BRAF密碼子突變信息,在術后隨訪中合理地安排復查項目,特別是對于KRAS突變患者腫瘤切除術后,腹部和胸部影像學檢查同等重要。
以往不同位點 RAS/BRAF突變在影響結直腸癌患者預后方面的研究多存有爭議[24-25]。針對非轉移性結直腸癌患者的研究,KRAS不同位點突變和BRAFV600E突變對疾病復發的預后價值得出了相互矛盾的結果,有部分研究[26-27]認為KRAS突變和BRAF突變與野生組之間的預后沒有差異,但是這些研究未排除MSI狀態對于結直腸癌預后的影響。既往也有研究[28]表明,并非所有KRAS密碼子突變都與DFS較差相關,提示KRAS密碼子突變個體之間存在差異。還有研究[29]認為,KRAS G13突變是KRAS影響預后的唯一密碼子突變。本研究評估了KRAS G12突變、KRAS G13突變、其他RAS突變及BRAFV600E突變對Ⅰ ~Ⅲ期MSS型結直腸癌患者預后價值的影響。結果顯示,在MSS型Ⅰ ~Ⅲ期結直腸癌患者中,KRAS外顯子的G12和G13位點突變發生率分別為29.9%和13.3%。多因素分析綜合性別、年齡、腫瘤部位(左半結腸和右半結腸)、腫瘤TNM分期、腫瘤分化程度等因素的分析結果顯示,KRAS G13突變與結直腸癌根治術后復發顯著相關。本研究發現,在Ⅰ ~Ⅲ期結直腸癌中,雖然KRAS和BRAF突變本身并非術后復發的標志物,但深入分析RAS/BRAF突變密碼子層面時發現,KRAS G13密碼子突變相較于其他KRAS密碼子和BRAF V600E突變顯示出更差的DFS。因此,KRAS G13密碼子突變可作為Ⅰ ~Ⅲ期結直腸癌患者DFS的獨立預后因素,提示該亞群患者可能需接受更加充分的術后輔助化療和密切的復發監測。
目前針對 RAS/BRAF位點突變的靶向治療藥物越來越多地應用于臨床[30]。有研究[31]表明,BRAFV600E 突變的結直腸癌應用恩科拉非尼、貝尼替尼 和西妥昔單抗的三聯療法獲得了很好的療效。索拉非尼(Sotorasib,AMG510)作為首個進入臨床試驗的KRAS G12C抑制劑,在結直腸癌患者中也取得了很好的療效[32]。可見根據基因突變狀態對結直腸患者進行預后分層,并進行個性化治療越來越重要。
本研究的創新性不僅包括排除了MSI狀態對于Ⅰ ~Ⅲ期結直腸預后的影響,而且從KRAS突變的亞型中找到了一種影響非轉移性結直腸癌預后的標志物。因此建議對所有結直腸患者可進行 RAS/BRAF突變檢測,而且要精確到外顯子層面,并將其作為變量納入未來結直腸癌患者隨訪治療的分層中。未轉移的結直腸癌患者不僅術后要對MSI狀態進行盡早的檢測,也應盡早考慮對手術標本進行 RAS/BRAF突變狀態的檢測,以提供更多判斷根治性切除術后患者預后的信息,并在疾病復發轉移時迅速選取最合適的一線治療方案。從樣本檢測上講,新鮮的腫瘤樣本進行 RAS/BRAF突變狀態檢測也優于復發后進行石蠟樣本檢測的敏感度。本研究為Ⅰ ~Ⅲ期結直腸癌根治性切除術后患者提供了進行基因檢測的參考依據。然而,本研究也有一些局限性,包括本研究的回顧性設計,不可避免地入組患者會存在一些異質性;而且回顧性收集含有基因檢測數據的人群不能完全反映真實世界的患者群體。
綜上所述,結直腸癌不同 RAS/BRAF基因密碼子突變伴隨著不同的腫瘤臨床病理特征和器官轉移部位。 KRAS G13密碼子突變是Ⅰ ~Ⅲ期結直腸癌預后不良的獨立預后因素。建議臨床上對Ⅰ ~Ⅲ期結直腸癌患者應常規檢測 RAS/BRAF基因位點突變情況,以指導結直腸癌患者的隨訪管理,幫助臨床醫生在腫瘤復發后做出合理的臨床決策。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:張翔和蔣微琴負責論文選題、數據分析及論文撰寫;張翔、華漢巨、劉碩和廖天一負責文獻收集和資料與數據的提取;蔡輝對文章的設計、撰寫和修改給予指導。
倫理聲明:本研究通過了浙江大學醫學院附屬第一醫院臨床研究倫理委員會的審批,批文編號:(2021) IIT快審第(654)號;通過了甘肅省人民醫院醫學倫理委員會的審批,批文編號:2024-009。
結直腸癌已成為全世界第3常見的癌癥相關死亡原因[1]。隨著對癌癥發病機制的深入研究,針對結直腸癌的各種靶向治療方式取得了階段性進展[2],例如表皮生長因子受體(epidermal growth factor receptor,EGFR)抑制劑(西妥昔單抗和帕尼單抗)、血管內皮生長因子 (vascular endothelial growth factor,VEGF)抑制劑(貝伐珠單抗)、酪氨酸激酶抑制劑(瑞戈非尼)、 BRAF 抑制劑(恩考芬尼)等。靶向治療目前已成為轉移性結直腸癌治療的重要部分[3]。然而不幸的是,部分耐藥性基因的突變例如 KRAS、NRAS 和 BRAF,影響了患者癌癥的進展與預后[4]。
RAS/BRAF癌基因突變發生在50%~60%的結直腸癌患者中[5-6],與抗表皮生長因子受體(anti-EGFR)治療耐藥性和結直腸癌患者預后不良相關[7]。 RAS/BRAF基因及其等位基因突變頻率在不同類型腫瘤中差異很大[8],對于大多數腫瘤如結直腸癌、胰腺癌和肺癌,KRAS基因突變比較常見,但在黑色素瘤和甲狀腺癌中,NRAS基因突變更為常見[9]。在肺癌中,KRAS G12C位點是發生頻率最高的突變,而在結直腸癌中, RAS/BRAF位點突變發生頻率依次是:KRAS G12D、KRAS G12V、KRAS G13D、BRAFV600E和KRAS G12C[8,10]。因此,隨著第二代測序技術(next-generation sequencingtechnology,NGS)的普及,我們對 RAS/BRAF>突變的關注不應局限于基因水平,而是應細化到密碼子以及等位基因水平。
從分子功能上看,KRAS是一種鳥嘌呤核苷酸的膜結合調節蛋白(G蛋白),屬于鳥嘌呤三磷酸酶(guanosine triphosphatases,GTPases)家族,其作為二磷酸鹽(guanosine diphosphate,GDP)/三磷酸鹽(guanosine triphosphate,GTP)二元分子開關,控制從活化的膜受體到細胞內分子的重要信號轉導,活化的KRAS蛋白可激活多種信號通路,包括RAF-MEK-ERK信號通路、PI3K-AKT-mTOR信號通路和其他信號通路,從而參與細胞增殖、分化和遷移的調控[11-12]。
既往研究[13]表明,在結直腸癌中,KRAS密碼子12突變,而不是密碼子13突變,與預后較差有關。然而,其他研究[14]卻顯示了相反的結果,認為KRAS G13D突變的預后最差。還有一些異質性的回顧性研究[15-16]評估了KRAS G12D突變的預后價值,但結果并不一致。上述很多研究只關注 RAS/BRAF位點突變對Ⅳ期結直腸癌癌患者的影響,而對于Ⅰ ~Ⅲ期結直腸癌患者的研究比較少。為探究 RAS/BRAF不同位點突變在Ⅰ ~Ⅲ期結直腸癌患者中的價值,并為根治術后的治療和隨訪提供參考依據,本研究回顧性分析了415例結直腸癌患者的臨床病理資料,對Ⅰ ~Ⅲ期結直腸癌患者 RAS/BRAF基因不同密碼子突變的臨床病理特征和預后及其影響因素進行探討。
1 資料與方法
1.1 研究對象
回顧性收集 2017 年 3 月 1 日至 2022 年 10 月 1 日期間在浙江大學第一附屬醫院結直腸外科以及甘肅省人民醫院普外科行根治術的415例Ⅰ ~Ⅲ期結直腸癌且有NGS 數據的患者作為研究對象。 納入標準:① 術后病理學檢查證實為結直腸腺癌或黏液腺癌;② 已行結直腸癌根治術,術后病理分期為 Ⅰ ~Ⅲ期,微衛星穩定(microsatellite stability,MSS)型;③ 有NGS數據且臨床重要資料完整并規律隨訪。排除標準:① 確診有肝、肺、腹膜、遠處淋巴結等1處或多處轉移;② 有其他多原發惡性腫瘤病史或合并心、肺、肝、腎等臟器功能不全者;③ 術后免疫組化證實為錯配修復缺陷(mismatch repair-deficient,dMMR)或NGS檢測為高度微衛星不穩定(microsatellite instability-high,MSI-H)的患者;④ RAS/BRAF雙位點或者多位點突變。
1.2 臨床資料收集和隨訪
1.2.1 基因檢測資料收集
通過電子病歷系統收集納入研究的結直腸癌患者術后病理標本行NGS檢測的數據,包括41個基因或520個基因兩種NGS數據以及MSS/MSI狀態。檢測精度要求:① KRAS,2 號外顯子上的 12 號密碼子(G12C、G12S、G12R、G12V、G12D、G12A)和 13 號密碼子 G13D。② BRAF,15 號 外 顯 子 上 第 600 位 密 碼 子 V600E。③ NRAS,第 2、3和4號外顯子的突變情況。
1.2.2 隨訪
通過門診電子病歷系統、影像檢查系統以及電話隨訪的形式對納入研究患者進行生存隨訪,記錄局部復發、遠處轉移等信息。本研究隨訪從患者術后開始,直至患者復發或死亡結束。無病生存期(disease-free survival,DFS)為手術后第1天至腫瘤發生進展或死亡之間的時間。
1.3 統計學方法
使用SPSS統計軟件(版本26,IBM)進行統計分析。分類變量采用卡方檢驗或Fisher精確概率法進行比較;采用Kaplan-Meier方法繪制生存曲線,差異分析采用log-rank檢驗,當生存曲線出現交叉時使用Gehan-Breslow-Wilcoxon 檢驗代替log-rank檢驗;采用Cox模型進行多變量分析。 檢驗水準α=0.05。
2 結果
2.1 一般情況
本研究納入的415例Ⅰ ~Ⅲ期MSS型結直腸癌患者均獲隨訪,隨訪時間10~96個月,中位隨訪時間為23個月,發生復發轉移182例(43.9%),無復發轉移233例(56.1%);DFS 為3~96個月,中位DFS為24個月。415例中 RAS/BRAF未發生突變即野生型166例(40.0%);KRAS G12突變124例(29.9%);KRAS G13突變55例(13.3%); BRAFV600E突變23例(5.5%);其他RAS密碼子突變47例(11.3%),包括KRAS Q61突變13例(3.1%),KRAS A146突變9例(2.2%),NRAS突變20例(4.8%),其他KRAS突變5例(1.2%)。根據 RAS/BRAF有無突變及突變位點的不同將415例患者分為5組:RAS/BRAF野生型組(簡稱野生組,n=166)、KRAS G12密碼子突變組(簡稱KRAS G12突變組,n=124)、KRAS G13密碼子突變組(KRAS G13突變組,n=55)、BRAFV600E突變組(n=23)和其他RAS密碼子突變組(簡稱其他RAS突變組,n=47)。
2.2 RAS/BRAF不同突變位點患者的臨床病理特征分析結果
RAS/BRAF不同突變位點患者的臨床病理特征見表1。由表1可見:與野生組患者相比,只有BRAFV600E突變與黏液腺癌相關(P=0.033)。KRAS G12突變組、KRAS G13突變組和其他RAS突變組在年齡、性別、原發灶部位、T/N分期、分化程度、神經侵犯、脈管癌栓等方面的差異均無統計學意義(P>0.05)。
2.3 RAS/BRAF不同突變位點患者的腫瘤轉移部位分析結果
RAS/BRAF不同突變位點患者的腫瘤轉移部位結果見表2。由表2可見,與野生組比較,突變組患者在發生異時性肺轉移方面的差異有統計學意義(P=0.001)。突變組亞組與野生組比較結果顯示:KRAS G12突變患者在發生異時性肝轉移和肺轉移方面的差異均有統計學意義(P<0.05);KRAS G13突變組和其他RAS突變組在發生異時性肺轉移方面的差異均有統計學意義(P<0.05)。提示RAS各密碼子突變均可能增加肺轉移發生的概率,KRAS G12突變可能降低肝轉移發生的概率
2.4 RAS/BRAF不同突變位點患者的 DFS 分析結果
采用Kaplan-Meier方法繪制的RAS/BRAF不同突變位點Ⅰ ~Ⅲ期結直腸癌患者的生存曲線見圖1。 由圖1可見:與野生組比較,KRAS突變組和KRAS G13突變組患者的生存情況(DFS)較差,其差異有統計學意義(P=0.021,P=0.001);KRAS G12突變組、 BRAFV600E突變組及其他RAS突變組患者的生存情況(DFS)與野生組比較差異無統計學意義(P>0.05)。
 圖1
RAS/BRAF不同突變位點Ⅰ~Ⅲ期結直腸癌患者的DFS曲線,a~e分別是KRAS突變組、KRAS G12突變組、KRAS G13突變組、其他RAS突變組和BRAFV600E突變組與與野生組比較的生存曲線
圖1
RAS/BRAF不同突變位點Ⅰ~Ⅲ期結直腸癌患者的DFS曲線,a~e分別是KRAS突變組、KRAS G12突變組、KRAS G13突變組、其他RAS突變組和BRAFV600E突變組與與野生組比較的生存曲線
2.5 影響Ⅰ ~Ⅲ期結直腸癌患者DFS的單因素和多因素分析結果
影響Ⅰ ~Ⅲ期結直腸癌患者DFS的單因素 Cox 比例風險回歸分析結果顯示:淋巴結轉移、KRAS突變和KRAS G13突變是影響Ⅰ ~Ⅲ結直腸癌患者DFS 的因素(P<0.05); 進一步行多因素 Cox 比例風險回歸分析其結果顯示:只有KRAS G13突變是影響Ⅰ ~Ⅲ期結直腸癌患者DFS 的危險因素(P=0.003)。具體見表3。
3 討論
本研究回顧性分析了Ⅰ ~Ⅲ期MSS型結直腸癌患者中 RAS/BRAF密碼子突變與其臨床病理特征、腫瘤轉移部位以及臨床預后之間的關系。RAS/BRAF密碼子突變發生頻率與以往發表的研究結果[17]一致。 隨著免疫治療在MSI-H型結直腸癌晚期一線和直腸癌新輔助治療中的廣泛應用,結直腸癌的預后得到了較大的改善,同時MSI-H型結直腸癌屬于“熱腫瘤”,往往伴隨著較高的腫瘤突變負荷(tumor mutational burden,TMB)和免疫浸潤評分較高[18],MSI-H在Ⅰ ~Ⅲ期結直腸癌中的發生率高且預后較好[19]。為了避免MSI-H對于 RAS/BRAF突變的影響,本研究排除了所有的MSI-H患者,最終納入分析基于所有的MSS型結直腸癌。
利用 NGS檢測結直腸癌患者中 RAS/BRAF的突變情況,得到了美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)發布的《結直腸癌臨床實踐指南》的推薦,該指南認為所有轉移性結直腸癌患者均應進行 RAS和 BRAF 突變基因分型,并作為 NGS檢測組合的一部分進行檢測[20],以便在晚期一線治療中選擇抗EGFR的藥物,但是在Ⅰ ~Ⅲ期未轉移的結直腸癌患者中較少推薦。
在臨床病理特征分析中本研究發現,與野生組相比,BRAFV600E突變者中黏液腺癌占比較高,這意味著更差的腫瘤生物學行為,這和以往的研究結果[21-22]相符。但是在本研究進一步的生存預后分析中未觀察到BRAFV600E突變出現更差的DFS,可能原因是BRAFV600E突變者較少,后續需要更大樣本量的臨床研究來驗證。在比較不同 RAS/BRAF基因位點突變者之間的異時性腫瘤轉移部位時,本研究發現RAS/BRAF不同的突變位點發生腫瘤轉移的部位也不相同,RAS位點突變有可能增加發生肺轉移的概率,KRAS G12突變有可能降低發生肝轉移的概率,這和同時性結直腸癌轉移部位的研究結果一致[23],提示結直腸癌患者的復發模式部分取決于原發腫瘤的體細胞突變特征,需根據不同的 RAS/BRAF密碼子突變信息,在術后隨訪中合理地安排復查項目,特別是對于KRAS突變患者腫瘤切除術后,腹部和胸部影像學檢查同等重要。
以往不同位點 RAS/BRAF突變在影響結直腸癌患者預后方面的研究多存有爭議[24-25]。針對非轉移性結直腸癌患者的研究,KRAS不同位點突變和BRAFV600E突變對疾病復發的預后價值得出了相互矛盾的結果,有部分研究[26-27]認為KRAS突變和BRAF突變與野生組之間的預后沒有差異,但是這些研究未排除MSI狀態對于結直腸癌預后的影響。既往也有研究[28]表明,并非所有KRAS密碼子突變都與DFS較差相關,提示KRAS密碼子突變個體之間存在差異。還有研究[29]認為,KRAS G13突變是KRAS影響預后的唯一密碼子突變。本研究評估了KRAS G12突變、KRAS G13突變、其他RAS突變及BRAFV600E突變對Ⅰ ~Ⅲ期MSS型結直腸癌患者預后價值的影響。結果顯示,在MSS型Ⅰ ~Ⅲ期結直腸癌患者中,KRAS外顯子的G12和G13位點突變發生率分別為29.9%和13.3%。多因素分析綜合性別、年齡、腫瘤部位(左半結腸和右半結腸)、腫瘤TNM分期、腫瘤分化程度等因素的分析結果顯示,KRAS G13突變與結直腸癌根治術后復發顯著相關。本研究發現,在Ⅰ ~Ⅲ期結直腸癌中,雖然KRAS和BRAF突變本身并非術后復發的標志物,但深入分析RAS/BRAF突變密碼子層面時發現,KRAS G13密碼子突變相較于其他KRAS密碼子和BRAF V600E突變顯示出更差的DFS。因此,KRAS G13密碼子突變可作為Ⅰ ~Ⅲ期結直腸癌患者DFS的獨立預后因素,提示該亞群患者可能需接受更加充分的術后輔助化療和密切的復發監測。
目前針對 RAS/BRAF位點突變的靶向治療藥物越來越多地應用于臨床[30]。有研究[31]表明,BRAFV600E 突變的結直腸癌應用恩科拉非尼、貝尼替尼 和西妥昔單抗的三聯療法獲得了很好的療效。索拉非尼(Sotorasib,AMG510)作為首個進入臨床試驗的KRAS G12C抑制劑,在結直腸癌患者中也取得了很好的療效[32]。可見根據基因突變狀態對結直腸患者進行預后分層,并進行個性化治療越來越重要。
本研究的創新性不僅包括排除了MSI狀態對于Ⅰ ~Ⅲ期結直腸預后的影響,而且從KRAS突變的亞型中找到了一種影響非轉移性結直腸癌預后的標志物。因此建議對所有結直腸患者可進行 RAS/BRAF突變檢測,而且要精確到外顯子層面,并將其作為變量納入未來結直腸癌患者隨訪治療的分層中。未轉移的結直腸癌患者不僅術后要對MSI狀態進行盡早的檢測,也應盡早考慮對手術標本進行 RAS/BRAF突變狀態的檢測,以提供更多判斷根治性切除術后患者預后的信息,并在疾病復發轉移時迅速選取最合適的一線治療方案。從樣本檢測上講,新鮮的腫瘤樣本進行 RAS/BRAF突變狀態檢測也優于復發后進行石蠟樣本檢測的敏感度。本研究為Ⅰ ~Ⅲ期結直腸癌根治性切除術后患者提供了進行基因檢測的參考依據。然而,本研究也有一些局限性,包括本研究的回顧性設計,不可避免地入組患者會存在一些異質性;而且回顧性收集含有基因檢測數據的人群不能完全反映真實世界的患者群體。
綜上所述,結直腸癌不同 RAS/BRAF基因密碼子突變伴隨著不同的腫瘤臨床病理特征和器官轉移部位。 KRAS G13密碼子突變是Ⅰ ~Ⅲ期結直腸癌預后不良的獨立預后因素。建議臨床上對Ⅰ ~Ⅲ期結直腸癌患者應常規檢測 RAS/BRAF基因位點突變情況,以指導結直腸癌患者的隨訪管理,幫助臨床醫生在腫瘤復發后做出合理的臨床決策。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:張翔和蔣微琴負責論文選題、數據分析及論文撰寫;張翔、華漢巨、劉碩和廖天一負責文獻收集和資料與數據的提取;蔡輝對文章的設計、撰寫和修改給予指導。
倫理聲明:本研究通過了浙江大學醫學院附屬第一醫院臨床研究倫理委員會的審批,批文編號:(2021) IIT快審第(654)號;通過了甘肅省人民醫院醫學倫理委員會的審批,批文編號:2024-009。