引用本文: 陳濤, 楊濤, 劉禮鑫, 劉康, 夏術森. 腫瘤相關成纖維細胞來源的Wnt5a對胃癌細胞侵襲和遷移的影響及其與胃癌臨床病理特征的相關性. 中國普外基礎與臨床雜志, 2024, 31(7): 848-857. doi: 10.7507/1007-9424.202401075 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胃癌是世界范圍內最常見的惡性腫瘤之一,是癌癥相關死亡的第4大原因[1]。與大多數發達國家相比,中國胃癌的死亡率/發病率(0.845)和5年患病率(27.6/10萬人)較高,并突出了年輕人中早發胃癌發病率持續上升的特征[2]。近年來,隨著外科手術、放療、化療、免疫治療等的進展,胃癌患者的生存率顯著提高,但5年生存率仍低于50%[3],給人類健康及社會造成沉重負擔,其中最關鍵的原因就是胃癌的復發及轉移。因此,深入探討胃癌侵襲及轉移機制,對防治胃癌轉移及復發具有重要的臨床價值和社會效益。
腫瘤微環境(tumor microenvironment,TME)在胃腸道腫瘤的進展過程中起重要作用,也成為近年來腫瘤的研究熱點之一。TME是腫瘤發生發展的細胞外部環境,包括腫瘤細胞、細胞外基質、生長因子及其他信號因子[4]。腫瘤相關成纖維細胞(cancer-associated fibroblasts,CAFs)是TME的主要組成部分,可以通過分泌多種因子促進癌細胞的侵襲和遷移[5]。Wnt信號通路是胚胎發育的關鍵調控因子,可分為兩類即β-catenin依賴性通路和β-catenin非依賴性通路。β-catenin依賴性通路在腫瘤發展中已被廣泛研究,如CAFs分泌的Wnt2通過刺激上皮-間充質轉化促進食管癌的進展,CAFs分泌的Wnt3a參與了結直腸癌[6-7]的耐藥性等。然而,關于β-catenin非依賴性通路的研究較少,仍存在爭議。Wnt5a是一種經典的激活β-catenin非依賴性通路的配體[8],已被證實在CAFs中高表達,并且能促進結直腸癌細胞增殖和遷移[9]。但在胃癌中,CAFs與β-catenin非依賴性通路之間的相關性仍知之甚少。因此本研究探討了來自CAFs的Wnt5a對胃癌細胞侵襲及遷移的影響,及其與胃癌臨床病理特征間的關系。
1 資料與方法
1.1 數據庫資料
本研究在 GEO 數據庫(
1.2 臨床病例
本研究選取2020年1月至2021年6月期間在川北醫學院附屬醫院就診并經病理學檢查確診的胃癌患者手術切除的石蠟標本62例,包括腫瘤組織及其距癌灶邊緣5 cm 以遠的正常胃組織,分別作為胃癌組與正常組。同時選取同期行手術治療的5例胃癌患者的新鮮組織標本用于提取胃成纖維細胞。所有標本的獲取均征得了患者同意,并通過了川北醫學院附屬醫院倫理委員會的審批同意(批文編號:2022ER455-1)。所選取胃癌患者術前均未接受化療、放療等輔助治療。
1.3 方法
1.3.1 胃癌細胞、主要儀器及試劑
人胃癌細胞系MGC-803和MKN-28來自于中國科學院。RNA提取試劑和SYBR Green Ⅱ熒光染料購自南京諾唯贊生物科技有限公司;BCA蛋白定量試劑盒購自上海碧云天生物技術有限公司;免疫組化試劑盒和DAB試劑盒均購自北京中杉金橋生物技術有限公司;Gibco DMEM培養基(Dulbecco’s Modified Eagle Medium) 、2%胎牛血清、Lipofectamine 2000 試劑和增強化學發光試劑購自賽默飛世爾科技有限公司;RIPA裂解液(Radio Immunoprecipitation Assay Lysis Buffer)購自Biosharp生物科技有限公司;兔抗Wnt5a多克隆抗體購自武漢三鷹生物技術有限公司;PrimeScript RT-PCR試劑盒購自寶日生物技術(北京)有限公司;24孔Transwell板購自康寧(上海)管理有限公司。
1.3.2 臨床病例資料收集
通過查閱胃癌患者的術后病理報告及住院病歷資料,記錄患者年齡、性別、腫瘤分化程度、腫瘤T分期、淋巴結轉移情況、遠處轉移情況、神經侵犯情況和脈管侵犯情況信息。對照組則選自距離癌灶邊緣5 cm以上的正常胃組織。
1.3.3 細胞培養
取人胃癌細胞系MGC-803和MKN-28 各1×106個,用Gibco DMEM培養基與2%胎牛血清在37 ℃的5%CO2培養箱中培養,每隔2 d更換細胞培養液,并以1培養瓶傳3培養瓶的比例行傳代培養,取第4代細胞用于后續實驗。
1.3.4 胃成纖維細胞分離
采用組織塊法制備人胃組織中的CAFs和NGFs。將新鮮切除的胃癌患者的組織標本用眼科剪剪碎成1~2 mm見方的組織塊,加入含有10%胎牛血清和1%青霉素和鏈霉素的Gibco DMEM培養基, 置于37 ℃ 、含有5%CO2的組織培養箱中培養。CAFs來自胃癌組織,NGFs來自距離癌灶邊緣5 cm以上的正常胃組織。 提取出的成纖維細胞通過鏡下觀察、采用qRT-PCR檢測成纖維細胞標志物α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(vimentin,Vim)和成纖維細胞活化蛋白(fibroblast activating protein,FAP)在CAFs和NGFs中的mRNA表達、Western blot實驗檢測α-SMA蛋白的表達以及Transwell遷移和侵襲實驗檢測CAFs和NGFs的遷移和侵襲能力予以鑒定。提取成功的CAFs和NGFs傳代培養,取第3代和第10代之間的細胞用于后續實驗。本研究選取手術治療的5例胃癌患者的新鮮組織標本用于提取胃成纖維細胞,5例患者具體情況見表1。
1.3.5 胃癌患者手術組織標本中Wnt5a蛋白表達的檢測
采用免疫組織化學染色方法。 選取胃癌患者手術切除的石蠟標本,3 μm厚切片,烘片2 h后在二甲苯中脫蠟2次,再依次用100%、95%、75%和50%的乙醇水化,再進行抗原修復(中杉金橋檸檬酸鈉pH 6.0)。用3%H2O2滅活內源性過氧化物酶,再用3%牛血清白蛋白封閉非特異性結合位點。然后,樣品用兔抗Wnt5a多克隆抗體(稀釋1∶250)作為一抗,在4 ℃下孵育過夜。最后,切片用蘇木精染色。Wnt5a蛋白陽性表達為腫瘤間質中呈彌漫或散在分布的棕色或棕褐色顆粒,呈淡藍色顆粒則為陰性表達;然后通過ImageJ聯合IHC Profiler插件對樣本的染色情況進行自動化評分。
1.3.6 轉染RNA
將提取并鑒定后的CAFs分成4組即Wnt5a模擬物siWnt5a-1、siWnt5a-2和siWnt5a-3轉染組以及陰性對照組(siNC),每組2瓶,每瓶2×105個細胞,1瓶用于檢測轉染效率,1瓶用于后續實驗。根據試劑盒的說明,使用Lipofectamine 2000 試劑分別將siWnt5a-1、siWnt5a-2和siWnt5a-3轉染到各對應組細胞中。然后將轉染后的細胞及siNC組細胞培養48 h,采用蛋白免疫印跡(Western blot)實驗檢測各組CAFs中Wnt5a蛋白的表達情況,通過計算選取轉染效果最佳的Wnt5a模擬物進行下一步實驗 。
1.3.7 蛋白免疫印跡(Western blot)實驗
收集CAFs及NGFs(各1×106個),加入RIPA裂解液裂解。提取獲得總蛋白液后,使用BCA蛋白定量試劑盒檢測總蛋白液中蛋白濃度。檢測α-SMA和Wnt5a蛋白參照參考文獻 [10] 的方法。最后通過Image J軟件,以甘油醛3-磷酸脫氫酶(recombinant glyceraldehyde-3-phophate dehydrogenase,GAPDH)為內參計算CAFs及NGFs中α-SMA和Wnt5a蛋白相對表達水平。實驗獨立重復3次,取3次的均值作為最終結果。
1.3.8 qRT-PCR
用RNA提取試劑盒從CAFs和NGFs中提取總RNA,用PrimeScript RT-PCR試劑盒合成cDNA。qRT-PCR使用SYBR Green Ⅱ熒光染料,按照制試劑盒說明書進行,qPCR引物序列見表2。以GAPDH mRNA表達水平作內參,采用2?ΔΔCt法對樣品內的α-SMA、Vim、FAP和Wnt5a的mRNA表達進行相對定量。實驗獨立重復3次,取3次的均值作為最終結果。
1.3.9 Transwell 侵襲、遷移實驗
在Transwell遷移試驗中,分別將NGFs和CAFs接種到24孔Transwell板的下腔室, 24 h后,于下室加入600 μL含2%胎牛血清的DMEM,然后分別將MGC-803和MKN-28胃癌細胞(各4×104個)與200 μL無血清DMEM接種到Transwell小室中。培養48 h后,用PBS沖洗一遍小室后,用4%多聚甲醛固定穿過Transwell小室聚碳酸酯膜的胃癌細胞,并用0.1%結晶紫染色10 min,通過倒置顯微鏡觀察NGFs和CAFs對遷移或侵襲通過小室的胃癌細胞數量的影響,并使用ImageJ對Transwell結果進行分析。在Transwell侵襲實驗中,在將胃癌細胞接種到小室前需用基質膠覆蓋Transwell小室的聚碳酸酯膜2 h,余步驟同Transwell遷移試驗。 在重組Wnt5a的Transwell遷移實驗中,下室加入600 μL 含有2%胎牛血清的DMEM和不同濃度的重組Wnt5a蛋白(0、25、50、100和200 ng/mL),上室加入MGC-803(4×104個)和MKN-28(4×104個)胃癌細胞,36 h后固定附著在膜表面底表面的MGC-803胃癌細胞并染色,48 h后固定附著在膜底表面的MKN-28胃癌細胞并用0.1%結晶紫染色10 min,通過倒置顯微鏡觀察不同濃度重組Wnt5a蛋白對遷移通過小室的胃癌細胞數量的影響,并使用ImageJ對Transwell結果進行分析。在Transwell侵襲實驗中,因在Transwell遷移實驗中胃癌細胞在25 ng/mL與50 ng/mL時無明顯變化,故設置4個濃度梯度(0、50、100和200 ng/mL),在將胃癌細胞接種到小室前需用基質膠覆蓋Transwell小室的聚碳酸酯膜2 h,余步驟同重組Wnt5a的Transwell遷移實驗。實驗獨立重復3次,取3次的均值作為最終結果。
1.3.10 細胞共培養實驗
使用Transwell小室進行胃癌細胞與胃成纖維細胞非接觸式共培養實驗。將MGC-803和MKN-28胃癌細胞(各4×104個)培養于上室,將siNC組和各轉染siWnt5a組的CAFs(2×105個)培養于下室。共培養體系置于37 ℃含有5%CO2的培養箱中培養48 h后用0.1%結晶紫染色,觀察遷移或侵襲通過小室的胃癌細胞,并使用ImageJ對Transwell結果進行分析。實驗獨立重復3次,取3次的均值作為最終結果。
1.4 統計學方法
統計分析使用GraphPad Prism軟件9(GraphPad Software,Inc.,San Diego,CA,USA)完成。本實驗正態性檢驗通過Q-Q圖完成。計量數據符合正態分布者以均數±標準差( ±s)表示,采用兩獨立樣本的Student’s t檢驗或多組數據的單因素方差分析;不符合正態分布者用中位數表示,采用非參數檢驗。計數資料采用成組χ2檢驗、連續校正χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
±s)表示,采用兩獨立樣本的Student’s t檢驗或多組數據的單因素方差分析;不符合正態分布者用中位數表示,采用非參數檢驗。計數資料采用成組χ2檢驗、連續校正χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
2 結果
2.1 數據庫資料分析結果
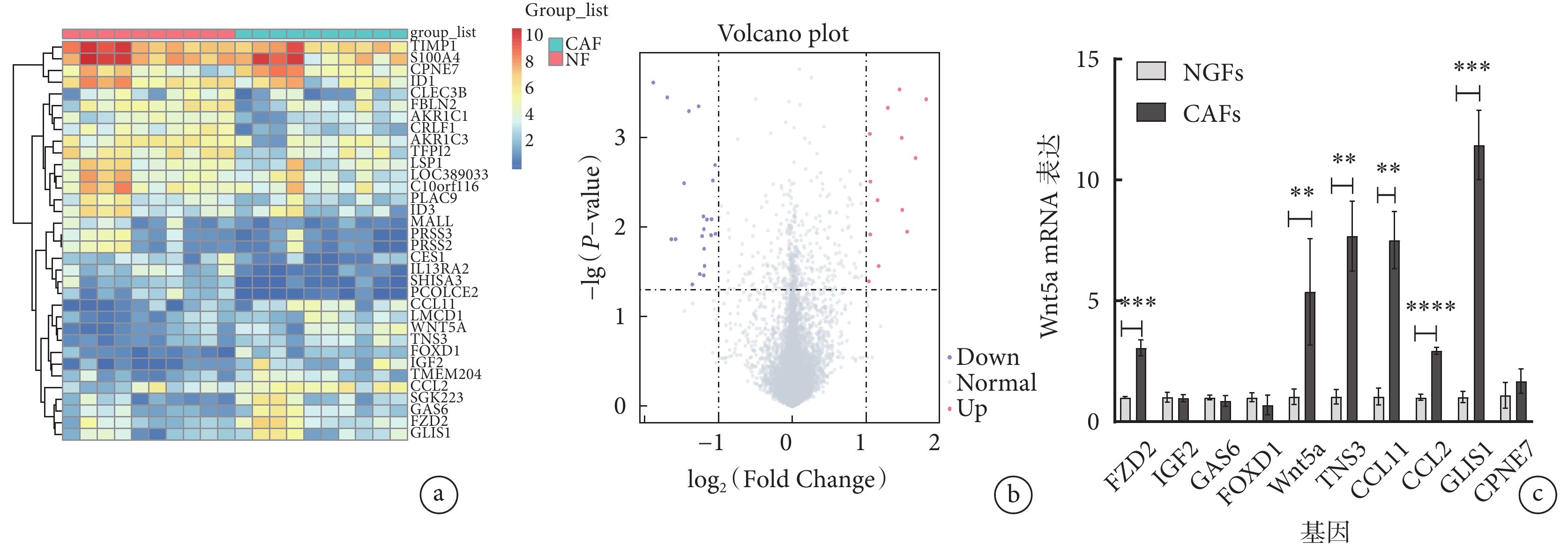
在GSE194261數據集中,共納入10對胃癌組織中提取的CAFs樣本及其對應的NGFs樣本,通過基因表達譜分析,發現CAFs與NGFs中有34個差異表達的基因,其中在CAFs中有13個表達上調基因和21個表達下調基因。 選取在CAFs中表達差異較大的10個上調基因,通過qRT-PCR檢測這10個差異表達基因在提取出的CAFs及其對應的NGFs中的表達情況,結果顯示Wnt5a基因在CAFs與NGFs中呈現差異表達,即Wnt5a基因在CAFs中表達上調,位于火山圖紅色區域,而在NGFs中呈低表達,其差異有統計學意義(P<0.05)。具體見圖1。
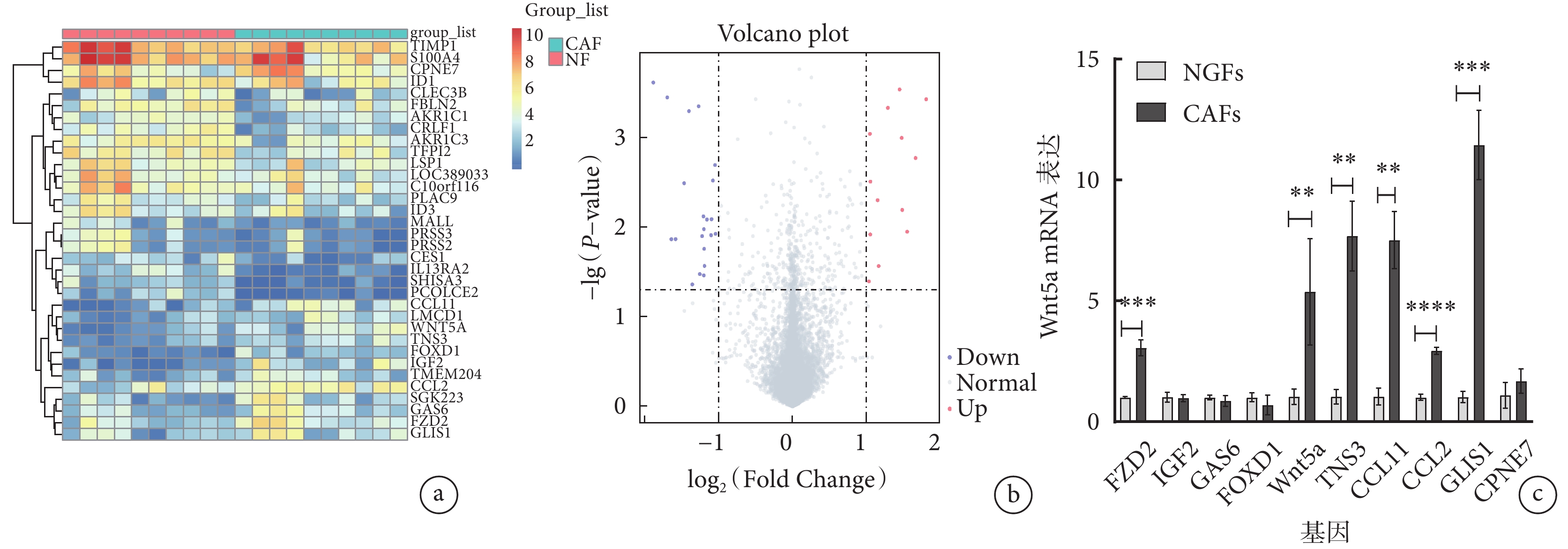 圖1
示微陣列數據分析結果
圖1
示微陣列數據分析結果
a和b:熱圖(a)及火山圖(b)顯示通過RNA測序鑒定出的差異表達基因,在CAFs 中有13個上調基因和21個下調基因;c: qRT-PCR檢測10個上調基因在CAFs與NGFs中的表達差異。**
2.2 Wnt5a蛋白在胃癌組織及正常胃組織中的表達結果
CAFs主要存在于胃癌組織間質中,Wnt5a蛋白陽性表達于胃癌細胞及胃癌組織間質中,呈彌漫或散在分布的棕色、棕褐色顆粒,在正常胃組織中較少呈現陽性表達。所以將Wnt5a蛋白在胃癌組織中表現出的染色強度高于正常胃組織的病例判定為Wnt5a蛋白高表達。結果顯示,82例胃癌患者的組織標本中Wnt5蛋白呈高表達者51例(62.2%),低表達者31例(37.8%)。
2.3 胃癌組織間質中Wnt5a蛋白的表達與胃癌臨床病理特征相關性分析結果
結果見表3。由表3可見,Wnt5a蛋白在胃癌組織中的表達與腫瘤T分期(χ2=5.035,P<0.05)相關,而與性別、年齡、腫瘤分化程度、淋巴轉移、遠處轉移、脈管侵犯和神經侵犯無相關性(P>0.05)。
2.4 人胃組織中CAFs和NGFs的提取及鑒定結果
從5例胃癌患者的胃癌組織標本及對應的距離癌灶邊緣5 cm以上的正常胃組織標本中提取并培養CAFs和NGFs,鏡下見兩種細胞均呈長梭形,無明顯形態學差異,系典型的成纖維細胞。 qRT-PCR檢測成纖維細胞標志物α-SMA、Vim和FAP在CAFs和NGFs中的mRNA表達結果顯示,在CAFs和NGFs中三者均有表達;同時發現α-SMA mRNA在CAFs中的相對表達水平高于NGFs(P<0.01);在CAFs和NGFs中Vim和FAP mRNA的相對表達水平差異無統計學意義(P>0.05)。 因此在Western blot實驗中主要檢測了α-SMA蛋白的表達量,結果顯示CAFs中α-SMA蛋白的相對表達量高于NGFs(P<0.01)。Transwell遷移和侵襲實驗結果顯示,CAFs遷移和侵襲能力強于NGFs(P<0.001)。 以上結果提示提示CAFs和NGFs分離提取成功,具體見補充材料圖1。
2.5 Wnt5a影響胃癌細胞遷移和侵襲的檢測結果
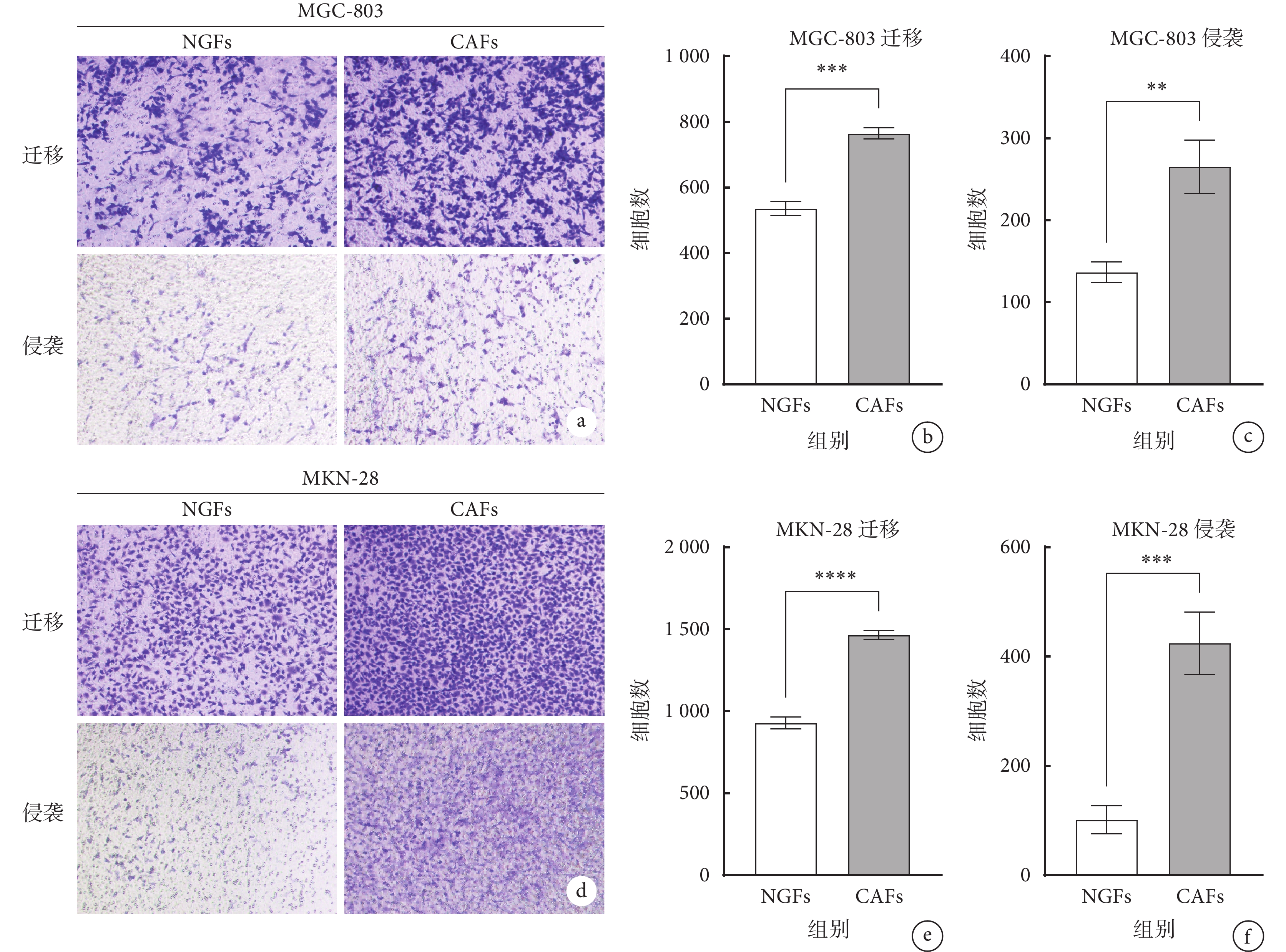
為了觀察CAFs和NGFs對胃癌細胞(MGC-803及MKN-28細胞系)的侵襲和遷移的影響,本研究首先將MGC-803和MKN-28細胞系分別與CAFs和NGFs共培養,結果顯示,相較于NGFs,與CAFs共培養的MGC-803和MKN-28細胞系的侵襲和遷移能力增強(P<0.05,圖2a~2f),提示CAFs對胃癌進展具有促進作用。為了進一步觀察Wnt5a是否通過CAFs與胃癌細胞相互作用來調節腫瘤進展,本研究采用RNA轉染技術進行了體外實驗。 Western blot實驗結果顯示,轉染siWnt5a 48 h后的CAFs中Wnt5a 蛋白相對表達水平明顯下調(圖3a和3b),提示轉染有效。 Transwell侵襲遷移實驗發現,轉染siWnt5a的CAFs的自身侵襲和遷移能力無明顯改變(圖3c~3e),排除了CAFs自身變化對胃癌細胞侵襲及遷移的影響。 相較于siNC組的CAFs,轉染siWnt5a組的CAFs減弱了胃癌MKN-28細胞系的侵襲和遷移能力(P<0.05),但對胃癌MGC-803細胞系的侵襲和遷移能力影響不明顯(P>0.05),見圖3f~3k。為了進一步觀察Wnt5a是如何調控胃癌進展的,本研究使用不同濃度的人重組Wnt5a蛋白進行了體外實驗。在Transwell遷移和侵襲試驗中,使用不同濃度人重組Wnt5a蛋白刺激胃癌細胞后,發現人重組Wnt5a蛋白濃度大于100 ng/mL時,胃癌MGC-803和MKN-28細胞系的侵襲及遷移能力顯著增強(P<0.05,圖4)
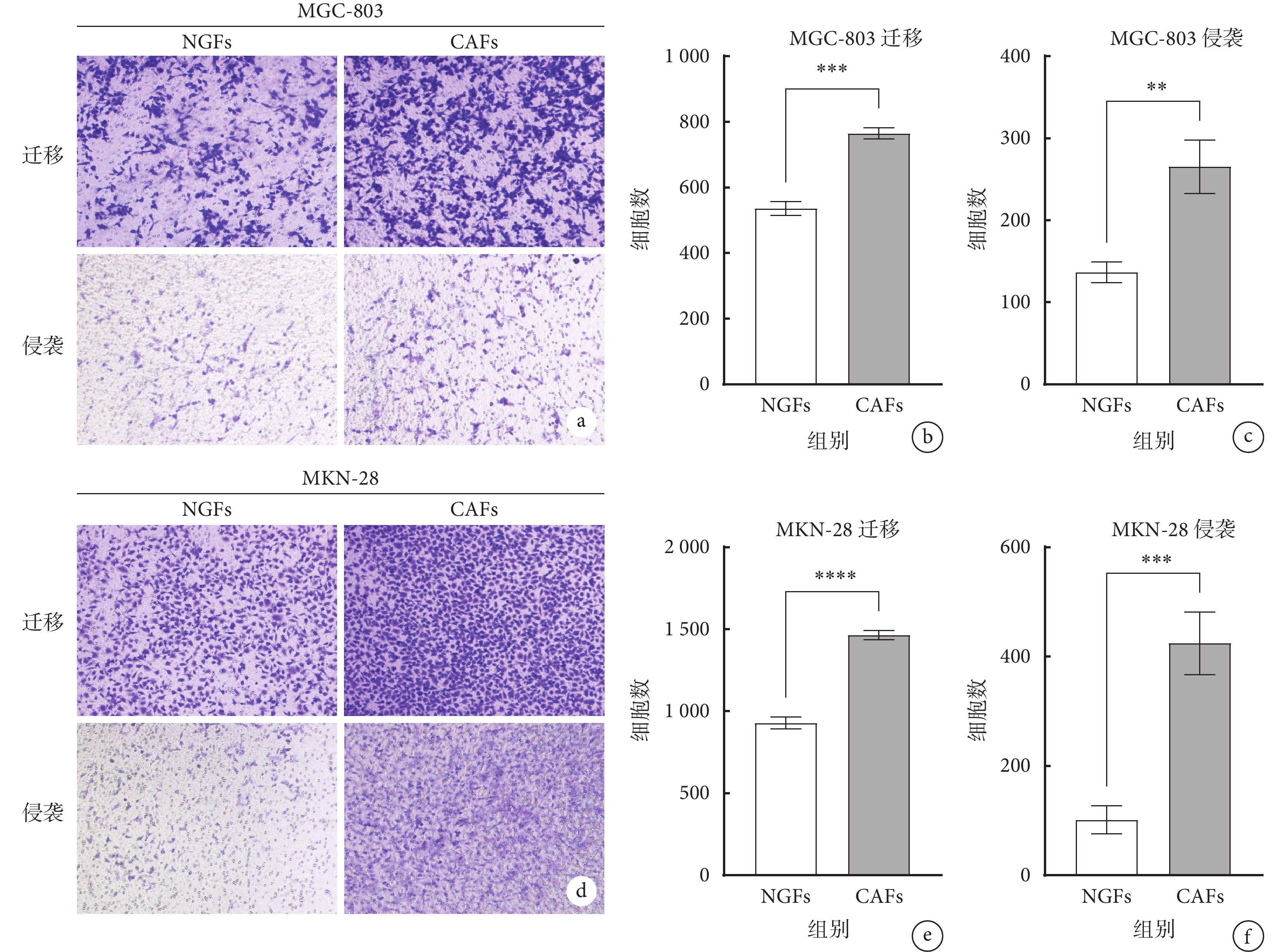 圖2
示CAFs和NGFs對胃癌細胞侵襲和遷移能力的影響
圖2
示CAFs和NGFs對胃癌細胞侵襲和遷移能力的影響
a~c: MGC-803細胞系遷移和侵襲情況,鏡下結果(a,結晶紫染色 ×200),遷移(b)和侵襲(c)細胞計數;d~f:MKN-28細胞系遷移和侵襲情況,鏡下結果(d,結晶紫染色 ×200),遷移(e)和侵襲(f)細胞計數。**
 圖3
示Wnt5a對CAFs及胃癌MGC-803及MKN-28細胞系遷移和侵襲能力的影響
圖3
示Wnt5a對CAFs及胃癌MGC-803及MKN-28細胞系遷移和侵襲能力的影響
a和b:各組CAFs中Wnt5a蛋白表達的電泳圖(a)及相對表達水平(b);c~e:轉染siWnt5a后CAFs的自身侵襲和遷移情況,鏡下結果(c,結晶紫染色 ×200),遷移(d)和侵襲(e)細胞計數; f~h:轉染siWnt5a的CAFs對胃癌MGC-803及MKN-28細胞系遷移的影響,鏡下結果(f,結晶紫染色 ×200),MGC-803細胞系(g),MKN-28細胞系(h);i~k:轉染siWnt5a的CAFs對胃癌MGC-803及MKN-28細胞系侵襲的影響,鏡下結果(i,結晶紫染色 ×200),MGC-803細胞系(j),MKN-28細胞系(k)。ns:差異無統計學意義;*
 圖4
示不同濃度人重組Wnt5a蛋白作用MGC-803和MKN-28細胞系后的遷移和侵襲能力檢測結果
圖4
示不同濃度人重組Wnt5a蛋白作用MGC-803和MKN-28細胞系后的遷移和侵襲能力檢測結果
a和b:遷移(a)和侵襲(b)鏡下結果(結晶紫染色 ×200);c和d:MGC-803細胞系(c)和MKN-28細胞系(d)遷移細胞計數;e和f:MGC-803細胞系(e)和MKN-28細胞系(f)侵襲細胞計數。 *
3 討論
腫瘤進展是由腫瘤細胞自身(基因突變)和胞外環境(TME)共同決定的[10]。基因突變是腫瘤發生的必要條件,但卻不足以推動其發展。隨著對實體腫瘤研究的深入,TME進入了研究人員的視線。TME中細胞通過自分泌和旁分泌信號因子促進血管重塑和細胞外基質重構,為腫瘤細胞定植提供有利環境[11-12]。而CAFs是TME的重要組成部分,密切參與腫瘤的侵襲、轉移等進展。Shelton等[13]研究發現,黑色素瘤中的miRNA失調,可通過誘導上皮-間充質轉化(epithelial-mesenchymal transition,EMT)改變基質中CAFs的分泌表型。Wu等[14]研究發現,CAFs通過分泌IL-6激活胃癌細胞中Janus激酶2/信號轉導子和轉錄激活子通路,增強胃癌細胞的遷移和EMT。 Shi等[15]研究發現,源于CAFs的miRNA-34可以有效抑制胃癌細胞的增殖、侵襲。 Kramer等[16]研究發現,來源于結直腸癌的CAFs的Wnt2可影響腫瘤的侵襲和轉移。Hirashima等[17]的研究發現,Wnt5a在CAFs中高表達,與結直腸癌細胞增殖和轉移密切相關。TME中CAFs分泌的Wnt蛋白是近年來研究惡性腫瘤侵襲、轉移的熱點之一。Wnt蛋白是一個分泌型糖蛋白家族,主要通過β-catenin依賴通路和β-catenin非依賴性通路調節各種生物的生長發育過程,在發育、體內平衡和疾病發生發展中起著重要作用,且已被證明參與了腫瘤的進展[18-20]。Wnt5a是Wnt家族的一個成員,位于人類染色體3p14.2-p21.1上,是一種經典的激活β-catenin非依賴途徑的配體,可通過調節幾種非經典信號通路,促進腫瘤細胞遷移和侵襲[21-23]。例如,Ma等[24]通過體內體外實驗研究發現,膀胱癌中干擾素依賴型SLC14A1+ CAFs能通過調節Wnt5a促進癌干細胞的生成。 Li等[25]研究發現,α增強子結合蛋白1(αEnhancer binding protein 1,ATBF1)通過Wnt5a及其信號通路參與調節乳腺癌的發生。Zhou等[26]發現,在卵巢癌中,Wnt5a蛋白表達顯著上調,并與不良預后相關。 然而國內雜志尚未見報道CAFs來源的Wnt5a對胃癌進展的影響。
為了驗證CAFs分泌的Wnt5a與胃癌進展是否相關,本研究首先對GEO數據庫GSE194261數據集進行分析,結果顯示Wnt5a在CAFs中呈高表達;進一步檢測臨床胃癌患者手術切除的組織標本中Wnt5a蛋白的表達情況,結果顯示在胃癌組織中Wnt5a蛋白呈陽性表達,其染色強度高于正常胃組織且Wnt5a蛋白在胃癌組織中的表達與腫瘤T分期相關(P<0.05),而與性別、年齡、腫瘤分化程度、淋巴結轉移、遠處轉移、脈管侵犯和神經侵犯無相關性(P>0.05)。 該結果提示:CAFs分泌的Wnt5a可能在胃癌細胞侵襲和遷移轉移中扮演重要角色。本研究還選取5例胃癌患者獲取新鮮手術切除組織標本中提取CAFs和NGFs進行了原代培養及鑒定,在顯微鏡下發現兩者都成長梭形,無明顯形態學差異;通過qRT- PCR檢測CAFs和NGFs中成纖維細胞標志物α-SMA mRNA的表達,結果顯示, 在CAFs中α-SMA mRNA相對表達水平高于NGFs(P<0.01),而Vim和FAP mRNA的相對表達水平在兩種細胞中的差異無統計學意義(P>0.05),這與相關文獻報道結果[27]一致。通過Western blot和Transwell侵襲及遷移實驗進一步鑒定提取出的CAFS與NGFs,結果發現在CAFs中α-SMA蛋白相對表達量高于NGFs(P<0.001),并且CAFs的侵襲和遷移能力強于NGFs。上述結果均表明本研究成功分離提取出了CAFs和NGFs。本研究進一步在體外觀察了CAFs對胃癌MGC-803和MKN-28細胞系遷移和侵襲能力的影響。結果顯示:相較于與NGFs共培養的胃癌MGC-803和MKN-28細胞系,與CAFs共培養的胃癌MGC-803和MKN-28細胞系的遷移和侵襲能力能力顯著增強(P<0.05),提示CAFs對胃癌的進展具有促進作用。進一步使用轉染了siWnt5a的CAFs進行體外實驗,結果顯示:相較于siNC組的CAFs,轉染siWnt5a的CAFs減弱了胃癌MKN-28細胞系的侵襲和遷移能力(P<0.05),但對胃癌MGC-803細胞系的侵襲和遷移能力影響不明顯(P>0.05)。我們推測其可能原因為CAFs自身分泌Wnt5a的量較少,且MGC-803生長較快,減弱了siWnt5a的影響。 因此本研究在體外Transwell 遷移和侵襲實驗中,進一步觀察了不同濃度人重組Wnt5a蛋白對胃癌MGC-803和MKN-28細胞系遷移和侵襲能力的影響,結果顯示:人重組Wnt5a蛋白濃度大于100 ng/mL時胃癌細胞的遷移和侵襲能力顯著增強(P<0.05)。上述結果提示,CAFs可能以旁分泌的方式分泌Wnt5a蛋白,以此促進胃癌細胞的侵襲和遷移。
綜上所述,本研究發現來源于胃癌組織的CAFs中Wnt5a呈高表達且與胃癌的浸潤深度相關;來自CAFs的Wnt5a可促進胃癌細胞的遷移及侵襲,有可能作為抗癌治療的靶點,但本實驗未行動物實驗,實驗結果具有一定的局限性,且具體的作用機制尚未深入研究,因此需待后續進一步研究相關機制。
重要聲明
利益沖突聲明:本文全體作者閱讀并了解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有影響本文研究的相互競爭的經濟利益或個人關系。
作者貢獻聲明:陳濤負責課題設計和論文撰寫,楊濤負責實驗操作,劉禮鑫負責實驗操作和文獻綜述,劉康負責實驗設計,夏術森負責論文寫作指導。
倫理聲明:本研究已通過川北醫學院附屬醫院醫學倫理委員會的審核批準,批文編號: 2022ER455-1。
胃癌是世界范圍內最常見的惡性腫瘤之一,是癌癥相關死亡的第4大原因[1]。與大多數發達國家相比,中國胃癌的死亡率/發病率(0.845)和5年患病率(27.6/10萬人)較高,并突出了年輕人中早發胃癌發病率持續上升的特征[2]。近年來,隨著外科手術、放療、化療、免疫治療等的進展,胃癌患者的生存率顯著提高,但5年生存率仍低于50%[3],給人類健康及社會造成沉重負擔,其中最關鍵的原因就是胃癌的復發及轉移。因此,深入探討胃癌侵襲及轉移機制,對防治胃癌轉移及復發具有重要的臨床價值和社會效益。
腫瘤微環境(tumor microenvironment,TME)在胃腸道腫瘤的進展過程中起重要作用,也成為近年來腫瘤的研究熱點之一。TME是腫瘤發生發展的細胞外部環境,包括腫瘤細胞、細胞外基質、生長因子及其他信號因子[4]。腫瘤相關成纖維細胞(cancer-associated fibroblasts,CAFs)是TME的主要組成部分,可以通過分泌多種因子促進癌細胞的侵襲和遷移[5]。Wnt信號通路是胚胎發育的關鍵調控因子,可分為兩類即β-catenin依賴性通路和β-catenin非依賴性通路。β-catenin依賴性通路在腫瘤發展中已被廣泛研究,如CAFs分泌的Wnt2通過刺激上皮-間充質轉化促進食管癌的進展,CAFs分泌的Wnt3a參與了結直腸癌[6-7]的耐藥性等。然而,關于β-catenin非依賴性通路的研究較少,仍存在爭議。Wnt5a是一種經典的激活β-catenin非依賴性通路的配體[8],已被證實在CAFs中高表達,并且能促進結直腸癌細胞增殖和遷移[9]。但在胃癌中,CAFs與β-catenin非依賴性通路之間的相關性仍知之甚少。因此本研究探討了來自CAFs的Wnt5a對胃癌細胞侵襲及遷移的影響,及其與胃癌臨床病理特征間的關系。
1 資料與方法
1.1 數據庫資料
本研究在 GEO 數據庫(
1.2 臨床病例
本研究選取2020年1月至2021年6月期間在川北醫學院附屬醫院就診并經病理學檢查確診的胃癌患者手術切除的石蠟標本62例,包括腫瘤組織及其距癌灶邊緣5 cm 以遠的正常胃組織,分別作為胃癌組與正常組。同時選取同期行手術治療的5例胃癌患者的新鮮組織標本用于提取胃成纖維細胞。所有標本的獲取均征得了患者同意,并通過了川北醫學院附屬醫院倫理委員會的審批同意(批文編號:2022ER455-1)。所選取胃癌患者術前均未接受化療、放療等輔助治療。
1.3 方法
1.3.1 胃癌細胞、主要儀器及試劑
人胃癌細胞系MGC-803和MKN-28來自于中國科學院。RNA提取試劑和SYBR Green Ⅱ熒光染料購自南京諾唯贊生物科技有限公司;BCA蛋白定量試劑盒購自上海碧云天生物技術有限公司;免疫組化試劑盒和DAB試劑盒均購自北京中杉金橋生物技術有限公司;Gibco DMEM培養基(Dulbecco’s Modified Eagle Medium) 、2%胎牛血清、Lipofectamine 2000 試劑和增強化學發光試劑購自賽默飛世爾科技有限公司;RIPA裂解液(Radio Immunoprecipitation Assay Lysis Buffer)購自Biosharp生物科技有限公司;兔抗Wnt5a多克隆抗體購自武漢三鷹生物技術有限公司;PrimeScript RT-PCR試劑盒購自寶日生物技術(北京)有限公司;24孔Transwell板購自康寧(上海)管理有限公司。
1.3.2 臨床病例資料收集
通過查閱胃癌患者的術后病理報告及住院病歷資料,記錄患者年齡、性別、腫瘤分化程度、腫瘤T分期、淋巴結轉移情況、遠處轉移情況、神經侵犯情況和脈管侵犯情況信息。對照組則選自距離癌灶邊緣5 cm以上的正常胃組織。
1.3.3 細胞培養
取人胃癌細胞系MGC-803和MKN-28 各1×106個,用Gibco DMEM培養基與2%胎牛血清在37 ℃的5%CO2培養箱中培養,每隔2 d更換細胞培養液,并以1培養瓶傳3培養瓶的比例行傳代培養,取第4代細胞用于后續實驗。
1.3.4 胃成纖維細胞分離
采用組織塊法制備人胃組織中的CAFs和NGFs。將新鮮切除的胃癌患者的組織標本用眼科剪剪碎成1~2 mm見方的組織塊,加入含有10%胎牛血清和1%青霉素和鏈霉素的Gibco DMEM培養基, 置于37 ℃ 、含有5%CO2的組織培養箱中培養。CAFs來自胃癌組織,NGFs來自距離癌灶邊緣5 cm以上的正常胃組織。 提取出的成纖維細胞通過鏡下觀察、采用qRT-PCR檢測成纖維細胞標志物α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(vimentin,Vim)和成纖維細胞活化蛋白(fibroblast activating protein,FAP)在CAFs和NGFs中的mRNA表達、Western blot實驗檢測α-SMA蛋白的表達以及Transwell遷移和侵襲實驗檢測CAFs和NGFs的遷移和侵襲能力予以鑒定。提取成功的CAFs和NGFs傳代培養,取第3代和第10代之間的細胞用于后續實驗。本研究選取手術治療的5例胃癌患者的新鮮組織標本用于提取胃成纖維細胞,5例患者具體情況見表1。
1.3.5 胃癌患者手術組織標本中Wnt5a蛋白表達的檢測
采用免疫組織化學染色方法。 選取胃癌患者手術切除的石蠟標本,3 μm厚切片,烘片2 h后在二甲苯中脫蠟2次,再依次用100%、95%、75%和50%的乙醇水化,再進行抗原修復(中杉金橋檸檬酸鈉pH 6.0)。用3%H2O2滅活內源性過氧化物酶,再用3%牛血清白蛋白封閉非特異性結合位點。然后,樣品用兔抗Wnt5a多克隆抗體(稀釋1∶250)作為一抗,在4 ℃下孵育過夜。最后,切片用蘇木精染色。Wnt5a蛋白陽性表達為腫瘤間質中呈彌漫或散在分布的棕色或棕褐色顆粒,呈淡藍色顆粒則為陰性表達;然后通過ImageJ聯合IHC Profiler插件對樣本的染色情況進行自動化評分。
1.3.6 轉染RNA
將提取并鑒定后的CAFs分成4組即Wnt5a模擬物siWnt5a-1、siWnt5a-2和siWnt5a-3轉染組以及陰性對照組(siNC),每組2瓶,每瓶2×105個細胞,1瓶用于檢測轉染效率,1瓶用于后續實驗。根據試劑盒的說明,使用Lipofectamine 2000 試劑分別將siWnt5a-1、siWnt5a-2和siWnt5a-3轉染到各對應組細胞中。然后將轉染后的細胞及siNC組細胞培養48 h,采用蛋白免疫印跡(Western blot)實驗檢測各組CAFs中Wnt5a蛋白的表達情況,通過計算選取轉染效果最佳的Wnt5a模擬物進行下一步實驗 。
1.3.7 蛋白免疫印跡(Western blot)實驗
收集CAFs及NGFs(各1×106個),加入RIPA裂解液裂解。提取獲得總蛋白液后,使用BCA蛋白定量試劑盒檢測總蛋白液中蛋白濃度。檢測α-SMA和Wnt5a蛋白參照參考文獻 [10] 的方法。最后通過Image J軟件,以甘油醛3-磷酸脫氫酶(recombinant glyceraldehyde-3-phophate dehydrogenase,GAPDH)為內參計算CAFs及NGFs中α-SMA和Wnt5a蛋白相對表達水平。實驗獨立重復3次,取3次的均值作為最終結果。
1.3.8 qRT-PCR
用RNA提取試劑盒從CAFs和NGFs中提取總RNA,用PrimeScript RT-PCR試劑盒合成cDNA。qRT-PCR使用SYBR Green Ⅱ熒光染料,按照制試劑盒說明書進行,qPCR引物序列見表2。以GAPDH mRNA表達水平作內參,采用2?ΔΔCt法對樣品內的α-SMA、Vim、FAP和Wnt5a的mRNA表達進行相對定量。實驗獨立重復3次,取3次的均值作為最終結果。
1.3.9 Transwell 侵襲、遷移實驗
在Transwell遷移試驗中,分別將NGFs和CAFs接種到24孔Transwell板的下腔室, 24 h后,于下室加入600 μL含2%胎牛血清的DMEM,然后分別將MGC-803和MKN-28胃癌細胞(各4×104個)與200 μL無血清DMEM接種到Transwell小室中。培養48 h后,用PBS沖洗一遍小室后,用4%多聚甲醛固定穿過Transwell小室聚碳酸酯膜的胃癌細胞,并用0.1%結晶紫染色10 min,通過倒置顯微鏡觀察NGFs和CAFs對遷移或侵襲通過小室的胃癌細胞數量的影響,并使用ImageJ對Transwell結果進行分析。在Transwell侵襲實驗中,在將胃癌細胞接種到小室前需用基質膠覆蓋Transwell小室的聚碳酸酯膜2 h,余步驟同Transwell遷移試驗。 在重組Wnt5a的Transwell遷移實驗中,下室加入600 μL 含有2%胎牛血清的DMEM和不同濃度的重組Wnt5a蛋白(0、25、50、100和200 ng/mL),上室加入MGC-803(4×104個)和MKN-28(4×104個)胃癌細胞,36 h后固定附著在膜表面底表面的MGC-803胃癌細胞并染色,48 h后固定附著在膜底表面的MKN-28胃癌細胞并用0.1%結晶紫染色10 min,通過倒置顯微鏡觀察不同濃度重組Wnt5a蛋白對遷移通過小室的胃癌細胞數量的影響,并使用ImageJ對Transwell結果進行分析。在Transwell侵襲實驗中,因在Transwell遷移實驗中胃癌細胞在25 ng/mL與50 ng/mL時無明顯變化,故設置4個濃度梯度(0、50、100和200 ng/mL),在將胃癌細胞接種到小室前需用基質膠覆蓋Transwell小室的聚碳酸酯膜2 h,余步驟同重組Wnt5a的Transwell遷移實驗。實驗獨立重復3次,取3次的均值作為最終結果。
1.3.10 細胞共培養實驗
使用Transwell小室進行胃癌細胞與胃成纖維細胞非接觸式共培養實驗。將MGC-803和MKN-28胃癌細胞(各4×104個)培養于上室,將siNC組和各轉染siWnt5a組的CAFs(2×105個)培養于下室。共培養體系置于37 ℃含有5%CO2的培養箱中培養48 h后用0.1%結晶紫染色,觀察遷移或侵襲通過小室的胃癌細胞,并使用ImageJ對Transwell結果進行分析。實驗獨立重復3次,取3次的均值作為最終結果。
1.4 統計學方法
統計分析使用GraphPad Prism軟件9(GraphPad Software,Inc.,San Diego,CA,USA)完成。本實驗正態性檢驗通過Q-Q圖完成。計量數據符合正態分布者以均數±標準差( ±s)表示,采用兩獨立樣本的Student’s t檢驗或多組數據的單因素方差分析;不符合正態分布者用中位數表示,采用非參數檢驗。計數資料采用成組χ2檢驗、連續校正χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
±s)表示,采用兩獨立樣本的Student’s t檢驗或多組數據的單因素方差分析;不符合正態分布者用中位數表示,采用非參數檢驗。計數資料采用成組χ2檢驗、連續校正χ2檢驗或Fisher確切概率法。檢驗水準α=0.05。
2 結果
2.1 數據庫資料分析結果
在GSE194261數據集中,共納入10對胃癌組織中提取的CAFs樣本及其對應的NGFs樣本,通過基因表達譜分析,發現CAFs與NGFs中有34個差異表達的基因,其中在CAFs中有13個表達上調基因和21個表達下調基因。 選取在CAFs中表達差異較大的10個上調基因,通過qRT-PCR檢測這10個差異表達基因在提取出的CAFs及其對應的NGFs中的表達情況,結果顯示Wnt5a基因在CAFs與NGFs中呈現差異表達,即Wnt5a基因在CAFs中表達上調,位于火山圖紅色區域,而在NGFs中呈低表達,其差異有統計學意義(P<0.05)。具體見圖1。
 圖1
示微陣列數據分析結果
圖1
示微陣列數據分析結果
a和b:熱圖(a)及火山圖(b)顯示通過RNA測序鑒定出的差異表達基因,在CAFs 中有13個上調基因和21個下調基因;c: qRT-PCR檢測10個上調基因在CAFs與NGFs中的表達差異。**
2.2 Wnt5a蛋白在胃癌組織及正常胃組織中的表達結果
CAFs主要存在于胃癌組織間質中,Wnt5a蛋白陽性表達于胃癌細胞及胃癌組織間質中,呈彌漫或散在分布的棕色、棕褐色顆粒,在正常胃組織中較少呈現陽性表達。所以將Wnt5a蛋白在胃癌組織中表現出的染色強度高于正常胃組織的病例判定為Wnt5a蛋白高表達。結果顯示,82例胃癌患者的組織標本中Wnt5蛋白呈高表達者51例(62.2%),低表達者31例(37.8%)。
2.3 胃癌組織間質中Wnt5a蛋白的表達與胃癌臨床病理特征相關性分析結果
結果見表3。由表3可見,Wnt5a蛋白在胃癌組織中的表達與腫瘤T分期(χ2=5.035,P<0.05)相關,而與性別、年齡、腫瘤分化程度、淋巴轉移、遠處轉移、脈管侵犯和神經侵犯無相關性(P>0.05)。
2.4 人胃組織中CAFs和NGFs的提取及鑒定結果
從5例胃癌患者的胃癌組織標本及對應的距離癌灶邊緣5 cm以上的正常胃組織標本中提取并培養CAFs和NGFs,鏡下見兩種細胞均呈長梭形,無明顯形態學差異,系典型的成纖維細胞。 qRT-PCR檢測成纖維細胞標志物α-SMA、Vim和FAP在CAFs和NGFs中的mRNA表達結果顯示,在CAFs和NGFs中三者均有表達;同時發現α-SMA mRNA在CAFs中的相對表達水平高于NGFs(P<0.01);在CAFs和NGFs中Vim和FAP mRNA的相對表達水平差異無統計學意義(P>0.05)。 因此在Western blot實驗中主要檢測了α-SMA蛋白的表達量,結果顯示CAFs中α-SMA蛋白的相對表達量高于NGFs(P<0.01)。Transwell遷移和侵襲實驗結果顯示,CAFs遷移和侵襲能力強于NGFs(P<0.001)。 以上結果提示提示CAFs和NGFs分離提取成功,具體見補充材料圖1。
2.5 Wnt5a影響胃癌細胞遷移和侵襲的檢測結果
為了觀察CAFs和NGFs對胃癌細胞(MGC-803及MKN-28細胞系)的侵襲和遷移的影響,本研究首先將MGC-803和MKN-28細胞系分別與CAFs和NGFs共培養,結果顯示,相較于NGFs,與CAFs共培養的MGC-803和MKN-28細胞系的侵襲和遷移能力增強(P<0.05,圖2a~2f),提示CAFs對胃癌進展具有促進作用。為了進一步觀察Wnt5a是否通過CAFs與胃癌細胞相互作用來調節腫瘤進展,本研究采用RNA轉染技術進行了體外實驗。 Western blot實驗結果顯示,轉染siWnt5a 48 h后的CAFs中Wnt5a 蛋白相對表達水平明顯下調(圖3a和3b),提示轉染有效。 Transwell侵襲遷移實驗發現,轉染siWnt5a的CAFs的自身侵襲和遷移能力無明顯改變(圖3c~3e),排除了CAFs自身變化對胃癌細胞侵襲及遷移的影響。 相較于siNC組的CAFs,轉染siWnt5a組的CAFs減弱了胃癌MKN-28細胞系的侵襲和遷移能力(P<0.05),但對胃癌MGC-803細胞系的侵襲和遷移能力影響不明顯(P>0.05),見圖3f~3k。為了進一步觀察Wnt5a是如何調控胃癌進展的,本研究使用不同濃度的人重組Wnt5a蛋白進行了體外實驗。在Transwell遷移和侵襲試驗中,使用不同濃度人重組Wnt5a蛋白刺激胃癌細胞后,發現人重組Wnt5a蛋白濃度大于100 ng/mL時,胃癌MGC-803和MKN-28細胞系的侵襲及遷移能力顯著增強(P<0.05,圖4)
 圖2
示CAFs和NGFs對胃癌細胞侵襲和遷移能力的影響
圖2
示CAFs和NGFs對胃癌細胞侵襲和遷移能力的影響
a~c: MGC-803細胞系遷移和侵襲情況,鏡下結果(a,結晶紫染色 ×200),遷移(b)和侵襲(c)細胞計數;d~f:MKN-28細胞系遷移和侵襲情況,鏡下結果(d,結晶紫染色 ×200),遷移(e)和侵襲(f)細胞計數。**
 圖3
示Wnt5a對CAFs及胃癌MGC-803及MKN-28細胞系遷移和侵襲能力的影響
圖3
示Wnt5a對CAFs及胃癌MGC-803及MKN-28細胞系遷移和侵襲能力的影響
a和b:各組CAFs中Wnt5a蛋白表達的電泳圖(a)及相對表達水平(b);c~e:轉染siWnt5a后CAFs的自身侵襲和遷移情況,鏡下結果(c,結晶紫染色 ×200),遷移(d)和侵襲(e)細胞計數; f~h:轉染siWnt5a的CAFs對胃癌MGC-803及MKN-28細胞系遷移的影響,鏡下結果(f,結晶紫染色 ×200),MGC-803細胞系(g),MKN-28細胞系(h);i~k:轉染siWnt5a的CAFs對胃癌MGC-803及MKN-28細胞系侵襲的影響,鏡下結果(i,結晶紫染色 ×200),MGC-803細胞系(j),MKN-28細胞系(k)。ns:差異無統計學意義;*
 圖4
示不同濃度人重組Wnt5a蛋白作用MGC-803和MKN-28細胞系后的遷移和侵襲能力檢測結果
圖4
示不同濃度人重組Wnt5a蛋白作用MGC-803和MKN-28細胞系后的遷移和侵襲能力檢測結果
a和b:遷移(a)和侵襲(b)鏡下結果(結晶紫染色 ×200);c和d:MGC-803細胞系(c)和MKN-28細胞系(d)遷移細胞計數;e和f:MGC-803細胞系(e)和MKN-28細胞系(f)侵襲細胞計數。 *
3 討論
腫瘤進展是由腫瘤細胞自身(基因突變)和胞外環境(TME)共同決定的[10]。基因突變是腫瘤發生的必要條件,但卻不足以推動其發展。隨著對實體腫瘤研究的深入,TME進入了研究人員的視線。TME中細胞通過自分泌和旁分泌信號因子促進血管重塑和細胞外基質重構,為腫瘤細胞定植提供有利環境[11-12]。而CAFs是TME的重要組成部分,密切參與腫瘤的侵襲、轉移等進展。Shelton等[13]研究發現,黑色素瘤中的miRNA失調,可通過誘導上皮-間充質轉化(epithelial-mesenchymal transition,EMT)改變基質中CAFs的分泌表型。Wu等[14]研究發現,CAFs通過分泌IL-6激活胃癌細胞中Janus激酶2/信號轉導子和轉錄激活子通路,增強胃癌細胞的遷移和EMT。 Shi等[15]研究發現,源于CAFs的miRNA-34可以有效抑制胃癌細胞的增殖、侵襲。 Kramer等[16]研究發現,來源于結直腸癌的CAFs的Wnt2可影響腫瘤的侵襲和轉移。Hirashima等[17]的研究發現,Wnt5a在CAFs中高表達,與結直腸癌細胞增殖和轉移密切相關。TME中CAFs分泌的Wnt蛋白是近年來研究惡性腫瘤侵襲、轉移的熱點之一。Wnt蛋白是一個分泌型糖蛋白家族,主要通過β-catenin依賴通路和β-catenin非依賴性通路調節各種生物的生長發育過程,在發育、體內平衡和疾病發生發展中起著重要作用,且已被證明參與了腫瘤的進展[18-20]。Wnt5a是Wnt家族的一個成員,位于人類染色體3p14.2-p21.1上,是一種經典的激活β-catenin非依賴途徑的配體,可通過調節幾種非經典信號通路,促進腫瘤細胞遷移和侵襲[21-23]。例如,Ma等[24]通過體內體外實驗研究發現,膀胱癌中干擾素依賴型SLC14A1+ CAFs能通過調節Wnt5a促進癌干細胞的生成。 Li等[25]研究發現,α增強子結合蛋白1(αEnhancer binding protein 1,ATBF1)通過Wnt5a及其信號通路參與調節乳腺癌的發生。Zhou等[26]發現,在卵巢癌中,Wnt5a蛋白表達顯著上調,并與不良預后相關。 然而國內雜志尚未見報道CAFs來源的Wnt5a對胃癌進展的影響。
為了驗證CAFs分泌的Wnt5a與胃癌進展是否相關,本研究首先對GEO數據庫GSE194261數據集進行分析,結果顯示Wnt5a在CAFs中呈高表達;進一步檢測臨床胃癌患者手術切除的組織標本中Wnt5a蛋白的表達情況,結果顯示在胃癌組織中Wnt5a蛋白呈陽性表達,其染色強度高于正常胃組織且Wnt5a蛋白在胃癌組織中的表達與腫瘤T分期相關(P<0.05),而與性別、年齡、腫瘤分化程度、淋巴結轉移、遠處轉移、脈管侵犯和神經侵犯無相關性(P>0.05)。 該結果提示:CAFs分泌的Wnt5a可能在胃癌細胞侵襲和遷移轉移中扮演重要角色。本研究還選取5例胃癌患者獲取新鮮手術切除組織標本中提取CAFs和NGFs進行了原代培養及鑒定,在顯微鏡下發現兩者都成長梭形,無明顯形態學差異;通過qRT- PCR檢測CAFs和NGFs中成纖維細胞標志物α-SMA mRNA的表達,結果顯示, 在CAFs中α-SMA mRNA相對表達水平高于NGFs(P<0.01),而Vim和FAP mRNA的相對表達水平在兩種細胞中的差異無統計學意義(P>0.05),這與相關文獻報道結果[27]一致。通過Western blot和Transwell侵襲及遷移實驗進一步鑒定提取出的CAFS與NGFs,結果發現在CAFs中α-SMA蛋白相對表達量高于NGFs(P<0.001),并且CAFs的侵襲和遷移能力強于NGFs。上述結果均表明本研究成功分離提取出了CAFs和NGFs。本研究進一步在體外觀察了CAFs對胃癌MGC-803和MKN-28細胞系遷移和侵襲能力的影響。結果顯示:相較于與NGFs共培養的胃癌MGC-803和MKN-28細胞系,與CAFs共培養的胃癌MGC-803和MKN-28細胞系的遷移和侵襲能力能力顯著增強(P<0.05),提示CAFs對胃癌的進展具有促進作用。進一步使用轉染了siWnt5a的CAFs進行體外實驗,結果顯示:相較于siNC組的CAFs,轉染siWnt5a的CAFs減弱了胃癌MKN-28細胞系的侵襲和遷移能力(P<0.05),但對胃癌MGC-803細胞系的侵襲和遷移能力影響不明顯(P>0.05)。我們推測其可能原因為CAFs自身分泌Wnt5a的量較少,且MGC-803生長較快,減弱了siWnt5a的影響。 因此本研究在體外Transwell 遷移和侵襲實驗中,進一步觀察了不同濃度人重組Wnt5a蛋白對胃癌MGC-803和MKN-28細胞系遷移和侵襲能力的影響,結果顯示:人重組Wnt5a蛋白濃度大于100 ng/mL時胃癌細胞的遷移和侵襲能力顯著增強(P<0.05)。上述結果提示,CAFs可能以旁分泌的方式分泌Wnt5a蛋白,以此促進胃癌細胞的侵襲和遷移。
綜上所述,本研究發現來源于胃癌組織的CAFs中Wnt5a呈高表達且與胃癌的浸潤深度相關;來自CAFs的Wnt5a可促進胃癌細胞的遷移及侵襲,有可能作為抗癌治療的靶點,但本實驗未行動物實驗,實驗結果具有一定的局限性,且具體的作用機制尚未深入研究,因此需待后續進一步研究相關機制。
重要聲明
利益沖突聲明:本文全體作者閱讀并了解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有影響本文研究的相互競爭的經濟利益或個人關系。
作者貢獻聲明:陳濤負責課題設計和論文撰寫,楊濤負責實驗操作,劉禮鑫負責實驗操作和文獻綜述,劉康負責實驗設計,夏術森負責論文寫作指導。
倫理聲明:本研究已通過川北醫學院附屬醫院醫學倫理委員會的審核批準,批文編號: 2022ER455-1。