引用本文: 駱偉, 蘇圓輝, 于澄, 柴長鵬, 唐歡, 苗龍, 王正峰, 徐浩. 懸浮培養構建源于胃癌患者的類器官及鑒定. 中國普外基礎與臨床雜志, 2024, 31(8): 924-927. doi: 10.7507/1007-9424.202401079 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
雖然胃癌發病率自20世紀中期以來開始下降[1],但它仍是造成全球癌癥相關死亡的第三大原因[2-3]。由于胃癌患者的臨床癥狀出現較晚,大部分患者就診時已處于疾病中晚期,所以胃癌患者的治療效果仍欠佳[4]。因此,對胃癌的發病機制和防治方法進行深入研究意義重大。近年來研究較熱的類器官是通過原代組織的成體干細胞、胚胎干細胞或誘導多能干細胞在富含層粘連蛋白的細胞外基質中自組裝而形成[5-6],它與原代組織在生理結構和功能上相似,是腫瘤研究的良好模型。早在2018年始已有4個團隊[7-10]報道了胃類器官的建立及應用研究,在這些研究中均是利用基質膠Matrigel進行類器官的培養,其實驗費用相對較高。本研究采用懸浮法建立胃癌類器官,探討其可行性,為胃癌類器官的培養探索一種實用且較經濟的實驗方法。
1 資料與方法
1.1 組織來源
本研究僅是初步驗證懸浮培養構建胃癌類器官的可行性,因此僅選取2021年7–12月期間于蘭州大學第一醫院行手術治療的3例胃癌患者的組織標本。患者術前均未接受腫瘤放化療,經術后組織病理學檢查確認。本研究獲得了蘭州大學第一醫院醫學倫理委員會的批準通過(批文編號:LDYYLL2022-292),并且也獲得了3例患者授權委托人的知情同意。
1.2 方法
1.2.1 主要試劑和儀器
12孔培養板購自無錫耐思生物科技有限公司(貨號:71201B01)。DMEM/F12培養基、胎牛血清及Trypsin(胰蛋白酶)均購自以色列BI公司。細胞培養添加劑Glutamax(貨號:35050061)和組織分散酶Dispase Ⅱ(貨號:17105041)均購自美國Invitrogen公司;膠原酶Ⅱ(貨號:17101015)購自美國Gibco公司;無血清快速細胞凍存液M5 HiPure(貨號:MF699-01)購自北京聚合美生物科技有限公司;抗體低分子量細胞角蛋白(low molecular weight cytokeratin,CK-LMW,貨號:MAB-0051)、p53(貨號:MAB-0674)及Ki67(貨號: MAB-0672)均購自福州邁新生物技術開發有限公司。倒置顯微鏡購自日本Nikon公司,石蠟切片機購自德國Laica公司。
1.2.2 類器官的建立
嚴格采取無菌操作原則。根據腫瘤大小切取適量新鮮腫瘤組織后置于運輸液中保存,在最短時間內轉運至實驗室。將癌組織標本放入60 mm培養皿內,用磷酸鹽緩沖液沖洗,去除血塊、壞死組織及纖維成分。然后用無菌手術刀片切取清理干凈的部分組織,凍存于–80 ℃冰箱中,備后續實驗用;將剩余腫瘤組織盡可能切碎,然后加入至10 mL混合消化酶的離心管中消化,于37 ℃下搖床中消化20~60 min。期間不時觀察組織塊消化情況,待組織體積減少至一半時,將消化液用100目細胞篩過濾后收集至15 mL離心管內,400×g離心4 min,棄去上清液。重復2次。收集細胞沉淀,用類器官完全培養液重懸腫瘤細胞。然后按每孔200個小細胞團將細胞懸液直接接種至12孔超低吸附板進行類器官的培養。類器官培養基成分為DMEM/F12培養基中加入1×Glutamax、10%胎牛血清和1%青-鏈霉素。
1.2.3 類器官的傳代、凍存和復蘇
當胃癌類器官直徑達到100 μm時進行傳代。將類器官懸液移至15 mL離心管中,加入適量磷酸鹽緩沖液,用槍頭輕柔吹打混勻,400×g離心4 min,棄去上清液。向沉淀中加入約2 mL的0.25%胰蛋白酶,輕柔吹打,分散團塊,37 ℃環境消化,同時保持鏡下觀察,直至類器官酶解至3~5個細胞的小細胞團狀態。終止消化時向細胞團塊加入5 mL完全培養基,槍頭輕柔吹打混勻,400×g離心4 min,棄去上清液。按照1∶2~1∶3的比例進行傳代。一部分類器官加入凍存液凍存,于液氮中長期保存。復蘇時凍存管用37 ℃水浴,溶解后快速轉移至15 mL離心管,添加5 mL類器官培養基,用移液管輕輕吹打3次,400×g離心4 min,棄去上清液,再次重懸后接種至超低吸附板進行類器官培養。
1.2.4 類器官包埋切片
通過離心將懸浮培養的類器官分離出來,浸入4%多聚甲醛溶液中固定24 h,然后用梯度(50%、70%、80%、95%、100%×2,每梯度30 min)乙醇脫水;放入二甲苯乙醇對半溶液中30 min,再轉入純二甲苯中浸漬2次,每次1 h。類器官進行瓊脂包埋,切成厚度約為5 μm的薄片,粘于玻片并干燥,備用。
1.2.5 蘇木精-伊紅(hematoxylin-eosin,HE)染色
將固定原發胃癌組織與類器官石蠟切片的載玻片分別放在染色架上,二甲苯清除樣品中的石蠟,每次2 min,重復3次;將載玻片置入100%乙醇中處理2 min,重復3次;接著轉移到95%的乙醇中處理2 min;轉移到70%乙醇中處理2 min;在室溫下,用自來水沖洗載玻片至少2 min。將樣品在蘇木精溶液中染色3 min。將載玻片置于室溫下的自來水沖洗至少5 min。將樣品在伊紅溶液中染色2 min。將載玻片用95%的乙醇浸泡約20次。轉移到95%的乙醇中處理2 min。轉移到100%的乙醇中處理2 min,重復2次。將載玻片置入二甲苯中處理2 min,重復3次。在載玻片的組織上滴1滴中性樹膠,然后蓋玻片封片;最后顯微鏡鏡檢,進行圖像采集分析。
1.2.6 免疫組織化學染色
將原發胃癌組織與類器官分別在4%多聚甲醛溶液中室溫下固定30 min,石蠟包埋。切片后按照標準流程對CK-LMW、p53和Ki67進行免疫組織化學染色。最后用BX51熒光顯微鏡(Olympus)進行圖像采集分析。
2 結果
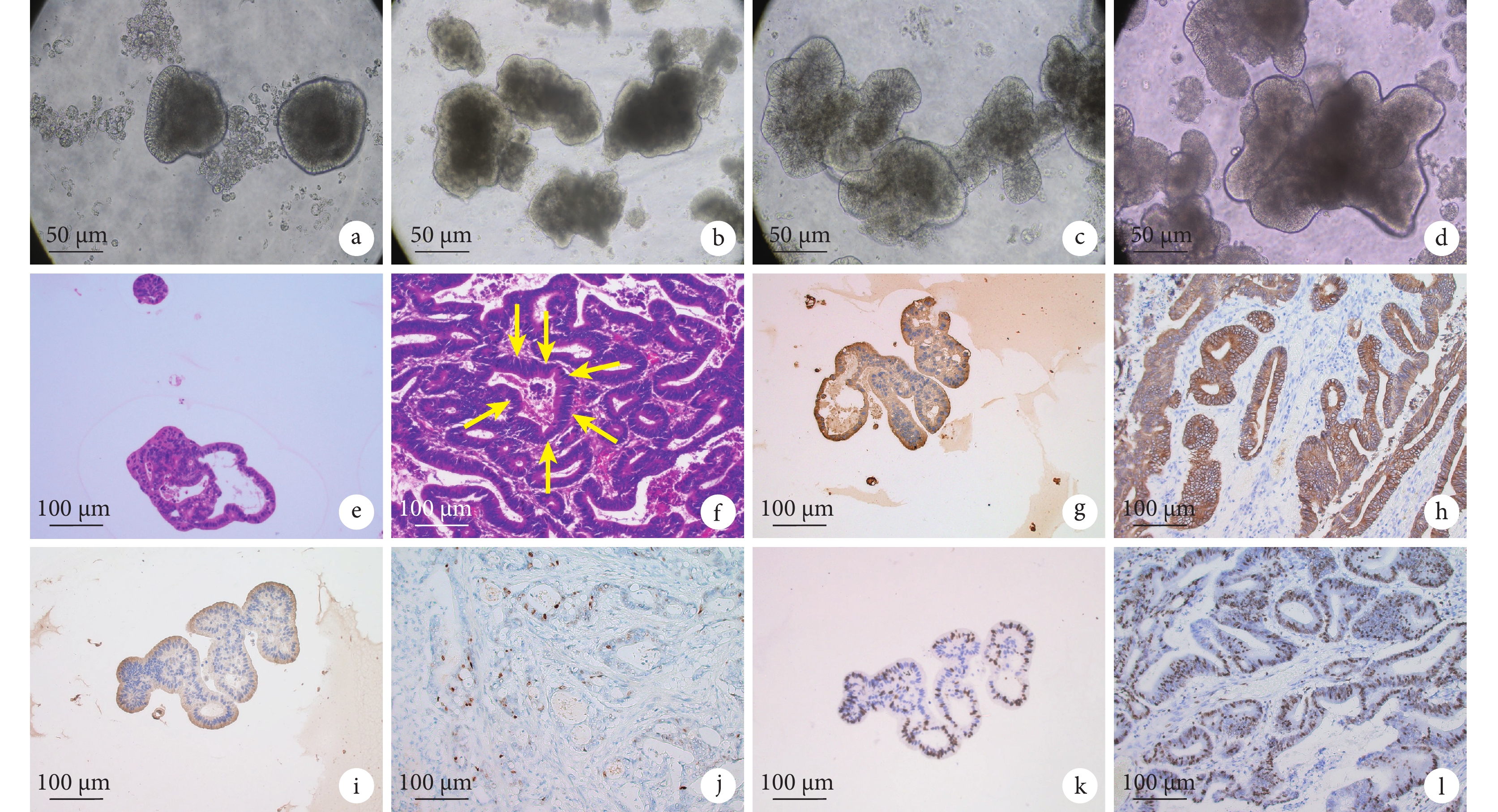
最終1例成功構建了胃癌類器官,建立的類器官經凍存、復蘇后依舊活性良好。倒置顯微鏡下觀察,類器官初始時(培養至第5天時)呈球形結構(圖1a),隨著時間的延長,至第10天時見類器官逐漸呈短棒狀結構(圖1b),至第15天時出現分枝樣改變(圖1c),至第20天時形成不規則的腺管樣結構(圖1d)。光鏡下觀察,建立的胃癌類器官呈團塊狀或者不規則腺體樣,腺體結構復雜,可見腺腔樣結構、細胞核有異型性、染色質濃聚的腺癌特征(圖1e),與原發胃癌的組織病理學特征高度一致(圖1f)。顯微鏡下觀察,在胃癌類器官及原發胃癌組織中CK-LMW(圖1g、1h)、p53 (圖1i、1j)蛋白表達均呈陽性,Ki67均呈高比例(陽性率約為70%)表達(圖1k、1l)。以上胃癌類器官和原發胃癌組織的形態學和免疫組織化學染色分析結果提示,本研究成功構建了胃癌類器官。
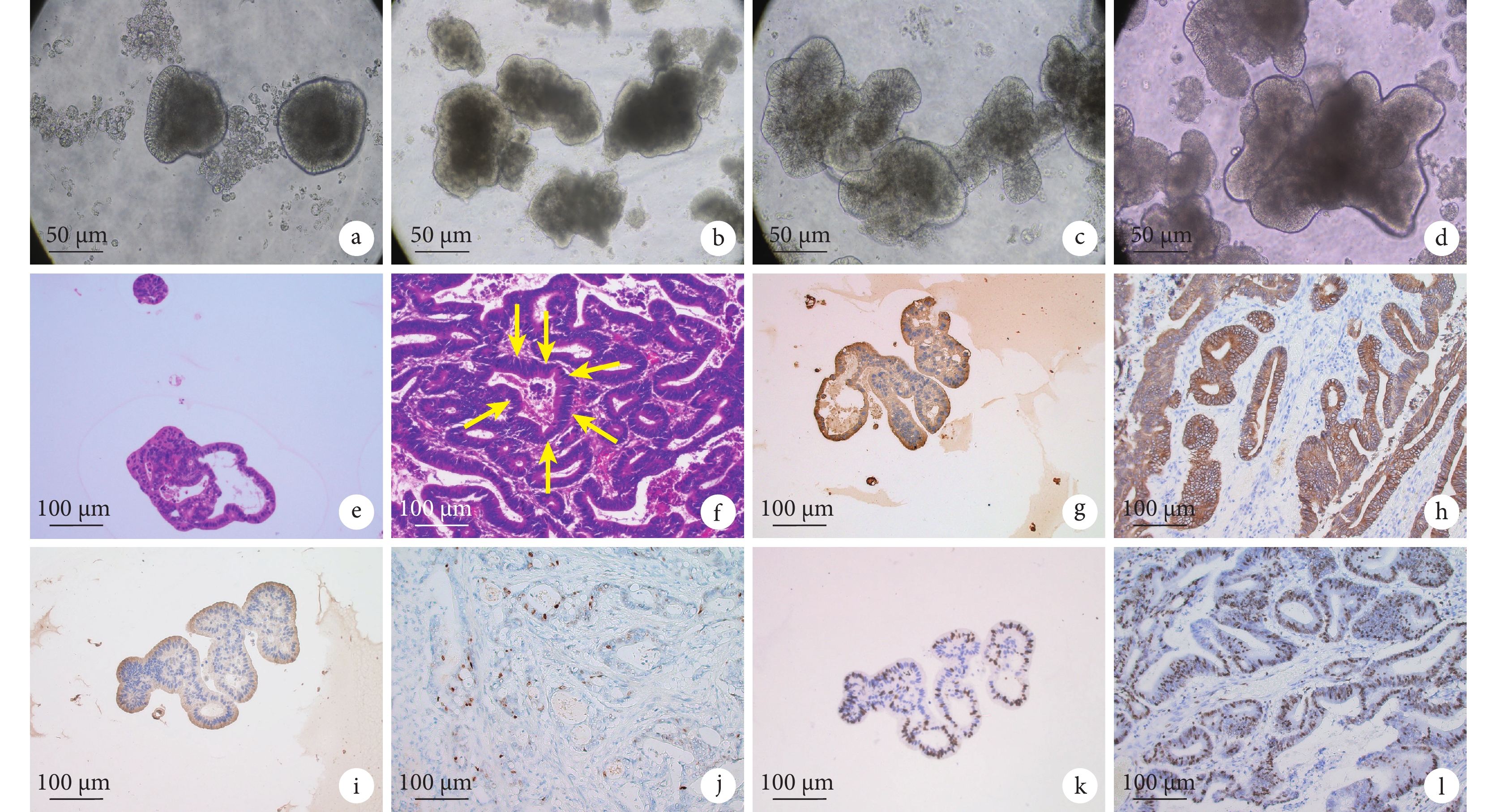 圖1
示胃癌類器官的結果
圖1
示胃癌類器官的結果
a~d:分別為培養至第5 (a)、10 (b)、15 (c) 和20 (d) 天時的胃癌類器官;e、f:分別為胃癌類器官和原發胃癌組織的HE染色結果,f 圖中黃箭所示為原發性胃癌組織的腺腔樣結構;g~l:分別為類器官和原發胃癌組織中CK-LMN (g、h)、p53 (i、j) 及Ki67(k、l) 的陽性表達結果
3 討論
盡管二維腫瘤細胞系為藥物篩選等提供了重要的數據,但它們存在的基因變化導致了在臨床試驗中的高失敗率[11]。腫瘤類器官是一種全新的腫瘤模型,它保留了原發腫瘤的大部分遺傳和組織學特征,是腫瘤機制研究、藥物研發等的優良模型[8, 12]。目前類器官的培養,絕大部分是通過將細胞接種于基質膠Matrigel進行構建[13]。隨著對細胞外基質的深入了解,Matrigel的使用受到越來越多地質疑,如它來自于腫瘤組織,其生物安全性值得關注;基質膠復雜且不明確,批次間變異率高;其高成本也限制了它的廣泛應用[14-17]。本研究采用懸浮培養,使用的是普通完全培養基,未使用文獻[12-13]中推薦的無血清培養基+高濃度各種生長因子的方案,成功建立了胃癌類器官。懸浮培養法的優勢在于:本方法在后續類器官的收集、傳代、凍存等實驗中處理起來更簡單、方便;培養過程中未使用Matrigel,可以減少鼠源成分與人源腫瘤間的相互作用帶來的影響,還可以較大幅度地降低類器官培養成本[18-19]。本研究團隊的體會是:在原代細胞獲取方面,結合文獻及既往的細胞系培養經驗,建議在酶消化過程中要勤于觀察組織消化情況并做好及時終止消化,最理想的狀態是腫瘤組織被消化成亞腺管或者小細胞團樣結構而不是被消化成單細胞,這樣可以極大地提高細胞系或者類器官的培養成功率;另外一點體會是,在腫瘤類器官的培養過程中,細胞的自身特性最為重要,即使在簡化培養體系下,腫瘤類器官仍能保留原發腫瘤的病理及分子特征,能夠滿足后續藥物篩選、功能驗證等實驗應用的需求。
目前總體來說,胃癌類器官培養的成功率相對偏低,50%的胃癌類器官培養成功率已是較高的水平[10, 12]。本研究中的胃癌類器官的培養成功率為1/3,這可能與本研究樣本量較少有關,有必要進一步擴大樣本量進行驗證。此外,筆者團隊將進一步優化胃癌類器官懸浮培養體系,以期提高胃癌類器官的培養成功率,為胃癌基礎研究、新藥研發和高通量測序分析提供理想的體外模型。
重要聲明
利益沖突聲明:所有作者聲明無利益沖突。
作者貢獻聲明:駱偉、蘇圓輝、于澄、柴長鵬、唐歡及苗龍進行實驗操作及論文撰寫;徐浩、駱偉及柴長鵬經費支持;王正峰和徐浩指導研究及修改論文。
倫理聲明:本研究通過了蘭州大學第一醫院醫學倫理委員會的批準(批文編號:LDYYLL2022-292)。
雖然胃癌發病率自20世紀中期以來開始下降[1],但它仍是造成全球癌癥相關死亡的第三大原因[2-3]。由于胃癌患者的臨床癥狀出現較晚,大部分患者就診時已處于疾病中晚期,所以胃癌患者的治療效果仍欠佳[4]。因此,對胃癌的發病機制和防治方法進行深入研究意義重大。近年來研究較熱的類器官是通過原代組織的成體干細胞、胚胎干細胞或誘導多能干細胞在富含層粘連蛋白的細胞外基質中自組裝而形成[5-6],它與原代組織在生理結構和功能上相似,是腫瘤研究的良好模型。早在2018年始已有4個團隊[7-10]報道了胃類器官的建立及應用研究,在這些研究中均是利用基質膠Matrigel進行類器官的培養,其實驗費用相對較高。本研究采用懸浮法建立胃癌類器官,探討其可行性,為胃癌類器官的培養探索一種實用且較經濟的實驗方法。
1 資料與方法
1.1 組織來源
本研究僅是初步驗證懸浮培養構建胃癌類器官的可行性,因此僅選取2021年7–12月期間于蘭州大學第一醫院行手術治療的3例胃癌患者的組織標本。患者術前均未接受腫瘤放化療,經術后組織病理學檢查確認。本研究獲得了蘭州大學第一醫院醫學倫理委員會的批準通過(批文編號:LDYYLL2022-292),并且也獲得了3例患者授權委托人的知情同意。
1.2 方法
1.2.1 主要試劑和儀器
12孔培養板購自無錫耐思生物科技有限公司(貨號:71201B01)。DMEM/F12培養基、胎牛血清及Trypsin(胰蛋白酶)均購自以色列BI公司。細胞培養添加劑Glutamax(貨號:35050061)和組織分散酶Dispase Ⅱ(貨號:17105041)均購自美國Invitrogen公司;膠原酶Ⅱ(貨號:17101015)購自美國Gibco公司;無血清快速細胞凍存液M5 HiPure(貨號:MF699-01)購自北京聚合美生物科技有限公司;抗體低分子量細胞角蛋白(low molecular weight cytokeratin,CK-LMW,貨號:MAB-0051)、p53(貨號:MAB-0674)及Ki67(貨號: MAB-0672)均購自福州邁新生物技術開發有限公司。倒置顯微鏡購自日本Nikon公司,石蠟切片機購自德國Laica公司。
1.2.2 類器官的建立
嚴格采取無菌操作原則。根據腫瘤大小切取適量新鮮腫瘤組織后置于運輸液中保存,在最短時間內轉運至實驗室。將癌組織標本放入60 mm培養皿內,用磷酸鹽緩沖液沖洗,去除血塊、壞死組織及纖維成分。然后用無菌手術刀片切取清理干凈的部分組織,凍存于–80 ℃冰箱中,備后續實驗用;將剩余腫瘤組織盡可能切碎,然后加入至10 mL混合消化酶的離心管中消化,于37 ℃下搖床中消化20~60 min。期間不時觀察組織塊消化情況,待組織體積減少至一半時,將消化液用100目細胞篩過濾后收集至15 mL離心管內,400×g離心4 min,棄去上清液。重復2次。收集細胞沉淀,用類器官完全培養液重懸腫瘤細胞。然后按每孔200個小細胞團將細胞懸液直接接種至12孔超低吸附板進行類器官的培養。類器官培養基成分為DMEM/F12培養基中加入1×Glutamax、10%胎牛血清和1%青-鏈霉素。
1.2.3 類器官的傳代、凍存和復蘇
當胃癌類器官直徑達到100 μm時進行傳代。將類器官懸液移至15 mL離心管中,加入適量磷酸鹽緩沖液,用槍頭輕柔吹打混勻,400×g離心4 min,棄去上清液。向沉淀中加入約2 mL的0.25%胰蛋白酶,輕柔吹打,分散團塊,37 ℃環境消化,同時保持鏡下觀察,直至類器官酶解至3~5個細胞的小細胞團狀態。終止消化時向細胞團塊加入5 mL完全培養基,槍頭輕柔吹打混勻,400×g離心4 min,棄去上清液。按照1∶2~1∶3的比例進行傳代。一部分類器官加入凍存液凍存,于液氮中長期保存。復蘇時凍存管用37 ℃水浴,溶解后快速轉移至15 mL離心管,添加5 mL類器官培養基,用移液管輕輕吹打3次,400×g離心4 min,棄去上清液,再次重懸后接種至超低吸附板進行類器官培養。
1.2.4 類器官包埋切片
通過離心將懸浮培養的類器官分離出來,浸入4%多聚甲醛溶液中固定24 h,然后用梯度(50%、70%、80%、95%、100%×2,每梯度30 min)乙醇脫水;放入二甲苯乙醇對半溶液中30 min,再轉入純二甲苯中浸漬2次,每次1 h。類器官進行瓊脂包埋,切成厚度約為5 μm的薄片,粘于玻片并干燥,備用。
1.2.5 蘇木精-伊紅(hematoxylin-eosin,HE)染色
將固定原發胃癌組織與類器官石蠟切片的載玻片分別放在染色架上,二甲苯清除樣品中的石蠟,每次2 min,重復3次;將載玻片置入100%乙醇中處理2 min,重復3次;接著轉移到95%的乙醇中處理2 min;轉移到70%乙醇中處理2 min;在室溫下,用自來水沖洗載玻片至少2 min。將樣品在蘇木精溶液中染色3 min。將載玻片置于室溫下的自來水沖洗至少5 min。將樣品在伊紅溶液中染色2 min。將載玻片用95%的乙醇浸泡約20次。轉移到95%的乙醇中處理2 min。轉移到100%的乙醇中處理2 min,重復2次。將載玻片置入二甲苯中處理2 min,重復3次。在載玻片的組織上滴1滴中性樹膠,然后蓋玻片封片;最后顯微鏡鏡檢,進行圖像采集分析。
1.2.6 免疫組織化學染色
將原發胃癌組織與類器官分別在4%多聚甲醛溶液中室溫下固定30 min,石蠟包埋。切片后按照標準流程對CK-LMW、p53和Ki67進行免疫組織化學染色。最后用BX51熒光顯微鏡(Olympus)進行圖像采集分析。
2 結果
最終1例成功構建了胃癌類器官,建立的類器官經凍存、復蘇后依舊活性良好。倒置顯微鏡下觀察,類器官初始時(培養至第5天時)呈球形結構(圖1a),隨著時間的延長,至第10天時見類器官逐漸呈短棒狀結構(圖1b),至第15天時出現分枝樣改變(圖1c),至第20天時形成不規則的腺管樣結構(圖1d)。光鏡下觀察,建立的胃癌類器官呈團塊狀或者不規則腺體樣,腺體結構復雜,可見腺腔樣結構、細胞核有異型性、染色質濃聚的腺癌特征(圖1e),與原發胃癌的組織病理學特征高度一致(圖1f)。顯微鏡下觀察,在胃癌類器官及原發胃癌組織中CK-LMW(圖1g、1h)、p53 (圖1i、1j)蛋白表達均呈陽性,Ki67均呈高比例(陽性率約為70%)表達(圖1k、1l)。以上胃癌類器官和原發胃癌組織的形態學和免疫組織化學染色分析結果提示,本研究成功構建了胃癌類器官。
 圖1
示胃癌類器官的結果
圖1
示胃癌類器官的結果
a~d:分別為培養至第5 (a)、10 (b)、15 (c) 和20 (d) 天時的胃癌類器官;e、f:分別為胃癌類器官和原發胃癌組織的HE染色結果,f 圖中黃箭所示為原發性胃癌組織的腺腔樣結構;g~l:分別為類器官和原發胃癌組織中CK-LMN (g、h)、p53 (i、j) 及Ki67(k、l) 的陽性表達結果
3 討論
盡管二維腫瘤細胞系為藥物篩選等提供了重要的數據,但它們存在的基因變化導致了在臨床試驗中的高失敗率[11]。腫瘤類器官是一種全新的腫瘤模型,它保留了原發腫瘤的大部分遺傳和組織學特征,是腫瘤機制研究、藥物研發等的優良模型[8, 12]。目前類器官的培養,絕大部分是通過將細胞接種于基質膠Matrigel進行構建[13]。隨著對細胞外基質的深入了解,Matrigel的使用受到越來越多地質疑,如它來自于腫瘤組織,其生物安全性值得關注;基質膠復雜且不明確,批次間變異率高;其高成本也限制了它的廣泛應用[14-17]。本研究采用懸浮培養,使用的是普通完全培養基,未使用文獻[12-13]中推薦的無血清培養基+高濃度各種生長因子的方案,成功建立了胃癌類器官。懸浮培養法的優勢在于:本方法在后續類器官的收集、傳代、凍存等實驗中處理起來更簡單、方便;培養過程中未使用Matrigel,可以減少鼠源成分與人源腫瘤間的相互作用帶來的影響,還可以較大幅度地降低類器官培養成本[18-19]。本研究團隊的體會是:在原代細胞獲取方面,結合文獻及既往的細胞系培養經驗,建議在酶消化過程中要勤于觀察組織消化情況并做好及時終止消化,最理想的狀態是腫瘤組織被消化成亞腺管或者小細胞團樣結構而不是被消化成單細胞,這樣可以極大地提高細胞系或者類器官的培養成功率;另外一點體會是,在腫瘤類器官的培養過程中,細胞的自身特性最為重要,即使在簡化培養體系下,腫瘤類器官仍能保留原發腫瘤的病理及分子特征,能夠滿足后續藥物篩選、功能驗證等實驗應用的需求。
目前總體來說,胃癌類器官培養的成功率相對偏低,50%的胃癌類器官培養成功率已是較高的水平[10, 12]。本研究中的胃癌類器官的培養成功率為1/3,這可能與本研究樣本量較少有關,有必要進一步擴大樣本量進行驗證。此外,筆者團隊將進一步優化胃癌類器官懸浮培養體系,以期提高胃癌類器官的培養成功率,為胃癌基礎研究、新藥研發和高通量測序分析提供理想的體外模型。
重要聲明
利益沖突聲明:所有作者聲明無利益沖突。
作者貢獻聲明:駱偉、蘇圓輝、于澄、柴長鵬、唐歡及苗龍進行實驗操作及論文撰寫;徐浩、駱偉及柴長鵬經費支持;王正峰和徐浩指導研究及修改論文。
倫理聲明:本研究通過了蘭州大學第一醫院醫學倫理委員會的批準(批文編號:LDYYLL2022-292)。