活體肝臟移植是目前解決器官供需矛盾的主要手段之一。但是若移植物體積不足可能會導致受者出現小肝綜合征,然而若移植物捐獻體積過大則可能發生供體術后肝衰竭等風險,于是雙供體肝臟移植在此背景下應運而生。雙供體肝臟移植能夠最大限度地減少每份供體肝臟切除體積來保證供體安全,同時又能為受體提供足夠量體積的肝臟,但是該項術式在我國開展較少。為了促進雙供體肝臟移植在我國順利推廣,將它作為供體來源的重要補充手段之一,四川大學華西醫院組織相關專家并結合國際移植先進國家的成熟經驗,圍繞供體評估與選擇、手術方式、術后并發癥等方面制定了本項共識。
引用本文: 呂濤, 徐崗, 徐西, 楊儉, 宋九林, 汪守平, 伊力亞爾·艾爾肯, 孔凌祥, 袁京生, 文天夫, 嚴律南, 吳泓, 楊家印. 華西雙供體肝臟移植專家共識. 中國普外基礎與臨床雜志, 2024, 31(4): 385-388. doi: 10.7507/1007-9424.202402061 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
0 前言
肝臟移植是治療終末期肝臟疾病的唯一方法。由于公民逝世后器官捐獻短缺,活體肝臟移植已成為解決器官供需矛盾的主要手段。在活體肝臟移植實踐過程中,主要挑戰在于既要保證供體有足夠體積的剩余肝臟,又要避免受體出現小肝綜合征。面對挑戰,2001年Lee等[1]報道了首例雙供體肝臟移植(dual-graft liver transplantation,DGLT)。但是由于該項手術極具挑戰性,目前全球僅累計報道了400余例DGLT[2-4]。在我國,2005年嚴律南等[5]報道了首例DGLT,同時還報道了1例全球首例活體聯合公民逝世后器官捐獻的DGLT,但是該項術式未能進行大范圍推廣。現階段為了促進DGLT在我國順利推廣,將它作為供體來源的重要補充,四川大學華西醫院組織相關專家結合國際移植先進國家的成熟經驗制定了本項共識。
1 DGLT的優勢
供體安全和受體小肝綜合征是活體肝臟移植應用面臨的兩大關鍵問題。為了滿足受體代謝需求,通常建議移植物受體體質量比(graft to recipient weight ratio,GRWR)≥0.8%[6-7],同時為了保障供體安全,其剩余肝臟體積不應低于總肝臟體積的30%[8],這些因素還受供體的年齡、肝臟脂肪變性及其他身體原因所限制,使大量潛在活體器官捐獻者因此放棄了捐獻[9-10]。DGLT能夠最大限度地減少每位供體的肝臟切除體積以保障其安全性,既能為受體提供足夠體積的肝臟,又能擴大供體選擇標準,還可采用一部分邊緣活體供體捐獻的肝臟,這在一定程度上擴大了供肝池。
2 供體的評估與選擇
2.1 供體評估
2.1.1 活體供體的評估
對活體供體的評估與活體肝臟移植相同,主要目的是:① 確保可以安全獲得足夠體積的供肝;② 確保無供體來源性疾病傳播給受體;③ 確保供體了解整個器官捐獻過程且能克服可能的心理后果[6, 11]。在評估過程中,需對供體的年齡、一般情況、既往史、家族史等進行詳細了解,此外還需完成血清學檢查、影像學檢查(包括腹部三維CT成像、磁共振胰膽管成像)等,以詳細了解供體的健康情況、肝臟情況、是否存在解剖變異等。對于存在脂肪肝易感因素(肥胖、糖尿病、血脂異常)和(或)與脂肪肝一致的影像學結果的活體捐獻者,建議在移植前根據情況進行活檢,以明確供肝大泡性脂肪變性程度[12]。
2.1.2 公民逝世后器官捐獻供體的評估
對于公民逝世后器官捐獻供體的評估應與劈離式肝臟移植相同[13]。除了對供體的解剖、肝臟體積及肝臟質量進行評估外,還需要對供體的死亡原因、重癥加強護理病房住院時間、升壓藥物用量、內環境情況等進行評估。
2.2 供肝類型的選擇
2.2.1 按供肝解剖位置分類
目前臨床采用的供肝組合類型主要有:左半肝+左半肝、右半肝+左半肝、右半肝+左外葉、左半肝+左外葉、左外葉+左外葉等[1, 4-5, 14-20]。由于存在兩個供體,每個供體只需要捐獻相對較小體積的肝臟即可保障供體剩余肝臟體積,同時又可以滿足受體需要。因此,相較于活體肝臟移植和劈離式肝臟移植,供體選擇標準可以適當放寬,但是仍建議GRWR≥0.8%。
2.2.2 按供肝來源分類
目前供體來源主要是活體供體+活體供體和活體供體+公民逝世后器官捐獻供體這兩種類型。由于大部分國家或地區均存在公民逝世后器官捐獻供體短缺,多數DGLT是活體供體+活體供體[21]。盡管DGLT能有效保障活體供體安全,但采用活體供體+活體供體是讓2名健康人同時承受肝臟捐獻風險,它存在一定的倫理爭議,也會增加外科醫生的心理負擔。活體供體+公民逝世后器官捐獻供體能夠在一定程度上避免該問題,并且來自公民逝世后器官捐獻供體的移植物可以保留相對較長的血管及膽管,能夠降低手術難度。除了以上兩種類型組合之外,2022年復旦大學附屬中山醫院樊嘉和周儉教授團隊報道了1例活體供肝聯合“廢棄”肝臟的DGLT,患者移植物1來自于其父親捐獻的不含肝中靜脈的右半肝,移植物2來自于1例肝臟尾葉巨大良性腫瘤患者在接受左半肝+尾狀葉切除后自愿捐獻切除的左半肝[16],該案例又為擴展DGLT供肝來源提供了新思路。
3 移植物的植入方式
3.1 序貫植入
3.1.1 肝右葉聯合左半肝(或左外葉)
該手術方式更符合肝臟的正常解剖位置,相當于常規的活體左半肝和活體右半肝植入過程,相對降低了血管和膽管吻合難度,其不足之處是右半肝獲取會增大供體手術風險且手術時間會延長。在當前雙左半肝已能滿足受者所需、又能縮短手術時間且能提高供體手術安全性的前提下,右半肝聯合左半肝(或左外葉)術式的應用少于雙左半肝供肝[22]。右半肝聯合左半肝(或左外葉)方式的具體手術過程:在完成受體肝臟切除后,阻斷受體下腔靜脈,將右肝移植物放入原右肝解剖位置,并將移植物的流出道與受體肝右靜脈進行端端吻合(與活體右半肝移植一樣,根據移植物情況評估是否重建肝中靜脈,主要根據肝中靜脈殘端直徑,建議>5 mm的肝中靜脈需重建),將移植物門靜脈右支與受體原有門靜脈右支進行端端吻合,吻合完成后阻斷鉗夾閉受體肝左靜脈殘端且松開下腔靜脈阻斷,再阻斷受體門靜脈左支殘端后松開門靜脈阻斷鉗開始灌注右肝移植物;然后將左肝移植物放入受體左肝解剖位置,將移植物肝左靜脈與受體肝左靜脈和肝中靜脈開口進行吻合,將移植物門靜脈左支與受體原有門靜脈左支進行吻合,松開所有阻斷鉗,灌注左肝移植物。再將移植物的動脈分別與受體肝右動脈、肝左動脈進行吻合,最后將右側移植物膽管與受體膽總管進行端端吻合,然后進行左側Roux-en-Y膽腸吻合。
3.1.2 左半肝(或左外葉)聯合左半肝(或左外葉)
雙左半肝供肝是最早和最廣泛應用的手術方式,其原因主要有:① 提高了供者安全性,左半肝切取的安全性要遠高于右半肝切取,供者剩余肝臟體積能得到充分保障;② 保障了受者所需肝臟體積,2個左半肝的總體積基本可滿足大多數受者所需;③ 降低了供體手術難度[22]。具體手術過程:在完成受體全肝切除后阻斷下腔靜脈。將第1個左側移植物放入原左肝解剖位置,將其流出道與受體肝左靜脈和肝中靜脈開口進行吻合。第2個左側移植物橫向180°倒置放入原右肝解剖位置,并將其流出道與肝右靜脈殘端進行端端吻合。將左側移植物門靜脈與受體門靜脈左支進行端端吻合。吻合完成后,阻斷鉗夾閉受體肝右靜脈殘端及門靜脈右支殘端后松開下腔靜脈阻斷,同時松開門靜脈阻斷鉗開始灌注左側肝移植物。因為右側移植物經過了180°翻轉,膽管位于門靜脈后方,若完成血管吻合后再行膽管吻合將變得困難,因此有文獻[4, 18, 23]報道先吻合右側膽管,再吻合門靜脈右支,然后進行左側Roux-en-Y膽腸吻合。因為左肝移植物較小而無法填充受體腹腔的右上象限空間,因而通常需放置不同尺寸的組織擴張器來支撐移植物,以防止未來血管緊張。
移植物的左右放置位置主要是根據兩個移植物膽管的大小和數量決定的。由于對放置于右側的移植物行膽腸吻合術在技術上不可行,因此通常將具有多個膽管開口或移植物膽管與受體膽管大小不匹配的移植物放置于左側;若兩個移植物都是單一膽管開口且管徑相似,可以根據移植物或受體肝動脈的數量或長度來決定;若條件相似,通常則建議將質量更好的移植物放置于左側[4]。
3.2 體外拼接后植入
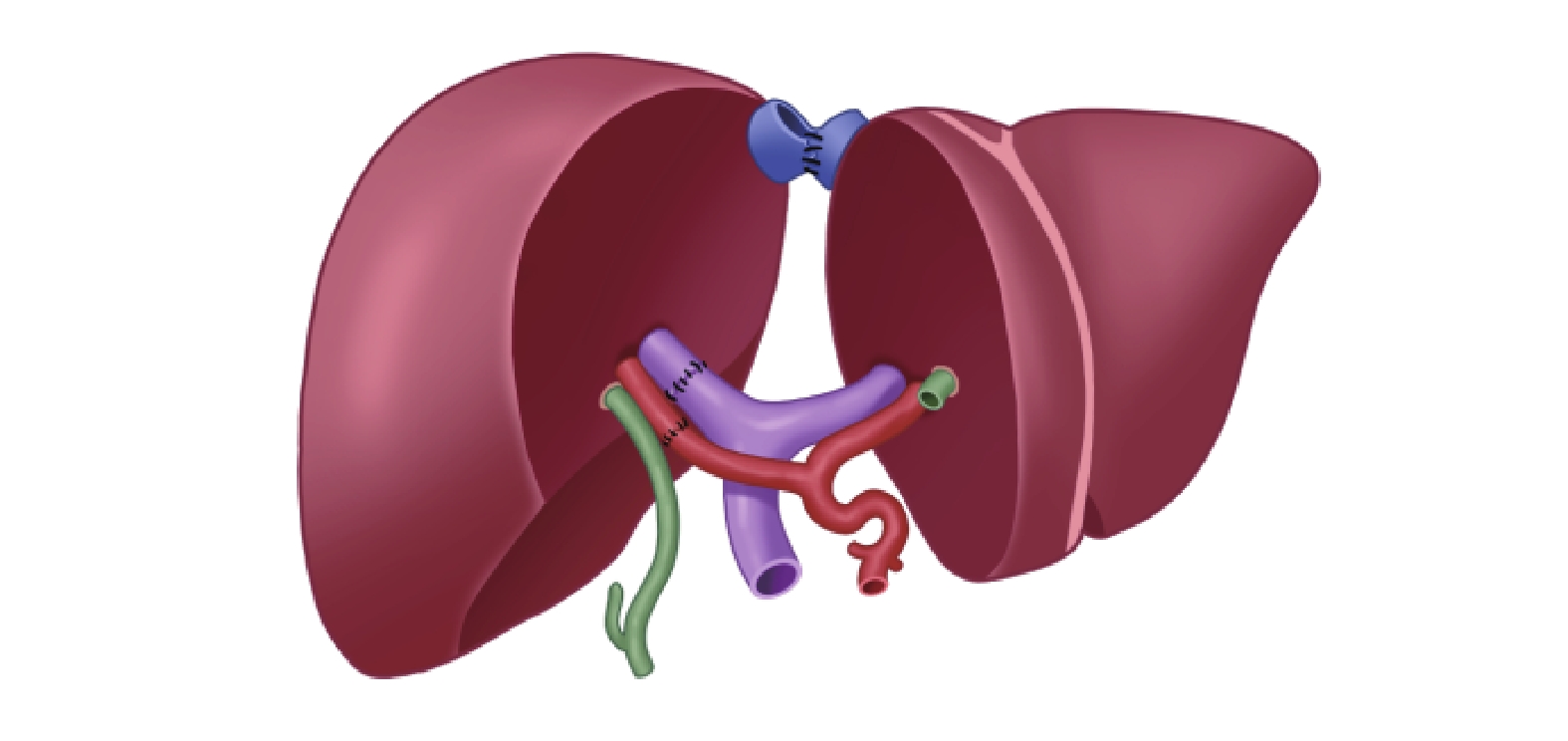
除了常規的序貫植入方式,四川大學華西醫院楊家印教授團隊還報道了1例體外拼接技術[24],即將來自于活體供體的不含肝中靜脈的右半肝(移植物1,包含肝右靜脈、門靜脈右支和肝右動脈)與來自公民逝世后器官捐獻供體的左外葉(移植物2,包含肝總動脈、肝固有動脈、肝左動脈、肝右動脈殘端;保留部分靜脈,從門靜脈左支取至門靜脈主干)于修肝臺上進行拼接。簡言之,是利用血管補片(來自于公民逝世后器官捐獻供體)將兩個移植物的肝右靜脈與肝左靜脈整合成型,將移植物1的門靜脈右支經血管搭橋后與移植物2的門靜脈主干與門靜脈右支開口處行端側吻合,將移植物1的肝右動脈與移植物2的肝右動脈殘端行端端吻合(圖1)。最后采用改良背馱式肝臟移植的方式將肝靜脈整形口與受體下腔靜脈進行端側吻合;將移植物2的門靜脈主干與受體門靜脈進行吻合;將移植物2的肝總動脈與受體肝固有動脈行端端吻合。通過上述體外拼接的方式能夠降低體內血管吻合難度,減少體內操作時間,縮短無肝期。
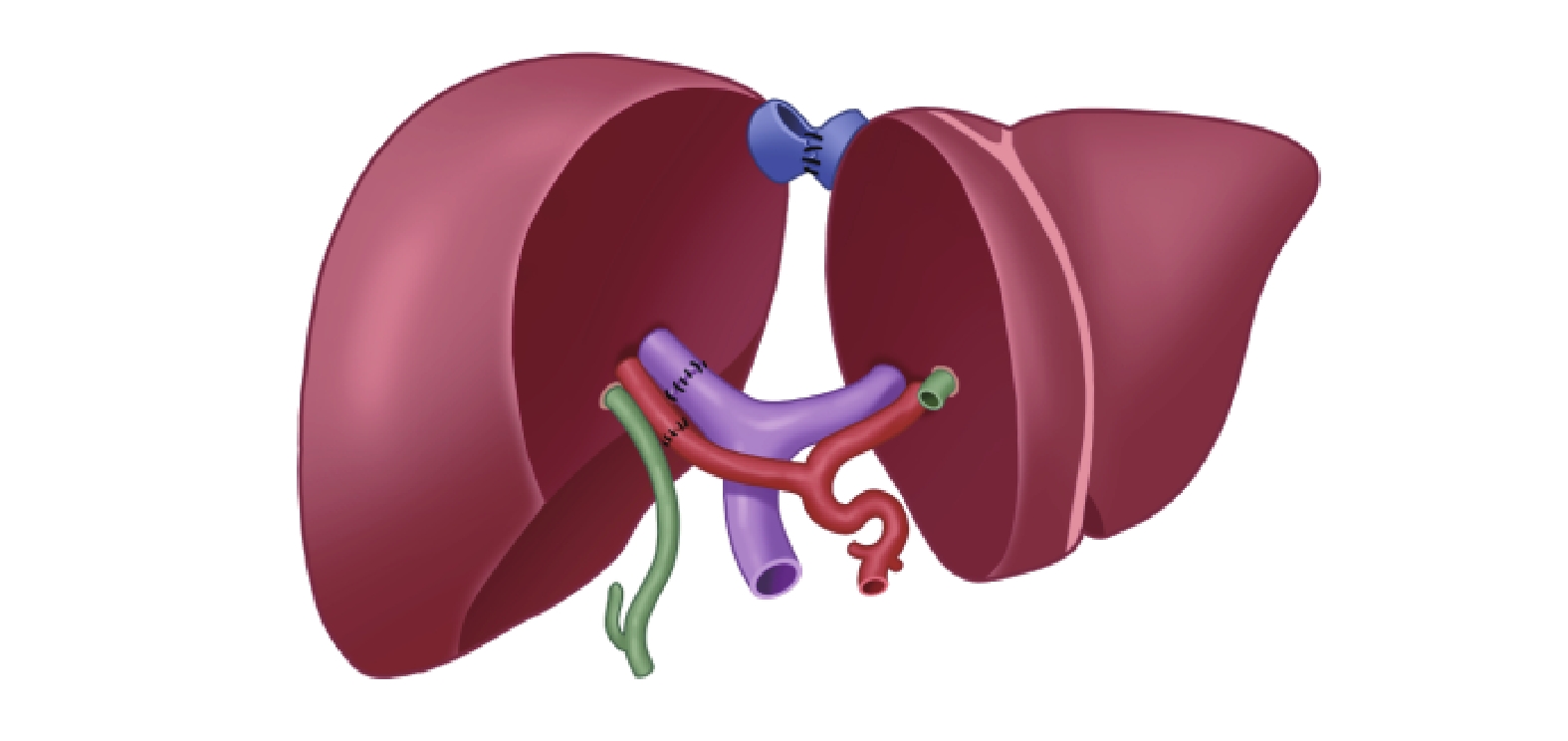 圖1
示雙供肝體外拼接手術示意圖
圖1
示雙供肝體外拼接手術示意圖
4 DGLT術后并發癥的處理
DGLT術后并發癥的處理基本與活體肝臟移植和劈離式肝臟移植相同。肝臟移植術后管理團隊應熟悉供肝的選擇和重建方式,利用多種影像技術積極監測和處理DGLT相關的血管和膽管并發癥;除此之外,在DGLT中,兩個移植物在體內會出現功能性抑制,從而引起一側移植物萎縮[21, 25]。根據文獻[21]報道,DGLT后有16%的受體在1~18個月內出現單側移植物萎縮。但目前無證據表明單側移植物萎縮會影響移植物的功能及受體的存活。
5 總結
盡管DGLT手術操作復雜,難度較大,但是當供體由于肝臟體積、解剖或病理因素而無法進行單次活體器官捐獻時,DGLT應被視為一種可行的策略。就目前而言,DGLT的推廣還需要專家共識和基于證據的指導方針,使該手術方式成為標準治療手段而不僅僅是一些先驅外科醫生的常規治療。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
“華西雙供體肝臟移植專家共識”編審委員會成員名單
主審專家
嚴律南
編委會成員
文天夫,楊儉,宋九林,汪守平,伊力亞爾·艾爾肯, 孔凌祥,袁京生
執筆專家:
吳泓,楊家印,呂濤,徐崗,徐西
0 前言
肝臟移植是治療終末期肝臟疾病的唯一方法。由于公民逝世后器官捐獻短缺,活體肝臟移植已成為解決器官供需矛盾的主要手段。在活體肝臟移植實踐過程中,主要挑戰在于既要保證供體有足夠體積的剩余肝臟,又要避免受體出現小肝綜合征。面對挑戰,2001年Lee等[1]報道了首例雙供體肝臟移植(dual-graft liver transplantation,DGLT)。但是由于該項手術極具挑戰性,目前全球僅累計報道了400余例DGLT[2-4]。在我國,2005年嚴律南等[5]報道了首例DGLT,同時還報道了1例全球首例活體聯合公民逝世后器官捐獻的DGLT,但是該項術式未能進行大范圍推廣。現階段為了促進DGLT在我國順利推廣,將它作為供體來源的重要補充,四川大學華西醫院組織相關專家結合國際移植先進國家的成熟經驗制定了本項共識。
1 DGLT的優勢
供體安全和受體小肝綜合征是活體肝臟移植應用面臨的兩大關鍵問題。為了滿足受體代謝需求,通常建議移植物受體體質量比(graft to recipient weight ratio,GRWR)≥0.8%[6-7],同時為了保障供體安全,其剩余肝臟體積不應低于總肝臟體積的30%[8],這些因素還受供體的年齡、肝臟脂肪變性及其他身體原因所限制,使大量潛在活體器官捐獻者因此放棄了捐獻[9-10]。DGLT能夠最大限度地減少每位供體的肝臟切除體積以保障其安全性,既能為受體提供足夠體積的肝臟,又能擴大供體選擇標準,還可采用一部分邊緣活體供體捐獻的肝臟,這在一定程度上擴大了供肝池。
2 供體的評估與選擇
2.1 供體評估
2.1.1 活體供體的評估
對活體供體的評估與活體肝臟移植相同,主要目的是:① 確保可以安全獲得足夠體積的供肝;② 確保無供體來源性疾病傳播給受體;③ 確保供體了解整個器官捐獻過程且能克服可能的心理后果[6, 11]。在評估過程中,需對供體的年齡、一般情況、既往史、家族史等進行詳細了解,此外還需完成血清學檢查、影像學檢查(包括腹部三維CT成像、磁共振胰膽管成像)等,以詳細了解供體的健康情況、肝臟情況、是否存在解剖變異等。對于存在脂肪肝易感因素(肥胖、糖尿病、血脂異常)和(或)與脂肪肝一致的影像學結果的活體捐獻者,建議在移植前根據情況進行活檢,以明確供肝大泡性脂肪變性程度[12]。
2.1.2 公民逝世后器官捐獻供體的評估
對于公民逝世后器官捐獻供體的評估應與劈離式肝臟移植相同[13]。除了對供體的解剖、肝臟體積及肝臟質量進行評估外,還需要對供體的死亡原因、重癥加強護理病房住院時間、升壓藥物用量、內環境情況等進行評估。
2.2 供肝類型的選擇
2.2.1 按供肝解剖位置分類
目前臨床采用的供肝組合類型主要有:左半肝+左半肝、右半肝+左半肝、右半肝+左外葉、左半肝+左外葉、左外葉+左外葉等[1, 4-5, 14-20]。由于存在兩個供體,每個供體只需要捐獻相對較小體積的肝臟即可保障供體剩余肝臟體積,同時又可以滿足受體需要。因此,相較于活體肝臟移植和劈離式肝臟移植,供體選擇標準可以適當放寬,但是仍建議GRWR≥0.8%。
2.2.2 按供肝來源分類
目前供體來源主要是活體供體+活體供體和活體供體+公民逝世后器官捐獻供體這兩種類型。由于大部分國家或地區均存在公民逝世后器官捐獻供體短缺,多數DGLT是活體供體+活體供體[21]。盡管DGLT能有效保障活體供體安全,但采用活體供體+活體供體是讓2名健康人同時承受肝臟捐獻風險,它存在一定的倫理爭議,也會增加外科醫生的心理負擔。活體供體+公民逝世后器官捐獻供體能夠在一定程度上避免該問題,并且來自公民逝世后器官捐獻供體的移植物可以保留相對較長的血管及膽管,能夠降低手術難度。除了以上兩種類型組合之外,2022年復旦大學附屬中山醫院樊嘉和周儉教授團隊報道了1例活體供肝聯合“廢棄”肝臟的DGLT,患者移植物1來自于其父親捐獻的不含肝中靜脈的右半肝,移植物2來自于1例肝臟尾葉巨大良性腫瘤患者在接受左半肝+尾狀葉切除后自愿捐獻切除的左半肝[16],該案例又為擴展DGLT供肝來源提供了新思路。
3 移植物的植入方式
3.1 序貫植入
3.1.1 肝右葉聯合左半肝(或左外葉)
該手術方式更符合肝臟的正常解剖位置,相當于常規的活體左半肝和活體右半肝植入過程,相對降低了血管和膽管吻合難度,其不足之處是右半肝獲取會增大供體手術風險且手術時間會延長。在當前雙左半肝已能滿足受者所需、又能縮短手術時間且能提高供體手術安全性的前提下,右半肝聯合左半肝(或左外葉)術式的應用少于雙左半肝供肝[22]。右半肝聯合左半肝(或左外葉)方式的具體手術過程:在完成受體肝臟切除后,阻斷受體下腔靜脈,將右肝移植物放入原右肝解剖位置,并將移植物的流出道與受體肝右靜脈進行端端吻合(與活體右半肝移植一樣,根據移植物情況評估是否重建肝中靜脈,主要根據肝中靜脈殘端直徑,建議>5 mm的肝中靜脈需重建),將移植物門靜脈右支與受體原有門靜脈右支進行端端吻合,吻合完成后阻斷鉗夾閉受體肝左靜脈殘端且松開下腔靜脈阻斷,再阻斷受體門靜脈左支殘端后松開門靜脈阻斷鉗開始灌注右肝移植物;然后將左肝移植物放入受體左肝解剖位置,將移植物肝左靜脈與受體肝左靜脈和肝中靜脈開口進行吻合,將移植物門靜脈左支與受體原有門靜脈左支進行吻合,松開所有阻斷鉗,灌注左肝移植物。再將移植物的動脈分別與受體肝右動脈、肝左動脈進行吻合,最后將右側移植物膽管與受體膽總管進行端端吻合,然后進行左側Roux-en-Y膽腸吻合。
3.1.2 左半肝(或左外葉)聯合左半肝(或左外葉)
雙左半肝供肝是最早和最廣泛應用的手術方式,其原因主要有:① 提高了供者安全性,左半肝切取的安全性要遠高于右半肝切取,供者剩余肝臟體積能得到充分保障;② 保障了受者所需肝臟體積,2個左半肝的總體積基本可滿足大多數受者所需;③ 降低了供體手術難度[22]。具體手術過程:在完成受體全肝切除后阻斷下腔靜脈。將第1個左側移植物放入原左肝解剖位置,將其流出道與受體肝左靜脈和肝中靜脈開口進行吻合。第2個左側移植物橫向180°倒置放入原右肝解剖位置,并將其流出道與肝右靜脈殘端進行端端吻合。將左側移植物門靜脈與受體門靜脈左支進行端端吻合。吻合完成后,阻斷鉗夾閉受體肝右靜脈殘端及門靜脈右支殘端后松開下腔靜脈阻斷,同時松開門靜脈阻斷鉗開始灌注左側肝移植物。因為右側移植物經過了180°翻轉,膽管位于門靜脈后方,若完成血管吻合后再行膽管吻合將變得困難,因此有文獻[4, 18, 23]報道先吻合右側膽管,再吻合門靜脈右支,然后進行左側Roux-en-Y膽腸吻合。因為左肝移植物較小而無法填充受體腹腔的右上象限空間,因而通常需放置不同尺寸的組織擴張器來支撐移植物,以防止未來血管緊張。
移植物的左右放置位置主要是根據兩個移植物膽管的大小和數量決定的。由于對放置于右側的移植物行膽腸吻合術在技術上不可行,因此通常將具有多個膽管開口或移植物膽管與受體膽管大小不匹配的移植物放置于左側;若兩個移植物都是單一膽管開口且管徑相似,可以根據移植物或受體肝動脈的數量或長度來決定;若條件相似,通常則建議將質量更好的移植物放置于左側[4]。
3.2 體外拼接后植入
除了常規的序貫植入方式,四川大學華西醫院楊家印教授團隊還報道了1例體外拼接技術[24],即將來自于活體供體的不含肝中靜脈的右半肝(移植物1,包含肝右靜脈、門靜脈右支和肝右動脈)與來自公民逝世后器官捐獻供體的左外葉(移植物2,包含肝總動脈、肝固有動脈、肝左動脈、肝右動脈殘端;保留部分靜脈,從門靜脈左支取至門靜脈主干)于修肝臺上進行拼接。簡言之,是利用血管補片(來自于公民逝世后器官捐獻供體)將兩個移植物的肝右靜脈與肝左靜脈整合成型,將移植物1的門靜脈右支經血管搭橋后與移植物2的門靜脈主干與門靜脈右支開口處行端側吻合,將移植物1的肝右動脈與移植物2的肝右動脈殘端行端端吻合(圖1)。最后采用改良背馱式肝臟移植的方式將肝靜脈整形口與受體下腔靜脈進行端側吻合;將移植物2的門靜脈主干與受體門靜脈進行吻合;將移植物2的肝總動脈與受體肝固有動脈行端端吻合。通過上述體外拼接的方式能夠降低體內血管吻合難度,減少體內操作時間,縮短無肝期。
 圖1
示雙供肝體外拼接手術示意圖
圖1
示雙供肝體外拼接手術示意圖
4 DGLT術后并發癥的處理
DGLT術后并發癥的處理基本與活體肝臟移植和劈離式肝臟移植相同。肝臟移植術后管理團隊應熟悉供肝的選擇和重建方式,利用多種影像技術積極監測和處理DGLT相關的血管和膽管并發癥;除此之外,在DGLT中,兩個移植物在體內會出現功能性抑制,從而引起一側移植物萎縮[21, 25]。根據文獻[21]報道,DGLT后有16%的受體在1~18個月內出現單側移植物萎縮。但目前無證據表明單側移植物萎縮會影響移植物的功能及受體的存活。
5 總結
盡管DGLT手術操作復雜,難度較大,但是當供體由于肝臟體積、解剖或病理因素而無法進行單次活體器官捐獻時,DGLT應被視為一種可行的策略。就目前而言,DGLT的推廣還需要專家共識和基于證據的指導方針,使該手術方式成為標準治療手段而不僅僅是一些先驅外科醫生的常規治療。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
“華西雙供體肝臟移植專家共識”編審委員會成員名單
主審專家
嚴律南
編委會成員
文天夫,楊儉,宋九林,汪守平,伊力亞爾·艾爾肯, 孔凌祥,袁京生
執筆專家:
吳泓,楊家印,呂濤,徐崗,徐西