引用本文: 王橋生, 王美求, 符暉. 膿毒癥相關急性呼吸窘迫綜合征短期死亡風險評分標準構建. 中國呼吸與危重監護雜志, 2022, 21(3): 162-169. doi: 10.7507/1671-6205.202201007 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是危重患者常見的臨床綜合征,膿毒癥是誘發 ARDS 主要的病因之一,稱為膿毒癥相關 ARDS(sepsis-associated acute respiratory distress syndrome,sARDS),約占 32%[1]。sARDS 的 28 d 病死率達 41.5%[2],而一些國家嚴重 sARDS 的病死率達 50%[3]。按感染部位,肺炎是導致 sARDS 最常見的誘因,占 77%,總體病死率為 46.3%,其中重度 ARDS 病死率更高,達 56.2%[4]。研究顯示,膿毒癥患者疾病嚴重程度、基礎疾病、年齡、感染部位、肺炎嚴重程度評分、肺損傷預測評分等是發生 ARDS 的相關危險因素[5-6]。進一步預測 sARDS 預后的研究尚少。研究發現影響 sARDS 不良預后因素包括肺損傷評分、急性生理學和慢性健康狀況評價 Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)評分、是否使用血管活性藥物、是否機械通氣、血乳酸、降鈣素原(procalcitonin,PCT)水平等[5, 7-8],上述因素存在預測效能欠佳或操作復雜以及未進行有效的臨床驗證等弊端,導致臨床難以推廣應用。因此,本研究擬通過回顧性分析篩選影響 sARDS 28 d 死亡的不良預后的危險因素,進一步構建 sARDS 短期死亡風險評分標準,以期為臨床醫師客觀快速地評估 sARDS 患者入院時病情的危重程度,并及時甚至預見性采取積極的治療手段提供參考依據。
1 資料與方法
1.1 臨床資料
采用回顧性研究方法,選取 2013 年 1 月 1 日—2020 年 8 月 31 日在南華大學附屬第一醫院重癥加強治療病房(intensive care unit,ICU)診斷為 sARDS 的患者作為研究對象。納入標準:(1)年齡大于 18 歲;(2)符合 ARDS 柏林定義診斷標準[9];(3)符合 Sepsis 3.0 膿毒癥診斷標準[10]。排除標準:(1)入院 24 h 內死亡;(2)放棄積極治療;(3)孕婦或者哺乳期婦女;(4)臨床資料不全或病史不詳。
本研究符合醫學倫理學標準,并通過醫院醫學倫理委員會批準(倫理批號20200609)。
1.2 方法
1.2.1 觀察終點及分組
根據 sARDS 患者入 ICU 后 28 d 內是否死亡,將患者分為存活組及死亡組。
1.2.2 收集指標
收集了 54 個可能導致 sARDS 患者 28 d 內不良結局的危險因素:發病時間、入科時體溫、脈搏、呼吸、平均動脈壓、血糖、受累器官數目、白細胞計數、中性粒細胞絕對值、中性粒細胞百分比、淋巴細胞計數、血小板計數、血紅蛋白濃度、纖維蛋白原濃度、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、凝血酶原時間(prothrombin time,PT)、總膽紅素、直接膽紅素、間接膽紅素、谷丙轉氨酶(alanine transaminase,ALT)、谷草轉氨酶(aspartate transaminase,AST)、肌酐、尿素氮、心肌酶、肌鈣蛋白 T、C 反應蛋白(C-reactive protein,CRP)、PCT、D-二聚體、白細胞介素-6(interleukin-6,IL-6)、乳酸、腦鈉肽(brain natriuretic peptide,BNP)、實際二氧化碳分壓、氧合指數、性別、年齡、ARDS 嚴重程度、有無高血壓等基礎疾病、感染部位、有無機械通氣等。
1.2.3 評分標準的建立
評分標準建立原則:(1)基礎評分:將β值最小的危險因素的基礎評分定為 1 分,其余各危險因素的基礎評分為其回歸系數 β 值與最小 β 值的比值。(2)等級評分:無序分類變量與連續數值型變量的等級評分為 1 分;有序分類變量的最低等級者等級評分為 1 分,以后每提高一個等級加 1 分。(3)最終評分為基礎評分與等級評分相乘。
1.3 統計學方法
采用 IBM SPSS 25 統計軟件。呈正態分布的計量資料采用均數±標準差( ±s)表示,計數資料采用百分率表示;缺失值中計數資料予以眾數代替,計量資料予以平均值代替。首先,對潛在危險因素進行單因素 Logistic 回歸分析,P<0.05 表示潛在危險因素在死亡組和生存組間差異具有統計學意義。然后,將存在顯著差異的潛在危險因素進行向前-LR 法的多因素 Logistic 回歸分析,以 P<0.05 為選入多因素回歸方程的必要條件。預測的擬合優度采用Hosmer-Lemeshow χ2 檢驗,P>0.05 代表模型校準度好,預測值與實際觀察值相近。預測的準確度是對 sARDS 患者 28 d 內是否死亡的區別能力,通過受試者操作特征(receiver operating characteristic,ROC)曲線下面積來檢驗。曲線下面積≥0.7 代表該模型預測的準確度較高,且曲線下面積越接近1代表模型預測準確度越好。
±s)表示,計數資料采用百分率表示;缺失值中計數資料予以眾數代替,計量資料予以平均值代替。首先,對潛在危險因素進行單因素 Logistic 回歸分析,P<0.05 表示潛在危險因素在死亡組和生存組間差異具有統計學意義。然后,將存在顯著差異的潛在危險因素進行向前-LR 法的多因素 Logistic 回歸分析,以 P<0.05 為選入多因素回歸方程的必要條件。預測的擬合優度采用Hosmer-Lemeshow χ2 檢驗,P>0.05 代表模型校準度好,預測值與實際觀察值相近。預測的準確度是對 sARDS 患者 28 d 內是否死亡的區別能力,通過受試者操作特征(receiver operating characteristic,ROC)曲線下面積來檢驗。曲線下面積≥0.7 代表該模型預測的準確度較高,且曲線下面積越接近1代表模型預測準確度越好。
2 結果
2.1 患者的基本臨床資料
本研究最終納入150例sARDS患者,其中女52例(34.7%),男 98 例(65.3%)。存活組 67 例,死亡組 83 例,病死率為 55.3%。
2.2 單因素 Logistic 回歸分析 sARDS 患者 28 d 死亡的危險因素
sARDS 患者 28 d 內死亡的預后不良因素根據不同數據類型分為連續型變量和分類變量(二分類、多分類、等級)。單因素 Logistic 回歸分析結果顯示有 20 個潛在危險因素進入多因素回歸分析(P<0.05):平均動脈壓(P<0.01)、受累器官數目(P<0.01)、中性粒細胞百分比(P=0.015)、血小板計數(P=0.001)、纖維蛋白原(P<0.001)、直接膽紅素(P=0.049)、肌酐(P=0.001)、尿素氮(P=0.003)、乳酸脫氫酶(P=0.049)、肌酸激酶同工酶(P=0.029)、氧合指數(P<0.01)、實際二氧化碳分壓(P=0.002)、乳酸(P<0.001)、ARDS 嚴重程度(P<0.01)、感染部位(P=0.013)、APTT(P=0.034)、PT(P=0.013)、PCT(P=0.002)、BNP(P=0.048)、有無機械通氣(P<0.01)。由于 IL-6 數據缺失值過多,刪除缺失值數據后,將剩下的 50 例數據進行單因素分析,結果顯示兩組差異無統計學意義(P>0.05)。具體分析結果見表 1和表 2。
 )
)
2.3 多因素 Logistic 回歸分析構建 sARDS 患者 28 d 死亡預測模型
多因素 Logistic 回歸分析得出需機械通氣、乳酸≥4.3 mmol/L、受累器官數目≥3 個、ARDS 嚴重程度為 sARDS 患者 28 d 死亡的獨立危險因素(表 3)。構建 sARDS 患者 28 d 死亡預測模型的方程為P=ea/(1+ea),a=–7.418+1.649×有無機械通氣(0 或 1)+0.384×是否受累器官數目≥3 個(0 或 1)+0.139×是否乳酸≥4.3 mmol/L(0 或 1)+1.845×ARDS 嚴重程度(0 或 1 或 2)。預測模型中 e 為指數函數,P 為 sARDS 28 d 死亡的概率。公式中各變量賦值:在二分類變量“有無機械通氣”、“受累器官數目≥3 個”和“乳酸≥4.3 mmol/L”中,0 代表“無”或“否”,1 代表“有”或“是”;在等級變量“ARDS 嚴重程度”中,0 代表“輕度 ARDS”,1 代表“中度 ARDS”,2 代表“重度 ARDS”。采用 Hosmer-Lemeshow χ2 檢驗預測模型的擬合優度為χ2=5.393,P=0.715,ν=8,代表模型校準度好,預測值與實際觀察值相近。
2.4 ROC 曲線評價 sARDS 28 d 死亡預測模型與相關評分系統的預測性能
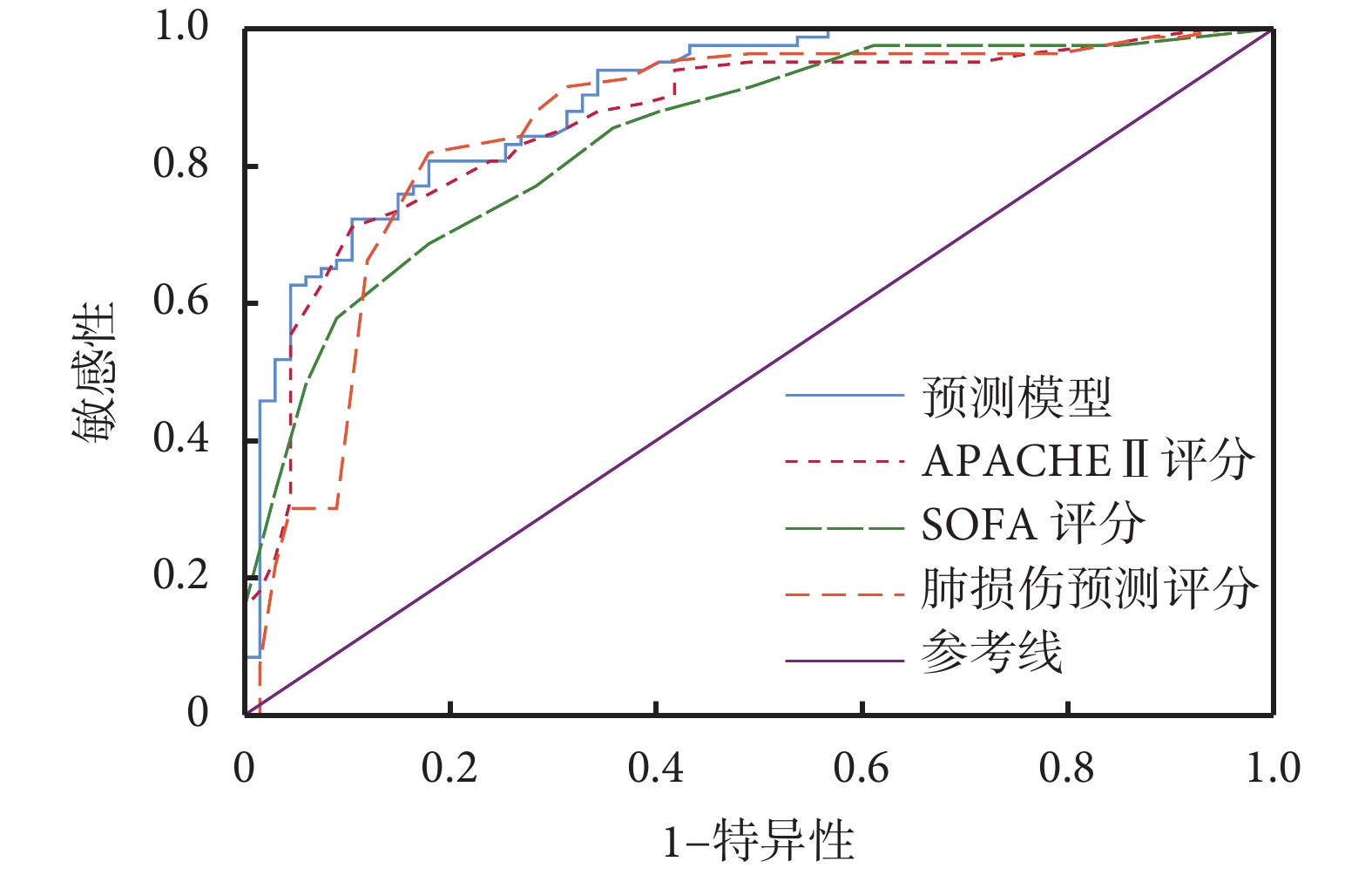
該預測模型預測患者死亡的 ROC 曲線下面積為 0.896,95% 可信區間 0.846~0.945,SE=0.025,代表該模型預測準確度較高,結果見圖 1。而肺損傷預測評分、APACHEⅡ 評分和序貫器官衰竭評分(sequential organ failure assessment,SOFA)評分 ROC 曲線下面積分別為 0.855、0.865和0.841,均稍低于該預測模型。各評分系統及預測模型對 sARDS 患者預后判斷效能比較見表 4。
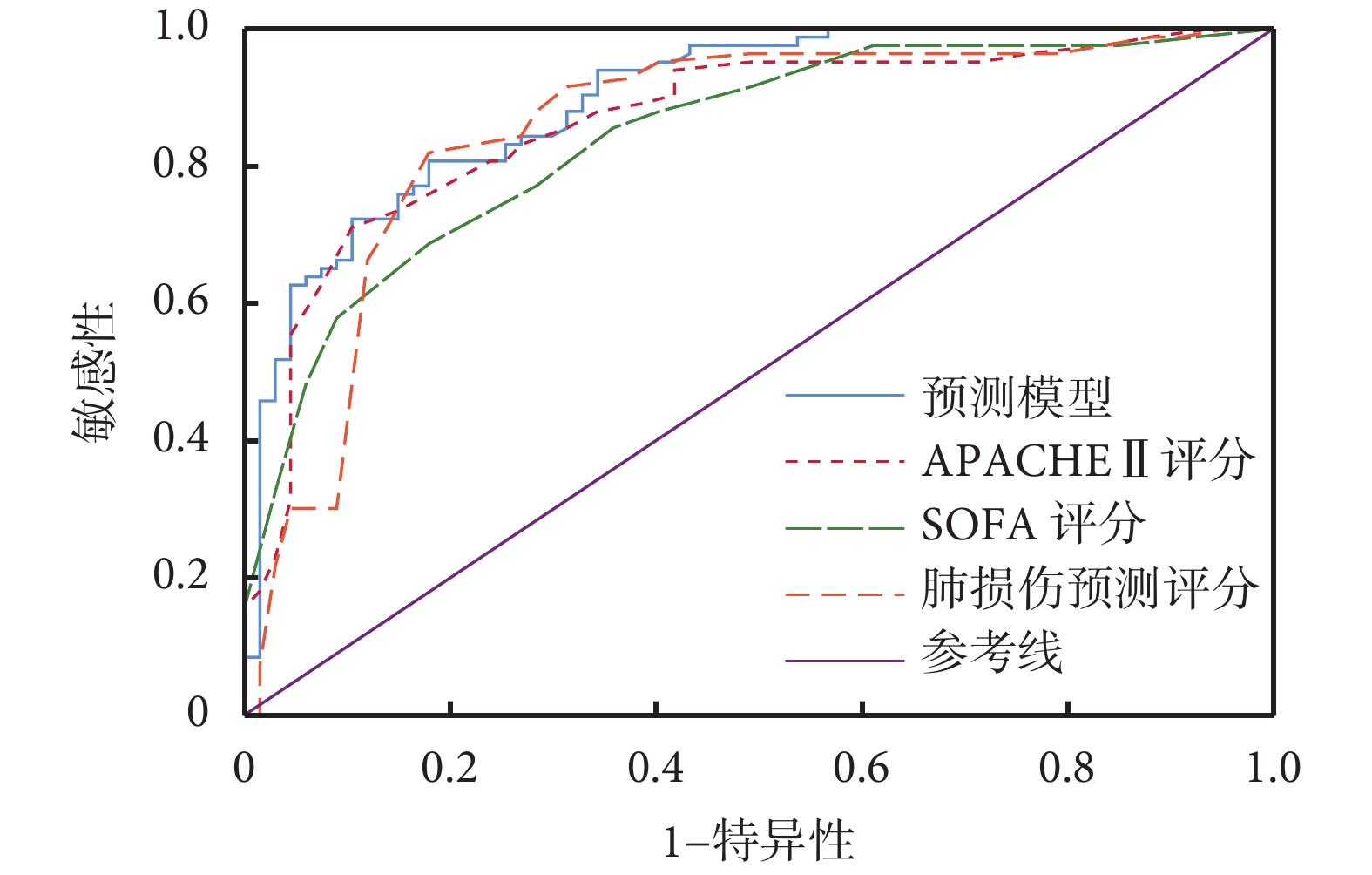 圖1
各評分系統及預測模型判斷 sARDS 患者預后的 ROC 曲線
圖1
各評分系統及預測模型判斷 sARDS 患者預后的 ROC 曲線
該預測模型的 ROC 曲線下面積大于 SOFA 評分、肺損傷預測評分和 APACHEⅡ 評分。
2.5 構建 sARDS 28 d 死亡預測的簡易評分標準
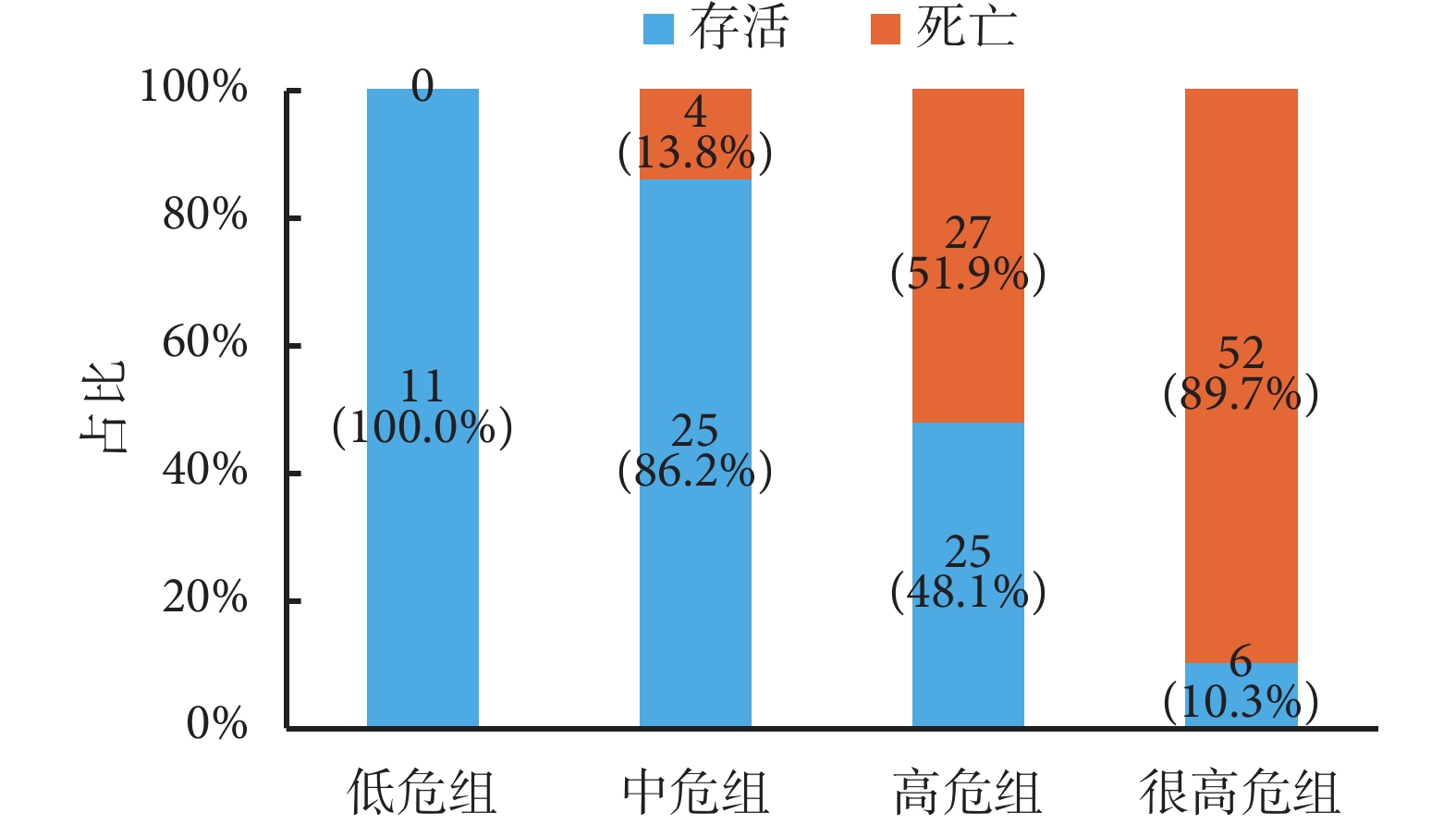
連續型變量根據 ROC 曲線得出截斷值(受累器官數目為 3 個,乳酸為 4.3 mmol/L),總分在 13~55 分,根據百分位數進行評分分級,低危組 13~23 分,中危組 24~34 分,高危組 35~45 分,極高危組>45 分。具體評分標準見表 5。將研究病例納入該評分標準,結果顯示隨著評分增加,sARDS 患者 28 d 內死亡風險增加:如果 1 個 sARDS 患者入院時評分在 13~23 分者,其生存概率基本上為 100.0%;評分在 24~34 分者,其生存概率為 86.2%、死亡概率為 13.8%;評分在 35~45 分者,其生存概率為 48.1%、死亡概率為 51.9%;危險評分>45 分者,其死亡概率為 89.7%、生存概率為 10.3%。結果見圖 2。
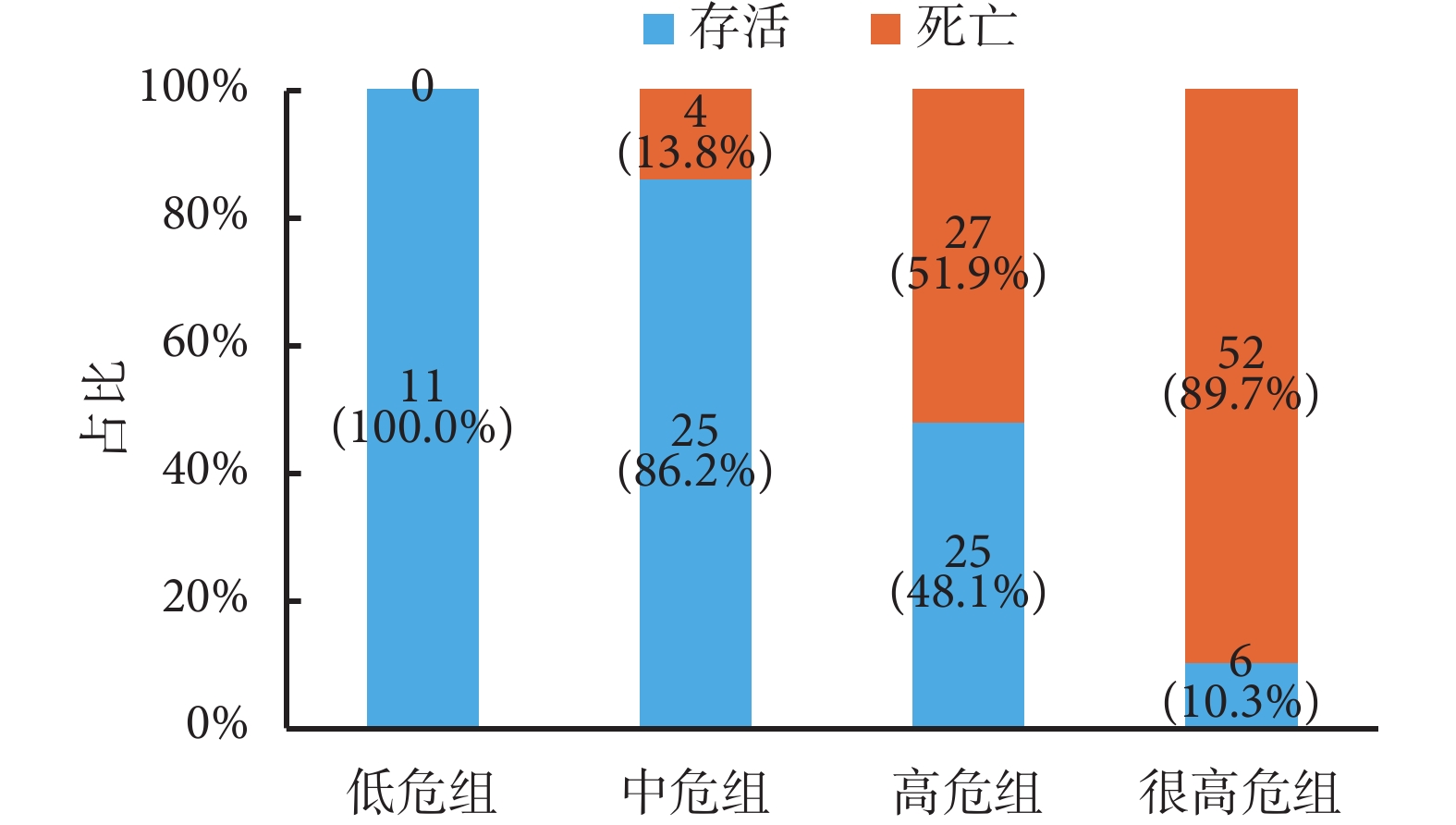 圖2
各危險分層 sARDS 患者預后分布情況
圖2
各危險分層 sARDS 患者預后分布情況
百分比堆積柱狀圖分別顯示各組 28 d 內死亡和存活患者的占比。將研究病例納入評分標準驗證,sARDS 患者 28 d 死亡概率從低危組至很高危組依次增加。
3 討論
膿毒癥是 ARDS 最常見的病因,膿毒癥和 ARDS 在發病機制也有類似之處,如炎性反應和內皮細胞功能紊亂。相比非膿毒癥誘發的 ARDS,sARDS 患者病死率更高。本研究共收集 150 例 sARDS 患者的臨床資料,其 28 d 病死率為 55.3%,和文獻報道基本一致[3]。除了 ARDS 自身不良的預后因素外,兩者的特點決定了導致膿毒癥相關預后不良的危險因素可能也影響 sARDS 患者預后,如血乳酸水平、器官衰竭數目。本研究通過收集了 54 個潛在的臨床預后不良危險因素,Logistic 回歸分析顯示需機械通氣、受累器官數目≥3 個、乳酸≥4.3 mmol/L、ARDS 嚴重程度是影響 sARDS 患者 28 d 死亡的獨立危險因子。
乳酸作為評估和指導膿毒癥尤其是膿毒性休克搶救治療的重要參考指標,同時也是膿毒癥患者不良預后的預測指標。膿毒癥并發ARDS在一定程度上增加乳酸的產生并延緩乳酸的清除。本研究發現乳酸為 sARDS 患者 28 d 死亡的獨立危險因素,當血乳酸≥4.3 mmol/L 時預測死亡的敏感性及特異性最好,與相關研究一致。而有創機械通氣是 ARDS 患者支持治療的基石,尤其是重度 ARDS 患者。本研究發現需要機械通氣是 sARDS 患者 28 d 死亡的獨立危險因素之一,可能與以下因素有關。首先,機械通氣患者容易并發呼吸相關性肺損傷,其病死率高達 29%~42%,嚴重影響危重癥患者的預后[11-12]。其次,機械通氣增加胸膜腔壓力,導致血流動力學的改變[13]。同時,以小潮氣量為主的肺保護性通氣策略容易繼發高碳酸血癥,可增強低氧性肺血管的收縮,導致肺動脈壓力增加,進而導致急性右心收縮功能障礙,增加病死率[14]。最后,機械通氣誘發的生物傷加重遠隔器官的損傷,增加病死率[15]。因此,在膿毒癥尤其是膿毒性休克基礎上,機械通氣相關不良因素可能加劇血流動力學紊亂,增加 sARDS 患者病死率。氧合指數是 ARDS 患者預后另一個重要參考指標,一項前瞻性研究分析發現氧合指數是預測病死率最準確的參數[16],而早期改善氧合指數是ARDS患者預后更好的一個因素[17]。既往研究也初步發現氧合指數及ARDS分度可能是影響重癥病毒性肺炎合并ARDS患者的預后因素[18]。在本研究也再次驗證了氧合指數是sARDS患者死亡的獨立危險因素。另外,膿毒癥是機體對感染反應失調所致的多器官功能衰竭,sARDS 本身就是膿毒癥的一個常見并發癥,一定程度上加劇各器官損傷。尤其是膿毒性休克并發 ARDS 時病死率顯著增加,是 ARDS 患者 28 d 死亡危險因素[19]。本研究發現隨著受累器官數目增加,sARDS 患者病死率增加。研究表明入院時無器官功能障礙的患者在 ICU 的病死率為 6%,而器官衰竭達 4 個或以上的患者的病死率為 65%,器官衰竭的數量與重癥監護室的病死率有直接相關性[20]。類似研究發現受累器官數目與 ARDS患者病情、死亡率呈正相關,并且受累器官數目可作為 ARDS 臨床預后的危險因素[21]。本研究發現 sARDS 患者受累器官數目≥3 個是預測患者短期死亡的截斷值,為評估該類患者病情提供了定量依據。
本研究在篩選出 sARDS 患者死亡的 4 個獨立危險因素外,進一步制定了 sARDS 患者 28 d 死亡預測評分標準。隨著評分的增加,sARDS 患者的 28 d 發生死亡的風險增加,且該評分標準對 sARDS 患者 28 d 死亡風險發生有較好的預測性。同時,上述各參數與患者預后密切相關,參數收集相對簡單,相比肺損傷預測評分、APACHEⅡ 評分,對預后也有較好的預測性,有利于臨床推廣應用。
總之,從本研究得出:(1)需機械通氣、受累器官數目≥3 個、乳酸≥4.3 mmol/L、ARDS 嚴重程度是影響 sARDS 患者 28 d 死亡的獨立危險因子;(2)依據死亡風險預測模型制定的評分標準對 sARDS 患者 28 d 死亡有較好的預測性。該評分標準可為臨床醫師客觀快速地評估 sARDS 患者入院時病情的危重程度,并早期采取積極的治療手段提供參考依據。
本研究有幾個值得評論的局限性。第一,本研究以單中心 ICU 的 sARDS 患者作為研究對象,因此最終所得出的評分標準應用于同級別的中心 ICU 會有參考價值,但要推廣至其他人群需要多中心研究來驗證。第二,本研究只收集了患者入院后 24 h 內最差的臨床數據,sARDS 患者病情是會動態變化的,多次收集一定時間間隔內的相關數據可能會增加本研究結果的有效性。第三,樣本量相對偏少。第四,評分標準還需進一步前瞻性研究進行驗證。第五,本研究為回顧性分析,數據可能存在難以避免的偏倚。
利益沖突:本研究不涉及任何利益沖突。
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是危重患者常見的臨床綜合征,膿毒癥是誘發 ARDS 主要的病因之一,稱為膿毒癥相關 ARDS(sepsis-associated acute respiratory distress syndrome,sARDS),約占 32%[1]。sARDS 的 28 d 病死率達 41.5%[2],而一些國家嚴重 sARDS 的病死率達 50%[3]。按感染部位,肺炎是導致 sARDS 最常見的誘因,占 77%,總體病死率為 46.3%,其中重度 ARDS 病死率更高,達 56.2%[4]。研究顯示,膿毒癥患者疾病嚴重程度、基礎疾病、年齡、感染部位、肺炎嚴重程度評分、肺損傷預測評分等是發生 ARDS 的相關危險因素[5-6]。進一步預測 sARDS 預后的研究尚少。研究發現影響 sARDS 不良預后因素包括肺損傷評分、急性生理學和慢性健康狀況評價 Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)評分、是否使用血管活性藥物、是否機械通氣、血乳酸、降鈣素原(procalcitonin,PCT)水平等[5, 7-8],上述因素存在預測效能欠佳或操作復雜以及未進行有效的臨床驗證等弊端,導致臨床難以推廣應用。因此,本研究擬通過回顧性分析篩選影響 sARDS 28 d 死亡的不良預后的危險因素,進一步構建 sARDS 短期死亡風險評分標準,以期為臨床醫師客觀快速地評估 sARDS 患者入院時病情的危重程度,并及時甚至預見性采取積極的治療手段提供參考依據。
1 資料與方法
1.1 臨床資料
采用回顧性研究方法,選取 2013 年 1 月 1 日—2020 年 8 月 31 日在南華大學附屬第一醫院重癥加強治療病房(intensive care unit,ICU)診斷為 sARDS 的患者作為研究對象。納入標準:(1)年齡大于 18 歲;(2)符合 ARDS 柏林定義診斷標準[9];(3)符合 Sepsis 3.0 膿毒癥診斷標準[10]。排除標準:(1)入院 24 h 內死亡;(2)放棄積極治療;(3)孕婦或者哺乳期婦女;(4)臨床資料不全或病史不詳。
本研究符合醫學倫理學標準,并通過醫院醫學倫理委員會批準(倫理批號20200609)。
1.2 方法
1.2.1 觀察終點及分組
根據 sARDS 患者入 ICU 后 28 d 內是否死亡,將患者分為存活組及死亡組。
1.2.2 收集指標
收集了 54 個可能導致 sARDS 患者 28 d 內不良結局的危險因素:發病時間、入科時體溫、脈搏、呼吸、平均動脈壓、血糖、受累器官數目、白細胞計數、中性粒細胞絕對值、中性粒細胞百分比、淋巴細胞計數、血小板計數、血紅蛋白濃度、纖維蛋白原濃度、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、凝血酶原時間(prothrombin time,PT)、總膽紅素、直接膽紅素、間接膽紅素、谷丙轉氨酶(alanine transaminase,ALT)、谷草轉氨酶(aspartate transaminase,AST)、肌酐、尿素氮、心肌酶、肌鈣蛋白 T、C 反應蛋白(C-reactive protein,CRP)、PCT、D-二聚體、白細胞介素-6(interleukin-6,IL-6)、乳酸、腦鈉肽(brain natriuretic peptide,BNP)、實際二氧化碳分壓、氧合指數、性別、年齡、ARDS 嚴重程度、有無高血壓等基礎疾病、感染部位、有無機械通氣等。
1.2.3 評分標準的建立
評分標準建立原則:(1)基礎評分:將β值最小的危險因素的基礎評分定為 1 分,其余各危險因素的基礎評分為其回歸系數 β 值與最小 β 值的比值。(2)等級評分:無序分類變量與連續數值型變量的等級評分為 1 分;有序分類變量的最低等級者等級評分為 1 分,以后每提高一個等級加 1 分。(3)最終評分為基礎評分與等級評分相乘。
1.3 統計學方法
采用 IBM SPSS 25 統計軟件。呈正態分布的計量資料采用均數±標準差( ±s)表示,計數資料采用百分率表示;缺失值中計數資料予以眾數代替,計量資料予以平均值代替。首先,對潛在危險因素進行單因素 Logistic 回歸分析,P<0.05 表示潛在危險因素在死亡組和生存組間差異具有統計學意義。然后,將存在顯著差異的潛在危險因素進行向前-LR 法的多因素 Logistic 回歸分析,以 P<0.05 為選入多因素回歸方程的必要條件。預測的擬合優度采用Hosmer-Lemeshow χ2 檢驗,P>0.05 代表模型校準度好,預測值與實際觀察值相近。預測的準確度是對 sARDS 患者 28 d 內是否死亡的區別能力,通過受試者操作特征(receiver operating characteristic,ROC)曲線下面積來檢驗。曲線下面積≥0.7 代表該模型預測的準確度較高,且曲線下面積越接近1代表模型預測準確度越好。
±s)表示,計數資料采用百分率表示;缺失值中計數資料予以眾數代替,計量資料予以平均值代替。首先,對潛在危險因素進行單因素 Logistic 回歸分析,P<0.05 表示潛在危險因素在死亡組和生存組間差異具有統計學意義。然后,將存在顯著差異的潛在危險因素進行向前-LR 法的多因素 Logistic 回歸分析,以 P<0.05 為選入多因素回歸方程的必要條件。預測的擬合優度采用Hosmer-Lemeshow χ2 檢驗,P>0.05 代表模型校準度好,預測值與實際觀察值相近。預測的準確度是對 sARDS 患者 28 d 內是否死亡的區別能力,通過受試者操作特征(receiver operating characteristic,ROC)曲線下面積來檢驗。曲線下面積≥0.7 代表該模型預測的準確度較高,且曲線下面積越接近1代表模型預測準確度越好。
2 結果
2.1 患者的基本臨床資料
本研究最終納入150例sARDS患者,其中女52例(34.7%),男 98 例(65.3%)。存活組 67 例,死亡組 83 例,病死率為 55.3%。
2.2 單因素 Logistic 回歸分析 sARDS 患者 28 d 死亡的危險因素
sARDS 患者 28 d 內死亡的預后不良因素根據不同數據類型分為連續型變量和分類變量(二分類、多分類、等級)。單因素 Logistic 回歸分析結果顯示有 20 個潛在危險因素進入多因素回歸分析(P<0.05):平均動脈壓(P<0.01)、受累器官數目(P<0.01)、中性粒細胞百分比(P=0.015)、血小板計數(P=0.001)、纖維蛋白原(P<0.001)、直接膽紅素(P=0.049)、肌酐(P=0.001)、尿素氮(P=0.003)、乳酸脫氫酶(P=0.049)、肌酸激酶同工酶(P=0.029)、氧合指數(P<0.01)、實際二氧化碳分壓(P=0.002)、乳酸(P<0.001)、ARDS 嚴重程度(P<0.01)、感染部位(P=0.013)、APTT(P=0.034)、PT(P=0.013)、PCT(P=0.002)、BNP(P=0.048)、有無機械通氣(P<0.01)。由于 IL-6 數據缺失值過多,刪除缺失值數據后,將剩下的 50 例數據進行單因素分析,結果顯示兩組差異無統計學意義(P>0.05)。具體分析結果見表 1和表 2。
 )
)
2.3 多因素 Logistic 回歸分析構建 sARDS 患者 28 d 死亡預測模型
多因素 Logistic 回歸分析得出需機械通氣、乳酸≥4.3 mmol/L、受累器官數目≥3 個、ARDS 嚴重程度為 sARDS 患者 28 d 死亡的獨立危險因素(表 3)。構建 sARDS 患者 28 d 死亡預測模型的方程為P=ea/(1+ea),a=–7.418+1.649×有無機械通氣(0 或 1)+0.384×是否受累器官數目≥3 個(0 或 1)+0.139×是否乳酸≥4.3 mmol/L(0 或 1)+1.845×ARDS 嚴重程度(0 或 1 或 2)。預測模型中 e 為指數函數,P 為 sARDS 28 d 死亡的概率。公式中各變量賦值:在二分類變量“有無機械通氣”、“受累器官數目≥3 個”和“乳酸≥4.3 mmol/L”中,0 代表“無”或“否”,1 代表“有”或“是”;在等級變量“ARDS 嚴重程度”中,0 代表“輕度 ARDS”,1 代表“中度 ARDS”,2 代表“重度 ARDS”。采用 Hosmer-Lemeshow χ2 檢驗預測模型的擬合優度為χ2=5.393,P=0.715,ν=8,代表模型校準度好,預測值與實際觀察值相近。
2.4 ROC 曲線評價 sARDS 28 d 死亡預測模型與相關評分系統的預測性能
該預測模型預測患者死亡的 ROC 曲線下面積為 0.896,95% 可信區間 0.846~0.945,SE=0.025,代表該模型預測準確度較高,結果見圖 1。而肺損傷預測評分、APACHEⅡ 評分和序貫器官衰竭評分(sequential organ failure assessment,SOFA)評分 ROC 曲線下面積分別為 0.855、0.865和0.841,均稍低于該預測模型。各評分系統及預測模型對 sARDS 患者預后判斷效能比較見表 4。
 圖1
各評分系統及預測模型判斷 sARDS 患者預后的 ROC 曲線
圖1
各評分系統及預測模型判斷 sARDS 患者預后的 ROC 曲線
該預測模型的 ROC 曲線下面積大于 SOFA 評分、肺損傷預測評分和 APACHEⅡ 評分。
2.5 構建 sARDS 28 d 死亡預測的簡易評分標準
連續型變量根據 ROC 曲線得出截斷值(受累器官數目為 3 個,乳酸為 4.3 mmol/L),總分在 13~55 分,根據百分位數進行評分分級,低危組 13~23 分,中危組 24~34 分,高危組 35~45 分,極高危組>45 分。具體評分標準見表 5。將研究病例納入該評分標準,結果顯示隨著評分增加,sARDS 患者 28 d 內死亡風險增加:如果 1 個 sARDS 患者入院時評分在 13~23 分者,其生存概率基本上為 100.0%;評分在 24~34 分者,其生存概率為 86.2%、死亡概率為 13.8%;評分在 35~45 分者,其生存概率為 48.1%、死亡概率為 51.9%;危險評分>45 分者,其死亡概率為 89.7%、生存概率為 10.3%。結果見圖 2。
 圖2
各危險分層 sARDS 患者預后分布情況
圖2
各危險分層 sARDS 患者預后分布情況
百分比堆積柱狀圖分別顯示各組 28 d 內死亡和存活患者的占比。將研究病例納入評分標準驗證,sARDS 患者 28 d 死亡概率從低危組至很高危組依次增加。
3 討論
膿毒癥是 ARDS 最常見的病因,膿毒癥和 ARDS 在發病機制也有類似之處,如炎性反應和內皮細胞功能紊亂。相比非膿毒癥誘發的 ARDS,sARDS 患者病死率更高。本研究共收集 150 例 sARDS 患者的臨床資料,其 28 d 病死率為 55.3%,和文獻報道基本一致[3]。除了 ARDS 自身不良的預后因素外,兩者的特點決定了導致膿毒癥相關預后不良的危險因素可能也影響 sARDS 患者預后,如血乳酸水平、器官衰竭數目。本研究通過收集了 54 個潛在的臨床預后不良危險因素,Logistic 回歸分析顯示需機械通氣、受累器官數目≥3 個、乳酸≥4.3 mmol/L、ARDS 嚴重程度是影響 sARDS 患者 28 d 死亡的獨立危險因子。
乳酸作為評估和指導膿毒癥尤其是膿毒性休克搶救治療的重要參考指標,同時也是膿毒癥患者不良預后的預測指標。膿毒癥并發ARDS在一定程度上增加乳酸的產生并延緩乳酸的清除。本研究發現乳酸為 sARDS 患者 28 d 死亡的獨立危險因素,當血乳酸≥4.3 mmol/L 時預測死亡的敏感性及特異性最好,與相關研究一致。而有創機械通氣是 ARDS 患者支持治療的基石,尤其是重度 ARDS 患者。本研究發現需要機械通氣是 sARDS 患者 28 d 死亡的獨立危險因素之一,可能與以下因素有關。首先,機械通氣患者容易并發呼吸相關性肺損傷,其病死率高達 29%~42%,嚴重影響危重癥患者的預后[11-12]。其次,機械通氣增加胸膜腔壓力,導致血流動力學的改變[13]。同時,以小潮氣量為主的肺保護性通氣策略容易繼發高碳酸血癥,可增強低氧性肺血管的收縮,導致肺動脈壓力增加,進而導致急性右心收縮功能障礙,增加病死率[14]。最后,機械通氣誘發的生物傷加重遠隔器官的損傷,增加病死率[15]。因此,在膿毒癥尤其是膿毒性休克基礎上,機械通氣相關不良因素可能加劇血流動力學紊亂,增加 sARDS 患者病死率。氧合指數是 ARDS 患者預后另一個重要參考指標,一項前瞻性研究分析發現氧合指數是預測病死率最準確的參數[16],而早期改善氧合指數是ARDS患者預后更好的一個因素[17]。既往研究也初步發現氧合指數及ARDS分度可能是影響重癥病毒性肺炎合并ARDS患者的預后因素[18]。在本研究也再次驗證了氧合指數是sARDS患者死亡的獨立危險因素。另外,膿毒癥是機體對感染反應失調所致的多器官功能衰竭,sARDS 本身就是膿毒癥的一個常見并發癥,一定程度上加劇各器官損傷。尤其是膿毒性休克并發 ARDS 時病死率顯著增加,是 ARDS 患者 28 d 死亡危險因素[19]。本研究發現隨著受累器官數目增加,sARDS 患者病死率增加。研究表明入院時無器官功能障礙的患者在 ICU 的病死率為 6%,而器官衰竭達 4 個或以上的患者的病死率為 65%,器官衰竭的數量與重癥監護室的病死率有直接相關性[20]。類似研究發現受累器官數目與 ARDS患者病情、死亡率呈正相關,并且受累器官數目可作為 ARDS 臨床預后的危險因素[21]。本研究發現 sARDS 患者受累器官數目≥3 個是預測患者短期死亡的截斷值,為評估該類患者病情提供了定量依據。
本研究在篩選出 sARDS 患者死亡的 4 個獨立危險因素外,進一步制定了 sARDS 患者 28 d 死亡預測評分標準。隨著評分的增加,sARDS 患者的 28 d 發生死亡的風險增加,且該評分標準對 sARDS 患者 28 d 死亡風險發生有較好的預測性。同時,上述各參數與患者預后密切相關,參數收集相對簡單,相比肺損傷預測評分、APACHEⅡ 評分,對預后也有較好的預測性,有利于臨床推廣應用。
總之,從本研究得出:(1)需機械通氣、受累器官數目≥3 個、乳酸≥4.3 mmol/L、ARDS 嚴重程度是影響 sARDS 患者 28 d 死亡的獨立危險因子;(2)依據死亡風險預測模型制定的評分標準對 sARDS 患者 28 d 死亡有較好的預測性。該評分標準可為臨床醫師客觀快速地評估 sARDS 患者入院時病情的危重程度,并早期采取積極的治療手段提供參考依據。
本研究有幾個值得評論的局限性。第一,本研究以單中心 ICU 的 sARDS 患者作為研究對象,因此最終所得出的評分標準應用于同級別的中心 ICU 會有參考價值,但要推廣至其他人群需要多中心研究來驗證。第二,本研究只收集了患者入院后 24 h 內最差的臨床數據,sARDS 患者病情是會動態變化的,多次收集一定時間間隔內的相關數據可能會增加本研究結果的有效性。第三,樣本量相對偏少。第四,評分標準還需進一步前瞻性研究進行驗證。第五,本研究為回顧性分析,數據可能存在難以避免的偏倚。
利益沖突:本研究不涉及任何利益沖突。