引用本文: 彭玲, 張華, 童霞, 張鑫, 張蘭蘭. 基于單細胞 RNA 測序分析高內皮細胞小靜脈對慢性阻塞性肺疾病患者肺免疫細胞招募作用. 中國呼吸與危重監護雜志, 2022, 21(3): 170-177. doi: 10.7507/1671-6205.202201039 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
高內皮細胞小靜脈(high endothelial venule,HEV)是介導淋巴細胞搬運到淋巴結和其他次級淋巴器官的專門血管[1-3]。通過提高淋巴細胞從血液中外滲,HEV 在淋巴細胞再循環和對外來入侵者(細菌和病毒感染)以及人體自身細胞的改變(癌癥中的新抗原)的免疫監測中發揮著重要作用。HEV 在免疫刺激的淋巴結的炎癥期間擴張,并在轉移和腫瘤排泄的淋巴結中擴增[4-5]。表達高水平 HEV 特異性硫酸化 MECA-79 抗原的 HEV 樣血管在許多人類炎癥和過敏性疾病(包括類風濕性關節炎、克羅恩病、過敏性鼻炎和哮喘)的慢性炎癥部位非淋巴組織中被誘導,這種血管被認為有助于慢性炎癥的放大和維持[6]。而慢性炎癥是慢性阻塞性肺疾病(簡稱慢阻肺)的主要發病因素[7-9]。Blanchard 等[6]的研究發現 MECA-79+腫瘤相關 HEV 在人類腫瘤中CD3+ T 淋巴細胞豐富的區域或 CD20+ B 淋巴細胞豐富的三級淋巴結構中高表達。同時,既往文獻報道慢阻肺患者的肺部存在 B 淋巴細胞濾泡[10]。但是關于慢阻肺和 HEV 的關系,未見相關文獻報道,需進一步探索。本研究利用生物信息學方法,通過對公共數據庫高通量基因表達數據庫(gene expression omnibus,GEO)數據的挖掘,選擇單細胞測序分析數據庫,旨在從單細胞水平了解慢阻肺是否存在 HEV 內皮細胞,其是否具備招募免疫細胞的作用,進一步分析其信號通路及相關的調控途徑。
1 資料與方法
1.1 數據收集
通過 GEO 數據庫檢索慢阻肺患者肺組織單細胞 RNA 測序(single-cell RNA sequencing,scRNA-seq)數據,下載 GSE136831 數據集用于分析[11]。
1.2 細胞測序數據分析流程
1.2.1 scRNA-seq 數據處理
使用 Seurat v3.6.2 版本分析 scRNA-seq 數據[12]。Seurat 分析標準流程:(1)導入數據,創建 Seurat 對象。(2)質量控制,選擇需要分析的細胞,質控標準為:① 排除少于 200 個基因或大于7500 的單個細胞;② 排除線粒體>25% 的單個細胞[13-14]。雙細胞排除標準是分子標簽過高和在同一剪輯中表達兩個或多個標記基因的單細胞[15]。(3)分別執行 LogNormalize()對每個數據進行標準化,使用 FindVariableFeatures()函數鑒定在細胞間表達高度變化的基因,使用 ScaleData()對數據進行縮放。采用 Harmony[16]整合每個器官的樣本,繼而進行主成分分析(principal component analysis,PCA)線性降維、細胞聚類、統一流形逼近與投影(uniform manifold approximation and projection,UMAP)非線性降維。(4)基因可視化。參考文獻[16]的方法,本研究在 PCA 和 UMAP 分析中選取具有統計學意義(P<0.05)且排列前 20 個的主成分。
1.2.2 細胞類型識別
參考文獻[17-18]的方法,細胞類型的確定主要通過“FindAllMarkers”、經典的細胞標記基因、使用 R 包(clustermole、singscore)預測聯合完成。“FindAllMarkers”中,通過確定每個簇中表達最高的基因及其重要功能來確定基因是否為標記基因。最小分數為 25%,對數轉換的倍數變化閾值為 0.25(
1.2.3 差異基因富集分析
以 avg_log2 FC>0.25 作為截尾值,分析慢阻肺患者和健康對照組者肺組織細胞的差異基因。使用基因本體論(gene ontology,GO)富集分析對差異基因進行富集分析,確認涉及免疫調節的差異基因,同時使用 AUCell 對富集到的相關信號通路基因集在不同亞群細胞上進行打分,分值以不同色階區別,其中黃色得分高,黑色得分低[24]。
1.2.4 擬時序分析
利用 R 包 monocle3 v1.0.0構建單細胞軌跡分析[25]。輸入標記為靜脈內皮細胞及其子集信息,對單細胞進行排序構建細胞軌跡,并構建單個基因的擬時軌跡。利用 R 包 monocle2 進行分支點分析[26]。
1.2.5 配體–受體相互作用分析
按照 NicheNet 的詳細說明[27]進行。本研究重點關注 HEV 內皮細胞與 T 淋巴細胞、B 淋巴細胞、樹突狀細胞之間的細胞互作,感興趣的基因集是慢阻肺組和健康對照組之間差異表達的基因。數據分析流程參考網址為
1.3 統計學方法
采用 GraphPad Prism 8.0 或 R 語言進行。計算來自慢阻肺、健康對照組的每個樣本中細胞類型的比例,并應用了t檢驗。使用 Wilcoxon 秩和統計檢驗對每個集群差異基因進行分析。P<0.05 和 avg_log2 FC>0.25 的差異基因用作通路富集分析的輸入。使用 Spearman 相關系數計算兩個樣本參數的相關分析。P<0.05 為差異有統計學意義。所有功能數據圖均顯示均數±標準誤。
2 結果
2.1 慢阻肺和健康人肺組織的細胞亞群分析
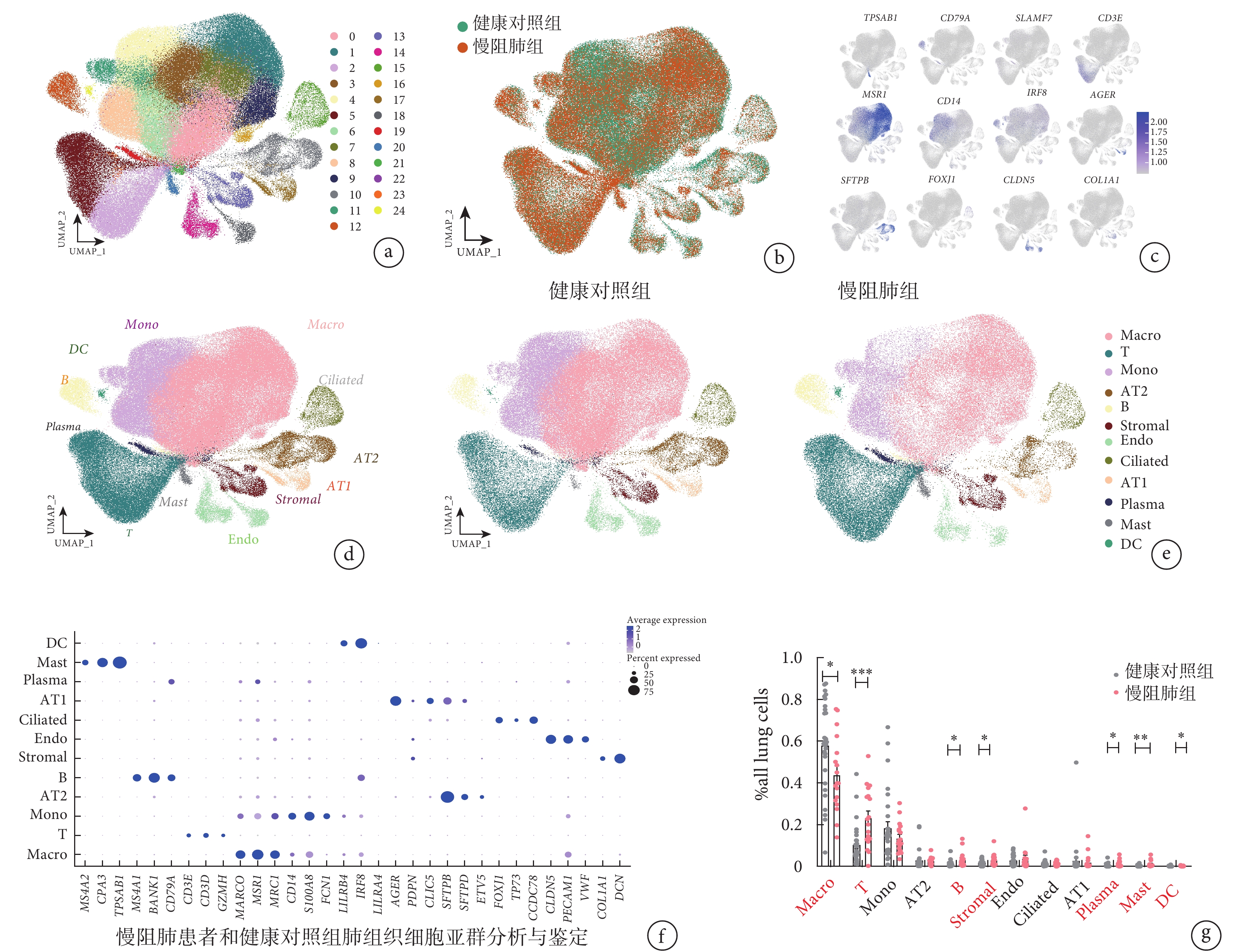
GSE136831 數據集包含了 18 例慢阻肺組患者及 28 例健康對照組。對該數據集中的肺細胞進行細胞亞群預測分析,得到了至少 25 種不同的細胞亞群(圖 1a),以及 219257 個細胞的圖譜,其中健康對照組有 133827 個細胞,慢阻肺組有 85430 個細胞(圖 1b)。基因標記結果顯示,這些肺細胞中有 12 種標記基因存在高表達(圖 1c);使用“FindAllMarkers”包對肺細胞進行的肺細胞亞群分析結果顯示,預測到 12 種不同的細胞亞群,分別為 T 淋巴細胞、B 淋巴細胞、漿細胞、巨噬細胞、單核細胞、樹突狀細胞、間質細胞、內皮細胞、Ⅰ 型肺泡上皮細胞、Ⅱ 型肺泡上皮細胞、纖毛細胞、肥大細胞(圖 1d~f),其中 T 淋巴細胞、B 淋巴細胞、漿細胞、肥大細胞和樹突狀細胞在慢阻肺組占比高于健康對照組,而巨噬細胞在健康對照組中高于慢阻肺(圖 1g)。
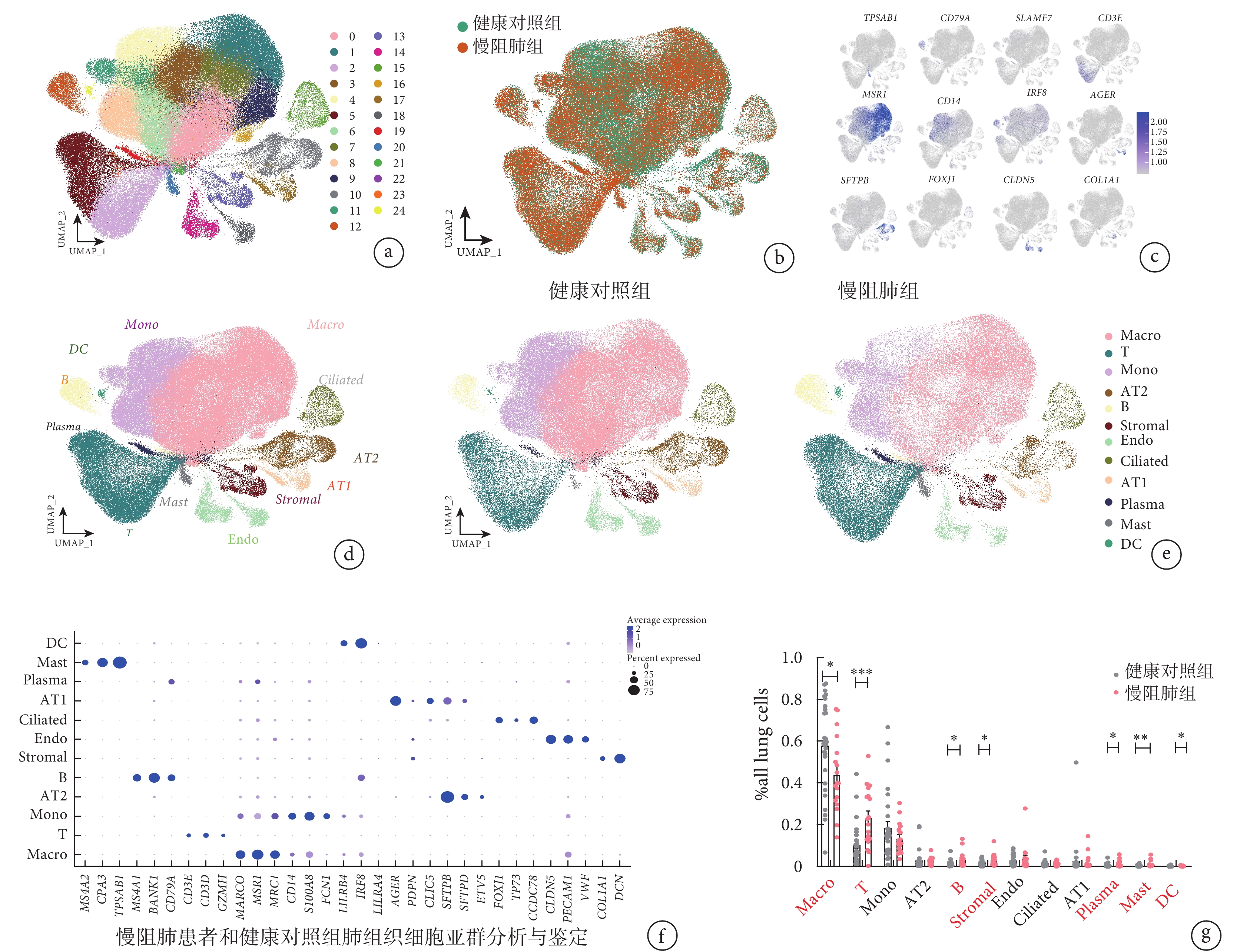 圖1
慢阻肺組患者和健康對照組肺組織細胞亞群分析和鑒定
圖1
慢阻肺組患者和健康對照組肺組織細胞亞群分析和鑒定
a~b. 慢阻肺組患者及健康對照組的肺組織細胞聚類分析 UMAP 圖,分為 25 個群。c. 12 種高表達標記基因的 UMAP 圖。d. UMAP 圖顯示的 12 種肺細胞亞群。其中,T:T 淋巴細胞;B:B 淋巴細胞;Plasma:漿細胞;Macro:巨噬細胞;Mono:單核細胞;DC:樹突狀細胞;Stromal:間質細胞;Endo:內皮細胞;AT1:Ⅰ 型肺泡上皮細胞;AT2:Ⅱ 型肺泡上皮細胞;Ciliated:纖毛細胞;Mast:肥大細胞。e. 慢阻肺組和健康對照組肺細胞不同細胞亞群分布情況的 UMAP 圖比較。f. 各細胞亞群標記基因在全部細胞亞群表達情況的散點圖。g. 12 種細胞亞群在慢阻肺組患者和健康對照組全肺細胞中的占比比較,慢阻肺組患者 B 淋巴細胞、漿細胞、肥大細胞、樹突狀細胞、間質細胞、T 淋巴細胞比例顯著升高,巨噬細胞比例較健康對照組下降。*
2.2 HEV 內皮細胞亞群鑒定分析
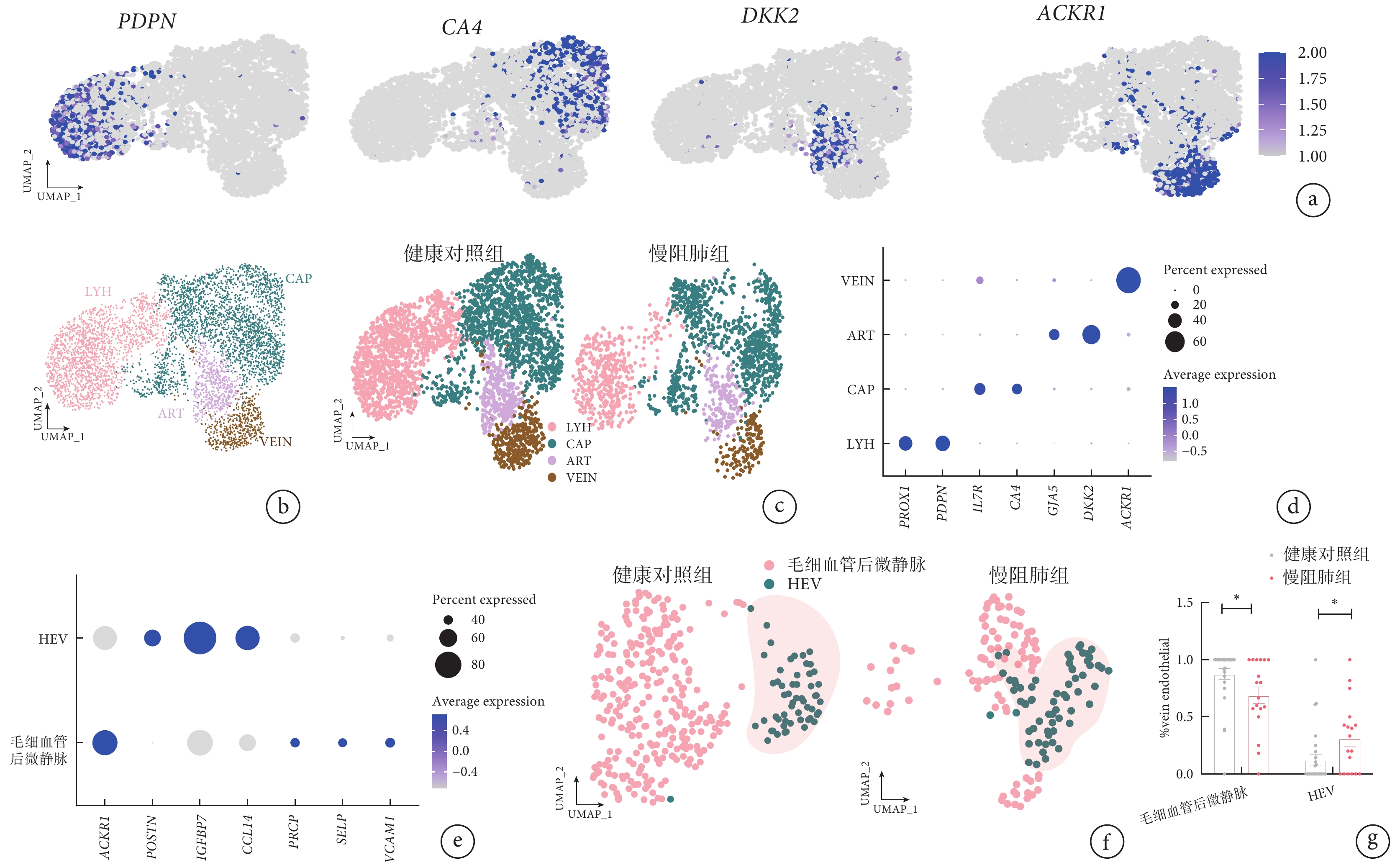
使用不同的內皮標記基因對肺細胞進行的細胞亞群分類結果顯示,淋巴管內皮 PDPN 基因、毛細血管內皮 CA4 基因、動脈內皮 DKK2 基因、靜脈內皮 ACKR1 基因在不同細胞群呈現高表達(圖 2a),內皮細胞亞群在慢阻肺組患者和健康對照組中呈現了明顯差異(圖 2b~c)。根據 HEV 內皮細胞標記基因結果,揭示肺細胞中存在 HEV 內皮細胞亞群(圖 2e~f),而且慢阻肺組和健康對照組肺細胞中 HEV 內皮細胞數量存在差異(圖 2f),與健康對照組比較,慢阻肺組肺細胞中的 HEV 內皮細胞比例明顯增多(圖 2g)。
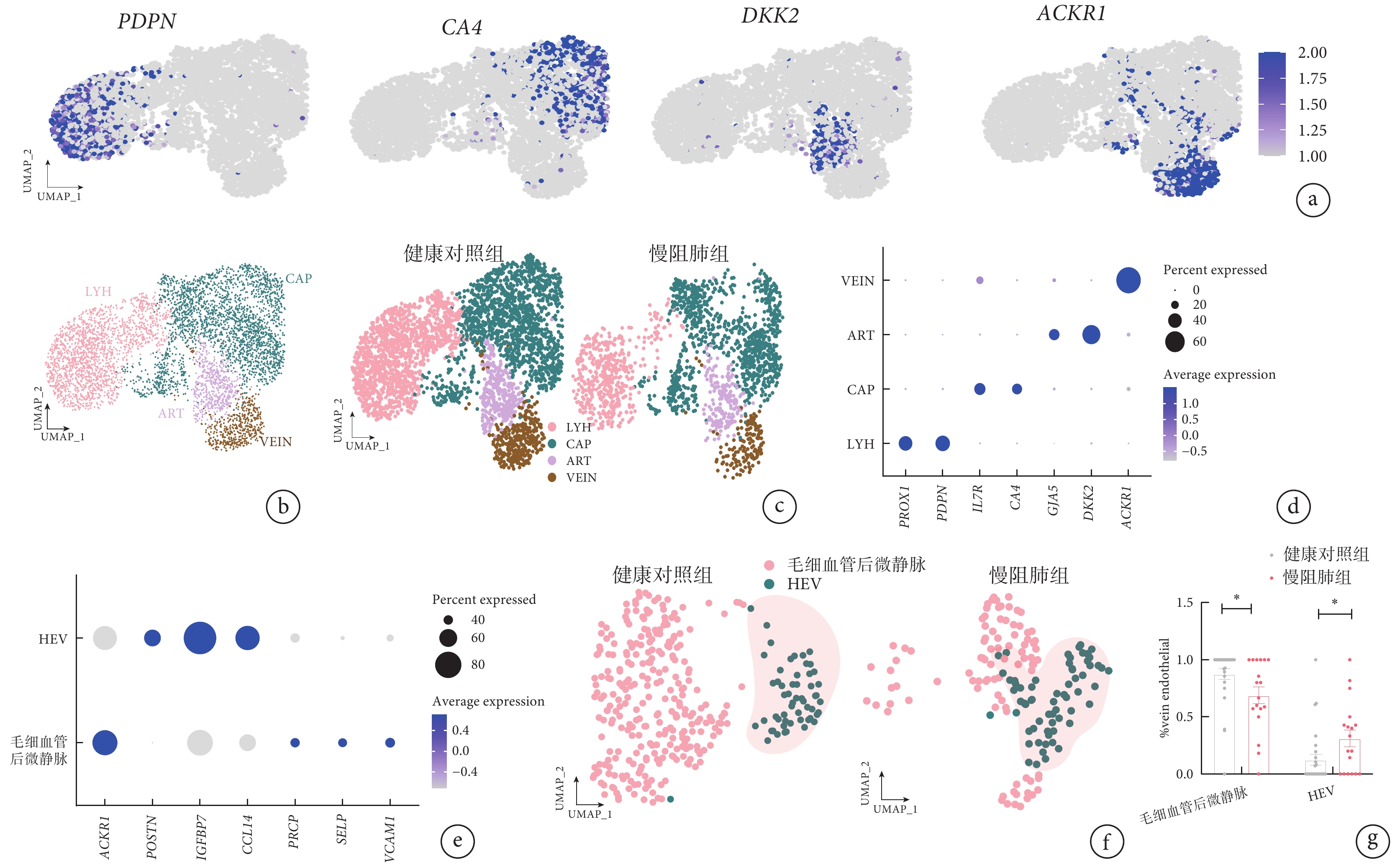 圖2
慢阻肺組患者和健康對照組肺組織血管內皮細胞亞群鑒定
圖2
慢阻肺組患者和健康對照組肺組織血管內皮細胞亞群鑒定
a. 4 種肺血管內皮標記基因的 UMAP 圖。其中,
2.3 HEV 內皮細胞亞群差異基因分析
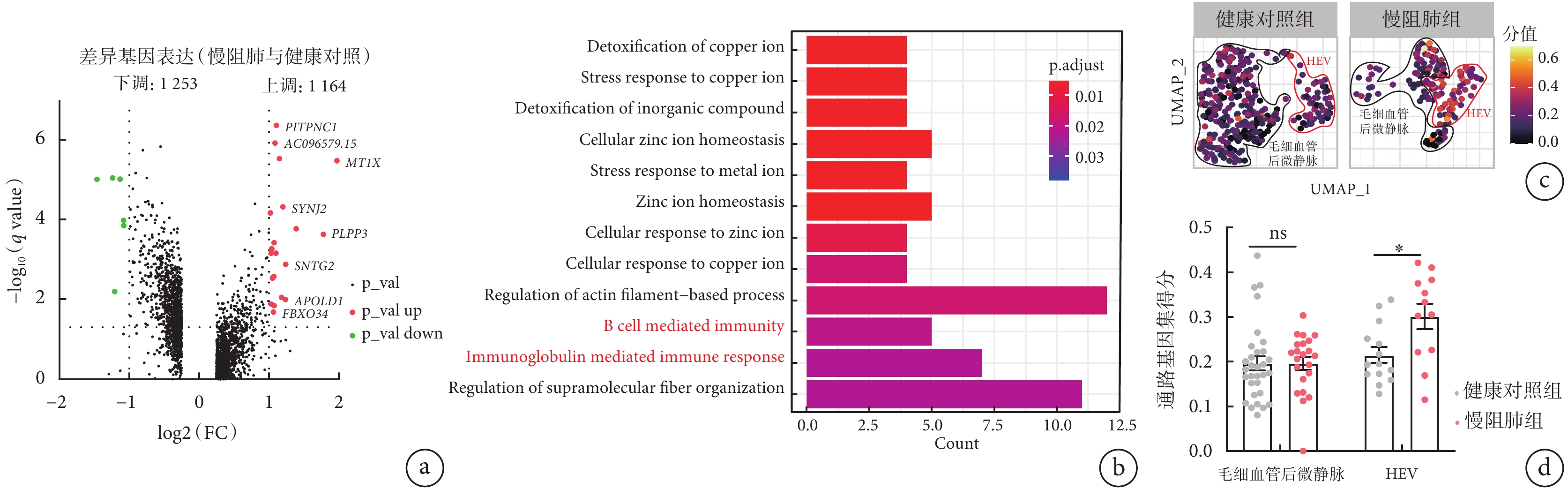
以 avg_log2 FC>0.25 作為截尾值,對慢阻肺組患者和健康對照組肺組織中 HEV 內皮細胞進行的差異基因分析結果顯示,慢阻肺組患者有 1253 個下調基因和 1164 個上調基因(圖 3a)。GO 富集分析發現差異基因中的 CD55、SWAP70、IL4R、MSH2、IGHA1、IGLL5、IGHG1、IGLC28 參與了 B 淋巴細胞介導的免疫和免疫球蛋白介導的免疫應答,HEV 內皮細胞亞群也富集到 B 淋巴細胞介導的免疫和免疫球蛋白介導的免疫應答相關的信號通路(圖 3b中紅色標注文字)。慢阻肺組患者較健康對照組中 HEV 內皮細胞亞群富集免疫相關信號通路基因集得分高,而慢阻肺組患者與健康對照組在毛細血管后微靜脈內皮細胞富集免疫相關信號通路基因集得分沒有統計學差異(圖 3c、d)。這提示慢阻肺組患者的 HEV 內皮細胞較健康對照組明顯富集免疫相關信號通路,且差異有統計學意義。
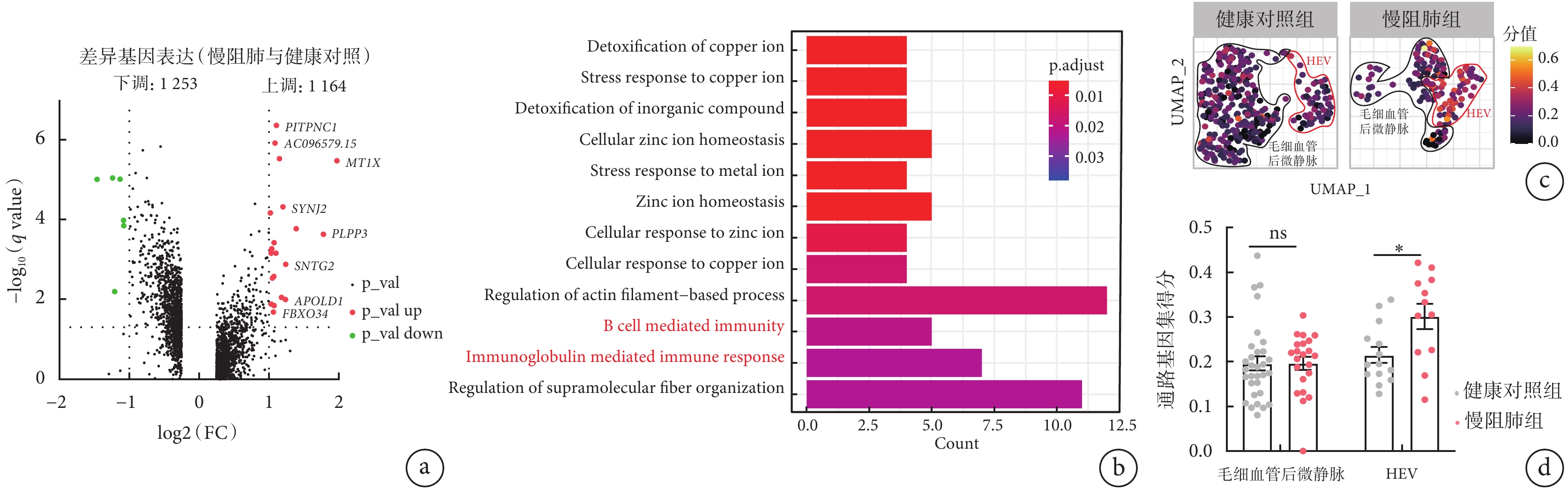 圖3
慢阻肺組患者和健康對照組肺組織 HEV 內皮細胞亞群的差異基因分析
圖3
慢阻肺組患者和健康對照組肺組織 HEV 內皮細胞亞群的差異基因分析
a. 慢阻肺組患者與健康對照組中 HEV 內皮細胞亞群中的差異基因火山圖。相對于健康對照組,慢阻肺組患者上調的基因有 1164 個,下調的基因有 1253 個。b. 差異基因的 GO 富集分析圖。HEV 內皮細胞亞群富集到 B 淋巴細胞免疫和免疫球蛋白介導的免疫應答相關的信號通路。c. 慢阻肺組患者與健康對照組中 HEV 內皮細胞亞群富集到 B 淋巴細胞免疫和免疫球蛋白介導的免疫應答相關的信號通路的差異基因 UMAP 圖。d. 慢阻肺組患者與健康對照組中 HEV 內皮細胞亞群富集免疫相關信號通路基因集得分比較。慢阻肺組患者的 HEV 內皮細胞較健康對照組明顯富集免疫相關信號通路,且差異有統計學意義。*
2.4 HEV 內皮細胞的擬時序軌跡分析
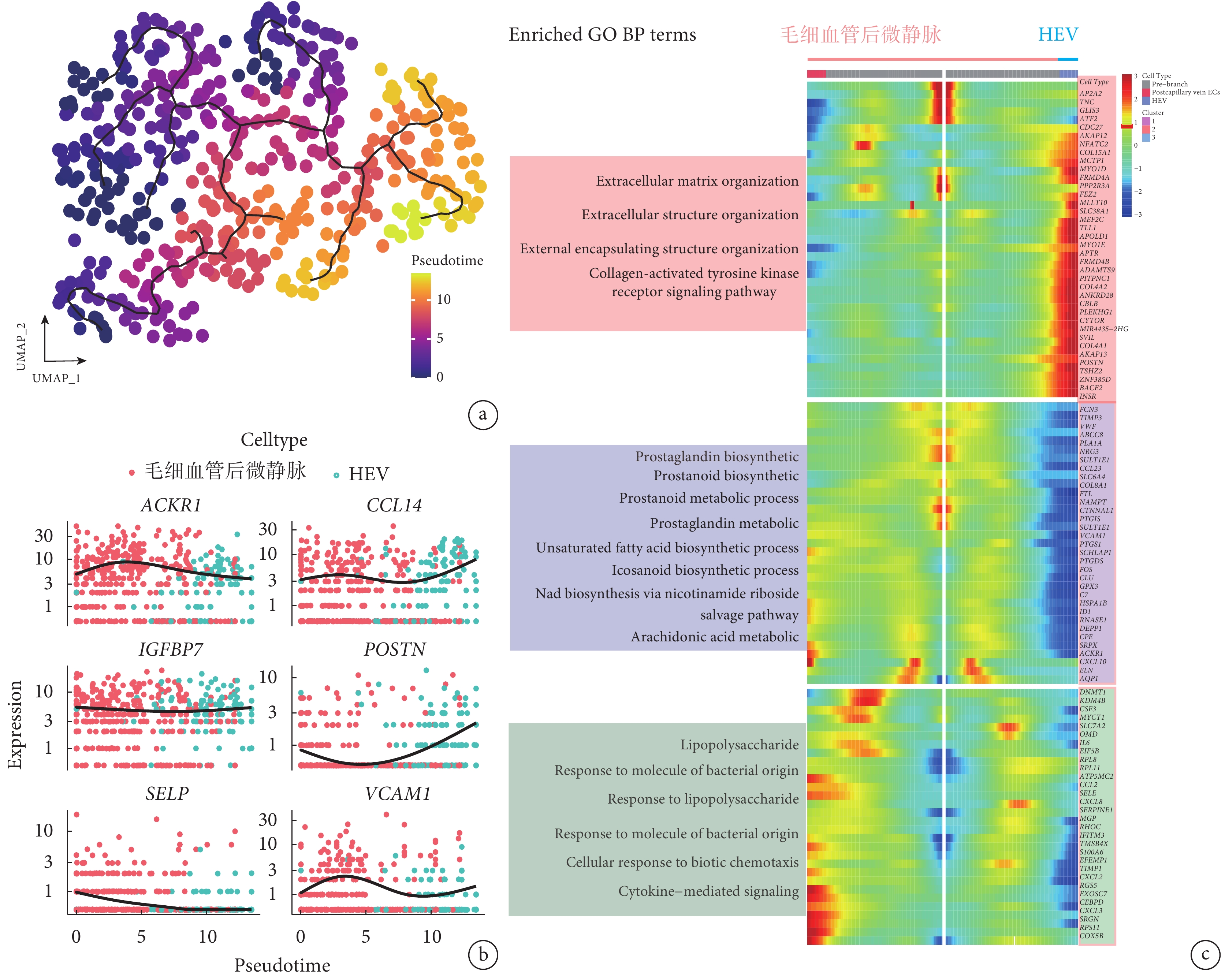
擬時序軌跡分析結果顯示,利用 monocle2 和 monocle3 分析細胞發育軌跡,可得到肺血管內皮細胞的發育軌跡(圖 4a)。進一步分析發現,ACKR1 和 SELP 基因在發育軌跡中逐漸下降,而 CCL14 和 POSTN 基因逐漸升高(圖 4b)。利用發育軌跡熱圖分析了 HEV 內皮細胞各個階段富集的基因表達,結果顯示參與基質重構的相關基因表達上升(圖 4c)。
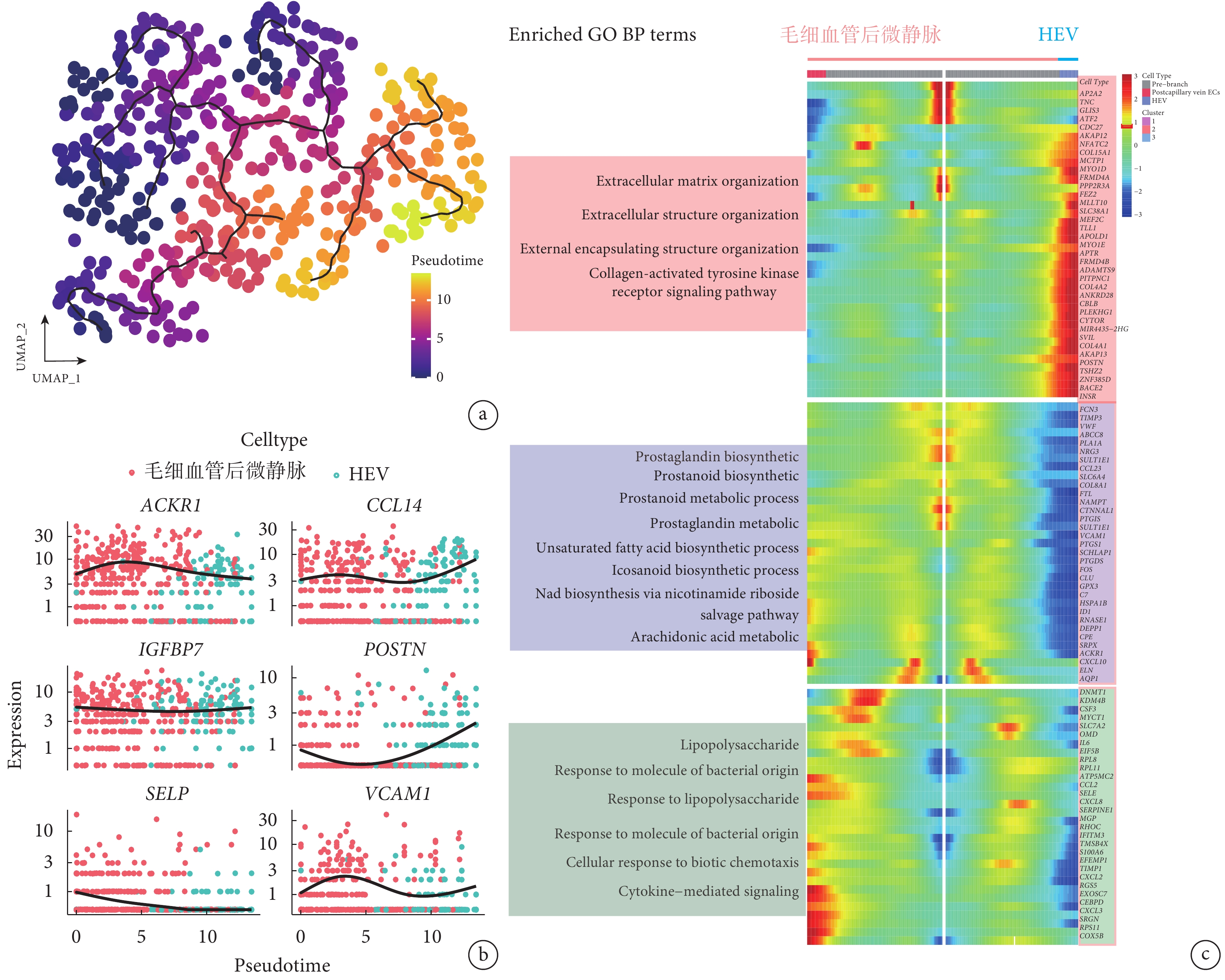 圖4
HEV 的擬時序軌跡分析
圖4
HEV 的擬時序軌跡分析
a. 偽時間分析顯示靜脈內皮細胞的進化趨勢是毛細血管后微靜脈內皮細胞至 HEV 內皮細胞。b. 單個基因的擬時軌跡,分別顯示 HEV 內皮細胞標記基因(
2.5 HEV 內皮細胞與免疫細胞的相互作用
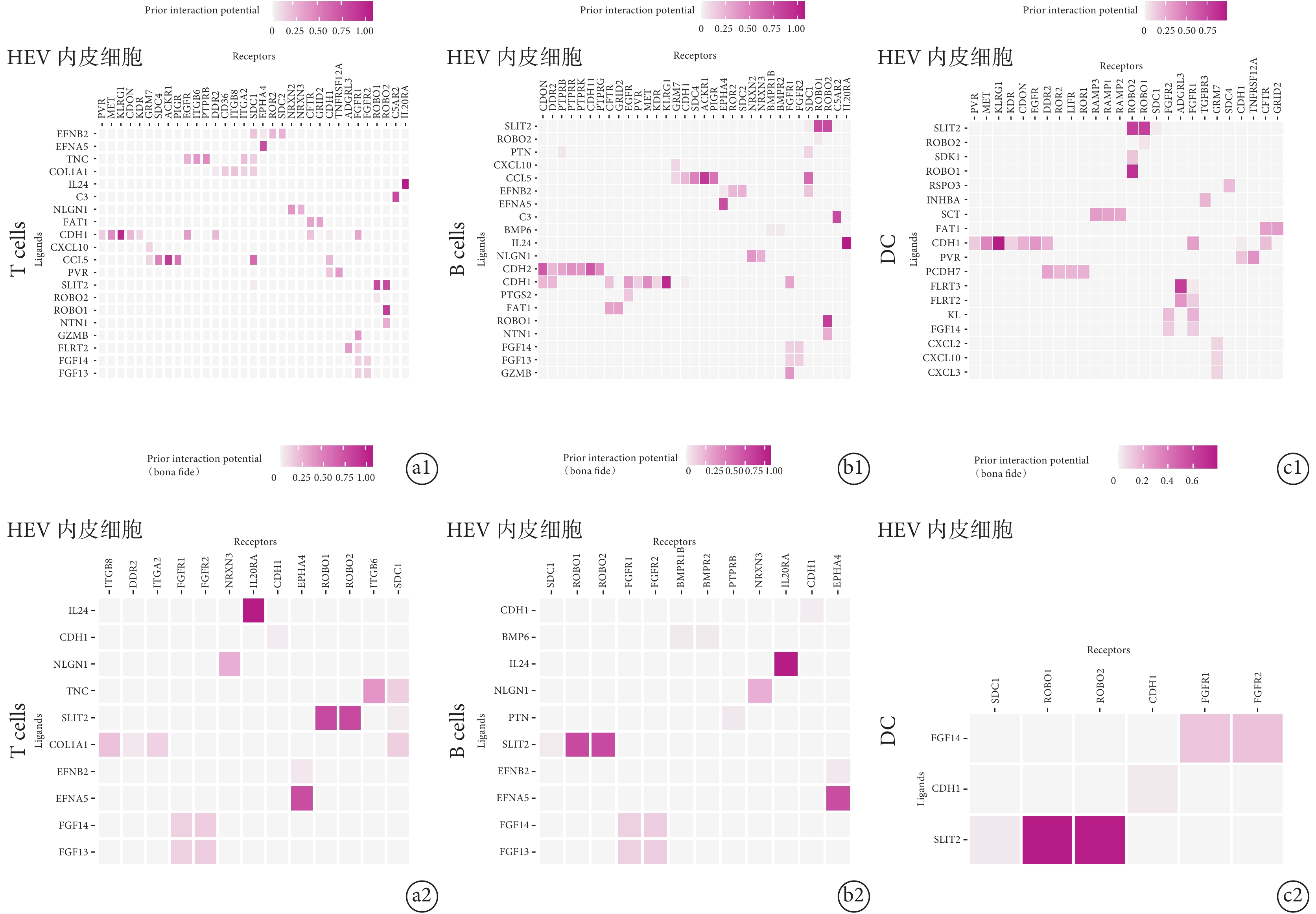
通過 NicheNet 受體與配體配對的原理進行配體–受體相互作用的分析,結果顯示 HEV 內皮細胞中受體基因與免疫細胞表面配體基因能互作。其中,T 淋巴細胞與 HEV 內皮細胞間通過 IL24與 IL20RA,SLIT2 與 ROBO1 和(或)ROBO2,以及 EFNA5 與 EPHA4 相互作用;B 淋巴細胞與 HEV 內皮細胞間通過 IL24 與 IL20RA,SLIT2 與 ROBO1 和(或)ROBO2,以及 EFNA5 與 EPHA4 相互作用;樹突狀細胞與 HEV 內皮細胞間通過 SLIT2 與 ROBO1 和(或)ROBO2,以及 FGF14 與 FGFR1 相互作用。這說明了 HEV 內皮細胞可以通過直接與免疫細胞作用方式激活 T 淋巴細胞(圖 5a)、B 淋巴細胞(圖 5b)和樹突狀細胞(圖 5c)。
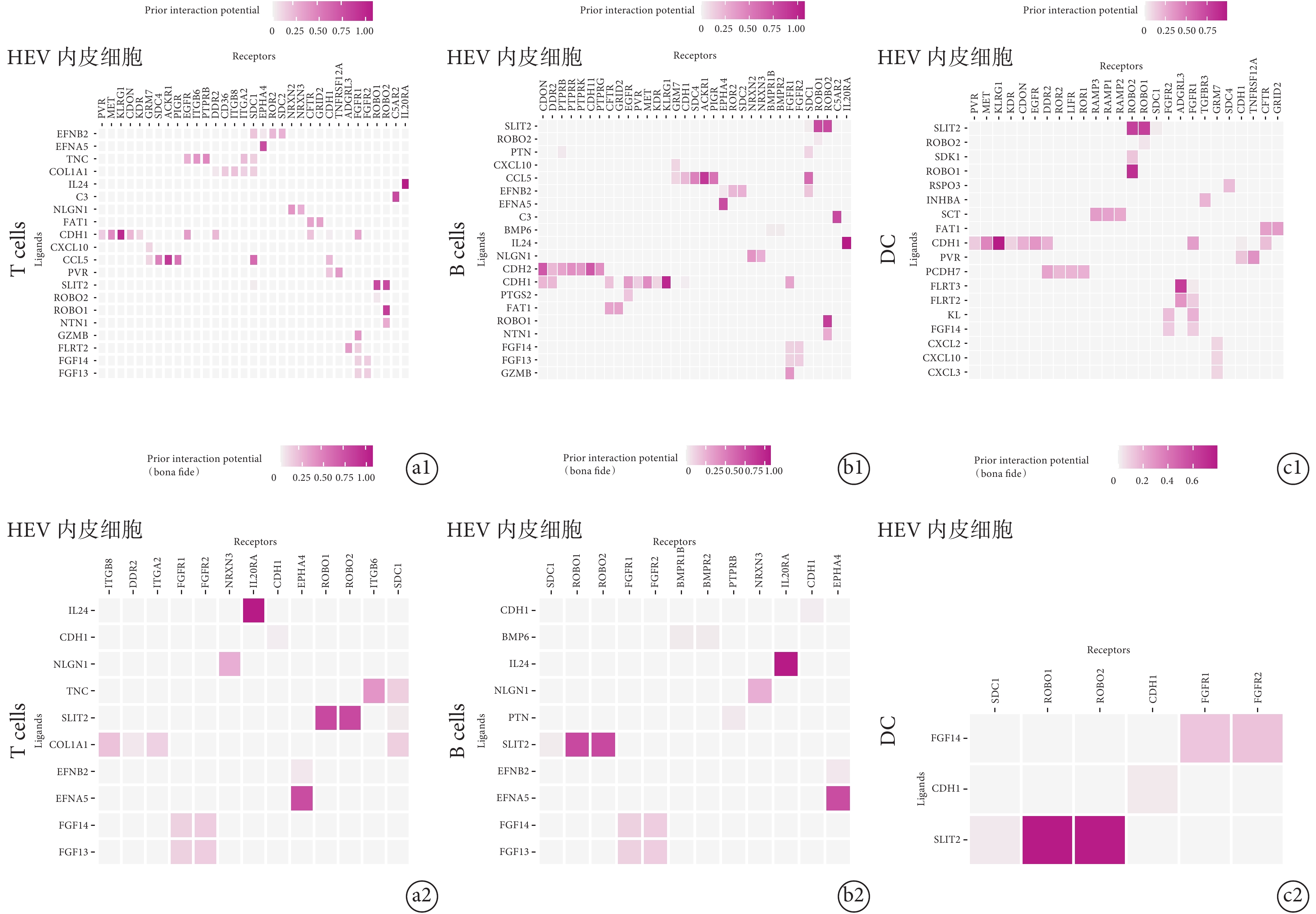 圖5
HEV 內皮細胞與免疫細胞的相互作用
圖5
HEV 內皮細胞與免疫細胞的相互作用
a. NicheNet 分析顯示 HEV 內皮細胞與 T 淋巴細胞受體配體圖。顯示 T 淋巴細胞與 HEV 內皮細胞可通過配體受體
3 討論
活體顯微鏡是能夠可視化淋巴細胞在體內被 HEV 內皮細胞招募的實驗方法,對于證明 HEV 的功能至關重要,特別是確認 HEV 內皮細胞介導淋巴細胞至組織中的能力[28]。但該方法操作復雜,而且具有創傷性,目前利用單細胞測序的技術,可以在生物信息學角度提出 HEV 內皮細胞的潛在的活化的信號通路及機制,一定程度上彌補了無法直觀觀察 HEV 內皮細胞的功能的缺陷。本研究應用生物信息學方法,利用 GSE136831 數據集中的 scRNA-seq 數據,通過對 GEO 數據的挖掘,參考文獻[17-23]進行細胞類型識別,從單細胞層面揭示慢阻肺組中存在 HEV 內皮細胞,并且其表達顯著上調,進一步挖掘 HEV 內皮細胞的相關的信號通路及其調控途徑,結果揭示了慢阻肺組中 HEV 內皮細胞和免疫細胞的關系,同時在免疫反應應答中,尤其是以 B 淋巴細胞、T 淋巴細胞和樹突狀細胞與 HEV 內皮細胞的關系較大。
在慢性炎癥疾病中,結構和表型與淋巴器官的 HEV 相似的血管可出現在非淋巴組織(血管及肺實質細胞)周邊[4]。類似 HEV 的血管有利于病理性淋巴細胞的流入,導致慢性炎癥的擴大和維持[29-31]。而有文獻報道,異位 HEV 樣血管的臨床意義高度依賴于疾病種類,腫瘤中的 HEV 能介導免疫細胞,繼而達到對腫瘤的破壞[32-33]。為了應對環境中的有害物質,例如脂多糖、香煙煙霧和細菌,氣道上皮和巨噬細胞會表達細胞因子(包括白細胞介素-1b、白細胞介素-6和腫瘤壞死因子-a)和趨化因子(例如 CCL20/巨噬細胞炎癥蛋白 MIP-3a),導致未成熟樹突狀細胞、T 淋巴細胞和 B 淋巴細胞的積累[9, 34-35]。由于持續的抗原暴露和(或)組織損傷,當急性炎癥變為慢性時,將產生具有分離 B 淋巴細胞和 T 淋巴細胞區域的淋巴濾泡組織,成熟的淋巴濾泡含有 HEV、濾泡樹突狀細胞和生發中心,以產生針對細菌和(或)自身抗原的抗體反應[36-37]。利用 GSE136831 數據集中的 scRNA-seq 數據并進行細胞類型識別,本研究預測到了 12 種不同的細胞亞群,分別為 T 淋巴細胞、B 淋巴細胞、漿細胞、巨噬細胞、單核細胞、樹突狀細胞、間質細胞、內皮細胞、Ⅰ 型肺泡上皮細胞、Ⅱ 型肺泡上皮細胞、纖毛細胞、肥大細胞,其中 T 淋巴細胞、B 淋巴細胞、漿細胞、肥大細胞和樹突狀細胞在慢阻肺組占比高于健康對照組,而巨噬細胞在健康對照組中高于慢阻肺。進一步對內皮細胞進行亞群鑒定分析,結果表明內皮細胞亞群在慢阻肺組和健康對照組中呈現了明顯差異,與健康對照組比較,在慢阻肺組中的 HEV 內皮細胞比例明顯增多。另外,擬時序軌跡分析結果顯示,在肺血管內皮細胞的發育軌跡中 ACKR1 和 SELP 基因逐漸下降,CCL14 和POSTN 基因逐漸升高,而且 HEV 內皮細胞中參與基質重構的相關基因表達上升。這些結果表明慢阻肺肺組織中確實存在表達顯著上調的 HEV 內皮細胞,而且其可能參與到基質重構過程。
在過去的幾十年里,對調節 HEV 內皮細胞的表型和功能的機制研究有了相當大的進展,包括在穩態期間的免疫激發。文獻報道了 HEV 內皮細胞在穩態期間處于激活狀態,淋巴毒素-β 受體信號調節許多 HEV 內皮細胞基因和通路,而且免疫刺激可以誘導 HEV 內皮細胞全局和暫時的炎癥表型,卻不損害它們招募幼稚淋巴細胞的能力[38]。在本研究中,慢阻肺組患者的 HEV 內皮細胞較健康對照組更明顯富集免疫相關信號通路,這表明炎癥與 HEV、免疫調節通路之間存在相關性,進一步的受體與配體配對分析結果顯示 HEV 內皮細胞可以通過直接與免疫細胞作用方式激活 T 淋巴細胞、B 淋巴細胞和樹突狀細胞。
綜上所述,本研究在單細胞水平驗證了 HEV 內皮細胞與慢阻肺的免疫細胞關系,但免疫細胞尤其是淋巴細胞反應的具體致病機制有待進一步探索。在未來的研究中,確定特異性抗原并探索其與慢阻肺相關淋巴細胞反應的確切作用以及對這種反應的調節,針對該方面的藥物開發是未來研究的方向。盡管 HEV 內皮細胞的確切功能有待繼續挖掘,但從目前研究已看到其潛在的治療作用,阻斷免疫誘導炎癥通路或者 HEV 內皮細胞作為病情預后指標;同時,本研究提示 HEV 內皮細胞具有基質重構的功能,因此 HEV 內皮細胞在慢性炎癥疾病中與病情加重可能存在相關性。這或許也是今后研究的一個重要方向。
利益沖突:本研究不涉及任何利益沖突。
高內皮細胞小靜脈(high endothelial venule,HEV)是介導淋巴細胞搬運到淋巴結和其他次級淋巴器官的專門血管[1-3]。通過提高淋巴細胞從血液中外滲,HEV 在淋巴細胞再循環和對外來入侵者(細菌和病毒感染)以及人體自身細胞的改變(癌癥中的新抗原)的免疫監測中發揮著重要作用。HEV 在免疫刺激的淋巴結的炎癥期間擴張,并在轉移和腫瘤排泄的淋巴結中擴增[4-5]。表達高水平 HEV 特異性硫酸化 MECA-79 抗原的 HEV 樣血管在許多人類炎癥和過敏性疾病(包括類風濕性關節炎、克羅恩病、過敏性鼻炎和哮喘)的慢性炎癥部位非淋巴組織中被誘導,這種血管被認為有助于慢性炎癥的放大和維持[6]。而慢性炎癥是慢性阻塞性肺疾病(簡稱慢阻肺)的主要發病因素[7-9]。Blanchard 等[6]的研究發現 MECA-79+腫瘤相關 HEV 在人類腫瘤中CD3+ T 淋巴細胞豐富的區域或 CD20+ B 淋巴細胞豐富的三級淋巴結構中高表達。同時,既往文獻報道慢阻肺患者的肺部存在 B 淋巴細胞濾泡[10]。但是關于慢阻肺和 HEV 的關系,未見相關文獻報道,需進一步探索。本研究利用生物信息學方法,通過對公共數據庫高通量基因表達數據庫(gene expression omnibus,GEO)數據的挖掘,選擇單細胞測序分析數據庫,旨在從單細胞水平了解慢阻肺是否存在 HEV 內皮細胞,其是否具備招募免疫細胞的作用,進一步分析其信號通路及相關的調控途徑。
1 資料與方法
1.1 數據收集
通過 GEO 數據庫檢索慢阻肺患者肺組織單細胞 RNA 測序(single-cell RNA sequencing,scRNA-seq)數據,下載 GSE136831 數據集用于分析[11]。
1.2 細胞測序數據分析流程
1.2.1 scRNA-seq 數據處理
使用 Seurat v3.6.2 版本分析 scRNA-seq 數據[12]。Seurat 分析標準流程:(1)導入數據,創建 Seurat 對象。(2)質量控制,選擇需要分析的細胞,質控標準為:① 排除少于 200 個基因或大于7500 的單個細胞;② 排除線粒體>25% 的單個細胞[13-14]。雙細胞排除標準是分子標簽過高和在同一剪輯中表達兩個或多個標記基因的單細胞[15]。(3)分別執行 LogNormalize()對每個數據進行標準化,使用 FindVariableFeatures()函數鑒定在細胞間表達高度變化的基因,使用 ScaleData()對數據進行縮放。采用 Harmony[16]整合每個器官的樣本,繼而進行主成分分析(principal component analysis,PCA)線性降維、細胞聚類、統一流形逼近與投影(uniform manifold approximation and projection,UMAP)非線性降維。(4)基因可視化。參考文獻[16]的方法,本研究在 PCA 和 UMAP 分析中選取具有統計學意義(P<0.05)且排列前 20 個的主成分。
1.2.2 細胞類型識別
參考文獻[17-18]的方法,細胞類型的確定主要通過“FindAllMarkers”、經典的細胞標記基因、使用 R 包(clustermole、singscore)預測聯合完成。“FindAllMarkers”中,通過確定每個簇中表達最高的基因及其重要功能來確定基因是否為標記基因。最小分數為 25%,對數轉換的倍數變化閾值為 0.25(
1.2.3 差異基因富集分析
以 avg_log2 FC>0.25 作為截尾值,分析慢阻肺患者和健康對照組者肺組織細胞的差異基因。使用基因本體論(gene ontology,GO)富集分析對差異基因進行富集分析,確認涉及免疫調節的差異基因,同時使用 AUCell 對富集到的相關信號通路基因集在不同亞群細胞上進行打分,分值以不同色階區別,其中黃色得分高,黑色得分低[24]。
1.2.4 擬時序分析
利用 R 包 monocle3 v1.0.0構建單細胞軌跡分析[25]。輸入標記為靜脈內皮細胞及其子集信息,對單細胞進行排序構建細胞軌跡,并構建單個基因的擬時軌跡。利用 R 包 monocle2 進行分支點分析[26]。
1.2.5 配體–受體相互作用分析
按照 NicheNet 的詳細說明[27]進行。本研究重點關注 HEV 內皮細胞與 T 淋巴細胞、B 淋巴細胞、樹突狀細胞之間的細胞互作,感興趣的基因集是慢阻肺組和健康對照組之間差異表達的基因。數據分析流程參考網址為
1.3 統計學方法
采用 GraphPad Prism 8.0 或 R 語言進行。計算來自慢阻肺、健康對照組的每個樣本中細胞類型的比例,并應用了t檢驗。使用 Wilcoxon 秩和統計檢驗對每個集群差異基因進行分析。P<0.05 和 avg_log2 FC>0.25 的差異基因用作通路富集分析的輸入。使用 Spearman 相關系數計算兩個樣本參數的相關分析。P<0.05 為差異有統計學意義。所有功能數據圖均顯示均數±標準誤。
2 結果
2.1 慢阻肺和健康人肺組織的細胞亞群分析
GSE136831 數據集包含了 18 例慢阻肺組患者及 28 例健康對照組。對該數據集中的肺細胞進行細胞亞群預測分析,得到了至少 25 種不同的細胞亞群(圖 1a),以及 219257 個細胞的圖譜,其中健康對照組有 133827 個細胞,慢阻肺組有 85430 個細胞(圖 1b)。基因標記結果顯示,這些肺細胞中有 12 種標記基因存在高表達(圖 1c);使用“FindAllMarkers”包對肺細胞進行的肺細胞亞群分析結果顯示,預測到 12 種不同的細胞亞群,分別為 T 淋巴細胞、B 淋巴細胞、漿細胞、巨噬細胞、單核細胞、樹突狀細胞、間質細胞、內皮細胞、Ⅰ 型肺泡上皮細胞、Ⅱ 型肺泡上皮細胞、纖毛細胞、肥大細胞(圖 1d~f),其中 T 淋巴細胞、B 淋巴細胞、漿細胞、肥大細胞和樹突狀細胞在慢阻肺組占比高于健康對照組,而巨噬細胞在健康對照組中高于慢阻肺(圖 1g)。
 圖1
慢阻肺組患者和健康對照組肺組織細胞亞群分析和鑒定
圖1
慢阻肺組患者和健康對照組肺組織細胞亞群分析和鑒定
a~b. 慢阻肺組患者及健康對照組的肺組織細胞聚類分析 UMAP 圖,分為 25 個群。c. 12 種高表達標記基因的 UMAP 圖。d. UMAP 圖顯示的 12 種肺細胞亞群。其中,T:T 淋巴細胞;B:B 淋巴細胞;Plasma:漿細胞;Macro:巨噬細胞;Mono:單核細胞;DC:樹突狀細胞;Stromal:間質細胞;Endo:內皮細胞;AT1:Ⅰ 型肺泡上皮細胞;AT2:Ⅱ 型肺泡上皮細胞;Ciliated:纖毛細胞;Mast:肥大細胞。e. 慢阻肺組和健康對照組肺細胞不同細胞亞群分布情況的 UMAP 圖比較。f. 各細胞亞群標記基因在全部細胞亞群表達情況的散點圖。g. 12 種細胞亞群在慢阻肺組患者和健康對照組全肺細胞中的占比比較,慢阻肺組患者 B 淋巴細胞、漿細胞、肥大細胞、樹突狀細胞、間質細胞、T 淋巴細胞比例顯著升高,巨噬細胞比例較健康對照組下降。*
2.2 HEV 內皮細胞亞群鑒定分析
使用不同的內皮標記基因對肺細胞進行的細胞亞群分類結果顯示,淋巴管內皮 PDPN 基因、毛細血管內皮 CA4 基因、動脈內皮 DKK2 基因、靜脈內皮 ACKR1 基因在不同細胞群呈現高表達(圖 2a),內皮細胞亞群在慢阻肺組患者和健康對照組中呈現了明顯差異(圖 2b~c)。根據 HEV 內皮細胞標記基因結果,揭示肺細胞中存在 HEV 內皮細胞亞群(圖 2e~f),而且慢阻肺組和健康對照組肺細胞中 HEV 內皮細胞數量存在差異(圖 2f),與健康對照組比較,慢阻肺組肺細胞中的 HEV 內皮細胞比例明顯增多(圖 2g)。
 圖2
慢阻肺組患者和健康對照組肺組織血管內皮細胞亞群鑒定
圖2
慢阻肺組患者和健康對照組肺組織血管內皮細胞亞群鑒定
a. 4 種肺血管內皮標記基因的 UMAP 圖。其中,
2.3 HEV 內皮細胞亞群差異基因分析
以 avg_log2 FC>0.25 作為截尾值,對慢阻肺組患者和健康對照組肺組織中 HEV 內皮細胞進行的差異基因分析結果顯示,慢阻肺組患者有 1253 個下調基因和 1164 個上調基因(圖 3a)。GO 富集分析發現差異基因中的 CD55、SWAP70、IL4R、MSH2、IGHA1、IGLL5、IGHG1、IGLC28 參與了 B 淋巴細胞介導的免疫和免疫球蛋白介導的免疫應答,HEV 內皮細胞亞群也富集到 B 淋巴細胞介導的免疫和免疫球蛋白介導的免疫應答相關的信號通路(圖 3b中紅色標注文字)。慢阻肺組患者較健康對照組中 HEV 內皮細胞亞群富集免疫相關信號通路基因集得分高,而慢阻肺組患者與健康對照組在毛細血管后微靜脈內皮細胞富集免疫相關信號通路基因集得分沒有統計學差異(圖 3c、d)。這提示慢阻肺組患者的 HEV 內皮細胞較健康對照組明顯富集免疫相關信號通路,且差異有統計學意義。
 圖3
慢阻肺組患者和健康對照組肺組織 HEV 內皮細胞亞群的差異基因分析
圖3
慢阻肺組患者和健康對照組肺組織 HEV 內皮細胞亞群的差異基因分析
a. 慢阻肺組患者與健康對照組中 HEV 內皮細胞亞群中的差異基因火山圖。相對于健康對照組,慢阻肺組患者上調的基因有 1164 個,下調的基因有 1253 個。b. 差異基因的 GO 富集分析圖。HEV 內皮細胞亞群富集到 B 淋巴細胞免疫和免疫球蛋白介導的免疫應答相關的信號通路。c. 慢阻肺組患者與健康對照組中 HEV 內皮細胞亞群富集到 B 淋巴細胞免疫和免疫球蛋白介導的免疫應答相關的信號通路的差異基因 UMAP 圖。d. 慢阻肺組患者與健康對照組中 HEV 內皮細胞亞群富集免疫相關信號通路基因集得分比較。慢阻肺組患者的 HEV 內皮細胞較健康對照組明顯富集免疫相關信號通路,且差異有統計學意義。*
2.4 HEV 內皮細胞的擬時序軌跡分析
擬時序軌跡分析結果顯示,利用 monocle2 和 monocle3 分析細胞發育軌跡,可得到肺血管內皮細胞的發育軌跡(圖 4a)。進一步分析發現,ACKR1 和 SELP 基因在發育軌跡中逐漸下降,而 CCL14 和 POSTN 基因逐漸升高(圖 4b)。利用發育軌跡熱圖分析了 HEV 內皮細胞各個階段富集的基因表達,結果顯示參與基質重構的相關基因表達上升(圖 4c)。
 圖4
HEV 的擬時序軌跡分析
圖4
HEV 的擬時序軌跡分析
a. 偽時間分析顯示靜脈內皮細胞的進化趨勢是毛細血管后微靜脈內皮細胞至 HEV 內皮細胞。b. 單個基因的擬時軌跡,分別顯示 HEV 內皮細胞標記基因(
2.5 HEV 內皮細胞與免疫細胞的相互作用
通過 NicheNet 受體與配體配對的原理進行配體–受體相互作用的分析,結果顯示 HEV 內皮細胞中受體基因與免疫細胞表面配體基因能互作。其中,T 淋巴細胞與 HEV 內皮細胞間通過 IL24與 IL20RA,SLIT2 與 ROBO1 和(或)ROBO2,以及 EFNA5 與 EPHA4 相互作用;B 淋巴細胞與 HEV 內皮細胞間通過 IL24 與 IL20RA,SLIT2 與 ROBO1 和(或)ROBO2,以及 EFNA5 與 EPHA4 相互作用;樹突狀細胞與 HEV 內皮細胞間通過 SLIT2 與 ROBO1 和(或)ROBO2,以及 FGF14 與 FGFR1 相互作用。這說明了 HEV 內皮細胞可以通過直接與免疫細胞作用方式激活 T 淋巴細胞(圖 5a)、B 淋巴細胞(圖 5b)和樹突狀細胞(圖 5c)。
 圖5
HEV 內皮細胞與免疫細胞的相互作用
圖5
HEV 內皮細胞與免疫細胞的相互作用
a. NicheNet 分析顯示 HEV 內皮細胞與 T 淋巴細胞受體配體圖。顯示 T 淋巴細胞與 HEV 內皮細胞可通過配體受體
3 討論
活體顯微鏡是能夠可視化淋巴細胞在體內被 HEV 內皮細胞招募的實驗方法,對于證明 HEV 的功能至關重要,特別是確認 HEV 內皮細胞介導淋巴細胞至組織中的能力[28]。但該方法操作復雜,而且具有創傷性,目前利用單細胞測序的技術,可以在生物信息學角度提出 HEV 內皮細胞的潛在的活化的信號通路及機制,一定程度上彌補了無法直觀觀察 HEV 內皮細胞的功能的缺陷。本研究應用生物信息學方法,利用 GSE136831 數據集中的 scRNA-seq 數據,通過對 GEO 數據的挖掘,參考文獻[17-23]進行細胞類型識別,從單細胞層面揭示慢阻肺組中存在 HEV 內皮細胞,并且其表達顯著上調,進一步挖掘 HEV 內皮細胞的相關的信號通路及其調控途徑,結果揭示了慢阻肺組中 HEV 內皮細胞和免疫細胞的關系,同時在免疫反應應答中,尤其是以 B 淋巴細胞、T 淋巴細胞和樹突狀細胞與 HEV 內皮細胞的關系較大。
在慢性炎癥疾病中,結構和表型與淋巴器官的 HEV 相似的血管可出現在非淋巴組織(血管及肺實質細胞)周邊[4]。類似 HEV 的血管有利于病理性淋巴細胞的流入,導致慢性炎癥的擴大和維持[29-31]。而有文獻報道,異位 HEV 樣血管的臨床意義高度依賴于疾病種類,腫瘤中的 HEV 能介導免疫細胞,繼而達到對腫瘤的破壞[32-33]。為了應對環境中的有害物質,例如脂多糖、香煙煙霧和細菌,氣道上皮和巨噬細胞會表達細胞因子(包括白細胞介素-1b、白細胞介素-6和腫瘤壞死因子-a)和趨化因子(例如 CCL20/巨噬細胞炎癥蛋白 MIP-3a),導致未成熟樹突狀細胞、T 淋巴細胞和 B 淋巴細胞的積累[9, 34-35]。由于持續的抗原暴露和(或)組織損傷,當急性炎癥變為慢性時,將產生具有分離 B 淋巴細胞和 T 淋巴細胞區域的淋巴濾泡組織,成熟的淋巴濾泡含有 HEV、濾泡樹突狀細胞和生發中心,以產生針對細菌和(或)自身抗原的抗體反應[36-37]。利用 GSE136831 數據集中的 scRNA-seq 數據并進行細胞類型識別,本研究預測到了 12 種不同的細胞亞群,分別為 T 淋巴細胞、B 淋巴細胞、漿細胞、巨噬細胞、單核細胞、樹突狀細胞、間質細胞、內皮細胞、Ⅰ 型肺泡上皮細胞、Ⅱ 型肺泡上皮細胞、纖毛細胞、肥大細胞,其中 T 淋巴細胞、B 淋巴細胞、漿細胞、肥大細胞和樹突狀細胞在慢阻肺組占比高于健康對照組,而巨噬細胞在健康對照組中高于慢阻肺。進一步對內皮細胞進行亞群鑒定分析,結果表明內皮細胞亞群在慢阻肺組和健康對照組中呈現了明顯差異,與健康對照組比較,在慢阻肺組中的 HEV 內皮細胞比例明顯增多。另外,擬時序軌跡分析結果顯示,在肺血管內皮細胞的發育軌跡中 ACKR1 和 SELP 基因逐漸下降,CCL14 和POSTN 基因逐漸升高,而且 HEV 內皮細胞中參與基質重構的相關基因表達上升。這些結果表明慢阻肺肺組織中確實存在表達顯著上調的 HEV 內皮細胞,而且其可能參與到基質重構過程。
在過去的幾十年里,對調節 HEV 內皮細胞的表型和功能的機制研究有了相當大的進展,包括在穩態期間的免疫激發。文獻報道了 HEV 內皮細胞在穩態期間處于激活狀態,淋巴毒素-β 受體信號調節許多 HEV 內皮細胞基因和通路,而且免疫刺激可以誘導 HEV 內皮細胞全局和暫時的炎癥表型,卻不損害它們招募幼稚淋巴細胞的能力[38]。在本研究中,慢阻肺組患者的 HEV 內皮細胞較健康對照組更明顯富集免疫相關信號通路,這表明炎癥與 HEV、免疫調節通路之間存在相關性,進一步的受體與配體配對分析結果顯示 HEV 內皮細胞可以通過直接與免疫細胞作用方式激活 T 淋巴細胞、B 淋巴細胞和樹突狀細胞。
綜上所述,本研究在單細胞水平驗證了 HEV 內皮細胞與慢阻肺的免疫細胞關系,但免疫細胞尤其是淋巴細胞反應的具體致病機制有待進一步探索。在未來的研究中,確定特異性抗原并探索其與慢阻肺相關淋巴細胞反應的確切作用以及對這種反應的調節,針對該方面的藥物開發是未來研究的方向。盡管 HEV 內皮細胞的確切功能有待繼續挖掘,但從目前研究已看到其潛在的治療作用,阻斷免疫誘導炎癥通路或者 HEV 內皮細胞作為病情預后指標;同時,本研究提示 HEV 內皮細胞具有基質重構的功能,因此 HEV 內皮細胞在慢性炎癥疾病中與病情加重可能存在相關性。這或許也是今后研究的一個重要方向。
利益沖突:本研究不涉及任何利益沖突。