引用本文: 張麗慧, 陳雪融. 艾滋病重癥肺炎患者并發急性呼吸窘迫綜合征的危險因素分析. 中國呼吸與危重監護雜志, 2023, 22(11): 761-767. doi: 10.7507/1671-6205.202210058 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
獲得性免疫缺陷綜合征(簡稱艾滋病,acquired immune deficiency syndrome,AIDS)是由人類免疫缺陷病毒(human immunodeficiency virus,HIV)感染導致免疫功能障礙從而引起的全身性疾病[1]。多項研究顯示導致艾滋病患者死亡的主要病因為機會性感染[2],其中肺部感染最為常見[3]。重癥肺炎呼吸衰竭亦是艾滋病患者入住重癥監護室(intensive care unit,ICU)的最常見疾病。急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)為一種急性、彌漫性、炎癥性肺損傷[4]。ARDS嚴重影響人們的生命健康,有研究表明其急性期病死率甚至高達57.1%[5],幸存者亦可能遺留長期器官障礙,降低生活質量。嚴重的肺部感染、休克、胰腺炎等多種因素均與ARDS發病有關[6],而AIDS患者最常見的機會性感染即為肺部感染,但是目前針對AIDS重癥肺炎患者并發ARDS的關注與相關研究卻極少。因此,本研究通過回顧性分析了本院ICU收治的艾滋病重癥肺炎患者的臨床資料,探尋其并發ARDS的危險因素,以期為臨床早期識別高危患者并及時干預提供參考。
1 資料與方法
1.1 臨床資料
本研究所使用的樣本均來自于成都市公共衛生臨床醫療中心重癥醫學科,選取的患者入住時間在2017年1月—2020年12月期間。納入標準:選擇入院時診斷為艾滋病合并重癥肺炎的患者,其中艾滋病的診斷依據《中國艾滋病診療指南(2021版)》[1],重癥肺炎診斷則參考《中國成人社區獲得性肺炎診斷和治療指南(2016年版)》[7],納入病例時均嚴格參照相關的診斷標準執行。排除標準:排除年齡在18歲以下的未成年患者,妊娠患者,住院時間≤24 h,依從性不佳者(包括治療尚未完成要求出院者、拒不接受醫療建議者),病例資料嚴重缺失者。本研究經四川大學華西醫院(2021年審158號)及成都市公共衛生臨床醫療中心(YJ-S2021-10)倫理委員會均審查同意并批準執行。最終納入232例艾滋病合并重癥肺炎的患者。
1.2 方法
1.2.1 收集資料
本研究收集患者入住ICU時的數據:(1)一般資料:年齡、性別、入院前總病程、預后情況(28天存活或死亡)等;(2)生命體征,如體溫、呼吸頻率、心率、平均動脈壓等;(3)實驗室檢查指標及評分,包括pH、血小板計數、白細胞計數(white blood cell count,WBC)、血紅蛋白、降鈣素原(procalcitonin,PCT)、α-羥丁酸脫氫酶(α-hydroxybutyrate dehydrogenase; α-HBDH)、乳酸脫氫酶(lactate dehydrogenase,LDH)、C反應蛋白(C-reactive protein,CRP)、血乳酸、CD4+ T淋巴細胞計數、急性生理學和慢性健康狀況評價Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)、序貫器官衰竭評分(sequential organ failure assessment,SOFA)等;(4)基礎疾病情況:慢性阻塞性肺疾病、高血壓、慢性腎功能不全、糖尿病等。總計57項指標。
1.2.2 分組
回顧性分析所納入的病例資料,嚴格按照ARDS的診斷標準執行,以是否合并ARDS為標準,將患者分為ARDS組和非ARDS組。臨床上對于ARDS的診斷難點在于判斷肺水腫是否存在以及鑒別肺水腫的來源。目前脈搏指示連續心排出量(pulse indicates continuous cardiac output,PiCCO)被認為是診斷肺水腫最為準確的方法,但受有創操作相關損傷、導管相關感染可能、風險-受益比低等影晌導致臨床常規實施難度較大[8]。目前研究認為:無創心排出量監測(noninvasive cardiac output monitoring,NICOM)、超聲、PiCCO在危重患者血流動力學監測方面具有良好的一致性,可用于危重患者血流動力學的監測和評價[9]。因此,本研究所納入的所有患者均在病程中反復使用心肺聯合超聲和NICOM監測來對患者進行動態評估,據監測結果來進行肺水腫的診斷及鑒別診斷,以確保研究對象診斷的準確性。
1.3 統計學方法
采用EXCEL錄入數據,SPSS 24.0統計軟件進行統計分析。變量賦值轉化為最大程度的利用數據并保留資料的完整性,如年齡、CRP、WBC、PCT、APACHEⅡ評分、SOFA評分等連續型變量均采用原始數據代入,而慢性腎功能不全、高血壓等基礎疾病等定性資料按疾病有、無而分別賦值1和0代入計算。按患者轉歸情況不同分為ARDS組和非ARDS組,并分別賦值1和0,轉化為二分類變量。正態分布計量資料以均數±標準差(x±s)表示,采用t檢驗進行比較。非正態分布的計量資料以中位數(四分位間距)[M(IQR)]表示,采用非參數檢驗進行比較;計數資料以例(%)表示。組間比較采用單因素Logistic回歸分析,將P<0.05的自變量進行多重共線性分析,以剔除方差膨脹因子(variance inflation factor,VIF)大于10的變量,然后將不存在共線性的變量納入多因素Logistic逐步回歸模型進行危險因素分析(檢驗水準為0.05),最后繪制繪制受試者操作特征(receiver operating characteristic,ROC)曲線。
2 結果
2.1 一般資料
232例艾滋病重癥肺炎患者中有33例并發ARDS,發病率為14.2%。ARDS組患者年齡(49.9±16.7)歲,非ARDS組患者年齡(49.6±15.8)歲。232例艾滋病重癥肺炎患者,28天總計死亡94例,總病死率為40.5%,其中ARDS組死亡27例,組內病死率81.8%;非ARDS組死亡67例,組內病死率33.7%。ARDS組與非ARDS組入院時臨床特點比較各項指標的描述性統計分析結果按數據是否符合正態分布分為正態分布和非正態分布,詳見表1和表2,并通過對偏態分布的指標對其對數的方式將之轉化為正態分布數據。
2.2 患者并發ARDS風險的單因素Logistic回歸分析
將是否并發ARDS作為因變量,其余57項臨床資料為協變量,進行單因素Logistic回歸分析。pH、APACHEⅡ評分、SOFA評分、WBC、LDH、α-HBDH、ALT、AST、鈣、FDP、D-二聚體這11項指標有統計學意義(P<0.05),與非ARDS患者并發ARDS相關。其中APACHEⅡ評分、SOFA評分、pH、LDH、α-HBDH、ALT、AST、FDP、D-二聚體這9項指標是正回歸系數,比值比(odds ratio,OR)大于1,說明這些指標為正性作用因素,即這些指標值越高,發生ARDS的可能性越高。而pH、血清鈣離子這2項指標回歸系數為負,OR值小于1,說明這些變量為負性作用因素,即這些指標值越高,發生ARDS的可能性越低。結果見表3。
2.3 各因素間多重共線性分析
將這11個變量構建模型納入多重共線性問題分析,結果如表4所示。其中ALT及AST的VIF值大于10,說明這兩項指標間存在共線性,予以剔除;其余9項指標之間VIF值均小于10,由此可判斷這9個指標之間并不存在多重共線性問題,故可以將這9個指標作為最終對象納入Logistic模型中。
2.4 患者并發ARDS風險的多因素逐步Logistic回歸分析
將單因素Logistic回歸分析選擇出的11項指標在排除存在多重共線性關系的2項指標后,所留下的9個有統計學意義的指標納入多因素Logistic回歸分析中,并采用逐步向前法對變量進行分析。α-HBDH[OR=1.001,95%置信區間(confidence interval,CI)1.000~1.002,P=0.045]和D-二聚體(OR=1.044,95%CI 1.006~1.083,P=0.024)這兩項指標具有統計學意義(P<0.005)。結果見表5。因此,羥丁酸脫氫酶、D-二聚體這2個指標為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
2.5 對獨立危險因素繪制ROC曲線并分析
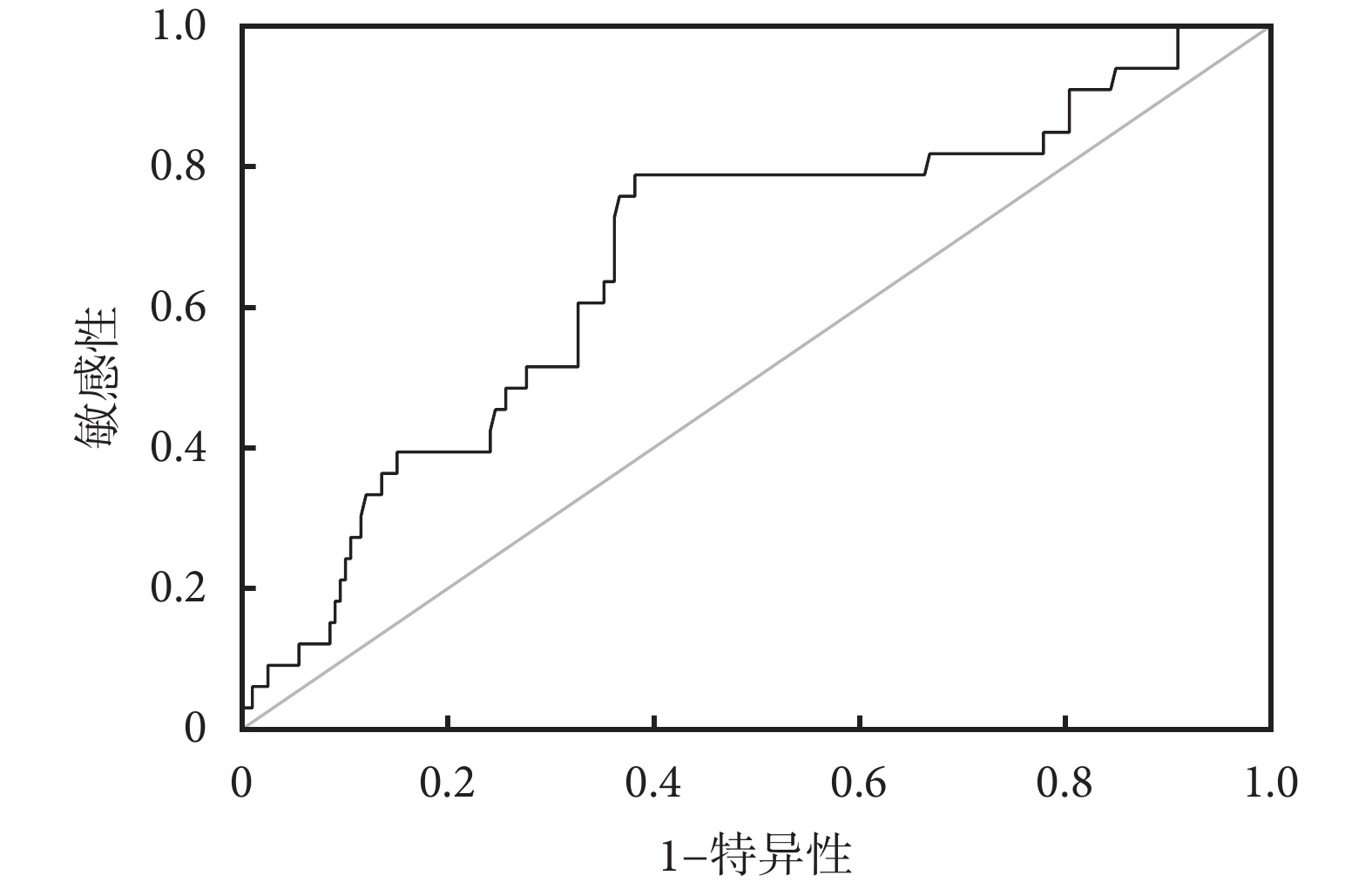
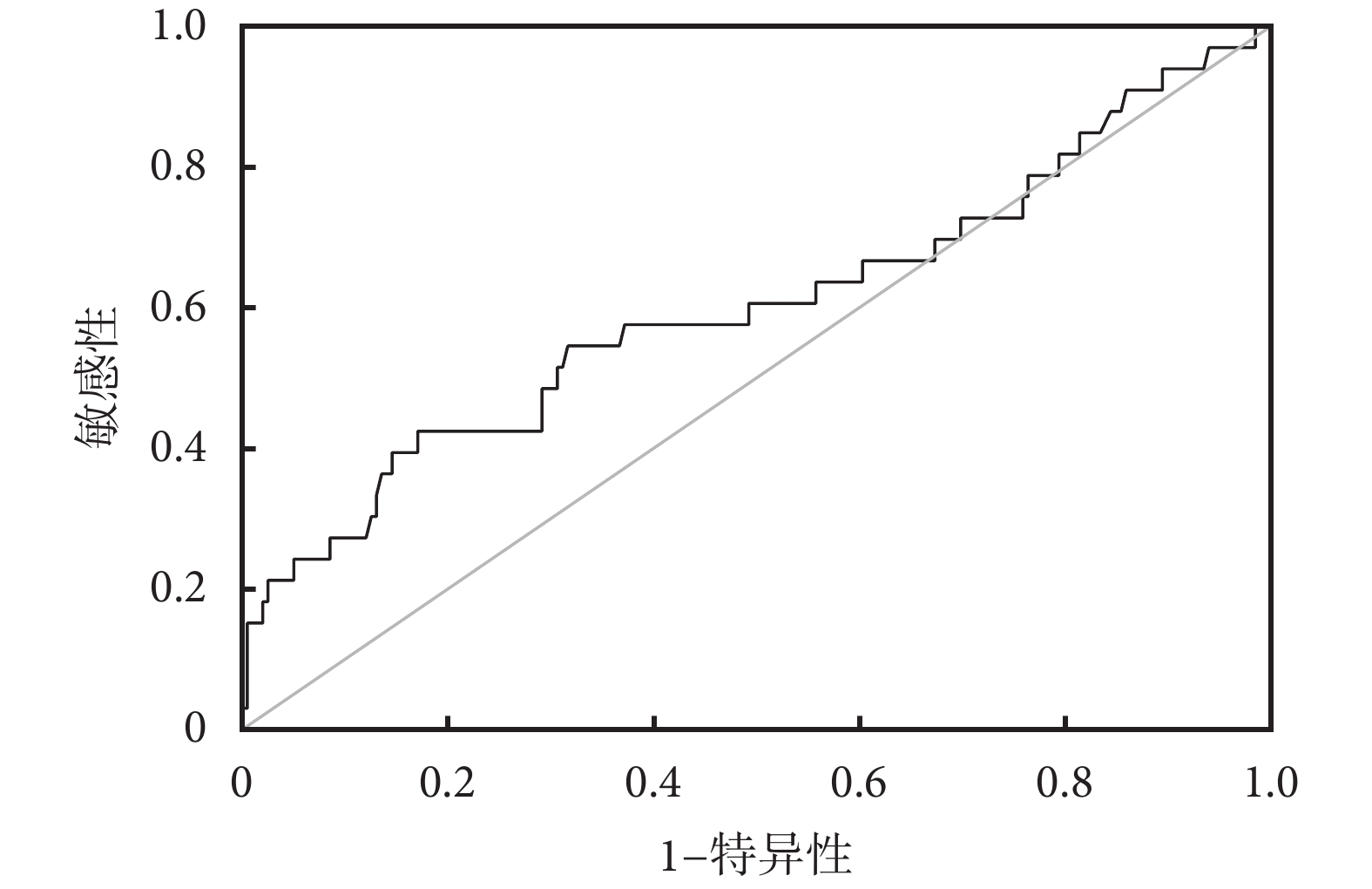
將α-HBDH、D-二聚體這2項獨立危險因素分別繪制ROC曲線,并計算約登指數找出最佳臨界值及其所對應的敏感性及特異性。艾滋病重癥肺炎患者并發ARDS的預測:(1)α-HBDH:ROC曲線下面積(area under ROC curve,AUC)為0.667,P=0.002,最佳臨界值為391 U/L,此時對應的敏感性為78.8%,特異性為61.8%),見圖1;(2)D-二聚體:AUC=0.602,P=0.062,最佳臨界值為4.855 μg/mL,對應的敏感性為42.4%,特異性為82.9%,見圖2。α-HBDH值越高(≥391 U/L)、D-二聚體越高(≥4.855 μg/mL)為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
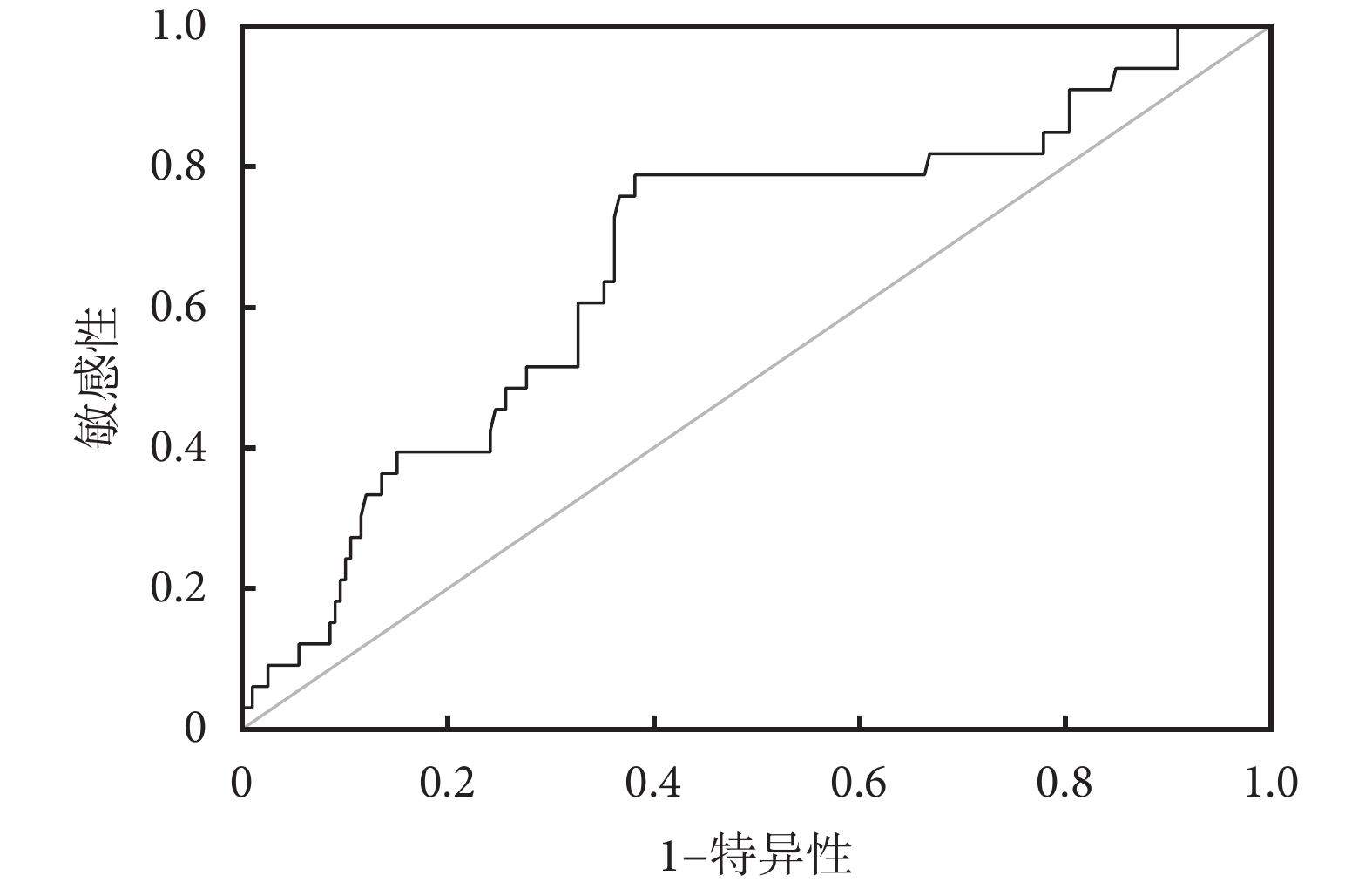 圖1
α-HBDH預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
圖1
α-HBDH預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
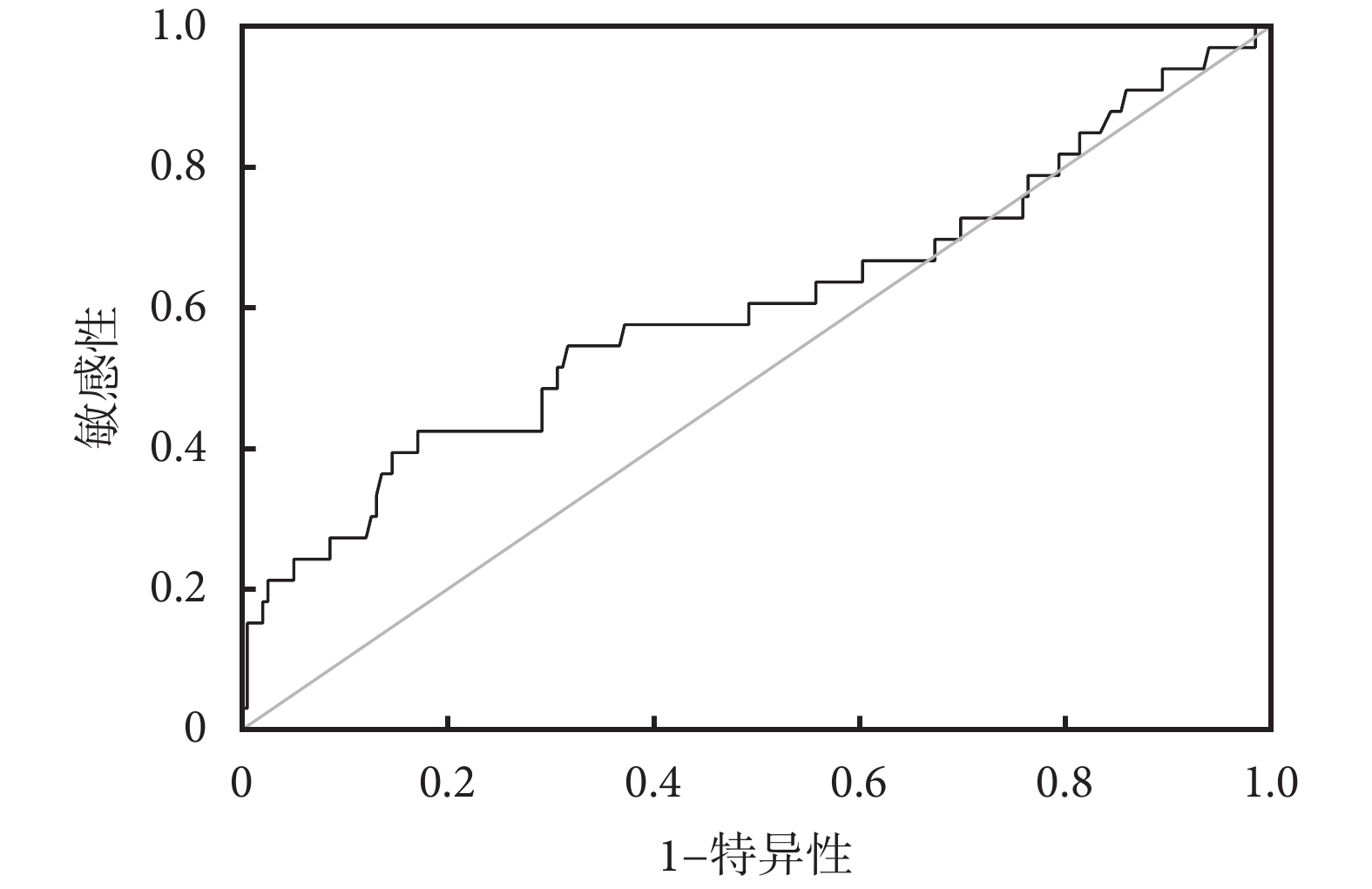 圖2
D-二聚體預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
圖2
D-二聚體預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
3 討論
本研究針對ICU艾滋病重癥肺炎患者并發ARDS危險因素進行分析,總計納入成都市公共衛生臨床醫療中心收治的232例艾滋病重癥肺炎患者的臨床資料,其中33例并發ARDS。ARDS組患者組內病死率81.8%,而非ARDS組的組內病死率33.7%,這與前文所述在患相同基礎疾病情況下,并發ARDS的患者病死率明顯高于未發生ARDS患者相一致。本研究隨后對納入分析的57項指標進行單因素Logistic回歸分析,發現共11項指標與ARDS的發生相關。排除了存在相互影響的ALT及AST兩項指標,再將pH、APACHEⅡ評分、SOFA評分、WBC、α-HBDH、羥丁酸脫氫酶、鈣、FDP、D-二聚體這9項指標納入多因素逐步Logistic回歸模型進行分析,結果發現α-HBDH和D-二聚體這2項指標為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
血清α-HBDH廣泛存在于心臟、肺、肝臟、骨骼肌、脾臟、腦、紅細胞等組織細胞的胞漿中,是LDH的同工酶之一,其檢測水平實際反映的是LDH1、LDH2的活性[10]。當心肌、肺組織、肝細胞等受到損傷時會釋放大量的α-HBDH。研究表明α-HBDH除用于急性心肌梗死的診斷外,尚因其參與糖酵解途徑而在甲狀腺功能低下、先兆子癇、貧血、腦炎、妊娠期肝內膽法淤積癥[11~14]等多種疾病的診斷中占有一席之地,同時亦可以作為評估急性胰腺炎、膀胱癌的預后及其早期生物標志物[15-16]。ARDS病程中伴隨著血管內皮細胞、透明膜、肺泡上皮細胞的損傷,α-HBDH必然出現上升,與本研究結果相一致。但α-HBDH的升高是否能夠作為ARDS的早期預警標志物及預后判斷依據尚無相關的報道。本研究首次在艾滋病重癥肺炎的患者中發現并得出血清α-HBDH為其并發ARDS的獨立危險因素,為后期進一步研究α-HBDH在ARDS的發生與發展過程中所起到的作用及產生的影響提供參考。
D-二聚體為交聯纖維蛋白的降解產物,其數值的增高能特異性的反映繼發性纖溶活性的增強,能有效反映血管內皮損傷的程度[17-18]。研究表明D-二聚體水平與膿毒癥所致ARDS病情和預后具有一定相關性[19]。本研究發現血清D-二聚體為艾滋病重癥肺炎患者并發ARDS的獨立危險因素,與國內外多項相似研究的結論一致。鑒于D-二聚體與血管內皮損傷、凝血功能異常均相關,以及ARDS是肺血管內皮功能受損后導致血管通透性增高性肺水腫形成,再結合本次研究結果,可以得出艾滋病重癥肺炎患者出現血漿D-二聚體水平的升高可能代表著血管內皮損傷、血管通透性增高,開始進入ARDS的病程。因此,血漿D-二聚體的升高能作為早期預測并發ARDS的生物標志之一。
本研究通過回顧性研究艾滋病重癥肺炎患者并發ARDS的危險因素,比較合并ARDS患者與未并發ARDS患者的一般情況、基礎疾病、實驗室指標等臨床病例資料,得出的主要結論如下。(1)研究所納入的艾滋病重癥肺炎患者中,并發ARDS占納入患者的14.2%,28天總病死率為40.5%,ARDS組內死亡率81.8%,非ARDS組內死亡率33.7%,進一步說明ARDS為艾滋病重癥肺炎患者的常見并發癥,且并發ARDS者死亡風險極大。(2)經單因素Logistic回歸分析,去除具有多重共線性的因素,再進行多因素Logistic回歸分析發現α-HBDH值(≥391 U/L)、D-二聚體(≥4.855 μg/mL)為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
本研究存在一定的局限性。首先,本研究為單中心回顧性隊列研究,預測模型準確性還有待大樣本多中心數據進一步驗證。其次,因艾滋病重癥肺炎合并ARDS的患者樣本量不足夠,未能以ARDS分度來進行分組,故未能建立預測ARDS嚴重程度的模型。最后,研究僅提取了ARDS發生前相關數據,并未進行長期的隨訪跟蹤分析,關于ARDS治療方案的選擇及可能影響患者預后的危險因素尚需進一步深入研究。
利益沖突:本研究不涉及任何利益沖突。
獲得性免疫缺陷綜合征(簡稱艾滋病,acquired immune deficiency syndrome,AIDS)是由人類免疫缺陷病毒(human immunodeficiency virus,HIV)感染導致免疫功能障礙從而引起的全身性疾病[1]。多項研究顯示導致艾滋病患者死亡的主要病因為機會性感染[2],其中肺部感染最為常見[3]。重癥肺炎呼吸衰竭亦是艾滋病患者入住重癥監護室(intensive care unit,ICU)的最常見疾病。急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)為一種急性、彌漫性、炎癥性肺損傷[4]。ARDS嚴重影響人們的生命健康,有研究表明其急性期病死率甚至高達57.1%[5],幸存者亦可能遺留長期器官障礙,降低生活質量。嚴重的肺部感染、休克、胰腺炎等多種因素均與ARDS發病有關[6],而AIDS患者最常見的機會性感染即為肺部感染,但是目前針對AIDS重癥肺炎患者并發ARDS的關注與相關研究卻極少。因此,本研究通過回顧性分析了本院ICU收治的艾滋病重癥肺炎患者的臨床資料,探尋其并發ARDS的危險因素,以期為臨床早期識別高危患者并及時干預提供參考。
1 資料與方法
1.1 臨床資料
本研究所使用的樣本均來自于成都市公共衛生臨床醫療中心重癥醫學科,選取的患者入住時間在2017年1月—2020年12月期間。納入標準:選擇入院時診斷為艾滋病合并重癥肺炎的患者,其中艾滋病的診斷依據《中國艾滋病診療指南(2021版)》[1],重癥肺炎診斷則參考《中國成人社區獲得性肺炎診斷和治療指南(2016年版)》[7],納入病例時均嚴格參照相關的診斷標準執行。排除標準:排除年齡在18歲以下的未成年患者,妊娠患者,住院時間≤24 h,依從性不佳者(包括治療尚未完成要求出院者、拒不接受醫療建議者),病例資料嚴重缺失者。本研究經四川大學華西醫院(2021年審158號)及成都市公共衛生臨床醫療中心(YJ-S2021-10)倫理委員會均審查同意并批準執行。最終納入232例艾滋病合并重癥肺炎的患者。
1.2 方法
1.2.1 收集資料
本研究收集患者入住ICU時的數據:(1)一般資料:年齡、性別、入院前總病程、預后情況(28天存活或死亡)等;(2)生命體征,如體溫、呼吸頻率、心率、平均動脈壓等;(3)實驗室檢查指標及評分,包括pH、血小板計數、白細胞計數(white blood cell count,WBC)、血紅蛋白、降鈣素原(procalcitonin,PCT)、α-羥丁酸脫氫酶(α-hydroxybutyrate dehydrogenase; α-HBDH)、乳酸脫氫酶(lactate dehydrogenase,LDH)、C反應蛋白(C-reactive protein,CRP)、血乳酸、CD4+ T淋巴細胞計數、急性生理學和慢性健康狀況評價Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)、序貫器官衰竭評分(sequential organ failure assessment,SOFA)等;(4)基礎疾病情況:慢性阻塞性肺疾病、高血壓、慢性腎功能不全、糖尿病等。總計57項指標。
1.2.2 分組
回顧性分析所納入的病例資料,嚴格按照ARDS的診斷標準執行,以是否合并ARDS為標準,將患者分為ARDS組和非ARDS組。臨床上對于ARDS的診斷難點在于判斷肺水腫是否存在以及鑒別肺水腫的來源。目前脈搏指示連續心排出量(pulse indicates continuous cardiac output,PiCCO)被認為是診斷肺水腫最為準確的方法,但受有創操作相關損傷、導管相關感染可能、風險-受益比低等影晌導致臨床常規實施難度較大[8]。目前研究認為:無創心排出量監測(noninvasive cardiac output monitoring,NICOM)、超聲、PiCCO在危重患者血流動力學監測方面具有良好的一致性,可用于危重患者血流動力學的監測和評價[9]。因此,本研究所納入的所有患者均在病程中反復使用心肺聯合超聲和NICOM監測來對患者進行動態評估,據監測結果來進行肺水腫的診斷及鑒別診斷,以確保研究對象診斷的準確性。
1.3 統計學方法
采用EXCEL錄入數據,SPSS 24.0統計軟件進行統計分析。變量賦值轉化為最大程度的利用數據并保留資料的完整性,如年齡、CRP、WBC、PCT、APACHEⅡ評分、SOFA評分等連續型變量均采用原始數據代入,而慢性腎功能不全、高血壓等基礎疾病等定性資料按疾病有、無而分別賦值1和0代入計算。按患者轉歸情況不同分為ARDS組和非ARDS組,并分別賦值1和0,轉化為二分類變量。正態分布計量資料以均數±標準差(x±s)表示,采用t檢驗進行比較。非正態分布的計量資料以中位數(四分位間距)[M(IQR)]表示,采用非參數檢驗進行比較;計數資料以例(%)表示。組間比較采用單因素Logistic回歸分析,將P<0.05的自變量進行多重共線性分析,以剔除方差膨脹因子(variance inflation factor,VIF)大于10的變量,然后將不存在共線性的變量納入多因素Logistic逐步回歸模型進行危險因素分析(檢驗水準為0.05),最后繪制繪制受試者操作特征(receiver operating characteristic,ROC)曲線。
2 結果
2.1 一般資料
232例艾滋病重癥肺炎患者中有33例并發ARDS,發病率為14.2%。ARDS組患者年齡(49.9±16.7)歲,非ARDS組患者年齡(49.6±15.8)歲。232例艾滋病重癥肺炎患者,28天總計死亡94例,總病死率為40.5%,其中ARDS組死亡27例,組內病死率81.8%;非ARDS組死亡67例,組內病死率33.7%。ARDS組與非ARDS組入院時臨床特點比較各項指標的描述性統計分析結果按數據是否符合正態分布分為正態分布和非正態分布,詳見表1和表2,并通過對偏態分布的指標對其對數的方式將之轉化為正態分布數據。
2.2 患者并發ARDS風險的單因素Logistic回歸分析
將是否并發ARDS作為因變量,其余57項臨床資料為協變量,進行單因素Logistic回歸分析。pH、APACHEⅡ評分、SOFA評分、WBC、LDH、α-HBDH、ALT、AST、鈣、FDP、D-二聚體這11項指標有統計學意義(P<0.05),與非ARDS患者并發ARDS相關。其中APACHEⅡ評分、SOFA評分、pH、LDH、α-HBDH、ALT、AST、FDP、D-二聚體這9項指標是正回歸系數,比值比(odds ratio,OR)大于1,說明這些指標為正性作用因素,即這些指標值越高,發生ARDS的可能性越高。而pH、血清鈣離子這2項指標回歸系數為負,OR值小于1,說明這些變量為負性作用因素,即這些指標值越高,發生ARDS的可能性越低。結果見表3。
2.3 各因素間多重共線性分析
將這11個變量構建模型納入多重共線性問題分析,結果如表4所示。其中ALT及AST的VIF值大于10,說明這兩項指標間存在共線性,予以剔除;其余9項指標之間VIF值均小于10,由此可判斷這9個指標之間并不存在多重共線性問題,故可以將這9個指標作為最終對象納入Logistic模型中。
2.4 患者并發ARDS風險的多因素逐步Logistic回歸分析
將單因素Logistic回歸分析選擇出的11項指標在排除存在多重共線性關系的2項指標后,所留下的9個有統計學意義的指標納入多因素Logistic回歸分析中,并采用逐步向前法對變量進行分析。α-HBDH[OR=1.001,95%置信區間(confidence interval,CI)1.000~1.002,P=0.045]和D-二聚體(OR=1.044,95%CI 1.006~1.083,P=0.024)這兩項指標具有統計學意義(P<0.005)。結果見表5。因此,羥丁酸脫氫酶、D-二聚體這2個指標為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
2.5 對獨立危險因素繪制ROC曲線并分析
將α-HBDH、D-二聚體這2項獨立危險因素分別繪制ROC曲線,并計算約登指數找出最佳臨界值及其所對應的敏感性及特異性。艾滋病重癥肺炎患者并發ARDS的預測:(1)α-HBDH:ROC曲線下面積(area under ROC curve,AUC)為0.667,P=0.002,最佳臨界值為391 U/L,此時對應的敏感性為78.8%,特異性為61.8%),見圖1;(2)D-二聚體:AUC=0.602,P=0.062,最佳臨界值為4.855 μg/mL,對應的敏感性為42.4%,特異性為82.9%,見圖2。α-HBDH值越高(≥391 U/L)、D-二聚體越高(≥4.855 μg/mL)為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
 圖1
α-HBDH預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
圖1
α-HBDH預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
 圖2
D-二聚體預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
圖2
D-二聚體預測艾滋病重癥肺炎患者并發ARDS的ROC曲線
3 討論
本研究針對ICU艾滋病重癥肺炎患者并發ARDS危險因素進行分析,總計納入成都市公共衛生臨床醫療中心收治的232例艾滋病重癥肺炎患者的臨床資料,其中33例并發ARDS。ARDS組患者組內病死率81.8%,而非ARDS組的組內病死率33.7%,這與前文所述在患相同基礎疾病情況下,并發ARDS的患者病死率明顯高于未發生ARDS患者相一致。本研究隨后對納入分析的57項指標進行單因素Logistic回歸分析,發現共11項指標與ARDS的發生相關。排除了存在相互影響的ALT及AST兩項指標,再將pH、APACHEⅡ評分、SOFA評分、WBC、α-HBDH、羥丁酸脫氫酶、鈣、FDP、D-二聚體這9項指標納入多因素逐步Logistic回歸模型進行分析,結果發現α-HBDH和D-二聚體這2項指標為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
血清α-HBDH廣泛存在于心臟、肺、肝臟、骨骼肌、脾臟、腦、紅細胞等組織細胞的胞漿中,是LDH的同工酶之一,其檢測水平實際反映的是LDH1、LDH2的活性[10]。當心肌、肺組織、肝細胞等受到損傷時會釋放大量的α-HBDH。研究表明α-HBDH除用于急性心肌梗死的診斷外,尚因其參與糖酵解途徑而在甲狀腺功能低下、先兆子癇、貧血、腦炎、妊娠期肝內膽法淤積癥[11~14]等多種疾病的診斷中占有一席之地,同時亦可以作為評估急性胰腺炎、膀胱癌的預后及其早期生物標志物[15-16]。ARDS病程中伴隨著血管內皮細胞、透明膜、肺泡上皮細胞的損傷,α-HBDH必然出現上升,與本研究結果相一致。但α-HBDH的升高是否能夠作為ARDS的早期預警標志物及預后判斷依據尚無相關的報道。本研究首次在艾滋病重癥肺炎的患者中發現并得出血清α-HBDH為其并發ARDS的獨立危險因素,為后期進一步研究α-HBDH在ARDS的發生與發展過程中所起到的作用及產生的影響提供參考。
D-二聚體為交聯纖維蛋白的降解產物,其數值的增高能特異性的反映繼發性纖溶活性的增強,能有效反映血管內皮損傷的程度[17-18]。研究表明D-二聚體水平與膿毒癥所致ARDS病情和預后具有一定相關性[19]。本研究發現血清D-二聚體為艾滋病重癥肺炎患者并發ARDS的獨立危險因素,與國內外多項相似研究的結論一致。鑒于D-二聚體與血管內皮損傷、凝血功能異常均相關,以及ARDS是肺血管內皮功能受損后導致血管通透性增高性肺水腫形成,再結合本次研究結果,可以得出艾滋病重癥肺炎患者出現血漿D-二聚體水平的升高可能代表著血管內皮損傷、血管通透性增高,開始進入ARDS的病程。因此,血漿D-二聚體的升高能作為早期預測并發ARDS的生物標志之一。
本研究通過回顧性研究艾滋病重癥肺炎患者并發ARDS的危險因素,比較合并ARDS患者與未并發ARDS患者的一般情況、基礎疾病、實驗室指標等臨床病例資料,得出的主要結論如下。(1)研究所納入的艾滋病重癥肺炎患者中,并發ARDS占納入患者的14.2%,28天總病死率為40.5%,ARDS組內死亡率81.8%,非ARDS組內死亡率33.7%,進一步說明ARDS為艾滋病重癥肺炎患者的常見并發癥,且并發ARDS者死亡風險極大。(2)經單因素Logistic回歸分析,去除具有多重共線性的因素,再進行多因素Logistic回歸分析發現α-HBDH值(≥391 U/L)、D-二聚體(≥4.855 μg/mL)為艾滋病重癥肺炎患者并發ARDS的獨立危險因素。
本研究存在一定的局限性。首先,本研究為單中心回顧性隊列研究,預測模型準確性還有待大樣本多中心數據進一步驗證。其次,因艾滋病重癥肺炎合并ARDS的患者樣本量不足夠,未能以ARDS分度來進行分組,故未能建立預測ARDS嚴重程度的模型。最后,研究僅提取了ARDS發生前相關數據,并未進行長期的隨訪跟蹤分析,關于ARDS治療方案的選擇及可能影響患者預后的危險因素尚需進一步深入研究。
利益沖突:本研究不涉及任何利益沖突。