引用本文: 蔣云書, 童春堂, 董亮亮. 肺炎合并胸腔積液患者胸水淋巴細胞亞群分析及其與危重癥發生的關系. 中國呼吸與危重監護雜志, 2023, 22(11): 775-781. doi: 10.7507/1671-6205.202307035 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
肺炎是由不同病原體或宿主因素所引起的一種肺部炎癥,其中以細菌性肺炎最為常見。肺炎患者的臨床表現主要是咳嗽、咳痰及高熱等,具有癥狀表現多樣、病情進展迅速及發熱時間較長等典型特征[1]。若體內炎癥反映過強,會使肺部受到嚴重損害,引起并發癥。其中合并胸腔積液是肺炎中最為常見的并發癥,常見致病菌包括肺炎鏈球菌、金黃色葡萄球菌等,常為混合感染,使治療難度加大[2]。胸腔積液主要是由感染和惡性腫瘤引起[3]。少量的胸腔積液可通過內科保守治療緩慢吸收,中等以上胸腔積液需外科胸腔穿刺引流進行治療[4]。淋巴細胞(lymphocyte,LYM)在機體中發揮重要功能,是一類免疫細胞,由淋巴器官產生,主要存在于淋巴管內循環的淋巴液中[5]。其中T淋巴細胞及其亞群是細胞免疫中重要的組成部分,在機體免疫過程中不可或。胸腔積液患者胸水性質不同,機體的免疫狀態也會不同[6]。通過分析肺炎合并胸腔積液患者的T淋巴細胞亞群(T lymphocyte Subsets,TLS),有助于對重癥肺炎的鑒別。當肺炎合并胸腔積液患者發生重癥肺炎時,臨床上通常C反應蛋白(C-reactive protein,CRP)、乳酸脫氫酶(lactate dehydrogenase,LDH)等生物標志物會產生變化[7]。研究指出機體一系列的免疫應答反應能夠激活凝血-纖溶系統,參與胸腔積液的炎癥發展過程[8]。但目前關于胸水淋巴細胞亞群與肺炎合并胸腔積液患者的嚴重程度之間的關系研究尚缺乏,故本研究將探討肺炎合并胸腔積液患者胸水淋巴細胞亞群與危重癥發生的關系,為重癥肺炎的臨床診治提供更多臨床依據。
1 資料與方法
1.1 臨床資料
選擇2020年1月—2022年6月我院收治的細菌性肺炎合并胸腔積液患者246例為研究對象,根據肺炎嚴重程度分為危重癥組(n=150)和非危重癥組(n=96),其中男128例,女118例,年齡35~65歲,平均年齡(55.20±9.66)歲。兩組患者采用傾向性評分匹配(propensity score matching,PSM)法按1∶1匹配后,兩組各為60例患者。本研究經我院醫學倫理委員會審核批準,患者及家屬均簽署知情同意書。納入標準:(1)所有患者入院時有影像學(胸部X線或CT)檢查,且胸部X線顯示肺部大片炎癥;(2)肺部CT或胸部彩超提示伴有胸腔積液;(3)患者及家屬均知情同意自愿參與研究;(4)隨訪資料完整。排除標準:(1)排除先天性心臟病、腫瘤等非肺炎因素引起的胸腔積液;(2)存在其他部位感染;(3)患有其他影響淋巴細胞亞群結果的血液系統疾病;(4)合并其他部位感染或免疫性疾病;(5)存在結核性胸膜炎等易引起胸腔積液等疾病的患者。
1.2 方法
1.2.1 收集資料
采集所有患者的各項資料,包括:(1)一般資料:性別、年齡、體重指數(body mass index,BMI)、病程、吸煙史、飲酒史、熱峰、熱程、住院時間、合并肺不張以及合并壞死性肺炎;(2)基礎疾病:高血壓、糖尿病、冠心病、腦血管疾病;(3)臨床癥狀:發熱、咯血或痰中帶血、咳嗽、咳痰、胸悶、氣促、呼吸困難、胸痛、乏力及其他。
1.2.2 分組
根據肺炎嚴重程度分組。按照肺炎嚴重度指數(pneumonia severity index,PSI)[9]:<50分為Ⅰ級,50~70分為Ⅱ級,70~89分為Ⅲ級,90~130分為Ⅳ級,?130分為V級。Ⅰ~Ⅲ級劃分為非危重癥組,Ⅳ~Ⅴ級劃分為危重癥組。
1.2.3 實驗室檢測
所有肺炎合并胸腔積液患者均在入院第1天清晨采集空腹靜脈血,取患者的胸腔穿刺積液,離心取上清液。采用HITDADF7600型全自動生化分析儀(山東東軟公司)及原廠配套試劑檢測(化學發光法)降鈣素原(procalcitonin,PCT)和CRP、采用Vidas D-二聚體試劑盒(VIDAS DD,France)及原廠配套試劑檢測D-二聚體(D-dimer,D-D)、采用VITROS5600全自動生化免疫分析儀(美國強生公司)及原廠配套試劑檢測LDH,采用SYSMEX XE-5000全自動血液分析儀(日本SYSMEX公司)及原廠配套試劑檢測血紅蛋白(hemoglobin,Hb)。采用FACSCalibur型流式細胞儀(美國Bectond-Dickinson公司)及原廠配套試劑檢測胸水淋巴細胞亞群(CD3+、CD4+及CD8+、CD4+/CD8+)。采用血常規檢測中性粒細胞(neutrophil,NEUT)、LYM、血小板(platelet,PLT)、外周血白細胞計數(white blood cell count,WBC)。
1.3 統計學方法
采用SPSS 23.0統計軟件。呈正態分布的計量資料以均數±標準差(x±s)表示,采用t檢驗比較兩組之間的差異。計數資料采用例(%)表示,采用χ2檢驗進行組間比較。采用Logistic回歸分析影響為重癥肺炎發生的危險因素。依據值對各保護因素進行賦分,構建列線圖預測模型。采用受試者操作特征曲線(receiver operating characteristic curve,ROC曲線)和Hosmer-Lemeshow goodness-of-fit檢驗模型的區分度和校準度。采用臨床決策(decision curve analysis,DCA)曲線評價模型的精準度。采用局部加權回歸散點平滑方法(locally weighted scatterplot smooothing,LOWESS)進行PSI評分與胸水淋巴細胞亞群數據點的曲線擬合。檢驗水準α=0.05。
2 結果
2.1 匹配前后兩組患者的基線特征比較
采用PSM法進行1∶1匹配,共匹配成功60對。匹配后兩組患者只在病程、熱峰、熱程、合并肺不張、WBC、CRP、D-D、PCT及Hb的差異有統計學意義(均P<0.05)。結果見表1。
2.2 兩組肺炎合并胸腔積液患者胸水淋巴細胞亞群比較
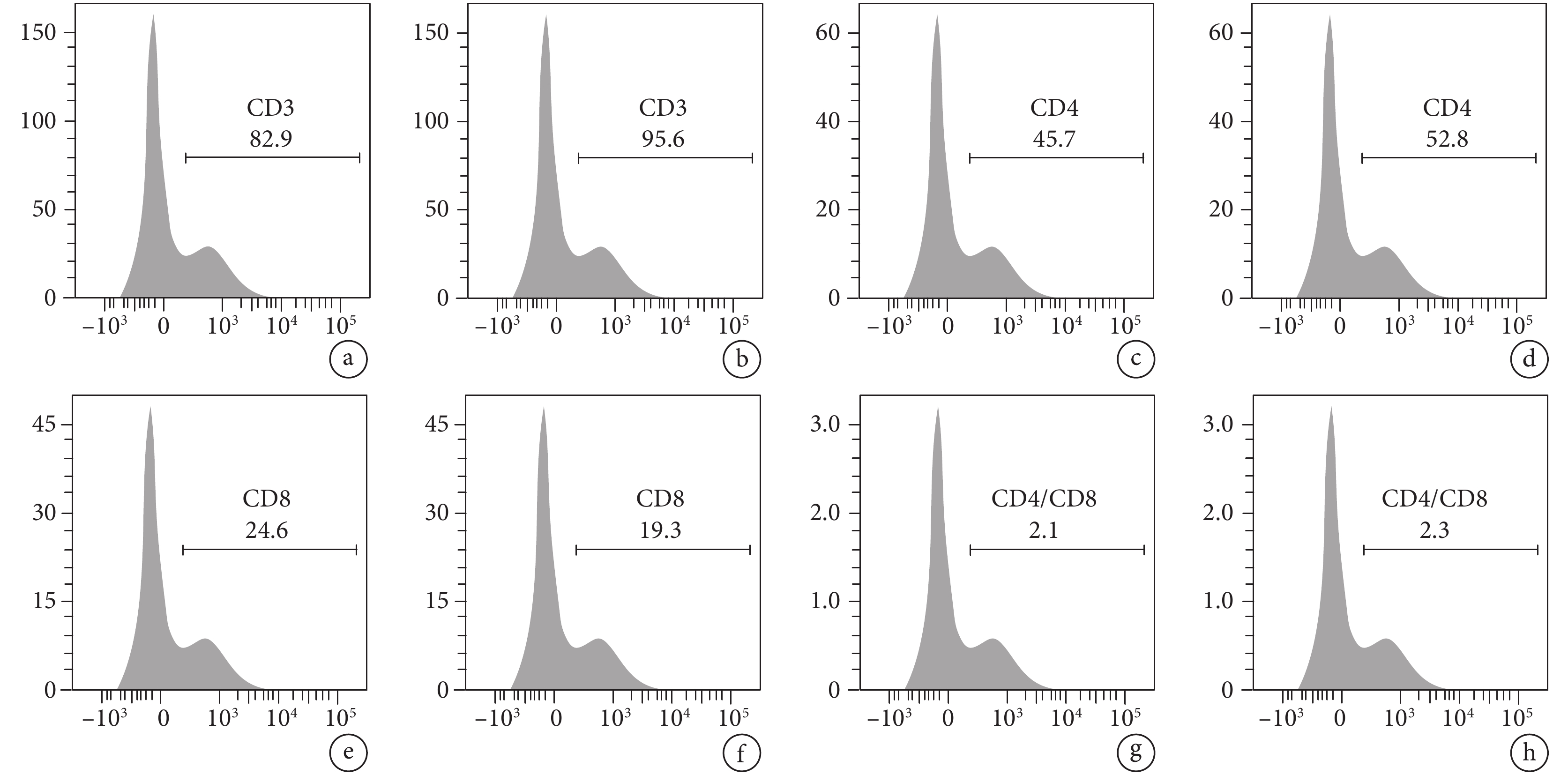
兩組肺炎合并胸腔積液患者胸水淋巴細胞亞群差異有統計學意義(P<0.05)。與非危重組相比,危重組患者CD3+、CD4+、CD4+/CD8+細胞比例均更低(P<0.05),CD8+細胞比例更高(P<0.05)。結果見圖1。
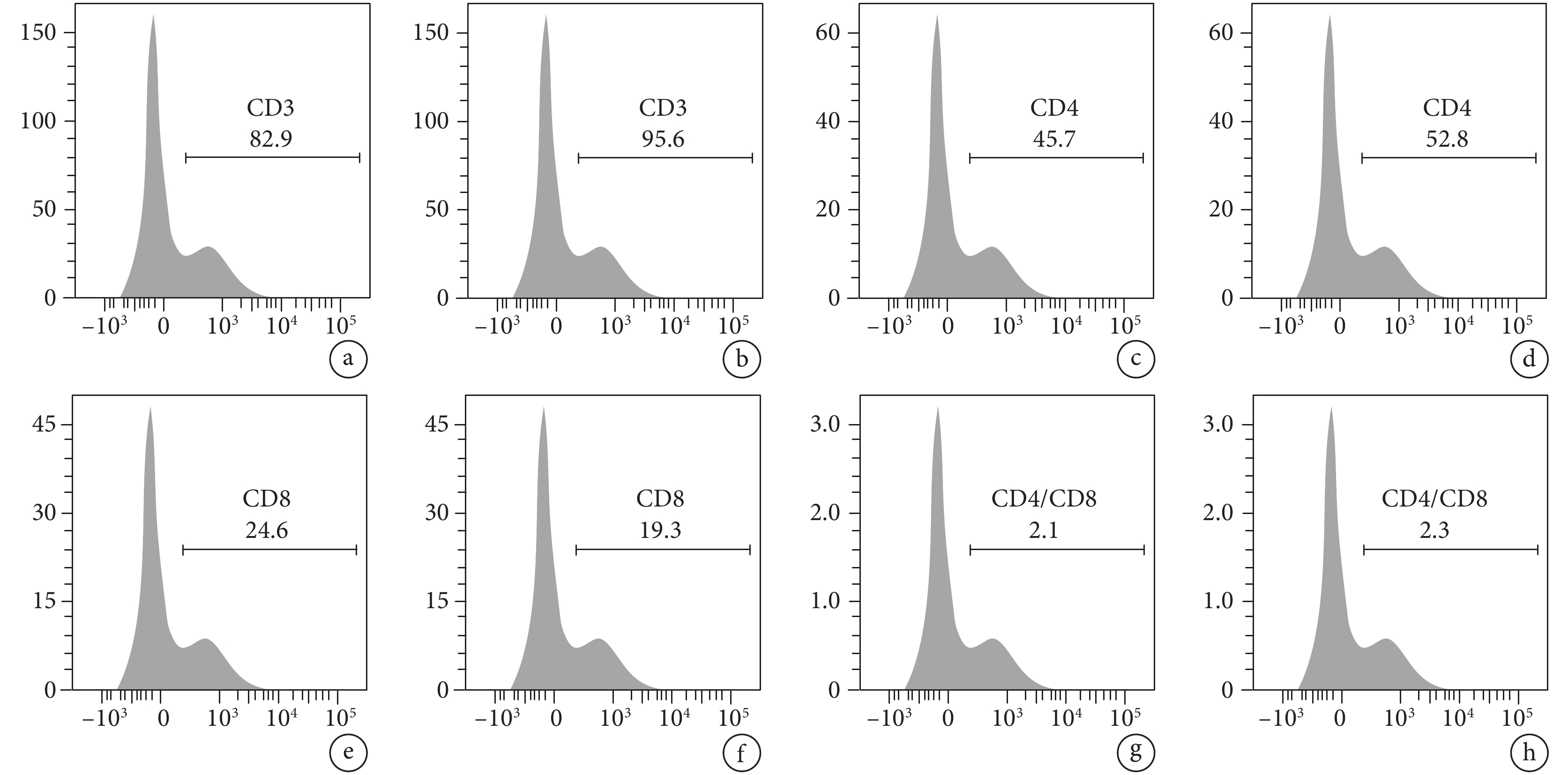 圖1
兩組患者CD3+、CD4+、CD8+、CD4+/CD8+細胞比例
圖1
兩組患者CD3+、CD4+、CD8+、CD4+/CD8+細胞比例
a. 危重組患者CD3+細胞比例;b. 非危重組患者CD3+細胞比例;c. 危重組患者CD4+細胞比例;d. 非危重組患者CD4+細胞比例;e. 危重組患者CD8+細胞比例;f. 非危重組患者CD8+細胞比例;g. 為危重組患者CD4+/CD8+細胞比例;h. 非危重組患者CD4+/CD8+細胞比例。
2.3 多因素Logistics回歸分析影響危重癥肺炎發生的危險因素
以表1中匹配后兩組差異有統計學意義的指標為自變量,以患者是否發生危重癥肺炎為因變量,進行多因素Logistic回歸分析。結果顯示合并肺不張,病程、熱峰、熱程升高,WBC、CRP、D-D、CD8+以及PCT水平升高,CD3+、CD4+、CD4+/CD8+以及Hb水平降低均為危重癥肺炎發生的獨立危險因素(P<0.05),結果見表2和表3。
2.4 構建列線圖預測模型
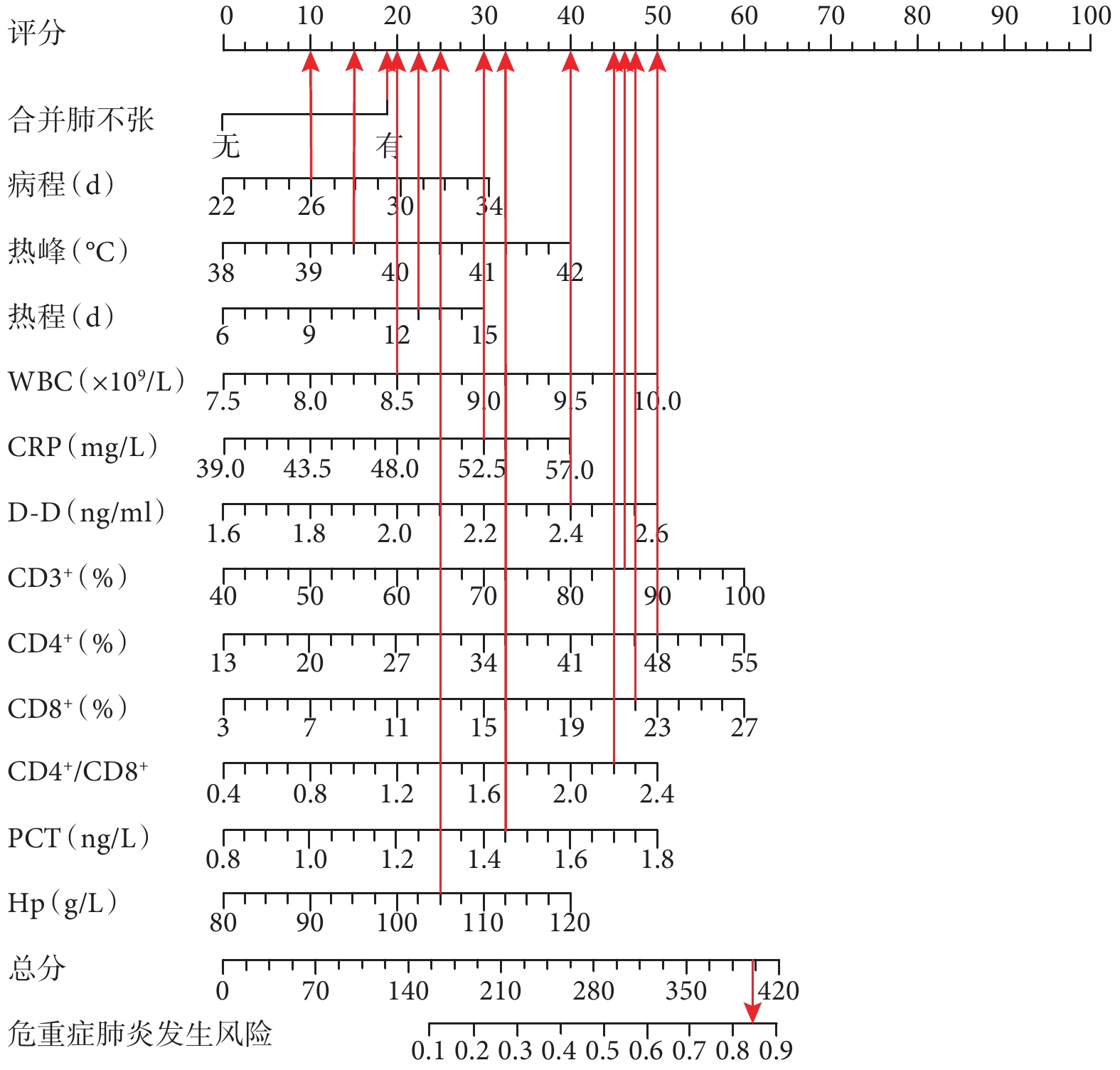
將Logistics分析當中的各危險因素代入SPSS中生成列線圖模型。根據列線圖模型讀出對應指標的賦分結果,預測危重癥肺炎發生風險。例如李某,合并肺不張對應賦分為18分;病程為26.5 d,對應賦分為10分;熱峰為39.8 ℃,對應賦分15分;熱程為14 d,對應賦分22分;WBC為8.5×109/L,對應賦分20分;CRP為52.5 mg/L,對應賦分30分;D-D為2.4 ng/mL,對應賦分40分;PCT為1.5 ng/L,對應賦分32分;CD3+為85%,對應賦分46分;CD4+為48%,對應賦分50分;CD8+為22 %,對應賦分48分;CD4+/CD8+為2.2,對應賦分45分;Hb為105.4 g/L,對應賦分25分;總分為401分。其危重癥肺炎發生風險為84.56 %。結果見圖2。
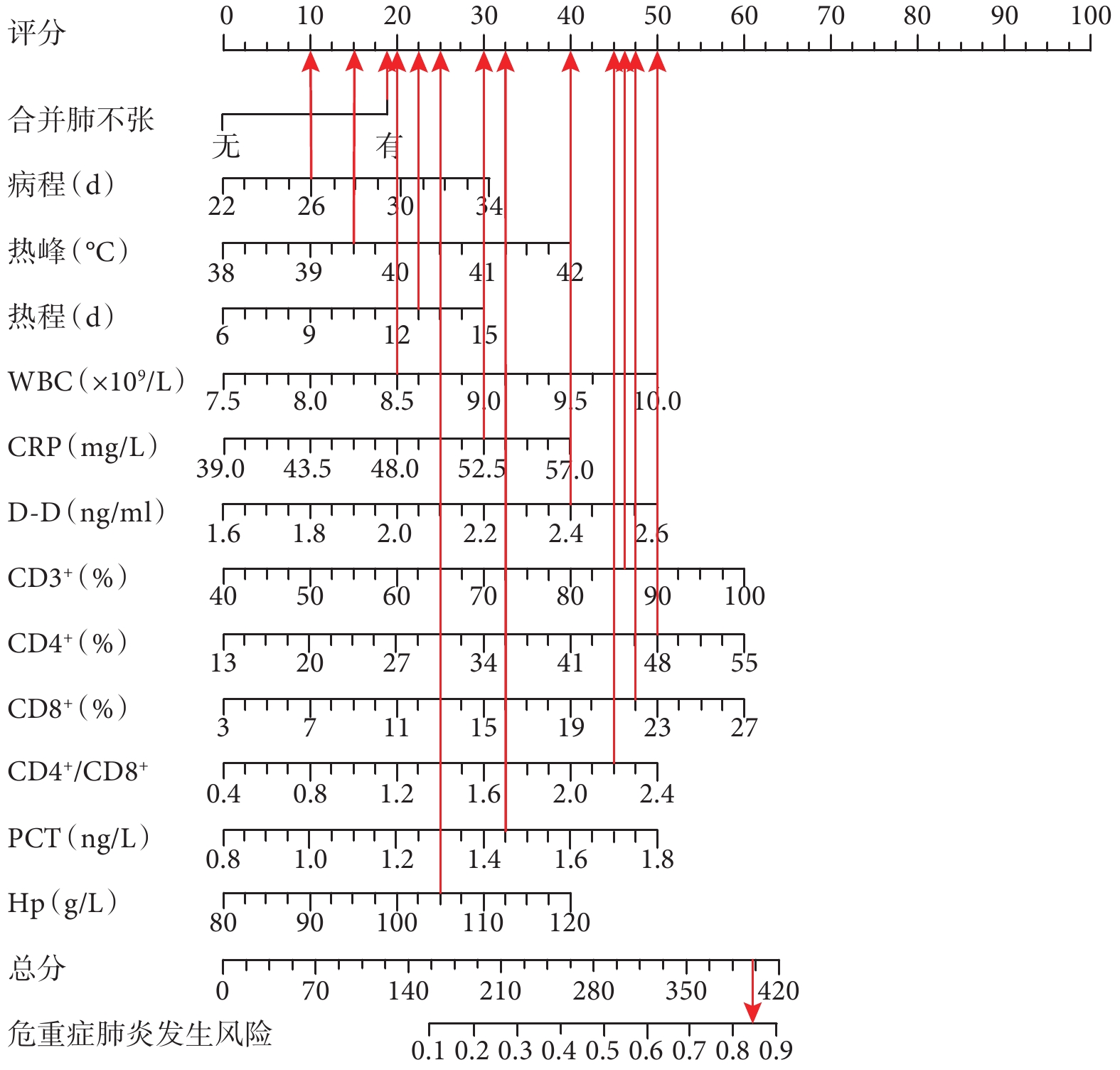 圖2
列線圖預測模型
圖2
列線圖預測模型
2.5 模型評價
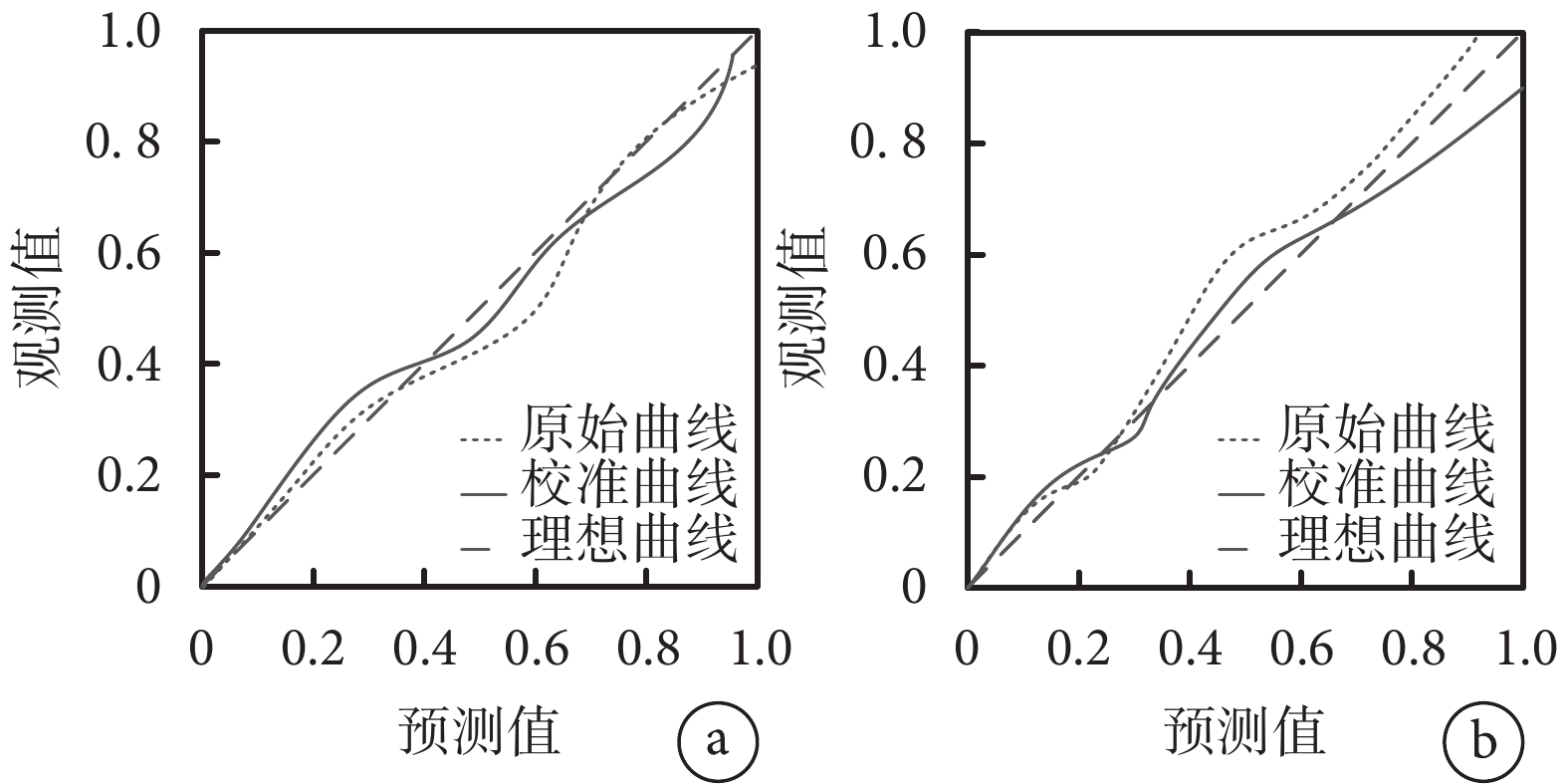
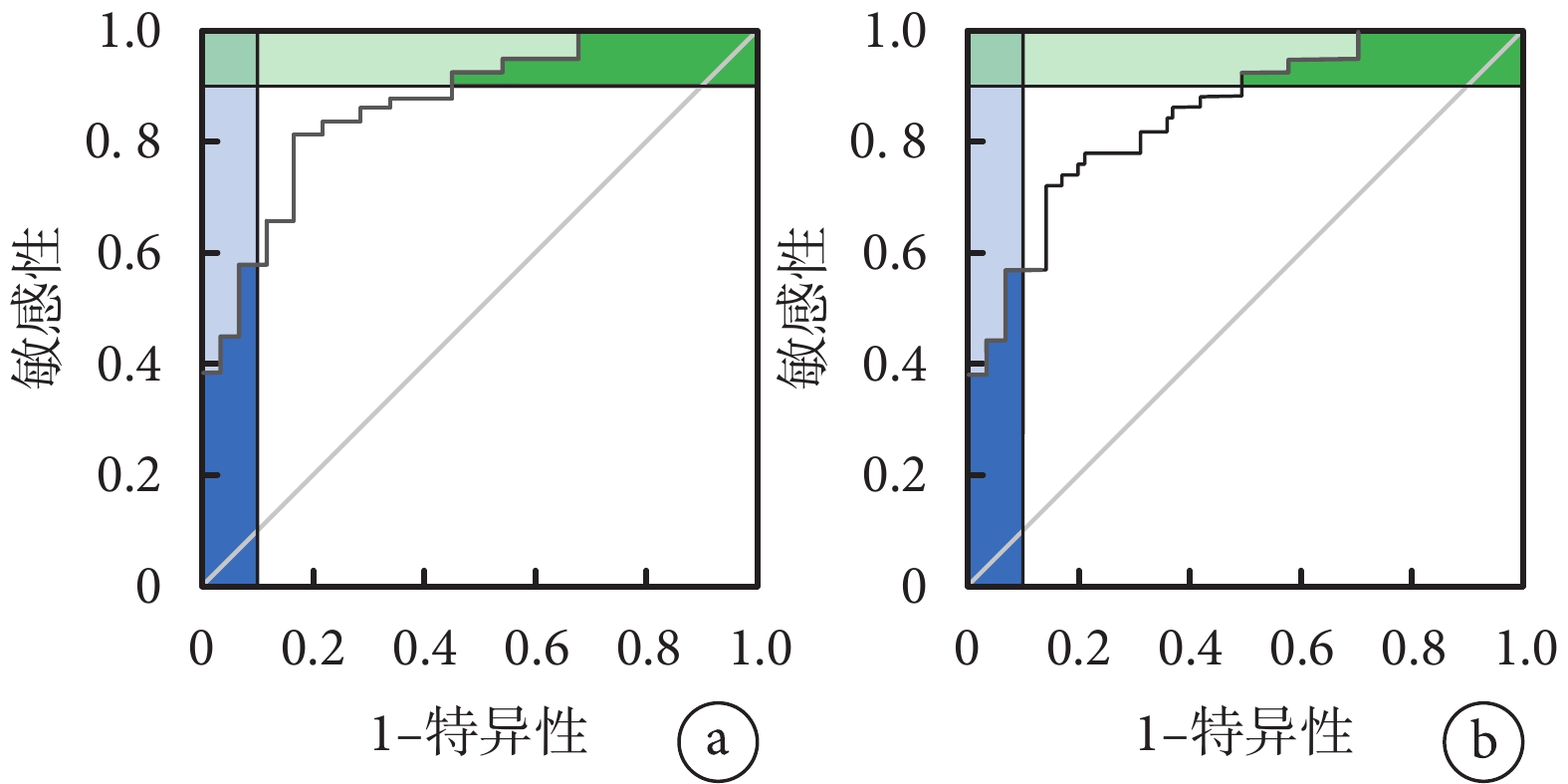
列線圖模型內部驗證采用Bootstrap重采樣1 000次進行,重復采樣前后以列線圖所得危重癥肺炎發生的風險事件發生風險為檢驗變量,實際危重癥肺炎發生情況為狀態變量構建ROC曲線及校準曲線,并計算曲線下面積、預測概率及危重癥肺炎的平均絕對誤差,結果顯示,內部驗證前后的ROC曲線下面積分別為0.866(95%CI 0.822~0.885)和0.822(95%CI 0.810~0.868),敏感性分別為87.10%、85.05%,特異度分別為90.25%、90.54%,平均絕對誤差均為0.010,說明該列線圖模型有較高的區分度和校準度且靈敏性和特異信良好。結果見圖3、圖4及表4。
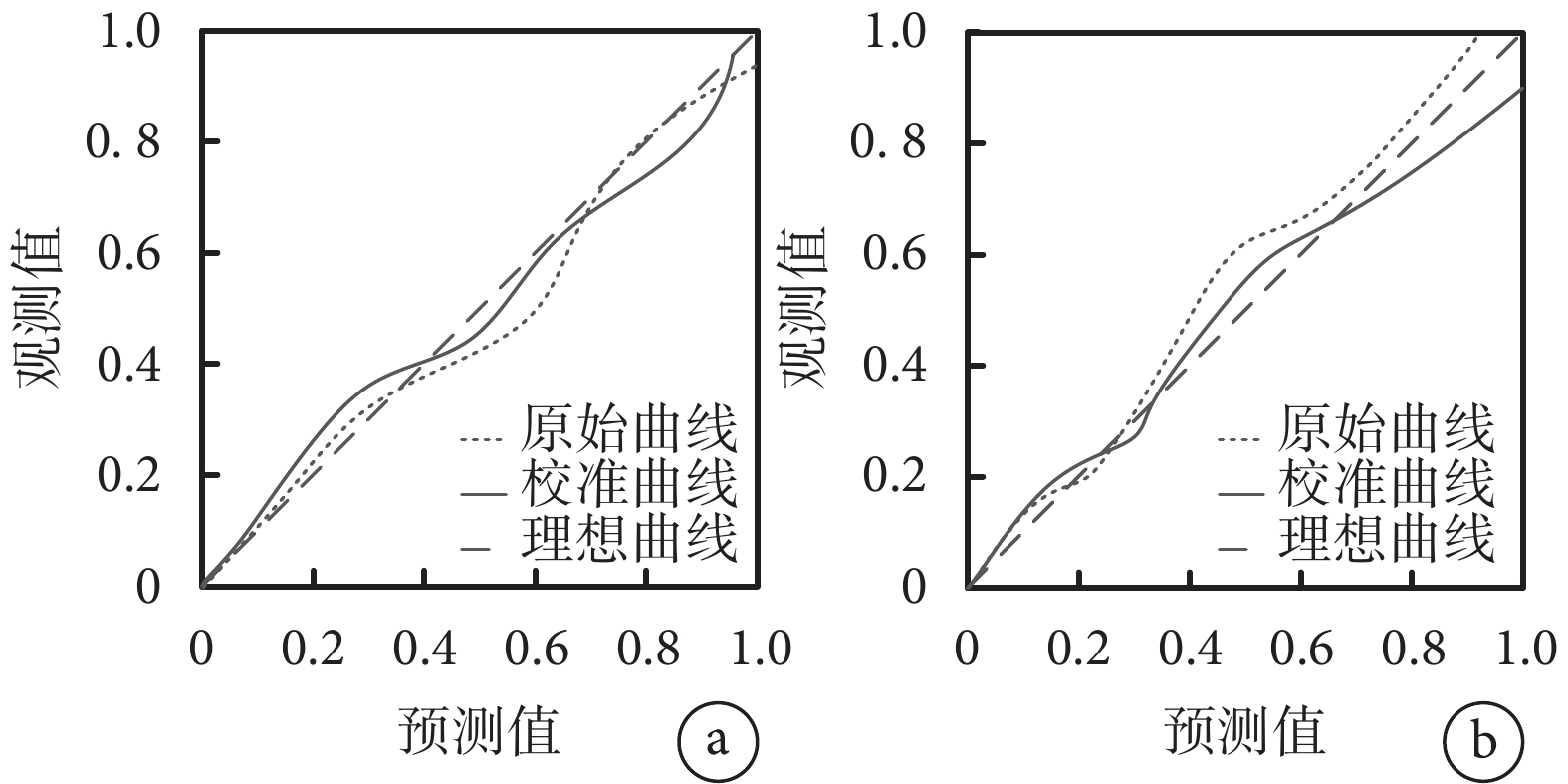 圖3
預測模型的校準曲線
圖3
預測模型的校準曲線
a. 內部驗證前;b. 內部驗證后。
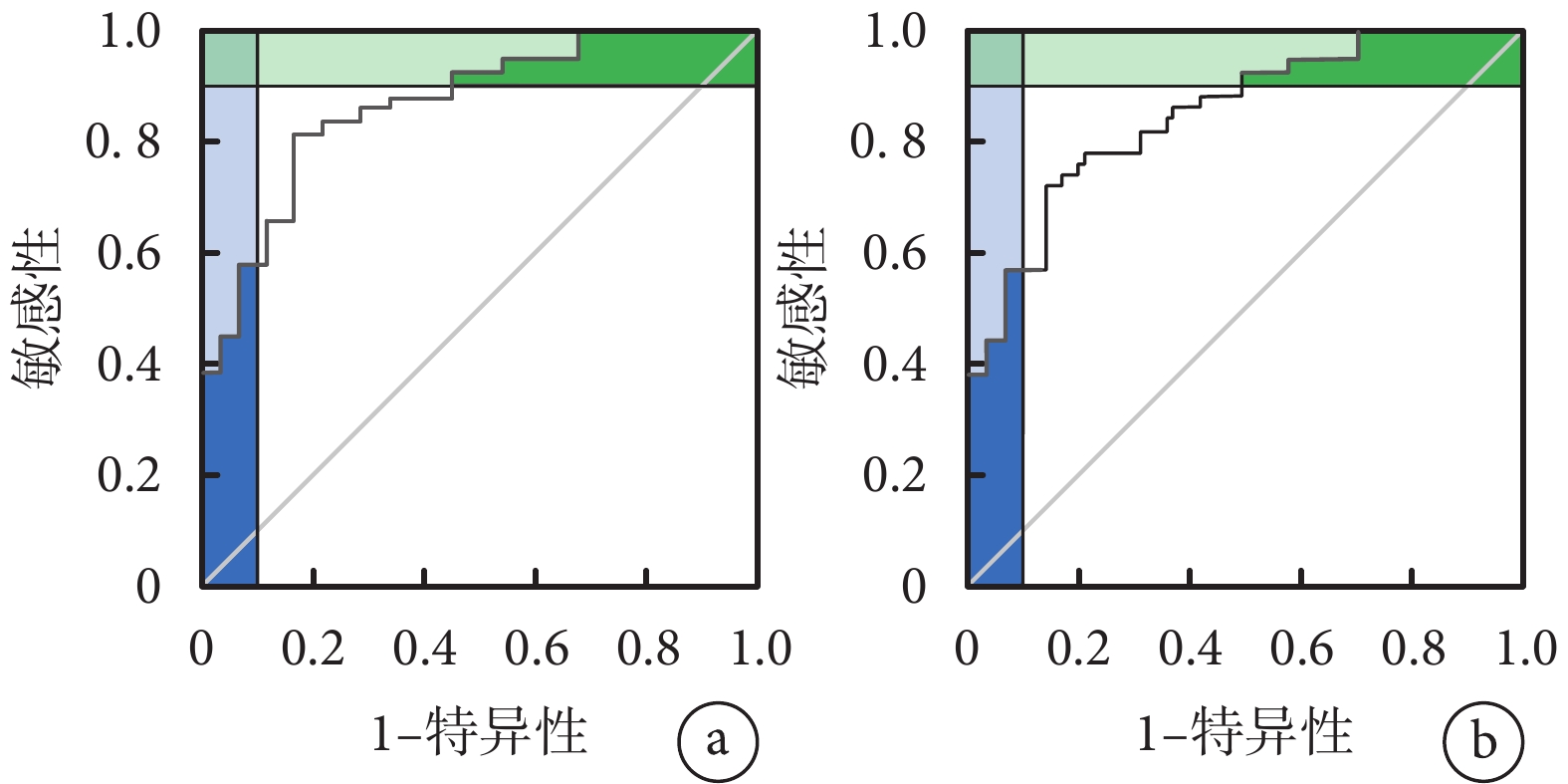 圖4
預測模型的ROC曲線
圖4
預測模型的ROC曲線
a. 內部驗證前;b. 內部驗證后。
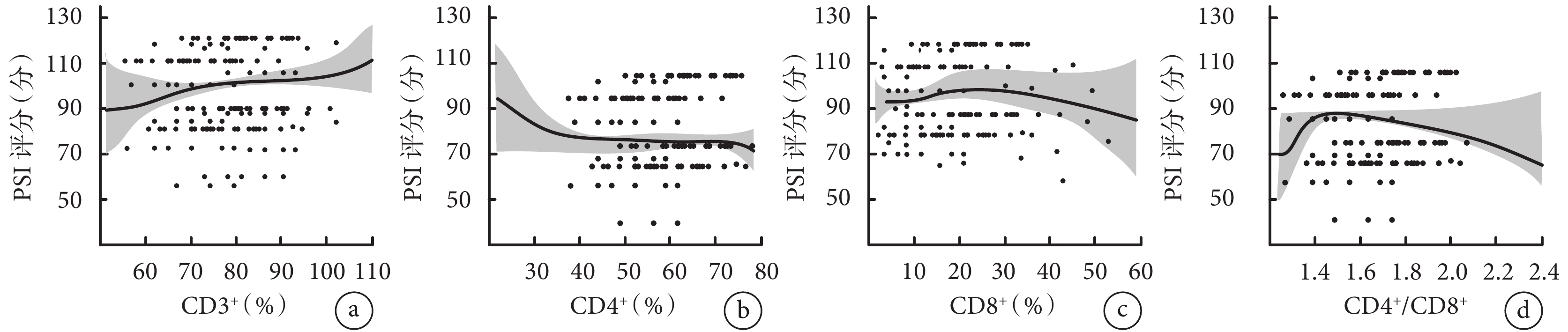
2.6 PSI評分與胸水淋巴細胞亞群的線性分析
LOWESS方法分析PSI評分與CD3+、CD4+、CD8+以及CD4+/CD8+之間的曲線關聯。結果顯示,PSI評分和CD3+、CD4+、CD8+以及CD4+/CD8+均具有一定的非線性關系。結果見圖5。
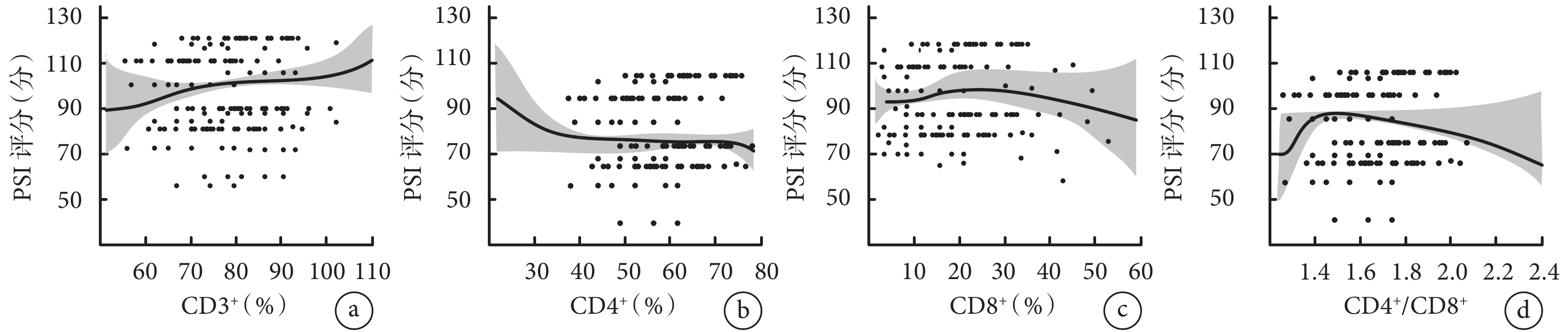 圖5
胸水淋巴細胞亞群與PSI評分的LOWESS分析
圖5
胸水淋巴細胞亞群與PSI評分的LOWESS分析
a. PSI評分與CD3+的線性分析;b. PSI評分與CD4+的線性分析;c. PSI評分與CD8+的線性分析;d. PSI評分與CD4+/CD8+的線性分析。
3 討論
肺炎作為一種常見傳染病,普遍存在咳嗽、咳痰等呼吸道癥狀和體征。另外,此類患者部分存在不同程度的胸腔積液情況,而胸腔積液的發生又導致患者生存質量進一步變差,甚至危及到患者的生命安全[10]。有報道指出合并胸腔積液會進一步導致患者炎性狀態的加重,提示可以通過檢測炎性指標,診斷肺炎嚴重程度[11]。TLS作為胸水淋巴細胞亞群中不可或缺的組成部分,參與機體免疫過程。TLS主要包括CD3+、CD4+、CD8+、CD4+/CD8+。研究發現肺炎合并胸腔積液患者外周血CD3+、CD4+細胞比例高于健康人[12]。Kamrani等[13]研究發現TLS在胸腔積液患者外周血與胸水中分布相似,且CD3+、CD4+細胞比例在惡性胸腔積液患者中相較于良性胸腔積液患者較低,提示TLS水平的變化可以鑒別良性胸腔積液與惡性胸腔積液。本研究結果顯示,PSI評分與CD3+、CD4+、CD8+以及CD4+/CD8+均具有一定的非線性關系,這與文獻[14]報道相一致。但目前關于肺炎合并胸腔積液患者病情嚴重程度與胸水淋巴細胞亞群的關系尚無明確定論。
本研究結果顯示,合并肺不張,病程、熱峰、熱程升高,WBC、CRP、D-D、CD8+及PCT水平升高,CD3+、CD4+、CD4+/CD8+及Hb水平降低均為危重癥肺炎發生的獨立危險因素。有研究指出若肺炎患者肺不張長期存在,會增加肺部炎癥和肺膿腫等發生率[15]。魯成等[16]研究發現,相較于普通型患者,重型新冠肺炎患者血清Hb水平降低,病程及住院時間更長。CRP作為急性時相反應蛋白,普遍參與體內各種炎癥,PCT是在細菌內毒素和機體炎癥因子誘導下生成的多肽類降鈣素激素原[17]。CRP和PCT作為炎癥指標在病情判斷和診斷療效上已得到臨床應用[18]。且研究發現WBC以及CRP是反映炎癥的指標,當機體出現炎癥或受到損傷時,會普遍升高[19],這與本研究結果相一致。樊亞麗等[20]研究發現,較高的熱峰及較長的熱程是支原體肺炎合并胸腔積液的獨立危險因素。當患者體內炎癥反應過度或血管內皮長時間持續損傷,血清中D-D水平會顯著升高[21]。持續的淋巴細胞減少,尤其是CD4+ T淋巴細胞水平的降低,對重癥肺炎的治療及預后有一定的提示意義[22]。CD3+ T淋巴細胞計數、CD4+ T淋巴細胞計數及CD8+ T淋巴細胞計數可作為重癥肺炎患者預后評估的早期預測指標。T淋巴細胞在感染后的獲得性免疫反應中起著關鍵作用,在重癥感染過程中淋巴細胞易發生凋亡,導致CD4+ T淋巴細胞明顯下降,同時炎癥細胞被大量激活,釋放出多種促炎和抗炎因子,導致重癥肺炎的發生[23]。在惡性胸腔積液患者胸水中CD3+、CD4+、CD4+/CD8+值較良性胸腔積液患者更低,而CD8+ T淋巴細胞則顯著升高[24]。這提示通過CD3+、CD4+、CD8+、CD4+/CD8+值的變化,可以判斷危重癥肺炎是否發生,在評估疾病的嚴重程度中發揮重要作用。
本研究存在一定的局限性:(1)缺少外對照組,無法進行擴展性的驗證;(2)本研究病例數較少,可能導致結果出現偏差,尚需要大量病例數進一步研究。因此,后續需要擴大病例數進行前瞻性研究。
綜上所述,胸水淋巴細胞亞群與肺炎合并胸腔積液患者的嚴重程度關系密切,CD3+、CD4+、CD8+及CD4+/CD8+若出現異常,需注意重癥肺炎的發生。
利益沖突:本研究不涉及任何利益沖突。
肺炎是由不同病原體或宿主因素所引起的一種肺部炎癥,其中以細菌性肺炎最為常見。肺炎患者的臨床表現主要是咳嗽、咳痰及高熱等,具有癥狀表現多樣、病情進展迅速及發熱時間較長等典型特征[1]。若體內炎癥反映過強,會使肺部受到嚴重損害,引起并發癥。其中合并胸腔積液是肺炎中最為常見的并發癥,常見致病菌包括肺炎鏈球菌、金黃色葡萄球菌等,常為混合感染,使治療難度加大[2]。胸腔積液主要是由感染和惡性腫瘤引起[3]。少量的胸腔積液可通過內科保守治療緩慢吸收,中等以上胸腔積液需外科胸腔穿刺引流進行治療[4]。淋巴細胞(lymphocyte,LYM)在機體中發揮重要功能,是一類免疫細胞,由淋巴器官產生,主要存在于淋巴管內循環的淋巴液中[5]。其中T淋巴細胞及其亞群是細胞免疫中重要的組成部分,在機體免疫過程中不可或。胸腔積液患者胸水性質不同,機體的免疫狀態也會不同[6]。通過分析肺炎合并胸腔積液患者的T淋巴細胞亞群(T lymphocyte Subsets,TLS),有助于對重癥肺炎的鑒別。當肺炎合并胸腔積液患者發生重癥肺炎時,臨床上通常C反應蛋白(C-reactive protein,CRP)、乳酸脫氫酶(lactate dehydrogenase,LDH)等生物標志物會產生變化[7]。研究指出機體一系列的免疫應答反應能夠激活凝血-纖溶系統,參與胸腔積液的炎癥發展過程[8]。但目前關于胸水淋巴細胞亞群與肺炎合并胸腔積液患者的嚴重程度之間的關系研究尚缺乏,故本研究將探討肺炎合并胸腔積液患者胸水淋巴細胞亞群與危重癥發生的關系,為重癥肺炎的臨床診治提供更多臨床依據。
1 資料與方法
1.1 臨床資料
選擇2020年1月—2022年6月我院收治的細菌性肺炎合并胸腔積液患者246例為研究對象,根據肺炎嚴重程度分為危重癥組(n=150)和非危重癥組(n=96),其中男128例,女118例,年齡35~65歲,平均年齡(55.20±9.66)歲。兩組患者采用傾向性評分匹配(propensity score matching,PSM)法按1∶1匹配后,兩組各為60例患者。本研究經我院醫學倫理委員會審核批準,患者及家屬均簽署知情同意書。納入標準:(1)所有患者入院時有影像學(胸部X線或CT)檢查,且胸部X線顯示肺部大片炎癥;(2)肺部CT或胸部彩超提示伴有胸腔積液;(3)患者及家屬均知情同意自愿參與研究;(4)隨訪資料完整。排除標準:(1)排除先天性心臟病、腫瘤等非肺炎因素引起的胸腔積液;(2)存在其他部位感染;(3)患有其他影響淋巴細胞亞群結果的血液系統疾病;(4)合并其他部位感染或免疫性疾病;(5)存在結核性胸膜炎等易引起胸腔積液等疾病的患者。
1.2 方法
1.2.1 收集資料
采集所有患者的各項資料,包括:(1)一般資料:性別、年齡、體重指數(body mass index,BMI)、病程、吸煙史、飲酒史、熱峰、熱程、住院時間、合并肺不張以及合并壞死性肺炎;(2)基礎疾病:高血壓、糖尿病、冠心病、腦血管疾病;(3)臨床癥狀:發熱、咯血或痰中帶血、咳嗽、咳痰、胸悶、氣促、呼吸困難、胸痛、乏力及其他。
1.2.2 分組
根據肺炎嚴重程度分組。按照肺炎嚴重度指數(pneumonia severity index,PSI)[9]:<50分為Ⅰ級,50~70分為Ⅱ級,70~89分為Ⅲ級,90~130分為Ⅳ級,?130分為V級。Ⅰ~Ⅲ級劃分為非危重癥組,Ⅳ~Ⅴ級劃分為危重癥組。
1.2.3 實驗室檢測
所有肺炎合并胸腔積液患者均在入院第1天清晨采集空腹靜脈血,取患者的胸腔穿刺積液,離心取上清液。采用HITDADF7600型全自動生化分析儀(山東東軟公司)及原廠配套試劑檢測(化學發光法)降鈣素原(procalcitonin,PCT)和CRP、采用Vidas D-二聚體試劑盒(VIDAS DD,France)及原廠配套試劑檢測D-二聚體(D-dimer,D-D)、采用VITROS5600全自動生化免疫分析儀(美國強生公司)及原廠配套試劑檢測LDH,采用SYSMEX XE-5000全自動血液分析儀(日本SYSMEX公司)及原廠配套試劑檢測血紅蛋白(hemoglobin,Hb)。采用FACSCalibur型流式細胞儀(美國Bectond-Dickinson公司)及原廠配套試劑檢測胸水淋巴細胞亞群(CD3+、CD4+及CD8+、CD4+/CD8+)。采用血常規檢測中性粒細胞(neutrophil,NEUT)、LYM、血小板(platelet,PLT)、外周血白細胞計數(white blood cell count,WBC)。
1.3 統計學方法
采用SPSS 23.0統計軟件。呈正態分布的計量資料以均數±標準差(x±s)表示,采用t檢驗比較兩組之間的差異。計數資料采用例(%)表示,采用χ2檢驗進行組間比較。采用Logistic回歸分析影響為重癥肺炎發生的危險因素。依據值對各保護因素進行賦分,構建列線圖預測模型。采用受試者操作特征曲線(receiver operating characteristic curve,ROC曲線)和Hosmer-Lemeshow goodness-of-fit檢驗模型的區分度和校準度。采用臨床決策(decision curve analysis,DCA)曲線評價模型的精準度。采用局部加權回歸散點平滑方法(locally weighted scatterplot smooothing,LOWESS)進行PSI評分與胸水淋巴細胞亞群數據點的曲線擬合。檢驗水準α=0.05。
2 結果
2.1 匹配前后兩組患者的基線特征比較
采用PSM法進行1∶1匹配,共匹配成功60對。匹配后兩組患者只在病程、熱峰、熱程、合并肺不張、WBC、CRP、D-D、PCT及Hb的差異有統計學意義(均P<0.05)。結果見表1。
2.2 兩組肺炎合并胸腔積液患者胸水淋巴細胞亞群比較
兩組肺炎合并胸腔積液患者胸水淋巴細胞亞群差異有統計學意義(P<0.05)。與非危重組相比,危重組患者CD3+、CD4+、CD4+/CD8+細胞比例均更低(P<0.05),CD8+細胞比例更高(P<0.05)。結果見圖1。
 圖1
兩組患者CD3+、CD4+、CD8+、CD4+/CD8+細胞比例
圖1
兩組患者CD3+、CD4+、CD8+、CD4+/CD8+細胞比例
a. 危重組患者CD3+細胞比例;b. 非危重組患者CD3+細胞比例;c. 危重組患者CD4+細胞比例;d. 非危重組患者CD4+細胞比例;e. 危重組患者CD8+細胞比例;f. 非危重組患者CD8+細胞比例;g. 為危重組患者CD4+/CD8+細胞比例;h. 非危重組患者CD4+/CD8+細胞比例。
2.3 多因素Logistics回歸分析影響危重癥肺炎發生的危險因素
以表1中匹配后兩組差異有統計學意義的指標為自變量,以患者是否發生危重癥肺炎為因變量,進行多因素Logistic回歸分析。結果顯示合并肺不張,病程、熱峰、熱程升高,WBC、CRP、D-D、CD8+以及PCT水平升高,CD3+、CD4+、CD4+/CD8+以及Hb水平降低均為危重癥肺炎發生的獨立危險因素(P<0.05),結果見表2和表3。
2.4 構建列線圖預測模型
將Logistics分析當中的各危險因素代入SPSS中生成列線圖模型。根據列線圖模型讀出對應指標的賦分結果,預測危重癥肺炎發生風險。例如李某,合并肺不張對應賦分為18分;病程為26.5 d,對應賦分為10分;熱峰為39.8 ℃,對應賦分15分;熱程為14 d,對應賦分22分;WBC為8.5×109/L,對應賦分20分;CRP為52.5 mg/L,對應賦分30分;D-D為2.4 ng/mL,對應賦分40分;PCT為1.5 ng/L,對應賦分32分;CD3+為85%,對應賦分46分;CD4+為48%,對應賦分50分;CD8+為22 %,對應賦分48分;CD4+/CD8+為2.2,對應賦分45分;Hb為105.4 g/L,對應賦分25分;總分為401分。其危重癥肺炎發生風險為84.56 %。結果見圖2。
 圖2
列線圖預測模型
圖2
列線圖預測模型
2.5 模型評價
列線圖模型內部驗證采用Bootstrap重采樣1 000次進行,重復采樣前后以列線圖所得危重癥肺炎發生的風險事件發生風險為檢驗變量,實際危重癥肺炎發生情況為狀態變量構建ROC曲線及校準曲線,并計算曲線下面積、預測概率及危重癥肺炎的平均絕對誤差,結果顯示,內部驗證前后的ROC曲線下面積分別為0.866(95%CI 0.822~0.885)和0.822(95%CI 0.810~0.868),敏感性分別為87.10%、85.05%,特異度分別為90.25%、90.54%,平均絕對誤差均為0.010,說明該列線圖模型有較高的區分度和校準度且靈敏性和特異信良好。結果見圖3、圖4及表4。
 圖3
預測模型的校準曲線
圖3
預測模型的校準曲線
a. 內部驗證前;b. 內部驗證后。
 圖4
預測模型的ROC曲線
圖4
預測模型的ROC曲線
a. 內部驗證前;b. 內部驗證后。
2.6 PSI評分與胸水淋巴細胞亞群的線性分析
LOWESS方法分析PSI評分與CD3+、CD4+、CD8+以及CD4+/CD8+之間的曲線關聯。結果顯示,PSI評分和CD3+、CD4+、CD8+以及CD4+/CD8+均具有一定的非線性關系。結果見圖5。
 圖5
胸水淋巴細胞亞群與PSI評分的LOWESS分析
圖5
胸水淋巴細胞亞群與PSI評分的LOWESS分析
a. PSI評分與CD3+的線性分析;b. PSI評分與CD4+的線性分析;c. PSI評分與CD8+的線性分析;d. PSI評分與CD4+/CD8+的線性分析。
3 討論
肺炎作為一種常見傳染病,普遍存在咳嗽、咳痰等呼吸道癥狀和體征。另外,此類患者部分存在不同程度的胸腔積液情況,而胸腔積液的發生又導致患者生存質量進一步變差,甚至危及到患者的生命安全[10]。有報道指出合并胸腔積液會進一步導致患者炎性狀態的加重,提示可以通過檢測炎性指標,診斷肺炎嚴重程度[11]。TLS作為胸水淋巴細胞亞群中不可或缺的組成部分,參與機體免疫過程。TLS主要包括CD3+、CD4+、CD8+、CD4+/CD8+。研究發現肺炎合并胸腔積液患者外周血CD3+、CD4+細胞比例高于健康人[12]。Kamrani等[13]研究發現TLS在胸腔積液患者外周血與胸水中分布相似,且CD3+、CD4+細胞比例在惡性胸腔積液患者中相較于良性胸腔積液患者較低,提示TLS水平的變化可以鑒別良性胸腔積液與惡性胸腔積液。本研究結果顯示,PSI評分與CD3+、CD4+、CD8+以及CD4+/CD8+均具有一定的非線性關系,這與文獻[14]報道相一致。但目前關于肺炎合并胸腔積液患者病情嚴重程度與胸水淋巴細胞亞群的關系尚無明確定論。
本研究結果顯示,合并肺不張,病程、熱峰、熱程升高,WBC、CRP、D-D、CD8+及PCT水平升高,CD3+、CD4+、CD4+/CD8+及Hb水平降低均為危重癥肺炎發生的獨立危險因素。有研究指出若肺炎患者肺不張長期存在,會增加肺部炎癥和肺膿腫等發生率[15]。魯成等[16]研究發現,相較于普通型患者,重型新冠肺炎患者血清Hb水平降低,病程及住院時間更長。CRP作為急性時相反應蛋白,普遍參與體內各種炎癥,PCT是在細菌內毒素和機體炎癥因子誘導下生成的多肽類降鈣素激素原[17]。CRP和PCT作為炎癥指標在病情判斷和診斷療效上已得到臨床應用[18]。且研究發現WBC以及CRP是反映炎癥的指標,當機體出現炎癥或受到損傷時,會普遍升高[19],這與本研究結果相一致。樊亞麗等[20]研究發現,較高的熱峰及較長的熱程是支原體肺炎合并胸腔積液的獨立危險因素。當患者體內炎癥反應過度或血管內皮長時間持續損傷,血清中D-D水平會顯著升高[21]。持續的淋巴細胞減少,尤其是CD4+ T淋巴細胞水平的降低,對重癥肺炎的治療及預后有一定的提示意義[22]。CD3+ T淋巴細胞計數、CD4+ T淋巴細胞計數及CD8+ T淋巴細胞計數可作為重癥肺炎患者預后評估的早期預測指標。T淋巴細胞在感染后的獲得性免疫反應中起著關鍵作用,在重癥感染過程中淋巴細胞易發生凋亡,導致CD4+ T淋巴細胞明顯下降,同時炎癥細胞被大量激活,釋放出多種促炎和抗炎因子,導致重癥肺炎的發生[23]。在惡性胸腔積液患者胸水中CD3+、CD4+、CD4+/CD8+值較良性胸腔積液患者更低,而CD8+ T淋巴細胞則顯著升高[24]。這提示通過CD3+、CD4+、CD8+、CD4+/CD8+值的變化,可以判斷危重癥肺炎是否發生,在評估疾病的嚴重程度中發揮重要作用。
本研究存在一定的局限性:(1)缺少外對照組,無法進行擴展性的驗證;(2)本研究病例數較少,可能導致結果出現偏差,尚需要大量病例數進一步研究。因此,后續需要擴大病例數進行前瞻性研究。
綜上所述,胸水淋巴細胞亞群與肺炎合并胸腔積液患者的嚴重程度關系密切,CD3+、CD4+、CD8+及CD4+/CD8+若出現異常,需注意重癥肺炎的發生。
利益沖突:本研究不涉及任何利益沖突。