引用本文: 馬娜, 金雨舟, 劉福菁, 沈婉林, 顧體軍. 乳酸脫氫酶白蛋白比值對重癥肺炎患者并發彌散性血管內凝血的預測價值. 中國呼吸與危重監護雜志, 2023, 22(12): 845-851. doi: 10.7507/1671-6205.202308059 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
重癥肺炎具有發病急、進展迅速、預后差的特點,患者可在短時間內出現感染性休克、意識障礙、多臟器功能不全等情況[1]。盡管近年來重癥肺炎的治療不斷發展,但病死率仍舊高達25.0%~44.4%[2]。重癥肺炎可導致凝血功能障礙,嚴重者引起彌散性血管內凝血(disseminated intravascular coagulation,DIC)[3],其死亡風險也將明顯增大。DIC是創傷、感染等各種病因引起以微循環衰竭、出血為主的一種臨床綜合征[4],其中感染是最常見的原因[5]。研究發現血清乳酸脫氫酶水平(lactate dehydrogenase,LDH)是肺炎和膿毒癥的預后因素[6-8],它往往隨著感染的嚴重程度而上升[9];血清白蛋白(albumin,Alb)下降是老年重癥肺炎患者病情嚴重程度的獨立危險因素[10]。但兩者易受代謝及其他疾病、營養狀況等因素的影響,因此將兩者聯合應用可以減少其他因素的影響。研究表明LDH和血Alb比值(lactate dehydrogenase to albumin ratio,LAR)對重癥感染患者具有預測價值[9],而LAR對重癥肺炎患者DIC發生的影響尚無相關研究。為此,本研究擬探討LAR與重癥肺炎患者并發DIC的關系,未制定干預策略有效防范DIC發生以改善患者預后的關鍵環節奠定基礎。
1 資料與方法
1.1 臨床資料
采用回顧性隊列研究。回顧性選擇2018年1月—2023年3月常州市第二人民醫院收治入院的312例重癥肺炎患者作為研究對象。重癥肺炎的診斷采用2007年美國胸科學會和美國感染病學會制定的重癥肺炎診斷標準[11]。DIC的診斷標準采用國際血栓與止血學會制定的關于DIC診斷標準[12],根據患者在急診室和患者住院后的血液參數評估DIC,≥5分定義為DIC。根據重癥肺炎是否發生DIC,將納入對象分為DIC組和非DIC組。排除標準:① 年齡<18歲;② 先天性凝血功能異常及嚴重免疫缺陷的患者;③ 就診近期3個月輸注人血Alb及使用影響凝血功能藥物者;④ 資料存在嚴重缺失病例;⑤ 為了排除DIC的選擇偏倚,我們排除了24 h內死亡的患者;⑥ 排除存在慢性肝功能不全的患者。本研究為回顧性分析臨床資料,未對患者進行任何干預措施,因此豁免知情同意的條件,已獲得常州市第二人民醫院倫理委員會批準,批號為[2023]KY101-01。
1.2 方法
1.2.1 數據收集
從醫院電子病歷管理系統收集所有患者的臨床資料,包括:① 基本信息:性別,年齡,伴隨的基礎疾病(包括高血壓、糖尿病、冠心病、慢性阻塞性肺疾病、腫瘤、心房顫動、心功能不全、腦卒中、慢性腎功能不全等病史);② 進入急診室首次生命體征:呼吸頻率、體溫、收縮壓、心率;③ 采集重癥肺炎患者急診室首次實驗室指標:白細胞計數(white blood cell count,WBC)、C反應蛋白(C-reactive protein,CRP)、降鈣素原(procalcitonin,PCT)、乳酸、Alb、LDH以及兩者的比值LAR;④ 病情嚴重評分:序貫器官衰竭評分(sequential organ failure assessment,SOFA)、入院后24 h內急性生理學和慢性健康狀況評價Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ),SOFA及APACHEⅡ均是根據患者首次急診室檢查結果及第1天處理情況計算得出。
1.2.2 結局
主要研究結局為重癥肺炎在急診室或住院期間是否并發DIC,次要結局為合并DIC的重癥肺炎患者30天內的死亡情況。
1.3 統計學方法
采用SPSS 25.0軟件和R4.3語言進行統計分析,正態連續分布資料采用均數±標準差(x±s)表示,兩組間比較應用獨立樣本t檢驗;非正態連續分布資料采用中位數(四分位數)[M(P25,P75)]表示,組間比較應用非參數U檢驗;計數資料采用例(%)表示,組間比較采用χ2檢驗及Fisher精確法。采用單因素和多因素Logistic回歸分析影響重癥肺炎患者發生DIC的危險因素。繪制受試者操作特征曲線(receiver operating characteristics curve,ROC曲線),計算ROC曲線下面積(the areas under ROC curve,AUC)評價危險因素對患者并發DIC的預測效能。我們根據ROC的界限值將LAR分組,高于界限值定義為高風險組,低于界限值定義為低風險組。采用Kaplan-Meier法進行生存分析,以Log-Rank法檢驗兩組患者存活率差異性。為了使結果穩健可靠,采用3種敏感性分析。① 亞組分析:LAR在不同人群DIC發生情況用亞組分析形式展現。② 變量轉換:將LAR轉換成分類變量和等級變量后重新帶入Logistic回歸分析。③ 考慮Logistic回歸的比值比(odds ratio,OR)值在本研究中可能存在過高或低估,我們采用修正Possion回歸重新擬合結局事件發生率。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料比較
本研究一共納入312例重癥肺炎患者,年齡中位數為76(68,83)歲,其中男242例,女70例。發生DIC者59例,發生率為18.9%。隨訪30天,312例患者一共死亡130例,病死率41.7%,而合并DIC者死亡49例,病死率83.0%。DIC組患者和非DIC組患者的基線資料差異無統計學意義(即年齡、性別、高血壓、糖尿病、冠心病、慢性阻塞性肺疾病、腫瘤、心房顫動、心力衰竭、腦卒中、腎功能不全)。DIC患者在進入急診室時首次測量的呼吸、心率無顯著差別,但這些患者體溫和血壓低于非DIC組,SOFA、APACHEⅡ、機械通氣使用、血管活性藥物使用更高。DIC組患者PCT、乳酸、LDH、LAR均高于非DIC組,Alb低于非DIC組,而WBC、CRP無顯著差異。結果見表1。
2.2 單因素和多因素Logistic回歸分析
目前對重癥肺炎發生DIC的風險因素尚不明確。對差異有統計學意義的變量進行單因素和多因素Logistic回歸分析(表2),結果顯示在校正年齡、性別、基礎病史等混雜因素后,SOFA、APACHEⅡ、PCT、乳酸、LDH、Alb、LAR是患者發生DIC的危險因素。
2.3 LAR對重癥肺炎DIC預測的ROC
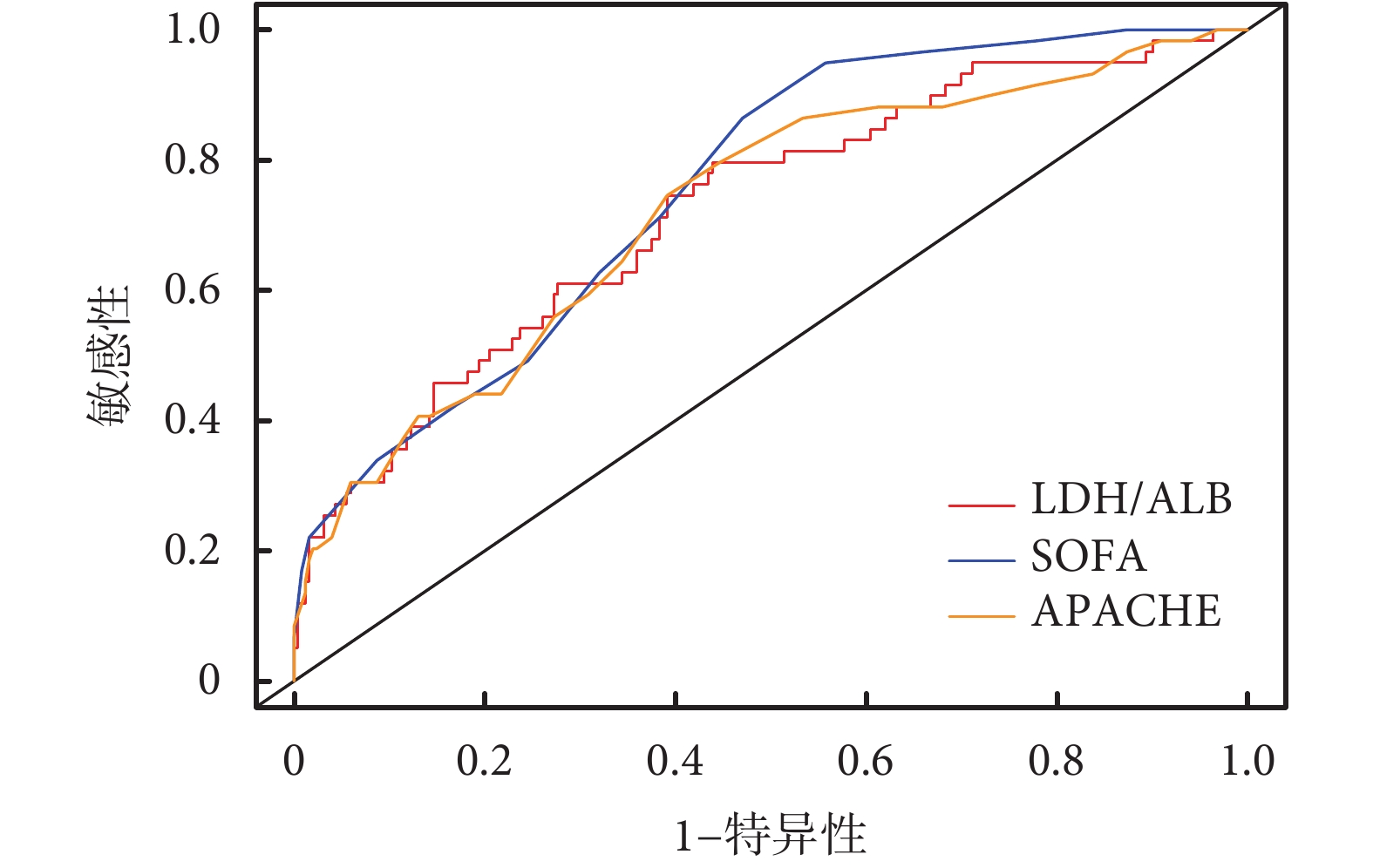
表3、圖1的結果顯示,與PCT、LAC、LDH、Alb指標相比,LAR預測重癥肺炎并發DIC具有較高的預測價值(AUC=0.723,95%CI 0.650~0.796),與SOFA(AUC=0.755,95%CI 0.693~0.817)、APACHEⅡ(AUC=0.722,95%CI 0.649~0.795)比較具有類似的預測價值。
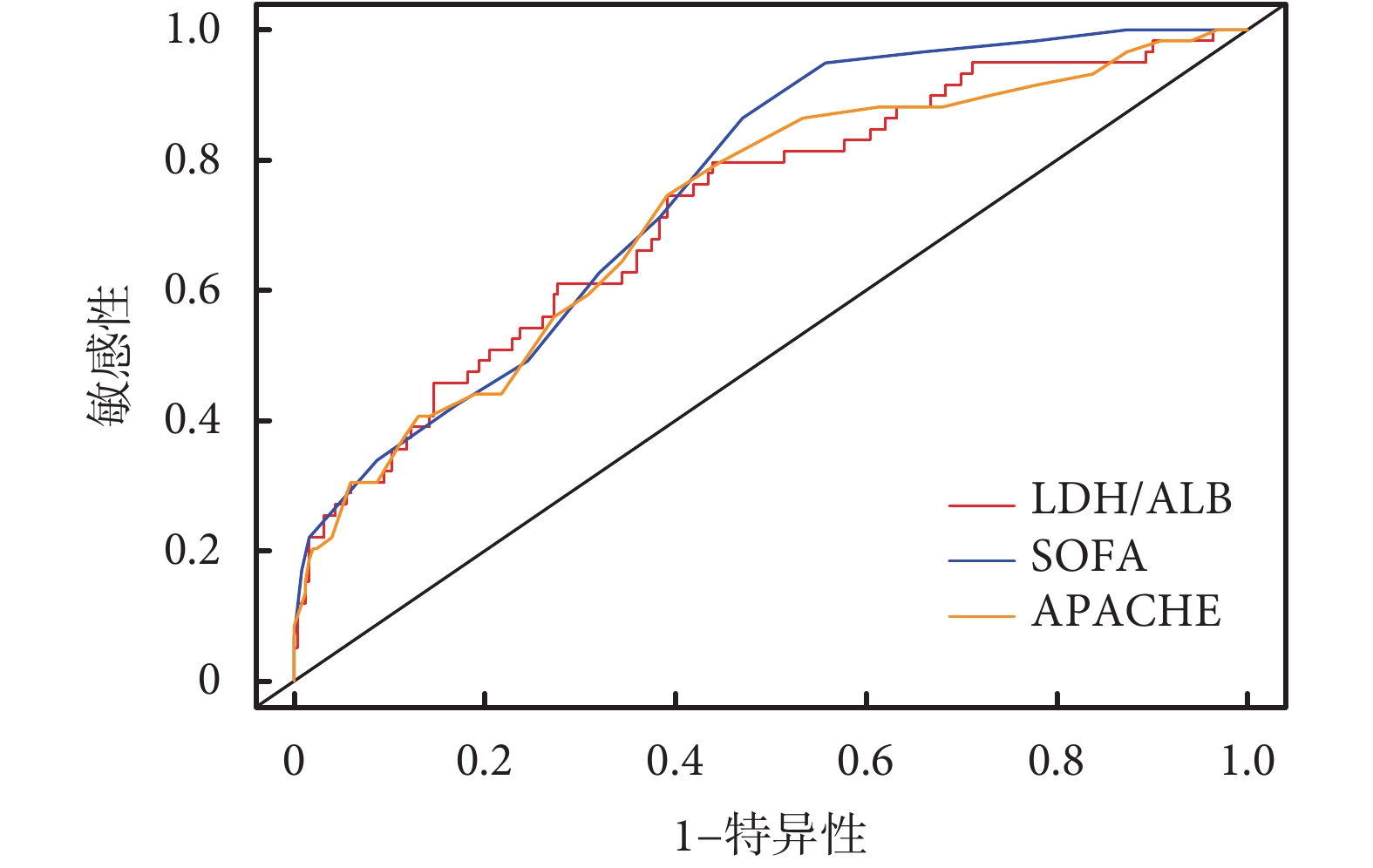 圖1
LAR、SOFA、APACHE評分預測重癥肺炎患者并發DIC的ROC曲線
圖1
LAR、SOFA、APACHE評分預測重癥肺炎患者并發DIC的ROC曲線
2.4 以LAR的ROC界值為風險分組的生存分析
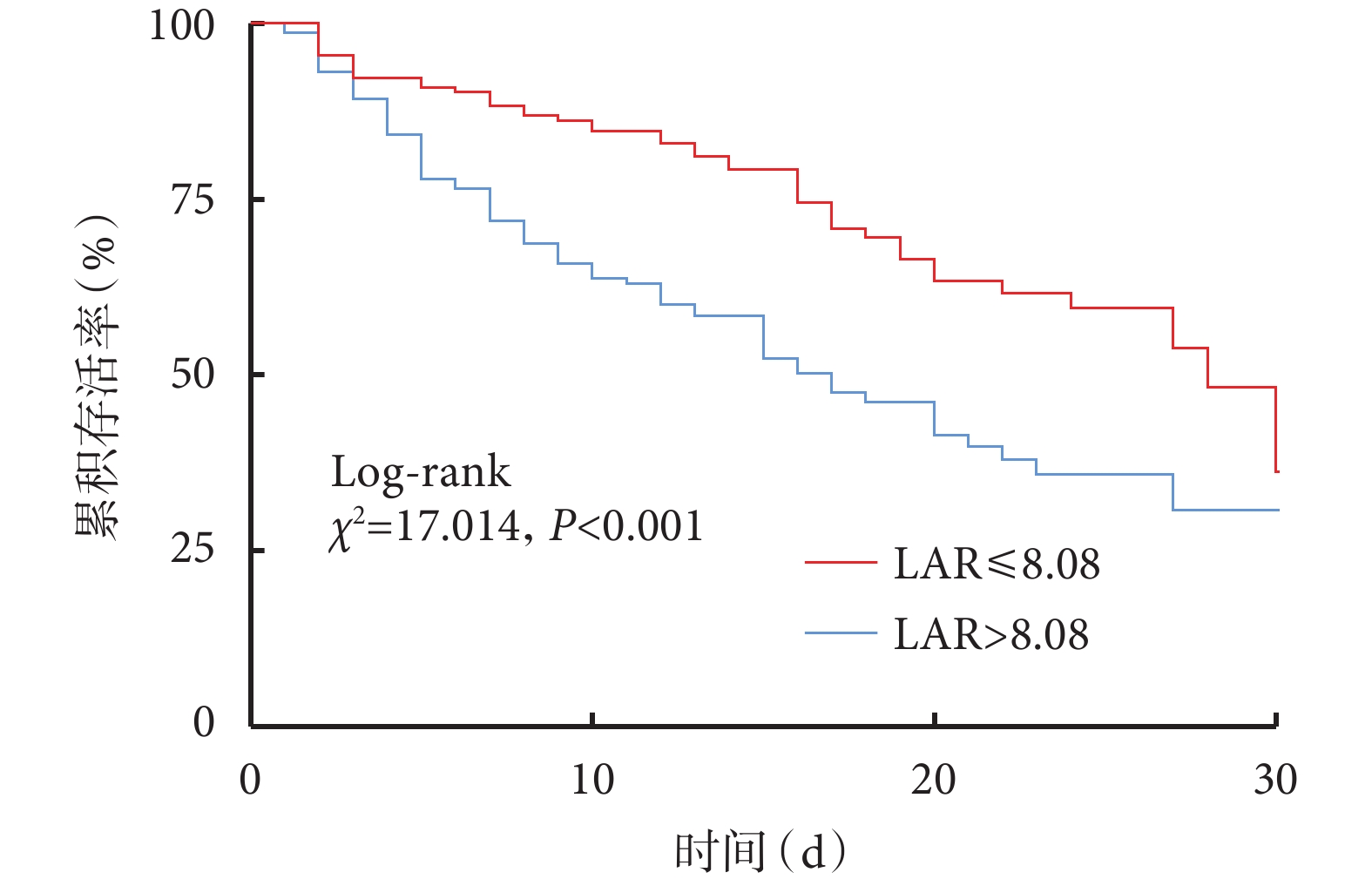
根據LAR的ROC曲線對應的界限值分組,將LAR高于界限值定義為DIC高風險患者,低于界限值定義為DIC低風險患者,以存活30天為界,分析DIC高風險患者和DIC低風險患者的30天生存情況。圖2結果顯示DIC高風險患者30天存活率明顯低于DIC低分險患者(log-rank,P<0.001)。DIC高風險患者相對DIC低風險患者,LAR對生存時間的影響具有統計學差異[風險比(hazard ratio,HR)=2.069,95%CI 1.423~3.008,P<0.001]。
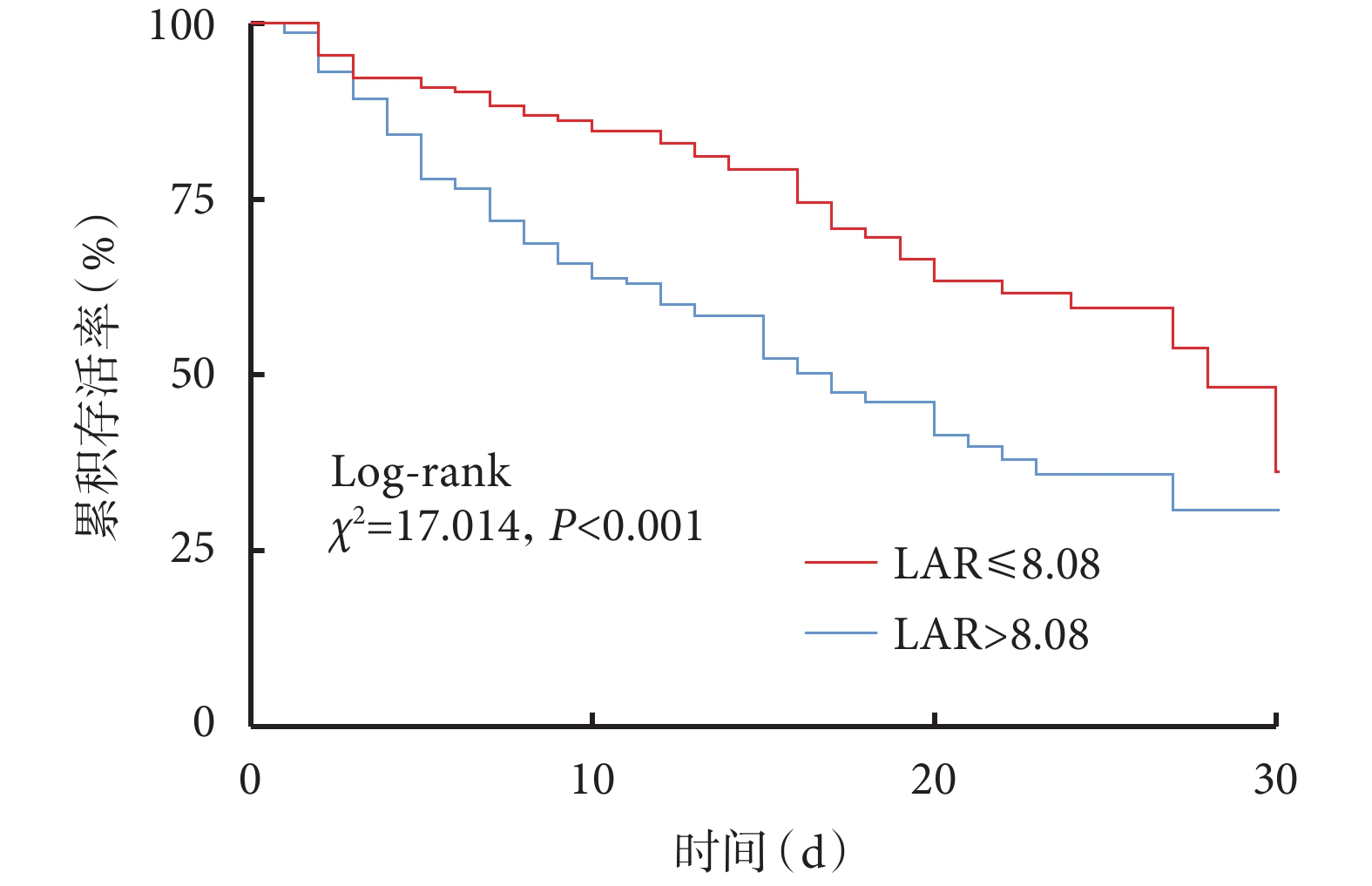 圖2
以LAR界限值分組的重癥肺炎合并DIC患者30天 Kaplan-Meier生存曲線
圖2
以LAR界限值分組的重癥肺炎合并DIC患者30天 Kaplan-Meier生存曲線
2.5 敏感性分析
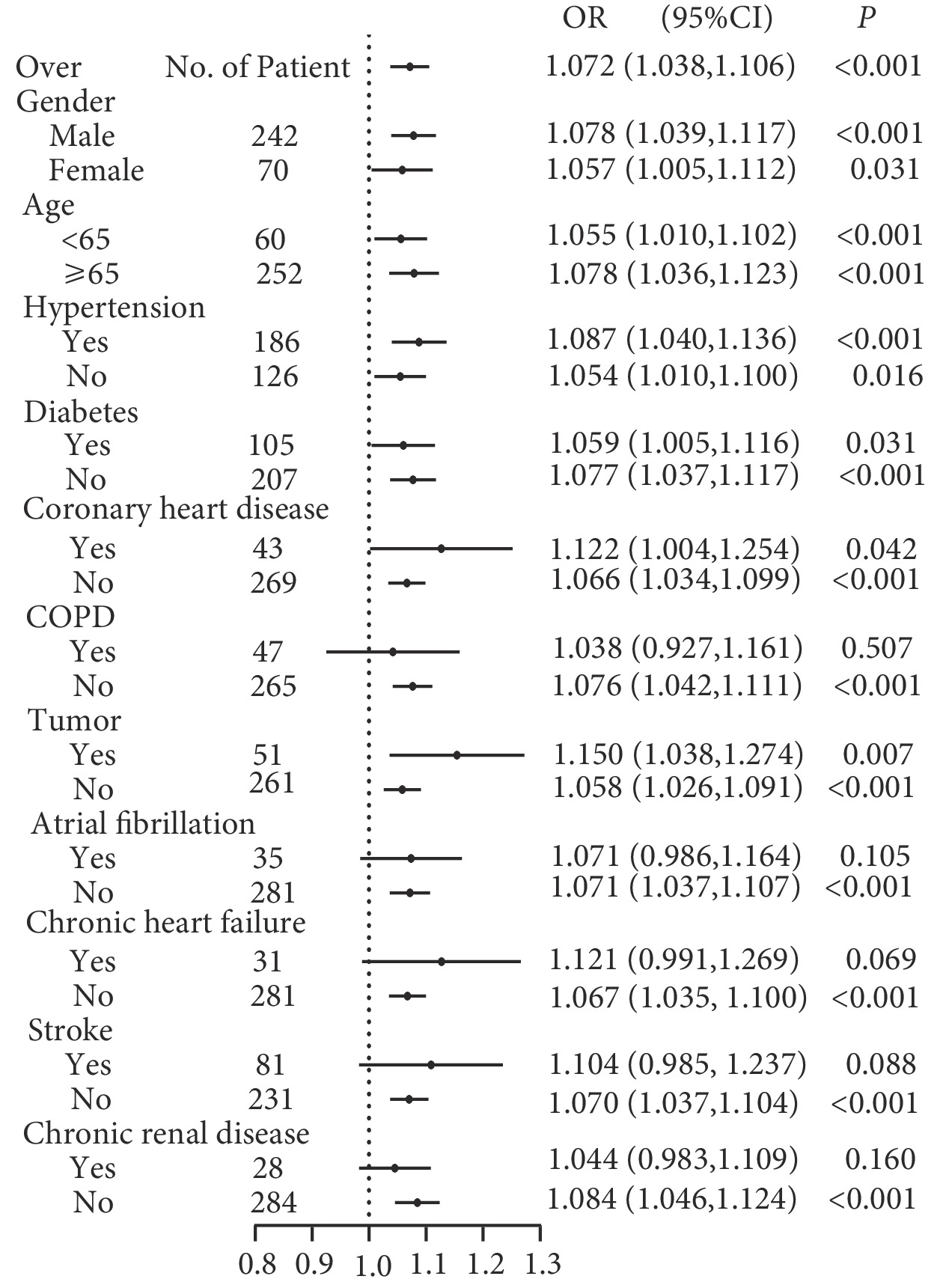
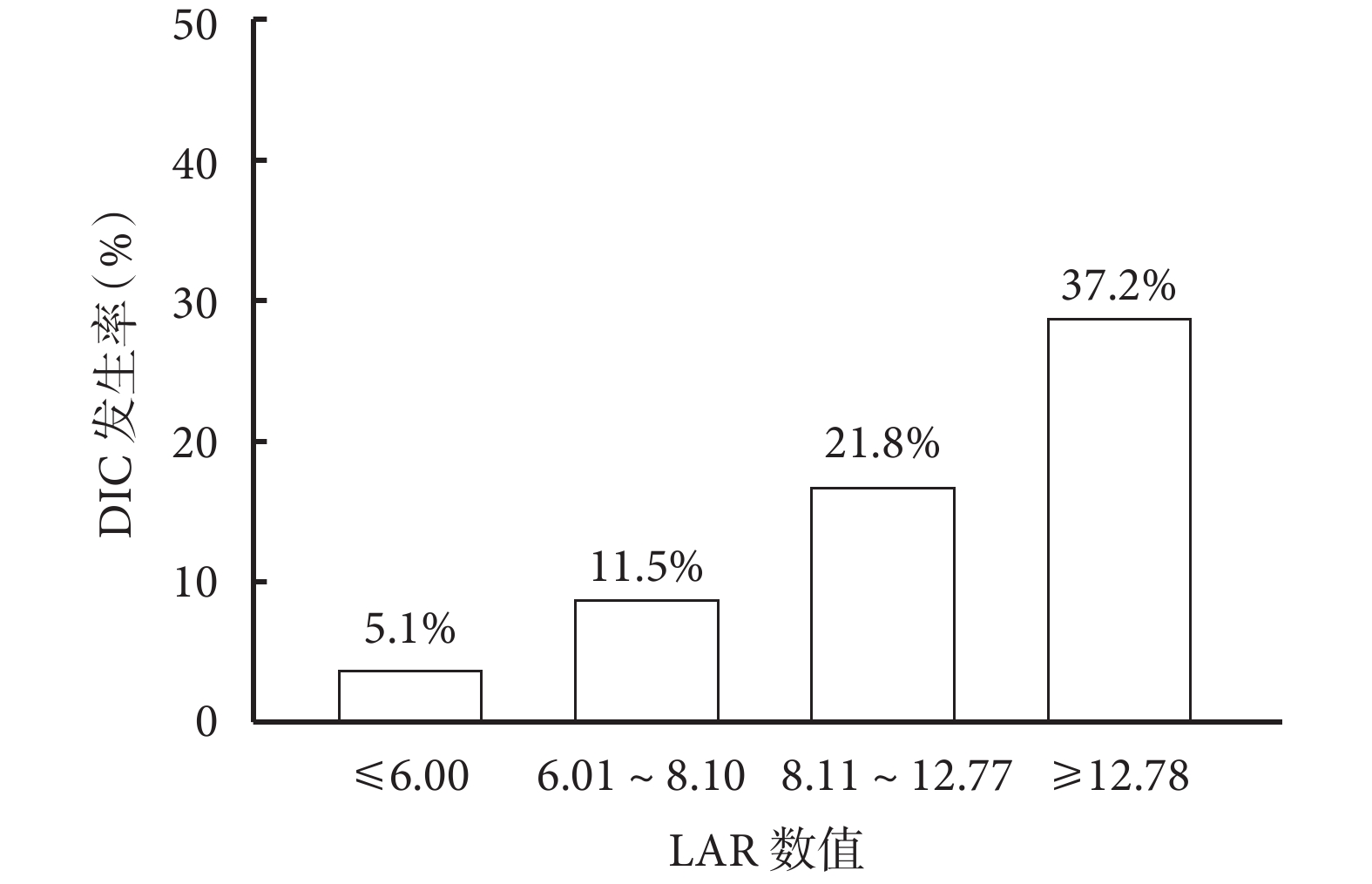
LAR在不同人群中DIC的風險亞組分析結果見圖3。整體而言LAR是發生DIC的風險因素。LAR是一個連續數值變量,將所有患者的LAR平均分為4等份,將LAR轉變為分類變量和等級變量后重新帶入Logistic分析,如表4、圖4結果所示,LAR越高發生DIC的風險越大,且呈現趨勢變化。四組不同LAR比值DIC發生率分別為5.1%(4例)、11.5%(9例)、21.8%(17例)、37.2%(29例),組間差異有統計學意義(P<0.05)。修正Poisson回歸顯示LAR仍然是重癥肺炎發生DIC的危險因素[相對危險度=1.021,95%CI (1.014~1.028),P<0.001]。
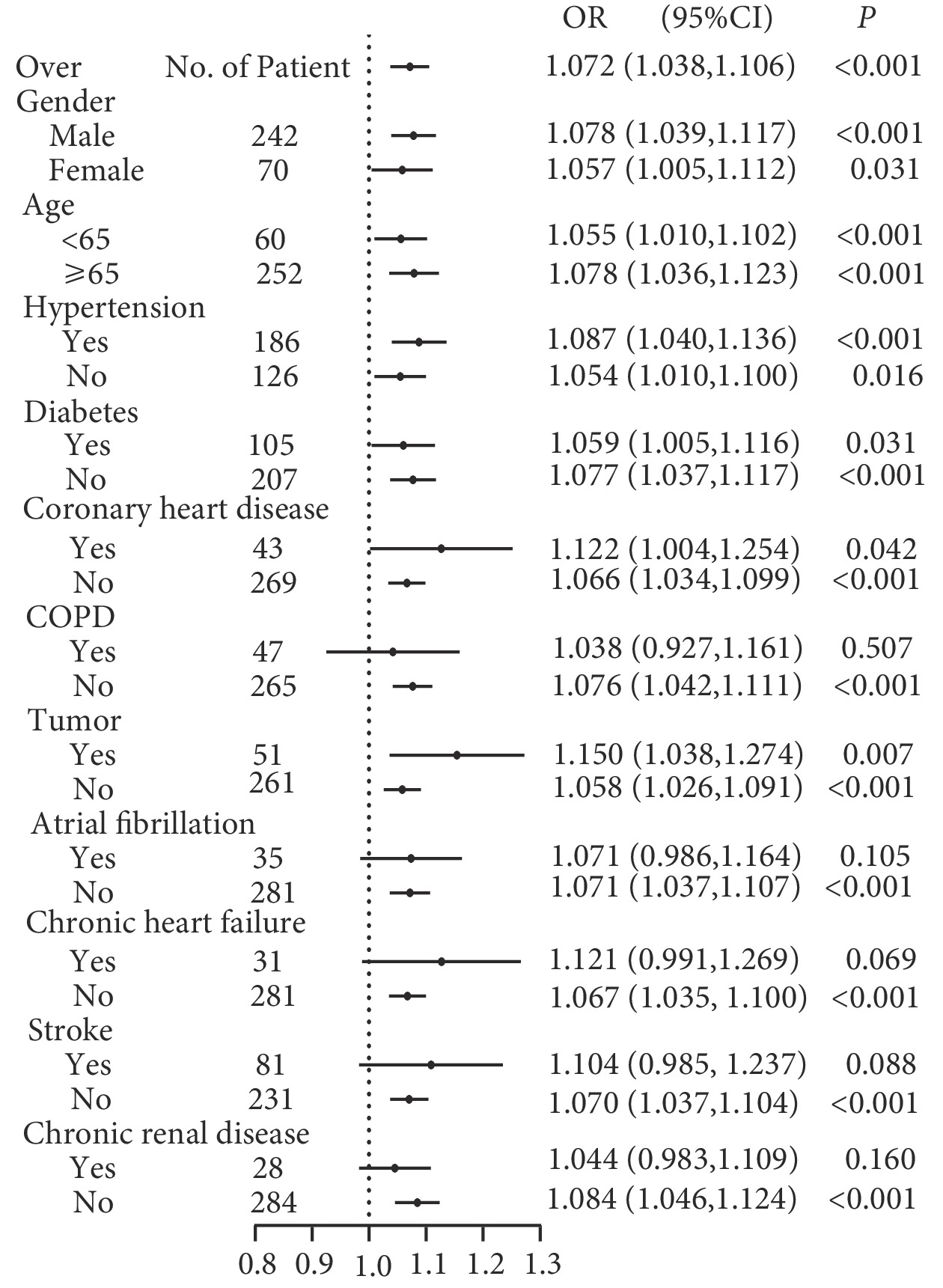 圖3
不同人群亞組分析LAR對重癥肺炎并發DIC的Logistic回歸分析
圖3
不同人群亞組分析LAR對重癥肺炎并發DIC的Logistic回歸分析
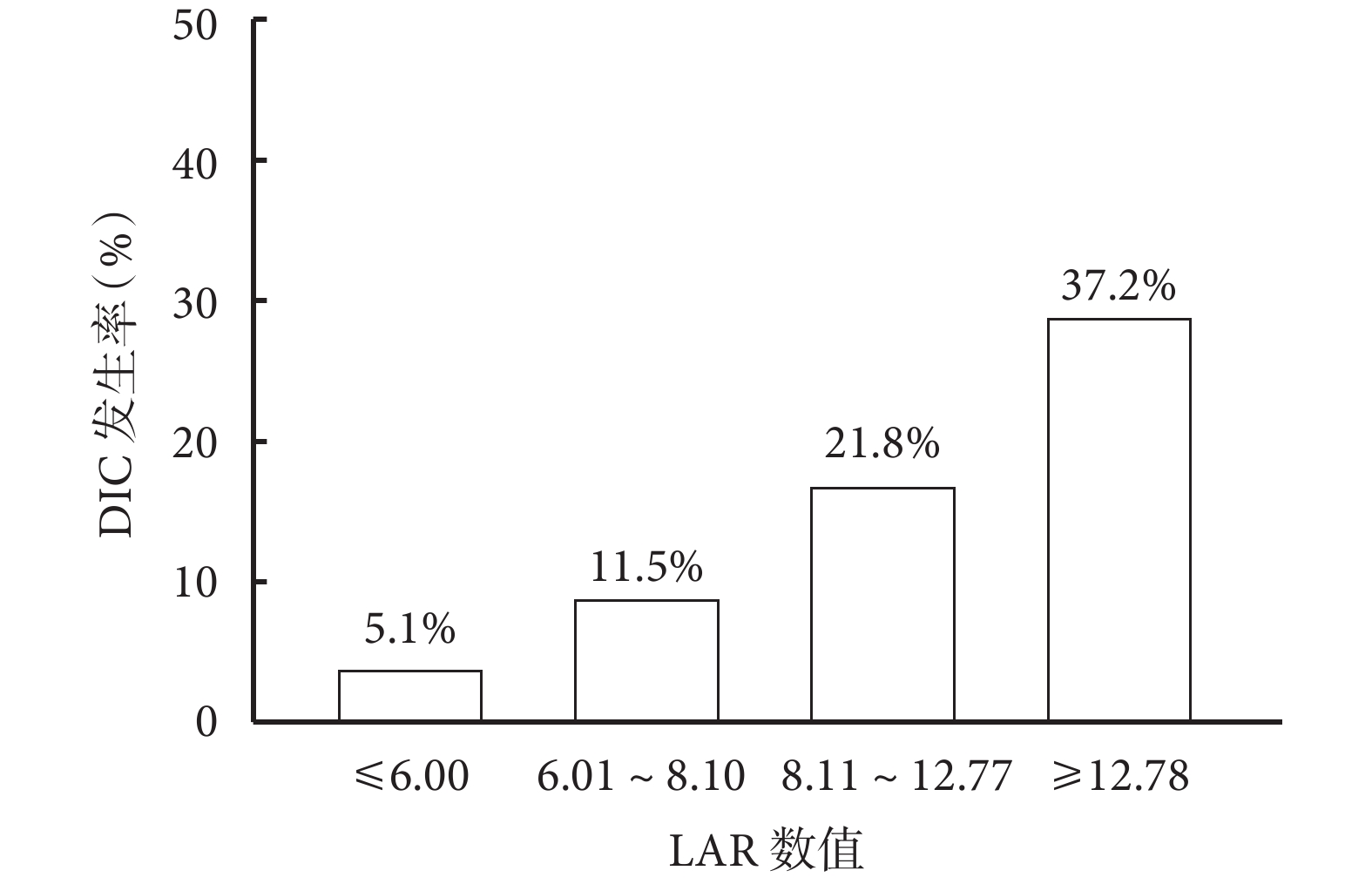 圖4
LAR不同分層的DIC發生率
圖4
LAR不同分層的DIC發生率
3 討論
早期研究已將LAR作為惡性腫瘤的預后評價指標[13-16],近年研究發現LAR可作為膿毒癥[9]、下呼吸道感染[17]及新型冠狀病毒新肺炎[18]患者院內病死率的獨立預測因素,而LAR與重癥肺炎發生DIC的研究有限。本研究探討了LAR與重癥肺炎發生DIC的關系,結果顯示LAR是重癥肺炎發生DIC的危險因素。急診室首次LAR對重癥肺炎發生DIC具有良好的預測效能。
LDH是一種促進丙酮酸轉化為乳酸的糖酵解酶,在幾乎所有類型的細胞中均可表達,在急性和嚴重肺損傷時LDH可出現升高,并且在其他間質性肺感染中同樣發現LDH升高[19],它可隨著感染的嚴重程度而上升,已被證實為肺炎預后的預測因子[20]。本研究也發現重癥肺炎并發DIC的患者LDH明顯高于非DIC的患者。在感染的打擊下,大量LDH釋放增加,乳酸轉化增加,乳酸是無氧代謝的產物,在無氧代謝過程中會產生大量的氧自由基,大量的氧自由基會通過Ca2+信號通路介導血管內皮的損傷。而血管內皮細胞損傷可導致促凝血作用加強,導致纖維蛋白的產生和沉積,從而引起血栓的產生,最終誘發DIC。
Alb在體內起到維持滲透壓、調節血管通透性和酸堿平衡的作用,Alb可以用作評估感染的預后因素,其水平可隨著感染加重而降低[21-22]。本研究發現重癥肺炎并發DIC的患者LAB明顯低于非DIC的患者。在炎癥狀態下,微循環毛細血管通透性增加[23],血管內Alb漏出引起Alb低下,低蛋白血癥進一步使血漿膠體滲透壓下降,組織間隙內大量體液潴留,有效循環血量減少,進而發生休克及血液黏滯度增加,引起微循環障礙最后發生DIC。Alb低還可能與肝儲備能量下降有關,凝血因子在肝臟中合成代謝,當肝功能下降引起凝血因子代謝損傷,從而導致凝血功能障礙引起DIC。
單獨使用LDH和血清Alb水平都可能受到除感染以外其他因素的影響。例如,由于肝細胞損傷導致的合成缺陷,由于腎小球疾病導致的過量損失,以及由于營養不良導致的氨基酸攝入不足可導致嚴重的低白蛋白血癥,肝病、貧血、心臟病發作和肌肉創傷可升高LDH血清水平[19]。因此,將兩者結合應用,可以減少其他因素的干擾,可以更有效地評估感染預后狀態。本研究發現重癥肺炎并發DIC的患者LAR明顯高于非DIC的患者,單因素和多因素Logistic回歸分析均提示LAR是重癥肺炎并發DIC的獨立危險因素,隨著LAR指標的進行性升高,DIC發生率隨之增高,死亡風險也隨之增加。根據ROC曲線結果提示LAR優于LDH、Alb單獨指標的預測價值,與經典SOFA、APACHEⅡ比具有類似的預測價值,但LAR結果更便捷易獲得,更適用于急診應用,可及時對患者做到早識別、早治療,降低病死率。為了證實結果的可靠性,我們在亞組分析中區分了不同人群后提示LAR依然是DIC的風險因素。
綜上所述,LAR可作為預測重癥肺炎合并DIC的早期診斷指標,我們的研究也不可避免的存在一些局限性。本研究人群針對的是重癥肺炎群體,病死率高,治療過程中存在影響預后的諸多因素;同時,這是一項單中心的回顧性病例對照研究,樣本量偏少,難免會存在一些偏倚影響結果。我們希望未來在多中心大樣本的研究下進一步論證LAR對重癥肺炎預后的預測效能。
利益沖突:本研究不涉及任何利益沖突。
重癥肺炎具有發病急、進展迅速、預后差的特點,患者可在短時間內出現感染性休克、意識障礙、多臟器功能不全等情況[1]。盡管近年來重癥肺炎的治療不斷發展,但病死率仍舊高達25.0%~44.4%[2]。重癥肺炎可導致凝血功能障礙,嚴重者引起彌散性血管內凝血(disseminated intravascular coagulation,DIC)[3],其死亡風險也將明顯增大。DIC是創傷、感染等各種病因引起以微循環衰竭、出血為主的一種臨床綜合征[4],其中感染是最常見的原因[5]。研究發現血清乳酸脫氫酶水平(lactate dehydrogenase,LDH)是肺炎和膿毒癥的預后因素[6-8],它往往隨著感染的嚴重程度而上升[9];血清白蛋白(albumin,Alb)下降是老年重癥肺炎患者病情嚴重程度的獨立危險因素[10]。但兩者易受代謝及其他疾病、營養狀況等因素的影響,因此將兩者聯合應用可以減少其他因素的影響。研究表明LDH和血Alb比值(lactate dehydrogenase to albumin ratio,LAR)對重癥感染患者具有預測價值[9],而LAR對重癥肺炎患者DIC發生的影響尚無相關研究。為此,本研究擬探討LAR與重癥肺炎患者并發DIC的關系,未制定干預策略有效防范DIC發生以改善患者預后的關鍵環節奠定基礎。
1 資料與方法
1.1 臨床資料
采用回顧性隊列研究。回顧性選擇2018年1月—2023年3月常州市第二人民醫院收治入院的312例重癥肺炎患者作為研究對象。重癥肺炎的診斷采用2007年美國胸科學會和美國感染病學會制定的重癥肺炎診斷標準[11]。DIC的診斷標準采用國際血栓與止血學會制定的關于DIC診斷標準[12],根據患者在急診室和患者住院后的血液參數評估DIC,≥5分定義為DIC。根據重癥肺炎是否發生DIC,將納入對象分為DIC組和非DIC組。排除標準:① 年齡<18歲;② 先天性凝血功能異常及嚴重免疫缺陷的患者;③ 就診近期3個月輸注人血Alb及使用影響凝血功能藥物者;④ 資料存在嚴重缺失病例;⑤ 為了排除DIC的選擇偏倚,我們排除了24 h內死亡的患者;⑥ 排除存在慢性肝功能不全的患者。本研究為回顧性分析臨床資料,未對患者進行任何干預措施,因此豁免知情同意的條件,已獲得常州市第二人民醫院倫理委員會批準,批號為[2023]KY101-01。
1.2 方法
1.2.1 數據收集
從醫院電子病歷管理系統收集所有患者的臨床資料,包括:① 基本信息:性別,年齡,伴隨的基礎疾病(包括高血壓、糖尿病、冠心病、慢性阻塞性肺疾病、腫瘤、心房顫動、心功能不全、腦卒中、慢性腎功能不全等病史);② 進入急診室首次生命體征:呼吸頻率、體溫、收縮壓、心率;③ 采集重癥肺炎患者急診室首次實驗室指標:白細胞計數(white blood cell count,WBC)、C反應蛋白(C-reactive protein,CRP)、降鈣素原(procalcitonin,PCT)、乳酸、Alb、LDH以及兩者的比值LAR;④ 病情嚴重評分:序貫器官衰竭評分(sequential organ failure assessment,SOFA)、入院后24 h內急性生理學和慢性健康狀況評價Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ),SOFA及APACHEⅡ均是根據患者首次急診室檢查結果及第1天處理情況計算得出。
1.2.2 結局
主要研究結局為重癥肺炎在急診室或住院期間是否并發DIC,次要結局為合并DIC的重癥肺炎患者30天內的死亡情況。
1.3 統計學方法
采用SPSS 25.0軟件和R4.3語言進行統計分析,正態連續分布資料采用均數±標準差(x±s)表示,兩組間比較應用獨立樣本t檢驗;非正態連續分布資料采用中位數(四分位數)[M(P25,P75)]表示,組間比較應用非參數U檢驗;計數資料采用例(%)表示,組間比較采用χ2檢驗及Fisher精確法。采用單因素和多因素Logistic回歸分析影響重癥肺炎患者發生DIC的危險因素。繪制受試者操作特征曲線(receiver operating characteristics curve,ROC曲線),計算ROC曲線下面積(the areas under ROC curve,AUC)評價危險因素對患者并發DIC的預測效能。我們根據ROC的界限值將LAR分組,高于界限值定義為高風險組,低于界限值定義為低風險組。采用Kaplan-Meier法進行生存分析,以Log-Rank法檢驗兩組患者存活率差異性。為了使結果穩健可靠,采用3種敏感性分析。① 亞組分析:LAR在不同人群DIC發生情況用亞組分析形式展現。② 變量轉換:將LAR轉換成分類變量和等級變量后重新帶入Logistic回歸分析。③ 考慮Logistic回歸的比值比(odds ratio,OR)值在本研究中可能存在過高或低估,我們采用修正Possion回歸重新擬合結局事件發生率。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料比較
本研究一共納入312例重癥肺炎患者,年齡中位數為76(68,83)歲,其中男242例,女70例。發生DIC者59例,發生率為18.9%。隨訪30天,312例患者一共死亡130例,病死率41.7%,而合并DIC者死亡49例,病死率83.0%。DIC組患者和非DIC組患者的基線資料差異無統計學意義(即年齡、性別、高血壓、糖尿病、冠心病、慢性阻塞性肺疾病、腫瘤、心房顫動、心力衰竭、腦卒中、腎功能不全)。DIC患者在進入急診室時首次測量的呼吸、心率無顯著差別,但這些患者體溫和血壓低于非DIC組,SOFA、APACHEⅡ、機械通氣使用、血管活性藥物使用更高。DIC組患者PCT、乳酸、LDH、LAR均高于非DIC組,Alb低于非DIC組,而WBC、CRP無顯著差異。結果見表1。
2.2 單因素和多因素Logistic回歸分析
目前對重癥肺炎發生DIC的風險因素尚不明確。對差異有統計學意義的變量進行單因素和多因素Logistic回歸分析(表2),結果顯示在校正年齡、性別、基礎病史等混雜因素后,SOFA、APACHEⅡ、PCT、乳酸、LDH、Alb、LAR是患者發生DIC的危險因素。
2.3 LAR對重癥肺炎DIC預測的ROC
表3、圖1的結果顯示,與PCT、LAC、LDH、Alb指標相比,LAR預測重癥肺炎并發DIC具有較高的預測價值(AUC=0.723,95%CI 0.650~0.796),與SOFA(AUC=0.755,95%CI 0.693~0.817)、APACHEⅡ(AUC=0.722,95%CI 0.649~0.795)比較具有類似的預測價值。
 圖1
LAR、SOFA、APACHE評分預測重癥肺炎患者并發DIC的ROC曲線
圖1
LAR、SOFA、APACHE評分預測重癥肺炎患者并發DIC的ROC曲線
2.4 以LAR的ROC界值為風險分組的生存分析
根據LAR的ROC曲線對應的界限值分組,將LAR高于界限值定義為DIC高風險患者,低于界限值定義為DIC低風險患者,以存活30天為界,分析DIC高風險患者和DIC低風險患者的30天生存情況。圖2結果顯示DIC高風險患者30天存活率明顯低于DIC低分險患者(log-rank,P<0.001)。DIC高風險患者相對DIC低風險患者,LAR對生存時間的影響具有統計學差異[風險比(hazard ratio,HR)=2.069,95%CI 1.423~3.008,P<0.001]。
 圖2
以LAR界限值分組的重癥肺炎合并DIC患者30天 Kaplan-Meier生存曲線
圖2
以LAR界限值分組的重癥肺炎合并DIC患者30天 Kaplan-Meier生存曲線
2.5 敏感性分析
LAR在不同人群中DIC的風險亞組分析結果見圖3。整體而言LAR是發生DIC的風險因素。LAR是一個連續數值變量,將所有患者的LAR平均分為4等份,將LAR轉變為分類變量和等級變量后重新帶入Logistic分析,如表4、圖4結果所示,LAR越高發生DIC的風險越大,且呈現趨勢變化。四組不同LAR比值DIC發生率分別為5.1%(4例)、11.5%(9例)、21.8%(17例)、37.2%(29例),組間差異有統計學意義(P<0.05)。修正Poisson回歸顯示LAR仍然是重癥肺炎發生DIC的危險因素[相對危險度=1.021,95%CI (1.014~1.028),P<0.001]。
 圖3
不同人群亞組分析LAR對重癥肺炎并發DIC的Logistic回歸分析
圖3
不同人群亞組分析LAR對重癥肺炎并發DIC的Logistic回歸分析
 圖4
LAR不同分層的DIC發生率
圖4
LAR不同分層的DIC發生率
3 討論
早期研究已將LAR作為惡性腫瘤的預后評價指標[13-16],近年研究發現LAR可作為膿毒癥[9]、下呼吸道感染[17]及新型冠狀病毒新肺炎[18]患者院內病死率的獨立預測因素,而LAR與重癥肺炎發生DIC的研究有限。本研究探討了LAR與重癥肺炎發生DIC的關系,結果顯示LAR是重癥肺炎發生DIC的危險因素。急診室首次LAR對重癥肺炎發生DIC具有良好的預測效能。
LDH是一種促進丙酮酸轉化為乳酸的糖酵解酶,在幾乎所有類型的細胞中均可表達,在急性和嚴重肺損傷時LDH可出現升高,并且在其他間質性肺感染中同樣發現LDH升高[19],它可隨著感染的嚴重程度而上升,已被證實為肺炎預后的預測因子[20]。本研究也發現重癥肺炎并發DIC的患者LDH明顯高于非DIC的患者。在感染的打擊下,大量LDH釋放增加,乳酸轉化增加,乳酸是無氧代謝的產物,在無氧代謝過程中會產生大量的氧自由基,大量的氧自由基會通過Ca2+信號通路介導血管內皮的損傷。而血管內皮細胞損傷可導致促凝血作用加強,導致纖維蛋白的產生和沉積,從而引起血栓的產生,最終誘發DIC。
Alb在體內起到維持滲透壓、調節血管通透性和酸堿平衡的作用,Alb可以用作評估感染的預后因素,其水平可隨著感染加重而降低[21-22]。本研究發現重癥肺炎并發DIC的患者LAB明顯低于非DIC的患者。在炎癥狀態下,微循環毛細血管通透性增加[23],血管內Alb漏出引起Alb低下,低蛋白血癥進一步使血漿膠體滲透壓下降,組織間隙內大量體液潴留,有效循環血量減少,進而發生休克及血液黏滯度增加,引起微循環障礙最后發生DIC。Alb低還可能與肝儲備能量下降有關,凝血因子在肝臟中合成代謝,當肝功能下降引起凝血因子代謝損傷,從而導致凝血功能障礙引起DIC。
單獨使用LDH和血清Alb水平都可能受到除感染以外其他因素的影響。例如,由于肝細胞損傷導致的合成缺陷,由于腎小球疾病導致的過量損失,以及由于營養不良導致的氨基酸攝入不足可導致嚴重的低白蛋白血癥,肝病、貧血、心臟病發作和肌肉創傷可升高LDH血清水平[19]。因此,將兩者結合應用,可以減少其他因素的干擾,可以更有效地評估感染預后狀態。本研究發現重癥肺炎并發DIC的患者LAR明顯高于非DIC的患者,單因素和多因素Logistic回歸分析均提示LAR是重癥肺炎并發DIC的獨立危險因素,隨著LAR指標的進行性升高,DIC發生率隨之增高,死亡風險也隨之增加。根據ROC曲線結果提示LAR優于LDH、Alb單獨指標的預測價值,與經典SOFA、APACHEⅡ比具有類似的預測價值,但LAR結果更便捷易獲得,更適用于急診應用,可及時對患者做到早識別、早治療,降低病死率。為了證實結果的可靠性,我們在亞組分析中區分了不同人群后提示LAR依然是DIC的風險因素。
綜上所述,LAR可作為預測重癥肺炎合并DIC的早期診斷指標,我們的研究也不可避免的存在一些局限性。本研究人群針對的是重癥肺炎群體,病死率高,治療過程中存在影響預后的諸多因素;同時,這是一項單中心的回顧性病例對照研究,樣本量偏少,難免會存在一些偏倚影響結果。我們希望未來在多中心大樣本的研究下進一步論證LAR對重癥肺炎預后的預測效能。
利益沖突:本研究不涉及任何利益沖突。