引用本文: 謝曉云, 湯健, 肖炳坤, 繆瀟瑤, 李志恒, 黃榮清. 輻射損傷大鼠呼出氣中揮發性有機化合物成分的氣相色譜-質譜研究. 中國呼吸與危重監護雜志, 2024, 23(5): 340-345. doi: 10.7507/1671-6205.202311059 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
放射治療是一種重要的癌癥治療方式[1-2],但治療性的放射劑量會對癌細胞和健康組織造成損害,對健康組織損害的嚴重程度因個體差異而難以預測[3]。隨著輻射技術的廣泛使用,輻射醫學及其他應用帶來了越來越多潛在的輻射損傷危害,一旦出現意外的核事故,則需要一個快速簡便的方法去診斷機體是否遭受輻射損傷。而目前臨床對輻射損傷的診斷方法主要是細胞遺傳學技術[4],如過早染色體凝聚分析、染色體畸變分析、微核分析等[5],但這些檢測方法耗時且對患者造成二次傷害。應用新興的呼吸代謝組學技術通過尋找輻射損傷相關的生物標志物,將為輻射損傷的分類、診斷建立無創、便捷的分析檢測方法奠定基礎。目前,已發現生物呼出氣中含有數千種不同的揮發性有機化合物(volatile organic compounds VOCs)[6],這些VOCs源于體內正常生理或疾病相關的代謝過程[7-8]。VOCs首先釋放到血液中,最終進入肺部,成為呼出的氣體。呼出氣的分析已經被廣泛應用于健康檢測和疾病的篩查診斷,如糖尿病[9-10]、肺癌[11-12]、新冠肺炎等[13-14],具有實時診斷的潛力。此外,呼出氣樣本具有非侵入性、容易獲取、分析快速等優點。目前將呼出氣樣本用于低劑量輻射損傷檢測的研究很少,本實驗以SD大鼠為實驗對象,利用呼出氣代謝組學技術探索低劑量輻射對大鼠呼出氣的影響,尋找輻射損傷潛在生物標志物,為非侵入性、快捷簡便的輻射損傷的分類、診斷提供相關檢測方法。
1 材料與方法
1.1 儀器、試劑和實驗動物
TD-30熱脫附儀(Shimadzu日本島津公司);Tenax-Ta吸附管(Shimadzu日本島津公司);GCMS-QP2010SE氣相色譜與質譜聯用儀(Shimadzu日本島津公司);大氣采樣儀GQC-2(北京科安勞保技術有限公司);大鼠體位固定器(自制);鈷源(軍事醫學研究院輻射醫學研究所提供);電子天平(杭州萬特衡器有限公司監制);一次性使用微量采血管(泰州市宇杰醫療器械有限公司);一次性使用無菌注射器(山東新華安得醫療用品有限公司)。水合氯醛(國藥集團化學試劑有限公司);變色硅膠(國藥集團化學試劑有限公司);氯化鈉注射液(石家莊四藥有限公司)。
SPF級雄性Sprague-Dawely(SD)大鼠,體重約190 g,購自斯貝福(北京)生物技術有限公司[許可證號:SCXK(京)2019–0010],飼養于軍事醫學研究院實驗動物中心[SYXK(軍)2017–0023],適應性喂養6天,飼養室溫度(24±3)℃,相對濕度50%~60%,進食與飲水自由。
1.2 方法
1.2.1 大鼠輻射模型
大鼠適應性喂養6天,在第6天晚上開始禁食12 h,飲水自由,第7天給予大鼠350 mg/kg的10%水合氯醛腹腔注射麻醉,仰臥位并排固定于泡沫板上,使用塑料扎帶和膠帶加固后,泡沫板豎直放置,使大鼠胸腹部朝外。用鉛塊遮擋大鼠頭部和腹部及以下部位,以49.96 R/min劑量率的60Co輻射源照射SD大鼠胸部,建立不同劑量(0.5、1、2、3 Gy)輻射損傷模型,每組8只。
1.2.2 儀器條件
TD30-熱脫附儀條件:吸附管脫附溫度250 ℃,流速60 mL/min,時間8 min;聚焦管冷卻溫度–20℃,聯合溫度、閥溫度和傳輸線溫度均250 ℃。色譜條件:Rtx-5MS毛細管柱(30 m×0.25 mm×0.25 μm),柱箱溫度40℃,進樣口溫度33℃,進樣時間1 min。柱溫程序:起始溫度40℃(保持5 min),以4 ℃/min的升溫速率上升至250℃(保持5 min);進樣方式為不分流。質譜條件:EI,離子源溫度240 ℃,接口溫度280 ℃,溶劑延遲時間1 min,掃描方式Scan,掃描范圍:35~500 m/z。
1.2.3 呼出氣采集方式
用經老化后的軟管依次連接大氣采樣儀、Tenax-Ta吸附管、硅膠干燥管和大鼠體位固定器。造模結束,等待SD大鼠完全蘇醒后立即進行第1次呼吸氣采集,作為第1天采集數據,而后采集輻射后第5天、第9天及第13天大鼠的呼出氣。采集速率75 mL/min,采集時長60 min[15]。
1.3 數據分析與處理
氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)數據以“.cdf”格式輸出,利用XCMS-online在線數據平臺對各組呼出氣的色譜峰保留時間和面積進行校準,獲取保留時間(Rt)、質荷比(m/z)、P值等參數。將獲取到P<0.05的相關峰數據通過歸一化,得到一個二維矩陣。將數據傳輸至SIMCA 14.1中,進行非監督模式的主成分分析(principal component analysis,PCA)、正交偏最小二乘法判別分析(orthogonal partial least squares discrimination analysis,OPLS-DA),篩選出vip>1的潛在差異性代謝物。將篩選出的化合物與NIST 2017質譜數據庫進行相似度對比檢索,并根據質譜裂解規律、特征離子和有關文獻來定性分析。體重作圖使用Origin 2022軟件,其他生化數據利用SPSS 27.0軟件進行統計分析,呈正態分布的計量實驗數據以均數±標準差(x±s)表示,多組數據比較采用單因素方差分析(one-way ANOVA)。P<0.05為差異有統計學意義。
2 結果
2.1 大鼠輻射損傷模型
2.1.1 大鼠體重變化
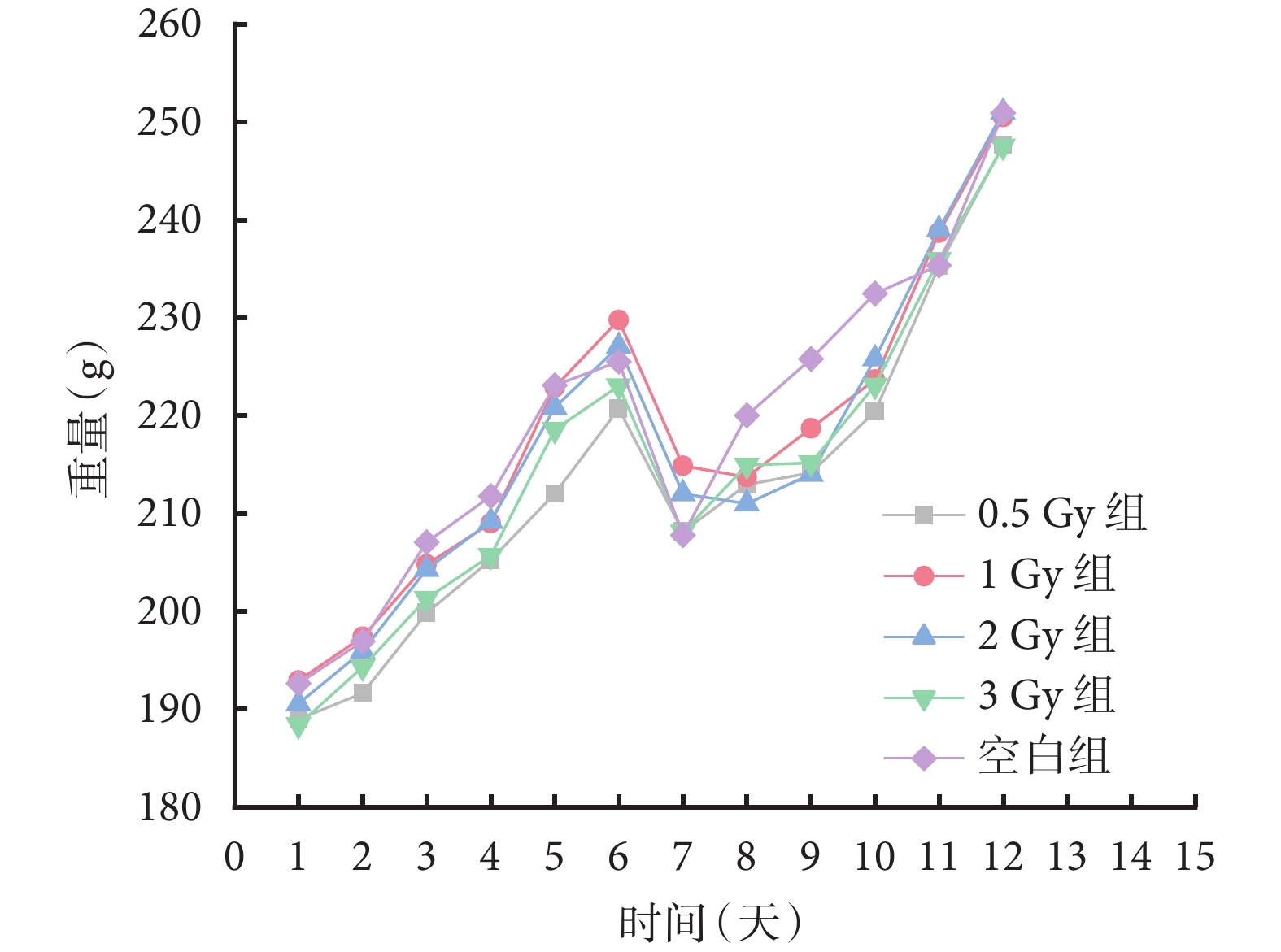
大鼠體重變化趨勢如圖1所示。輻射試驗前6天進行適應性喂養,各組大鼠體重平均穩步增加。第6天晚所有大鼠統一禁食,第7天體重均下降。造模結束后,各組大鼠恢復飲食、飲水自由。從圖1可見,輻射照射后3天內大鼠體重低于空白組,第4天開始逐漸恢復。
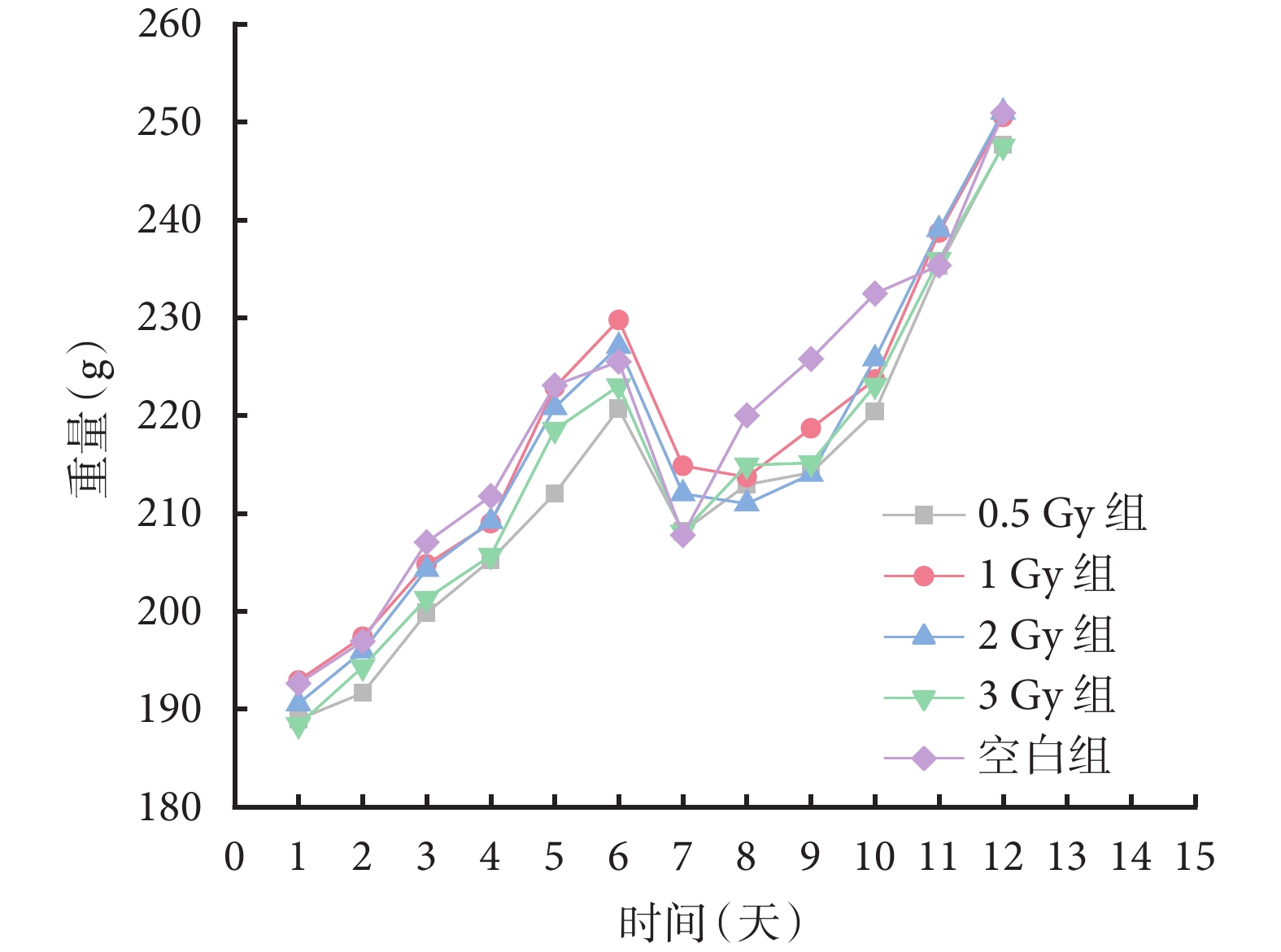 圖1
大鼠體重變化趨勢
圖1
大鼠體重變化趨勢
2.1.2 肺組織病理學變化
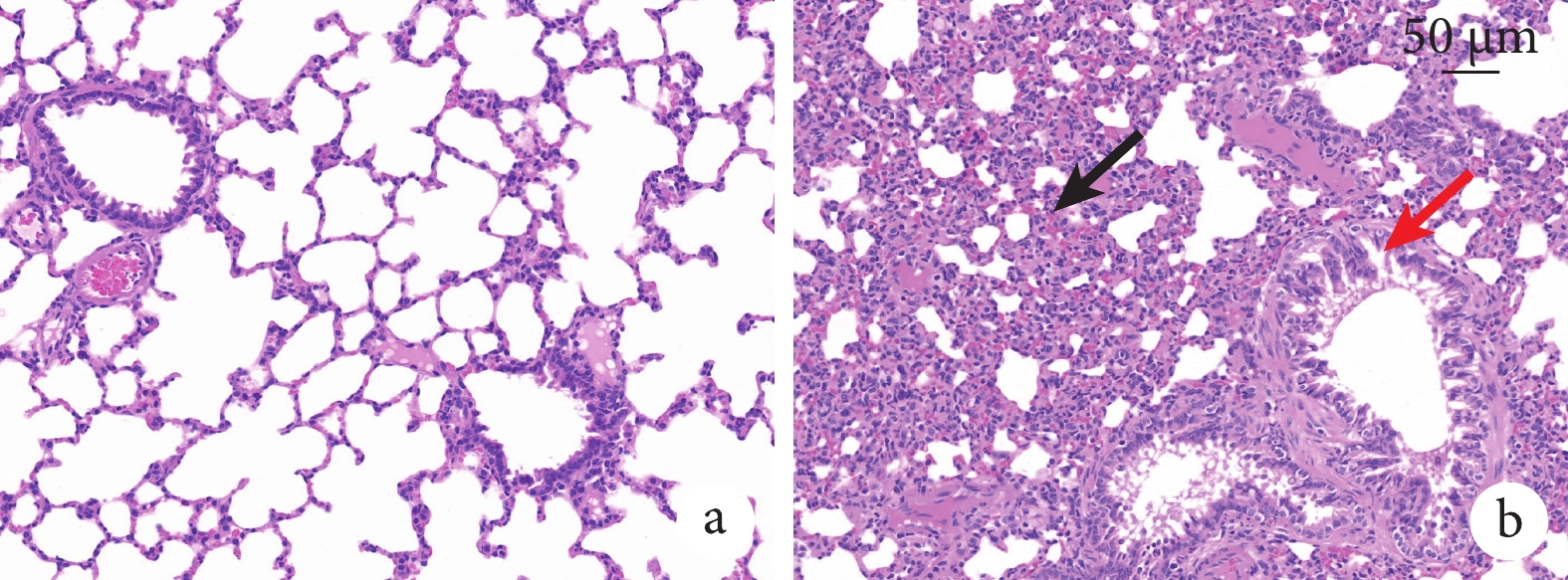
肺組織蘇木精-伊紅染色(hematoxylin-eosin staining,HE)染色切片見圖2。與空白組相比,模型組的肺組織切片可看見肺泡壁中度增厚,并伴有較多粒細胞浸潤,較多支氣管上皮細胞變性,胞質疏松淡染,并可見支氣管周圍淋巴細胞聚集,偶見支氣管中較多嗜酸性物質,說明輻射使大鼠的肺部在短期內產生一定程度的損傷。
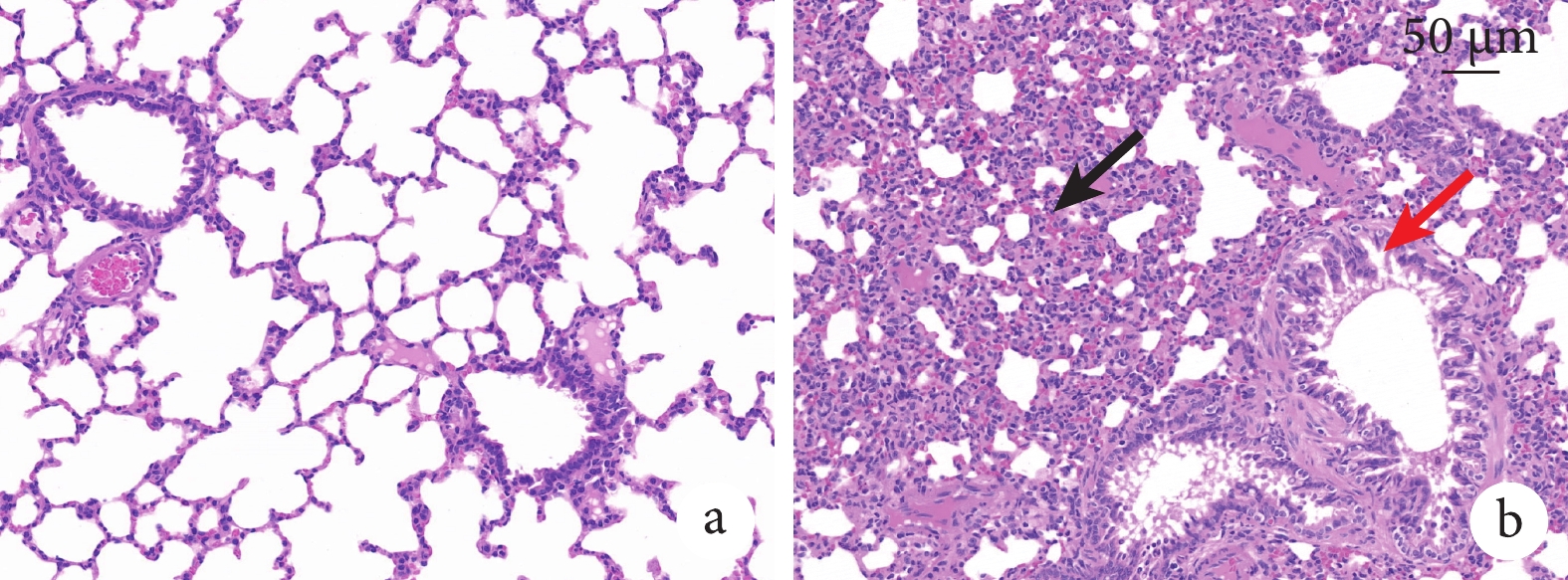 圖2
空白組與模型組肺組織HE染色切片(HE×20)
圖2
空白組與模型組肺組織HE染色切片(HE×20)
a. 空白組:各級支氣管、肺泡壁及血管等均未見明顯異;b. 3 Gy組:肺泡壁中度增厚,有較多粒細胞浸潤(黑箭),較多支氣管上皮細胞變性,胞質疏松淡染(紅箭)。
2.1.3 血象指標
如表1所示,60Co輻射照射模型組大鼠的外周血中白細胞、淋巴細胞、單核細胞和中性粒細胞百分比與空白組相比,隨著輻射劑量增加,差異逐漸增加。以上結果表明,大鼠的血液系統和免疫系統對輻射劑量有一定的依賴性,會造成不同程度損傷。各項血象指標變化趨勢符合輻射損傷后出現炎癥相關的基本特征,驗證本實驗輻射動物模型造模部分完成。
2.2 呼出氣分析
采集不同模型組和空白組的大鼠呼出氣,富集于Tenax-Ta吸附管中,使用GC-MS技術對吸附管中的物質進行分離與檢測。不同輻射劑量組與空白組的典型總離子流圖如圖3所示,從上往下輻射劑量分別為0.5 Gy、1 Gy、2 Gy、3 Gy和0 Gy,可見模型組與空白組的總離子流圖存在一定的變化,在相同的保留時間上,代謝物峰強度有所不同,說明不同輻射劑量對大鼠機體代謝產生了一定程度的變化。
 圖3
各組樣品典型總離子流圖
圖3
各組樣品典型總離子流圖
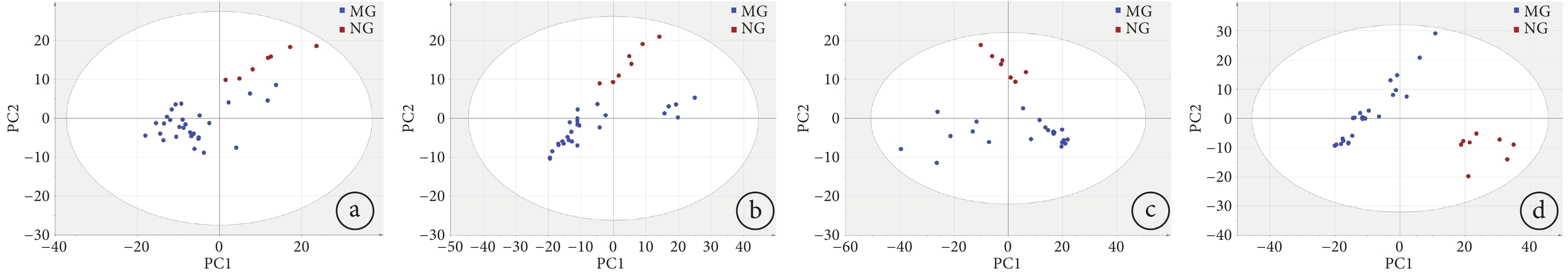
將各模型組數據分別與空白組數據經過XCMS-online在線數據平臺處理后,傳至SIMCA14.1,進行無監督的PCA分析。如圖4所示,空白組和各個不同時間段采集的模型組呼出氣樣本點均處于95%置信區間內。且不同劑量模型組與空白組的分離與聚集情況都相對較好,隨著劑量增加,分離程度更加明顯。其中,從低劑量到高劑量的累計預測率Q2值分別為0.51、0.57、0.64、0.59,都大于0.5,說明整體預測性良好,構建模型可靠。
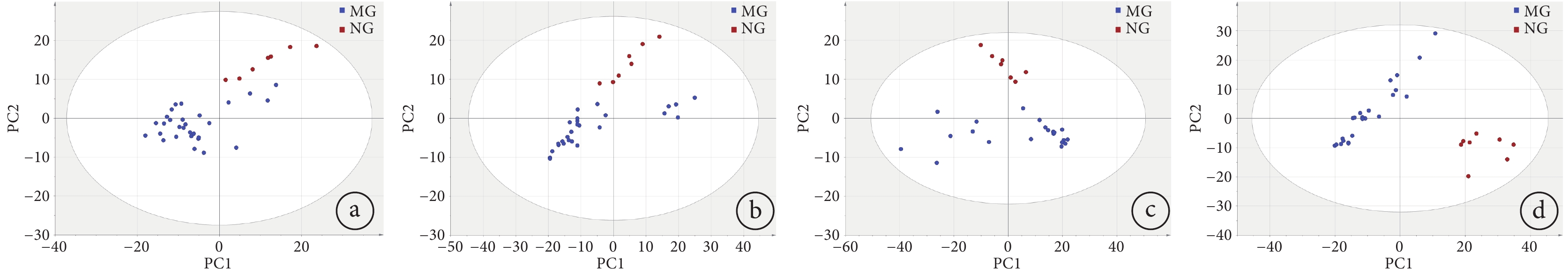 圖4
各個模型組與空白組的PCA分析圖
圖4
各個模型組與空白組的PCA分析圖
a. 0.5 Gy組與空白組;b. 1 Gy組與空白組;c. 2 Gy組與空白組;d. 3 Gy組與空白組
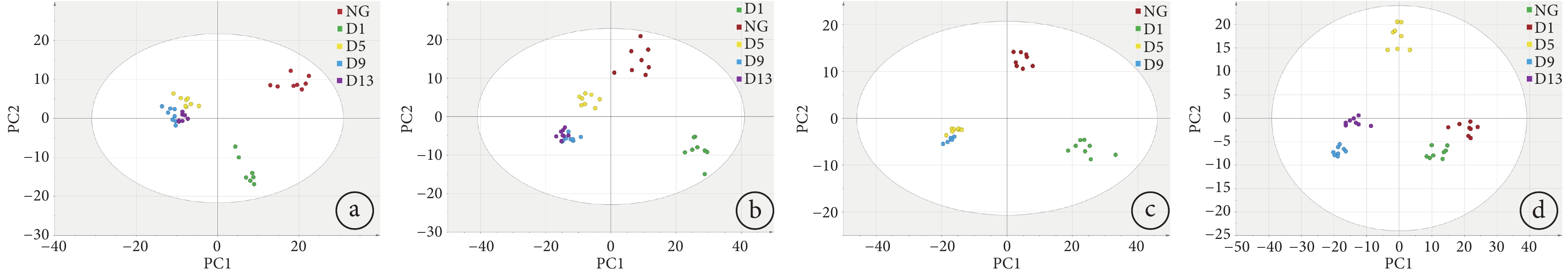
進一步對各模型組在不同時段采集的呼出氣以及空白組進行OPLS-DA分析,其中2 Gy組的大鼠在第13天時狀態不好,未進行采集。結果如圖5所示,各劑量組在不同天數采集的呼出氣的分離度和聚集性較良好,其中0.5 Gy、1 Gy和2 Gy與空白相比較,照射當天出現較大的差異性,而后逐漸出現軌跡緩慢移動的現象。構造的模型參數從低劑量到高劑量的R2X分別為0.76、0.76、0.79和0.82,R2Y分別為0.91、0.92、0.98和0.87,累積預測率Q2分別為0.80、0.83、0.92和0.86。
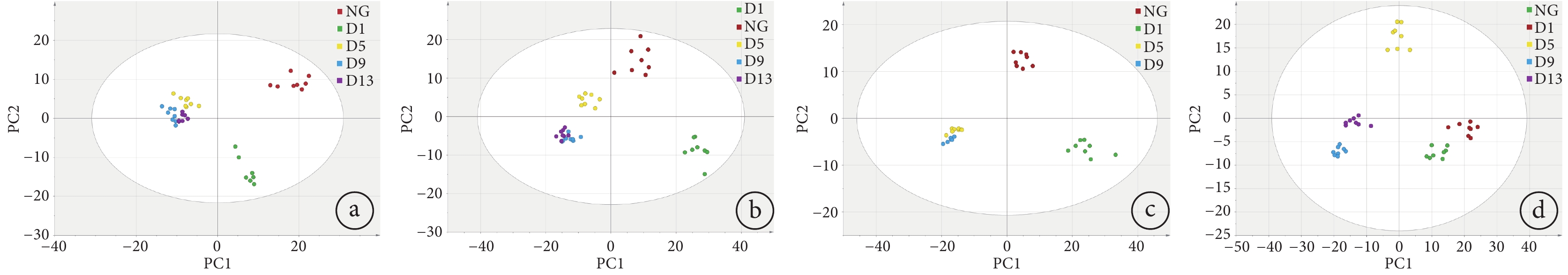 圖5
各個模型組與空白組的OPLS-DA分析圖
圖5
各個模型組與空白組的OPLS-DA分析圖
a. 0.5 Gy組與空白組;b. 1 Gy組與空白組;c. 2 Gy組與空白組;d. 3 Gy組與空白組
利用SIMCA14.1軟件對各模型組與空白組的數據進行OPLS-DA分析后,篩選出P<0.05和VIP>1的碎片峰組分,根據保留時間(rtmed)、質荷比(m/z)和裂解規律等在NIST 2017質譜數據庫中進行對比,并結合化合物裂解規律等分析方法,最終共獲得19種與輻射損傷相關的VOCs,如表2所示。對比不同劑量模型組與空白組VOCs的豐度發現,與空白組相比,苯乙酮、壬醛、癸醛、十四烷這4種VOCs在不同劑量輻射照射后的第1天豐度都達到最大值,而庚烷、氯苯、對二甲苯、間二氯苯這4種化合物在輻射照射后豐度呈下降趨勢,隨著采集呼出氣時間的推移,逐步降低,推測是輻射致使肺部出現一定程度的損傷。本次實驗推斷庚烷、氯苯、對二甲苯、間二氯苯、苯乙酮、壬醛、癸醛、十四烷8種化合物可能為組合差異性代謝物。
3 討論
壬醛和癸醛屬于醛類,先前研究發現均與哮喘、肺癌等肺部疾病有關[16-17]。輻射損傷可導致機體產生大量活性氧(reactive oxygen species,ROS)和脂質過氧化[18]。ROS的增加也稱為氧化應激,包括碳水化合物代謝和脂肪酸β氧化等一系列氧化還原反應,細胞膜合成能力增加,細胞色素酶P450(cytochrome P450 enzyme system,CYP450)和醇脫氫酶等關鍵酶活性改變[19-20]。所以醛類物質含量的增加可能與ROS的大量產生有關[21],因為醛不僅參與脂肪酸和醇類物質的代謝,同時在氨基酸和碳水化合物的分解過程種也會產生。苯乙酮通過消耗還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)還原成苯乙醇[22],同時NADPH也是谷胱甘肽(glutathione,GSH)還原酶的輔酶,輻射損傷會產生大量的ROS,細胞為維持氧化還原動態平衡,會高表達還原型GSH[23],NADPH會隨GSH增加而減少,使得大鼠體內苯乙酮不能及時還原成苯乙醇進行體內代謝而增多,因此大鼠呼出氣中的苯乙酮含量上升。對于十四烷,已有研究表明烷烴和甲基化烷烴是氧化應激后呼出氣中的重要代謝產物,大量的ROS的產生會造成細胞線粒體功能障礙,導致不飽和脂肪酸的脂質過氧化,生成的烷烴類VOCs以呼吸的方式排除體外[24-25],與本實驗中十四烷豐度增加相符。
吸入對二甲苯會使肝CYP450增加但不產生肝毒性[26],而肺中CYP450下降[27],肺CYP450的減少可能與對甲基苯甲醛(對二甲苯通過醇脫氫酶代謝)有關[28]。可由此推測輻射損傷導致脂質過氧化而使得肺中CYP450含量增多,對二甲苯逐步被氧化成對甲基苯甲醛后與CYP450相結合,使得輻射后大鼠呼出氣中對二甲苯含量減少。CYP2E1是由CYP450基因超家族編碼的一種血紅素蛋白,目前普遍認為CYP2E1在病理情況下的表達增高是氧化應激造成組織損傷的主要機制之一[29],與輻射后機體產生氧化應激相符合。而氯苯在機體的代謝情況主要通過CYP2E1的作用下,主要通過氯苯氧化物氧化成4-氯苯酚,較少氧化成2-氯苯酚,以及少量代謝物3-氯苯酚,這些物質再通過環氧化物水解酶水合生成二氫二醇,或通過GSH-S轉移酶與GSH結合,形成4-氯苯基巰基酸進行代謝[30-32],所以輻射后大鼠呼出氣中能檢測到的氯苯含量下降。間二氯苯含量下降也與CYP450含量增加相關,研究表明二氯苯主要通過涉及CYP450的肝微粒體酶系統代謝成相對應的二氯苯酚,以葡萄糖醛酸軛合物和硫酸鹽軛合物的形式從尿液中排出[33-34]。酶含量增加,致使更多的間二氯苯代謝成3,5-二氯鄰苯二酚[35],通過尿液進行排泄,呼出氣中的含量減少。本實驗推測可能成為差異代謝性的化合物大多與輻射致使大鼠體內產生的一系列與氧化應激和脂質過氧化的體內代謝有關。
綜上所述,本研究通過TD-GC-MS技術,探索了低劑量輻射對大鼠造成損傷后呼出氣中VOCs的含量變化,應用PCA分析發現輻射大鼠與非輻射大鼠的呼出氣具有明顯的區分度。另外,通過OPLS-DA模型,并結合化合物裂解規律等篩選出空白組與模型組的特征性VOCs,推測十四烷、苯乙酮、壬醛等8種VOCs可能是輻射損傷相關的組合差異性代謝物。本研究為早期輻射損傷診斷提供了非侵入性、無創檢測提供相關檢測方法,后續將收集更多相關樣本,進一步為呼出氣作為無創性輻射損傷診斷提供依據。本實驗尚存在一定局限性,研究納入的樣本量較小,后續的研究需要進一步擴大樣本量;同時,本實驗進行的劑量多為低劑量,并未從呼出氣的結果中得到隨劑量變化可推測出輻射損傷程度分類情況。后續將繼續進行更大量的不同輻射劑量大鼠呼出氣的分析,以期找出不同輻射劑量間的潛在差異性代謝物的變化情況。
利益沖突:本研究不涉及任何利益沖突。
放射治療是一種重要的癌癥治療方式[1-2],但治療性的放射劑量會對癌細胞和健康組織造成損害,對健康組織損害的嚴重程度因個體差異而難以預測[3]。隨著輻射技術的廣泛使用,輻射醫學及其他應用帶來了越來越多潛在的輻射損傷危害,一旦出現意外的核事故,則需要一個快速簡便的方法去診斷機體是否遭受輻射損傷。而目前臨床對輻射損傷的診斷方法主要是細胞遺傳學技術[4],如過早染色體凝聚分析、染色體畸變分析、微核分析等[5],但這些檢測方法耗時且對患者造成二次傷害。應用新興的呼吸代謝組學技術通過尋找輻射損傷相關的生物標志物,將為輻射損傷的分類、診斷建立無創、便捷的分析檢測方法奠定基礎。目前,已發現生物呼出氣中含有數千種不同的揮發性有機化合物(volatile organic compounds VOCs)[6],這些VOCs源于體內正常生理或疾病相關的代謝過程[7-8]。VOCs首先釋放到血液中,最終進入肺部,成為呼出的氣體。呼出氣的分析已經被廣泛應用于健康檢測和疾病的篩查診斷,如糖尿病[9-10]、肺癌[11-12]、新冠肺炎等[13-14],具有實時診斷的潛力。此外,呼出氣樣本具有非侵入性、容易獲取、分析快速等優點。目前將呼出氣樣本用于低劑量輻射損傷檢測的研究很少,本實驗以SD大鼠為實驗對象,利用呼出氣代謝組學技術探索低劑量輻射對大鼠呼出氣的影響,尋找輻射損傷潛在生物標志物,為非侵入性、快捷簡便的輻射損傷的分類、診斷提供相關檢測方法。
1 材料與方法
1.1 儀器、試劑和實驗動物
TD-30熱脫附儀(Shimadzu日本島津公司);Tenax-Ta吸附管(Shimadzu日本島津公司);GCMS-QP2010SE氣相色譜與質譜聯用儀(Shimadzu日本島津公司);大氣采樣儀GQC-2(北京科安勞保技術有限公司);大鼠體位固定器(自制);鈷源(軍事醫學研究院輻射醫學研究所提供);電子天平(杭州萬特衡器有限公司監制);一次性使用微量采血管(泰州市宇杰醫療器械有限公司);一次性使用無菌注射器(山東新華安得醫療用品有限公司)。水合氯醛(國藥集團化學試劑有限公司);變色硅膠(國藥集團化學試劑有限公司);氯化鈉注射液(石家莊四藥有限公司)。
SPF級雄性Sprague-Dawely(SD)大鼠,體重約190 g,購自斯貝福(北京)生物技術有限公司[許可證號:SCXK(京)2019–0010],飼養于軍事醫學研究院實驗動物中心[SYXK(軍)2017–0023],適應性喂養6天,飼養室溫度(24±3)℃,相對濕度50%~60%,進食與飲水自由。
1.2 方法
1.2.1 大鼠輻射模型
大鼠適應性喂養6天,在第6天晚上開始禁食12 h,飲水自由,第7天給予大鼠350 mg/kg的10%水合氯醛腹腔注射麻醉,仰臥位并排固定于泡沫板上,使用塑料扎帶和膠帶加固后,泡沫板豎直放置,使大鼠胸腹部朝外。用鉛塊遮擋大鼠頭部和腹部及以下部位,以49.96 R/min劑量率的60Co輻射源照射SD大鼠胸部,建立不同劑量(0.5、1、2、3 Gy)輻射損傷模型,每組8只。
1.2.2 儀器條件
TD30-熱脫附儀條件:吸附管脫附溫度250 ℃,流速60 mL/min,時間8 min;聚焦管冷卻溫度–20℃,聯合溫度、閥溫度和傳輸線溫度均250 ℃。色譜條件:Rtx-5MS毛細管柱(30 m×0.25 mm×0.25 μm),柱箱溫度40℃,進樣口溫度33℃,進樣時間1 min。柱溫程序:起始溫度40℃(保持5 min),以4 ℃/min的升溫速率上升至250℃(保持5 min);進樣方式為不分流。質譜條件:EI,離子源溫度240 ℃,接口溫度280 ℃,溶劑延遲時間1 min,掃描方式Scan,掃描范圍:35~500 m/z。
1.2.3 呼出氣采集方式
用經老化后的軟管依次連接大氣采樣儀、Tenax-Ta吸附管、硅膠干燥管和大鼠體位固定器。造模結束,等待SD大鼠完全蘇醒后立即進行第1次呼吸氣采集,作為第1天采集數據,而后采集輻射后第5天、第9天及第13天大鼠的呼出氣。采集速率75 mL/min,采集時長60 min[15]。
1.3 數據分析與處理
氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)數據以“.cdf”格式輸出,利用XCMS-online在線數據平臺對各組呼出氣的色譜峰保留時間和面積進行校準,獲取保留時間(Rt)、質荷比(m/z)、P值等參數。將獲取到P<0.05的相關峰數據通過歸一化,得到一個二維矩陣。將數據傳輸至SIMCA 14.1中,進行非監督模式的主成分分析(principal component analysis,PCA)、正交偏最小二乘法判別分析(orthogonal partial least squares discrimination analysis,OPLS-DA),篩選出vip>1的潛在差異性代謝物。將篩選出的化合物與NIST 2017質譜數據庫進行相似度對比檢索,并根據質譜裂解規律、特征離子和有關文獻來定性分析。體重作圖使用Origin 2022軟件,其他生化數據利用SPSS 27.0軟件進行統計分析,呈正態分布的計量實驗數據以均數±標準差(x±s)表示,多組數據比較采用單因素方差分析(one-way ANOVA)。P<0.05為差異有統計學意義。
2 結果
2.1 大鼠輻射損傷模型
2.1.1 大鼠體重變化
大鼠體重變化趨勢如圖1所示。輻射試驗前6天進行適應性喂養,各組大鼠體重平均穩步增加。第6天晚所有大鼠統一禁食,第7天體重均下降。造模結束后,各組大鼠恢復飲食、飲水自由。從圖1可見,輻射照射后3天內大鼠體重低于空白組,第4天開始逐漸恢復。
 圖1
大鼠體重變化趨勢
圖1
大鼠體重變化趨勢
2.1.2 肺組織病理學變化
肺組織蘇木精-伊紅染色(hematoxylin-eosin staining,HE)染色切片見圖2。與空白組相比,模型組的肺組織切片可看見肺泡壁中度增厚,并伴有較多粒細胞浸潤,較多支氣管上皮細胞變性,胞質疏松淡染,并可見支氣管周圍淋巴細胞聚集,偶見支氣管中較多嗜酸性物質,說明輻射使大鼠的肺部在短期內產生一定程度的損傷。
 圖2
空白組與模型組肺組織HE染色切片(HE×20)
圖2
空白組與模型組肺組織HE染色切片(HE×20)
a. 空白組:各級支氣管、肺泡壁及血管等均未見明顯異;b. 3 Gy組:肺泡壁中度增厚,有較多粒細胞浸潤(黑箭),較多支氣管上皮細胞變性,胞質疏松淡染(紅箭)。
2.1.3 血象指標
如表1所示,60Co輻射照射模型組大鼠的外周血中白細胞、淋巴細胞、單核細胞和中性粒細胞百分比與空白組相比,隨著輻射劑量增加,差異逐漸增加。以上結果表明,大鼠的血液系統和免疫系統對輻射劑量有一定的依賴性,會造成不同程度損傷。各項血象指標變化趨勢符合輻射損傷后出現炎癥相關的基本特征,驗證本實驗輻射動物模型造模部分完成。
2.2 呼出氣分析
采集不同模型組和空白組的大鼠呼出氣,富集于Tenax-Ta吸附管中,使用GC-MS技術對吸附管中的物質進行分離與檢測。不同輻射劑量組與空白組的典型總離子流圖如圖3所示,從上往下輻射劑量分別為0.5 Gy、1 Gy、2 Gy、3 Gy和0 Gy,可見模型組與空白組的總離子流圖存在一定的變化,在相同的保留時間上,代謝物峰強度有所不同,說明不同輻射劑量對大鼠機體代謝產生了一定程度的變化。
 圖3
各組樣品典型總離子流圖
圖3
各組樣品典型總離子流圖
將各模型組數據分別與空白組數據經過XCMS-online在線數據平臺處理后,傳至SIMCA14.1,進行無監督的PCA分析。如圖4所示,空白組和各個不同時間段采集的模型組呼出氣樣本點均處于95%置信區間內。且不同劑量模型組與空白組的分離與聚集情況都相對較好,隨著劑量增加,分離程度更加明顯。其中,從低劑量到高劑量的累計預測率Q2值分別為0.51、0.57、0.64、0.59,都大于0.5,說明整體預測性良好,構建模型可靠。
 圖4
各個模型組與空白組的PCA分析圖
圖4
各個模型組與空白組的PCA分析圖
a. 0.5 Gy組與空白組;b. 1 Gy組與空白組;c. 2 Gy組與空白組;d. 3 Gy組與空白組
進一步對各模型組在不同時段采集的呼出氣以及空白組進行OPLS-DA分析,其中2 Gy組的大鼠在第13天時狀態不好,未進行采集。結果如圖5所示,各劑量組在不同天數采集的呼出氣的分離度和聚集性較良好,其中0.5 Gy、1 Gy和2 Gy與空白相比較,照射當天出現較大的差異性,而后逐漸出現軌跡緩慢移動的現象。構造的模型參數從低劑量到高劑量的R2X分別為0.76、0.76、0.79和0.82,R2Y分別為0.91、0.92、0.98和0.87,累積預測率Q2分別為0.80、0.83、0.92和0.86。
 圖5
各個模型組與空白組的OPLS-DA分析圖
圖5
各個模型組與空白組的OPLS-DA分析圖
a. 0.5 Gy組與空白組;b. 1 Gy組與空白組;c. 2 Gy組與空白組;d. 3 Gy組與空白組
利用SIMCA14.1軟件對各模型組與空白組的數據進行OPLS-DA分析后,篩選出P<0.05和VIP>1的碎片峰組分,根據保留時間(rtmed)、質荷比(m/z)和裂解規律等在NIST 2017質譜數據庫中進行對比,并結合化合物裂解規律等分析方法,最終共獲得19種與輻射損傷相關的VOCs,如表2所示。對比不同劑量模型組與空白組VOCs的豐度發現,與空白組相比,苯乙酮、壬醛、癸醛、十四烷這4種VOCs在不同劑量輻射照射后的第1天豐度都達到最大值,而庚烷、氯苯、對二甲苯、間二氯苯這4種化合物在輻射照射后豐度呈下降趨勢,隨著采集呼出氣時間的推移,逐步降低,推測是輻射致使肺部出現一定程度的損傷。本次實驗推斷庚烷、氯苯、對二甲苯、間二氯苯、苯乙酮、壬醛、癸醛、十四烷8種化合物可能為組合差異性代謝物。
3 討論
壬醛和癸醛屬于醛類,先前研究發現均與哮喘、肺癌等肺部疾病有關[16-17]。輻射損傷可導致機體產生大量活性氧(reactive oxygen species,ROS)和脂質過氧化[18]。ROS的增加也稱為氧化應激,包括碳水化合物代謝和脂肪酸β氧化等一系列氧化還原反應,細胞膜合成能力增加,細胞色素酶P450(cytochrome P450 enzyme system,CYP450)和醇脫氫酶等關鍵酶活性改變[19-20]。所以醛類物質含量的增加可能與ROS的大量產生有關[21],因為醛不僅參與脂肪酸和醇類物質的代謝,同時在氨基酸和碳水化合物的分解過程種也會產生。苯乙酮通過消耗還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)還原成苯乙醇[22],同時NADPH也是谷胱甘肽(glutathione,GSH)還原酶的輔酶,輻射損傷會產生大量的ROS,細胞為維持氧化還原動態平衡,會高表達還原型GSH[23],NADPH會隨GSH增加而減少,使得大鼠體內苯乙酮不能及時還原成苯乙醇進行體內代謝而增多,因此大鼠呼出氣中的苯乙酮含量上升。對于十四烷,已有研究表明烷烴和甲基化烷烴是氧化應激后呼出氣中的重要代謝產物,大量的ROS的產生會造成細胞線粒體功能障礙,導致不飽和脂肪酸的脂質過氧化,生成的烷烴類VOCs以呼吸的方式排除體外[24-25],與本實驗中十四烷豐度增加相符。
吸入對二甲苯會使肝CYP450增加但不產生肝毒性[26],而肺中CYP450下降[27],肺CYP450的減少可能與對甲基苯甲醛(對二甲苯通過醇脫氫酶代謝)有關[28]。可由此推測輻射損傷導致脂質過氧化而使得肺中CYP450含量增多,對二甲苯逐步被氧化成對甲基苯甲醛后與CYP450相結合,使得輻射后大鼠呼出氣中對二甲苯含量減少。CYP2E1是由CYP450基因超家族編碼的一種血紅素蛋白,目前普遍認為CYP2E1在病理情況下的表達增高是氧化應激造成組織損傷的主要機制之一[29],與輻射后機體產生氧化應激相符合。而氯苯在機體的代謝情況主要通過CYP2E1的作用下,主要通過氯苯氧化物氧化成4-氯苯酚,較少氧化成2-氯苯酚,以及少量代謝物3-氯苯酚,這些物質再通過環氧化物水解酶水合生成二氫二醇,或通過GSH-S轉移酶與GSH結合,形成4-氯苯基巰基酸進行代謝[30-32],所以輻射后大鼠呼出氣中能檢測到的氯苯含量下降。間二氯苯含量下降也與CYP450含量增加相關,研究表明二氯苯主要通過涉及CYP450的肝微粒體酶系統代謝成相對應的二氯苯酚,以葡萄糖醛酸軛合物和硫酸鹽軛合物的形式從尿液中排出[33-34]。酶含量增加,致使更多的間二氯苯代謝成3,5-二氯鄰苯二酚[35],通過尿液進行排泄,呼出氣中的含量減少。本實驗推測可能成為差異代謝性的化合物大多與輻射致使大鼠體內產生的一系列與氧化應激和脂質過氧化的體內代謝有關。
綜上所述,本研究通過TD-GC-MS技術,探索了低劑量輻射對大鼠造成損傷后呼出氣中VOCs的含量變化,應用PCA分析發現輻射大鼠與非輻射大鼠的呼出氣具有明顯的區分度。另外,通過OPLS-DA模型,并結合化合物裂解規律等篩選出空白組與模型組的特征性VOCs,推測十四烷、苯乙酮、壬醛等8種VOCs可能是輻射損傷相關的組合差異性代謝物。本研究為早期輻射損傷診斷提供了非侵入性、無創檢測提供相關檢測方法,后續將收集更多相關樣本,進一步為呼出氣作為無創性輻射損傷診斷提供依據。本實驗尚存在一定局限性,研究納入的樣本量較小,后續的研究需要進一步擴大樣本量;同時,本實驗進行的劑量多為低劑量,并未從呼出氣的結果中得到隨劑量變化可推測出輻射損傷程度分類情況。后續將繼續進行更大量的不同輻射劑量大鼠呼出氣的分析,以期找出不同輻射劑量間的潛在差異性代謝物的變化情況。
利益沖突:本研究不涉及任何利益沖突。