引用本文: 王琴, 林寧, 王家雨, 白玉杰, 李玫, 石培潔, 羅書泓, 馮健, 李福祥. 曲美他嗪在重癥加強治療病房獲得性衰弱中的作用及機制研究. 中國呼吸與危重監護雜志, 2024, 23(7): 478-487. doi: 10.7507/1671-6205.202312046 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
重癥加強治療病房獲得性衰弱(intensive care unit-acquired weakness,ICU-AW)是膿毒癥患者在內的危重患者常見的并發癥之一,是導致膿毒癥致死率和致殘率居高不下的重要原因[1-3]。ICU-AW主要表現為四肢弛緩性無力,且肢體近端肌肉萎縮和無力較為突出[4-5],此外,呼吸肌也經常受到影響,尤其接受機械通氣的患者[6],其發生機制和膿毒癥狀態下骨骼肌蛋白質的過度降解[5,7-8]和合成減少[8]密切相關,但膿毒癥狀態下骨骼肌損傷的機制及調控靶點尚不完全清楚。細胞焦亡是一種細胞程序性死亡,幾乎可以影響人體所有的重要系統[9]。曲美他嗪(trimetazidine,TMZ)作為抗心絞痛藥物,能夠通過抑制細胞焦亡而發揮心肌保護作用[10],最新研究發現TMZ還可以通過抑制細胞焦亡改善地塞米松誘導的肌肉萎縮[11]。由此可見,TMZ可能參與骨骼肌的代謝過程,但其能否通過調控細胞焦亡途徑改善ICU-AW患者的骨骼肌損傷尚未見報道。因此,本研究擬通過小鼠腹腔注射脂多糖(lipopolysaccharide,LPS)構建ICU-AW小鼠模型,并對TMZ在其中的作用和機制進行研究,為TMZ用于ICU-AW的防治提供可參考的實驗依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物
8~9周齡SPF級雄性C57BL/6野生型小鼠140只,體重(24.21±1.82)g,由斯貝福(北京)生物技術有限公司提供[合格證號SCXK(京)2019-0010]。小鼠在西部戰區總醫院實驗動物中心SPF級動物房常規飼養,室溫維持20~25℃,12 h/12 h光照和黑暗交替,給予常規飼料自由飲食,正式實驗開始前適應性飼養2周。實驗動物中心的資質號SYXK(川)2020-230。本研究獲得西部戰區總醫院實驗動物倫理委員會批準(2023EC5-ky010)。
1.1.2 主要試劑
大腸桿菌LPS(O55:L8880;北京索萊寶科技有限公司);TMZ(13171-25-0;北京沃凱生物科技有限公司);半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)抑制劑AC-YVAD-CMK(AC,美國MCE公司),全蛋白提取試劑盒、BCA蛋白濃度測定試劑盒(江蘇凱基生物技術有限公司);抗體肌肉細胞特異性泛素蛋白連接酶1(muscle-specific RING finger protein 1,MuRF1)、Atrogin-1、Caspase-1、消皮素D(gasdermin D,GSDMD)、β-actin、二抗山羊抗兔購于英國Abcam公司;實時熒光定量聚合酶鏈式反應(quantitative real-time polymerase chain reaction,qRT-PCR)引物購于北京擎科生物科技有限公司;蘇木精-伊紅染色(hematoxylin-eosin staining,HE)試劑盒購于蘭杰柯科技有限公司;白細胞介素(interleukin,IL)-1β、IL-18酶聯免疫吸附試驗(enzyme-linked immunosorbnent assay,ELISA)試劑盒購于(凡科維商城)。
1.2 方法
1.2.1 動物分組及模型制備
選取70只小鼠,隨機分為Normal組、LPS溶劑(Vehicle)組、LPS(6 mg/kg)組、LPS(8 mg/kg)組、LPS(10 mg/kg)組、LPS(12 mg/kg)組、LPS(14 mg/kg)組,每組10只。Normal組為空白對照組,各不同濃度的LPS組參考Zhang等[12]研究的造模方法予以腹腔注射LPS構建ICU-AW小鼠模型,Vehicle組予以腹腔注射等體積生理鹽水。觀察各組小鼠體重、抓力、96 h存活率,選取最佳LPS濃度和取材時間,進一步檢測該LPS濃度及取材時間對小鼠腓腸肌萎縮蛋白MuRF1、Atrogin-1的mRNA和蛋白表達的影響,以驗證ICU-AW造模是否成功。根據前期研究結果最終選取LPS(12 mg/kg)腹腔注射96 h作為后續實驗造模方法。
造模成功后另取70只小鼠隨機分為Normal組、Vehicle組、LPS組、LPS+TMZ溶劑組、LPS+TMZ組、LPS+TMZ+AC溶劑組、LPS+TMZ+AC組,每組10只。Normal組不做任何干預;Vehicle組腹腔注射LPS溶液等體積生理鹽水;剩余各組均腹腔注射LPS(12 mg/kg);LPS注射完成后,LPS+TMZ組、LPS+TMZ+AC溶劑組、LPS+TMZ+AC組予以TMZ(5 mg·kg–1·d–1)灌胃[13-14],每天1次,持續4 d;LPS+TMZ溶劑組予以TMZ等量生理鹽水灌胃,每天1次,持續4 d;其中,LPS+TMZ+AC組在LPS注射前1 h腹腔注射Caspase-1抑制劑AC[溶解在DMSO中,再用磷酸鹽緩沖液(phosphate buffered saline,PBS)稀釋,DMSO終濃度<1.67%,劑量為6.5 mg/kg[15]];LPS+TMZ+AC溶劑組注射等量AC溶劑PBS。TMZ治療結束后,檢測各組小鼠體重、抓力、96 h存活率,腓腸肌MuRF1、Atrogin-1、Caspase-1、GSDMD的mRNA和蛋白表達,以及小鼠血清IL-1β和IL-18的濃度,腓腸肌進行HE染色觀察組織病理變化。
1.2.2 小鼠肌肉力量的檢測
按Witteveen等[16]的抓力檢測方法,從造模開始前1天至第14天,每天用無創小鼠抓力儀測量小鼠前肢肌肉抓力。每次測試前抓力儀調零。小鼠安靜狀態下,右手提小鼠尾巴,將小鼠的前肢放在抓力測試儀金屬網上,勻速向后拉動小鼠,使小鼠向后移動至金屬網最后一格,每次測量時當小鼠將爪子從網格上松開時,會收縮肢體,此時金屬板連接著的抓力儀主機顯示器將顯示當次小鼠抓力峰值。每次測量后給予小鼠充分休息,連續測量5次,去掉最大值、最小值,剩余3次結果取平均值,即為抓力值。所有測試由一人操作,以減少測量誤差。
1.2.3 血液及組織學標本的采集
每組小鼠在造模成功后第4天通過腹腔注射1%戊巴比妥鈉(50 mg/kg)進行麻醉,麻醉成功后,采用摘眼球取血法采集血液標本,靜置30 min以后,離心,分離血清,保存于–80℃冰箱,備后續檢測用。留取小鼠一側腓腸肌,將所取標本置入4%多聚甲醛溶液中24 h以上,另一側腓腸肌置于–80℃冰箱中保存待檢。
1.2.4 腓腸肌組織學檢查
HE染色:取固定后的小鼠腓腸肌標本,進行脫水、石蠟包埋,4 μm厚度切片,按照HE染色試劑盒操作說明書步驟進行HE染色,并在光學顯微鏡下觀察、拍照。
1.2.5 qPCR檢測mRNA表達
采用qPCR檢測腓腸肌中MuRF1、Atrogin-1、GSDMD、Casepase-1基因的表達(引物序列見表1)。采用Trizol法提取腓腸肌組織標本中的總RNA,離心、RNA洗滌、再溶解,測定總Caspase-1、GSDMD的RNA濃度及純度,最后進行引物設計及PCR反應。
1.2.6 蛋白免疫印跡(Western blot)測定蛋白的含量
采用Western blot檢測腓腸肌中MuRF1、Atrogin-1、GSDMD、Casepase-1蛋白的表達。裂解腓腸肌組織并提取總蛋白,采用BCA法進行蛋白定量,經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳、轉膜、封閉后,加入相應一抗,4℃孵育過夜,TBST漂洗3次后,加入相應二抗孵育1 h,TBST漂洗3次,洗膜后使用Millipore顯色試劑盒進行顯色,采用凝膠成像系統拍照。用Image J軟件對目的基因條帶灰度值進行統計分析。
1.2.7 ELISA試劑盒分別測定小鼠血清中IL-Iβ、IL-18的濃度
各炎癥指標的檢測操作均按相應ELISA試劑盒說明書步驟進行。
1.3 統計學方法
使用GraphPad Prism V5及SPSS 16.0軟件進行制圖及數據分析。符合正態分布的計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗;兩組間比較采用t檢驗;方差不齊時采用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 LPS腹腔注射成功構建ICU-AW小鼠模型
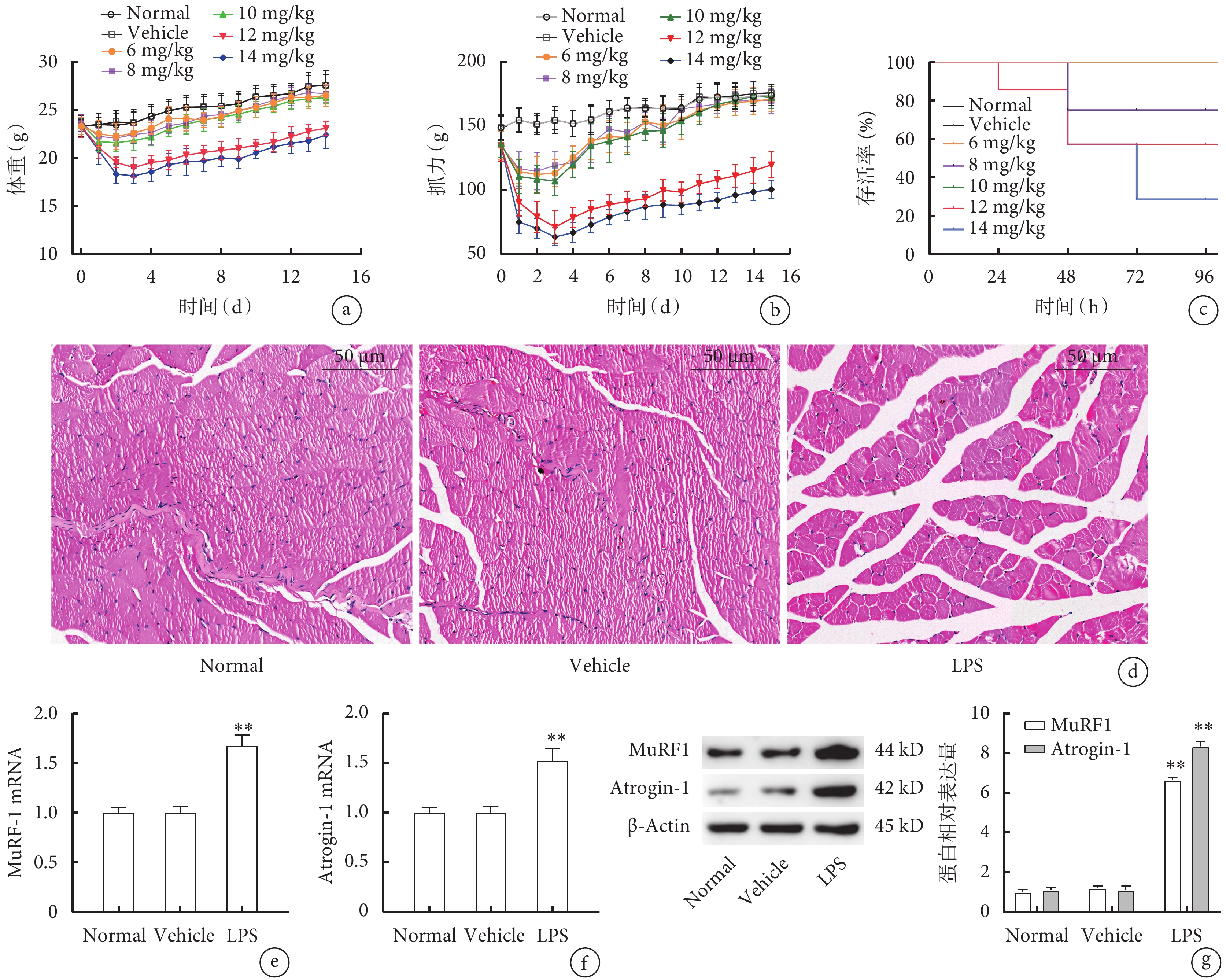
小鼠腹腔不同濃度LPS注射后,LPS(6 mg/kg)組、LPS(8 mg/kg)組、LPS(10 mg/kg)組在2周的觀察期內體重及抓力值無明顯變化(圖1a、b,P>0.05),而LPS(12 mg/kg)和LPS(14 mg/kg)組小鼠體重和抓力均呈先下降后逐漸升高趨勢(圖1a、b,P<0.05);組內分析發現,與第0天相比,LPS(12 mg/kg)和LPS(14 mg/kg)組小鼠均在3~5 d時體重和抓力最低(圖1a、b,P<0.05)。各組小鼠96 h存活率分析發現,LPS(12 mg/kg)和LPS(14 mg/kg)組小鼠存活率均顯著低于Normal組(圖1c,P<0.05),而LPS(14 mg/kg)組比LPS(12 mg/kg)組小鼠存活率更低(圖1c,P<0.05)。光鏡下,Normal組和Vehicle組小鼠腓腸肌肌束結構完整,肌纖維排列緊密,大小形態正常,未見細胞碎裂、溶解;而LPS(12 mg/kg)組出現肌肉萎縮、肌束結構破壞、細胞數量減少、肌纖維排列疏松(圖1d)。qPCR檢測發現,與Normal組及Vehicle組相比,LPS(12 mg/kg)組小鼠MuRF1(圖1e)、Atrogin-1(圖1f)表達均顯著升高(P<0.01),Western blot檢測結果與qPCR趨勢一致(圖1g,P<0.01)。
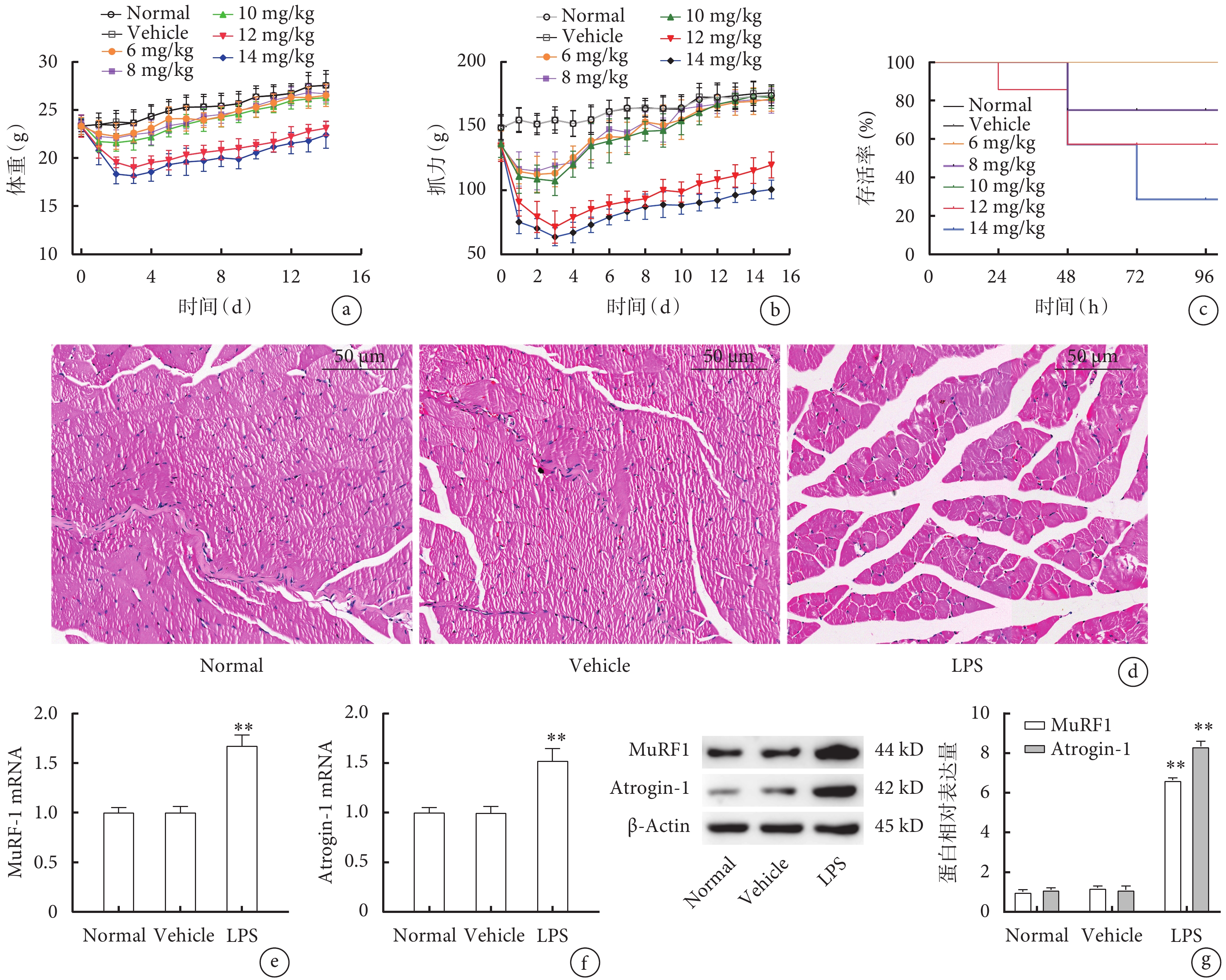 圖1
LPS腹腔注射構建ICU-AW模型小鼠生理指標及骨骼肌變化比較
圖1
LPS腹腔注射構建ICU-AW模型小鼠生理指標及骨骼肌變化比較
a. 體重;b. 抓力;c. 存活率;d. 腓腸肌病理像(HE×200);e. 腓腸肌MuRF1的mRNA表達;f. 腓腸肌Atrogin-1的mRNA表達;g. 腓腸肌MuRF1和Atrogin-1的蛋白表達。與Normal組及Vehicle組比較,*
2.2 Caspase-1/GSDMD信號通路介導的細胞焦亡可能參與ICU-AW發病過程
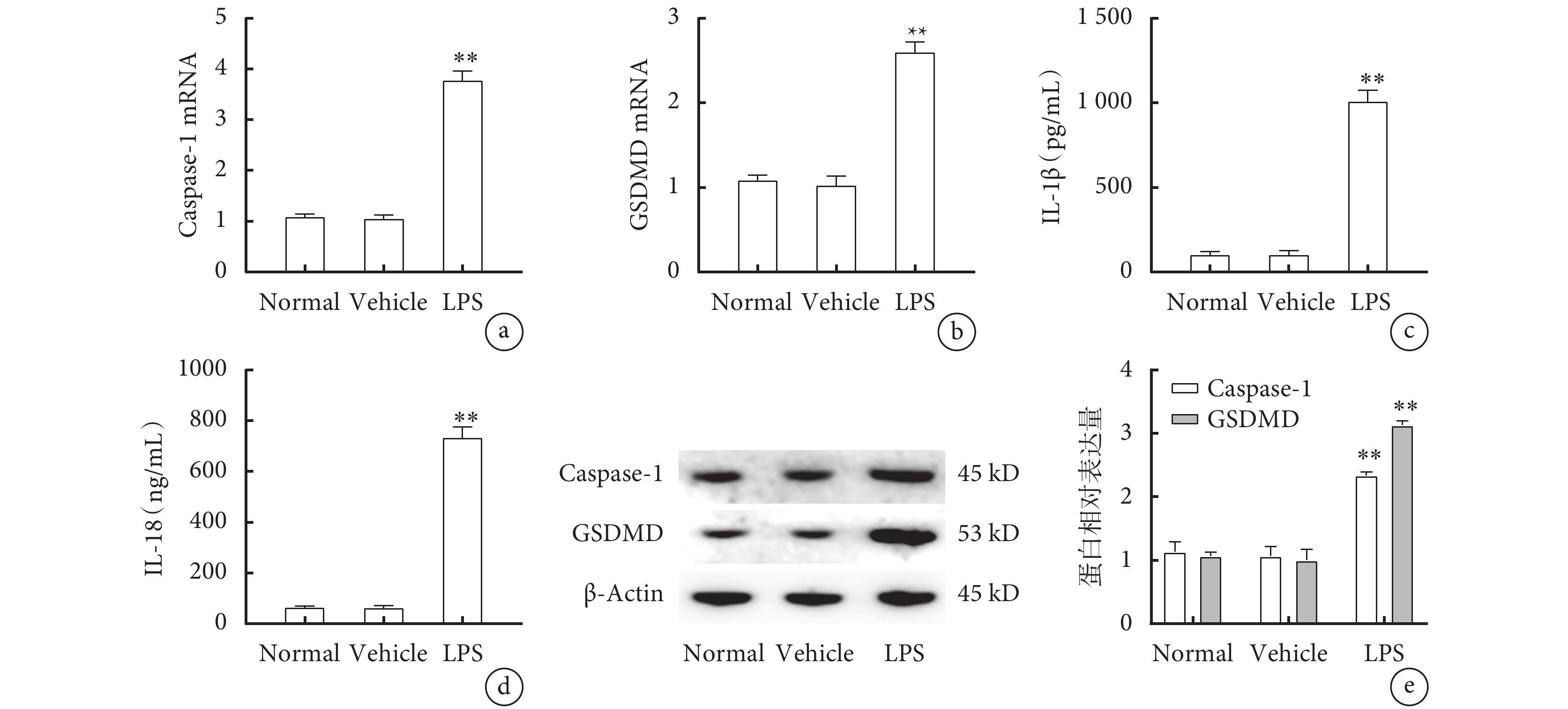
各組小鼠腓腸肌qPCR結果提示,與Normal組及Vehicle組相比,LPS組Caspase-1(圖2a)和GSDMD(圖2b)的mRNA表達及蛋白表達量(圖2e)明顯升高(P<0.01)。ELISA結果顯示,與Normal組及Vehicle組相比,LPS組血清IL-1β(圖2c)和IL-18(圖2d)的濃度也明顯升高(P<0.01)。
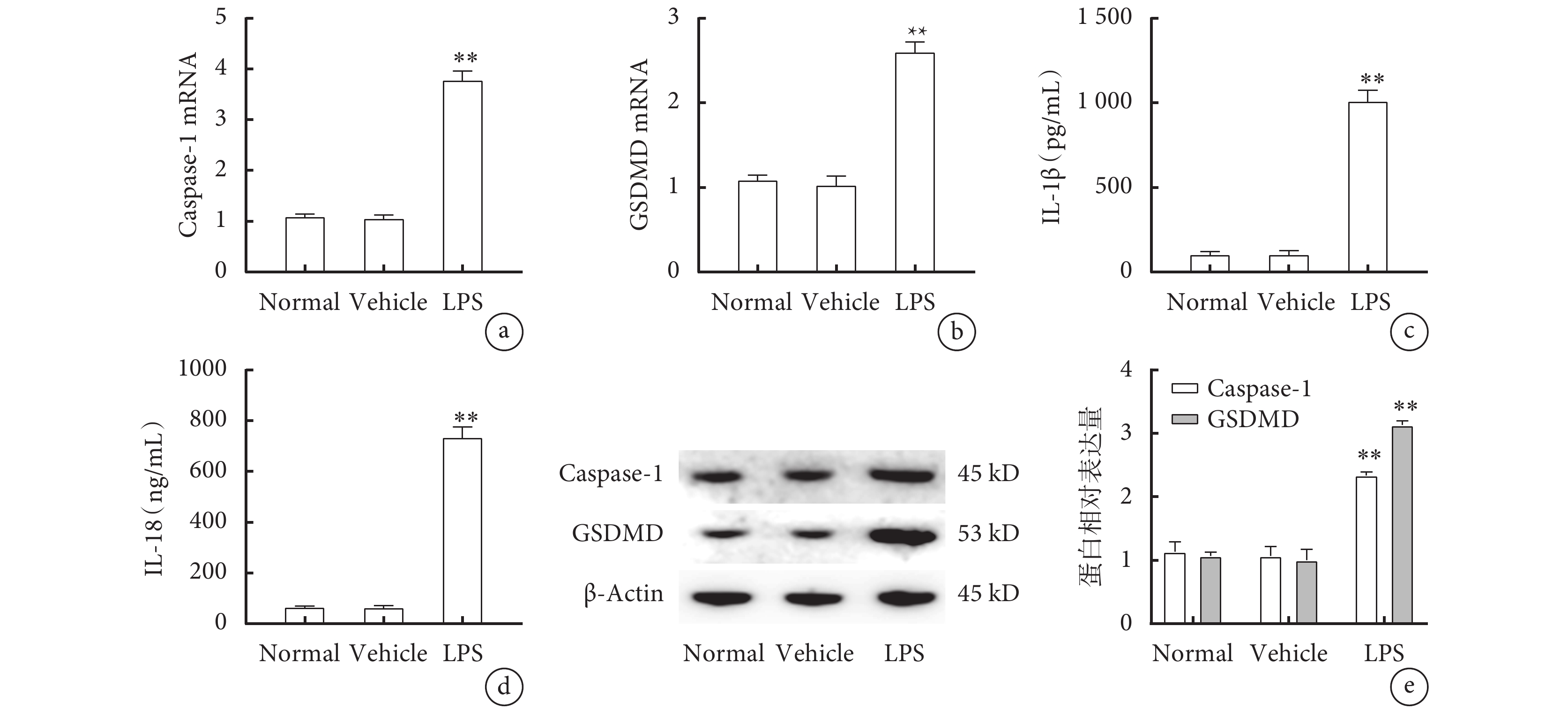 圖2
各組小鼠焦亡相關蛋白Caspase-1、GSDMD表達情況及血清IL-1β、IL-18濃度
圖2
各組小鼠焦亡相關蛋白Caspase-1、GSDMD表達情況及血清IL-1β、IL-18濃度
a. 腓腸肌Caspase-1 mRNA的表達;b. 腓腸肌GSDMD mRNA的表達;c. 血清IL-1β的濃度;d. 血清IL-18的濃度;e. 腓腸肌Caspase-1和GSDMD的蛋白表達。與Normal組及Vehicle組比較,**
2.3 TMZ可能對ICU-AW小鼠具有保護作用
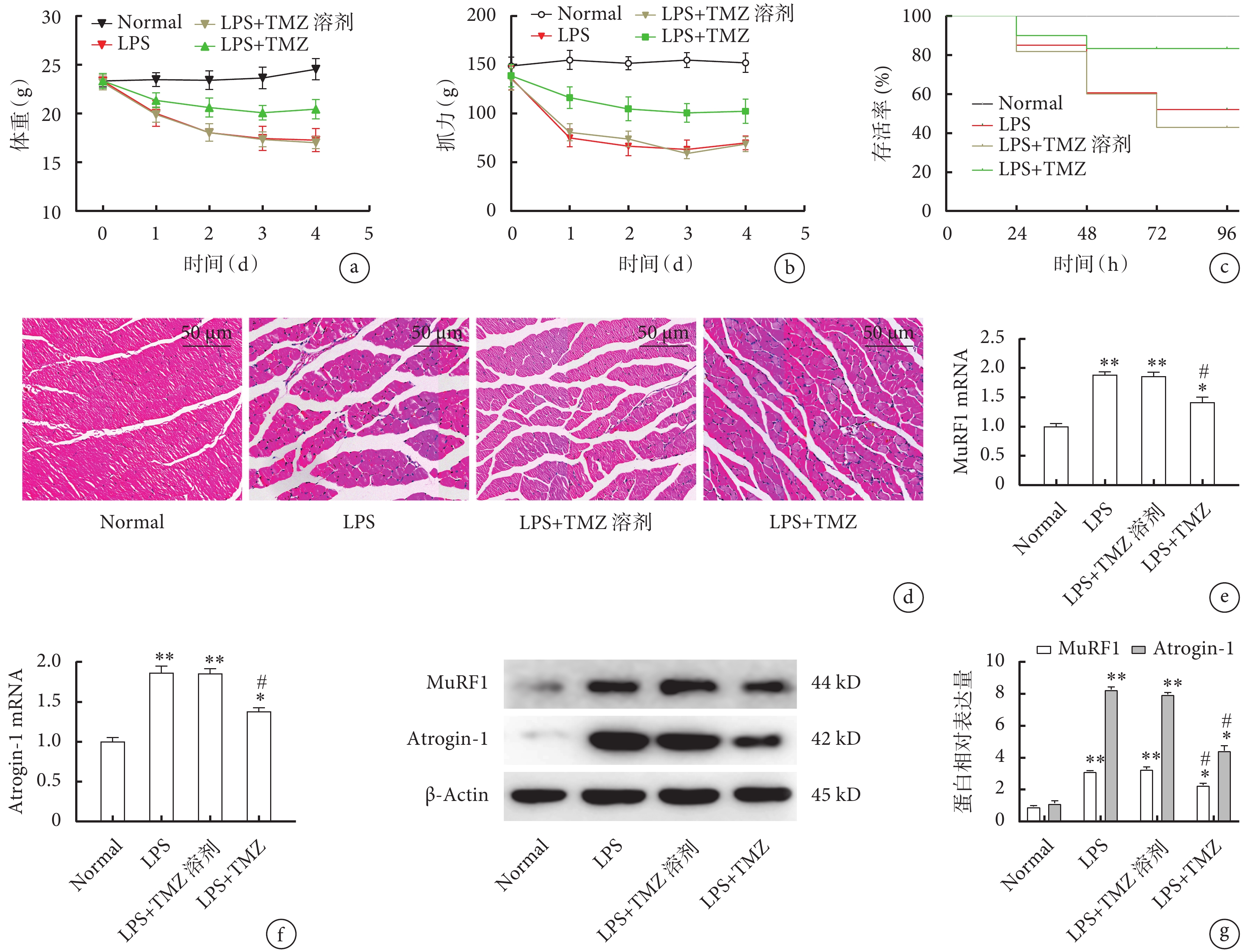
在LPS造模的基礎上予以TMZ干預后,LPS+TMZ組體重及抓力均低于Normal組(圖3a、b,P<0.05),但高于LPS組及LPS+TMZ溶劑組(表2,圖3a、b,P<0.05);LPS+TMZ組小鼠存活率低于Normal組但高于LPS組及LPS+TMZ溶劑組(圖3c,P<0.05);LPS+TMZ組相比LPS組及LPS+TMZ溶劑組肌肉萎縮程度減輕、肌束結構破壞較少、細胞的數量增多(圖3d);qPCR檢測結果提示,與LPS組及LPS+TMZ溶劑組相比,LPS+TMZ組MuRF1(圖3e)、Atrogin-1(圖3f)表達均明顯降低(P<0.05);Western blot檢測結果與qPCR結果趨勢一致(圖3g,P<0.05)。
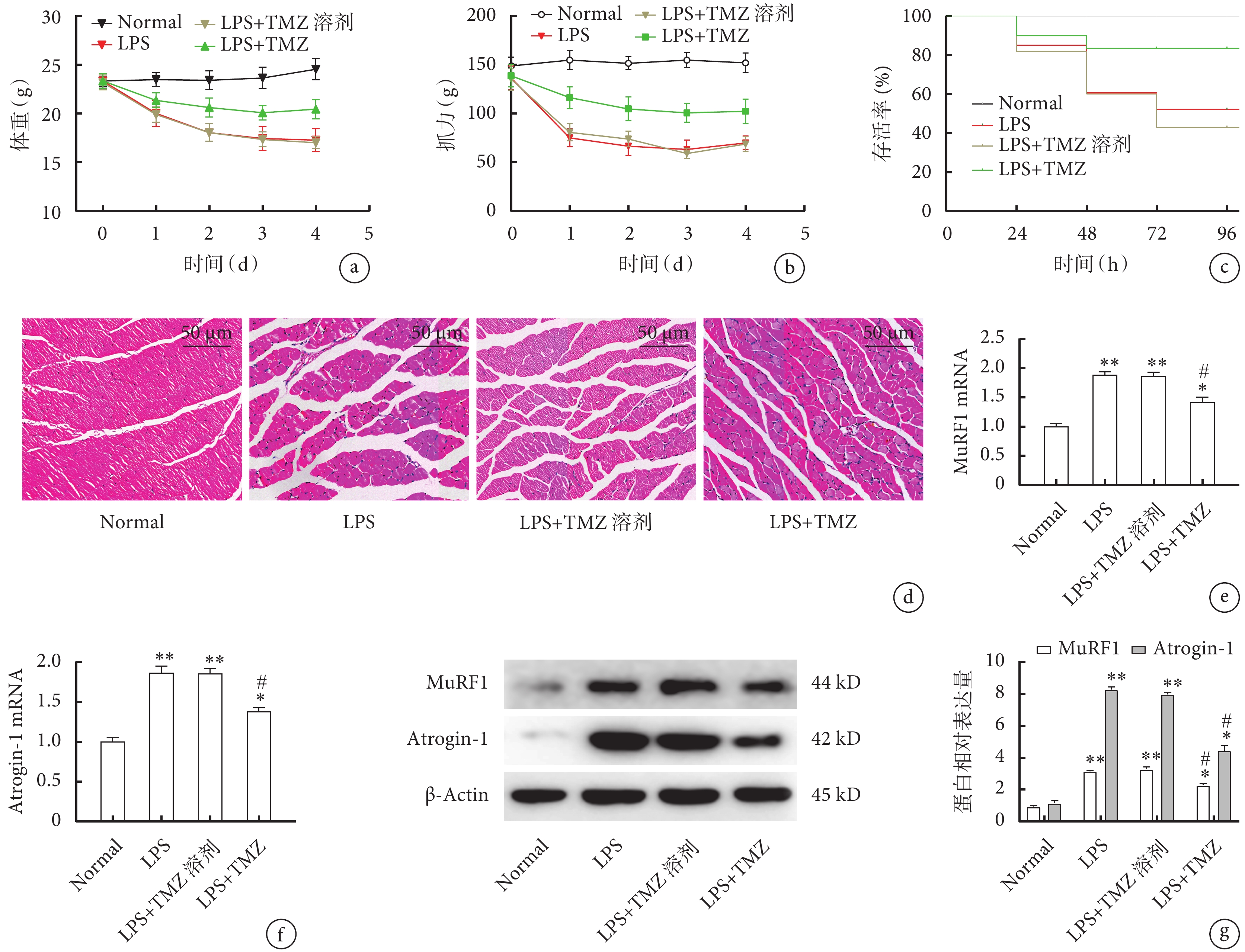 圖3
TMZ干預后各組小鼠生理指標及骨骼肌變化
圖3
TMZ干預后各組小鼠生理指標及骨骼肌變化
a. 體重;b. 抓力;c. 存活率;d. 腓腸肌病理像(HE×200);e. 腓腸肌MuRF1的mRNA表達;f. 腓腸肌Atrogin-1的mRNA表達;g. 腓腸肌MuRF1和Atrogin-1的蛋白表達。與Normal組比較,*
2.4 TMZ的保護作用可能是通過抑制Caspase-1/GSDMD介導的細胞焦亡發揮作用
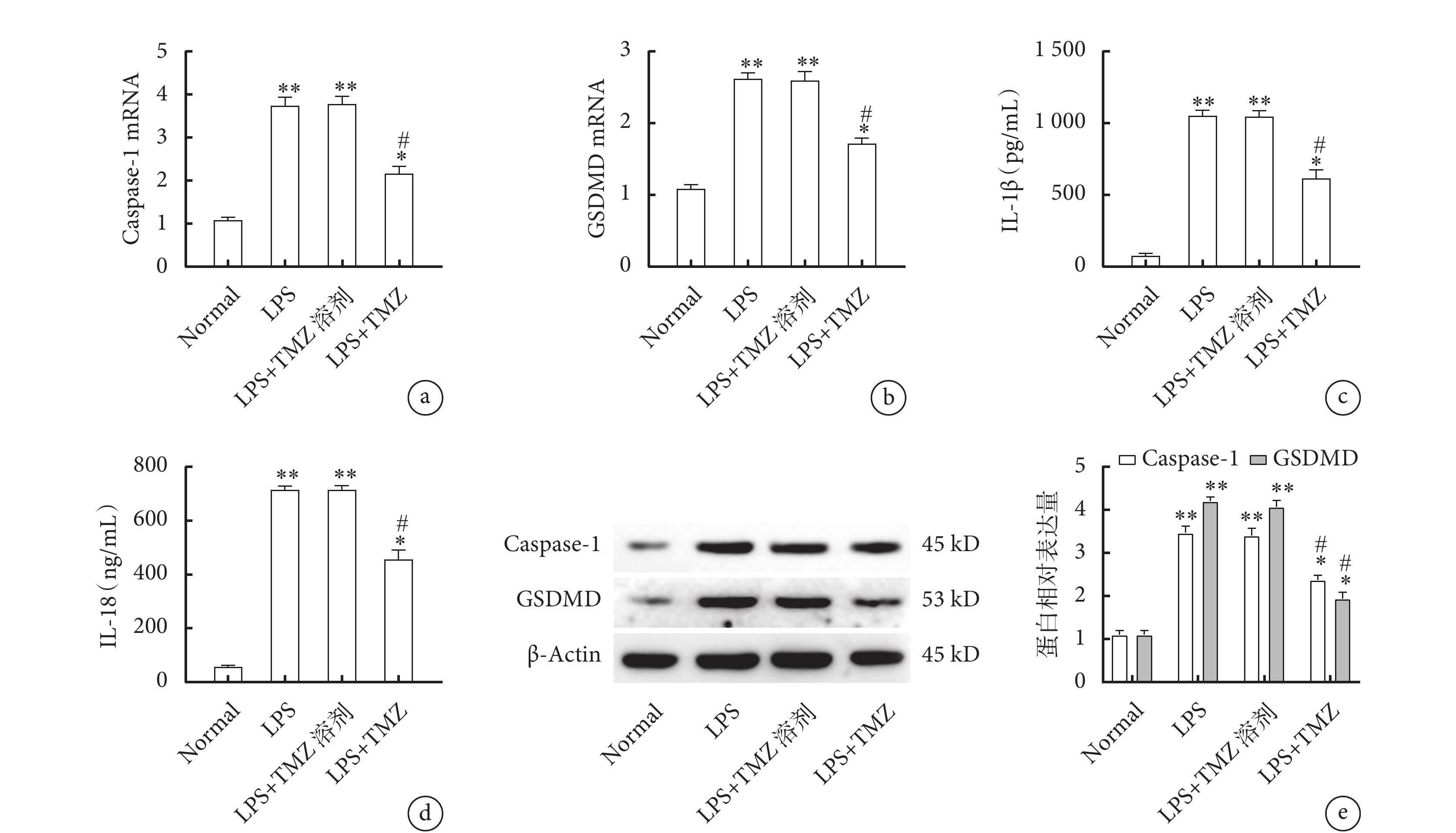
在LPS基礎上予以TMZ干預后,LPS組、LPS+TMZ溶劑組及LPS+TMZ組Caspase-1和GSDMD的mRNA表達均高于Normal組(圖4a、b,P<0.05),但TMZ組Caspase-1和GSDMD的mRNA表達低于LPS組及LPS+TMZ溶劑組(圖4a、b,P<0.05);進一步檢測血清中IL-1β、IL-18濃度及腓腸肌Caspase-1、GSDMD表達量,發現與qPCR趨勢一致(圖4c、d、e,P<0.05)。
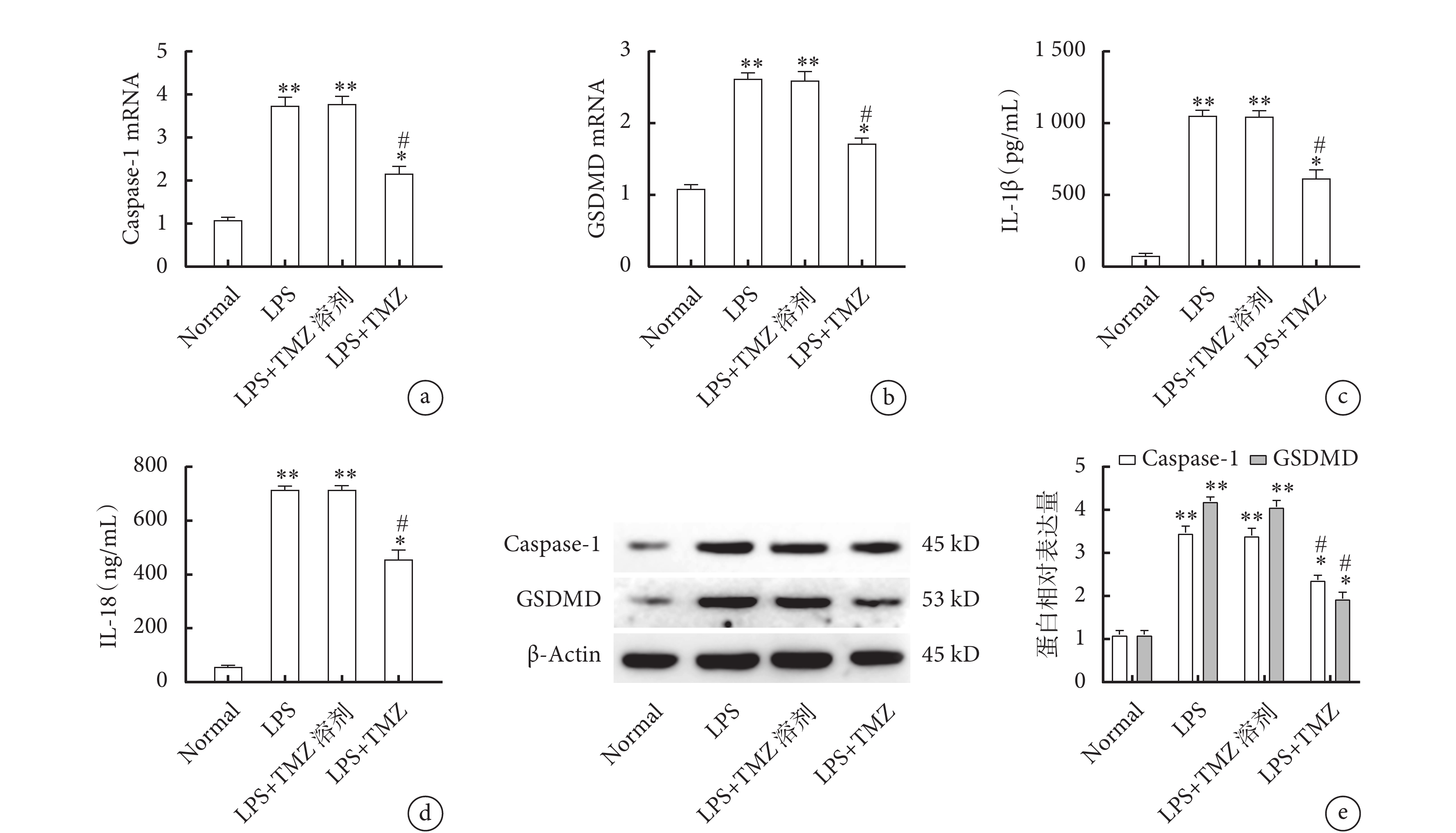 圖4
各組小鼠骨骼肌焦亡通路蛋白Caspase-1、GSDMD的表達量及血清IL-1β、IL-18濃度
圖4
各組小鼠骨骼肌焦亡通路蛋白Caspase-1、GSDMD的表達量及血清IL-1β、IL-18濃度
a. 腓腸肌Caspase-1 mRNA的表達;b. 腓腸肌GSDMD mRNA的表達;c. 血清IL-1β濃度;d. 血清IL-18濃度;e. 腓腸肌Caspase-1及GSDMD的Western blot結果。與Normal組比較,*
2.5 Caspase-1抑制劑AC能夠通過抑制Caspase-1/GSDMD介導的細胞焦亡增強TMZ的骨骼肌保護作用
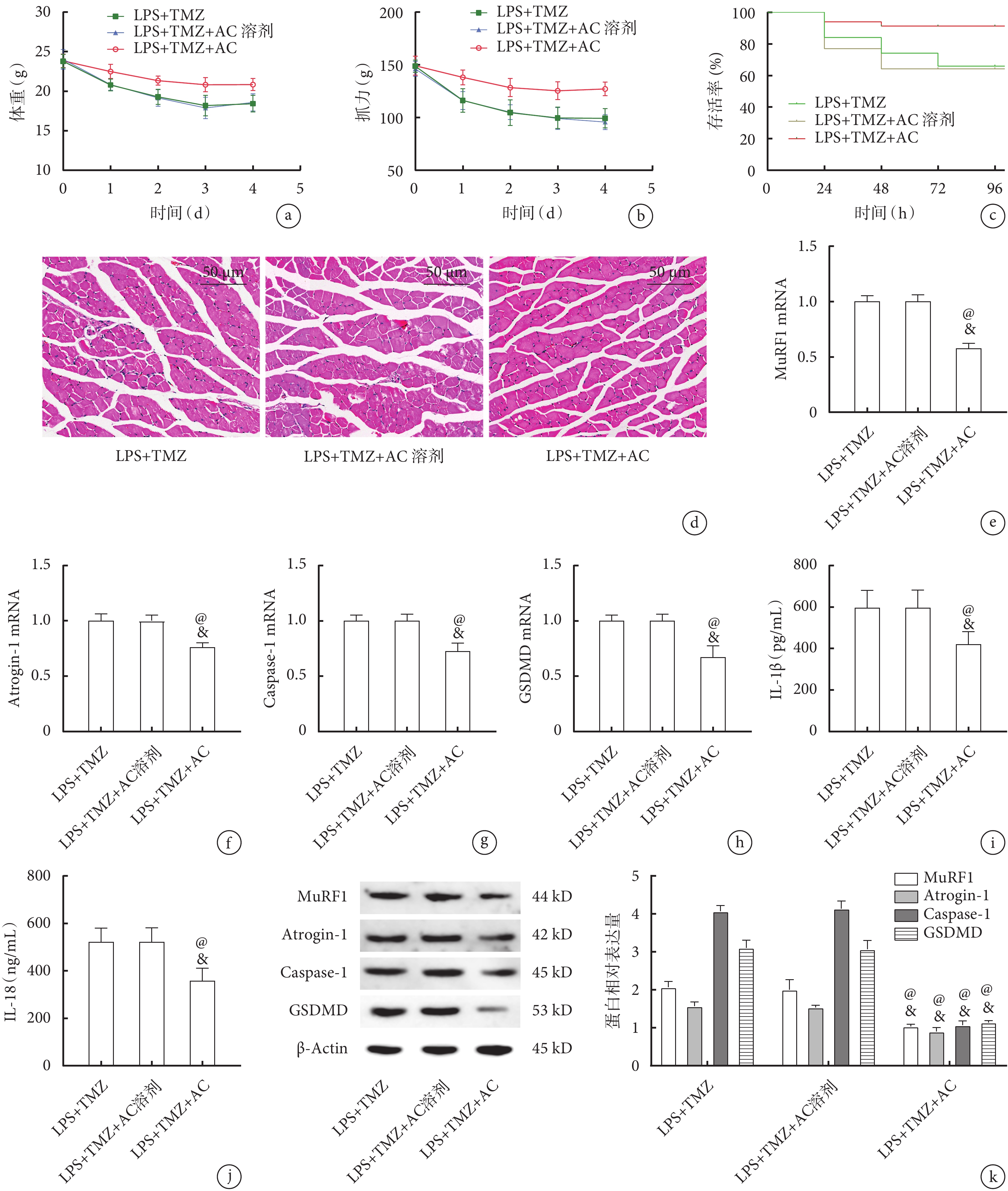
在LPS+TMZ基礎上予以Caspase-1抑制劑AC干預后,與LPS+TMZ組及LPS+TMZ+AC溶劑組相比,LPS+TMZ+AC組小鼠體重、抓力明顯升高(表3,圖5a、b,P<0.05);LPS+TMZ+AC組96 h存活率明顯高于LPS+TMZ組及LPS+TMZ+AC溶劑組(圖5c,P<0.05);腓腸肌HE染色結果提示,與LPS+TMZ組及LPS+TMZ+AC溶劑組比較,LPS+TMZ+AC組肌肉萎縮程度減輕,肌束結構破壞較少,細胞的數量增多(圖5d);腓腸肌qPCR檢測結果提示,與LPS+TMZ組及LPS+TMZ+AC溶劑組比較,LPS+TMZ+AC組MuRF1(圖5e)、Atrogin-1(圖5f)、Caspase-1(圖5g)和GSDMD(圖5h)的mRNA表達均顯著降低(P<0.05);進一步檢測各組GSDMD、Caspase-1蛋白及血清中IL-1β、IL-18濃度,發現與qPCR趨勢一致(圖5i~k,P<0.05)。
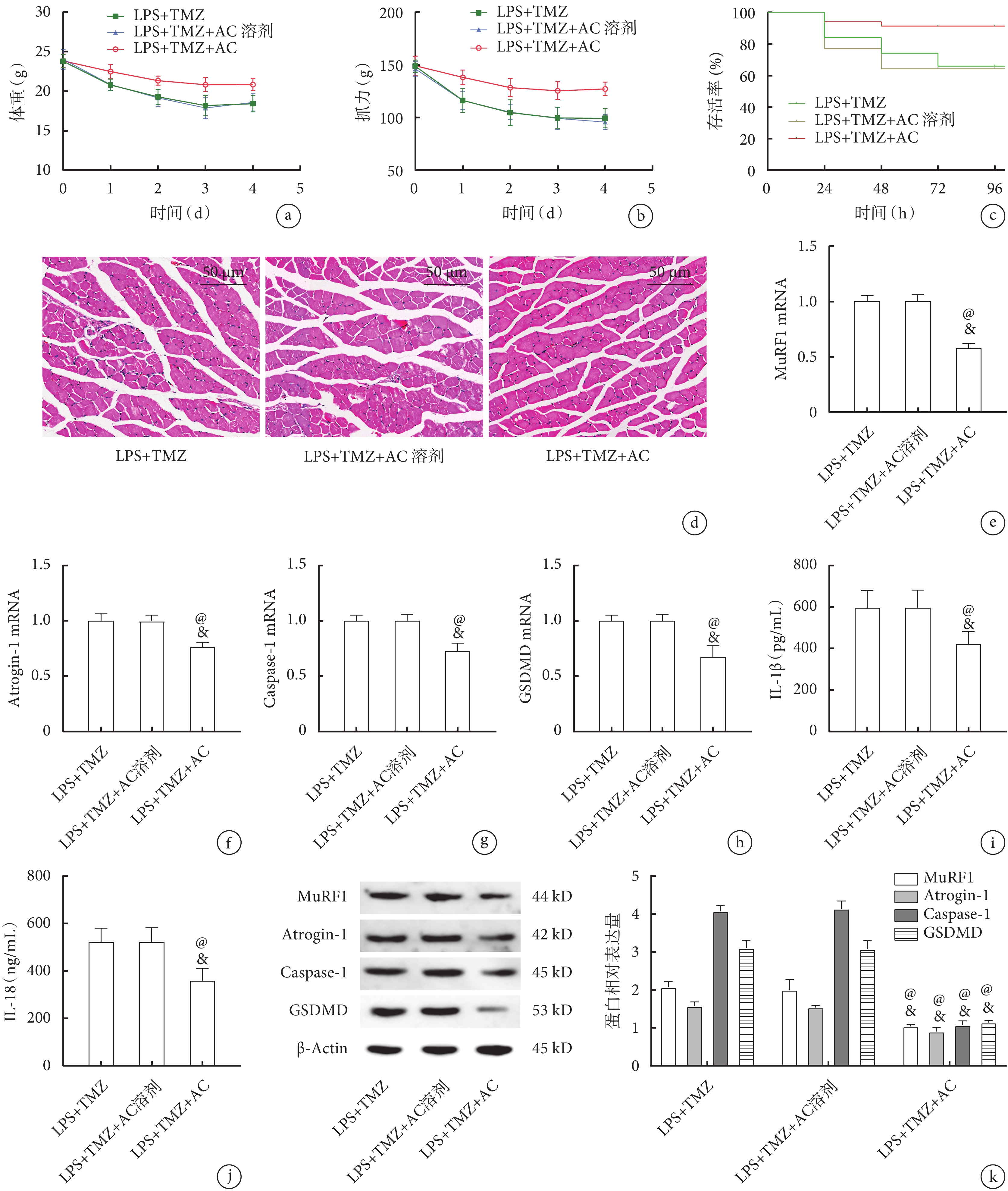 圖5
Caspase-1抑制劑AC與TMZ干預后各組小鼠生理指標及骨骼肌變化比較
圖5
Caspase-1抑制劑AC與TMZ干預后各組小鼠生理指標及骨骼肌變化比較
a. 體重;b. 抓力;c. 存活率;d. 腓腸肌病理像(HE×200);e. 腓腸肌MuRF1的mRNA表達;f. 腓腸肌Atrogin-1的mRNA表達;g. 腓腸肌Caspase-1的mRNA表達;h. 腓腸肌GSDMD的mRNA表達;i. 血清IL-1β的濃度;j. 血清IL-18的濃度;k. 腓腸肌MuRF1、Atrogin-1、Caspase-1、GSDMD的蛋白表達。與LPS+TMZ+AC溶劑組比較,@
3 討論
ICU-AW是危重癥患者的常見并發癥,可致機械通氣時間延長、ICU住院時間增加、病死率升高以及幸存者生活質量下降[17-18],但目前治療現狀并不滿意,主要原因在于發病機制尚不完全清楚、干預手段有限、缺乏特定藥物或靶向藥物進行治療[19-21]。因此,對ICU-AW發病機制及干預靶點進行深入研究對ICU-AW的防治具有重要意義。
目前,利用LPS腹腔注射構建ICU-AW模型是研究較多、較為成熟的造模方法[21-22]。但現有文獻中LPS造模濃度差異較大,本研究首先給小鼠腹腔注射不同濃度的LPS,綜合考慮存活率、炎癥程度、骨骼肌功能學和組織學等評價因素對最佳的LPS造模濃度進行了研究。結果發現采用12 mg/kg濃度的LPS腹腔注射造模穩定且小鼠存活率高,在96 h小鼠抓力和體重最低,外周血炎癥指標明顯升高,骨骼肌出現萎縮,因此將該濃度LPS干預96 h作為后續實驗的造模條件。
越來越多的研究表明,細胞焦亡參與諸多炎癥反應性疾病的發生發展[23-24],是導致肌肉萎縮的主要機制之一[25]。而GSDMD蛋白是細胞焦亡發生機制中的關鍵執行者,在細胞焦亡過程中發揮著重要作用。GSDMD在炎性Caspases-1介導下被切割為一個N端片段和C端片段,其中N端片段能在細胞膜上打孔并啟動細胞焦亡,進而促成成熟的IL-1β和IL-18釋放到胞外[26]。但Caspases-1/GSDMD介導的細胞焦亡在ICU-AW中的作用及調控機制尚不完全清楚。本研究通過腹腔注射LPS制備了ICU-AW小鼠模型,取材其骨骼肌組織進行qPCR、Western blot及病理檢測,收集外周血檢測炎癥因子濃度,發現細胞焦亡相關炎癥因子IL-1β和IL-18在血清中大量釋放,小鼠腓腸肌中Caspase-1、GSDMD基因和蛋白表達量均明顯高于對照組,提示Caspase-1/GSDMD信號通路介導的細胞焦亡可能參與了ICU-AW的發生發展。TMZ已被證實能通過抑制細胞焦亡發揮心肌保護作用[10],TMZ可減輕他汀類藥物相關的骨骼肌損傷[27],最新研究還發現TMZ通過抑制細胞焦亡改善地塞米松誘導的肌肉萎縮[11]。由此可見,TMZ和骨骼肌功能調控密切相關[11],但其在ICU-AW狀態下能否通過調控Caspase-1/GSDMD介導的細胞焦亡發揮骨骼肌保護作用尚無報道。本研究發現TMZ能夠改善LPS誘導的小鼠體重減輕和抓力降低,提高存活率,改善腓腸肌萎縮程度,降低萎縮蛋白MuRF1和Atrogin-1的表達,提示TMZ對ICU-AW具有保護作用。進一步檢測焦亡相關分子的表達,發現與對照組比較,TMZ組骨骼肌中Caspase-1、GSDMD基因和蛋白的表達明顯降低(P<0.05),血清中IL-18、IL-1β濃度也明顯降低(P<0.05),提示TMZ的保護作用可能是通過抑制Caspase-1/GSDMD信號通路發揮作用的。而利用Caspase-1抑制劑AC干預后,發現AC干預能夠增強TMZ的骨骼肌保護作用,則進一步證實了TMZ的保護作用依賴于Caspase-1/GSDMD信號通路。本研究首次明確了TMZ在ICU-AW中的作用及干預靶點,為TMZ拓寬適應證并應用于ICU-AW的臨床防治提供了理論參考依據。本研究的不足之處在于缺乏臨床試驗和細胞試驗的進一步驗證,我們將在下一步的研究中繼續探索,為TMZ應用于ICU-AW的防治提供更多參考依據。
綜上所述,本研究首次明確了TMZ對ICU-AW具有保護作用,且可能是通過抑制Caspase-1/GSDMD介導的細胞焦亡發揮作用,這對ICU-AW的防治具有重要參考價值。
利益沖突:本研究不涉及任何利益沖突。
重癥加強治療病房獲得性衰弱(intensive care unit-acquired weakness,ICU-AW)是膿毒癥患者在內的危重患者常見的并發癥之一,是導致膿毒癥致死率和致殘率居高不下的重要原因[1-3]。ICU-AW主要表現為四肢弛緩性無力,且肢體近端肌肉萎縮和無力較為突出[4-5],此外,呼吸肌也經常受到影響,尤其接受機械通氣的患者[6],其發生機制和膿毒癥狀態下骨骼肌蛋白質的過度降解[5,7-8]和合成減少[8]密切相關,但膿毒癥狀態下骨骼肌損傷的機制及調控靶點尚不完全清楚。細胞焦亡是一種細胞程序性死亡,幾乎可以影響人體所有的重要系統[9]。曲美他嗪(trimetazidine,TMZ)作為抗心絞痛藥物,能夠通過抑制細胞焦亡而發揮心肌保護作用[10],最新研究發現TMZ還可以通過抑制細胞焦亡改善地塞米松誘導的肌肉萎縮[11]。由此可見,TMZ可能參與骨骼肌的代謝過程,但其能否通過調控細胞焦亡途徑改善ICU-AW患者的骨骼肌損傷尚未見報道。因此,本研究擬通過小鼠腹腔注射脂多糖(lipopolysaccharide,LPS)構建ICU-AW小鼠模型,并對TMZ在其中的作用和機制進行研究,為TMZ用于ICU-AW的防治提供可參考的實驗依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物
8~9周齡SPF級雄性C57BL/6野生型小鼠140只,體重(24.21±1.82)g,由斯貝福(北京)生物技術有限公司提供[合格證號SCXK(京)2019-0010]。小鼠在西部戰區總醫院實驗動物中心SPF級動物房常規飼養,室溫維持20~25℃,12 h/12 h光照和黑暗交替,給予常規飼料自由飲食,正式實驗開始前適應性飼養2周。實驗動物中心的資質號SYXK(川)2020-230。本研究獲得西部戰區總醫院實驗動物倫理委員會批準(2023EC5-ky010)。
1.1.2 主要試劑
大腸桿菌LPS(O55:L8880;北京索萊寶科技有限公司);TMZ(13171-25-0;北京沃凱生物科技有限公司);半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)抑制劑AC-YVAD-CMK(AC,美國MCE公司),全蛋白提取試劑盒、BCA蛋白濃度測定試劑盒(江蘇凱基生物技術有限公司);抗體肌肉細胞特異性泛素蛋白連接酶1(muscle-specific RING finger protein 1,MuRF1)、Atrogin-1、Caspase-1、消皮素D(gasdermin D,GSDMD)、β-actin、二抗山羊抗兔購于英國Abcam公司;實時熒光定量聚合酶鏈式反應(quantitative real-time polymerase chain reaction,qRT-PCR)引物購于北京擎科生物科技有限公司;蘇木精-伊紅染色(hematoxylin-eosin staining,HE)試劑盒購于蘭杰柯科技有限公司;白細胞介素(interleukin,IL)-1β、IL-18酶聯免疫吸附試驗(enzyme-linked immunosorbnent assay,ELISA)試劑盒購于(凡科維商城)。
1.2 方法
1.2.1 動物分組及模型制備
選取70只小鼠,隨機分為Normal組、LPS溶劑(Vehicle)組、LPS(6 mg/kg)組、LPS(8 mg/kg)組、LPS(10 mg/kg)組、LPS(12 mg/kg)組、LPS(14 mg/kg)組,每組10只。Normal組為空白對照組,各不同濃度的LPS組參考Zhang等[12]研究的造模方法予以腹腔注射LPS構建ICU-AW小鼠模型,Vehicle組予以腹腔注射等體積生理鹽水。觀察各組小鼠體重、抓力、96 h存活率,選取最佳LPS濃度和取材時間,進一步檢測該LPS濃度及取材時間對小鼠腓腸肌萎縮蛋白MuRF1、Atrogin-1的mRNA和蛋白表達的影響,以驗證ICU-AW造模是否成功。根據前期研究結果最終選取LPS(12 mg/kg)腹腔注射96 h作為后續實驗造模方法。
造模成功后另取70只小鼠隨機分為Normal組、Vehicle組、LPS組、LPS+TMZ溶劑組、LPS+TMZ組、LPS+TMZ+AC溶劑組、LPS+TMZ+AC組,每組10只。Normal組不做任何干預;Vehicle組腹腔注射LPS溶液等體積生理鹽水;剩余各組均腹腔注射LPS(12 mg/kg);LPS注射完成后,LPS+TMZ組、LPS+TMZ+AC溶劑組、LPS+TMZ+AC組予以TMZ(5 mg·kg–1·d–1)灌胃[13-14],每天1次,持續4 d;LPS+TMZ溶劑組予以TMZ等量生理鹽水灌胃,每天1次,持續4 d;其中,LPS+TMZ+AC組在LPS注射前1 h腹腔注射Caspase-1抑制劑AC[溶解在DMSO中,再用磷酸鹽緩沖液(phosphate buffered saline,PBS)稀釋,DMSO終濃度<1.67%,劑量為6.5 mg/kg[15]];LPS+TMZ+AC溶劑組注射等量AC溶劑PBS。TMZ治療結束后,檢測各組小鼠體重、抓力、96 h存活率,腓腸肌MuRF1、Atrogin-1、Caspase-1、GSDMD的mRNA和蛋白表達,以及小鼠血清IL-1β和IL-18的濃度,腓腸肌進行HE染色觀察組織病理變化。
1.2.2 小鼠肌肉力量的檢測
按Witteveen等[16]的抓力檢測方法,從造模開始前1天至第14天,每天用無創小鼠抓力儀測量小鼠前肢肌肉抓力。每次測試前抓力儀調零。小鼠安靜狀態下,右手提小鼠尾巴,將小鼠的前肢放在抓力測試儀金屬網上,勻速向后拉動小鼠,使小鼠向后移動至金屬網最后一格,每次測量時當小鼠將爪子從網格上松開時,會收縮肢體,此時金屬板連接著的抓力儀主機顯示器將顯示當次小鼠抓力峰值。每次測量后給予小鼠充分休息,連續測量5次,去掉最大值、最小值,剩余3次結果取平均值,即為抓力值。所有測試由一人操作,以減少測量誤差。
1.2.3 血液及組織學標本的采集
每組小鼠在造模成功后第4天通過腹腔注射1%戊巴比妥鈉(50 mg/kg)進行麻醉,麻醉成功后,采用摘眼球取血法采集血液標本,靜置30 min以后,離心,分離血清,保存于–80℃冰箱,備后續檢測用。留取小鼠一側腓腸肌,將所取標本置入4%多聚甲醛溶液中24 h以上,另一側腓腸肌置于–80℃冰箱中保存待檢。
1.2.4 腓腸肌組織學檢查
HE染色:取固定后的小鼠腓腸肌標本,進行脫水、石蠟包埋,4 μm厚度切片,按照HE染色試劑盒操作說明書步驟進行HE染色,并在光學顯微鏡下觀察、拍照。
1.2.5 qPCR檢測mRNA表達
采用qPCR檢測腓腸肌中MuRF1、Atrogin-1、GSDMD、Casepase-1基因的表達(引物序列見表1)。采用Trizol法提取腓腸肌組織標本中的總RNA,離心、RNA洗滌、再溶解,測定總Caspase-1、GSDMD的RNA濃度及純度,最后進行引物設計及PCR反應。
1.2.6 蛋白免疫印跡(Western blot)測定蛋白的含量
采用Western blot檢測腓腸肌中MuRF1、Atrogin-1、GSDMD、Casepase-1蛋白的表達。裂解腓腸肌組織并提取總蛋白,采用BCA法進行蛋白定量,經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳、轉膜、封閉后,加入相應一抗,4℃孵育過夜,TBST漂洗3次后,加入相應二抗孵育1 h,TBST漂洗3次,洗膜后使用Millipore顯色試劑盒進行顯色,采用凝膠成像系統拍照。用Image J軟件對目的基因條帶灰度值進行統計分析。
1.2.7 ELISA試劑盒分別測定小鼠血清中IL-Iβ、IL-18的濃度
各炎癥指標的檢測操作均按相應ELISA試劑盒說明書步驟進行。
1.3 統計學方法
使用GraphPad Prism V5及SPSS 16.0軟件進行制圖及數據分析。符合正態分布的計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗;兩組間比較采用t檢驗;方差不齊時采用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 LPS腹腔注射成功構建ICU-AW小鼠模型
小鼠腹腔不同濃度LPS注射后,LPS(6 mg/kg)組、LPS(8 mg/kg)組、LPS(10 mg/kg)組在2周的觀察期內體重及抓力值無明顯變化(圖1a、b,P>0.05),而LPS(12 mg/kg)和LPS(14 mg/kg)組小鼠體重和抓力均呈先下降后逐漸升高趨勢(圖1a、b,P<0.05);組內分析發現,與第0天相比,LPS(12 mg/kg)和LPS(14 mg/kg)組小鼠均在3~5 d時體重和抓力最低(圖1a、b,P<0.05)。各組小鼠96 h存活率分析發現,LPS(12 mg/kg)和LPS(14 mg/kg)組小鼠存活率均顯著低于Normal組(圖1c,P<0.05),而LPS(14 mg/kg)組比LPS(12 mg/kg)組小鼠存活率更低(圖1c,P<0.05)。光鏡下,Normal組和Vehicle組小鼠腓腸肌肌束結構完整,肌纖維排列緊密,大小形態正常,未見細胞碎裂、溶解;而LPS(12 mg/kg)組出現肌肉萎縮、肌束結構破壞、細胞數量減少、肌纖維排列疏松(圖1d)。qPCR檢測發現,與Normal組及Vehicle組相比,LPS(12 mg/kg)組小鼠MuRF1(圖1e)、Atrogin-1(圖1f)表達均顯著升高(P<0.01),Western blot檢測結果與qPCR趨勢一致(圖1g,P<0.01)。
 圖1
LPS腹腔注射構建ICU-AW模型小鼠生理指標及骨骼肌變化比較
圖1
LPS腹腔注射構建ICU-AW模型小鼠生理指標及骨骼肌變化比較
a. 體重;b. 抓力;c. 存活率;d. 腓腸肌病理像(HE×200);e. 腓腸肌MuRF1的mRNA表達;f. 腓腸肌Atrogin-1的mRNA表達;g. 腓腸肌MuRF1和Atrogin-1的蛋白表達。與Normal組及Vehicle組比較,*
2.2 Caspase-1/GSDMD信號通路介導的細胞焦亡可能參與ICU-AW發病過程
各組小鼠腓腸肌qPCR結果提示,與Normal組及Vehicle組相比,LPS組Caspase-1(圖2a)和GSDMD(圖2b)的mRNA表達及蛋白表達量(圖2e)明顯升高(P<0.01)。ELISA結果顯示,與Normal組及Vehicle組相比,LPS組血清IL-1β(圖2c)和IL-18(圖2d)的濃度也明顯升高(P<0.01)。
 圖2
各組小鼠焦亡相關蛋白Caspase-1、GSDMD表達情況及血清IL-1β、IL-18濃度
圖2
各組小鼠焦亡相關蛋白Caspase-1、GSDMD表達情況及血清IL-1β、IL-18濃度
a. 腓腸肌Caspase-1 mRNA的表達;b. 腓腸肌GSDMD mRNA的表達;c. 血清IL-1β的濃度;d. 血清IL-18的濃度;e. 腓腸肌Caspase-1和GSDMD的蛋白表達。與Normal組及Vehicle組比較,**
2.3 TMZ可能對ICU-AW小鼠具有保護作用
在LPS造模的基礎上予以TMZ干預后,LPS+TMZ組體重及抓力均低于Normal組(圖3a、b,P<0.05),但高于LPS組及LPS+TMZ溶劑組(表2,圖3a、b,P<0.05);LPS+TMZ組小鼠存活率低于Normal組但高于LPS組及LPS+TMZ溶劑組(圖3c,P<0.05);LPS+TMZ組相比LPS組及LPS+TMZ溶劑組肌肉萎縮程度減輕、肌束結構破壞較少、細胞的數量增多(圖3d);qPCR檢測結果提示,與LPS組及LPS+TMZ溶劑組相比,LPS+TMZ組MuRF1(圖3e)、Atrogin-1(圖3f)表達均明顯降低(P<0.05);Western blot檢測結果與qPCR結果趨勢一致(圖3g,P<0.05)。
 圖3
TMZ干預后各組小鼠生理指標及骨骼肌變化
圖3
TMZ干預后各組小鼠生理指標及骨骼肌變化
a. 體重;b. 抓力;c. 存活率;d. 腓腸肌病理像(HE×200);e. 腓腸肌MuRF1的mRNA表達;f. 腓腸肌Atrogin-1的mRNA表達;g. 腓腸肌MuRF1和Atrogin-1的蛋白表達。與Normal組比較,*
2.4 TMZ的保護作用可能是通過抑制Caspase-1/GSDMD介導的細胞焦亡發揮作用
在LPS基礎上予以TMZ干預后,LPS組、LPS+TMZ溶劑組及LPS+TMZ組Caspase-1和GSDMD的mRNA表達均高于Normal組(圖4a、b,P<0.05),但TMZ組Caspase-1和GSDMD的mRNA表達低于LPS組及LPS+TMZ溶劑組(圖4a、b,P<0.05);進一步檢測血清中IL-1β、IL-18濃度及腓腸肌Caspase-1、GSDMD表達量,發現與qPCR趨勢一致(圖4c、d、e,P<0.05)。
 圖4
各組小鼠骨骼肌焦亡通路蛋白Caspase-1、GSDMD的表達量及血清IL-1β、IL-18濃度
圖4
各組小鼠骨骼肌焦亡通路蛋白Caspase-1、GSDMD的表達量及血清IL-1β、IL-18濃度
a. 腓腸肌Caspase-1 mRNA的表達;b. 腓腸肌GSDMD mRNA的表達;c. 血清IL-1β濃度;d. 血清IL-18濃度;e. 腓腸肌Caspase-1及GSDMD的Western blot結果。與Normal組比較,*
2.5 Caspase-1抑制劑AC能夠通過抑制Caspase-1/GSDMD介導的細胞焦亡增強TMZ的骨骼肌保護作用
在LPS+TMZ基礎上予以Caspase-1抑制劑AC干預后,與LPS+TMZ組及LPS+TMZ+AC溶劑組相比,LPS+TMZ+AC組小鼠體重、抓力明顯升高(表3,圖5a、b,P<0.05);LPS+TMZ+AC組96 h存活率明顯高于LPS+TMZ組及LPS+TMZ+AC溶劑組(圖5c,P<0.05);腓腸肌HE染色結果提示,與LPS+TMZ組及LPS+TMZ+AC溶劑組比較,LPS+TMZ+AC組肌肉萎縮程度減輕,肌束結構破壞較少,細胞的數量增多(圖5d);腓腸肌qPCR檢測結果提示,與LPS+TMZ組及LPS+TMZ+AC溶劑組比較,LPS+TMZ+AC組MuRF1(圖5e)、Atrogin-1(圖5f)、Caspase-1(圖5g)和GSDMD(圖5h)的mRNA表達均顯著降低(P<0.05);進一步檢測各組GSDMD、Caspase-1蛋白及血清中IL-1β、IL-18濃度,發現與qPCR趨勢一致(圖5i~k,P<0.05)。
 圖5
Caspase-1抑制劑AC與TMZ干預后各組小鼠生理指標及骨骼肌變化比較
圖5
Caspase-1抑制劑AC與TMZ干預后各組小鼠生理指標及骨骼肌變化比較
a. 體重;b. 抓力;c. 存活率;d. 腓腸肌病理像(HE×200);e. 腓腸肌MuRF1的mRNA表達;f. 腓腸肌Atrogin-1的mRNA表達;g. 腓腸肌Caspase-1的mRNA表達;h. 腓腸肌GSDMD的mRNA表達;i. 血清IL-1β的濃度;j. 血清IL-18的濃度;k. 腓腸肌MuRF1、Atrogin-1、Caspase-1、GSDMD的蛋白表達。與LPS+TMZ+AC溶劑組比較,@
3 討論
ICU-AW是危重癥患者的常見并發癥,可致機械通氣時間延長、ICU住院時間增加、病死率升高以及幸存者生活質量下降[17-18],但目前治療現狀并不滿意,主要原因在于發病機制尚不完全清楚、干預手段有限、缺乏特定藥物或靶向藥物進行治療[19-21]。因此,對ICU-AW發病機制及干預靶點進行深入研究對ICU-AW的防治具有重要意義。
目前,利用LPS腹腔注射構建ICU-AW模型是研究較多、較為成熟的造模方法[21-22]。但現有文獻中LPS造模濃度差異較大,本研究首先給小鼠腹腔注射不同濃度的LPS,綜合考慮存活率、炎癥程度、骨骼肌功能學和組織學等評價因素對最佳的LPS造模濃度進行了研究。結果發現采用12 mg/kg濃度的LPS腹腔注射造模穩定且小鼠存活率高,在96 h小鼠抓力和體重最低,外周血炎癥指標明顯升高,骨骼肌出現萎縮,因此將該濃度LPS干預96 h作為后續實驗的造模條件。
越來越多的研究表明,細胞焦亡參與諸多炎癥反應性疾病的發生發展[23-24],是導致肌肉萎縮的主要機制之一[25]。而GSDMD蛋白是細胞焦亡發生機制中的關鍵執行者,在細胞焦亡過程中發揮著重要作用。GSDMD在炎性Caspases-1介導下被切割為一個N端片段和C端片段,其中N端片段能在細胞膜上打孔并啟動細胞焦亡,進而促成成熟的IL-1β和IL-18釋放到胞外[26]。但Caspases-1/GSDMD介導的細胞焦亡在ICU-AW中的作用及調控機制尚不完全清楚。本研究通過腹腔注射LPS制備了ICU-AW小鼠模型,取材其骨骼肌組織進行qPCR、Western blot及病理檢測,收集外周血檢測炎癥因子濃度,發現細胞焦亡相關炎癥因子IL-1β和IL-18在血清中大量釋放,小鼠腓腸肌中Caspase-1、GSDMD基因和蛋白表達量均明顯高于對照組,提示Caspase-1/GSDMD信號通路介導的細胞焦亡可能參與了ICU-AW的發生發展。TMZ已被證實能通過抑制細胞焦亡發揮心肌保護作用[10],TMZ可減輕他汀類藥物相關的骨骼肌損傷[27],最新研究還發現TMZ通過抑制細胞焦亡改善地塞米松誘導的肌肉萎縮[11]。由此可見,TMZ和骨骼肌功能調控密切相關[11],但其在ICU-AW狀態下能否通過調控Caspase-1/GSDMD介導的細胞焦亡發揮骨骼肌保護作用尚無報道。本研究發現TMZ能夠改善LPS誘導的小鼠體重減輕和抓力降低,提高存活率,改善腓腸肌萎縮程度,降低萎縮蛋白MuRF1和Atrogin-1的表達,提示TMZ對ICU-AW具有保護作用。進一步檢測焦亡相關分子的表達,發現與對照組比較,TMZ組骨骼肌中Caspase-1、GSDMD基因和蛋白的表達明顯降低(P<0.05),血清中IL-18、IL-1β濃度也明顯降低(P<0.05),提示TMZ的保護作用可能是通過抑制Caspase-1/GSDMD信號通路發揮作用的。而利用Caspase-1抑制劑AC干預后,發現AC干預能夠增強TMZ的骨骼肌保護作用,則進一步證實了TMZ的保護作用依賴于Caspase-1/GSDMD信號通路。本研究首次明確了TMZ在ICU-AW中的作用及干預靶點,為TMZ拓寬適應證并應用于ICU-AW的臨床防治提供了理論參考依據。本研究的不足之處在于缺乏臨床試驗和細胞試驗的進一步驗證,我們將在下一步的研究中繼續探索,為TMZ應用于ICU-AW的防治提供更多參考依據。
綜上所述,本研究首次明確了TMZ對ICU-AW具有保護作用,且可能是通過抑制Caspase-1/GSDMD介導的細胞焦亡發揮作用,這對ICU-AW的防治具有重要參考價值。
利益沖突:本研究不涉及任何利益沖突。