引用本文: 朱鵬飛, 賴曉蓉, 熊沿, 肖祝. 蟛蜞菊內酯通過抑制AMPK/NLRP3/Caspase-1信號通路減輕脂多糖誘導的肺泡上皮細胞焦亡. 中國呼吸與危重監護雜志, 2024, 23(7): 488-494. doi: 10.7507/1671-6205.202402029 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
急性肺損傷是由多種致病因素導致的炎癥綜合征,主要表現為肺上皮細胞損傷,嚴重時可以引起細胞焦亡[1]。脂多糖(lipolyaccharide,LPS)作為革蘭陰性細菌細胞壁的主要成分,可以引起急性肺損傷,常被用于構建肺損傷模型[2]。蟛蜞菊內酯(wedelactone,WEL)是菊科植物墨旱蓮的主要成分之一,具有抗炎、抗氧化等作用。研究顯示,WEL可以通過激活腺苷酸活化蛋白激酶(adenylate activates protein kinase,AMPK)增加AMPK磷酸化水平,減少肺部炎癥細胞浸潤,減輕肺纖維化[3]。AMPK/核苷酸結合寡聚化結構域樣受體3(nucleotide-bound oligomerized domain-like receptor 3,NLRP3)/半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase-1,Caspase-1)信號通路是細胞焦亡經典通路。研究顯示達格列凈可激活AMPK,抑制NLRP3、Caspase-1活化,發揮抗炎、抗氧化、抗焦亡作用,改善急性肺損傷[4]。但是WEL是否可以通過AMPK/NLRP3/Caspase-1信號通路,減輕LPS誘導的肺泡上皮細胞焦亡還有待進一步研究。本研究探索WEL對LPS誘導的肺泡上皮細胞焦亡及AMPK/NLRP3/Caspase-1信號通路的影響,為肺損傷的治療提供參考。
1 材料與方法
1.1 主要材料
BEAS-2B細胞(Y-00805)購于上海酶研生物科技有限公司。LPS(L8880)購于上海恒斐生物科技有限公司。WEL(HPLC≥98%)購于上海吉至生化科技有限公司。AMPK抑制劑Compound C(HY-13418A)購于MCE公司。Caspase-1抑制劑Z-YVAD-FMK(HY-P1009)購于美國MedChemExpress公司。腫瘤壞死因子α(tumor necrosis factor-alpha,TNF-α)(PT518)、白細胞介素-1β(interleukin-1β,IL-1β)、白細胞介素-8(interleukin-8,IL-8)(PI640)酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)試劑盒購自上海碧云天生物技術有限公司;熒光標記的山羊抗兔lgG(ab150077)購于上海abcam公司;Gasdermin家族蛋白(gasdermin family proteins,DGSDMD)(sc-393581)購于Santa Cruz Biotechnology公司;AMPK(ab32047)、NLRP3(ab263899)、Caspase-1(ab62698)單抗購于上海Abcam公司;GAPDH單抗(5174)購于美國Cell Signaling Technology公司。
1.2 方法
1.2.1 MTT法檢測細胞活性
在37℃、5% CO2培養箱中用含10%磷酸鹽緩沖液(phosphate buffered saline,PBS)的DMEM培養基培養BEAS-2B細胞,至細胞生長到對數期,用不同濃度的WEL處理BEAS-2B細胞,并將細胞置于37℃ 5% CO2培養箱培養2天,離心去上清,加入20 μL 5 g/L MTT溶液,37℃恒溫培養箱培養4 h,離心去上清,加入100 μL DMSO,渦旋振蕩,酶標儀測OD值。
1.2.2 細胞分組及處理
將肺泡上皮細胞BEAS-2B分為對照組、脂多糖組(LPS組)、10 μmol/L蟛蜞菊內酯組(WEL-L組)、20 μmol/L蟛蜞菊內酯組(WEL-M組)、40 μmol/L蟛蜞菊內酯組(WEL-H組)、40 μmol/L蟛蜞菊內酯+10 μmol/L AMPK抑制劑Compound C組(WEL-H+Compound C組)、20 μmol/L Caspase-1抑制劑Z-YVAD-FMK組(Z-YVAD-FMK組)。對照組細胞不做任何處理;LPS組細胞用濃度為10 μg/mL LPS處理24 h[5];WEL-L組、WEL-M組和WEL-H組細胞用濃度為10 μg/mL LPS及分別用10 μmol/L、20 μmol/L、40 μmol/L的WEL共培養處理24 h;WEL-H+Compound C組細胞用10 μg/mL LPS、40 μmol/L的WEL、10 μmol/L AMPK抑制劑Compound C[6]共培養處理24 h;Z-YVAD-FMK組細胞用10 μg/mL LPS、20 μmol/L Caspase-1抑制劑Z-YVAD-FMK[7]共培養處理24 h。
1.2.3 ELISA檢測炎癥因子
收集1.2.2制備的各組細胞培養基上清液,ELISA試劑盒檢測TNF-α、IL-1β、IL-8水平。
1.2.4 細胞顯微結構觀察細胞超微結構
取1.2.2制備的各組細胞用胰酶消化后將細胞懸液移入離心管,離心棄上清,加入1 mL 2.5%戊二醛溶液固定細胞,制作電鏡切片,用透射電鏡觀察各組細胞超微結構。
1.2.5 免疫熒光檢測Caspase-1、DGSDMD蛋白表達
取含1.2.2各組細胞玻片放置在24孔板,每孔2×105個細胞,4%多聚甲醛室溫固定20 min,0.5% Triton X-100 4℃透膜5 min,含5% BSA的PBS室溫封閉1 h,分別加入一抗Caspase-1、GSDMD 4℃孵育過夜,再加入二抗山羊抗兔lgG(H+L)37℃孵育1 h。PI染核5 min,封片,熒光顯微鏡下觀察并拍照,Image J軟件分析蛋白熒光強度。
1.2.6 Western blot法檢測AMPK、NLRP3、Caspase-1表達
取1.2.2制備的各組細胞加入RIPA細胞裂解液裂解蛋白,電泳分離,轉膜封閉。隨后加入一抗4℃孵育過夜,二抗室溫孵育,ECL曝光,Image J軟件分析條帶灰度值。
1.3 統計學方法
采用SPSS 25.0進行統計分析,呈正態分布的計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 WEL對BEAS-2B細胞活性的影響
與對照組相比,100 μmol/L及200 μmol/L的WEL處理后細胞活性顯著下降(P<0.05),而40 μmol/L及以下濃度的WEL對細胞活性無明顯影響(P>0.05),結果見表1。因此,選擇10、20、40 μmol/L的WEL不影響細胞活性的濃度進行后續實驗。
2.2 WEL對LPS誘導的BEAS-2B細胞活性的影響
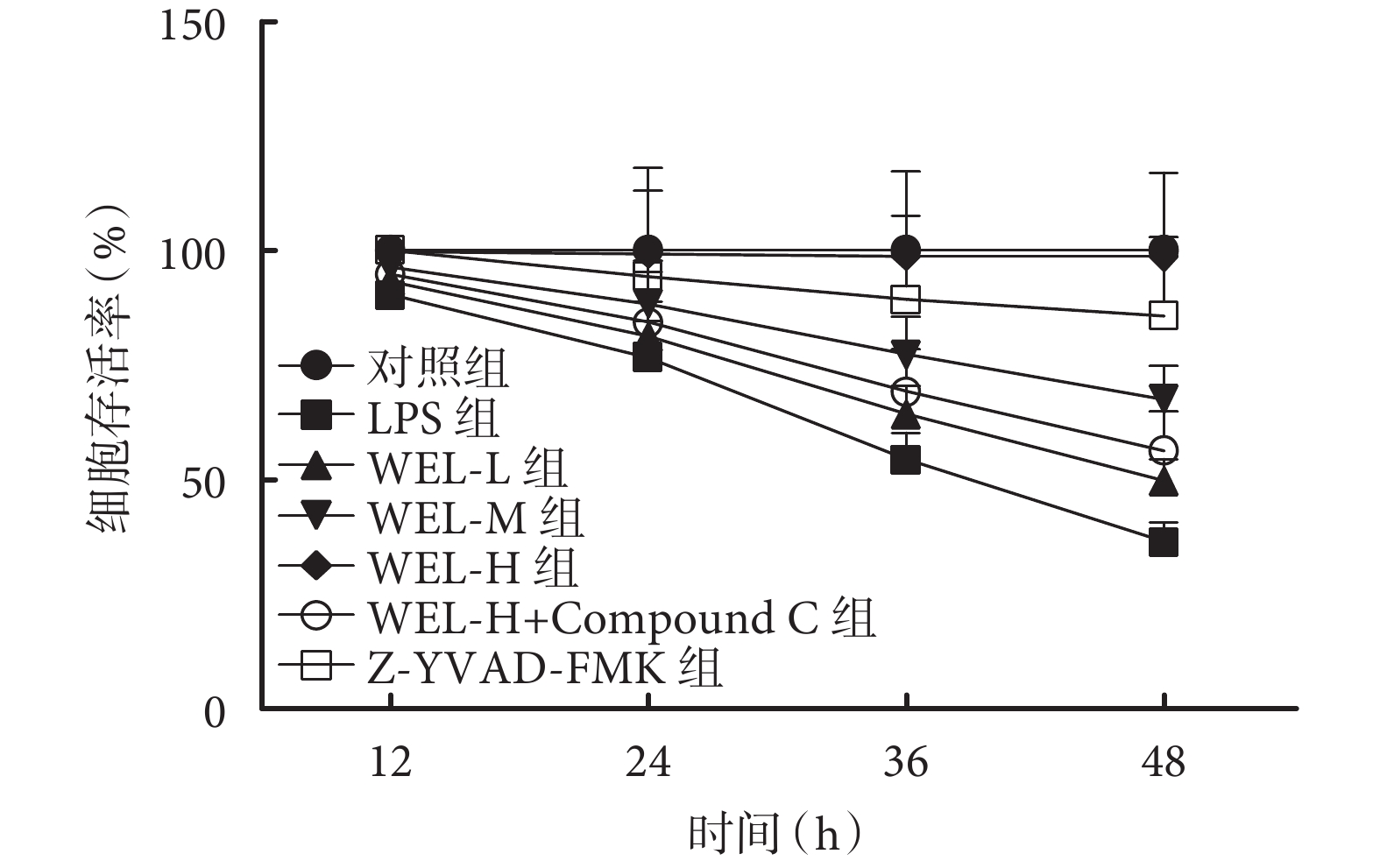
隨著時間推移,除對照組,其余各組細胞存活率逐漸降低;與對照組相比,LPS組BEAS-2B細胞存活率顯著降低(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組BEAS-2B細胞存活率依次顯著升高,Z-YVAD-FMK組細胞存活率顯著升高(P<0.05);與WEL-H組相比,WEL-H+Compound C組細胞存活率顯著降低(P<0.05)。結果見圖1、表2。
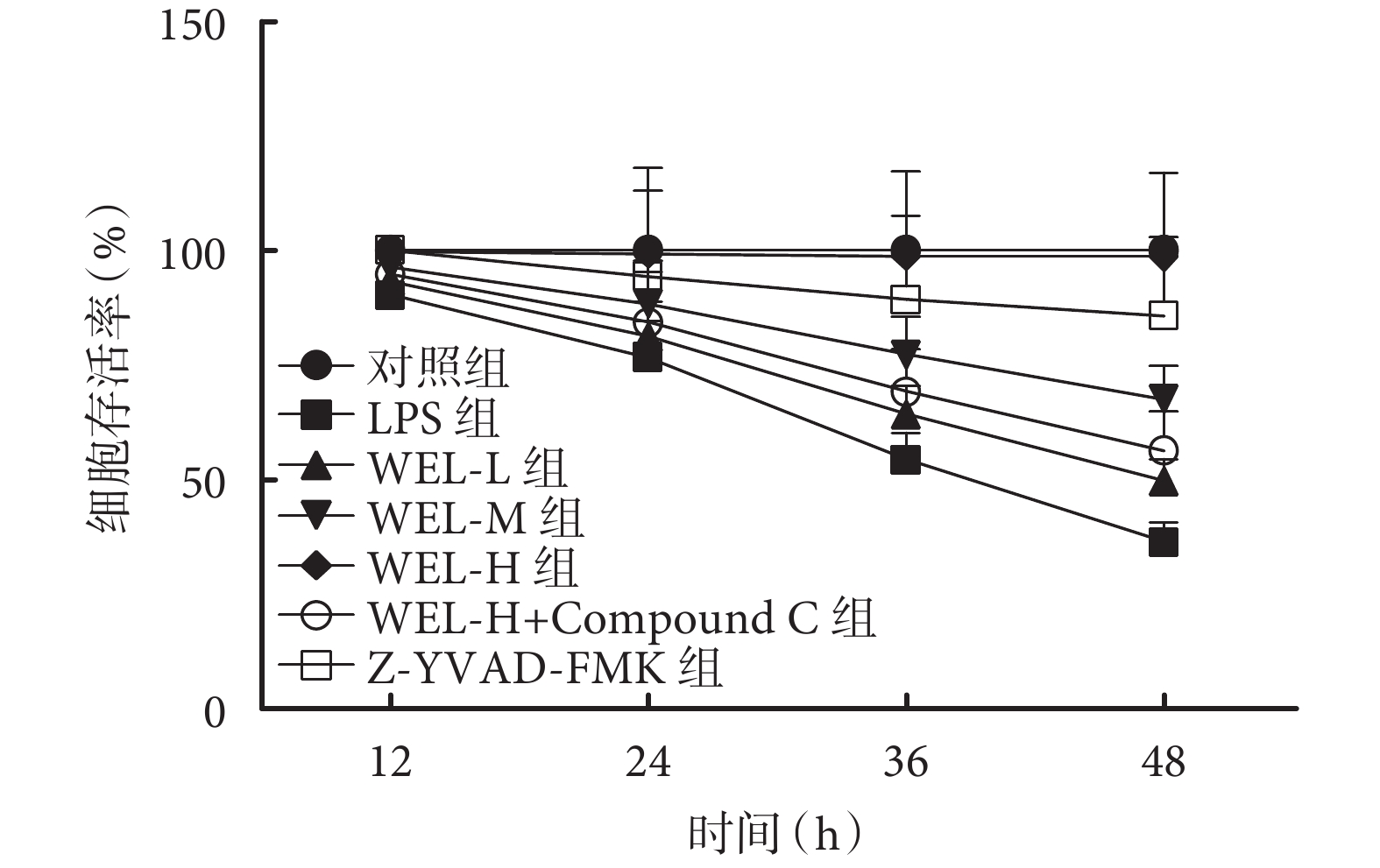 圖1
各組細胞存活率比較
圖1
各組細胞存活率比較
2.3 WEL對LPS誘導的BEAS-2B細胞顯微結構的影響
對照組細胞內質網和線粒體形態飽滿;與對照組相比,LPS組細胞損傷嚴重,線粒體嵴斷裂且數量減少;與LPS組相比,WEL-L組、WEL-M組、WEL-H組細胞損傷依次減輕,內質網和線粒體嵴逐漸正常完整,Z-YVAD-FMK組細胞損傷不明顯,內質網與線粒體完整正常;與WEL-H組相比,WEL-H+Compound C組細胞損傷嚴重,線粒體嵴斷裂且數量減少。結果見圖2。
 圖2
各組細胞透射電鏡像(×50 000)
圖2
各組細胞透射電鏡像(×50 000)
a. 對照組;b. LPS組;c. WEL-L組;d. WEL-M組;e. WEL-H組;f. WEL-H+Compound C組;g. Z-YVAD-FMK組。
2.4 WEL對LPS誘導的BEAS-2B細胞TNF-α、IL-1β、IL-8水平的影響
與對照組相比,LPS組TNF-α、IL-1β、IL-8水平顯著上升(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組TNF-α、IL-1β、IL-8水平依次顯著下降,Z-YVAD-FMK組TNF-α、IL-1β、IL-8水平顯著下降(P<0.05);與WEL-H組相比,WEL-H+Compound C組TNF-α、IL-1β、IL-8水平顯著上升(P<0.05)。結果見表3。
2.5 WEL對LPS誘導的BEAS-2B細胞焦亡相關基因Caspase-1、GSDMD的影響
如圖3所示,Caspase-1、GSDMD染色呈紅色,DAPI染色呈藍色。與對照組相比,LPS組Caspase-1、GSDMD水平上升(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組Caspase-1、GSDMD水平依次顯著下降,Z-YVAD-FMK組Caspase-1、GSDMD水平顯著下降(P<0.05);與WEL-H組相比,WEL-H+Compound C組Caspase-1、GSDMD水平顯著上升(P<0.05)。結果見表4。
 圖3
免疫熒光觀察各組細胞Caspase-1、GSDMD蛋白表達(×1 000)
圖3
免疫熒光觀察各組細胞Caspase-1、GSDMD蛋白表達(×1 000)
2.6 WEL對AMPK/NLRP3/Caspase-1信號通路的影響
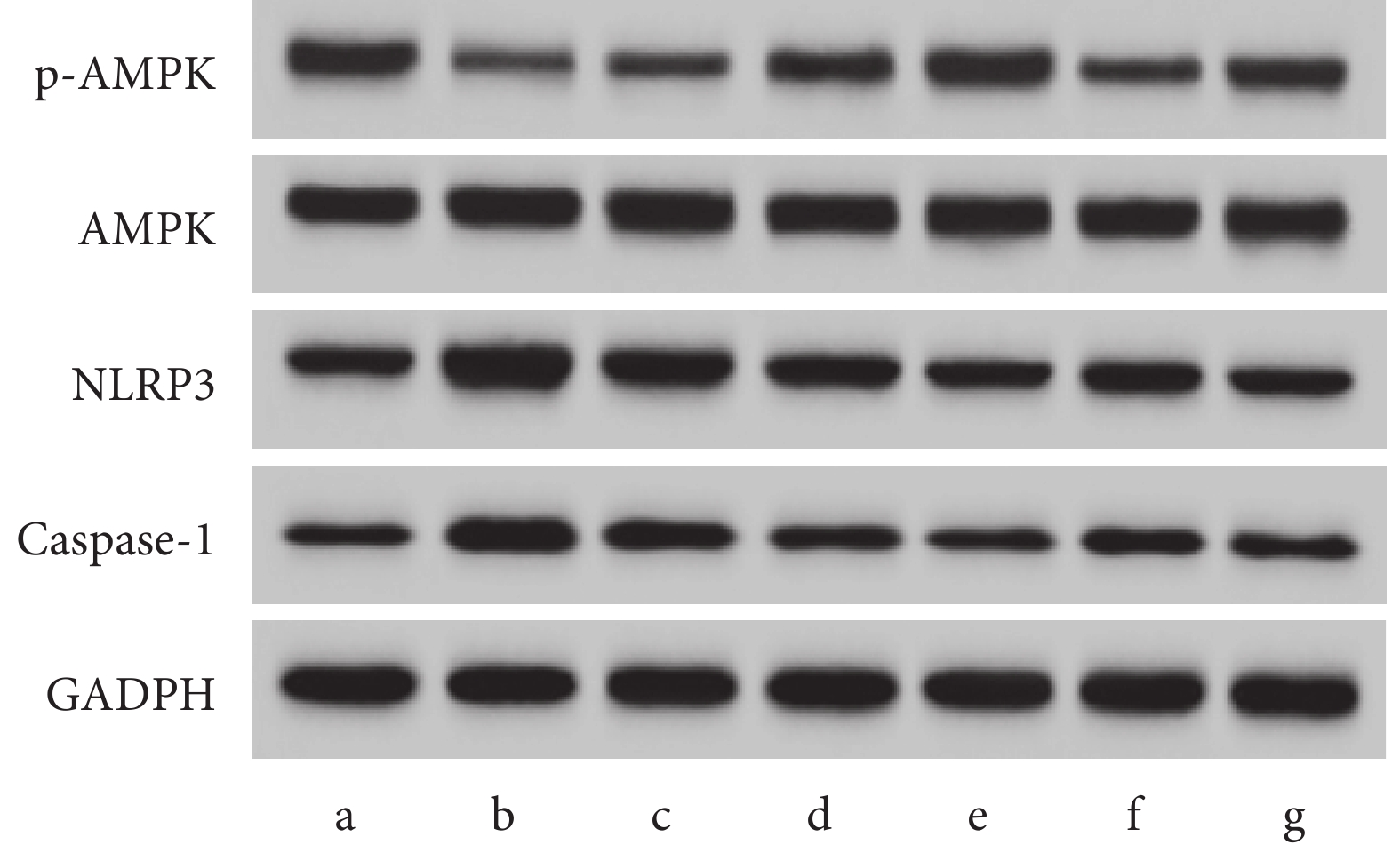
與對照組相比,LPS組p-AMPK/AMPK下降,NLRP3、Caspase-1蛋白表達上升(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組p-AMPK/AMPK上升,NLRP3、Caspase-1蛋白表達依次下降,Z-YVAD-FMK組p-AMPK/AMPK表達上升,NLRP3、Caspase-1蛋白表達下降(P<0.05);與WEL-H組相比,WEL-H+Compound C組p-AMPK/AMPK下降,NLRP3、Caspase-1蛋白表達上升(P<0.05)。結果見圖4和表5。
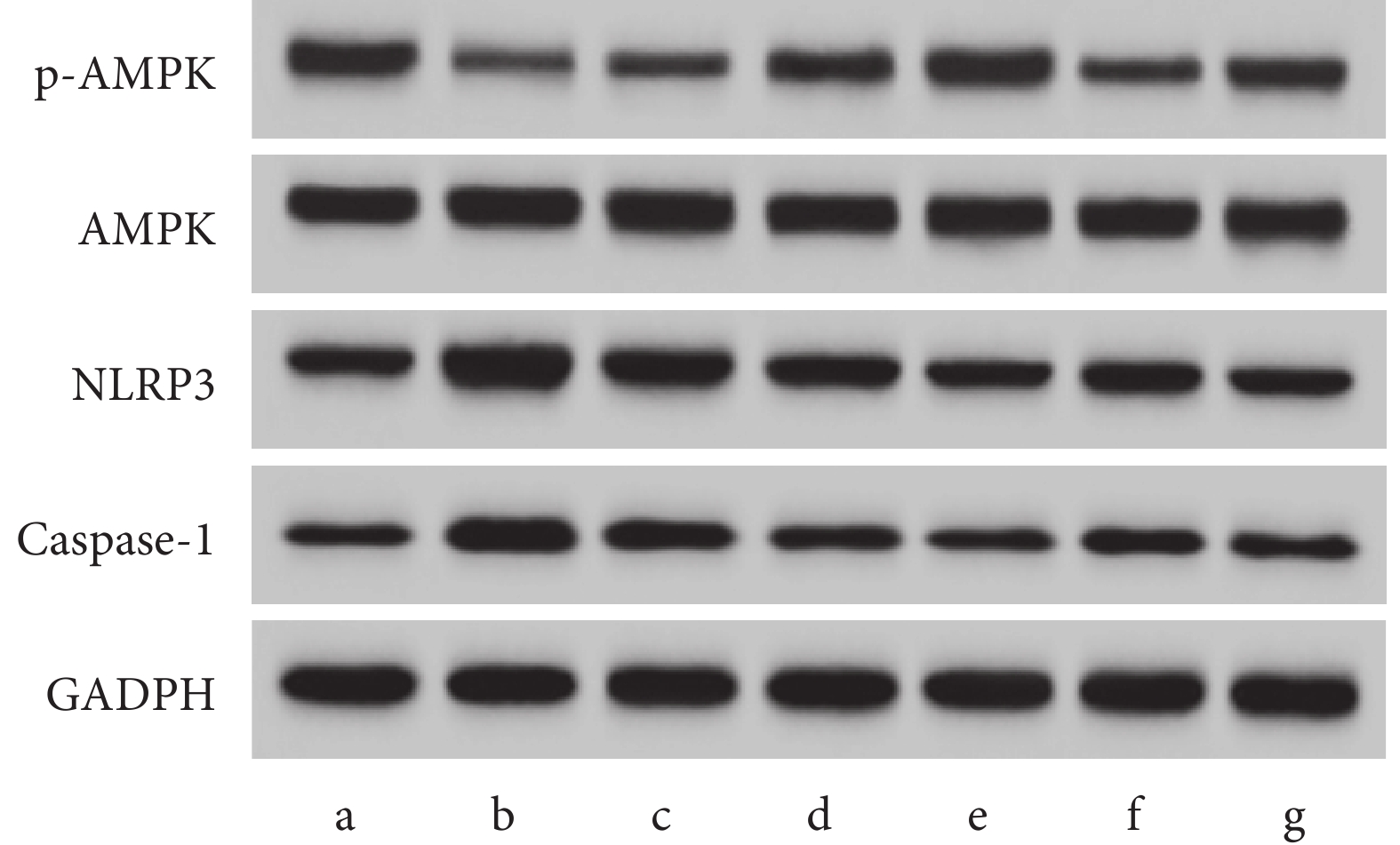 圖4
Western blot檢測AMPK/NLRP3/Caspase-1通路相關蛋白表達
圖4
Western blot檢測AMPK/NLRP3/Caspase-1通路相關蛋白表達
a. 對照組;b. LPS組;c. WEL-L組;d. WEL-M組;e. WEL-H組;f. WEL-H+Compound C組;g. Z-YVAD-FMK組。
3 討論
炎癥反應是肺損傷的主要標志,而TNF-α、IL-1β、IL-8等炎癥因子在細胞的炎癥反應中發揮重要作用。LPS作為感染疾病中的主要促炎因子之一,過量時會促進TNF-α、IL-1β、IL-8等相關炎癥細胞因子大量分泌和釋放,導致肺血管內皮細胞和肺泡上皮細胞過度炎癥損傷,甚至細胞焦亡,從而造成肺功能損傷[8]。WEL具有抗炎、抗氧化、抗凋亡等作用,在肺損傷的治療中發揮重要作用[9]。研究發現WEL可通過調控鐵死亡抑制TNF-α、IL-1β水平,從而減輕高氧性急性肺損傷[10]。WEL可以抑制炎癥小體活化,減輕急性胰腺炎和相關肺損傷[11]。本研究顯示WEL可以減輕LPS誘導的肺泡上皮細胞炎癥,降低TNF-α、IL-1β、IL-8水平,抑制細胞死亡。
細胞焦亡是細胞死亡的一種,適當的焦亡可以使宿主對感染病起到防御作用,過度焦亡可以危害宿主。細胞焦亡是一種炎性半胱氨酸蛋白酶依賴性的細胞程序性死亡,與多種炎癥性疾病相關。當細胞受到傷害刺激,形成含NLR的炎癥小體,其中NLRP3最具有代表性,然后與凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein containing CARD,ASC)結合,形成炎癥小體復合物,激活多種Caspase如Caspase-1,從而造成多種GSDMD蛋白家族成員發生剪切和多聚化,釋放大量促炎癥因子TNF-α、IL-1β、IL-8等,造成細胞穿孔死亡,最終焦亡[12-13]。研究顯示Caspase-1、NLRP3、GSDMD焦亡相關因子的缺失可以減輕炎癥反應,降低胰腺炎引起的焦亡[14]。電針可抑制NLRP3、ASC、cleaved-Caspase-1、GSDMD-N蛋白表達及IL-1β、IL-8水平,減輕大鼠膿毒癥急性肺損傷[15]。本研究顯示WEL可以抑制Caspase-1、GSDMD水平,從而減輕細胞焦亡。
AMPK/NLRP3/Caspase-1信號通路作為經典細胞焦亡通路,在細胞炎癥反應及焦亡過程中發揮重要作用。當機體遭到損傷時,可激活NLRs和Caspase-1,促進下游相關因子的表達,進而增加炎癥因子的釋放,加劇炎癥反應,促進細胞的焦亡。而降低NLRP3、Caspase-1水平和炎癥因子TNF-α、IL-6、IL-8釋放,可以抑制細胞焦亡,減輕炎癥,從而起到保護作用[16]。AMPK作為真核細胞的能量感受器,能夠協調包括自噬、凋亡、細胞周期和蛋白質合成在內的一系列細胞過程,與人類疾病的發生發展密切相關,其可以抑制NLRP3介導的細胞焦亡,從而保護肺損傷[17]。本研究顯示WEL可以上調AMPK,下調NLRP3、Caspase-1表達,AMPK抑制劑可以逆轉AMPK對LPS誘導的肺上皮細胞焦亡的抑制作用,WEL與Caspase-1抑制劑均可以降低細胞的炎癥水平,抑制細胞焦亡。說明WEL通過增加AMPK磷酸化,可抑制NLRP3,可抑制Caspase-1表達,從而抑制細胞焦亡。
綜上所述,WEL可以通過抑制AMPK/NLRP3/Caspase-1信號通路,從而抑制LPS誘導的肺泡上皮細胞焦亡。但是WEL調控AMPK/NLRP3/Caspase-1信號通路的作用機制仍需結合動物模型進一步研究。
利益沖突:本研究不涉及任何利益沖突。
急性肺損傷是由多種致病因素導致的炎癥綜合征,主要表現為肺上皮細胞損傷,嚴重時可以引起細胞焦亡[1]。脂多糖(lipolyaccharide,LPS)作為革蘭陰性細菌細胞壁的主要成分,可以引起急性肺損傷,常被用于構建肺損傷模型[2]。蟛蜞菊內酯(wedelactone,WEL)是菊科植物墨旱蓮的主要成分之一,具有抗炎、抗氧化等作用。研究顯示,WEL可以通過激活腺苷酸活化蛋白激酶(adenylate activates protein kinase,AMPK)增加AMPK磷酸化水平,減少肺部炎癥細胞浸潤,減輕肺纖維化[3]。AMPK/核苷酸結合寡聚化結構域樣受體3(nucleotide-bound oligomerized domain-like receptor 3,NLRP3)/半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase-1,Caspase-1)信號通路是細胞焦亡經典通路。研究顯示達格列凈可激活AMPK,抑制NLRP3、Caspase-1活化,發揮抗炎、抗氧化、抗焦亡作用,改善急性肺損傷[4]。但是WEL是否可以通過AMPK/NLRP3/Caspase-1信號通路,減輕LPS誘導的肺泡上皮細胞焦亡還有待進一步研究。本研究探索WEL對LPS誘導的肺泡上皮細胞焦亡及AMPK/NLRP3/Caspase-1信號通路的影響,為肺損傷的治療提供參考。
1 材料與方法
1.1 主要材料
BEAS-2B細胞(Y-00805)購于上海酶研生物科技有限公司。LPS(L8880)購于上海恒斐生物科技有限公司。WEL(HPLC≥98%)購于上海吉至生化科技有限公司。AMPK抑制劑Compound C(HY-13418A)購于MCE公司。Caspase-1抑制劑Z-YVAD-FMK(HY-P1009)購于美國MedChemExpress公司。腫瘤壞死因子α(tumor necrosis factor-alpha,TNF-α)(PT518)、白細胞介素-1β(interleukin-1β,IL-1β)、白細胞介素-8(interleukin-8,IL-8)(PI640)酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)試劑盒購自上海碧云天生物技術有限公司;熒光標記的山羊抗兔lgG(ab150077)購于上海abcam公司;Gasdermin家族蛋白(gasdermin family proteins,DGSDMD)(sc-393581)購于Santa Cruz Biotechnology公司;AMPK(ab32047)、NLRP3(ab263899)、Caspase-1(ab62698)單抗購于上海Abcam公司;GAPDH單抗(5174)購于美國Cell Signaling Technology公司。
1.2 方法
1.2.1 MTT法檢測細胞活性
在37℃、5% CO2培養箱中用含10%磷酸鹽緩沖液(phosphate buffered saline,PBS)的DMEM培養基培養BEAS-2B細胞,至細胞生長到對數期,用不同濃度的WEL處理BEAS-2B細胞,并將細胞置于37℃ 5% CO2培養箱培養2天,離心去上清,加入20 μL 5 g/L MTT溶液,37℃恒溫培養箱培養4 h,離心去上清,加入100 μL DMSO,渦旋振蕩,酶標儀測OD值。
1.2.2 細胞分組及處理
將肺泡上皮細胞BEAS-2B分為對照組、脂多糖組(LPS組)、10 μmol/L蟛蜞菊內酯組(WEL-L組)、20 μmol/L蟛蜞菊內酯組(WEL-M組)、40 μmol/L蟛蜞菊內酯組(WEL-H組)、40 μmol/L蟛蜞菊內酯+10 μmol/L AMPK抑制劑Compound C組(WEL-H+Compound C組)、20 μmol/L Caspase-1抑制劑Z-YVAD-FMK組(Z-YVAD-FMK組)。對照組細胞不做任何處理;LPS組細胞用濃度為10 μg/mL LPS處理24 h[5];WEL-L組、WEL-M組和WEL-H組細胞用濃度為10 μg/mL LPS及分別用10 μmol/L、20 μmol/L、40 μmol/L的WEL共培養處理24 h;WEL-H+Compound C組細胞用10 μg/mL LPS、40 μmol/L的WEL、10 μmol/L AMPK抑制劑Compound C[6]共培養處理24 h;Z-YVAD-FMK組細胞用10 μg/mL LPS、20 μmol/L Caspase-1抑制劑Z-YVAD-FMK[7]共培養處理24 h。
1.2.3 ELISA檢測炎癥因子
收集1.2.2制備的各組細胞培養基上清液,ELISA試劑盒檢測TNF-α、IL-1β、IL-8水平。
1.2.4 細胞顯微結構觀察細胞超微結構
取1.2.2制備的各組細胞用胰酶消化后將細胞懸液移入離心管,離心棄上清,加入1 mL 2.5%戊二醛溶液固定細胞,制作電鏡切片,用透射電鏡觀察各組細胞超微結構。
1.2.5 免疫熒光檢測Caspase-1、DGSDMD蛋白表達
取含1.2.2各組細胞玻片放置在24孔板,每孔2×105個細胞,4%多聚甲醛室溫固定20 min,0.5% Triton X-100 4℃透膜5 min,含5% BSA的PBS室溫封閉1 h,分別加入一抗Caspase-1、GSDMD 4℃孵育過夜,再加入二抗山羊抗兔lgG(H+L)37℃孵育1 h。PI染核5 min,封片,熒光顯微鏡下觀察并拍照,Image J軟件分析蛋白熒光強度。
1.2.6 Western blot法檢測AMPK、NLRP3、Caspase-1表達
取1.2.2制備的各組細胞加入RIPA細胞裂解液裂解蛋白,電泳分離,轉膜封閉。隨后加入一抗4℃孵育過夜,二抗室溫孵育,ECL曝光,Image J軟件分析條帶灰度值。
1.3 統計學方法
采用SPSS 25.0進行統計分析,呈正態分布的計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 WEL對BEAS-2B細胞活性的影響
與對照組相比,100 μmol/L及200 μmol/L的WEL處理后細胞活性顯著下降(P<0.05),而40 μmol/L及以下濃度的WEL對細胞活性無明顯影響(P>0.05),結果見表1。因此,選擇10、20、40 μmol/L的WEL不影響細胞活性的濃度進行后續實驗。
2.2 WEL對LPS誘導的BEAS-2B細胞活性的影響
隨著時間推移,除對照組,其余各組細胞存活率逐漸降低;與對照組相比,LPS組BEAS-2B細胞存活率顯著降低(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組BEAS-2B細胞存活率依次顯著升高,Z-YVAD-FMK組細胞存活率顯著升高(P<0.05);與WEL-H組相比,WEL-H+Compound C組細胞存活率顯著降低(P<0.05)。結果見圖1、表2。
 圖1
各組細胞存活率比較
圖1
各組細胞存活率比較
2.3 WEL對LPS誘導的BEAS-2B細胞顯微結構的影響
對照組細胞內質網和線粒體形態飽滿;與對照組相比,LPS組細胞損傷嚴重,線粒體嵴斷裂且數量減少;與LPS組相比,WEL-L組、WEL-M組、WEL-H組細胞損傷依次減輕,內質網和線粒體嵴逐漸正常完整,Z-YVAD-FMK組細胞損傷不明顯,內質網與線粒體完整正常;與WEL-H組相比,WEL-H+Compound C組細胞損傷嚴重,線粒體嵴斷裂且數量減少。結果見圖2。
 圖2
各組細胞透射電鏡像(×50 000)
圖2
各組細胞透射電鏡像(×50 000)
a. 對照組;b. LPS組;c. WEL-L組;d. WEL-M組;e. WEL-H組;f. WEL-H+Compound C組;g. Z-YVAD-FMK組。
2.4 WEL對LPS誘導的BEAS-2B細胞TNF-α、IL-1β、IL-8水平的影響
與對照組相比,LPS組TNF-α、IL-1β、IL-8水平顯著上升(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組TNF-α、IL-1β、IL-8水平依次顯著下降,Z-YVAD-FMK組TNF-α、IL-1β、IL-8水平顯著下降(P<0.05);與WEL-H組相比,WEL-H+Compound C組TNF-α、IL-1β、IL-8水平顯著上升(P<0.05)。結果見表3。
2.5 WEL對LPS誘導的BEAS-2B細胞焦亡相關基因Caspase-1、GSDMD的影響
如圖3所示,Caspase-1、GSDMD染色呈紅色,DAPI染色呈藍色。與對照組相比,LPS組Caspase-1、GSDMD水平上升(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組Caspase-1、GSDMD水平依次顯著下降,Z-YVAD-FMK組Caspase-1、GSDMD水平顯著下降(P<0.05);與WEL-H組相比,WEL-H+Compound C組Caspase-1、GSDMD水平顯著上升(P<0.05)。結果見表4。
 圖3
免疫熒光觀察各組細胞Caspase-1、GSDMD蛋白表達(×1 000)
圖3
免疫熒光觀察各組細胞Caspase-1、GSDMD蛋白表達(×1 000)
2.6 WEL對AMPK/NLRP3/Caspase-1信號通路的影響
與對照組相比,LPS組p-AMPK/AMPK下降,NLRP3、Caspase-1蛋白表達上升(P<0.05);與LPS組相比,WEL-L組、WEL-M組、WEL-H組p-AMPK/AMPK上升,NLRP3、Caspase-1蛋白表達依次下降,Z-YVAD-FMK組p-AMPK/AMPK表達上升,NLRP3、Caspase-1蛋白表達下降(P<0.05);與WEL-H組相比,WEL-H+Compound C組p-AMPK/AMPK下降,NLRP3、Caspase-1蛋白表達上升(P<0.05)。結果見圖4和表5。
 圖4
Western blot檢測AMPK/NLRP3/Caspase-1通路相關蛋白表達
圖4
Western blot檢測AMPK/NLRP3/Caspase-1通路相關蛋白表達
a. 對照組;b. LPS組;c. WEL-L組;d. WEL-M組;e. WEL-H組;f. WEL-H+Compound C組;g. Z-YVAD-FMK組。
3 討論
炎癥反應是肺損傷的主要標志,而TNF-α、IL-1β、IL-8等炎癥因子在細胞的炎癥反應中發揮重要作用。LPS作為感染疾病中的主要促炎因子之一,過量時會促進TNF-α、IL-1β、IL-8等相關炎癥細胞因子大量分泌和釋放,導致肺血管內皮細胞和肺泡上皮細胞過度炎癥損傷,甚至細胞焦亡,從而造成肺功能損傷[8]。WEL具有抗炎、抗氧化、抗凋亡等作用,在肺損傷的治療中發揮重要作用[9]。研究發現WEL可通過調控鐵死亡抑制TNF-α、IL-1β水平,從而減輕高氧性急性肺損傷[10]。WEL可以抑制炎癥小體活化,減輕急性胰腺炎和相關肺損傷[11]。本研究顯示WEL可以減輕LPS誘導的肺泡上皮細胞炎癥,降低TNF-α、IL-1β、IL-8水平,抑制細胞死亡。
細胞焦亡是細胞死亡的一種,適當的焦亡可以使宿主對感染病起到防御作用,過度焦亡可以危害宿主。細胞焦亡是一種炎性半胱氨酸蛋白酶依賴性的細胞程序性死亡,與多種炎癥性疾病相關。當細胞受到傷害刺激,形成含NLR的炎癥小體,其中NLRP3最具有代表性,然后與凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein containing CARD,ASC)結合,形成炎癥小體復合物,激活多種Caspase如Caspase-1,從而造成多種GSDMD蛋白家族成員發生剪切和多聚化,釋放大量促炎癥因子TNF-α、IL-1β、IL-8等,造成細胞穿孔死亡,最終焦亡[12-13]。研究顯示Caspase-1、NLRP3、GSDMD焦亡相關因子的缺失可以減輕炎癥反應,降低胰腺炎引起的焦亡[14]。電針可抑制NLRP3、ASC、cleaved-Caspase-1、GSDMD-N蛋白表達及IL-1β、IL-8水平,減輕大鼠膿毒癥急性肺損傷[15]。本研究顯示WEL可以抑制Caspase-1、GSDMD水平,從而減輕細胞焦亡。
AMPK/NLRP3/Caspase-1信號通路作為經典細胞焦亡通路,在細胞炎癥反應及焦亡過程中發揮重要作用。當機體遭到損傷時,可激活NLRs和Caspase-1,促進下游相關因子的表達,進而增加炎癥因子的釋放,加劇炎癥反應,促進細胞的焦亡。而降低NLRP3、Caspase-1水平和炎癥因子TNF-α、IL-6、IL-8釋放,可以抑制細胞焦亡,減輕炎癥,從而起到保護作用[16]。AMPK作為真核細胞的能量感受器,能夠協調包括自噬、凋亡、細胞周期和蛋白質合成在內的一系列細胞過程,與人類疾病的發生發展密切相關,其可以抑制NLRP3介導的細胞焦亡,從而保護肺損傷[17]。本研究顯示WEL可以上調AMPK,下調NLRP3、Caspase-1表達,AMPK抑制劑可以逆轉AMPK對LPS誘導的肺上皮細胞焦亡的抑制作用,WEL與Caspase-1抑制劑均可以降低細胞的炎癥水平,抑制細胞焦亡。說明WEL通過增加AMPK磷酸化,可抑制NLRP3,可抑制Caspase-1表達,從而抑制細胞焦亡。
綜上所述,WEL可以通過抑制AMPK/NLRP3/Caspase-1信號通路,從而抑制LPS誘導的肺泡上皮細胞焦亡。但是WEL調控AMPK/NLRP3/Caspase-1信號通路的作用機制仍需結合動物模型進一步研究。
利益沖突:本研究不涉及任何利益沖突。