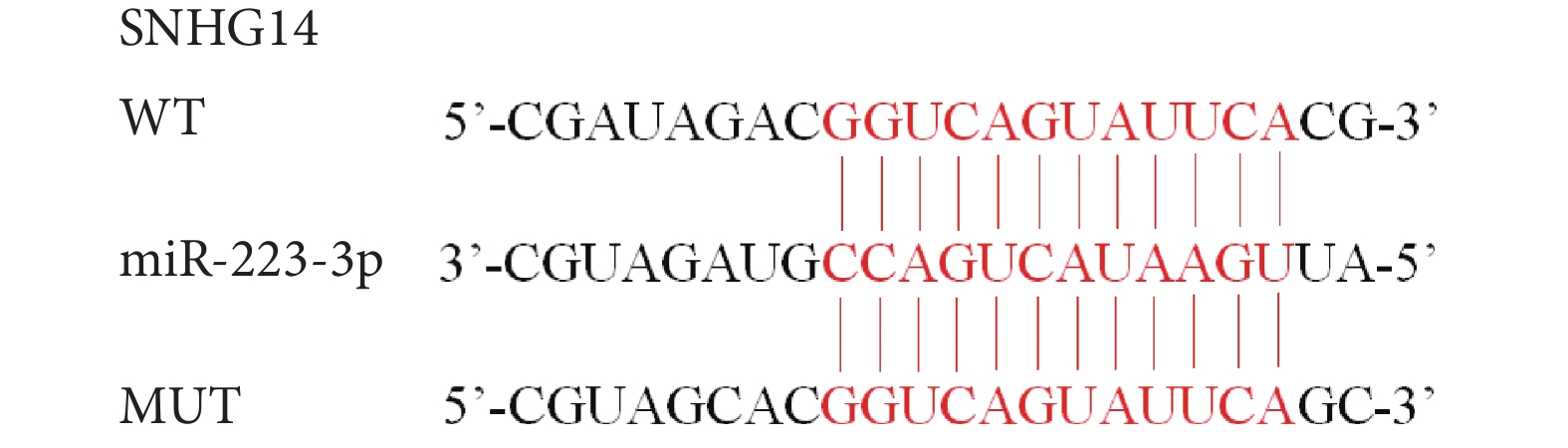引用本文: 李瑩, 肖文彪, 林曉. LncRNA SNHG14調控miR-223-3p減輕大鼠膿毒癥相關性肺損傷的機制探討. 中國呼吸與危重監護雜志, 2025, 24(1): 18-25. doi: 10.7507/1671-6205.202405026 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
膿毒癥是一種炎癥反應失調引起的器官功能障礙綜合征,可發展為嚴重膿毒癥與膿毒性休克,致死率高。膿毒癥相關性肺損傷是膿毒癥常見的并發癥,調查發現在膿毒癥中肺損傷發生率約40.2%,病死率30%~85%[1],提示膿毒癥患者肺損傷發生及相關死亡風險均處于高水平。目前臨床上對于膿毒癥相關性肺損傷多采用基礎支持治療,但收效并不理想[2]。多種長鏈非編碼核糖核酸(long chain non-coding ribonucleic acid,LncRNA)與微小核糖核酸(microribonucleic acid,miR)被發現參與膿毒癥的發生與進展,且調控其表達可控制病情及相關靶器官損害,與抑制炎癥反應有緊密關系[3-5]。研究發現LncRNA核內小RNA宿主基因14(long chain non coding ribonucleic acid small nucleolar RNA host gene 14,LncRNA SNHG14)可參與氧-糖剝奪/復氧誘導的神經細胞損傷,與炎癥反應調控密切相關[6];在膿毒癥中miR-223-3p表達下降,并能負反饋調控人NOD樣受體家族蛋白3(NOD like receptor family protein 3,NLPR3)通路、增加NLPR3、胱天蛋白酶半胱氨酸天冬氨酸蛋白酶1(Cysteine-requiring aspartate protease 1,Caspase-1)、1-氨基環丙烷-1-羧酸合酶(1-aminocyclopropane-1-carboxylate synthase,ACS)表達,參與炎癥因子的剪切活化,引起肺損傷[7]。Hong等[8]研究發現LncRNA SNHG14可負反饋靶向miR-223-3p介導膿毒癥急性肺損傷細胞自噬。然而LncRNA SNHG14是否可靶向miR-223-3p調控NLPR3通路減輕膿毒癥相關性肺損傷尚需要進一步研究驗證,基于此,本研究設計開展大鼠實驗探討該問題,旨在為減輕膿毒癥相關性肺損傷新藥的研發提供方向。
1 材料與方法
1.1 材料
SD大鼠80只,7~9周齡,清潔級,雌雄均半,體質量180~220 g,購自上海斯萊克實驗動物有限責任公司,許可證號SCXK(滬)2017-0005。本研究經福建醫科大學實驗動物倫理委員會批準通過(審批號:FJMU IACUC 2021-J-0080)。實驗動物中心資質號:SYXK(閩)2022-0004。
pcDNA-SNHG14、pcDNA、si-SNHG14、si-DNA、miR-223-3p mimic、miR mimic-NC、miR-223-3p inhibitor、miR inhibitor-NC質粒(均由深圳晶美生物有限公司合成);腺病毒(杭州創試生物科技有限公司,貨號CS4008X);Lipofectamine 2000脂質體(美國Invitrogen公司,貨號
醫用離心機(德國Eppendorf公司,5424R型);聚合酶鏈反應(polymerase chain reaction,PCR)儀(美國Thermo Fisher公司,QuantStudio3型);光學顯微鏡(德國OPTO公司,100-MC-075型);凝膠電泳儀(美國ProteinSimple公司,AlphaImager Mini型);雙熒光素酶報告基因系統(美國Promega公司,E1960型)。
1.2 方法
1.2.1 建模方法
取72只大鼠盲腸結扎穿孔法建立膿毒癥相關性肺損傷模型。常規腹腔麻醉后固定、皮膚消毒,沿腹正中線剪開約2 cm,分離腸系膜,用絲線結扎回盲腸瓣下方盲腸根部。取針頭穿透結扎端的盲腸,將糞便與腸內容物擠出至腹腔,將腸管回納,縫合、消毒。大鼠造模后6 h若有豎毛、腹瀉、呼吸困難、躁動、萎靡、爪趾青紫等認為造模成功。若有造模不成功或干預期間死亡大鼠則按照同等操作補齊。剩余9只大鼠僅剪開腹正中線、分離腸系膜并回納腸管,縫合、消毒,不進行絲線結扎和針頭穿孔,記為假手術組。
1.2.2 干預方法
將建模成功的72只大鼠采用隨機數字表分9組,即SNHG14上調組(注射攜帶pcDNA-SNHG14的腺病毒)、SNHG14上調對照組(注射攜帶pcDNA的腺病毒)、SNHG14下調組(靜脈注射攜帶si-SNHG14的腺病毒)、SNHG14下調對照組(脈注射攜帶si-DNA的腺病毒)、miR-223-3p上調組(注射攜帶miR-223-3p mimic的腺病毒)、miR-223-3p上調對照組(注射攜帶miR mimic-NC的腺病毒)、miR-223-3p下調組(注射攜帶miR inhibitor-NC的腺病毒)、miR-223-3p下調對照組(注射攜帶miR inhibitor-NC的腺病毒)、模型組(注射無菌生理鹽水)。假手術組同樣注射無菌生理鹽水。均經尾靜脈給藥。其中質粒轉染腺病毒載體、制備腺病毒液均參照說明書,注射劑量均為200 μL/只。
1.2.3 檢測指標及取樣方法
48 h后,各組均取尾靜脈血檢測血清炎癥因子水平;斷頭法處死,每組各取4只剝離左肺和右肺組織檢測LncRNA SNHG14、miR-223-3p和NLPR3、Caspase-1、ACS表達,肺組織濕/干重比值(wet weight/dry weight,W/D),肺組織病理改變,并制備膿毒癥相關性肺損傷細胞用以雙熒光素酶報告基因實驗;各組剩余4只均分離出全部氣管、肺臟及心臟檢測肺泡液體清除率(alveolar fluid clearance rate,AFC)。
LncRNA SNHG14、miR-223-3p表達檢測:采用實時定量逆轉錄聚合酶鏈反應(realtime-quantitative polymerase chain reaction,RT-qPCR)進行檢測。取肺組織勻漿離心(12 000 r/min、15 min),取上清。提取總RNA,逆轉錄。制備反應體系(共20 μL),引物信息見表1,前者內參為GAPDH,后者內參為U6。反應程序:95℃ 5 min,40個循環:95℃ 15 s、60℃ 34 s,最終75℃ 5 min。計算2–△△Ct。
血清炎癥因子水平檢測:將經抗凝處理的血液樣本3 500 r/min離心10min,取上清液按照ELISA試劑盒說明書測定血清TNF-α、IL-1β、IL-18水平。
肺組織W/D和AFC測定:(1)肺組織W/D:用電子天平稱量肺組織濕質量(wet weight,W),置于60℃烘箱中烘干1 h再次測量肺組織干質量(dry weight,D),計算W/D。(2)AFC:取氣管導管插入右肺下部,5%白蛋白(0.15 mg Evans藍標記)制成等滲生理鹽水灌注液按照4 mL/kg滴入右肺下葉,給氧2 mL。維持氣道壓650~700 Pa,持續全氧通氣1 h。取0.2 mL右下肺液體,測定620 nm的吸光度值。AFC%=灌入肺泡內液體量–肺泡內液體量。
肺組織病理改變觀察:HE染色。4%多聚甲醛固定24 h,常規石蠟包埋,制成切片(4 μm厚),HE然后封片并在光學顯微鏡下觀察。肺組織病理改變量化評分細則見表2。
肺組織NLPR3、Caspase-1、ACS基因表達檢測:采用RT-qPCR法。操作同LncRNA SNHG14、miR-223-3p表達檢測,引物信息見表1,內參為GAPDH。
肺組織NLPR3、Caspase-1、ACS蛋白表達檢測:采用免疫印跡法(Western blot,WB)。向肺組織中加入蛋白裂解液,離心(12 000 r/min,15 min),提取總蛋白并測其濃度。電泳將目標蛋白分離,轉至聚偏二氟乙烯膜,5%牛血清蛋白封閉。加入一抗(1∶1 000),室溫下,24 h后洗滌;加入免疫球蛋白G/辣根過氧化物酶標記的二抗(1∶2 000、1∶2 000、1∶5 000),4℃,2 h后顯色、曝光顯影。
LncRNA SNHG14對miR-223-3p的靶向調控驗證:采用雙熒光素酶報告基因實驗。首先取肺組織采用組織塊分離法獲得細胞。將野生型(wild type,WT)和突變型(mutation type,MUT)SNHG14熒光素酶載體與miR-223-3p mimic、miR-NC轉染至細胞,所用方法為脂質體轉染法。以熒光素酶活性測定試劑盒檢測,每組3個復孔。
1.3 統計學方法
利用SPSS21.0軟件中單因素分析和SNK-q檢驗多樣本計量資料,獨立樣本t檢驗檢驗兩樣本計量資料,計量資料均經Kolmogorov-Smirnov法檢驗服從正態分布,以均數±標準差(x±s)表示。P<0.05為差異有統計學意義。
2 結果
2.1 LncRNA SNHG14、miR-223-3p表達
與假手術組比較,模型組肺組織LncRNA SNHG14表達升高(P<0.05)、miR-223-3p表達下降(P<0.05)。與模型組及相應對照組比較,SNHG14上調組肺組織LncRNA SNHG14表達及SNHG14下調組、miR-223-3p上調組miR-223-3p表達均升高(P<0.05),而SNHG14下調組肺組織LncRNA SNHG14表達及SNHG14上調組、miR-223-3p下調組miR-223-3p表達均下降(P<0.05)。結果見表3。
2.2 血清炎癥因子水平
與假手術組比較,模型組血清TNF-α、IL-1β、IL-18水平均升高(P<0.05)。與模型組和相應對照組比較,SNHG14上調組及miR-223-3p下調組血清TNF-α、IL-1β、IL-18水平均升高(P<0.05),而SNHG14下調組及miR-223-3p上調組血清TNF-α、IL-1β、IL-18水平均下降(P<0.05)。結果見表4。
2.3 肺組織W/D與AFC
與假手術組比較,模型組W/D升高(P<0.05),而AFC下降(P<0.05)。與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組W/D升高(P<0.05),而AFC下降(P<0.05);SNHG14下調組、miR-223-3p上調組W/D下降(P<0.05),而AFC升高(P<0.05)。結果見表4。
2.4 肺組織病理改變與量化評分
假手術組肺泡完整、飽滿,肺間質正常。模型組與各對照組大部分肺泡完整性受損、萎陷嚴重,肺間質顯著增厚且有明顯水腫,并伴部分炎癥細胞浸潤。SNHG14上調組、miR-223-3p下調組大部分肺泡完整性嚴重受損、萎陷極為嚴重,肺間質顯著增厚且水腫嚴重,并伴有極大量炎癥細胞浸潤。SNHG14下調組、miR-223-3p上調組少部分肺泡完整性受損、萎陷,肺間質輕微增厚和水腫,有少量炎癥細胞浸潤。結果見圖1。
 圖1
各組肺組織病理改變(HE×200)
圖1
各組肺組織病理改變(HE×200)
a. 假手術組;b. 模型組;c. SNHG14上調組;d. SNHG14上調對照組;e. SNHG14下調組;f. SNHG14下調對照組;g. miR-223-3p上調組;h. miR-223-3p上調對照組;i. miR-223-3p下調組;j. miR-223-3p下調對照組。
與假手術組比較,模型組病理改變量化評分升高(P<0.05)。與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組病理改變量化評分升高(P<0.05),SNHG14下調組、miR-223-3p上調組病理改變量化評分下降(P<0.05)。結果見表5。
2.5 肺組織NLPR3、Caspase-1、ACS基因表達
與假手術組比較,模型組肺組織NLPR3、Caspase-1、ACS基因表達升高(P<0.05)。與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組肺組織NLPR3、Caspase-1、ACS基因表達升高(P<0.05),SNHG14下調組、miR-223-3p上調組肺組織NLPR3、Caspase-1、ACS基因表達下降(P<0.05)。結果見表5。
2.6 肺組織NLPR3、Caspase-1、ACS蛋白表達比較
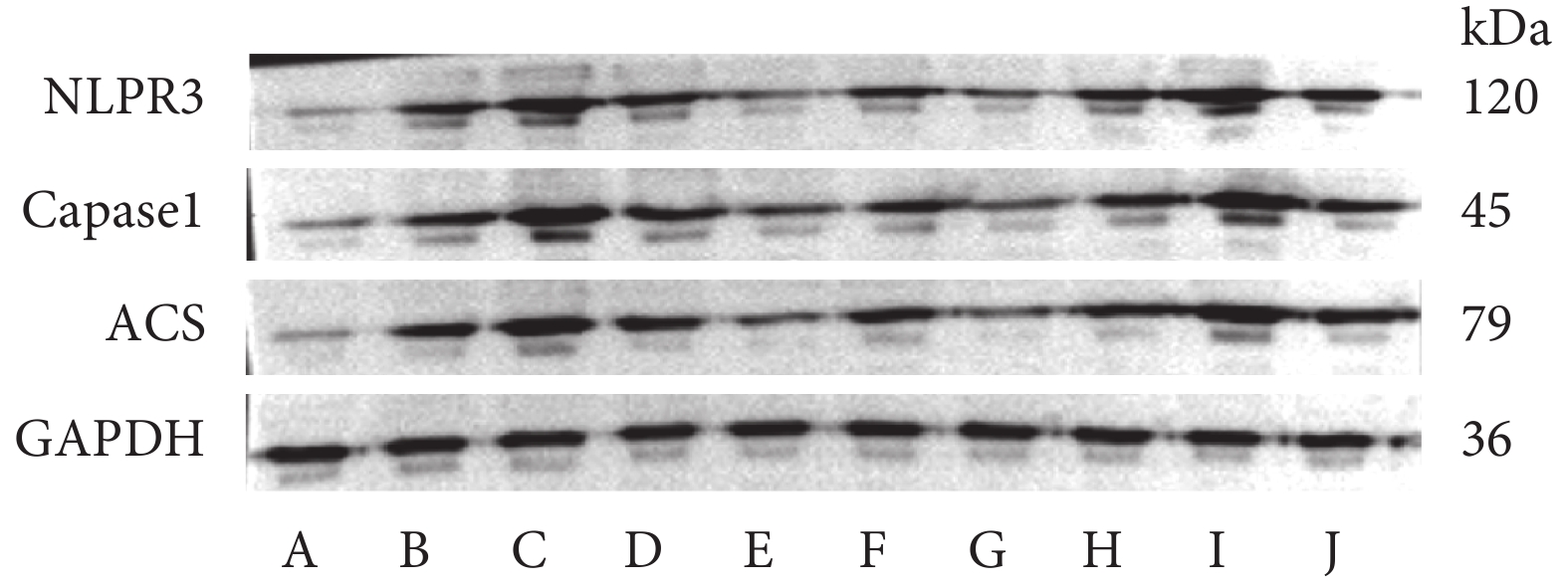
與假手術組比較,模型組肺組織NLPR3、Caspase-1、ACS蛋白表達升高(P<0.05);與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組肺組織NLPR3、Caspase-1、ACS蛋白表達升高(P<0.05),SNHG14下調組、miR-223-3p上調組肺組織NLPR3、Caspase-1、ACS蛋白表達下降(P<0.05)。結果見表5和圖2。
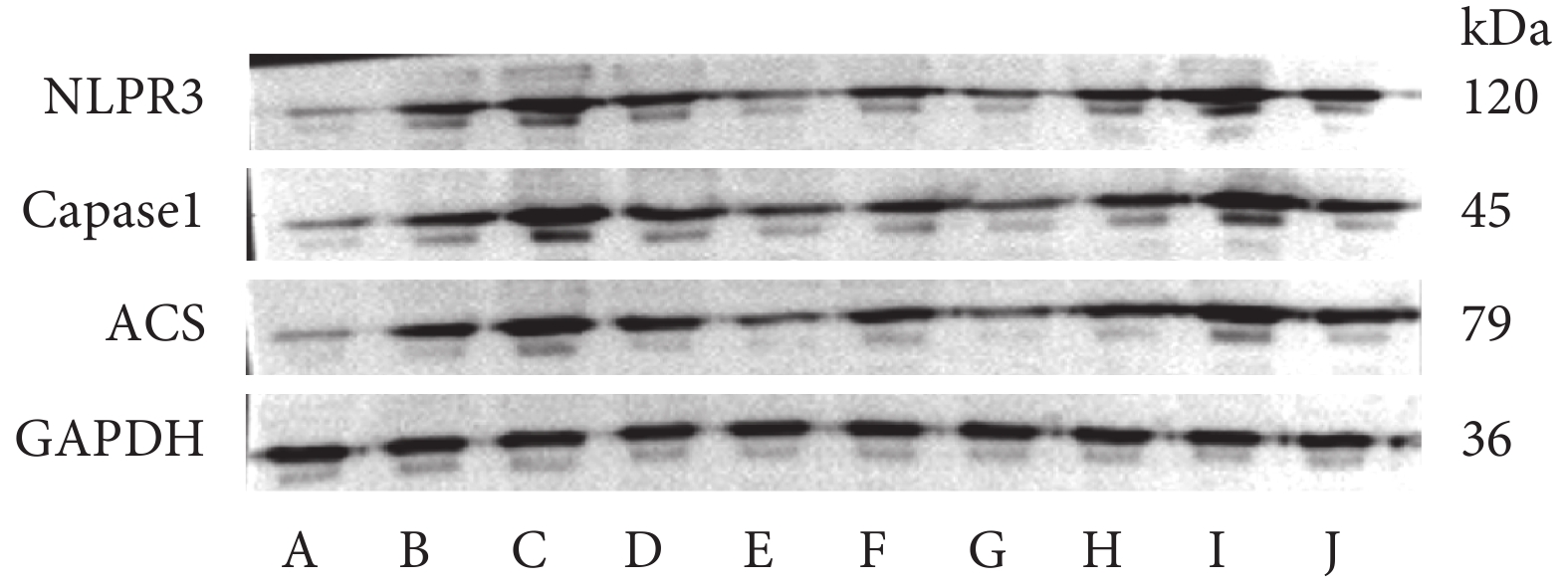 圖2
各組肺組織NLPR3、Caspase-1、ACS蛋白表達檢測
圖2
各組肺組織NLPR3、Caspase-1、ACS蛋白表達檢測
A:假手術組;B:模型組;C:SNHG14上調組;D:SNHG14上調對照組;E:SNHG14下調組;F:SNHG14下調對照組;G:miR-223-3p上調組;H:miR-223-3p上調對照組;I:miR-223-3p下調組;J:miR-223-3p下調對照組。
2.7 LncRNA SNHG14對miR-223-3p的靶向調控作用驗證
LncRNA SNHG14與miR-223-3p存在結合位點,見圖3。與轉染WT SNHG14的細胞相比,轉染MUT SNHG14的細胞miR-223-3p熒光素酶相對活性增加(P<0.05),而miR-NC的熒光素酶相對活性差異無統計學意義(P>0.05),結果見表6。
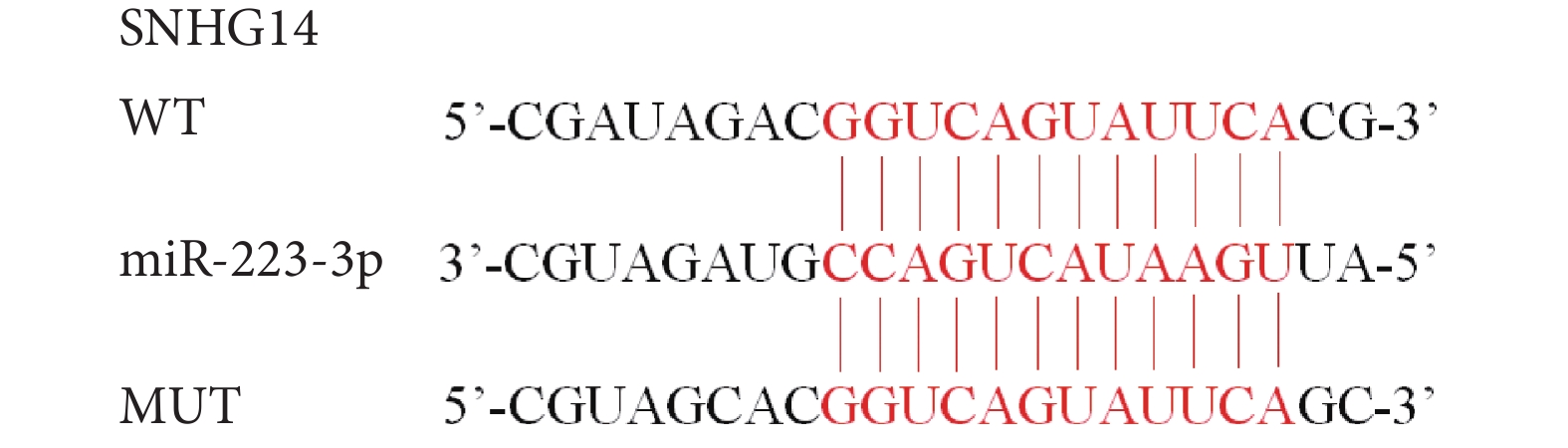 圖3
LncRNA SNHG14與miR-223-3p的結合位點
圖3
LncRNA SNHG14與miR-223-3p的結合位點
3 討論
罹患膿毒癥后機體呈現全身性的、劇烈的炎癥反應,損傷肺、肝、腎、腸、心、腦等多個器官的結構與功能,可引起多器官功能障礙綜合癥和休克,甚至死亡[9-10]。肺是膿毒癥狀態下最易受損的靶器官,這與過度的促炎癥因子釋放和劇烈的氧化應激反應均有密切關系[11]。然而目前臨床上常用的抗炎、抗氧化應激等藥物并不能有效減輕膿毒癥相關性肺損傷,這與所用藥物靶點單一而參與炎癥及氧化應激反應的分子眾多有關[12]。因此,探討新的參與膿毒癥相關性肺損傷的基因、探索新的抗炎治療靶點十分必要。
本研究中,與假手術組比較,模型組肺組織LncRNA SNHG14表達、血清炎癥因子水平、W/D、病理改變量化評分均升高,而miR-223-3p表達、AFC均下降,提示LncRNA SNHG14表達升高和miR-223-3p表達表達下降均可能參與膿毒癥相關性肺損傷,且此類疾病不僅存在嚴重的炎癥反應,肺組織也有明顯病理改變,W/D顯著增加,AFC則顯著下降。LncRNA SNHG14高表達可誘發脂多糖誘導的急性肺損傷,下調其表達可靶向miR-34c-3p、調控趨化因子受體1的表達進而減輕急性肺損傷,且與調控信號通道蛋白1的表達也有關[6]。LncRNA SNHG14高表達可參與細胞凋亡,推測這與膿毒癥相關性肺損傷病理改變有關[13]。miR-223-3p是重要的炎癥反應調控分子,可參與調控NLRP3、核轉錄因子κB、絲裂原活化蛋白激酶、核糖體蛋白S6激酶/低氧誘導因子1等多種途徑進而影響炎癥反應,參與靶器官驗證損害及惡性腫瘤等疾病[14-16]。研究發現miR-223-3p低表達可以預測膿毒癥[17],miR-223-3p低表達可參與新生兒早期膿毒癥的發生及進展[18]。本研究結果與上述報道一致,提示能通過抑制LncRNA SNHG14表達、上調miR-223-3p表達減輕膿毒癥相關性肺損傷,本研究SNHG14下調組、miR-223-3p上調組肺組織病理改變顯著減輕,量化評分與W/D均顯著下降,AFC顯著升高,驗證了上述結論;而SNHG14上調組、miR-223-3p下調組膿毒癥相關性肺損傷均加重,這也說明了LncRNA SNHG14高表達、miR-223-3p低表達可參與膿毒癥相關性肺損傷的發生及加重。
本研究還發現,與假手術組比較,模型組肺組織NLPR3、Caspase-1、ACS表達均升高;與模型組及相應對照組比較,SNHG14下調組與miR-223-3p上調組肺組織NLPR3、Caspase-1、ACS表達均下降,SNHG14上調組與miR-223-3p下調組上述表達則均升高。這表明抑制LncRNA SNHG14、促進miR-223-3p可下調膿毒癥相關性肺損傷NLPR3、Caspase-1、ACS的表達,反之則可增加上述表達。NLPR3屬于炎癥小體傳感器,激活NLPR3可產生Caspase-1、ACS等在內的寡聚體復合物,在眾多炎癥疾病中至關重要。NLPR3激活后可上調核轉錄因子κB,增加相關促炎癥因子的表達,包括炎癥小體傳感器蛋白、TNF-α、IL-1β、IL-18等。另一方面,NLPR3激活還可增加與ASC的結合及Caspase-1的募集,這也是增加IL-1β分泌、導致細胞凋亡的重要原因。Ren等[19]研究顯示NLRP3通路激活在細胞焦亡中也有積極作用,這與炎癥所致的組織損傷有關。朱敏杰等[20]研究發現NLRP3表達升高可增加Caspase-1的表達,增加IL-1β和IL-8的分泌,參與膿毒癥致急性腎損傷這一病理過程。NLRP3上調與肺損傷的關系國內外也不乏相關報道[21-23]。研究證實miR-223-3p可負反饋調節NLRP3通路參與脂多糖誘導的急性腎損傷[24]。本研究也發現,LncRNA SNHG14可負反饋靶向調控miR-223-3p。基于此可以推測,LncRNA SNHG14可靶向調控miR-223-3p,并通過激活NLRP3通路引起炎癥反應,參與膿毒癥相關性肺損傷。而下調LncRNA SNHG14可靶向增加miR-223-3p表達,并抑制NLRP3通路活性,降低促炎癥因子水平,減輕膿毒癥相關性肺損傷。本研究為治療膿毒癥相關性肺損傷提供了一個新方向,但是如何抑制膿毒癥相關性肺損傷的LncRNA SNHG14表達及其在臨床中的適用性尚不可知,且該基因是否可通過其它機制參與膿毒癥相關性肺損傷也不清楚,后續仍需進行大量、深入地探討。
綜上所述,抑制LncRNA SNHG14表達可靶向上調miR-223-3p表達,并抑制NLRP3、Caspase-1、ACS表達,控制炎癥反應,進而減輕膿毒癥相關性肺損傷;反之則可通過下調miR-223-3p表達,并增加NLRP3、Caspase-1、ACS表達,加重炎癥反應和膿毒癥相關性肺損傷。
利益沖突:本研究不涉及任何利益沖突。
膿毒癥是一種炎癥反應失調引起的器官功能障礙綜合征,可發展為嚴重膿毒癥與膿毒性休克,致死率高。膿毒癥相關性肺損傷是膿毒癥常見的并發癥,調查發現在膿毒癥中肺損傷發生率約40.2%,病死率30%~85%[1],提示膿毒癥患者肺損傷發生及相關死亡風險均處于高水平。目前臨床上對于膿毒癥相關性肺損傷多采用基礎支持治療,但收效并不理想[2]。多種長鏈非編碼核糖核酸(long chain non-coding ribonucleic acid,LncRNA)與微小核糖核酸(microribonucleic acid,miR)被發現參與膿毒癥的發生與進展,且調控其表達可控制病情及相關靶器官損害,與抑制炎癥反應有緊密關系[3-5]。研究發現LncRNA核內小RNA宿主基因14(long chain non coding ribonucleic acid small nucleolar RNA host gene 14,LncRNA SNHG14)可參與氧-糖剝奪/復氧誘導的神經細胞損傷,與炎癥反應調控密切相關[6];在膿毒癥中miR-223-3p表達下降,并能負反饋調控人NOD樣受體家族蛋白3(NOD like receptor family protein 3,NLPR3)通路、增加NLPR3、胱天蛋白酶半胱氨酸天冬氨酸蛋白酶1(Cysteine-requiring aspartate protease 1,Caspase-1)、1-氨基環丙烷-1-羧酸合酶(1-aminocyclopropane-1-carboxylate synthase,ACS)表達,參與炎癥因子的剪切活化,引起肺損傷[7]。Hong等[8]研究發現LncRNA SNHG14可負反饋靶向miR-223-3p介導膿毒癥急性肺損傷細胞自噬。然而LncRNA SNHG14是否可靶向miR-223-3p調控NLPR3通路減輕膿毒癥相關性肺損傷尚需要進一步研究驗證,基于此,本研究設計開展大鼠實驗探討該問題,旨在為減輕膿毒癥相關性肺損傷新藥的研發提供方向。
1 材料與方法
1.1 材料
SD大鼠80只,7~9周齡,清潔級,雌雄均半,體質量180~220 g,購自上海斯萊克實驗動物有限責任公司,許可證號SCXK(滬)2017-0005。本研究經福建醫科大學實驗動物倫理委員會批準通過(審批號:FJMU IACUC 2021-J-0080)。實驗動物中心資質號:SYXK(閩)2022-0004。
pcDNA-SNHG14、pcDNA、si-SNHG14、si-DNA、miR-223-3p mimic、miR mimic-NC、miR-223-3p inhibitor、miR inhibitor-NC質粒(均由深圳晶美生物有限公司合成);腺病毒(杭州創試生物科技有限公司,貨號CS4008X);Lipofectamine 2000脂質體(美國Invitrogen公司,貨號
醫用離心機(德國Eppendorf公司,5424R型);聚合酶鏈反應(polymerase chain reaction,PCR)儀(美國Thermo Fisher公司,QuantStudio3型);光學顯微鏡(德國OPTO公司,100-MC-075型);凝膠電泳儀(美國ProteinSimple公司,AlphaImager Mini型);雙熒光素酶報告基因系統(美國Promega公司,E1960型)。
1.2 方法
1.2.1 建模方法
取72只大鼠盲腸結扎穿孔法建立膿毒癥相關性肺損傷模型。常規腹腔麻醉后固定、皮膚消毒,沿腹正中線剪開約2 cm,分離腸系膜,用絲線結扎回盲腸瓣下方盲腸根部。取針頭穿透結扎端的盲腸,將糞便與腸內容物擠出至腹腔,將腸管回納,縫合、消毒。大鼠造模后6 h若有豎毛、腹瀉、呼吸困難、躁動、萎靡、爪趾青紫等認為造模成功。若有造模不成功或干預期間死亡大鼠則按照同等操作補齊。剩余9只大鼠僅剪開腹正中線、分離腸系膜并回納腸管,縫合、消毒,不進行絲線結扎和針頭穿孔,記為假手術組。
1.2.2 干預方法
將建模成功的72只大鼠采用隨機數字表分9組,即SNHG14上調組(注射攜帶pcDNA-SNHG14的腺病毒)、SNHG14上調對照組(注射攜帶pcDNA的腺病毒)、SNHG14下調組(靜脈注射攜帶si-SNHG14的腺病毒)、SNHG14下調對照組(脈注射攜帶si-DNA的腺病毒)、miR-223-3p上調組(注射攜帶miR-223-3p mimic的腺病毒)、miR-223-3p上調對照組(注射攜帶miR mimic-NC的腺病毒)、miR-223-3p下調組(注射攜帶miR inhibitor-NC的腺病毒)、miR-223-3p下調對照組(注射攜帶miR inhibitor-NC的腺病毒)、模型組(注射無菌生理鹽水)。假手術組同樣注射無菌生理鹽水。均經尾靜脈給藥。其中質粒轉染腺病毒載體、制備腺病毒液均參照說明書,注射劑量均為200 μL/只。
1.2.3 檢測指標及取樣方法
48 h后,各組均取尾靜脈血檢測血清炎癥因子水平;斷頭法處死,每組各取4只剝離左肺和右肺組織檢測LncRNA SNHG14、miR-223-3p和NLPR3、Caspase-1、ACS表達,肺組織濕/干重比值(wet weight/dry weight,W/D),肺組織病理改變,并制備膿毒癥相關性肺損傷細胞用以雙熒光素酶報告基因實驗;各組剩余4只均分離出全部氣管、肺臟及心臟檢測肺泡液體清除率(alveolar fluid clearance rate,AFC)。
LncRNA SNHG14、miR-223-3p表達檢測:采用實時定量逆轉錄聚合酶鏈反應(realtime-quantitative polymerase chain reaction,RT-qPCR)進行檢測。取肺組織勻漿離心(12 000 r/min、15 min),取上清。提取總RNA,逆轉錄。制備反應體系(共20 μL),引物信息見表1,前者內參為GAPDH,后者內參為U6。反應程序:95℃ 5 min,40個循環:95℃ 15 s、60℃ 34 s,最終75℃ 5 min。計算2–△△Ct。
血清炎癥因子水平檢測:將經抗凝處理的血液樣本3 500 r/min離心10min,取上清液按照ELISA試劑盒說明書測定血清TNF-α、IL-1β、IL-18水平。
肺組織W/D和AFC測定:(1)肺組織W/D:用電子天平稱量肺組織濕質量(wet weight,W),置于60℃烘箱中烘干1 h再次測量肺組織干質量(dry weight,D),計算W/D。(2)AFC:取氣管導管插入右肺下部,5%白蛋白(0.15 mg Evans藍標記)制成等滲生理鹽水灌注液按照4 mL/kg滴入右肺下葉,給氧2 mL。維持氣道壓650~700 Pa,持續全氧通氣1 h。取0.2 mL右下肺液體,測定620 nm的吸光度值。AFC%=灌入肺泡內液體量–肺泡內液體量。
肺組織病理改變觀察:HE染色。4%多聚甲醛固定24 h,常規石蠟包埋,制成切片(4 μm厚),HE然后封片并在光學顯微鏡下觀察。肺組織病理改變量化評分細則見表2。
肺組織NLPR3、Caspase-1、ACS基因表達檢測:采用RT-qPCR法。操作同LncRNA SNHG14、miR-223-3p表達檢測,引物信息見表1,內參為GAPDH。
肺組織NLPR3、Caspase-1、ACS蛋白表達檢測:采用免疫印跡法(Western blot,WB)。向肺組織中加入蛋白裂解液,離心(12 000 r/min,15 min),提取總蛋白并測其濃度。電泳將目標蛋白分離,轉至聚偏二氟乙烯膜,5%牛血清蛋白封閉。加入一抗(1∶1 000),室溫下,24 h后洗滌;加入免疫球蛋白G/辣根過氧化物酶標記的二抗(1∶2 000、1∶2 000、1∶5 000),4℃,2 h后顯色、曝光顯影。
LncRNA SNHG14對miR-223-3p的靶向調控驗證:采用雙熒光素酶報告基因實驗。首先取肺組織采用組織塊分離法獲得細胞。將野生型(wild type,WT)和突變型(mutation type,MUT)SNHG14熒光素酶載體與miR-223-3p mimic、miR-NC轉染至細胞,所用方法為脂質體轉染法。以熒光素酶活性測定試劑盒檢測,每組3個復孔。
1.3 統計學方法
利用SPSS21.0軟件中單因素分析和SNK-q檢驗多樣本計量資料,獨立樣本t檢驗檢驗兩樣本計量資料,計量資料均經Kolmogorov-Smirnov法檢驗服從正態分布,以均數±標準差(x±s)表示。P<0.05為差異有統計學意義。
2 結果
2.1 LncRNA SNHG14、miR-223-3p表達
與假手術組比較,模型組肺組織LncRNA SNHG14表達升高(P<0.05)、miR-223-3p表達下降(P<0.05)。與模型組及相應對照組比較,SNHG14上調組肺組織LncRNA SNHG14表達及SNHG14下調組、miR-223-3p上調組miR-223-3p表達均升高(P<0.05),而SNHG14下調組肺組織LncRNA SNHG14表達及SNHG14上調組、miR-223-3p下調組miR-223-3p表達均下降(P<0.05)。結果見表3。
2.2 血清炎癥因子水平
與假手術組比較,模型組血清TNF-α、IL-1β、IL-18水平均升高(P<0.05)。與模型組和相應對照組比較,SNHG14上調組及miR-223-3p下調組血清TNF-α、IL-1β、IL-18水平均升高(P<0.05),而SNHG14下調組及miR-223-3p上調組血清TNF-α、IL-1β、IL-18水平均下降(P<0.05)。結果見表4。
2.3 肺組織W/D與AFC
與假手術組比較,模型組W/D升高(P<0.05),而AFC下降(P<0.05)。與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組W/D升高(P<0.05),而AFC下降(P<0.05);SNHG14下調組、miR-223-3p上調組W/D下降(P<0.05),而AFC升高(P<0.05)。結果見表4。
2.4 肺組織病理改變與量化評分
假手術組肺泡完整、飽滿,肺間質正常。模型組與各對照組大部分肺泡完整性受損、萎陷嚴重,肺間質顯著增厚且有明顯水腫,并伴部分炎癥細胞浸潤。SNHG14上調組、miR-223-3p下調組大部分肺泡完整性嚴重受損、萎陷極為嚴重,肺間質顯著增厚且水腫嚴重,并伴有極大量炎癥細胞浸潤。SNHG14下調組、miR-223-3p上調組少部分肺泡完整性受損、萎陷,肺間質輕微增厚和水腫,有少量炎癥細胞浸潤。結果見圖1。
 圖1
各組肺組織病理改變(HE×200)
圖1
各組肺組織病理改變(HE×200)
a. 假手術組;b. 模型組;c. SNHG14上調組;d. SNHG14上調對照組;e. SNHG14下調組;f. SNHG14下調對照組;g. miR-223-3p上調組;h. miR-223-3p上調對照組;i. miR-223-3p下調組;j. miR-223-3p下調對照組。
與假手術組比較,模型組病理改變量化評分升高(P<0.05)。與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組病理改變量化評分升高(P<0.05),SNHG14下調組、miR-223-3p上調組病理改變量化評分下降(P<0.05)。結果見表5。
2.5 肺組織NLPR3、Caspase-1、ACS基因表達
與假手術組比較,模型組肺組織NLPR3、Caspase-1、ACS基因表達升高(P<0.05)。與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組肺組織NLPR3、Caspase-1、ACS基因表達升高(P<0.05),SNHG14下調組、miR-223-3p上調組肺組織NLPR3、Caspase-1、ACS基因表達下降(P<0.05)。結果見表5。
2.6 肺組織NLPR3、Caspase-1、ACS蛋白表達比較
與假手術組比較,模型組肺組織NLPR3、Caspase-1、ACS蛋白表達升高(P<0.05);與模型組及相應對照組比較,SNHG14上調組、miR-223-3p下調組肺組織NLPR3、Caspase-1、ACS蛋白表達升高(P<0.05),SNHG14下調組、miR-223-3p上調組肺組織NLPR3、Caspase-1、ACS蛋白表達下降(P<0.05)。結果見表5和圖2。
 圖2
各組肺組織NLPR3、Caspase-1、ACS蛋白表達檢測
圖2
各組肺組織NLPR3、Caspase-1、ACS蛋白表達檢測
A:假手術組;B:模型組;C:SNHG14上調組;D:SNHG14上調對照組;E:SNHG14下調組;F:SNHG14下調對照組;G:miR-223-3p上調組;H:miR-223-3p上調對照組;I:miR-223-3p下調組;J:miR-223-3p下調對照組。
2.7 LncRNA SNHG14對miR-223-3p的靶向調控作用驗證
LncRNA SNHG14與miR-223-3p存在結合位點,見圖3。與轉染WT SNHG14的細胞相比,轉染MUT SNHG14的細胞miR-223-3p熒光素酶相對活性增加(P<0.05),而miR-NC的熒光素酶相對活性差異無統計學意義(P>0.05),結果見表6。
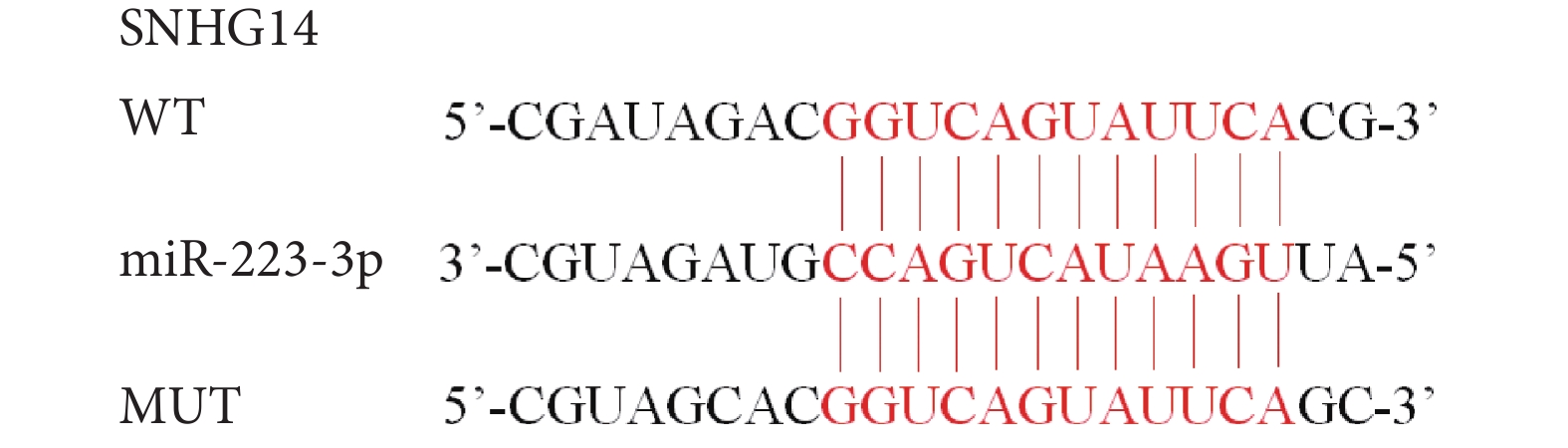 圖3
LncRNA SNHG14與miR-223-3p的結合位點
圖3
LncRNA SNHG14與miR-223-3p的結合位點
3 討論
罹患膿毒癥后機體呈現全身性的、劇烈的炎癥反應,損傷肺、肝、腎、腸、心、腦等多個器官的結構與功能,可引起多器官功能障礙綜合癥和休克,甚至死亡[9-10]。肺是膿毒癥狀態下最易受損的靶器官,這與過度的促炎癥因子釋放和劇烈的氧化應激反應均有密切關系[11]。然而目前臨床上常用的抗炎、抗氧化應激等藥物并不能有效減輕膿毒癥相關性肺損傷,這與所用藥物靶點單一而參與炎癥及氧化應激反應的分子眾多有關[12]。因此,探討新的參與膿毒癥相關性肺損傷的基因、探索新的抗炎治療靶點十分必要。
本研究中,與假手術組比較,模型組肺組織LncRNA SNHG14表達、血清炎癥因子水平、W/D、病理改變量化評分均升高,而miR-223-3p表達、AFC均下降,提示LncRNA SNHG14表達升高和miR-223-3p表達表達下降均可能參與膿毒癥相關性肺損傷,且此類疾病不僅存在嚴重的炎癥反應,肺組織也有明顯病理改變,W/D顯著增加,AFC則顯著下降。LncRNA SNHG14高表達可誘發脂多糖誘導的急性肺損傷,下調其表達可靶向miR-34c-3p、調控趨化因子受體1的表達進而減輕急性肺損傷,且與調控信號通道蛋白1的表達也有關[6]。LncRNA SNHG14高表達可參與細胞凋亡,推測這與膿毒癥相關性肺損傷病理改變有關[13]。miR-223-3p是重要的炎癥反應調控分子,可參與調控NLRP3、核轉錄因子κB、絲裂原活化蛋白激酶、核糖體蛋白S6激酶/低氧誘導因子1等多種途徑進而影響炎癥反應,參與靶器官驗證損害及惡性腫瘤等疾病[14-16]。研究發現miR-223-3p低表達可以預測膿毒癥[17],miR-223-3p低表達可參與新生兒早期膿毒癥的發生及進展[18]。本研究結果與上述報道一致,提示能通過抑制LncRNA SNHG14表達、上調miR-223-3p表達減輕膿毒癥相關性肺損傷,本研究SNHG14下調組、miR-223-3p上調組肺組織病理改變顯著減輕,量化評分與W/D均顯著下降,AFC顯著升高,驗證了上述結論;而SNHG14上調組、miR-223-3p下調組膿毒癥相關性肺損傷均加重,這也說明了LncRNA SNHG14高表達、miR-223-3p低表達可參與膿毒癥相關性肺損傷的發生及加重。
本研究還發現,與假手術組比較,模型組肺組織NLPR3、Caspase-1、ACS表達均升高;與模型組及相應對照組比較,SNHG14下調組與miR-223-3p上調組肺組織NLPR3、Caspase-1、ACS表達均下降,SNHG14上調組與miR-223-3p下調組上述表達則均升高。這表明抑制LncRNA SNHG14、促進miR-223-3p可下調膿毒癥相關性肺損傷NLPR3、Caspase-1、ACS的表達,反之則可增加上述表達。NLPR3屬于炎癥小體傳感器,激活NLPR3可產生Caspase-1、ACS等在內的寡聚體復合物,在眾多炎癥疾病中至關重要。NLPR3激活后可上調核轉錄因子κB,增加相關促炎癥因子的表達,包括炎癥小體傳感器蛋白、TNF-α、IL-1β、IL-18等。另一方面,NLPR3激活還可增加與ASC的結合及Caspase-1的募集,這也是增加IL-1β分泌、導致細胞凋亡的重要原因。Ren等[19]研究顯示NLRP3通路激活在細胞焦亡中也有積極作用,這與炎癥所致的組織損傷有關。朱敏杰等[20]研究發現NLRP3表達升高可增加Caspase-1的表達,增加IL-1β和IL-8的分泌,參與膿毒癥致急性腎損傷這一病理過程。NLRP3上調與肺損傷的關系國內外也不乏相關報道[21-23]。研究證實miR-223-3p可負反饋調節NLRP3通路參與脂多糖誘導的急性腎損傷[24]。本研究也發現,LncRNA SNHG14可負反饋靶向調控miR-223-3p。基于此可以推測,LncRNA SNHG14可靶向調控miR-223-3p,并通過激活NLRP3通路引起炎癥反應,參與膿毒癥相關性肺損傷。而下調LncRNA SNHG14可靶向增加miR-223-3p表達,并抑制NLRP3通路活性,降低促炎癥因子水平,減輕膿毒癥相關性肺損傷。本研究為治療膿毒癥相關性肺損傷提供了一個新方向,但是如何抑制膿毒癥相關性肺損傷的LncRNA SNHG14表達及其在臨床中的適用性尚不可知,且該基因是否可通過其它機制參與膿毒癥相關性肺損傷也不清楚,后續仍需進行大量、深入地探討。
綜上所述,抑制LncRNA SNHG14表達可靶向上調miR-223-3p表達,并抑制NLRP3、Caspase-1、ACS表達,控制炎癥反應,進而減輕膿毒癥相關性肺損傷;反之則可通過下調miR-223-3p表達,并增加NLRP3、Caspase-1、ACS表達,加重炎癥反應和膿毒癥相關性肺損傷。
利益沖突:本研究不涉及任何利益沖突。