引用本文: 曾海文, 陳巧莉, 丁志榮. LncRNA-NORAD調節miR-155-5p/TLR6分子軸對膿毒癥大鼠急性肺損傷的影響. 中國呼吸與危重監護雜志, 2025, 24(1): 26-32. doi: 10.7507/1671-6205.202402017 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
膿毒癥是對感染反應失調而導致的器官功能障礙綜合征,而肺部是最先受到損傷的器官之一,急性肺損傷(acute lung injury,ALI)是膿毒癥患者死亡的常見病因[1]。ALI患者臨床主要表現為低氧血癥、呼吸困難等,發病時危及患者生命[2]。近年來隨著分子生物學的發展,從分子水平干預治療ALI逐漸成為研究熱點[3]。已證實長鏈非編碼核糖核酸(long non-coding RNA,lncRNA)參與調控細胞多種疾病的發生發展過程[4]。Zhou等[5]研究表明沉默DNA損傷激活的非編碼RNA(non-coding RNA activated by DNA damage,NORAD)可有效減輕LPS誘導的肺內皮細胞損傷。Lei等[6]研究表明NORAD在潰瘍性結腸炎大鼠結腸黏膜組織中過表達,沉默NORAD表達可降低大鼠炎癥反應、氧化應激,降低細胞凋亡。LncRNA發揮生物學作用一般是通過調控miRNA表達來實現的,miRNA在調控細胞生物學過程中發揮重要作用[7]。Lin等[8]研究表明過表達miR-155-5p可減輕呼吸機誘導肺損傷小鼠細胞凋亡和自噬,減輕肺損傷。推測miR-155-5p可降低肺損傷,而miRNA可通過與其靶基因mRNA結合來調控細胞生物學過程。Toll樣受體6(Toll-like receptor 6,TLR6)具有促進炎癥發生的作用,Wang等[9]研究表明TLR6在膿毒癥患者血液中高表達,降低TLR6表達可減輕膿毒癥誘導的炎癥反應。生物信息學顯示miR-155-5p與NORAD和TLR6存在靶向關系。因此,本研究就NORAD是否可通過調節miR-155-5p/TLR6軸來影響膿毒癥大鼠ALI進行探討。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物和細胞
選取SPF級200~230 g雄性SD大鼠60只,購自福建醫科大學[合格證號SCXK(閩)2022-0001]。小鼠肺微血管內皮細胞MHC細胞購自上海一研生物科技有限公司。本研究經福建醫科大學動物實驗中心倫理委員會審核通過(批號2022-08912)。
1.1.2 主要試劑與儀器
白細胞介素(interleukin,IL)-8、IL-1β、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)ELISA試劑盒購自河南閔翰生物科技有限公司;Trizol試劑購自上海科澄維生物科技有限公司;實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction,qRT-PCR)試劑盒購自上海威奧生物科技有限公司;胰蛋白酶購自上海莼試生物技術有限公司;CX41顯微鏡購自上海蒼茂實業有限公司;TLR6、Bax、Bcl-2、裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved cysteinyl aspartate specific proteinase 3,Cleaved-caspase-3)、β-actin一抗和二抗均購自英國Abcam公司。
1.2 方法
1.2.1 造模與分組
取50只大鼠于大鼠腹腔內注射10 mg/kg的脂多糖(lipopolysaccharide,LPS)以建立膿毒癥ALI大鼠模型[10],將建模后的大鼠隨機分為模型組、NORAD低表達空載組(LV-sh-NC組)、NORAD低表達組(LV-sh-NORAD組)、NORAD低表達+miR-155-5p低表達空載組(LV-sh-NORAD+NC antagomir)、NORAD低表達+miR-155-5p低表達組(LV-sh-NORAD+miR-155-5p antagomir),另取10只腹腔內注射生理鹽水做為對照組。LV-sh-NC組和LV-sh-NORAD組大鼠尾靜脈注射200 μL sh-NORAD慢病毒空載體(6×106 TU/mL)和200 μL sh-NORAD慢病毒載體(6×106 TU/mL),LV-sh-NORAD+NC antagomir組和LV-sh-NORAD+miR-155-5p antagomir組大鼠尾靜脈注射200 μL sh-NORAD慢病毒載體(6×106 TU/ml)后再尾靜脈注射200 μL NC antagomir和miR-155-5p antagomir質粒,對照組和模型組同等方式注射等量生理鹽水。
1.2.2 樣本采集
48 h后取大鼠外周血3 mL,4℃冰箱保存,斷頭處死大鼠,取出大鼠完整肺組織,–80℃冰箱保存待測。
1.2.3 血清IL-8、IL-β、TNF-α水平檢測
將新鮮血液離心收集血清,根據試劑盒說明書加入相應的反應試劑,終止試劑后檢測IL-8、IL-β、TNF-α水平。
1.2.4 qRT-PCR檢測肺組織中NORAD、miR-155-5p和TLR6 mRNA表達
取部分大鼠左肺組織,提取其總RNA,并逆轉錄為cDNA后,對cDNA進行熒光定量擴增。分別以GAPDH和U6為內參,計算NORAD、miR-155-5p和TLR6 mRNA的相對表達量(2–ΔΔCt方法)。引物:NORAD正向:5?-TCCCATCACCATCTTCCAGG-3?,反向5?-CCGTTGTCGTCAGGACTAGGTAGG-3?;TLR6 mRNA正向:5?-TGCAACATGAGCCAAGACAG-3?,反向5?-TTCTTGGTGGCAGGTCTTTG-3?;miR-155-5p正向:5?-GGGGTTAATGCTAATCGTGA-3?,反向5?-CAGTGCGTGTCGTGGAGT-3?;GAPDH正向:5'-CAAGGACCTCTACGCCAAC-3',反向:5'-TGGAGGCGCGATGATCTT-3'。U6正向:5'-CTCGCTTCGGCAGCACA-3',反向:5'-AACGCTTCACGAATTTGCGT-3'。
1.2.5 肺水腫評估
取大鼠右肺,清除表面水分,稱量記為濕重(wet weight,W),之后置于80℃干燥箱中烘干至恒重,稱量記為干重(dry weight,D),計算W/D值。
1.2.6 HE染色觀察肺組織形態變化
取左肺組織切片,多聚甲醛進行固定,石蠟包埋切片(4 μm),脫蠟,清洗,然后蘇木精-伊紅染色(hematoxylin-eosin staining,HE)染色,脫水后進行封片,顯微鏡觀察肺組織形態變化。
1.2.7 TUNEL法檢測肺組織細胞凋亡情況
取1.2.6中固定肺組織,包埋,切片,脫蠟,酒精梯度脫水,然后按照原位末端標記法(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)試劑盒說明書進行后續操作,觀察細胞凋亡情況。凋亡率=TUNEL陽性細胞數/總細胞數×100%。
1.2.8 免疫印跡法(Western blot)檢測大鼠肺組織中相關蛋白表達
取大鼠左肺組織低溫研磨勻漿,提取蛋白后熱水浴將其變性,電泳分離蛋白并轉移至PVDF膜上,封閉液封閉2 h,加入一抗TLR6、Bax、Bcl-2、Cleaved-caspase-3、β-actin稀釋液4℃孵育過夜,加入二抗,ECL顯色后用Image J軟件分析蛋白。
1.2.9 雙熒光素酶報告基因檢測
采用雙熒光素酶報告基因實驗驗證miR-155-5p與NORAD和TLR6的關系。構建NORAD野生型和突變型載體(NORAD-WT和NORAD-MUT),將NORAD-WT分別與miR-155-5p空載和過表達質粒共轉染于MHC細胞中,在將NORAD-MUT分別與miR-155-5p空載和過表達質粒共轉染于細胞MHC中,48 h后,檢測熒光素酶活性。構建TLR6野生型和突變型載體(TLR6-WT和TLR6-MUT),將TLR6-WT分別與miR-155-5p空載和過表達質粒共轉染于MHC細胞中,再將TLR6-MUT分別與miR-NC和miR-155-5p mimic共轉染于MHC細胞中,48 h后,檢測熒光素酶活性。
1.3 統計學方法
采用GraphPad Prism 8.0.1軟件分析數據。呈正態分布的計量資料以均數±標準差(x±s)表示,多組間比較用單因素方差分析,組內兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠血漿炎癥因子表達比較
模型組和LV-sh-NC組大鼠血清IL-1β、TNF-α、IL-8水平顯著高于對照組(P<0.05);LV-sh-NORAD組大鼠血清IL-1β、TNF-α、IL-8水平顯著低于LV-sh-NC組(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組大鼠血清IL-1β、TNF-α、IL-8水平顯著高于LV-sh-NORAD+NC antagomir組(P<0.05)。結果見表1。
2.2 各組大鼠肺組織中NORAD、miR-155-5p和TLR6基因表達比較
模型組和LV-sh-NC組大鼠肺組織中NORAD和TLR6 mRNA表達水平顯著高于對照組,miR-155-5p表達水平低于對照組(P<0.05);LV-sh-NORAD組大鼠肺組織中NORAD和TLR6 mRNA表達水平低于LV-sh-NC組,miR-155-5p表達水平顯著高于LV-sh-NC組(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組大鼠肺組織中TLR6 mRNA表達水平高于LV-sh-NORAD+NC antagomir組,miR-155-5p表達水平低于LV-sh-NORAD+NC antagomir組(P<0.05)。結果見表2。
2.3 各組大鼠W/D比值比較
模型組和LV-sh-NC組相較于對照組大鼠肺組織W/D比值顯著增大(P<0.05);LV-sh-NORAD組相較于LV-sh-NC組大鼠肺組織W/D比值顯著減小(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組相較于LV-sh-NORAD+NC antagomir 組大鼠肺組織W/D比值顯著增大(P<0.05)。結果見表3。
2.4 各組大鼠肺組織形態變化比較
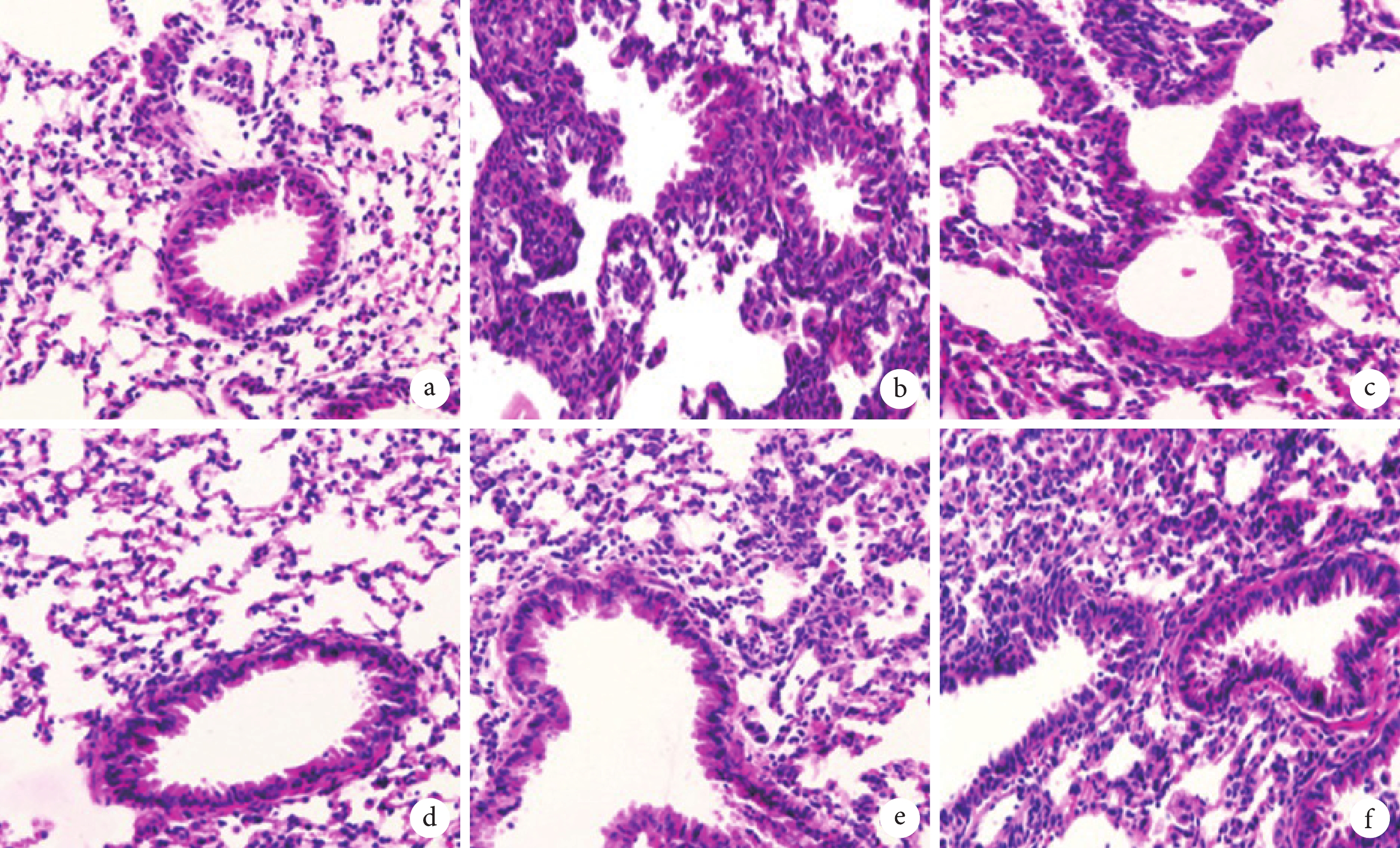
由圖1可見,對照組大鼠肺組織形態完好;模型組和LV-sh-NC組大鼠肺組織有明顯損傷,肺泡結構破損,肺泡間隔增大,明顯肺水腫和大量炎性細胞浸潤現象;LV-sh-NORAD組肺組織損傷程度顯著減輕;與LV-sh-NORAD+NC antagomir組比較,LV-sh-NORAD+miR-155-5p antagomir組肺組織損傷程度顯著加重。
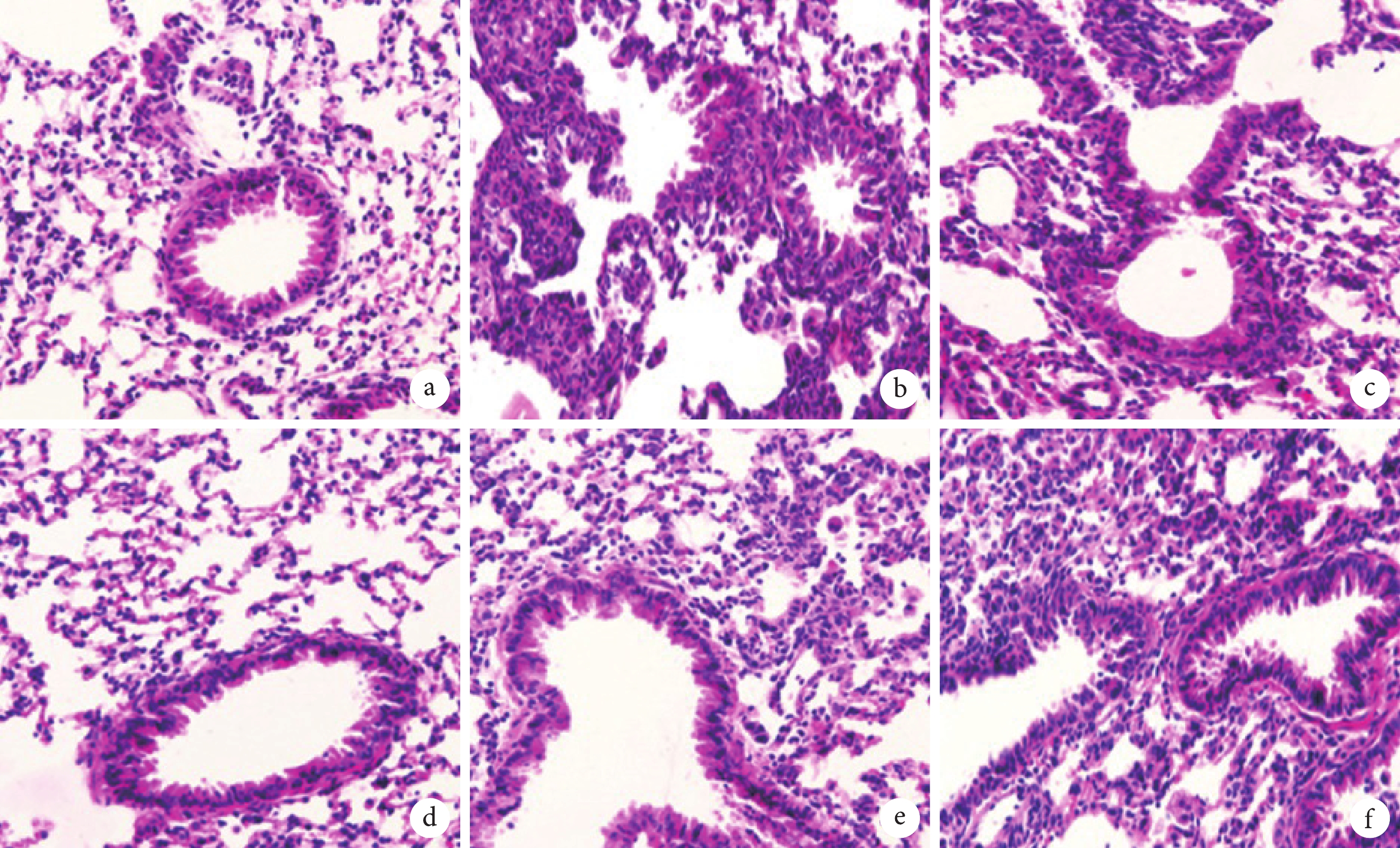 圖1
大鼠肺組織病理像(HE×200)
圖1
大鼠肺組織病理像(HE×200)
a. 對照組;b. 模型組;c. LV-sh-NC組LV-sh-NORAD組;d. LV-sh-NORAD組;e. LV-sh-NORAD+NC antagomir組;f. LV-sh-NORAD+miR-155-5p antagomir組。
2.5 各組大鼠肺組織細胞凋亡比較
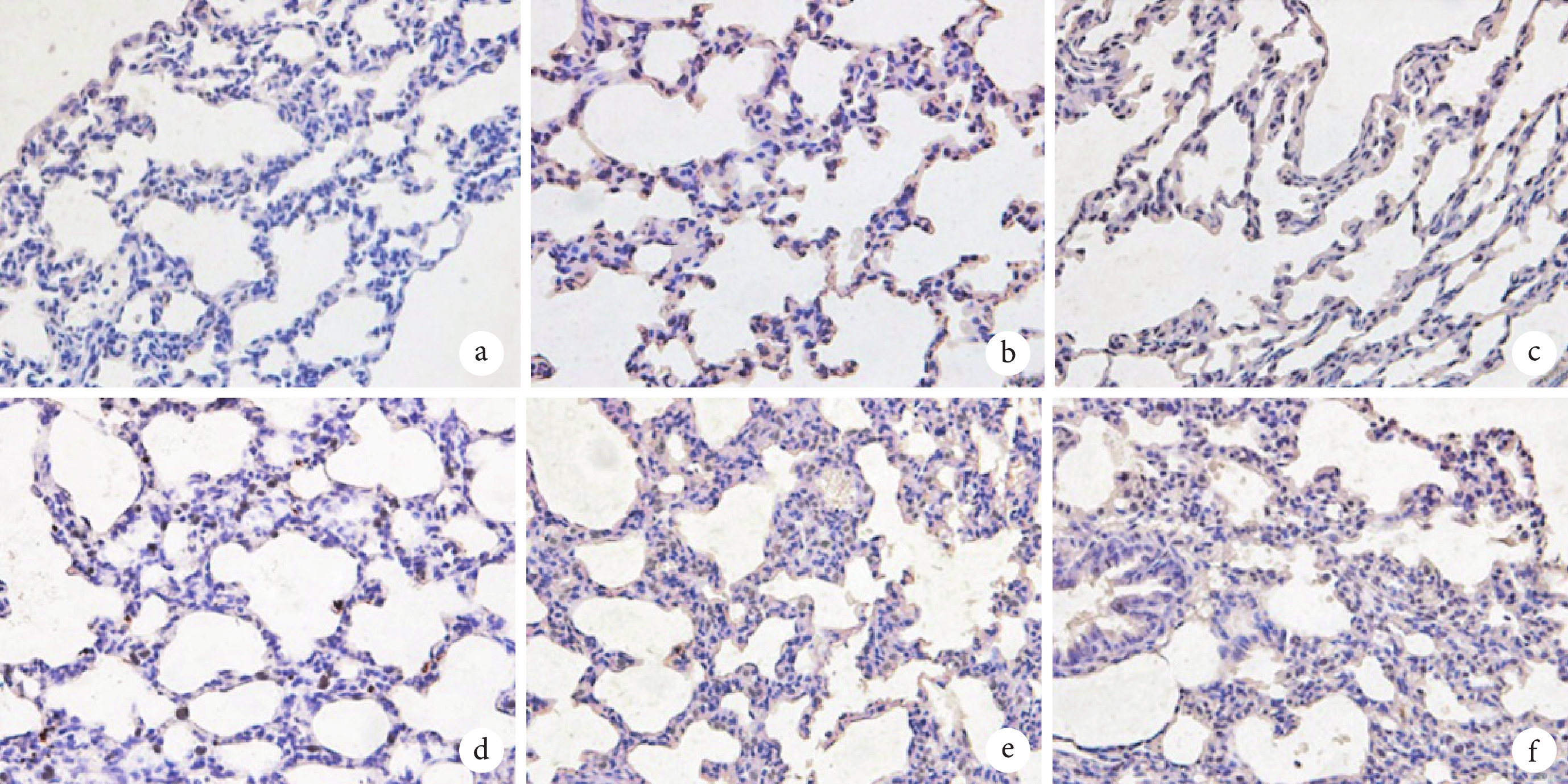
模型組和LV-sh-NC組相較于對照組大鼠肺組織細胞凋亡率顯著升高(P<0.05);LV-sh-NORAD組相較于LV-sh-NC組大鼠肺組織細胞凋亡率顯著降低(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組相較于LV-sh-NORAD+NC antagomir組大鼠肺組織細胞凋亡率顯著升高(P<0.05)。結果見圖2和表4。
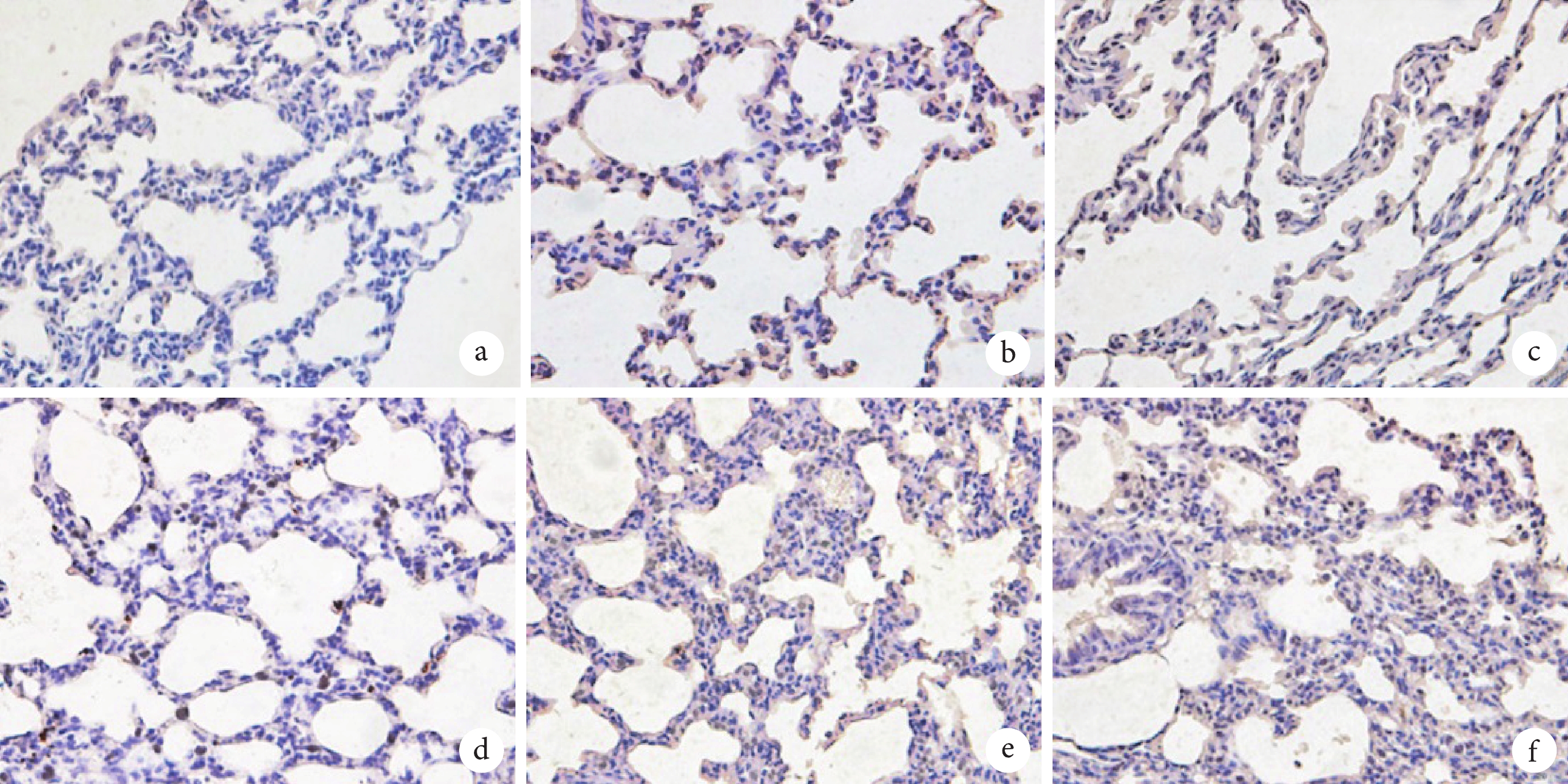 圖2
肺組織細胞凋亡病理像(TUNEL×400)
圖2
肺組織細胞凋亡病理像(TUNEL×400)
a. 對照組;b. 模型組;c. LV-sh-NC組LV-sh-NORAD組;d. LV-sh-NORAD組;e. LV-sh-NORAD+NC antagomir組;f. LV-sh-NORAD+miR-155-5p antagomir組。
2.6 各組大鼠肺組織相關蛋白表達比較
相較于對照組,模型組和LV-sh-NC組大鼠肺組織TLR6、Bax、Cleaved-caspase-3蛋白表達顯著升高,Bcl-2蛋白表達顯著降低(P<0.05);LV-sh-NORAD組相較于LV-sh-NC組大鼠肺組織TLR6、Bax、Cleaved-caspase-3蛋白表顯著降低,Bcl-2蛋白表達顯著升高(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組相較于LV-sh-NORAD+NC antagomir組大鼠肺組織TLR6、Bax、Cleaved-caspase-3蛋白表顯著升高,Bcl-2蛋白表達顯著降低(P<0.05)。結果見圖3和表5。
 圖3
各組大鼠肺組織相關蛋白表達
圖3
各組大鼠肺組織相關蛋白表達
A:對照組;B:模型組;C:LV-sh-NC組;D:LV-sh-NORAD組;E:LV-sh-NORAD+NC antagomir組;F:LV-sh-NORAD+miR-155-5p antagomir組。
2.7 雙熒光素酶報告基因檢測
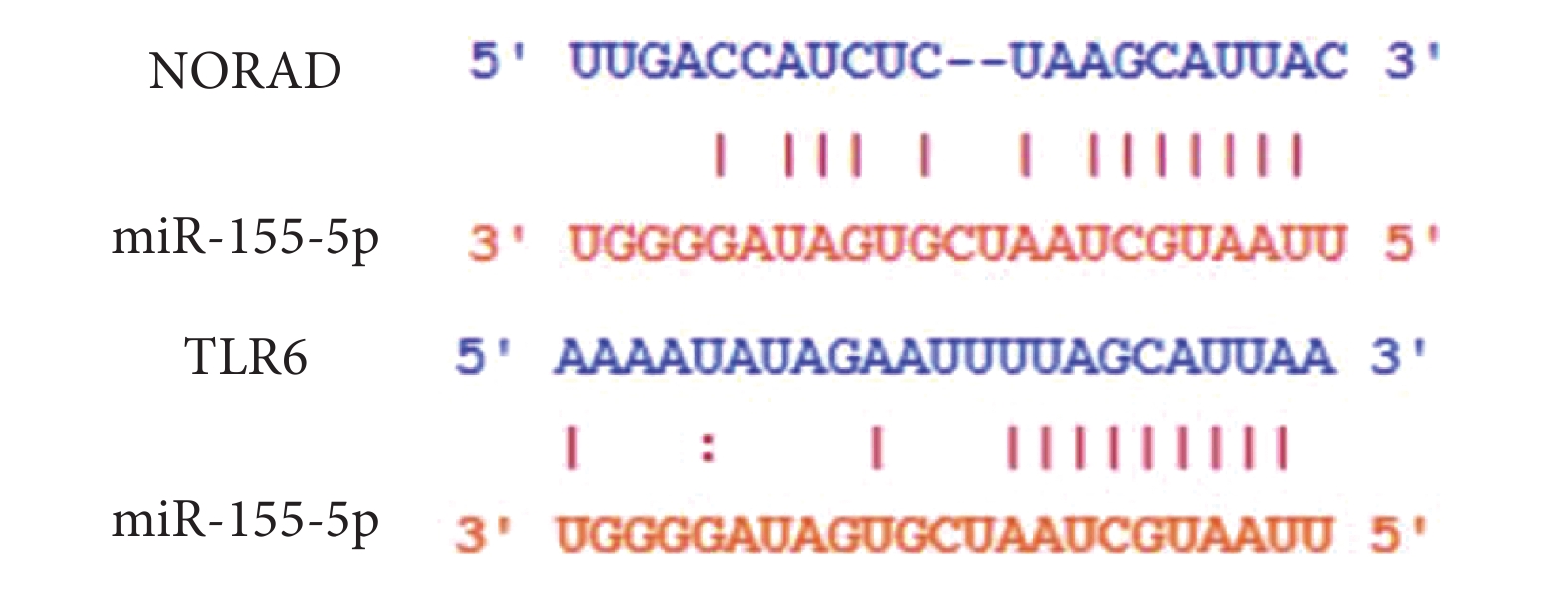
miR-155-5p與NORAD、TLR6的靶向結合位點如圖4所示。miR-155-5p mimic+NORAD-WT組熒光素酶活性低于miR-NC+NORAD-WT組(P<0.05);miR-NC+NORAD-MUT與miR-155-5p mimic+NORAD-MUT組熒光素酶活性差異無統計學意義(P>0.05)。結果見表6。miR-155-5p mimi+TLR6-WT組熒光素酶活性低于miR-NC+TLR6-WT組(P<0.05);miR-NC+TLR6-MUT組與miR-155-5p mimic+TLR6-MUT組熒光素酶活性差異無統計學意義(P>0.05)。結果見表7。
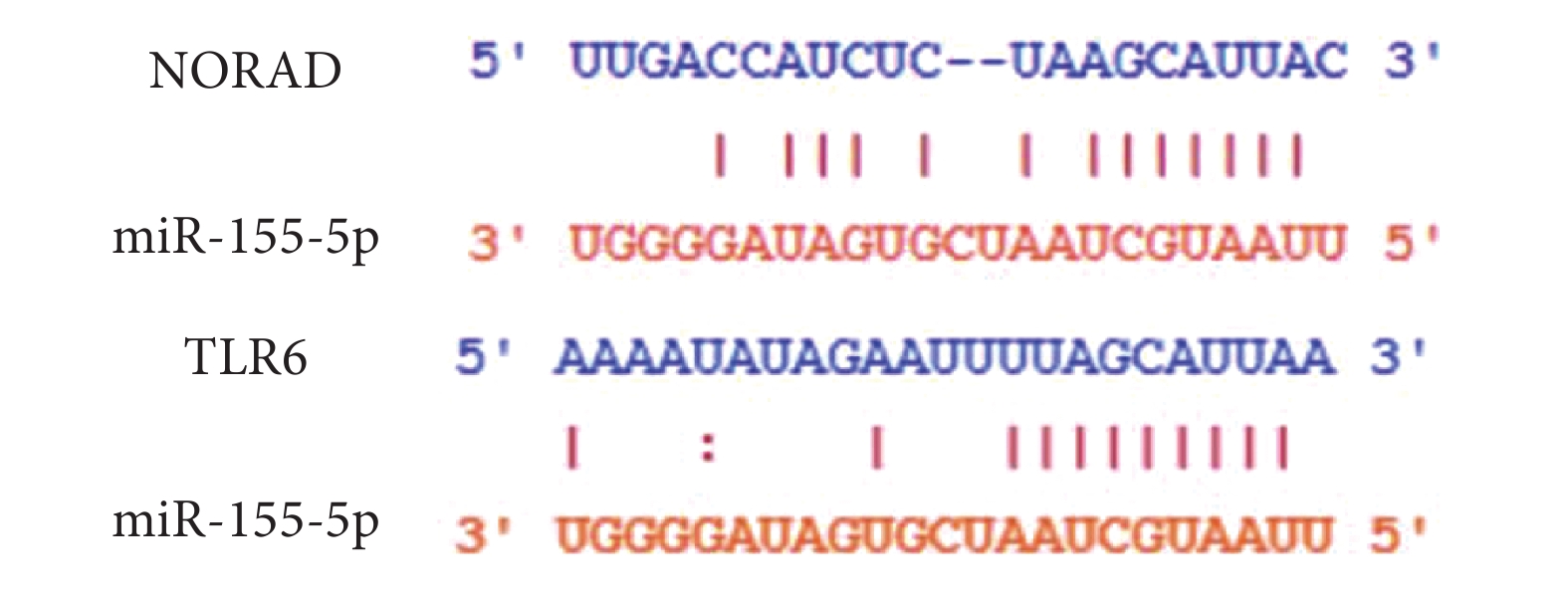 圖4
miR-155-5p與NORAD、TLR6的靶向結合位點
圖4
miR-155-5p與NORAD、TLR6的靶向結合位點
3 討論
膿毒癥是一種機體感染后引發全身感染性炎癥反應的一種疾病,膿毒癥發生后會造成機體多器官功能障礙,而ALI是膿毒癥常見并發癥[11]。ALI發生后會激活中性粒細胞及趨化因子趨向運動,進而對肺毛細血管內皮和肺泡內皮細胞造成損傷,導致液體及蛋白質滲漏,引起肺水腫,進而損壞肺的換氣功能,造成呼吸功能障礙,治療不及時導致患者死亡[12]。目前ALI的發病機制尚未研究清楚,針對ALI也無較好的治療措施和特效藥物[13],因此探究ALI的分子發病機制對治療ALI具有重要意義。
研究已證實LncRNA可調節細胞多種生理代謝過程,參與多種疾病的發生發展過程[14]。Xie等[15]研究表明負調控NORAD表達可減輕膿毒癥大鼠急性腎損傷,并降低LPS誘導的HK-3細胞炎癥和細胞凋亡,改善心肌損傷。Zhang等[16]研究表明NORAD在LPS誘導的膿毒癥細胞中高表達,沉默NORAD表達可降低炎癥反應,推測NORAD可降低組織炎癥和細胞凋亡。本研究結果顯示,膿毒癥ALI大鼠肺組織NORAD高表達,血清炎癥因子IL-1β、TNF-α、IL-8水平,W/D比值、細胞凋亡率,肺組織凋亡相關蛋白Bax、Cleaved-caspase-3表達顯著升高,抗凋亡蛋白Bcl-2表達顯著降低;沉默NORAD表達后可降低ALI大鼠炎癥反應、肺組織細胞凋亡和肺水腫,減輕肺組織損傷。以上結果提示沉默NORAD表達降低ALI大鼠炎癥,減輕肺損傷,與推測結果一致。
miRNA是一種小RNA,具有調控細胞生理代謝過程的作用。研究已證實miRNA主要通過與LncRNA和mRNA的堿基互補結合參與調控細胞生物學過程[17]。Liu等[17]研究表明外泌體miR-384-5p可減輕ALI大鼠炎癥反應、細胞凋亡和肺組織損傷。Yi等[18]研究表明過表達miR-30b-3p可預防LPS誘導的ALI。本研究結果顯示,ALI大鼠肺組織中miR-155-5p低表達,TLR6高表達,促進肺組織損傷。沉默NORAD表達后,miR-155-5p表達顯著升高,TLR6表達顯著降低,ALI大鼠肺損傷顯著減輕;在沉默NORAD表達的基礎上下調miR-155-5p表達,結果發現下調miR-155-5p表達可減弱沉默NORAD表達對ALI大鼠的改善作用;通過生物信息學發現NORAD與miR-155-5p存在靶向結合位點,熒光素酶活性實驗證實兩組有靶向關系,提示NORAD可能通過海綿化miR-155-5p表達來調控ALI大鼠肺損傷。
TLR6屬于Toll樣受體家族,TLR通過與病原體微生物相關分子模式結合可激活核因子κB(nuclear factor-κB,NF-κB)信號通路啟動炎癥反應發生[19]。Zou等[20]研究顯示抑制TLR6介導的NF-κB信號通路可減輕敗血支原體誘導的雞肺部炎癥。Khan等[21]研究顯示TLR6過表達可增強膿毒癥誘導的ALI大鼠炎癥反應。本研究結果顯示,ALI大鼠肺組織中TLR6基因和蛋白高表達,下調NORAD表達后,miR-155-5p表達升高,TLR6表達下調。當下調miR-155-5p表達時,TLR6表達上調,熒光素酶活性實驗也證實miR-155-5p與TLR6存在靶向調控關系,提示TLR6表達受miR-155-5p調控。綜合以上結果得出結論,NORAD可能通過下調miR-155-5p表達進而調控TLR6表達來影響ALI大鼠肺損傷。
綜上所述,負調控NORAD可調控miR-155-5p/TLR6分子軸減輕ALI大鼠肺水腫、炎癥反應和細胞凋亡,減輕肺損傷。調控ALI的分子機制復雜,還需要進一步深入研究。
利益沖突:本研究不涉及任何利益沖突。
膿毒癥是對感染反應失調而導致的器官功能障礙綜合征,而肺部是最先受到損傷的器官之一,急性肺損傷(acute lung injury,ALI)是膿毒癥患者死亡的常見病因[1]。ALI患者臨床主要表現為低氧血癥、呼吸困難等,發病時危及患者生命[2]。近年來隨著分子生物學的發展,從分子水平干預治療ALI逐漸成為研究熱點[3]。已證實長鏈非編碼核糖核酸(long non-coding RNA,lncRNA)參與調控細胞多種疾病的發生發展過程[4]。Zhou等[5]研究表明沉默DNA損傷激活的非編碼RNA(non-coding RNA activated by DNA damage,NORAD)可有效減輕LPS誘導的肺內皮細胞損傷。Lei等[6]研究表明NORAD在潰瘍性結腸炎大鼠結腸黏膜組織中過表達,沉默NORAD表達可降低大鼠炎癥反應、氧化應激,降低細胞凋亡。LncRNA發揮生物學作用一般是通過調控miRNA表達來實現的,miRNA在調控細胞生物學過程中發揮重要作用[7]。Lin等[8]研究表明過表達miR-155-5p可減輕呼吸機誘導肺損傷小鼠細胞凋亡和自噬,減輕肺損傷。推測miR-155-5p可降低肺損傷,而miRNA可通過與其靶基因mRNA結合來調控細胞生物學過程。Toll樣受體6(Toll-like receptor 6,TLR6)具有促進炎癥發生的作用,Wang等[9]研究表明TLR6在膿毒癥患者血液中高表達,降低TLR6表達可減輕膿毒癥誘導的炎癥反應。生物信息學顯示miR-155-5p與NORAD和TLR6存在靶向關系。因此,本研究就NORAD是否可通過調節miR-155-5p/TLR6軸來影響膿毒癥大鼠ALI進行探討。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物和細胞
選取SPF級200~230 g雄性SD大鼠60只,購自福建醫科大學[合格證號SCXK(閩)2022-0001]。小鼠肺微血管內皮細胞MHC細胞購自上海一研生物科技有限公司。本研究經福建醫科大學動物實驗中心倫理委員會審核通過(批號2022-08912)。
1.1.2 主要試劑與儀器
白細胞介素(interleukin,IL)-8、IL-1β、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)ELISA試劑盒購自河南閔翰生物科技有限公司;Trizol試劑購自上海科澄維生物科技有限公司;實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction,qRT-PCR)試劑盒購自上海威奧生物科技有限公司;胰蛋白酶購自上海莼試生物技術有限公司;CX41顯微鏡購自上海蒼茂實業有限公司;TLR6、Bax、Bcl-2、裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved cysteinyl aspartate specific proteinase 3,Cleaved-caspase-3)、β-actin一抗和二抗均購自英國Abcam公司。
1.2 方法
1.2.1 造模與分組
取50只大鼠于大鼠腹腔內注射10 mg/kg的脂多糖(lipopolysaccharide,LPS)以建立膿毒癥ALI大鼠模型[10],將建模后的大鼠隨機分為模型組、NORAD低表達空載組(LV-sh-NC組)、NORAD低表達組(LV-sh-NORAD組)、NORAD低表達+miR-155-5p低表達空載組(LV-sh-NORAD+NC antagomir)、NORAD低表達+miR-155-5p低表達組(LV-sh-NORAD+miR-155-5p antagomir),另取10只腹腔內注射生理鹽水做為對照組。LV-sh-NC組和LV-sh-NORAD組大鼠尾靜脈注射200 μL sh-NORAD慢病毒空載體(6×106 TU/mL)和200 μL sh-NORAD慢病毒載體(6×106 TU/mL),LV-sh-NORAD+NC antagomir組和LV-sh-NORAD+miR-155-5p antagomir組大鼠尾靜脈注射200 μL sh-NORAD慢病毒載體(6×106 TU/ml)后再尾靜脈注射200 μL NC antagomir和miR-155-5p antagomir質粒,對照組和模型組同等方式注射等量生理鹽水。
1.2.2 樣本采集
48 h后取大鼠外周血3 mL,4℃冰箱保存,斷頭處死大鼠,取出大鼠完整肺組織,–80℃冰箱保存待測。
1.2.3 血清IL-8、IL-β、TNF-α水平檢測
將新鮮血液離心收集血清,根據試劑盒說明書加入相應的反應試劑,終止試劑后檢測IL-8、IL-β、TNF-α水平。
1.2.4 qRT-PCR檢測肺組織中NORAD、miR-155-5p和TLR6 mRNA表達
取部分大鼠左肺組織,提取其總RNA,并逆轉錄為cDNA后,對cDNA進行熒光定量擴增。分別以GAPDH和U6為內參,計算NORAD、miR-155-5p和TLR6 mRNA的相對表達量(2–ΔΔCt方法)。引物:NORAD正向:5?-TCCCATCACCATCTTCCAGG-3?,反向5?-CCGTTGTCGTCAGGACTAGGTAGG-3?;TLR6 mRNA正向:5?-TGCAACATGAGCCAAGACAG-3?,反向5?-TTCTTGGTGGCAGGTCTTTG-3?;miR-155-5p正向:5?-GGGGTTAATGCTAATCGTGA-3?,反向5?-CAGTGCGTGTCGTGGAGT-3?;GAPDH正向:5'-CAAGGACCTCTACGCCAAC-3',反向:5'-TGGAGGCGCGATGATCTT-3'。U6正向:5'-CTCGCTTCGGCAGCACA-3',反向:5'-AACGCTTCACGAATTTGCGT-3'。
1.2.5 肺水腫評估
取大鼠右肺,清除表面水分,稱量記為濕重(wet weight,W),之后置于80℃干燥箱中烘干至恒重,稱量記為干重(dry weight,D),計算W/D值。
1.2.6 HE染色觀察肺組織形態變化
取左肺組織切片,多聚甲醛進行固定,石蠟包埋切片(4 μm),脫蠟,清洗,然后蘇木精-伊紅染色(hematoxylin-eosin staining,HE)染色,脫水后進行封片,顯微鏡觀察肺組織形態變化。
1.2.7 TUNEL法檢測肺組織細胞凋亡情況
取1.2.6中固定肺組織,包埋,切片,脫蠟,酒精梯度脫水,然后按照原位末端標記法(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)試劑盒說明書進行后續操作,觀察細胞凋亡情況。凋亡率=TUNEL陽性細胞數/總細胞數×100%。
1.2.8 免疫印跡法(Western blot)檢測大鼠肺組織中相關蛋白表達
取大鼠左肺組織低溫研磨勻漿,提取蛋白后熱水浴將其變性,電泳分離蛋白并轉移至PVDF膜上,封閉液封閉2 h,加入一抗TLR6、Bax、Bcl-2、Cleaved-caspase-3、β-actin稀釋液4℃孵育過夜,加入二抗,ECL顯色后用Image J軟件分析蛋白。
1.2.9 雙熒光素酶報告基因檢測
采用雙熒光素酶報告基因實驗驗證miR-155-5p與NORAD和TLR6的關系。構建NORAD野生型和突變型載體(NORAD-WT和NORAD-MUT),將NORAD-WT分別與miR-155-5p空載和過表達質粒共轉染于MHC細胞中,在將NORAD-MUT分別與miR-155-5p空載和過表達質粒共轉染于細胞MHC中,48 h后,檢測熒光素酶活性。構建TLR6野生型和突變型載體(TLR6-WT和TLR6-MUT),將TLR6-WT分別與miR-155-5p空載和過表達質粒共轉染于MHC細胞中,再將TLR6-MUT分別與miR-NC和miR-155-5p mimic共轉染于MHC細胞中,48 h后,檢測熒光素酶活性。
1.3 統計學方法
采用GraphPad Prism 8.0.1軟件分析數據。呈正態分布的計量資料以均數±標準差(x±s)表示,多組間比較用單因素方差分析,組內兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠血漿炎癥因子表達比較
模型組和LV-sh-NC組大鼠血清IL-1β、TNF-α、IL-8水平顯著高于對照組(P<0.05);LV-sh-NORAD組大鼠血清IL-1β、TNF-α、IL-8水平顯著低于LV-sh-NC組(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組大鼠血清IL-1β、TNF-α、IL-8水平顯著高于LV-sh-NORAD+NC antagomir組(P<0.05)。結果見表1。
2.2 各組大鼠肺組織中NORAD、miR-155-5p和TLR6基因表達比較
模型組和LV-sh-NC組大鼠肺組織中NORAD和TLR6 mRNA表達水平顯著高于對照組,miR-155-5p表達水平低于對照組(P<0.05);LV-sh-NORAD組大鼠肺組織中NORAD和TLR6 mRNA表達水平低于LV-sh-NC組,miR-155-5p表達水平顯著高于LV-sh-NC組(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組大鼠肺組織中TLR6 mRNA表達水平高于LV-sh-NORAD+NC antagomir組,miR-155-5p表達水平低于LV-sh-NORAD+NC antagomir組(P<0.05)。結果見表2。
2.3 各組大鼠W/D比值比較
模型組和LV-sh-NC組相較于對照組大鼠肺組織W/D比值顯著增大(P<0.05);LV-sh-NORAD組相較于LV-sh-NC組大鼠肺組織W/D比值顯著減小(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組相較于LV-sh-NORAD+NC antagomir 組大鼠肺組織W/D比值顯著增大(P<0.05)。結果見表3。
2.4 各組大鼠肺組織形態變化比較
由圖1可見,對照組大鼠肺組織形態完好;模型組和LV-sh-NC組大鼠肺組織有明顯損傷,肺泡結構破損,肺泡間隔增大,明顯肺水腫和大量炎性細胞浸潤現象;LV-sh-NORAD組肺組織損傷程度顯著減輕;與LV-sh-NORAD+NC antagomir組比較,LV-sh-NORAD+miR-155-5p antagomir組肺組織損傷程度顯著加重。
 圖1
大鼠肺組織病理像(HE×200)
圖1
大鼠肺組織病理像(HE×200)
a. 對照組;b. 模型組;c. LV-sh-NC組LV-sh-NORAD組;d. LV-sh-NORAD組;e. LV-sh-NORAD+NC antagomir組;f. LV-sh-NORAD+miR-155-5p antagomir組。
2.5 各組大鼠肺組織細胞凋亡比較
模型組和LV-sh-NC組相較于對照組大鼠肺組織細胞凋亡率顯著升高(P<0.05);LV-sh-NORAD組相較于LV-sh-NC組大鼠肺組織細胞凋亡率顯著降低(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組相較于LV-sh-NORAD+NC antagomir組大鼠肺組織細胞凋亡率顯著升高(P<0.05)。結果見圖2和表4。
 圖2
肺組織細胞凋亡病理像(TUNEL×400)
圖2
肺組織細胞凋亡病理像(TUNEL×400)
a. 對照組;b. 模型組;c. LV-sh-NC組LV-sh-NORAD組;d. LV-sh-NORAD組;e. LV-sh-NORAD+NC antagomir組;f. LV-sh-NORAD+miR-155-5p antagomir組。
2.6 各組大鼠肺組織相關蛋白表達比較
相較于對照組,模型組和LV-sh-NC組大鼠肺組織TLR6、Bax、Cleaved-caspase-3蛋白表達顯著升高,Bcl-2蛋白表達顯著降低(P<0.05);LV-sh-NORAD組相較于LV-sh-NC組大鼠肺組織TLR6、Bax、Cleaved-caspase-3蛋白表顯著降低,Bcl-2蛋白表達顯著升高(P<0.05);LV-sh-NORAD+miR-155-5p antagomir組相較于LV-sh-NORAD+NC antagomir組大鼠肺組織TLR6、Bax、Cleaved-caspase-3蛋白表顯著升高,Bcl-2蛋白表達顯著降低(P<0.05)。結果見圖3和表5。
 圖3
各組大鼠肺組織相關蛋白表達
圖3
各組大鼠肺組織相關蛋白表達
A:對照組;B:模型組;C:LV-sh-NC組;D:LV-sh-NORAD組;E:LV-sh-NORAD+NC antagomir組;F:LV-sh-NORAD+miR-155-5p antagomir組。
2.7 雙熒光素酶報告基因檢測
miR-155-5p與NORAD、TLR6的靶向結合位點如圖4所示。miR-155-5p mimic+NORAD-WT組熒光素酶活性低于miR-NC+NORAD-WT組(P<0.05);miR-NC+NORAD-MUT與miR-155-5p mimic+NORAD-MUT組熒光素酶活性差異無統計學意義(P>0.05)。結果見表6。miR-155-5p mimi+TLR6-WT組熒光素酶活性低于miR-NC+TLR6-WT組(P<0.05);miR-NC+TLR6-MUT組與miR-155-5p mimic+TLR6-MUT組熒光素酶活性差異無統計學意義(P>0.05)。結果見表7。
 圖4
miR-155-5p與NORAD、TLR6的靶向結合位點
圖4
miR-155-5p與NORAD、TLR6的靶向結合位點
3 討論
膿毒癥是一種機體感染后引發全身感染性炎癥反應的一種疾病,膿毒癥發生后會造成機體多器官功能障礙,而ALI是膿毒癥常見并發癥[11]。ALI發生后會激活中性粒細胞及趨化因子趨向運動,進而對肺毛細血管內皮和肺泡內皮細胞造成損傷,導致液體及蛋白質滲漏,引起肺水腫,進而損壞肺的換氣功能,造成呼吸功能障礙,治療不及時導致患者死亡[12]。目前ALI的發病機制尚未研究清楚,針對ALI也無較好的治療措施和特效藥物[13],因此探究ALI的分子發病機制對治療ALI具有重要意義。
研究已證實LncRNA可調節細胞多種生理代謝過程,參與多種疾病的發生發展過程[14]。Xie等[15]研究表明負調控NORAD表達可減輕膿毒癥大鼠急性腎損傷,并降低LPS誘導的HK-3細胞炎癥和細胞凋亡,改善心肌損傷。Zhang等[16]研究表明NORAD在LPS誘導的膿毒癥細胞中高表達,沉默NORAD表達可降低炎癥反應,推測NORAD可降低組織炎癥和細胞凋亡。本研究結果顯示,膿毒癥ALI大鼠肺組織NORAD高表達,血清炎癥因子IL-1β、TNF-α、IL-8水平,W/D比值、細胞凋亡率,肺組織凋亡相關蛋白Bax、Cleaved-caspase-3表達顯著升高,抗凋亡蛋白Bcl-2表達顯著降低;沉默NORAD表達后可降低ALI大鼠炎癥反應、肺組織細胞凋亡和肺水腫,減輕肺組織損傷。以上結果提示沉默NORAD表達降低ALI大鼠炎癥,減輕肺損傷,與推測結果一致。
miRNA是一種小RNA,具有調控細胞生理代謝過程的作用。研究已證實miRNA主要通過與LncRNA和mRNA的堿基互補結合參與調控細胞生物學過程[17]。Liu等[17]研究表明外泌體miR-384-5p可減輕ALI大鼠炎癥反應、細胞凋亡和肺組織損傷。Yi等[18]研究表明過表達miR-30b-3p可預防LPS誘導的ALI。本研究結果顯示,ALI大鼠肺組織中miR-155-5p低表達,TLR6高表達,促進肺組織損傷。沉默NORAD表達后,miR-155-5p表達顯著升高,TLR6表達顯著降低,ALI大鼠肺損傷顯著減輕;在沉默NORAD表達的基礎上下調miR-155-5p表達,結果發現下調miR-155-5p表達可減弱沉默NORAD表達對ALI大鼠的改善作用;通過生物信息學發現NORAD與miR-155-5p存在靶向結合位點,熒光素酶活性實驗證實兩組有靶向關系,提示NORAD可能通過海綿化miR-155-5p表達來調控ALI大鼠肺損傷。
TLR6屬于Toll樣受體家族,TLR通過與病原體微生物相關分子模式結合可激活核因子κB(nuclear factor-κB,NF-κB)信號通路啟動炎癥反應發生[19]。Zou等[20]研究顯示抑制TLR6介導的NF-κB信號通路可減輕敗血支原體誘導的雞肺部炎癥。Khan等[21]研究顯示TLR6過表達可增強膿毒癥誘導的ALI大鼠炎癥反應。本研究結果顯示,ALI大鼠肺組織中TLR6基因和蛋白高表達,下調NORAD表達后,miR-155-5p表達升高,TLR6表達下調。當下調miR-155-5p表達時,TLR6表達上調,熒光素酶活性實驗也證實miR-155-5p與TLR6存在靶向調控關系,提示TLR6表達受miR-155-5p調控。綜合以上結果得出結論,NORAD可能通過下調miR-155-5p表達進而調控TLR6表達來影響ALI大鼠肺損傷。
綜上所述,負調控NORAD可調控miR-155-5p/TLR6分子軸減輕ALI大鼠肺水腫、炎癥反應和細胞凋亡,減輕肺損傷。調控ALI的分子機制復雜,還需要進一步深入研究。
利益沖突:本研究不涉及任何利益沖突。