引用本文: 吳倩宇, 黃勇, 羅雯, 資梅, 張根龍, 劉一鵬. 血管介入栓塞輔助下支氣管鏡技術診斷并局部治療成人支氣管黏液表皮樣癌病例報道一例. 中國呼吸與危重監護雜志, 2024, 23(12): 882-886. doi: 10.7507/1671-6205.202409105 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
臨床資料 患者男,41歲,退伍軍人,吸煙史約20年,20支/日,否認腫瘤家族史。因“發現支氣管占位20余天”,于2024年4月16日入院。20天前患者無明顯自覺癥狀,僅在體檢時行胸部CT意外發現左肺下葉支氣管腔內實性結節影,大小約11 mm×13 mm×14 mm,邊界欠光整,考慮肺癌可能性大。再次行胸部CT增強掃描,平掃時CT值約37 HU,增強掃描呈漸進性明顯強化,CT值分別為105 HU、188 HU,肺門及縱膈未見腫大淋巴結影,傾向于腫瘤。患者入院前曾就診于兩家外院的呼吸科及腫瘤科,第一家醫院行普通支氣管鏡檢查取材,病理未見明確腫瘤性病變;第二家醫院行支氣管鏡介入技術(超聲探查術+電圈套活檢術+鉗夾術+氬氣止血術),病理顯示支氣管黏膜慢性炎,伴腺上皮鱗狀化生及增生。
入院查體:體溫36.5 ℃,脈搏99次/min,呼吸20次/min,血壓132/48 mm Hg(1 mm Hg=0.133 kPa),神志清醒,胸廓未見異常,雙側呼吸運動對稱,雙側肺部語音震顫對稱,無明顯增強或減弱,雙肺叩診呈清音,雙肺呼吸音清,未聞及干濕性啰音,心臟、腹部體查未見異常,未見杵狀指,雙下肢無水腫,肌張力正常。
實驗室檢查:常規血液檢查顯示白細胞、中性粒細胞、血紅蛋白和血小板計數正常。癌胚抗原(CEA)(1.57 g/L)、神經元特異性烯醇化酶(11.50 g/L)和鱗狀細胞癌抗原(1.45 g/L)等腫瘤標志物均在正常范圍。血清C-反應蛋白、降鈣素原、白細胞介素6、凝血酶原時間、活化部分凝血活酶時間、D-二聚體等凝血試驗均正常。
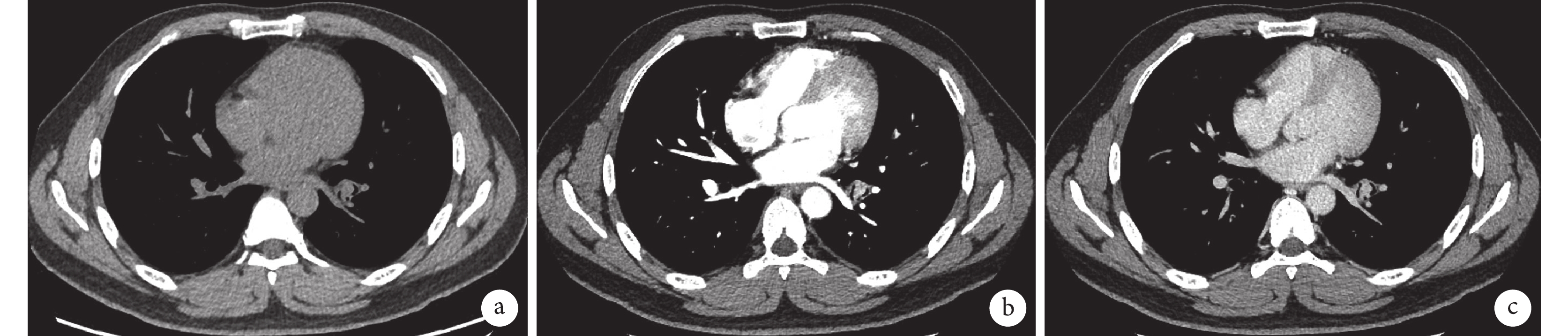
影像學檢查:胸部增強CT示左肺下葉支氣管腔內見一實性結節影,大小約11×13×14 mm,邊界欠光整,平掃CT值約37 HU(圖1a),增強掃描呈明顯強化,CT值分別為105 HU、188 HU(圖1b,1c)。CT檢查縱隔淋巴結未見腫大。
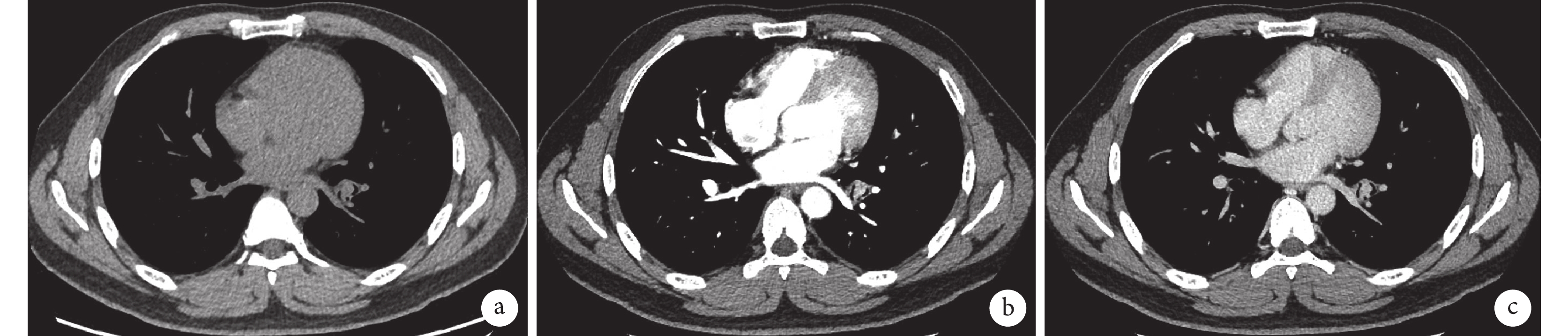 圖1
胸部增強CT像(2024-04-09)左肺下葉支氣管腔內見一實性結節影,大小約11 mm*13 mm*14 mm,邊界欠光整,平掃CT值約37 HU,增強掃描呈明顯強化,CT值分別為105 HU、188 HU
圖1
胸部增強CT像(2024-04-09)左肺下葉支氣管腔內見一實性結節影,大小約11 mm*13 mm*14 mm,邊界欠光整,平掃CT值約37 HU,增強掃描呈明顯強化,CT值分別為105 HU、188 HU
a:縱膈窗平掃;b :縱膈窗動脈期;c :縱膈窗靜脈期。
支氣管鏡檢查及病理:第一次支氣管鏡(2024-03-29):左下肺基底段支氣管新生物。病理未見明確腫瘤性病變。
第二次支氣管鏡(2024-04-10):① 左下葉基底段支氣管新生物,性質待查;② 氣管、雙側支氣管黏膜炎性改變;③ 鏡下治療(超聲探查術+灌洗術+電圈套活檢術+鉗夾術+氬氣止血術)。病理報告支氣管黏膜慢性炎,伴腺上皮鱗狀化生及增生。
第三次支氣管鏡前血管介入栓塞(2024-04-22):通過X線透視下支氣管動脈DSA造影,予PVA顆粒(規格100~300 mm )先行左支氣管責任動脈栓塞,補充推注少量明膠海綿顆粒(350 mm )后,栓塞滿意。
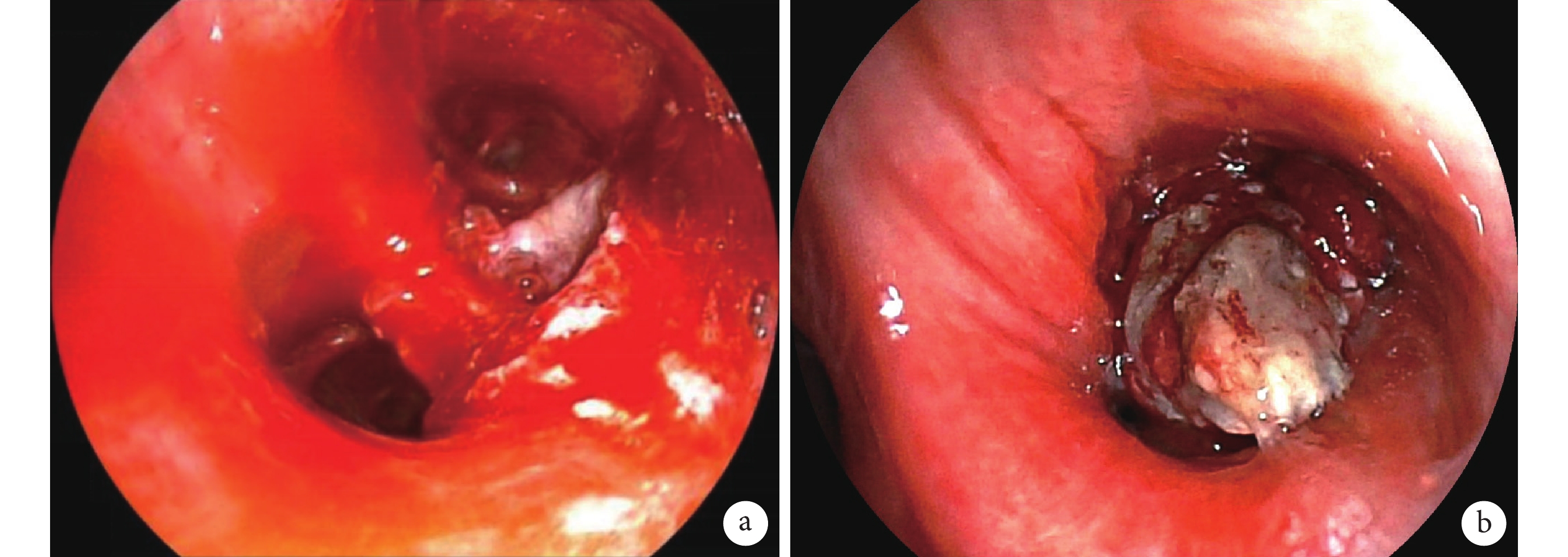
第三次支氣管鏡(2024-04-24):左下葉基底段支氣管為新生物填塞管腔絕大部分,富士電子氣管鏡EB-530H勉強可深入至各基底段開口。用高頻電圈套器反復套住左下葉基底段開口處新生物,用冷凍探頭摘取圈套下來的組織,有少量出血,予以冰鹽水、腎上腺素局部噴灑止血;視野滿意后用凍切的方法逐步清理剩余新生物,至暴露各基底段開口,術中出血均予以充分止血;在無法繼續凍切后,換用凍融的方法逐一處理新生物殘余表面組織,檢查無遺漏及出血后終止操作。(圖2a,2b)
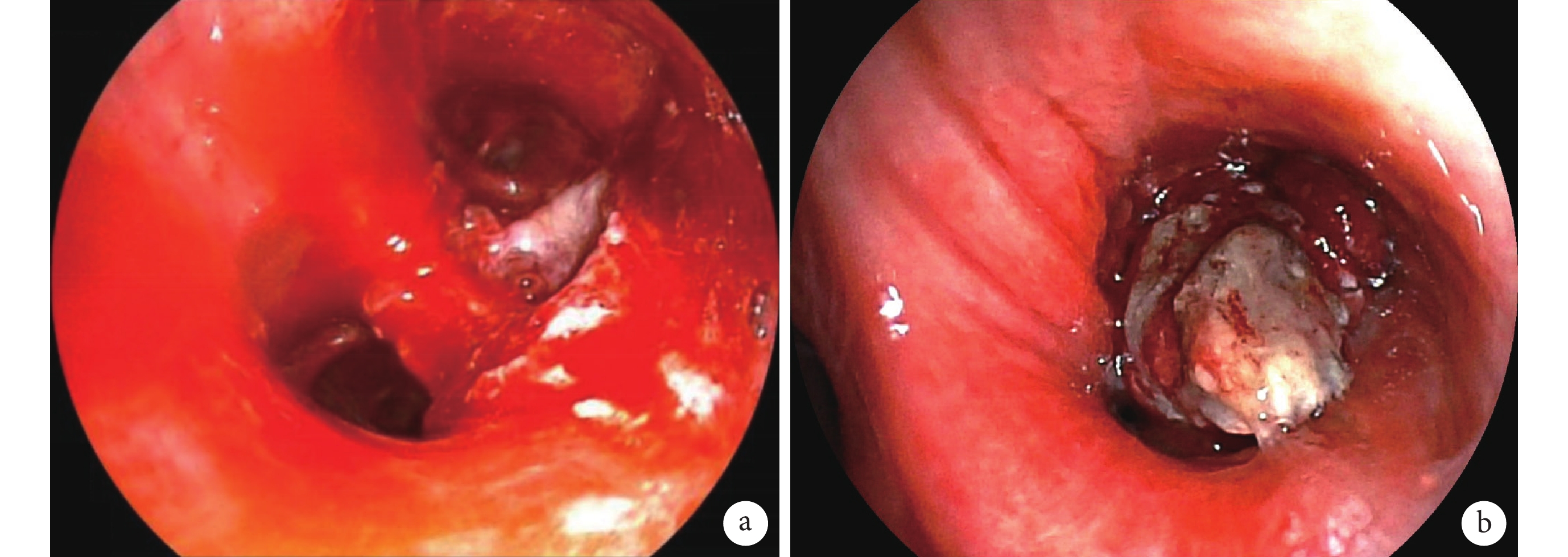 圖2
支氣管粘液表皮樣癌的介入支氣管鏡治療
圖2
支氣管粘液表皮樣癌的介入支氣管鏡治療
a:左下葉基底段支氣管內新生物;b:介入支氣管檢查及治療術后。
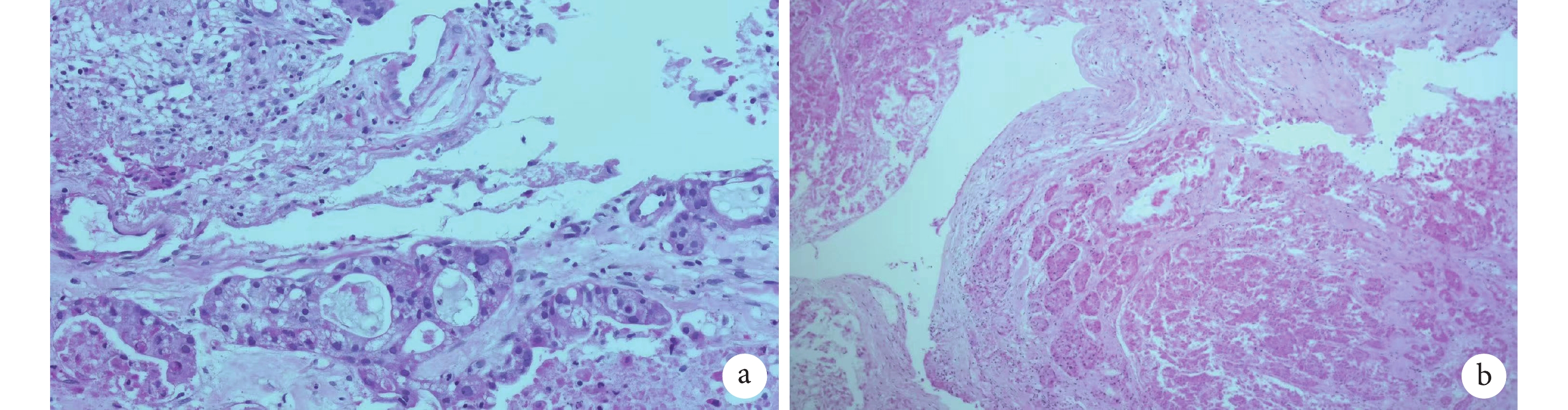
病理報告:(左肺下葉支氣管內新生物)上皮性腫瘤伴大片壞死,符合腺涎腫瘤,傾向低級別黏液表皮樣癌(Mucoepidermoid carcinoma,MEC)。(圖3a,3b)
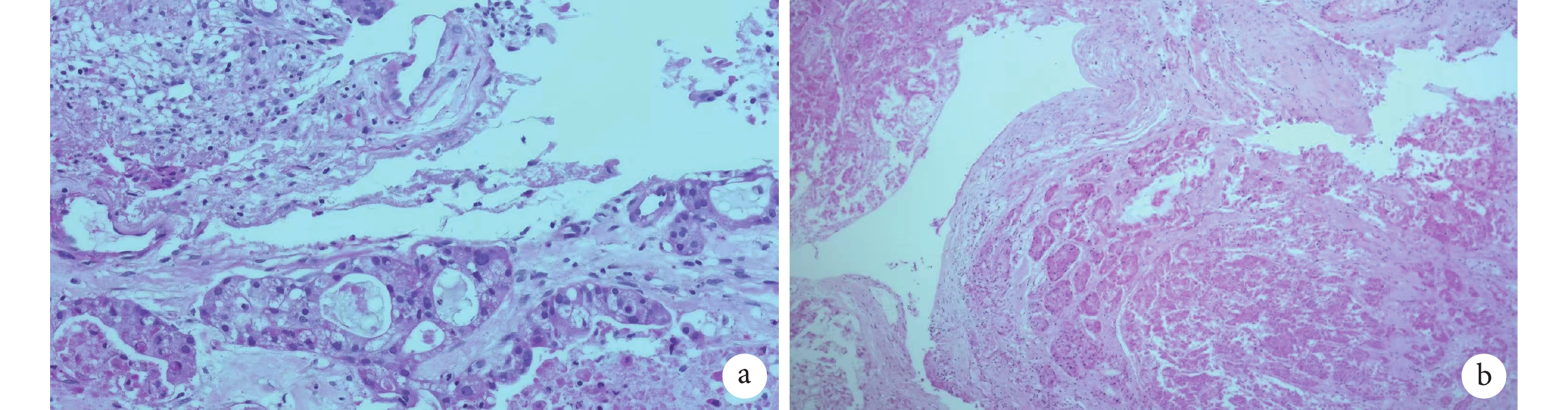 圖3
組織病理學分析
圖3
組織病理學分析
(蘇木精和伊紅染色;a:×100;b:×400) 表現出粘液表皮樣癌的特征:腫瘤由腺體、小管和囊腫組成,其中含有被纖維基質分隔的粘蛋白。
免疫組化結果:CK(+),CD31(?),D2-40(?),SMA(?),S-100(?),caldesmon(?),Calponin (?),Vimentin (部分+),Ki-67(約1%+),CD34(?),P63(少許+),P40 (?) HMB-45(?),CK5/6(部分+),Syn(?),CgA(?),TTF-1(?),NapsinA(?),CK7(+)。特殊染色結果:粘液卡紅(+),AB-PAS(+)。
入我院后通過科內病情討論,分析患者前兩次取材不滿意與其腫塊富血供有關,取材風險大導致取材不充分。隨后在血管介入科輔助下,通過X線透視下支氣管動脈DSA造影,先行左支氣管責任動脈栓塞。第三次行支氣管鏡檢查,鏡下見左下葉基底段支氣管為新生物填塞管腔絕大部分,檢查鏡勉強可深入至各基底段開口。由于提前行血管介入栓塞,術中出血少,用高頻電圈套器+凍切+凍融術,充分清理新生物,至暴露各基底段開口。術后組織取樣和組織病理學檢查證實了MEC(低級別)的診斷。
肺癌形成的實性巢團伴有黏液成分時,就容易與MEC 混淆,免疫組化有助于我們鑒別肺MEC、肺鱗癌及腺癌。肺原發 MEC 通常不表達 TTF1 和 Napsin A,而腺鱗癌里的腺癌成分這兩個抗體的表達率高,分別達到 68% 和 84%[1]。此外,腺鱗癌的 Ki-67 陽性指數一般>30% ,而絕大多數肺MEC病例中的 Ki?67 陽性指數例<10%,僅有少數高級別肺MEC 可>30%。張兵林[2]等做過類似研究,認為 TTF1、Napsin A 的陰性表達及 Ki-67 陽性指數<20% 可以作為肺唾液腺型癌的主要鑒別特征。
討論 成人支氣管黏液表皮樣癌(Mucoepidermoid carcinoma,MEC)作為一種相對罕見的肺部腫瘤類型,約占原發性肺部惡性腫瘤的0.1%~0.2%[3]。根據世界衛生組織第五版分類,屬于唾液腺腫瘤,由黏液分泌細胞、中間細胞、鱗狀上皮細胞組成[4,5]。MEC根據其組織學表現可分為低級別和高級別,其中大多數是低級別。MEC早期診斷是關鍵,由于MEC通常富血供,有患者因出血風險而貽誤診斷時間。支氣管MEC的治療通常采用傳統切除術、袖狀肺葉切除術或采用開放或視頻輔助技術進行的肺切除術。對于低級別MEC,手術切除被認為是一線治療方法,可實現完全康復、預后良好[6,7]。然而,對于腫瘤位于大氣道的氣管支氣管患者,手術切除不可避免地會損害肺功能并造成相當大的創傷,這給治療帶來了挑戰。近年來,介入支氣管鏡治療因其并發癥少、能保留肺功能而在支氣管MEC的治療中受到廣泛關注[8,9]。支氣管MEC所有年齡段都可能發病,但主要是年輕患者。Fois等[10]發表的一系列56例病例中,>50%的患者年齡在30歲以下,平均年齡為34歲。本病例是一名中青年男性患者。
由于這些腫瘤主要累及肺葉及肺段支氣管,因此其癥狀和體征與大氣道阻塞一致,即咳嗽、咯血、支氣管炎、喘息、哮喘癥狀和難愈性肺炎[11-14] 。三分之一的患者沒有癥狀。不到5%的低級別MEC擴散至淋巴結,高級別MEC通常發生遠處轉移[15]。
MEC在胸部影像上的常見表現是肺葉或節段管腔內有結節,常伴有阻塞,即阻塞性肺炎/肺膿腫、亞段性肺不張、粘液嵌塞和阻塞性肺氣腫[16]。腫瘤的外觀包括環形或隆起的軟組織結節,邊緣光滑或息肉狀[17]。Ban等[18]報道MEC通常呈肺門型、邊緣清晰、形狀規則、異質對比增強明顯。MEC可見斑片狀低密度區,鈣化發生率較低[19]。高級別MEC可能具有不均勻的密度、小葉輪廓和邊界不清的特征[20]。Chen等[21]揭示了肺MEC具有囊性空腔的罕見體征,這可能表明早期和快速轉移。本病例中,患者的胸部CT左肺下葉支氣管腔內見一實性結節影,邊界欠光整,增強掃描呈漸進性、明顯強化。
可彎曲支氣管鏡是MEC的主要診斷工具,因為它可以直接觀察病變和活檢。 MEC腫瘤的纖維支氣管鏡視圖通常顯示為有蒂、息肉狀、光滑、外生性腫塊,血管豐富[22]。p63、EMA、細胞角蛋白(CK)7、CK5/6免疫染色呈陽性,TTF-1、SMA、S100和鈣調蛋白呈陰性[23,24]。在MEC病例中,CRTC1/CRTC3-MAML2融合轉錄物的比例約為33.7%~69.7%[25]。多項研究表明融合可能預示著更好的預后[25,26]。然而,隨后的一些研究表明,融合在高級別病例中可能很少發生[27],并且與腫瘤級別或生存率無關[28,29]。
MEC的預后取決于病理分級和TNM分期。與高級別 MEC 相比,低級別 MEC 的預后良好[30]。Shen等[31]對45名患者的回顧性研究顯示,總體5年生存率為100%,而TNM I期和II-IV期的生存率為69.1%,低危人群的3年生存率為100%。低級別患者vs高級別患者81.8%。高齡、大病灶、轉移、高ki-67指數和分化差被認為是生存較差的獨立預后因素[32,33]。Komiya等的研究提示主支氣管或上葉腫瘤顯著降低5年疾病特異性生存率[34]。
本例患者在行血管介入栓塞輔助下,第三次支氣管鏡最終確診MEC(低級別),TNM分期為 IA期。患者在確診后,返回當地醫院行左肺下葉切除術,術后恢復良好。
目前,手術切除仍是支氣管MEC的一線治療方法。手術切除低級別MEC可使其完全康復,預后良好[6,7,35]。然而,由于 MEC 通常生長在大氣道中,手術可能會導致肺功能顯著喪失,并伴有嚴重的術后并發癥。此外,大氣道中的腫瘤可能會導致嚴重的呼吸窘迫,從而使患者不適合手術。近年來,支氣管鏡介入治療MEC患者受到廣泛關注。可以進行多種支氣管鏡干預措施,包括硬性支氣管鏡檢查、氬離子凝固、CO2冷凍療法和電環療法來去除腫塊。張等[36]報道了支氣管鏡干預對于患有罕見支氣管鏡相關并發癥的低度氣管內MEC患者的有效性和安全性。Yang等[37]報道了4例經支氣管鏡切除的低級別MEC患兒。術中及術后無大出血、氣胸發生。Chen等[38]回顧性分析了11例成年支氣管MEC患者,發現所有患者經過支氣管鏡介入治療后癥狀均明顯改善,且無嚴重并發癥如出血、氣胸或縱隔氣腫。Kim等[39]收集了原發性肺唾液腺型腫瘤患者,其中12例MEC患者,發現低級別MEC患者的手術組和支氣管鏡干預組的總生存率無顯著差異。對于更嚴重的病例,五分之一的患者因呼吸窘迫而需要支氣管鏡干預作為術前的過渡治療。此外,已有多個病例報告表明介入支氣管鏡治療支氣管MEC具有良好的效果[40,41]。Ding等[42]報道一例介入支氣管鏡可以成功根除腫瘤,并在沒有明顯創傷的情況下為患者提供良好的預后。雖然這些回顧性研究樣本量較小,且只有少數病例報告討論支氣管鏡介入治療作為MEC的主要治療方法,但我們認為,對于低級別MEC,由于其通常是淺表且局限于支氣管,支氣管鏡介入治療完全可以治療低級別MEC。根除腫塊,并發癥少,保留肺功能,預后與手術相似。本例患者在第三次明確診斷的支氣管鏡時已經基本處理干凈腫瘤病灶,繼續支氣管鏡隨訪和必要的腔內治療也是可選方案,尤其是不能耐受或不愿外科手術的患者。對于高級別支氣管MEC,介入支氣管鏡治療可以作為術前的橋梁治療,快速緩解危及生命的阻塞。對于有遠處轉移的支氣管MEC,支氣管鏡干預可以顯著緩解患者的呼吸窘迫,提高生活質量。
血管介入栓塞輔助治療可以減少支氣管鏡介入技術風險,減少并發癥,且避免肺功能喪失,因此在支氣管MEC的治療中有望得到更多應用,特別是支氣管低級別MEC。需要更多更大樣本的前瞻性研究來進一步評估其有效性和安全性。
利益沖突:本研究不涉及任何利益沖突。
臨床資料 患者男,41歲,退伍軍人,吸煙史約20年,20支/日,否認腫瘤家族史。因“發現支氣管占位20余天”,于2024年4月16日入院。20天前患者無明顯自覺癥狀,僅在體檢時行胸部CT意外發現左肺下葉支氣管腔內實性結節影,大小約11 mm×13 mm×14 mm,邊界欠光整,考慮肺癌可能性大。再次行胸部CT增強掃描,平掃時CT值約37 HU,增強掃描呈漸進性明顯強化,CT值分別為105 HU、188 HU,肺門及縱膈未見腫大淋巴結影,傾向于腫瘤。患者入院前曾就診于兩家外院的呼吸科及腫瘤科,第一家醫院行普通支氣管鏡檢查取材,病理未見明確腫瘤性病變;第二家醫院行支氣管鏡介入技術(超聲探查術+電圈套活檢術+鉗夾術+氬氣止血術),病理顯示支氣管黏膜慢性炎,伴腺上皮鱗狀化生及增生。
入院查體:體溫36.5 ℃,脈搏99次/min,呼吸20次/min,血壓132/48 mm Hg(1 mm Hg=0.133 kPa),神志清醒,胸廓未見異常,雙側呼吸運動對稱,雙側肺部語音震顫對稱,無明顯增強或減弱,雙肺叩診呈清音,雙肺呼吸音清,未聞及干濕性啰音,心臟、腹部體查未見異常,未見杵狀指,雙下肢無水腫,肌張力正常。
實驗室檢查:常規血液檢查顯示白細胞、中性粒細胞、血紅蛋白和血小板計數正常。癌胚抗原(CEA)(1.57 g/L)、神經元特異性烯醇化酶(11.50 g/L)和鱗狀細胞癌抗原(1.45 g/L)等腫瘤標志物均在正常范圍。血清C-反應蛋白、降鈣素原、白細胞介素6、凝血酶原時間、活化部分凝血活酶時間、D-二聚體等凝血試驗均正常。
影像學檢查:胸部增強CT示左肺下葉支氣管腔內見一實性結節影,大小約11×13×14 mm,邊界欠光整,平掃CT值約37 HU(圖1a),增強掃描呈明顯強化,CT值分別為105 HU、188 HU(圖1b,1c)。CT檢查縱隔淋巴結未見腫大。
 圖1
胸部增強CT像(2024-04-09)左肺下葉支氣管腔內見一實性結節影,大小約11 mm*13 mm*14 mm,邊界欠光整,平掃CT值約37 HU,增強掃描呈明顯強化,CT值分別為105 HU、188 HU
圖1
胸部增強CT像(2024-04-09)左肺下葉支氣管腔內見一實性結節影,大小約11 mm*13 mm*14 mm,邊界欠光整,平掃CT值約37 HU,增強掃描呈明顯強化,CT值分別為105 HU、188 HU
a:縱膈窗平掃;b :縱膈窗動脈期;c :縱膈窗靜脈期。
支氣管鏡檢查及病理:第一次支氣管鏡(2024-03-29):左下肺基底段支氣管新生物。病理未見明確腫瘤性病變。
第二次支氣管鏡(2024-04-10):① 左下葉基底段支氣管新生物,性質待查;② 氣管、雙側支氣管黏膜炎性改變;③ 鏡下治療(超聲探查術+灌洗術+電圈套活檢術+鉗夾術+氬氣止血術)。病理報告支氣管黏膜慢性炎,伴腺上皮鱗狀化生及增生。
第三次支氣管鏡前血管介入栓塞(2024-04-22):通過X線透視下支氣管動脈DSA造影,予PVA顆粒(規格100~300 mm )先行左支氣管責任動脈栓塞,補充推注少量明膠海綿顆粒(350 mm )后,栓塞滿意。
第三次支氣管鏡(2024-04-24):左下葉基底段支氣管為新生物填塞管腔絕大部分,富士電子氣管鏡EB-530H勉強可深入至各基底段開口。用高頻電圈套器反復套住左下葉基底段開口處新生物,用冷凍探頭摘取圈套下來的組織,有少量出血,予以冰鹽水、腎上腺素局部噴灑止血;視野滿意后用凍切的方法逐步清理剩余新生物,至暴露各基底段開口,術中出血均予以充分止血;在無法繼續凍切后,換用凍融的方法逐一處理新生物殘余表面組織,檢查無遺漏及出血后終止操作。(圖2a,2b)
 圖2
支氣管粘液表皮樣癌的介入支氣管鏡治療
圖2
支氣管粘液表皮樣癌的介入支氣管鏡治療
a:左下葉基底段支氣管內新生物;b:介入支氣管檢查及治療術后。
病理報告:(左肺下葉支氣管內新生物)上皮性腫瘤伴大片壞死,符合腺涎腫瘤,傾向低級別黏液表皮樣癌(Mucoepidermoid carcinoma,MEC)。(圖3a,3b)
 圖3
組織病理學分析
圖3
組織病理學分析
(蘇木精和伊紅染色;a:×100;b:×400) 表現出粘液表皮樣癌的特征:腫瘤由腺體、小管和囊腫組成,其中含有被纖維基質分隔的粘蛋白。
免疫組化結果:CK(+),CD31(?),D2-40(?),SMA(?),S-100(?),caldesmon(?),Calponin (?),Vimentin (部分+),Ki-67(約1%+),CD34(?),P63(少許+),P40 (?) HMB-45(?),CK5/6(部分+),Syn(?),CgA(?),TTF-1(?),NapsinA(?),CK7(+)。特殊染色結果:粘液卡紅(+),AB-PAS(+)。
入我院后通過科內病情討論,分析患者前兩次取材不滿意與其腫塊富血供有關,取材風險大導致取材不充分。隨后在血管介入科輔助下,通過X線透視下支氣管動脈DSA造影,先行左支氣管責任動脈栓塞。第三次行支氣管鏡檢查,鏡下見左下葉基底段支氣管為新生物填塞管腔絕大部分,檢查鏡勉強可深入至各基底段開口。由于提前行血管介入栓塞,術中出血少,用高頻電圈套器+凍切+凍融術,充分清理新生物,至暴露各基底段開口。術后組織取樣和組織病理學檢查證實了MEC(低級別)的診斷。
肺癌形成的實性巢團伴有黏液成分時,就容易與MEC 混淆,免疫組化有助于我們鑒別肺MEC、肺鱗癌及腺癌。肺原發 MEC 通常不表達 TTF1 和 Napsin A,而腺鱗癌里的腺癌成分這兩個抗體的表達率高,分別達到 68% 和 84%[1]。此外,腺鱗癌的 Ki-67 陽性指數一般>30% ,而絕大多數肺MEC病例中的 Ki?67 陽性指數例<10%,僅有少數高級別肺MEC 可>30%。張兵林[2]等做過類似研究,認為 TTF1、Napsin A 的陰性表達及 Ki-67 陽性指數<20% 可以作為肺唾液腺型癌的主要鑒別特征。
討論 成人支氣管黏液表皮樣癌(Mucoepidermoid carcinoma,MEC)作為一種相對罕見的肺部腫瘤類型,約占原發性肺部惡性腫瘤的0.1%~0.2%[3]。根據世界衛生組織第五版分類,屬于唾液腺腫瘤,由黏液分泌細胞、中間細胞、鱗狀上皮細胞組成[4,5]。MEC根據其組織學表現可分為低級別和高級別,其中大多數是低級別。MEC早期診斷是關鍵,由于MEC通常富血供,有患者因出血風險而貽誤診斷時間。支氣管MEC的治療通常采用傳統切除術、袖狀肺葉切除術或采用開放或視頻輔助技術進行的肺切除術。對于低級別MEC,手術切除被認為是一線治療方法,可實現完全康復、預后良好[6,7]。然而,對于腫瘤位于大氣道的氣管支氣管患者,手術切除不可避免地會損害肺功能并造成相當大的創傷,這給治療帶來了挑戰。近年來,介入支氣管鏡治療因其并發癥少、能保留肺功能而在支氣管MEC的治療中受到廣泛關注[8,9]。支氣管MEC所有年齡段都可能發病,但主要是年輕患者。Fois等[10]發表的一系列56例病例中,>50%的患者年齡在30歲以下,平均年齡為34歲。本病例是一名中青年男性患者。
由于這些腫瘤主要累及肺葉及肺段支氣管,因此其癥狀和體征與大氣道阻塞一致,即咳嗽、咯血、支氣管炎、喘息、哮喘癥狀和難愈性肺炎[11-14] 。三分之一的患者沒有癥狀。不到5%的低級別MEC擴散至淋巴結,高級別MEC通常發生遠處轉移[15]。
MEC在胸部影像上的常見表現是肺葉或節段管腔內有結節,常伴有阻塞,即阻塞性肺炎/肺膿腫、亞段性肺不張、粘液嵌塞和阻塞性肺氣腫[16]。腫瘤的外觀包括環形或隆起的軟組織結節,邊緣光滑或息肉狀[17]。Ban等[18]報道MEC通常呈肺門型、邊緣清晰、形狀規則、異質對比增強明顯。MEC可見斑片狀低密度區,鈣化發生率較低[19]。高級別MEC可能具有不均勻的密度、小葉輪廓和邊界不清的特征[20]。Chen等[21]揭示了肺MEC具有囊性空腔的罕見體征,這可能表明早期和快速轉移。本病例中,患者的胸部CT左肺下葉支氣管腔內見一實性結節影,邊界欠光整,增強掃描呈漸進性、明顯強化。
可彎曲支氣管鏡是MEC的主要診斷工具,因為它可以直接觀察病變和活檢。 MEC腫瘤的纖維支氣管鏡視圖通常顯示為有蒂、息肉狀、光滑、外生性腫塊,血管豐富[22]。p63、EMA、細胞角蛋白(CK)7、CK5/6免疫染色呈陽性,TTF-1、SMA、S100和鈣調蛋白呈陰性[23,24]。在MEC病例中,CRTC1/CRTC3-MAML2融合轉錄物的比例約為33.7%~69.7%[25]。多項研究表明融合可能預示著更好的預后[25,26]。然而,隨后的一些研究表明,融合在高級別病例中可能很少發生[27],并且與腫瘤級別或生存率無關[28,29]。
MEC的預后取決于病理分級和TNM分期。與高級別 MEC 相比,低級別 MEC 的預后良好[30]。Shen等[31]對45名患者的回顧性研究顯示,總體5年生存率為100%,而TNM I期和II-IV期的生存率為69.1%,低危人群的3年生存率為100%。低級別患者vs高級別患者81.8%。高齡、大病灶、轉移、高ki-67指數和分化差被認為是生存較差的獨立預后因素[32,33]。Komiya等的研究提示主支氣管或上葉腫瘤顯著降低5年疾病特異性生存率[34]。
本例患者在行血管介入栓塞輔助下,第三次支氣管鏡最終確診MEC(低級別),TNM分期為 IA期。患者在確診后,返回當地醫院行左肺下葉切除術,術后恢復良好。
目前,手術切除仍是支氣管MEC的一線治療方法。手術切除低級別MEC可使其完全康復,預后良好[6,7,35]。然而,由于 MEC 通常生長在大氣道中,手術可能會導致肺功能顯著喪失,并伴有嚴重的術后并發癥。此外,大氣道中的腫瘤可能會導致嚴重的呼吸窘迫,從而使患者不適合手術。近年來,支氣管鏡介入治療MEC患者受到廣泛關注。可以進行多種支氣管鏡干預措施,包括硬性支氣管鏡檢查、氬離子凝固、CO2冷凍療法和電環療法來去除腫塊。張等[36]報道了支氣管鏡干預對于患有罕見支氣管鏡相關并發癥的低度氣管內MEC患者的有效性和安全性。Yang等[37]報道了4例經支氣管鏡切除的低級別MEC患兒。術中及術后無大出血、氣胸發生。Chen等[38]回顧性分析了11例成年支氣管MEC患者,發現所有患者經過支氣管鏡介入治療后癥狀均明顯改善,且無嚴重并發癥如出血、氣胸或縱隔氣腫。Kim等[39]收集了原發性肺唾液腺型腫瘤患者,其中12例MEC患者,發現低級別MEC患者的手術組和支氣管鏡干預組的總生存率無顯著差異。對于更嚴重的病例,五分之一的患者因呼吸窘迫而需要支氣管鏡干預作為術前的過渡治療。此外,已有多個病例報告表明介入支氣管鏡治療支氣管MEC具有良好的效果[40,41]。Ding等[42]報道一例介入支氣管鏡可以成功根除腫瘤,并在沒有明顯創傷的情況下為患者提供良好的預后。雖然這些回顧性研究樣本量較小,且只有少數病例報告討論支氣管鏡介入治療作為MEC的主要治療方法,但我們認為,對于低級別MEC,由于其通常是淺表且局限于支氣管,支氣管鏡介入治療完全可以治療低級別MEC。根除腫塊,并發癥少,保留肺功能,預后與手術相似。本例患者在第三次明確診斷的支氣管鏡時已經基本處理干凈腫瘤病灶,繼續支氣管鏡隨訪和必要的腔內治療也是可選方案,尤其是不能耐受或不愿外科手術的患者。對于高級別支氣管MEC,介入支氣管鏡治療可以作為術前的橋梁治療,快速緩解危及生命的阻塞。對于有遠處轉移的支氣管MEC,支氣管鏡干預可以顯著緩解患者的呼吸窘迫,提高生活質量。
血管介入栓塞輔助治療可以減少支氣管鏡介入技術風險,減少并發癥,且避免肺功能喪失,因此在支氣管MEC的治療中有望得到更多應用,特別是支氣管低級別MEC。需要更多更大樣本的前瞻性研究來進一步評估其有效性和安全性。
利益沖突:本研究不涉及任何利益沖突。