引用本文: 馬興媛, 王浙, 王帥陽, 田野, 李婧, 謝蓓, 馬彬, 李林靜. piRNAs表達失調作為癌癥潛在診斷標志物的價值:一項系統評價和 Meta 分析. 中國循證醫學雜志, 2024, 24(2): 164-174. doi: 10.7507/1672-2531.202309004 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
癌癥是世界范圍內的主要公共衛生問題[1],其發病率和死亡率正在迅速增長。世界衛生組織下屬國際癌癥研究機構公布的數據顯示,2020年全球新增約1 930萬癌癥病例,癌癥死亡人數達1 000萬,相比于2019年(1 810萬和960萬)進一步增加[2]。臨床上,許多類型的癌癥在早期無特定的癥狀,常常在疾病晚期階段被診斷出來,導致治療效果不佳,如果能夠早期發現,將極大改善患者的預后[3]。目前,癌癥診斷的金標準是組織學評估,然而其侵入性和風險性等因素限制了其在早期診斷中的應用。雖然影像學篩查試驗(如低劑量計算機斷層掃描)可以有效檢測微小腫瘤,然而仍存在過度診斷和多次累積輻射的問題[4]。在臨床實踐中,已有一些血清生物標志物[如癌胚抗原(CEA)、糖類抗原199(CA 199)、甲胎蛋白(AFP)]用于癌癥診斷,但它們的敏感性和特異性較低[5]。因此,需要尋找具有高特異性和敏感性、高性價比和非侵入性生物標志物以便準確、早期診斷癌癥。
Piwi相互作用RNA(PIWI-interacting RNA,piRNA)是一類長度為26~31個核苷酸的新型小非編碼RNA,主要因其在生殖細胞的維持中發揮重要作用受到關注[6]。最近研究表明,piRNA廣泛存在于哺乳動物體細胞中,包括癌細胞[7],并且發現以癌癥特異性的方式在各種組織類型中表達。已在腎臟、甲狀腺、子宮、乳腺癌和胃癌組織中檢測到失調的piRNA[8]。此外,新出現的證據表明piRNA可通過調控轉錄和轉錄后水平的基因表達,影響腫瘤細胞的增殖、遷移、侵襲、干細胞維持和耐藥[9,10]。值得注意的是,piRNA在人體體液中非常穩定,不易被核糖核酸酶降解[11,12]。這些結果表明piRNA可能是診斷癌癥的有希望的新型生物標志物[13]。當前,越來越多的研究者致力于研究piRNA在癌癥檢測中的診斷價值,然而結果并不一致。例如,Iliev等[14]報道,piR-823在ccRCC診斷中具有89%的敏感性和78%的特異性,而相同的生物標志物在ESCC中僅具有63%的敏感性和77%的特異性[15],部分可歸因于研究納入的樣本量、種族、標本類型和piRNA譜的差異。因此,在將piRNA應用于臨床之前,迫切需要對其在癌癥中的診斷價值進行全面分析和評價。在此,我們全面檢索已發表的文獻,收集所有公開發表的研究數據,使用Meta分析的方法系統評估piRNA對癌癥的診斷效能,為臨床實踐提供證據,同時分析可能導致研究間異質性的來源,為piRNA臨床轉化及其未來的研究設計提供參考。
1 資料與方法
本系統評價方案已在PROSPERO注冊(編號:CRD42023425604)。Meta分析的工作流程和方法基于診斷準確性試驗的系統評價/Meta分析報告規范(PRISMA-DTA)[16]和《Cochrane診斷測試準確性系統評價手冊》[17]進行。
1.1 納入和排除標準
1.1.1 研究類型
納入評估piRNA對癌癥診斷準確性的觀察性研究,包括回顧性研究和前瞻性研究。
1.1.2 研究對象
納入癌癥患者均經組織病理學檢查(金標準)確診,本研究并未對年齡、性別、種族或TNM分期進行限制。
1.1.3 干預措施
測量取自手術或治療前的腫瘤組織、血液或其他體液中的piRNA表達水平。
1.1.4 結局指標
敏感度(sensitivity,SEN)、特異度(specificity,SPE)、診斷比值比(diagnostic odds ratio,DOR)、陽性似然比(positive likelihood ratio,PLR)、陰性似然比(negative likelihood ratio,NLR)、綜合受試者工作特征曲線(summary receiver operating characteristic curve,SROC)下面積(area under the curve,AUC)。
1.1.5 排除標準
① 非中文、英文文獻;② 無法獲取原文的研究。
1.2 檢索策略
計算機檢索PubMed、Web of Science、Embase、Cochrane library、CNKI、WanFang Data、VIP和CBM數據庫,搜集piRNA診斷癌癥的相關研究,檢索時限均從建庫至2023年4月。同時,手工檢索納入研究或相關綜述中的參考文獻列表,以獲得在初始檢索中可能遺漏的其他有價值的文章。使用“piwi-interacting RNA”和“neoplasms”這兩類檢索詞進行檢索。檢索策略采用自由詞和主題詞結合的方式,并根據不同數據庫進行調整。PubMed檢索策略詳見附件框1。
1.3 文獻篩選
兩位作者將從各個數據庫檢索到的文獻導出到Endnote X9文獻管理軟件中,并刪除重復項。首先,通過瀏覽標題和摘要進行初篩,剔除明顯不相關的文獻。其次,對初篩的文獻進行全文閱讀,篩選出符合納入排除標準的文獻。整個篩選過程由兩位作者(馬興媛和王帥陽)獨立進行,最終進行交叉核對,分歧內容由第三方(王浙)協助判斷。
1.4 數據提取
兩位作者(馬興媛和王帥陽)從每項納入的研究中獨立提取資料,包括第一作者、出版國家、發表年份、癌癥類型、piRNA譜、piRNA的表達、樣本量(病例/對照)、對照類型、檢測方法、樣本來源和Meta分析所需的數據[截斷值、SEN、SPE、真陽性(TP)、真陰性(TN)、假陽性(FP)、假陰性(FN)]。如果一項研究報告了兩種或兩種以上不同類型的piRNA的診斷結果,則每項piRNA測試都被視為一項獨立研究。任何分歧通過與第三方(王浙)討論來解決,直到達成共識。
1.5 納入研究的偏倚風險評估
本研究使用Cochrane協作網推薦的診斷準確性研究質量評估工具(quality assessment of diagnostic accuracy studies,QUADAS-2)[18]獨立對納入文獻的方法學質量和潛在的偏倚風險進行評價。QUADAS-2主要由患者選擇、待評價試驗、參考標準以及研究流程和時間點4個部分組成,并提供了標志性的問題以幫助作者進行偏倚風險的判斷。我們認為至少一個QUADAS‐2領域被判定為高偏倚風險的文獻具有較差的方法學質量。
納入文獻的質量評估由兩位作者(馬興媛和王帥陽)獨立完成并交叉檢查,通過與第三方(王浙)商議解決存在的分歧。
1.6 統計分析
使用Stata 17.0和RevMan 5.4軟件進行Meta分析。采用雙變量模型計算合并的SEN、SPE、DOR、PLR、NLR,繪制SROC并計算AUC,以評價piRNA的診斷性能。AUC越接近1越能證明診斷試驗的價值。
采用Spearman相關系數判斷有無閾值效應引起的異質性。采用Cochrane Q檢驗和I2檢驗來檢驗各研究間的異質性。I2> 50%或P<0.10提示各研究間異質性較大[19],使用隨機效應模型合并效應值。同時基于地區、樣本大小、癌癥類型、失調、標本來源等協變量進行亞組分析和Meta回歸以進一步探討非閾值效應來源的異質性[20]。進行敏感性分析以評價結果的穩定性。
此外,Fagan圖顯示了驗前概率、似然比和驗后概率之間的關系,被用來解釋piRNA對癌癥的臨床應用價值。使用Deeks漏斗圖檢驗來判斷納入文獻是否存在發表偏倚[21]。所有的統計學檢驗都是雙側的,P<0.05認為差異有統計學意義。
2 結果
2.1 文獻檢索結果
根據制定的檢索策略,從不同的數據庫共檢索到1 930篇相關文獻,包括PubMed(n=480)、Web of Science(n=827)、Embase(n=322)、Cochrane library(n=2)、CNKI(n=57)、WanFang Data(n=158)、VIP(n=29)和CBM(n=55)。使用EndNote X9軟件和手工去除847篇重復文章后,在閱讀標題和/或摘要后排除1 042篇文獻(其中215篇是綜述、Meta分析、會議摘要和病例報告等,771篇與piRNA診斷癌癥無關,56篇涉及動物和/或細胞系試驗)。仔細閱讀全文后,21篇文獻因非診斷性研究(n=14)或數據不足(n=7)被排除,3篇因樣本未取自治療或手術前(n=1)或患者未經病理學確診(n=2)被排除。最終,納入17篇文獻[14, 15, 22-36]的46項研究。文獻檢索流程及結果見附件圖1。
2.2 納入研究的基本特征
納入研究基本特征見表1。納入的17篇文獻(46項研究)[14, 15, 22-36]共包含4 956名癌癥患者和3 759名對照人群,均發表于2015―2022年之間。所有的癌癥病例均經病理確認,對照組為鄰近的非腫瘤組織、非癌組織或來自健康人的血清、胃液和尿液。標本均于治療或手術前收集。31項研究在亞洲進行,14項研究在歐洲進行,只有1項研究在非洲進行;29項研究側重于消化系統癌癥:結直腸癌(n=24)、胃癌(n=4)和食管鱗狀細胞癌(n=1);6項研究側重于泌尿生殖系統癌癥:透明腎細胞癌(n=4)和前列腺癌(n=2);3項研究側重于呼吸系統癌癥:非小細胞肺癌(n=3);分別有4項研究側重于內分泌系統癌癥[甲狀腺乳頭狀癌(n=4)]和神經系統癌癥[膠質母細胞瘤(n=4)]。在這些研究中應用了4種類型的標本,包括血清(n=29)、組織(n=14)、胃液(n=1)和尿液(n=1)。樣本量≥100例有22項試驗,其余的樣本量<100例。除了Mai等[29]的研究采用微滴式數字PCR,其他研究均使用RT-qPCR檢測piRNA。
2.3 納入研究的偏倚風險
所有研究均按照QUADAS-2評價體系進行偏倚風險評價,見附件圖2。所有納入的研究在參考試驗部分和病例流程和進展情況部分均符合低風險的評判標準。在患者選擇和待評價試驗部分各有94%和76%的偏倚風險被判定為不清楚。偏倚風險主要來自不適當的疾病譜組成(未納入未確診的病例)和未采用預先設定的閾值兩個方面。總體而言,納入研究均顯示出中-高質量,表明納入研究的質量是可靠的。
2.4 診斷準確性
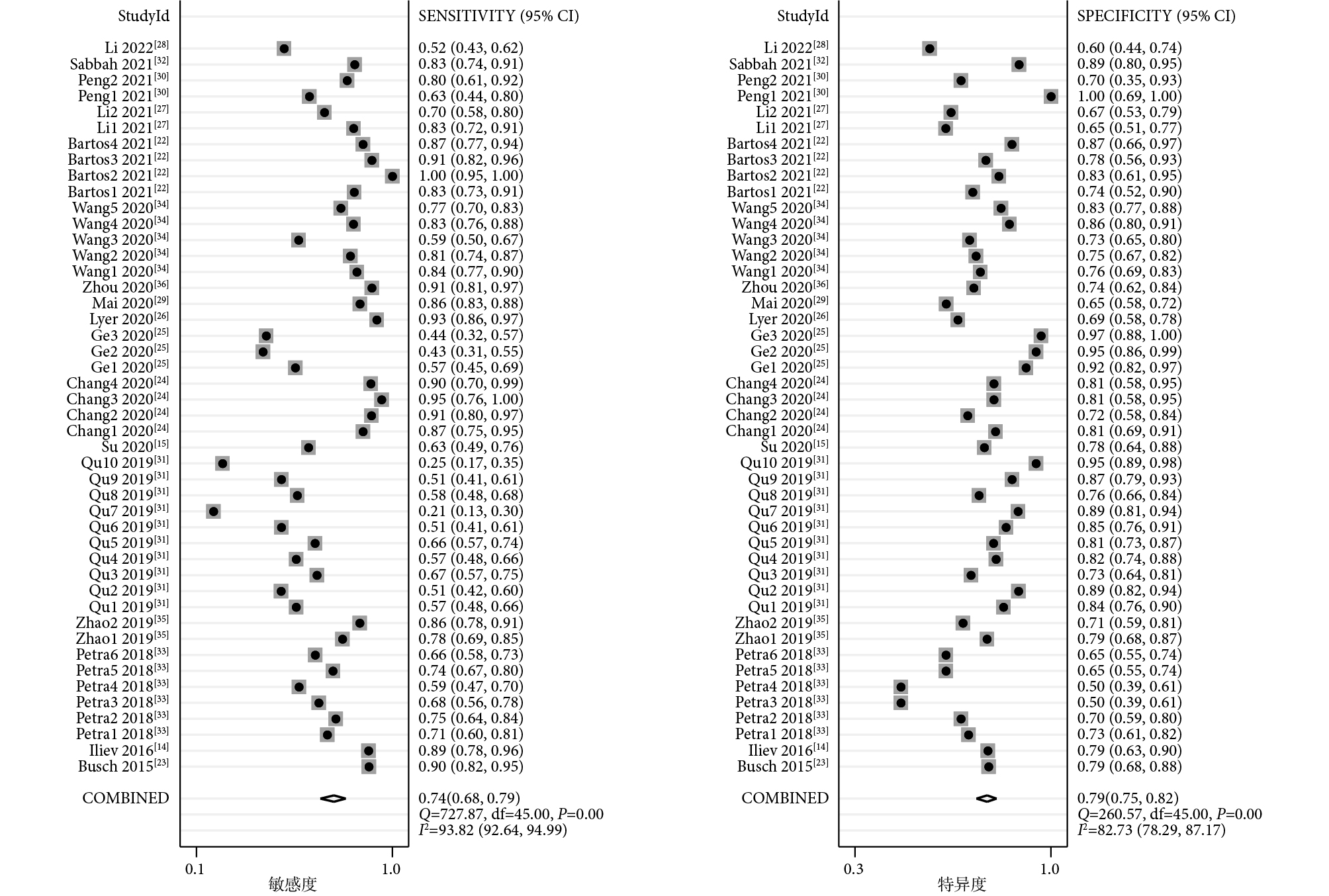
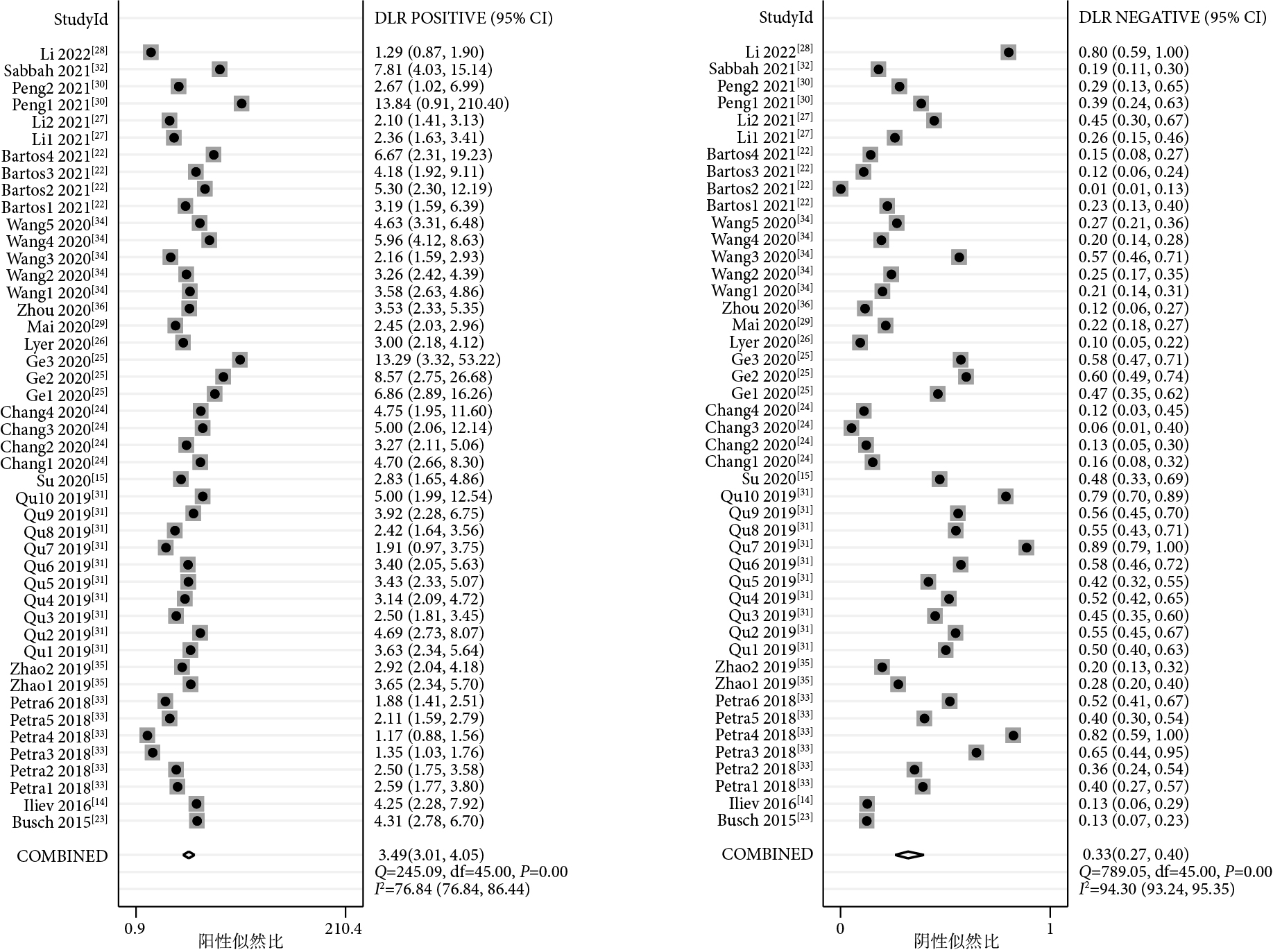
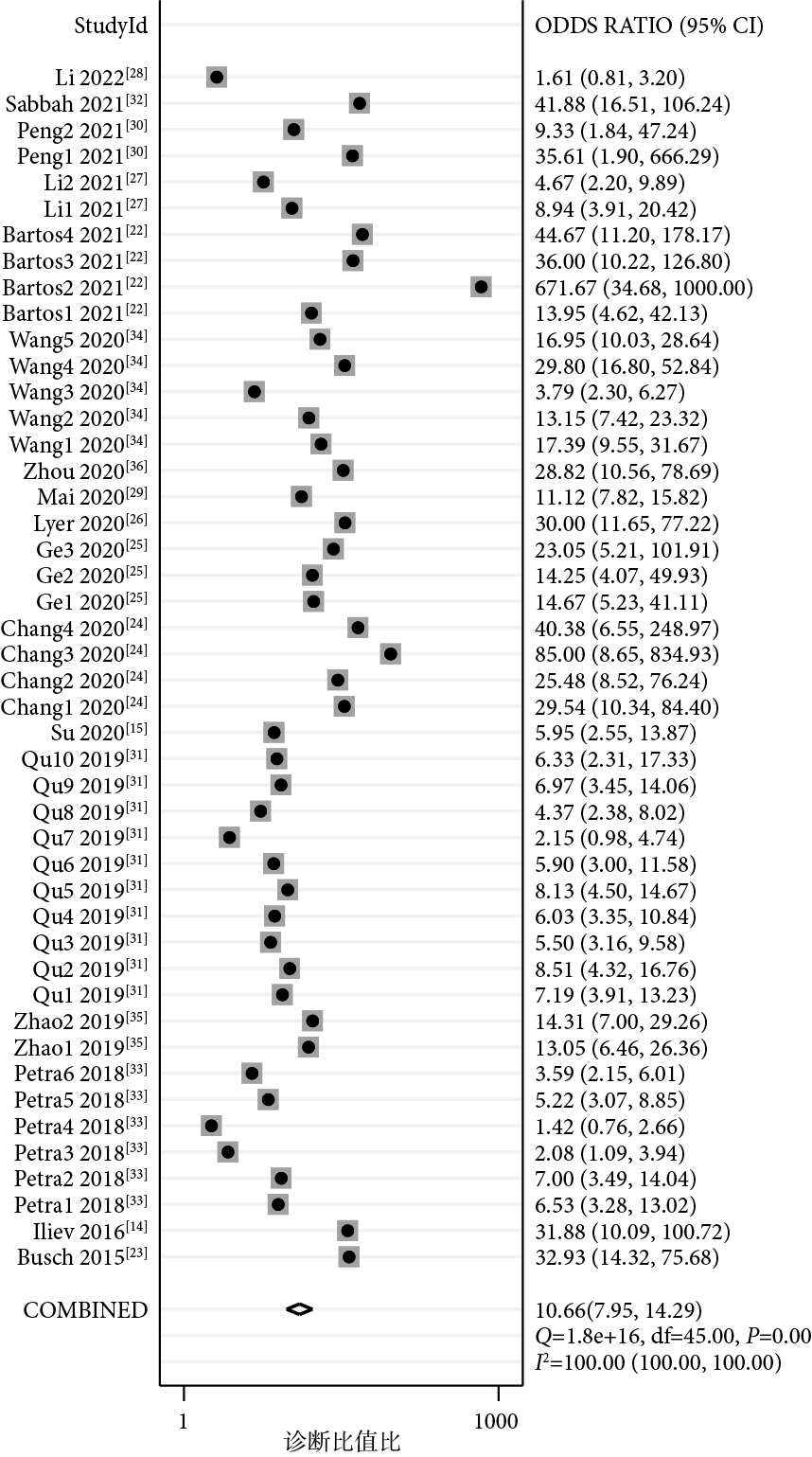
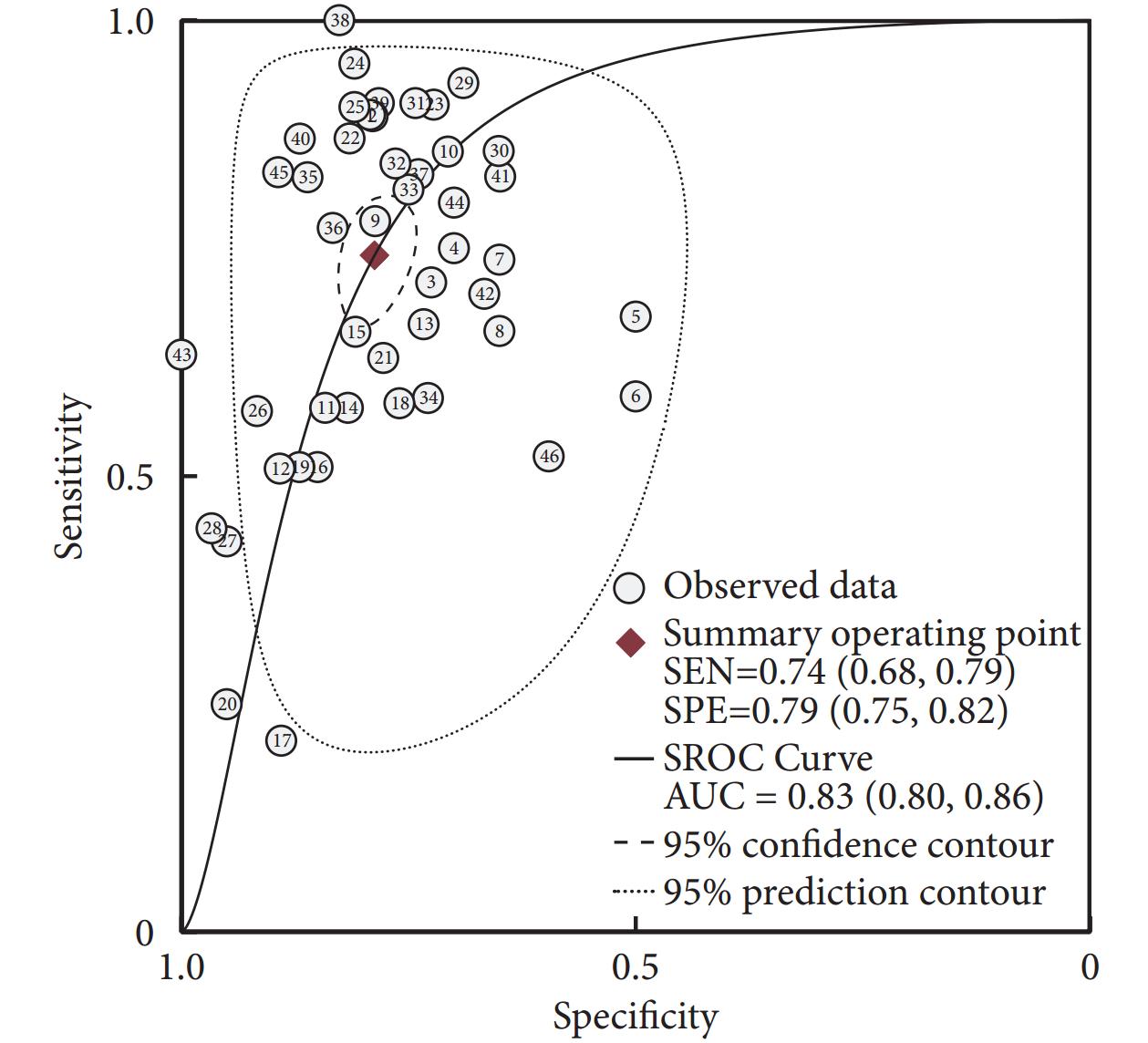
46項研究報告了piRNA對癌癥的診斷性能,SEN和SPE的范圍分別介于21%~100%和50%~100%之間。合并I2值分別為93.82%和82.73%,具有較大的統計學異質性,因此采用隨機效應模型。合并SEN為0.74[95%CI(0.68,0.79),I2=94%],SPE為0.79[(95%CI(0.75,0.82),I2=83%](圖1);PLR為3.49[(95%CI(3.01,4.05),I2=77%],NLR為0.33[(95%CI(0.27,0.40),I2=94%](圖2);DOR為11[(95%CI(8,14),I2=100%](圖3),AUC為0.83[95%CI(0.80,0.86)](圖4)。
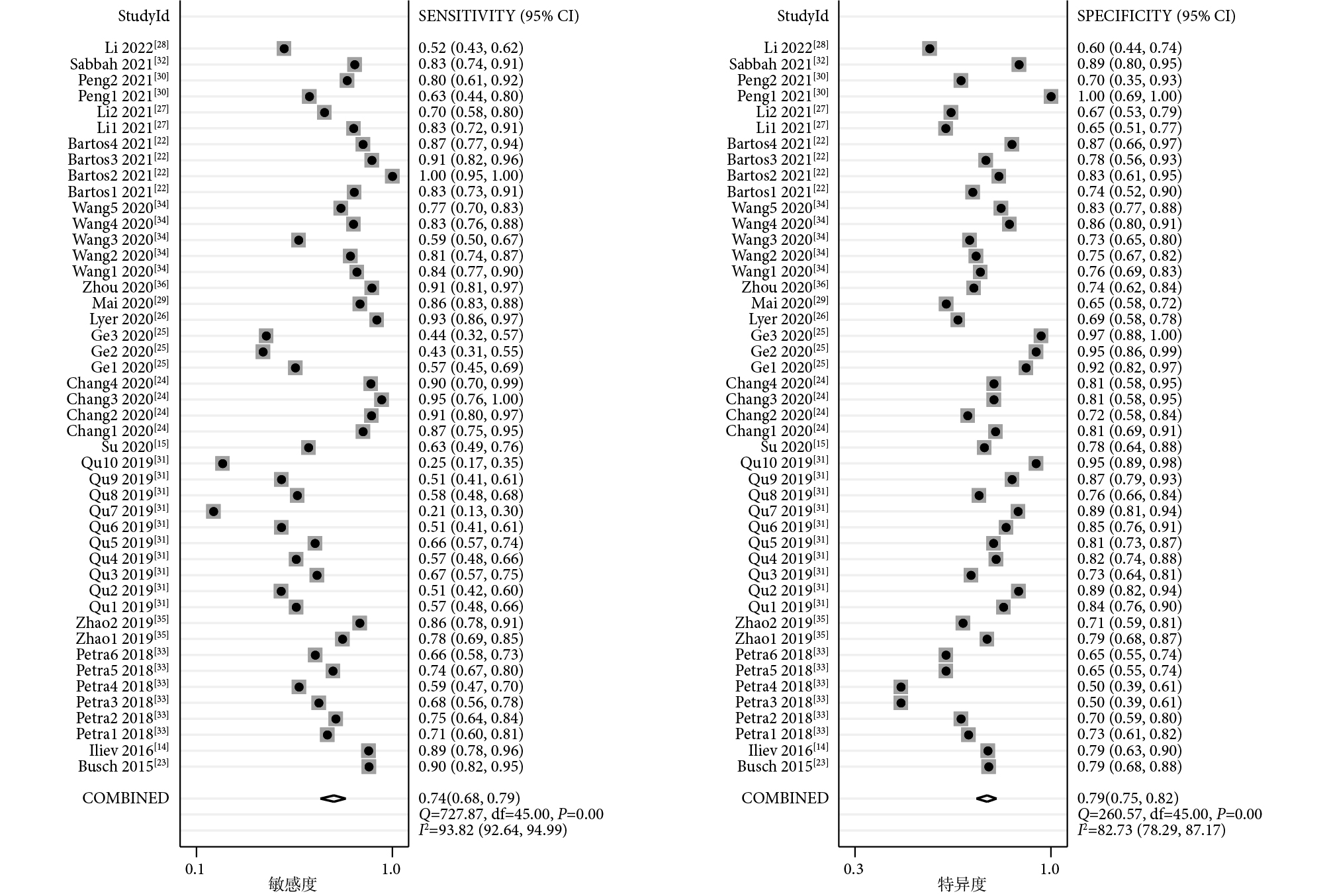 圖1
piRNA對癌癥診斷敏感度和特異度的Meta分析結果
圖1
piRNA對癌癥診斷敏感度和特異度的Meta分析結果
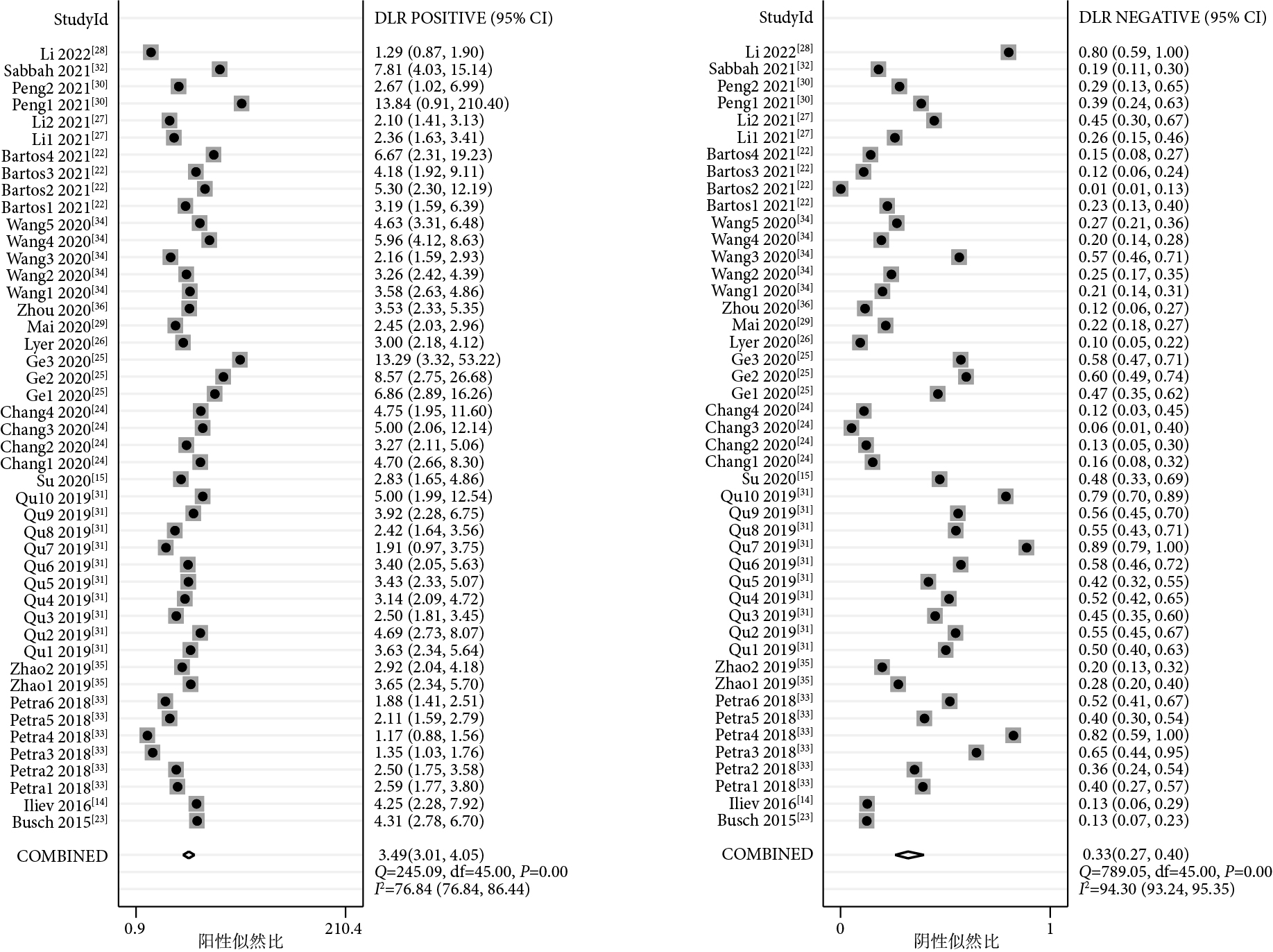 圖2
piRNA對癌癥診斷陽性似然比和陰性似然比的Meta分析結果
圖2
piRNA對癌癥診斷陽性似然比和陰性似然比的Meta分析結果
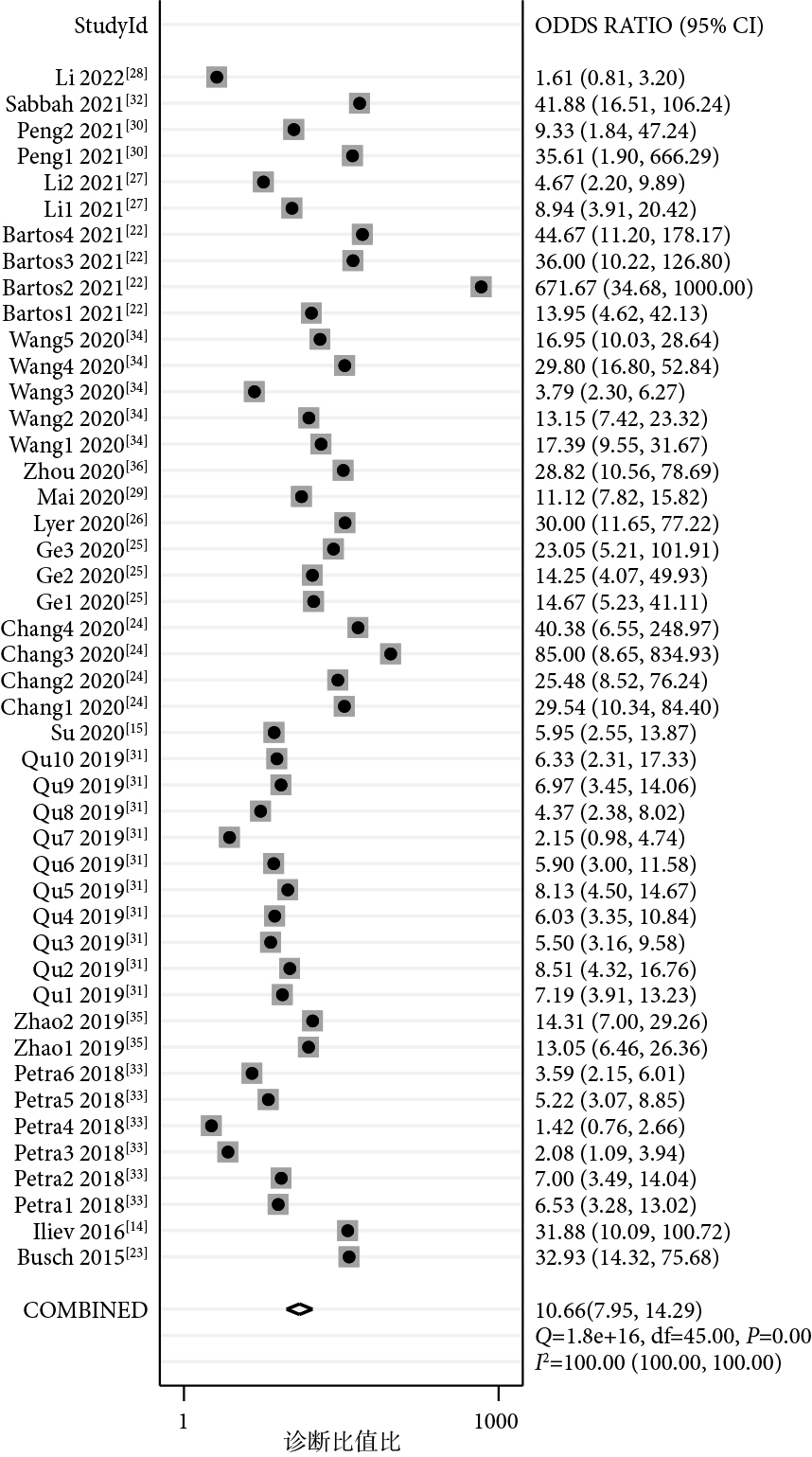 圖3
piRNA對癌癥診斷診斷比值比的Meta分析結果
圖3
piRNA對癌癥診斷診斷比值比的Meta分析結果
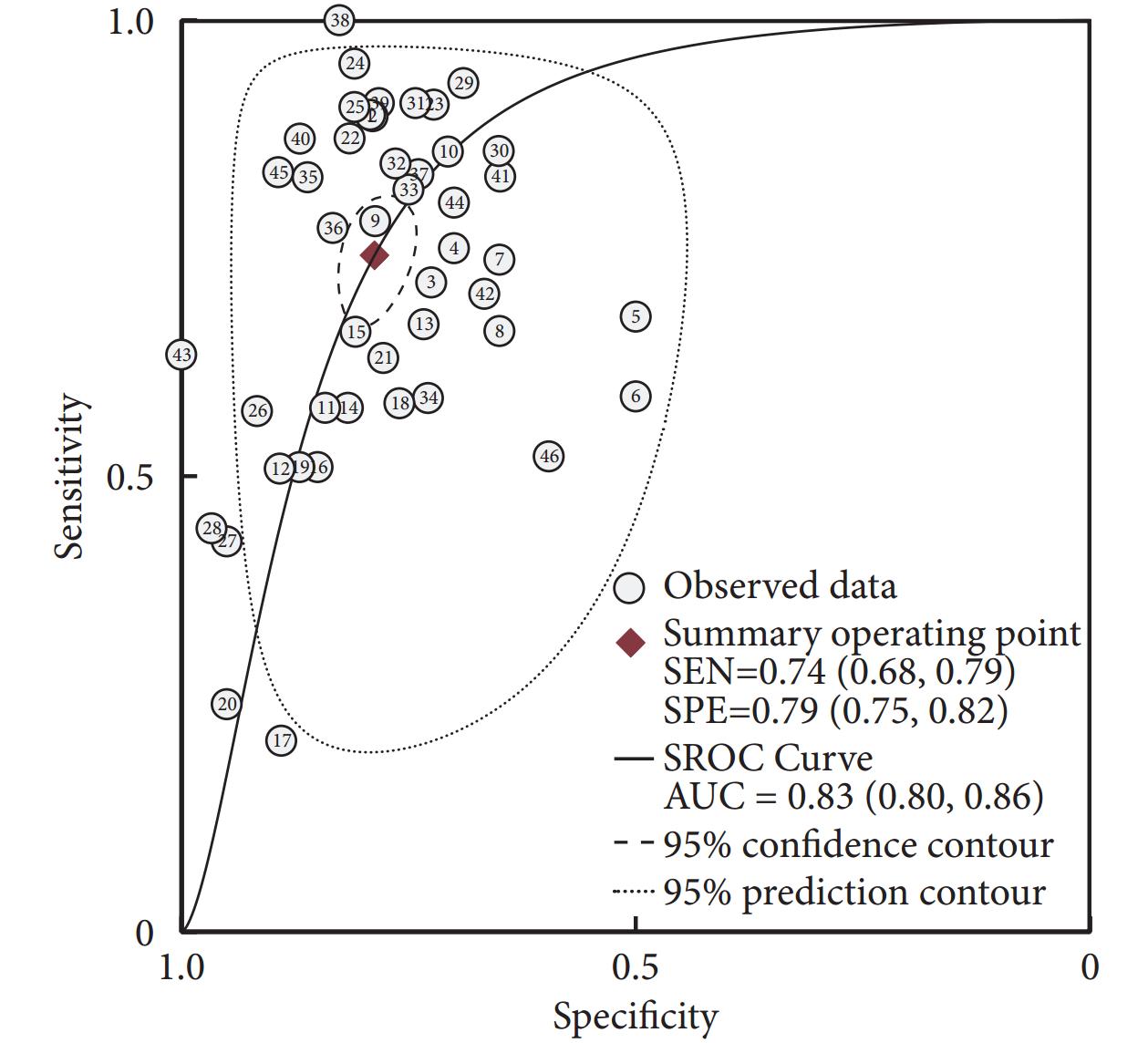 圖4
piRNA對癌癥診斷的SROC曲線
圖4
piRNA對癌癥診斷的SROC曲線
2.5 異質性分析
Spearman相關系數為?0.290 4,P>0.05,表明不存在閾值效應引起的異質性。因此,本研究進行了亞組分析和Meta回歸,以探討異質性的可能來源。
2.5.1 亞組分析
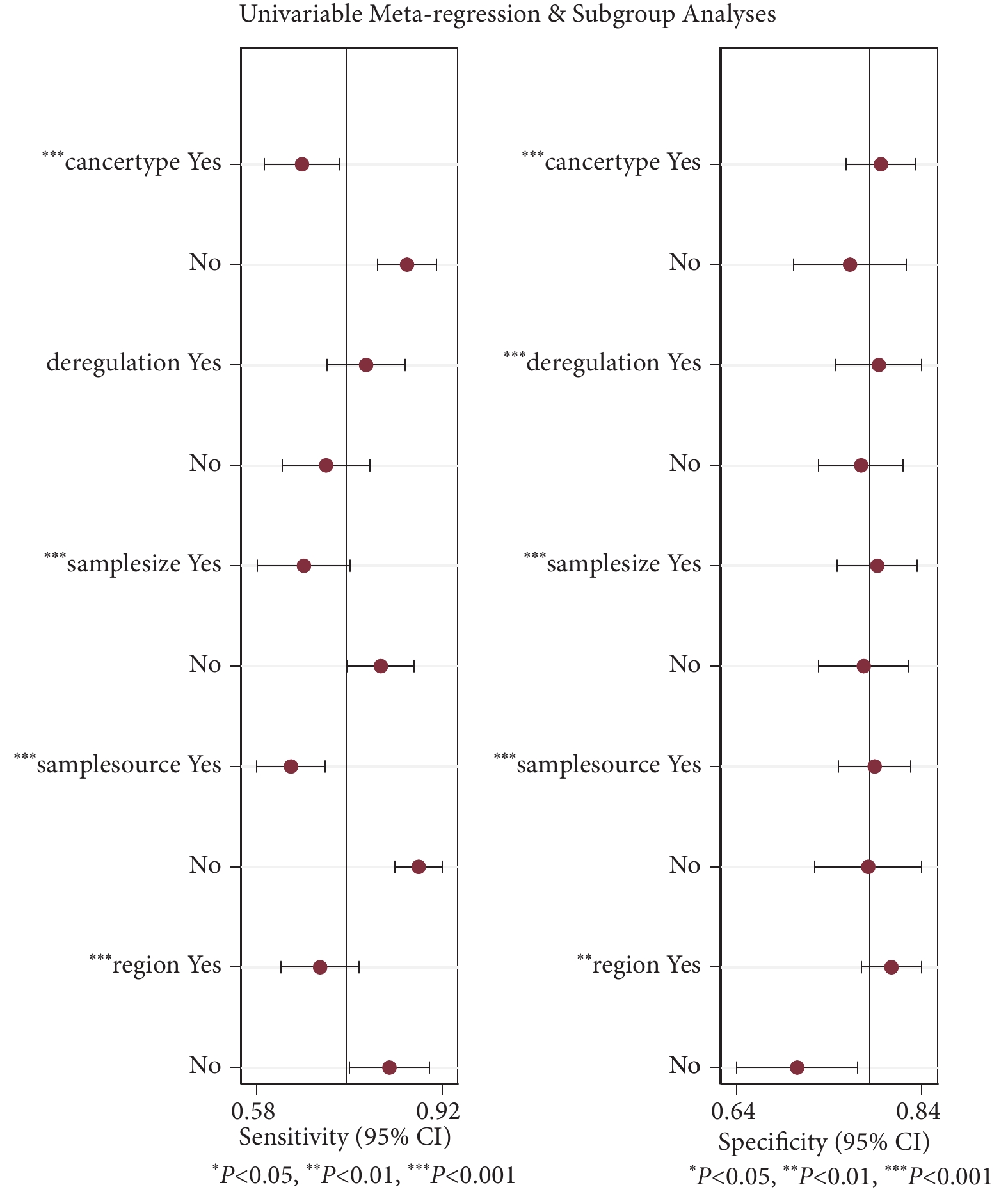
本研究根據癌癥類型(消化系統癌癥/泌尿生殖系統癌癥/呼吸系統癌癥/內分泌系統癌癥/神經系統癌癥)、樣本大小(≥100例/<100例)、失調(上調/下調)、標本來源(血液/非血液)和地區(亞洲/歐洲)等協變量進行亞組分析以確定異質性的可能來源。如表2所示,piRNA在消化系統癌癥中的SEN和SPE分別為0.66和0.80,在泌尿生殖系統癌癥中的SEN和SPE分別為0.83和0.78,在呼吸系統癌癥中的SEN和SPE分別為0.66和0.64,在內分泌系統癌癥中的SEN和SPE分別為0.90和0.78,在神經系統癌癥中的SEN和SPE分別為0.93和0.80。在基于失調的亞組分析中,上調的piRNA比下調的piRNA獲得更高的SEN、SPE (SEN:0.78 vs 0.71,SPE:0.80 vs 0.78)。在樣本量方面,與≥100例相比,<100例病例的研究顯示出更高的SEN,SPE略低(SEN:0.81 vs. 0.66,SPE:0.79 vs. 0.80)。對于基于地區的亞組,亞洲相比于歐洲表現出較低的SEN和較高的SPE(SEN:0.69 vs. 0.82,SPE:0.81 vs. 0.73)。最后,在樣本來源方面,從血液和非血液來源的標本中檢測到的piRNA具有相似的SPE,但血液組的SEN低于非血液組(SEN:0.64 vs. 0.88,SPE:0.80 vs. 0.77)。
2.5.2 Meta回歸
采用敏感性和特異性森林圖進一步進行Meta回歸,以探討地區、樣本量、癌癥類型、失調和樣本來源的差異是否是研究間異質性的可能來源。如圖5所示,地區(P<0.01)、樣本量(P <0.01)、癌癥類型(P<0.01)和樣本來源(P <0.01)是敏感性的異質性來源,地區(P<0.01)、樣本量(P<0.01)、癌癥類型(P<0.01)、失調(P<0.01)和樣本來源(P<0.01)均可能是特異性的異質性來源。
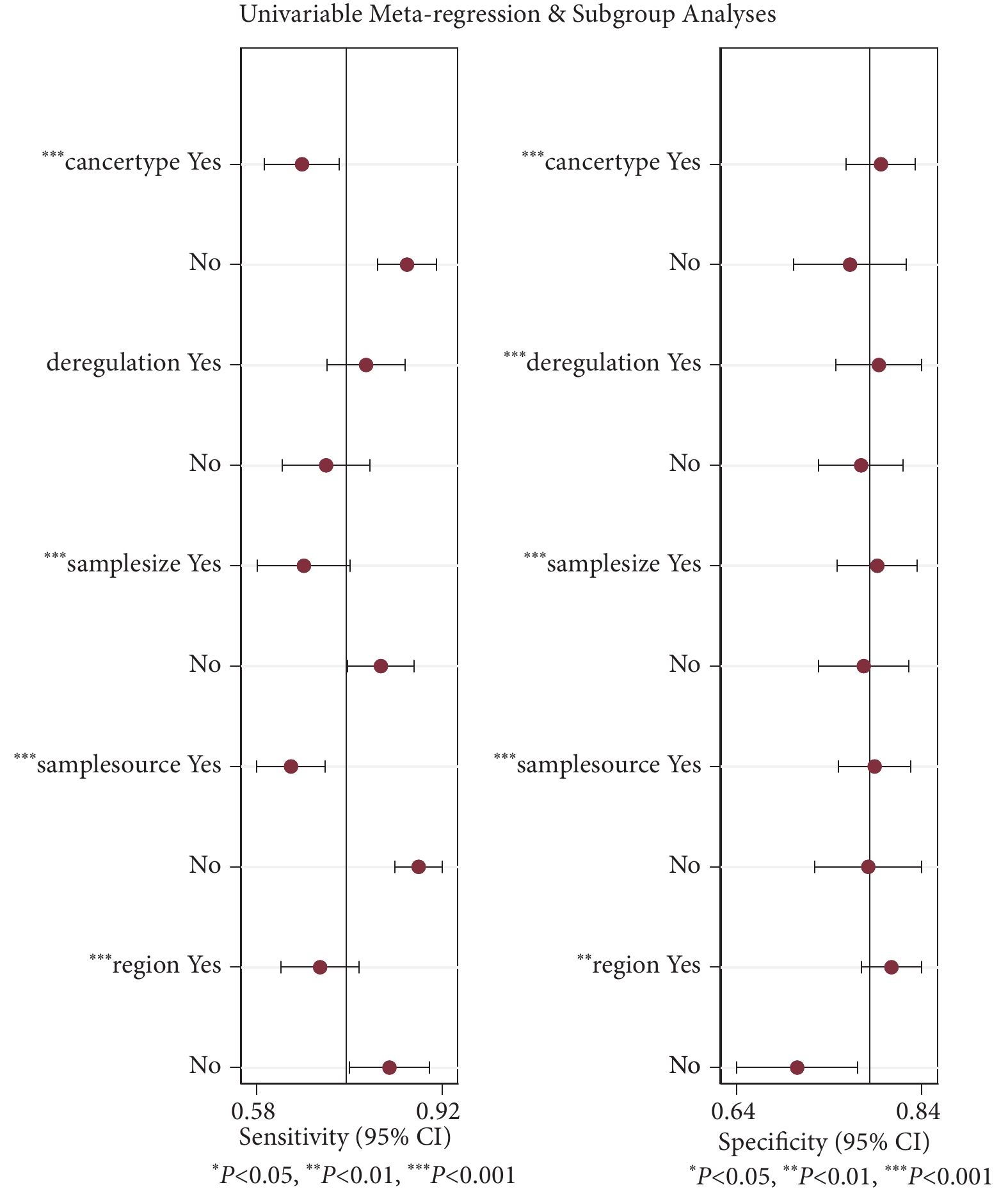 圖5
piRNA診斷癌癥敏感性和特異性的Meta回歸分析結果
圖5
piRNA診斷癌癥敏感性和特異性的Meta回歸分析結果
2.6 敏感性分析
不同敏感性分析見附件圖3。Influence Analysis顯示有8個離群研究,在剔除這8項研究后,合并的診斷準確性指標于總體研究相當(SEN:0.77 vs. 0.74;SPE:0.78 vs. 0.79;AUC:0.84 vs. 0.83),表明本次Meta分析結果相對穩健。
2.7 發表偏倚
由于發表偏倚被認為是影響Meta分析結果的重要因素[37]。本研究采用Deeks漏斗圖不對稱檢驗來探究發表偏倚,P值為0.09,提示納入研究不存在明顯的發表偏倚,見附件圖4。
2.8 臨床效用評價
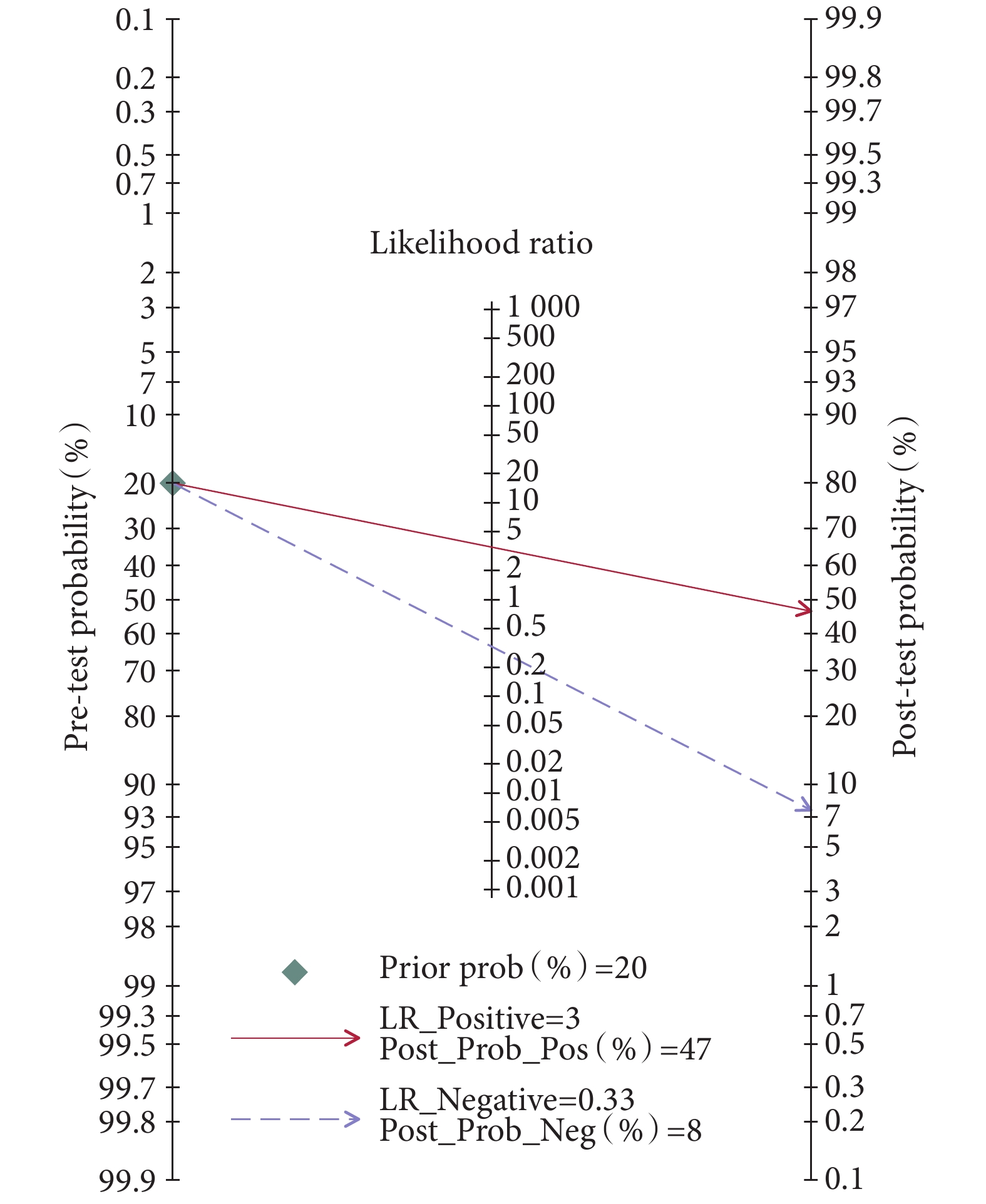
本研究采用Fagan列線圖對piRNA在癌癥中的臨床效用進行評價[38]。圖6結果顯示,驗前概率設定為20%時,陽性結果的驗后概率增加到47%,陰性結果的驗后概率減少到8%。
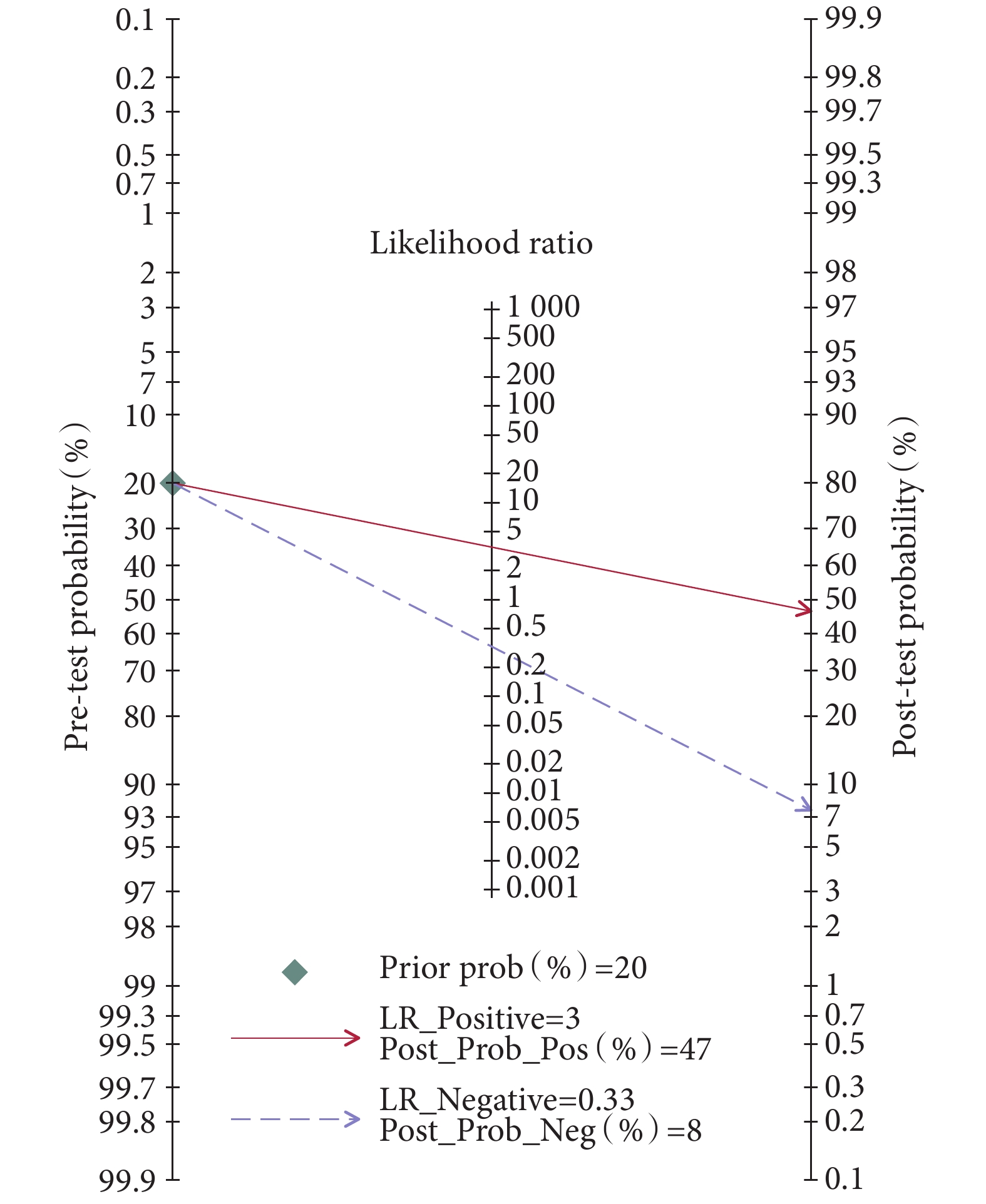 圖6
piRNA在癌癥中的臨床診斷價值的Fagan列線圖
圖6
piRNA在癌癥中的臨床診斷價值的Fagan列線圖
3 討論
越來越多的研究表明,在多種癌癥中異常表達的piRNA可能成為腫瘤診斷和治療的新的生物標志物和治療靶點[39]。據我們所知,這是第一個報道piRNA作為有前景的生物標志物對癌癥診斷效能的Meta分析。本Meta分析顯示,piRNA可用于區分癌癥患者和對照組,具有較好的診斷價值(AUC:0.83,SEN:74%,SPE:79%)。DOR是衡量一項測試的總體準確性的指標,是患病人群中出現陽性結果的概率與未患病人群中出現陽性結果的概率之比[40],DOR值>10認為有較好的判別性能。本研究顯示,DOR值為11[95%CI(8,14)],進一步證實了piRNA對癌癥的較好的診斷準確性。在本研究中,另一個用于評估的診斷指標是似然比。似然比是反映敏感度和特異度真實性的指標,PLR > 10和NLR < 0.1被認為是診斷或排除疾病的有力證據[41]。雖然AUC和DOR的結果顯示了較高水平的診斷準確性,但我們的合并PLR和NLR結果并不令人滿意。在我們的Meta分析中,PLR為3.49[95%CI(3.01,4.05)],NLR為0.33[95%CI(0.27,0.40)]。這一結果表明,患有癌癥的人獲得陽性測試結果的可能性是沒有癌癥的人的3.49倍,piRNA診斷結果為陰性的個體發生癌癥的概率為33%。因此,較差的PLR不足以支持癌癥的診斷,較差的NLR提示我們應聯合多種piRNA或聯合其他傳統生物標志物來排除癌癥診斷的可能性。多項研究均發現多種piRNA的組合比單個piRNA產生了更好的診斷性能[27, 31]。此外,Petra等[33]和Ge等[25]的研究也表明聯合傳統的血清腫瘤標志物(如CEA和CA199)可進一步提高piRNA的鑒別診斷價值。故而聯合多種piRNA或聯合piRNA與傳統標志物是未來的研究方向之一,其前景亦十分廣闊。同時,本研究也構建了Fagan列線圖來幫助將結果解釋為臨床有用的信息。當設定驗前概率為20%時,檢測結果為陽性的患者被正確診斷為癌癥的概率為47%;檢測結果為陰性的患者被忽略的概率為8%,這意味著piRNA在臨床上是有用的。發表偏倚和敏感性分析的結果則證明我們的結果是可靠的和穩健的。此外,考慮到大多數納入研究的偏倚風險在所有領域中產生了相似的結果,因此沒有進行關于方法學質量的敏感性分析。
根據癌癥類型亞組分析的結果顯示,相比于其他系統癌癥,piRNA在神經系統癌癥和內分泌系統癌癥中表現出了更好的診斷效能(SEN:0.93和0.90,SPE:0.80和0.78,AUC:0.84和0.92),表明piRNA檢測可能是神經系統癌癥和內分泌系統癌癥中更有希望的候選標志物。然而,由于納入的研究較少,需謹慎考慮癌癥類型亞組分析結果,需精心設計更多的診斷性研究來驗證piRNA在不同癌癥中的診斷性能。此外,基于樣本來源的亞組分析表明,非血液來源(組織、胃液和尿液)和血液來源的piRNA在區分癌癥患者方面的診斷性能相似(AUC:0.80 vs 0.79),都表現出令人鼓舞的診斷準確性。考慮到人體組織中piRNA的侵入性和復雜性,基于血液的piRNA測定在許多情況下可能更適用。值得注意的是,并非所有的piRNA在人類癌癥中都具有相同的失調模式,在腫瘤增殖和遷移中的功能也不同。例如,下調的piR-651可抑制肺癌細胞的遷移,增加細胞凋亡[42]。相反,肝癌中上調的piR-Hep1可能通過與PIWIL2結合上調PI3K/AKT信號通路中磷酸化的AKT來促進肝細胞增殖和侵襲,意味著預后不良[43]。因此,選擇哪種piRNA進行早期診斷取決于實際情況和不同的腫瘤,特別是在臨床中將其作為生物標志物應用時。有必要進行更多大規模的研究來闡明piRNA異常表達的機制,并進一步分析多種piRNAs對于癌癥檢測的診斷準確性有何影響。
異質性是Meta分析中的一個關鍵問題[44]。本研究通過I2測試發現顯著的異質性。閾值效應通常是診斷性Meta中異質性的主要原因。然而,Spearman相關系數的分析結果表明閾值不是異質性的潛在來源。進行Meta回歸分析以識別由非閾值效應引起的異質性。分析表明,異質性與地區、樣本量、癌癥類型、失調和樣本來源有關。其他潛在的異質性來源,如腫瘤分期、組織學類型、腫瘤大小、轉移情況等,由于相關數據不足,未得到進一步的分析。此外,我們注意到在樣本選擇、處理、樣本制備過程中的血細胞污染、piRNA的檢測方法和數據分析等操作方面缺乏統一的標準,這可能導致異質性。因此,我們建議建立一套可用于液體生物標本采集、處理和儲存的標準化方法,并建議在未來的診斷性研究中遵循這些標準[45]。
根據QUADAS‐2標準,所有納入的研究都顯示出中等到相對較高的質量,這增強了我們研究結果的可靠性。然而,在評估過程中,本研究發現許多研究的研究設計和實施存在缺陷,這些缺陷可能會妨礙對研究結果的客觀評價。首先,大多數納入的研究將健康個體作為對照,這與癌變情況有很大不同,可能高估了診斷價值,建議未來進一步開展腫瘤/良性模型和早期疾病的臨床試驗研究,以確認piRNAs的診斷作用。其次,大多數納入的研究使用ROC分析評估診斷臨界值,即未預先設定使用的閾值,而且沒有在獨立隊列中對其進行驗證,這將降低本研究提出的證據的質量,建議未來應實施驗證技術以評估統計分析的結果在獨立數據集上的泛化能力。此外,我們建議未來作者在發表診斷性研究時應嚴格按照已更新的診斷性臨床研究報告規范—STARD進行報告以促進研究結果的內部有效性、外部有效性和可重復性。因此,未來應進行的更大規模的重點關注技術方面或報告標準方面標準化方案的前瞻性研究,這對于產生可靠的結果和主要的臨床考慮是必不可少的。
本研究的優勢在于我們嚴格遵守PRISMA指南進行Meta分析,并使用Cochrane協作網推薦的量表評估納入研究的質量。其次,這是第一個關注piRNA對癌癥的整體診斷性能的研究。我們發現piRNA檢測具有較高的準確性,這為它們應用于臨床提供了證據。第三,我們進行了深入和全面的電子文獻檢索,避免使用檢索過濾器和檢索納入研究和相關綜述中的參考文獻,將錯過相關研究的風險降至最低。第四,兩位作者獨立確定研究并提取資料,從而最大限度地減少文獻篩選和數據提取中的人為錯誤。此外,本研究不僅提供了傳統的Meta分析結果,例如診斷性能指標的匯總估計,還提供了其他分析的結果,例如貝葉斯分析(包括Fagan列線圖),該分析進一步增加了臨床應用信息,使得臨床醫生能夠準確地了解在假陽性和假陰性預測方面犯錯誤的風險。最后,漏斗圖和敏感性分析的結果證明了結果的可靠性。
本研究存在一些局限性,因此需謹慎解釋一些觀察結果。首先,納入研究的研究對象多是亞洲和歐洲人群,非洲人群中piRNA診斷的數據不足(僅有一項研究),本Meta分析可能存在種群偏倚。需要在不同人群中進行進一步的多中心研究,以確認這些結果是否同樣適用于其他種族。其次,一些可能導致異質性的變量(如腫瘤分期、組織學類型、腫瘤大小、轉移情況等)由于數據不足,并未進行進一步的評估。因此,這些因素仍有待研究。第三,雖然這項Meta分析沒有關注單個piRNA,但總的來說,我們發現piRNA可以作為癌癥診斷的獨立風險預測因子。值得注意的是,這些限制主要來自于證據基礎,而不是用于審查和評估的方法。
簡而言之,這項Meta分析表明,piRNA在癌癥的診斷中具有較高的敏感度和特異度,這使得其在臨床上診斷癌癥是可行的;同時,聯合多種piRNA或piRNA和傳統生物標志物可能是提高癌癥檢出率的方法。但當前已發表piRNA的診斷性研究大多受限于有限的樣本和缺乏獨立驗證。因此,建議未來進行大規模的臨床隊列研究進一步探索和驗證piRNA作為腫瘤生物標志物的潛力和優勢。盡管仍然存在許多未知的挑戰,但隨著多組學、測序和其他技術的進步,piRNA作為腫瘤診斷和治療的新靶點將得到進行更深入和全面的評估[46]。
聲明 本文不存在任何利益沖突。
癌癥是世界范圍內的主要公共衛生問題[1],其發病率和死亡率正在迅速增長。世界衛生組織下屬國際癌癥研究機構公布的數據顯示,2020年全球新增約1 930萬癌癥病例,癌癥死亡人數達1 000萬,相比于2019年(1 810萬和960萬)進一步增加[2]。臨床上,許多類型的癌癥在早期無特定的癥狀,常常在疾病晚期階段被診斷出來,導致治療效果不佳,如果能夠早期發現,將極大改善患者的預后[3]。目前,癌癥診斷的金標準是組織學評估,然而其侵入性和風險性等因素限制了其在早期診斷中的應用。雖然影像學篩查試驗(如低劑量計算機斷層掃描)可以有效檢測微小腫瘤,然而仍存在過度診斷和多次累積輻射的問題[4]。在臨床實踐中,已有一些血清生物標志物[如癌胚抗原(CEA)、糖類抗原199(CA 199)、甲胎蛋白(AFP)]用于癌癥診斷,但它們的敏感性和特異性較低[5]。因此,需要尋找具有高特異性和敏感性、高性價比和非侵入性生物標志物以便準確、早期診斷癌癥。
Piwi相互作用RNA(PIWI-interacting RNA,piRNA)是一類長度為26~31個核苷酸的新型小非編碼RNA,主要因其在生殖細胞的維持中發揮重要作用受到關注[6]。最近研究表明,piRNA廣泛存在于哺乳動物體細胞中,包括癌細胞[7],并且發現以癌癥特異性的方式在各種組織類型中表達。已在腎臟、甲狀腺、子宮、乳腺癌和胃癌組織中檢測到失調的piRNA[8]。此外,新出現的證據表明piRNA可通過調控轉錄和轉錄后水平的基因表達,影響腫瘤細胞的增殖、遷移、侵襲、干細胞維持和耐藥[9,10]。值得注意的是,piRNA在人體體液中非常穩定,不易被核糖核酸酶降解[11,12]。這些結果表明piRNA可能是診斷癌癥的有希望的新型生物標志物[13]。當前,越來越多的研究者致力于研究piRNA在癌癥檢測中的診斷價值,然而結果并不一致。例如,Iliev等[14]報道,piR-823在ccRCC診斷中具有89%的敏感性和78%的特異性,而相同的生物標志物在ESCC中僅具有63%的敏感性和77%的特異性[15],部分可歸因于研究納入的樣本量、種族、標本類型和piRNA譜的差異。因此,在將piRNA應用于臨床之前,迫切需要對其在癌癥中的診斷價值進行全面分析和評價。在此,我們全面檢索已發表的文獻,收集所有公開發表的研究數據,使用Meta分析的方法系統評估piRNA對癌癥的診斷效能,為臨床實踐提供證據,同時分析可能導致研究間異質性的來源,為piRNA臨床轉化及其未來的研究設計提供參考。
1 資料與方法
本系統評價方案已在PROSPERO注冊(編號:CRD42023425604)。Meta分析的工作流程和方法基于診斷準確性試驗的系統評價/Meta分析報告規范(PRISMA-DTA)[16]和《Cochrane診斷測試準確性系統評價手冊》[17]進行。
1.1 納入和排除標準
1.1.1 研究類型
納入評估piRNA對癌癥診斷準確性的觀察性研究,包括回顧性研究和前瞻性研究。
1.1.2 研究對象
納入癌癥患者均經組織病理學檢查(金標準)確診,本研究并未對年齡、性別、種族或TNM分期進行限制。
1.1.3 干預措施
測量取自手術或治療前的腫瘤組織、血液或其他體液中的piRNA表達水平。
1.1.4 結局指標
敏感度(sensitivity,SEN)、特異度(specificity,SPE)、診斷比值比(diagnostic odds ratio,DOR)、陽性似然比(positive likelihood ratio,PLR)、陰性似然比(negative likelihood ratio,NLR)、綜合受試者工作特征曲線(summary receiver operating characteristic curve,SROC)下面積(area under the curve,AUC)。
1.1.5 排除標準
① 非中文、英文文獻;② 無法獲取原文的研究。
1.2 檢索策略
計算機檢索PubMed、Web of Science、Embase、Cochrane library、CNKI、WanFang Data、VIP和CBM數據庫,搜集piRNA診斷癌癥的相關研究,檢索時限均從建庫至2023年4月。同時,手工檢索納入研究或相關綜述中的參考文獻列表,以獲得在初始檢索中可能遺漏的其他有價值的文章。使用“piwi-interacting RNA”和“neoplasms”這兩類檢索詞進行檢索。檢索策略采用自由詞和主題詞結合的方式,并根據不同數據庫進行調整。PubMed檢索策略詳見附件框1。
1.3 文獻篩選
兩位作者將從各個數據庫檢索到的文獻導出到Endnote X9文獻管理軟件中,并刪除重復項。首先,通過瀏覽標題和摘要進行初篩,剔除明顯不相關的文獻。其次,對初篩的文獻進行全文閱讀,篩選出符合納入排除標準的文獻。整個篩選過程由兩位作者(馬興媛和王帥陽)獨立進行,最終進行交叉核對,分歧內容由第三方(王浙)協助判斷。
1.4 數據提取
兩位作者(馬興媛和王帥陽)從每項納入的研究中獨立提取資料,包括第一作者、出版國家、發表年份、癌癥類型、piRNA譜、piRNA的表達、樣本量(病例/對照)、對照類型、檢測方法、樣本來源和Meta分析所需的數據[截斷值、SEN、SPE、真陽性(TP)、真陰性(TN)、假陽性(FP)、假陰性(FN)]。如果一項研究報告了兩種或兩種以上不同類型的piRNA的診斷結果,則每項piRNA測試都被視為一項獨立研究。任何分歧通過與第三方(王浙)討論來解決,直到達成共識。
1.5 納入研究的偏倚風險評估
本研究使用Cochrane協作網推薦的診斷準確性研究質量評估工具(quality assessment of diagnostic accuracy studies,QUADAS-2)[18]獨立對納入文獻的方法學質量和潛在的偏倚風險進行評價。QUADAS-2主要由患者選擇、待評價試驗、參考標準以及研究流程和時間點4個部分組成,并提供了標志性的問題以幫助作者進行偏倚風險的判斷。我們認為至少一個QUADAS‐2領域被判定為高偏倚風險的文獻具有較差的方法學質量。
納入文獻的質量評估由兩位作者(馬興媛和王帥陽)獨立完成并交叉檢查,通過與第三方(王浙)商議解決存在的分歧。
1.6 統計分析
使用Stata 17.0和RevMan 5.4軟件進行Meta分析。采用雙變量模型計算合并的SEN、SPE、DOR、PLR、NLR,繪制SROC并計算AUC,以評價piRNA的診斷性能。AUC越接近1越能證明診斷試驗的價值。
采用Spearman相關系數判斷有無閾值效應引起的異質性。采用Cochrane Q檢驗和I2檢驗來檢驗各研究間的異質性。I2> 50%或P<0.10提示各研究間異質性較大[19],使用隨機效應模型合并效應值。同時基于地區、樣本大小、癌癥類型、失調、標本來源等協變量進行亞組分析和Meta回歸以進一步探討非閾值效應來源的異質性[20]。進行敏感性分析以評價結果的穩定性。
此外,Fagan圖顯示了驗前概率、似然比和驗后概率之間的關系,被用來解釋piRNA對癌癥的臨床應用價值。使用Deeks漏斗圖檢驗來判斷納入文獻是否存在發表偏倚[21]。所有的統計學檢驗都是雙側的,P<0.05認為差異有統計學意義。
2 結果
2.1 文獻檢索結果
根據制定的檢索策略,從不同的數據庫共檢索到1 930篇相關文獻,包括PubMed(n=480)、Web of Science(n=827)、Embase(n=322)、Cochrane library(n=2)、CNKI(n=57)、WanFang Data(n=158)、VIP(n=29)和CBM(n=55)。使用EndNote X9軟件和手工去除847篇重復文章后,在閱讀標題和/或摘要后排除1 042篇文獻(其中215篇是綜述、Meta分析、會議摘要和病例報告等,771篇與piRNA診斷癌癥無關,56篇涉及動物和/或細胞系試驗)。仔細閱讀全文后,21篇文獻因非診斷性研究(n=14)或數據不足(n=7)被排除,3篇因樣本未取自治療或手術前(n=1)或患者未經病理學確診(n=2)被排除。最終,納入17篇文獻[14, 15, 22-36]的46項研究。文獻檢索流程及結果見附件圖1。
2.2 納入研究的基本特征
納入研究基本特征見表1。納入的17篇文獻(46項研究)[14, 15, 22-36]共包含4 956名癌癥患者和3 759名對照人群,均發表于2015―2022年之間。所有的癌癥病例均經病理確認,對照組為鄰近的非腫瘤組織、非癌組織或來自健康人的血清、胃液和尿液。標本均于治療或手術前收集。31項研究在亞洲進行,14項研究在歐洲進行,只有1項研究在非洲進行;29項研究側重于消化系統癌癥:結直腸癌(n=24)、胃癌(n=4)和食管鱗狀細胞癌(n=1);6項研究側重于泌尿生殖系統癌癥:透明腎細胞癌(n=4)和前列腺癌(n=2);3項研究側重于呼吸系統癌癥:非小細胞肺癌(n=3);分別有4項研究側重于內分泌系統癌癥[甲狀腺乳頭狀癌(n=4)]和神經系統癌癥[膠質母細胞瘤(n=4)]。在這些研究中應用了4種類型的標本,包括血清(n=29)、組織(n=14)、胃液(n=1)和尿液(n=1)。樣本量≥100例有22項試驗,其余的樣本量<100例。除了Mai等[29]的研究采用微滴式數字PCR,其他研究均使用RT-qPCR檢測piRNA。
2.3 納入研究的偏倚風險
所有研究均按照QUADAS-2評價體系進行偏倚風險評價,見附件圖2。所有納入的研究在參考試驗部分和病例流程和進展情況部分均符合低風險的評判標準。在患者選擇和待評價試驗部分各有94%和76%的偏倚風險被判定為不清楚。偏倚風險主要來自不適當的疾病譜組成(未納入未確診的病例)和未采用預先設定的閾值兩個方面。總體而言,納入研究均顯示出中-高質量,表明納入研究的質量是可靠的。
2.4 診斷準確性
46項研究報告了piRNA對癌癥的診斷性能,SEN和SPE的范圍分別介于21%~100%和50%~100%之間。合并I2值分別為93.82%和82.73%,具有較大的統計學異質性,因此采用隨機效應模型。合并SEN為0.74[95%CI(0.68,0.79),I2=94%],SPE為0.79[(95%CI(0.75,0.82),I2=83%](圖1);PLR為3.49[(95%CI(3.01,4.05),I2=77%],NLR為0.33[(95%CI(0.27,0.40),I2=94%](圖2);DOR為11[(95%CI(8,14),I2=100%](圖3),AUC為0.83[95%CI(0.80,0.86)](圖4)。
 圖1
piRNA對癌癥診斷敏感度和特異度的Meta分析結果
圖1
piRNA對癌癥診斷敏感度和特異度的Meta分析結果
 圖2
piRNA對癌癥診斷陽性似然比和陰性似然比的Meta分析結果
圖2
piRNA對癌癥診斷陽性似然比和陰性似然比的Meta分析結果
 圖3
piRNA對癌癥診斷診斷比值比的Meta分析結果
圖3
piRNA對癌癥診斷診斷比值比的Meta分析結果
 圖4
piRNA對癌癥診斷的SROC曲線
圖4
piRNA對癌癥診斷的SROC曲線
2.5 異質性分析
Spearman相關系數為?0.290 4,P>0.05,表明不存在閾值效應引起的異質性。因此,本研究進行了亞組分析和Meta回歸,以探討異質性的可能來源。
2.5.1 亞組分析
本研究根據癌癥類型(消化系統癌癥/泌尿生殖系統癌癥/呼吸系統癌癥/內分泌系統癌癥/神經系統癌癥)、樣本大小(≥100例/<100例)、失調(上調/下調)、標本來源(血液/非血液)和地區(亞洲/歐洲)等協變量進行亞組分析以確定異質性的可能來源。如表2所示,piRNA在消化系統癌癥中的SEN和SPE分別為0.66和0.80,在泌尿生殖系統癌癥中的SEN和SPE分別為0.83和0.78,在呼吸系統癌癥中的SEN和SPE分別為0.66和0.64,在內分泌系統癌癥中的SEN和SPE分別為0.90和0.78,在神經系統癌癥中的SEN和SPE分別為0.93和0.80。在基于失調的亞組分析中,上調的piRNA比下調的piRNA獲得更高的SEN、SPE (SEN:0.78 vs 0.71,SPE:0.80 vs 0.78)。在樣本量方面,與≥100例相比,<100例病例的研究顯示出更高的SEN,SPE略低(SEN:0.81 vs. 0.66,SPE:0.79 vs. 0.80)。對于基于地區的亞組,亞洲相比于歐洲表現出較低的SEN和較高的SPE(SEN:0.69 vs. 0.82,SPE:0.81 vs. 0.73)。最后,在樣本來源方面,從血液和非血液來源的標本中檢測到的piRNA具有相似的SPE,但血液組的SEN低于非血液組(SEN:0.64 vs. 0.88,SPE:0.80 vs. 0.77)。
2.5.2 Meta回歸
采用敏感性和特異性森林圖進一步進行Meta回歸,以探討地區、樣本量、癌癥類型、失調和樣本來源的差異是否是研究間異質性的可能來源。如圖5所示,地區(P<0.01)、樣本量(P <0.01)、癌癥類型(P<0.01)和樣本來源(P <0.01)是敏感性的異質性來源,地區(P<0.01)、樣本量(P<0.01)、癌癥類型(P<0.01)、失調(P<0.01)和樣本來源(P<0.01)均可能是特異性的異質性來源。
 圖5
piRNA診斷癌癥敏感性和特異性的Meta回歸分析結果
圖5
piRNA診斷癌癥敏感性和特異性的Meta回歸分析結果
2.6 敏感性分析
不同敏感性分析見附件圖3。Influence Analysis顯示有8個離群研究,在剔除這8項研究后,合并的診斷準確性指標于總體研究相當(SEN:0.77 vs. 0.74;SPE:0.78 vs. 0.79;AUC:0.84 vs. 0.83),表明本次Meta分析結果相對穩健。
2.7 發表偏倚
由于發表偏倚被認為是影響Meta分析結果的重要因素[37]。本研究采用Deeks漏斗圖不對稱檢驗來探究發表偏倚,P值為0.09,提示納入研究不存在明顯的發表偏倚,見附件圖4。
2.8 臨床效用評價
本研究采用Fagan列線圖對piRNA在癌癥中的臨床效用進行評價[38]。圖6結果顯示,驗前概率設定為20%時,陽性結果的驗后概率增加到47%,陰性結果的驗后概率減少到8%。
 圖6
piRNA在癌癥中的臨床診斷價值的Fagan列線圖
圖6
piRNA在癌癥中的臨床診斷價值的Fagan列線圖
3 討論
越來越多的研究表明,在多種癌癥中異常表達的piRNA可能成為腫瘤診斷和治療的新的生物標志物和治療靶點[39]。據我們所知,這是第一個報道piRNA作為有前景的生物標志物對癌癥診斷效能的Meta分析。本Meta分析顯示,piRNA可用于區分癌癥患者和對照組,具有較好的診斷價值(AUC:0.83,SEN:74%,SPE:79%)。DOR是衡量一項測試的總體準確性的指標,是患病人群中出現陽性結果的概率與未患病人群中出現陽性結果的概率之比[40],DOR值>10認為有較好的判別性能。本研究顯示,DOR值為11[95%CI(8,14)],進一步證實了piRNA對癌癥的較好的診斷準確性。在本研究中,另一個用于評估的診斷指標是似然比。似然比是反映敏感度和特異度真實性的指標,PLR > 10和NLR < 0.1被認為是診斷或排除疾病的有力證據[41]。雖然AUC和DOR的結果顯示了較高水平的診斷準確性,但我們的合并PLR和NLR結果并不令人滿意。在我們的Meta分析中,PLR為3.49[95%CI(3.01,4.05)],NLR為0.33[95%CI(0.27,0.40)]。這一結果表明,患有癌癥的人獲得陽性測試結果的可能性是沒有癌癥的人的3.49倍,piRNA診斷結果為陰性的個體發生癌癥的概率為33%。因此,較差的PLR不足以支持癌癥的診斷,較差的NLR提示我們應聯合多種piRNA或聯合其他傳統生物標志物來排除癌癥診斷的可能性。多項研究均發現多種piRNA的組合比單個piRNA產生了更好的診斷性能[27, 31]。此外,Petra等[33]和Ge等[25]的研究也表明聯合傳統的血清腫瘤標志物(如CEA和CA199)可進一步提高piRNA的鑒別診斷價值。故而聯合多種piRNA或聯合piRNA與傳統標志物是未來的研究方向之一,其前景亦十分廣闊。同時,本研究也構建了Fagan列線圖來幫助將結果解釋為臨床有用的信息。當設定驗前概率為20%時,檢測結果為陽性的患者被正確診斷為癌癥的概率為47%;檢測結果為陰性的患者被忽略的概率為8%,這意味著piRNA在臨床上是有用的。發表偏倚和敏感性分析的結果則證明我們的結果是可靠的和穩健的。此外,考慮到大多數納入研究的偏倚風險在所有領域中產生了相似的結果,因此沒有進行關于方法學質量的敏感性分析。
根據癌癥類型亞組分析的結果顯示,相比于其他系統癌癥,piRNA在神經系統癌癥和內分泌系統癌癥中表現出了更好的診斷效能(SEN:0.93和0.90,SPE:0.80和0.78,AUC:0.84和0.92),表明piRNA檢測可能是神經系統癌癥和內分泌系統癌癥中更有希望的候選標志物。然而,由于納入的研究較少,需謹慎考慮癌癥類型亞組分析結果,需精心設計更多的診斷性研究來驗證piRNA在不同癌癥中的診斷性能。此外,基于樣本來源的亞組分析表明,非血液來源(組織、胃液和尿液)和血液來源的piRNA在區分癌癥患者方面的診斷性能相似(AUC:0.80 vs 0.79),都表現出令人鼓舞的診斷準確性。考慮到人體組織中piRNA的侵入性和復雜性,基于血液的piRNA測定在許多情況下可能更適用。值得注意的是,并非所有的piRNA在人類癌癥中都具有相同的失調模式,在腫瘤增殖和遷移中的功能也不同。例如,下調的piR-651可抑制肺癌細胞的遷移,增加細胞凋亡[42]。相反,肝癌中上調的piR-Hep1可能通過與PIWIL2結合上調PI3K/AKT信號通路中磷酸化的AKT來促進肝細胞增殖和侵襲,意味著預后不良[43]。因此,選擇哪種piRNA進行早期診斷取決于實際情況和不同的腫瘤,特別是在臨床中將其作為生物標志物應用時。有必要進行更多大規模的研究來闡明piRNA異常表達的機制,并進一步分析多種piRNAs對于癌癥檢測的診斷準確性有何影響。
異質性是Meta分析中的一個關鍵問題[44]。本研究通過I2測試發現顯著的異質性。閾值效應通常是診斷性Meta中異質性的主要原因。然而,Spearman相關系數的分析結果表明閾值不是異質性的潛在來源。進行Meta回歸分析以識別由非閾值效應引起的異質性。分析表明,異質性與地區、樣本量、癌癥類型、失調和樣本來源有關。其他潛在的異質性來源,如腫瘤分期、組織學類型、腫瘤大小、轉移情況等,由于相關數據不足,未得到進一步的分析。此外,我們注意到在樣本選擇、處理、樣本制備過程中的血細胞污染、piRNA的檢測方法和數據分析等操作方面缺乏統一的標準,這可能導致異質性。因此,我們建議建立一套可用于液體生物標本采集、處理和儲存的標準化方法,并建議在未來的診斷性研究中遵循這些標準[45]。
根據QUADAS‐2標準,所有納入的研究都顯示出中等到相對較高的質量,這增強了我們研究結果的可靠性。然而,在評估過程中,本研究發現許多研究的研究設計和實施存在缺陷,這些缺陷可能會妨礙對研究結果的客觀評價。首先,大多數納入的研究將健康個體作為對照,這與癌變情況有很大不同,可能高估了診斷價值,建議未來進一步開展腫瘤/良性模型和早期疾病的臨床試驗研究,以確認piRNAs的診斷作用。其次,大多數納入的研究使用ROC分析評估診斷臨界值,即未預先設定使用的閾值,而且沒有在獨立隊列中對其進行驗證,這將降低本研究提出的證據的質量,建議未來應實施驗證技術以評估統計分析的結果在獨立數據集上的泛化能力。此外,我們建議未來作者在發表診斷性研究時應嚴格按照已更新的診斷性臨床研究報告規范—STARD進行報告以促進研究結果的內部有效性、外部有效性和可重復性。因此,未來應進行的更大規模的重點關注技術方面或報告標準方面標準化方案的前瞻性研究,這對于產生可靠的結果和主要的臨床考慮是必不可少的。
本研究的優勢在于我們嚴格遵守PRISMA指南進行Meta分析,并使用Cochrane協作網推薦的量表評估納入研究的質量。其次,這是第一個關注piRNA對癌癥的整體診斷性能的研究。我們發現piRNA檢測具有較高的準確性,這為它們應用于臨床提供了證據。第三,我們進行了深入和全面的電子文獻檢索,避免使用檢索過濾器和檢索納入研究和相關綜述中的參考文獻,將錯過相關研究的風險降至最低。第四,兩位作者獨立確定研究并提取資料,從而最大限度地減少文獻篩選和數據提取中的人為錯誤。此外,本研究不僅提供了傳統的Meta分析結果,例如診斷性能指標的匯總估計,還提供了其他分析的結果,例如貝葉斯分析(包括Fagan列線圖),該分析進一步增加了臨床應用信息,使得臨床醫生能夠準確地了解在假陽性和假陰性預測方面犯錯誤的風險。最后,漏斗圖和敏感性分析的結果證明了結果的可靠性。
本研究存在一些局限性,因此需謹慎解釋一些觀察結果。首先,納入研究的研究對象多是亞洲和歐洲人群,非洲人群中piRNA診斷的數據不足(僅有一項研究),本Meta分析可能存在種群偏倚。需要在不同人群中進行進一步的多中心研究,以確認這些結果是否同樣適用于其他種族。其次,一些可能導致異質性的變量(如腫瘤分期、組織學類型、腫瘤大小、轉移情況等)由于數據不足,并未進行進一步的評估。因此,這些因素仍有待研究。第三,雖然這項Meta分析沒有關注單個piRNA,但總的來說,我們發現piRNA可以作為癌癥診斷的獨立風險預測因子。值得注意的是,這些限制主要來自于證據基礎,而不是用于審查和評估的方法。
簡而言之,這項Meta分析表明,piRNA在癌癥的診斷中具有較高的敏感度和特異度,這使得其在臨床上診斷癌癥是可行的;同時,聯合多種piRNA或piRNA和傳統生物標志物可能是提高癌癥檢出率的方法。但當前已發表piRNA的診斷性研究大多受限于有限的樣本和缺乏獨立驗證。因此,建議未來進行大規模的臨床隊列研究進一步探索和驗證piRNA作為腫瘤生物標志物的潛力和優勢。盡管仍然存在許多未知的挑戰,但隨著多組學、測序和其他技術的進步,piRNA作為腫瘤診斷和治療的新靶點將得到進行更深入和全面的評估[46]。
聲明 本文不存在任何利益沖突。