近年來,我國新藥研發投入激增,但面臨療效驗證難、失敗率高、臨床試驗成本高周期長等挑戰。傳統模式難以應對,亟需創新。適應性設計,特別是順序多重分配隨機試驗(sequential multiple assignment randomized trial,SMART),以其靈活高效成為新藥研發新路徑。本研究聚焦于SMART的兩階段設計,分析其原理,并與隨機對照試驗、標準成組序貫設計及交叉設計對比,凸顯其在精準評估治療策略、減少樣本浪費、增強復雜治療路徑探索上的優勢。通過實例分析,驗證了SMART顯著提升臨床試驗效率與治療決策質量,是應對新藥研發挑戰的創新方案。本研究旨在為臨床研究者提供策略參考,促進適應性設計在國內的普及,助力新藥研發高效推進。
引用本文: 周莎, 帥雨杏, 吉萌萌, 錢真真, 姜燕華, 荊志偉, 劉熾, 李紅毅, 禤國維, 陳新林. SMART兩階段設計與臨床試驗常用兩階段設計的比較. 中國循證醫學雜志, 2024, 24(12): 1482-1488. doi: 10.7507/1672-2531.202408007 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
近年來,我國在新藥研發上的投入持續增長,但仍存在兩大難題:一是新藥療效驗證難度大、失敗率高;二是臨床試驗成本高昂、耗時較長,導致企業對藥品臨床試驗意愿降低[1,2]。隨著降低研發成本、縮短周期及加速新藥上市的需求日益增強,傳統臨床試驗設計已難以滿足。因此,適應性設計(adaptive design,AD)在臨床試驗中逐漸受到廣泛關注。AD的臨床試驗可以提前終止,并根據期中分析結果調整方案。
順序多重分配隨機試驗(sequential multiple assignment randomized trial,SMART)設計專門用于解決適應性治療策略(adaptive treatment strategy,ATS)。國內對SMART設計的研究較少,其在臨床試驗案例更罕見。下面以臨床試驗常用的兩階段SMART設計為例來說明其方法學原理,將其與被視為臨床試驗“金標準”的隨機對照試驗(randomized controlled trial,RCT)、AD的標準成組序貫設計以及模式相似的交叉設計作比較,并結合典型實例,分析其優勢及應用前景,以啟發研究者設計方案。
1 AD與SMART設計
AD是一類在保持試驗有效性和完整性的前提下,根據前期成果調整后續試驗計劃參數,修改不合理假設,縮短研究周期、降低成本的研究設計方法,也被稱為可變性設計[3,4]。旨在盡早排除無效試驗藥物,同時確保受試者最大程度獲益。可調整參數包括:研究劑量或治療方案、治療持續時間、研究終點、實驗室試驗程序、診斷程序、可評價性標準、臨床反應評估、刪除/添加治療組,以及安全參數等。在臨床試驗操作中,統計程序的調整包括研究目的和假設、治療分配中的隨機化程序、樣本量重新評估、研究設計、數據監測和期中分析程序、統計分析計劃、數據分析方法等,并通過對預設的第I類錯誤率進行控制,提高試驗成功率。
其中,SMART設計最初由Murphy等研究者提出,是一種結合序貫治療和動態治療的臨床研究設計[5]。該設計包含2個或更多階段,每一個決策點上,受試者都會被隨機分配到不同的治療組,即隨機化過程不僅限于試驗初始階段,而是在后續每個決策節點均進行隨機分配。適應性特征體現在:后續治療方案的選擇,是基于前期已實施的治療措施、以及患者對相應治療方法的反應。這種設計試圖模擬實際臨床決策過程,旨在構建和優化ATS[6-8]。ATS以一序列的治療決策為特征,又被稱作動態治療法[9]、動態治療方案[10]、治療政策[11]、適應性干預[12]等。
SMART設計中,序貫治療根據患者隨時間變化而改變的臨床特征制定系列干預措施,而動態治療基于不同階段患者的臨床特征及療效進行臨床決策。
2 SMART設計的特點及與其他臨床試驗設計的異同
SMART是一種根據患者的特點來實施個性化干預方案(即干預類型和劑量),并根據患者的持續表現不斷調整干預方案的試驗設計。設計包含五大特點:① 嵌入和比較的干預措施為適應性干預;② 一個設計中嵌入多個任務,通過不同適應性干預的比較達到多個試驗目標;③ 多重隨機化;④ 樣本量可調整;⑤ 期中分析。SMART設計預先不固定樣本量(可設初始樣本量),設定關鍵決策點(期中分析),受試者陸續入組,及時獲取處理數據,分析關鍵指標,評估試驗實施及調整樣本量。如(π治療?π對照)≥20%,判定病例招募有效,試驗中止;若(π治療?π對照)≤5%,判定病例招募無效,試驗中止;若5%<(π治療?π對照)<20%,則繼續招募,重估樣本量,并進行第二終點分析。期中分析不影響病例入組。SMART設計在某種程度上與其他臨床試驗設計存在共通之處,但同時具有其獨特性。
2.1 SMART設計與RCT
RCT被稱為干預性臨床試驗的最佳方法和“金標準”[13],符合納入標準的研究對象會被隨機分配至試驗組和對照組,然后施加相應的干預,嚴格控制條件或環境的一致性,同步進行觀察和研究,通過采用客觀指標測量并評價試驗結果,從而最大程度地減小試驗組與對照組之間的不平衡因素[14]。SMART與RCT有相似之處:① 設置基線,納入同質性較高的研究疾病患者,提高可比性;② 遵循隨機、對照原則。
在對比總體目標時,SMART設計與RCT差異顯著:SMART設計的核心目標在于基于數據的分析,構建出高質量且具有適應性的干預策略,其重點在于根據實際數據動態調整干預方案。而與之相對,RCT則主要致力于評估已開發完成、固定不變的(非適應性)干預措施的效果和安全性。在評估干預效果時,RCT通過嚴謹的變量控制,確保研究對象具備相對同質性,并對研究人群實施盲法,以最大限度地減少主觀因素對療效評價的影響。然而,RCT中固定不變的干預措施以及嚴格的研究對象控制,使得其無法真實反映日常診療過程中療效的差異。實際治療中,患者個體差異、臨床反應異質性及慢性病復雜治療周期,導致RCT證據與藥物真實療效有較大差異。SMART設計根據個人需求和病情變化,逐步調整治療,更貼近臨床決策過程。
RCT旨在衡量試驗組是否優于對照組,SMART設計通過隨機比較試驗數據,確定最佳干預方案及適用受試者,并驗證是否應隨進展調整干預[15]。RCT整體評價最終效應,SMART設計則能找出最佳治療方案,包括最佳時機、先后順序等。分析依賴非隨機比較,證據等級低[16,17],但可通過SMART設計后的隨機驗證試驗彌補,比較開發出的適應性干預與替代方案。即SMART制定適應性干預,RCT評估適應性干預有效性。
RCT也具有一定的局限性:如高昂的成本、試驗可行性及倫理要求。篩選研究對象時,排除嚴重病情、多合并癥、特殊人群(如孕婦、兒童)[18],導致其結論難擴展至一般人群。針對特殊人群及罕見病研究,SMART設計彌補空缺,并提出新型snSMART設計[19]—小樣本、順序、多重分配、隨機試驗。
可見,SMART相較于RCT優勢在于制定適應性干預、貼近實際臨床決策、能夠研究特殊人群及罕見病(表1)。二者結合可彌補SMART證據質量不足。
2.2 SMART設計與成組序貫設計
成組序貫設計:試驗劃分成連續分析段,保證段內受試者數量及試驗組與對照組比例與總樣本一致。成組序貫設計類似SMART模式:① 試驗分連續分析段;② 可調整樣本量;③ 受試者序貫進入,定期評估結果。試驗期間,當病例數據滿足要求時,進行期中分析,判斷是否終止。兩種設計均表現出高靈活性。
期中分析在成組序貫設計中的應用價值在于,當證實組間差異確實存在時,可以提前得出結論,從而有效節省試驗樣本量,縮短試驗周期,同時避免受試者接受較差干預的風險,更符合倫理。然而,SMART設計不同于成組序貫設計,在于隨機化在一段時間內重復發生。SMART設計的獨特之處是中間結果,也稱為調整變量、裁剪變量[20],即再隨機化或重新隨機化所依據的變量。SMART設計包含一個額外的目標,是在再隨機點如何測量和管理調整變量。也就是說,SMART設計期中分析,除了判斷是否可以早期停止試驗,還包含了決定是否接受下一步治療以及治療內容,這個過程涉及二次隨機乃至多次隨機。
可見,SMART與RCT期中分析目的和內容迥異,前者適用于評估藥物療效安全性,后者用于尋找最優個性化治療方案(表2)。
2.3 SMART設計與交叉設計
交叉設計,作為臨床研究中的一級設計方案及主要研究方法之一,著重于通過隨機化手段來評估不同干預措施的療效。在此設計中,受試者首先被隨機分配至兩組,分別接受兩種不同的干預措施。隨后,在經過一個特定的洗脫期以消除可能存在的殘留效應后,兩組受試者互換干預措施,確保每位受試者均有機會先后接受兩種不同的干預。通過對比這兩種干預下的結果,為療效評估提供科學依據。
SMART設計作為交叉設計的一種衍生形式,特別適用于慢性病及復發性疾病的臨床研究。在此設計中,受試者可能基于其病情和治療反應接受多種不同的治療策略。與標準的交叉試驗不同,SMART設計中的治療策略是基于前一種治療反應而調整的,充分利用了治療間的相互作用,無需設置洗脫期來消除殘留效應。
在交叉試驗中,設置洗脫期是至關重要的。這一階段的設置旨在確保受試者在接受第二種干預時,其病情已盡可能恢復到初始狀態,從而消除前一種干預可能留下的影響,確保預后因素的均衡性和可比性。在統計結局指標之前,還需對洗脫期的順序效應[21]進行嚴格的檢驗,以確保結果的準確性。
值得注意的是,盡管交叉試驗和SMART設計在形式上有所相似,但其在處理個體差異和殘留效應上存在本質差異(表3)。交叉試驗通過洗脫期來消除個體差異和殘留效應,而SMART設計則更注重治療間的相互作用,無需設置洗脫期。這種差異使得兩種設計方法在臨床研究中具有不同的應用場景和優勢。
綜上所述,上述設計各有優勢,選擇臨床試驗設計需綜合考慮研究目的、研究對象、可分配資源和實施條件等。
3 實例分析
3.1 慢性淋巴細胞白血病(chronic lymphocytic leukemia,CLL)SMART實例設計
以下是一個針對CLL的兩階段SMART設計隨機Ⅲ期臨床研究(CLL SMART)[22]為實例。
伊布替尼(ibrutinib)是CLL的一線用藥,給藥時間越長,治療反應越好,大多數患者達到部分緩解,因此一線治療是伊布替尼維持治療(ibrutinib maintenance,IM),直至疾病進展[23,24]。研究目的是開發一線治療的聯合用藥方案,需要實現2個研究目標:① 確定伊布替尼、維奈托克和奧濱尤妥珠單抗聯用(ibrutinib+venetoclax+obinutuzumab,IVO)+IM是否優于伊布替尼和奧濱尤妥珠單抗聯用(ibrutinib+obinutuzumab,IO)+IM;② 確定對未達到微小殘留病灶完全緩解(MRD-CR)的患者,使用IVO+IM;對達到MRD-CR的患者,使用IVO+IM停藥的治療策略,是否優于IO+IM。在一個臨床試驗設計中解決2個問題、實現2個研究目標,該試驗采用了SMART設計。
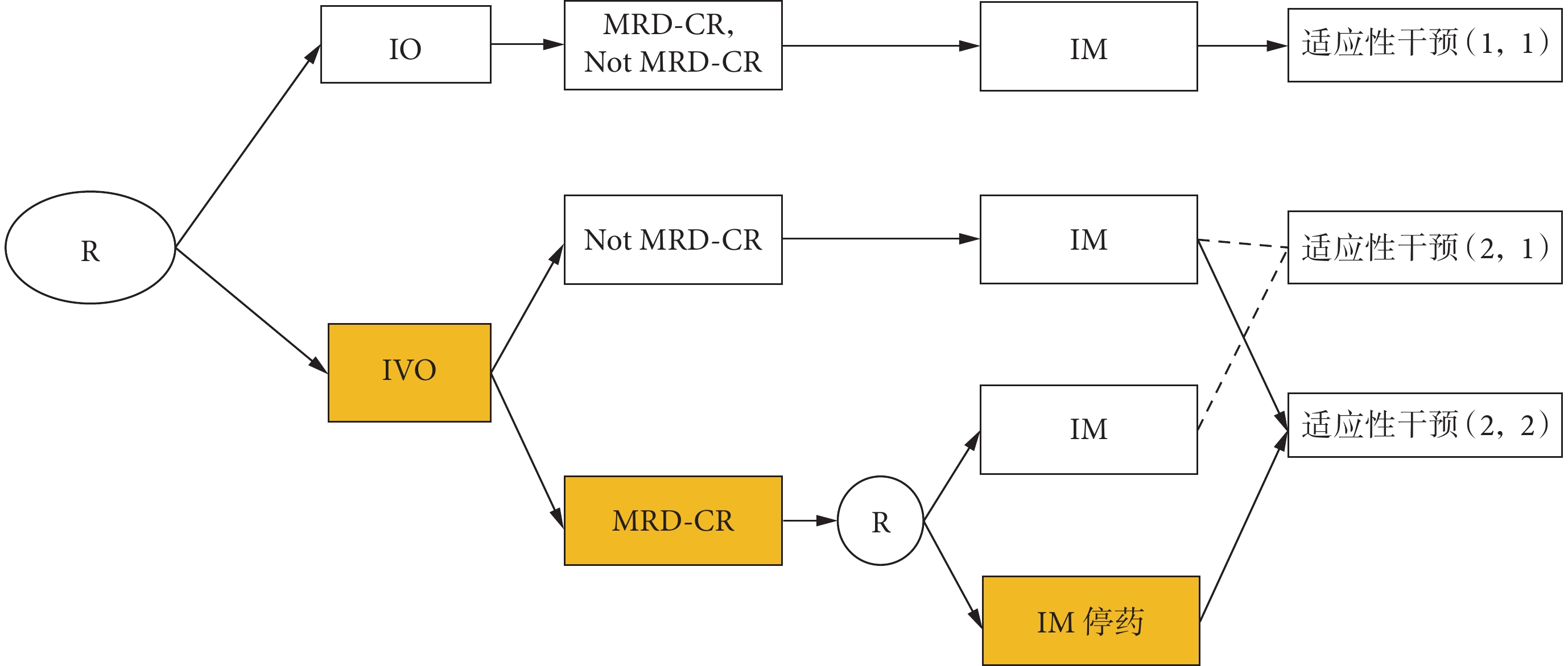
如圖1所示,第一階段,受試者被隨機分配到IO或IVO組。中間結果定義為:是否實現微小殘留病灶完全緩解(MRD-CR/Not MRD-CR)。第一階段干預后,評估MRD-CR狀態。隨機分配到IO組的患者,無論MRD-CR狀態如何,都將接受IM作為第二階段干預。然而,隨機分配到IVO組的患者,第二階段干預將取決于中間結果,即MRD-CR狀態。IVO組,Not MRD-CR的患者將接受IM;IVO組,MRD-CR的患者將以1∶1的比例重新隨機分配至IM或IM停藥。因此,構建了3種適應性干預(圖1):(1,1)IO→Not MRD-CR→IM,IO→MRD-CR→IM;(2,1)IVO→Not MRD-CR→IM,IVO→MRD-CR→IM;(2,2)IVO→Not MRD-CR→IM,IVO→MRD-CR→IM停藥。比較適應性干預(2,1)和(1,1)之間的短期無進展生存期(progression-free survival,PFS),實現研究目標①;比較適應性干預(2,2)和(1,1)的長期PFS,實現研究目標②。
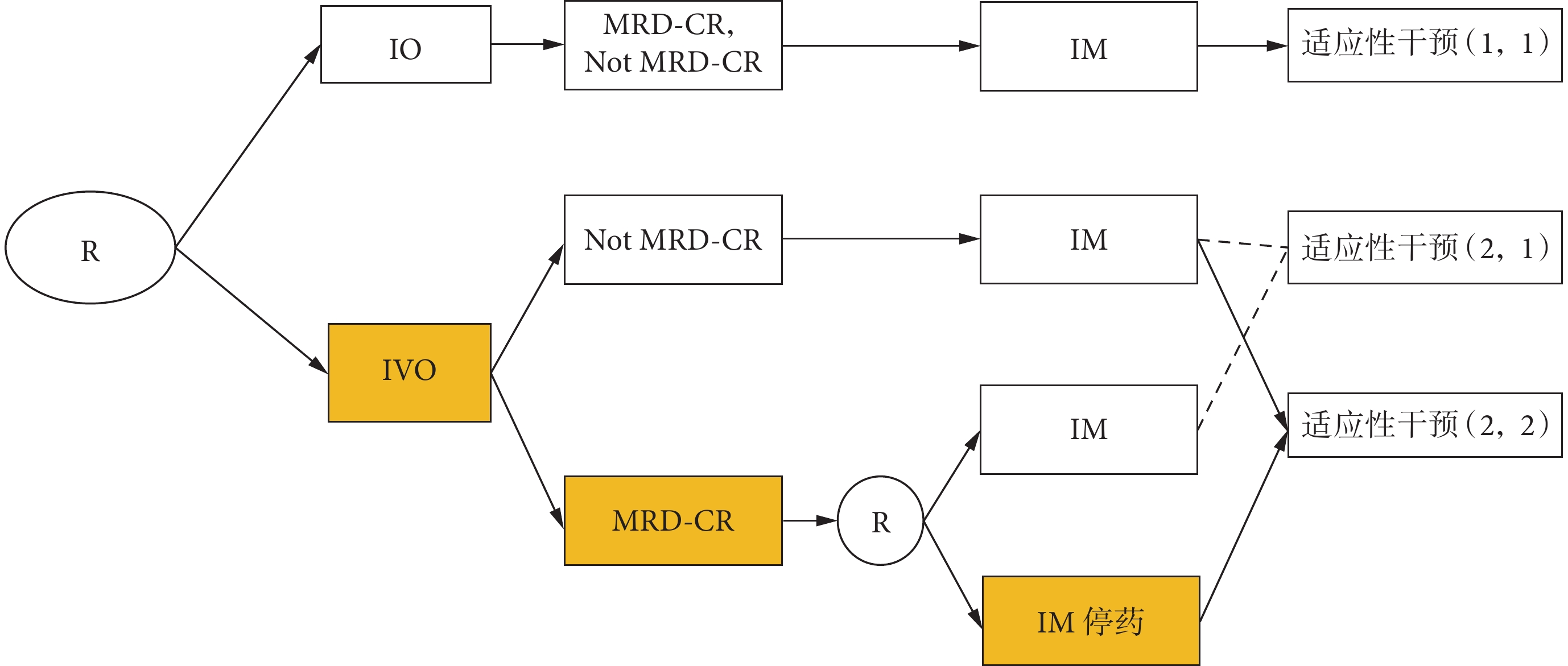 圖1
慢性淋巴細胞白血病SMART*示意圖
圖1
慢性淋巴細胞白血病SMART*示意圖
IO:伊布替尼和奧濱尤妥珠單抗聯用;IVO:伊布替尼、維奈托克和奧濱尤妥珠單抗聯用;MRD-CR:微小殘留病灶完全緩解;IM:伊布替尼維持治療;*:CLL SMART中包含2次隨機,重新隨機化后,隨機分為IM停藥組的患者將不再接受任何伊魯替尼治療。適應性干預(1,1):包括第一階段被隨機分配到IO組,無論其MRD-CR狀態如何,第二階段都將接受IM的患者;適應性干預(2,1):包括第一階段被隨機分配到IVO組,無論MRD-CR狀態如何,第二階段都將接受IM的患者;適應性干預(2,2):包括第一階段被隨機分配到IVO組,對未達到MRD-CR狀態(Not MRD-CR)的患者,第二階段接受IM治療;對于達到MRD-CR狀態的患者,第二階段IM停藥。
3.2 CLL SMART:成組序貫設計
假設改用成組序貫設計,在SMART設計(圖1)使用的相同方案下,亞組IVO→MRD-CR→IM停藥的數據將被排除在主要分析之外。這種方法存在風險[25,26],因為基于中間結果對重新隨機化患者亞組的系統性納入(或排除),并使用標準log-rank檢驗進行分析,會導致有偏比較。而且,重新隨機分配到IM停藥亞組患者的臨床結局將是次要的,且可能信息不足。
3.3 CLL SMART 替代試驗設計:雙臂 RCT
若采用經典的雙臂RCT設計,我們擬對比以下三組治療方案:① IO+IM;② IVO+IM;③ IVO+IM治療Not MRD-CR患者或IVO+IM停藥治療MRD-CR患者。分別類似于CLL SMART研究中嵌入的三種適應性干預,即(1,1)、(2,1)和(2,2)。此舉旨在簡化與SMART設計及二次隨機相關的感知復雜性,并降低對樣本量的需求。
然而,若僅通過雙臂RCT對比① IO+IM與② IVO+IM兩種治療方案,我們將無法對IM停藥在反應強烈患者(MRD-CR)中的治療策略進行有效評估。同樣地,若僅比較① IO+IM與③ IVO+IM治療Not MRD-CR、IM+IVO停藥治療MRD-CR患者,雖然Not MRD-CR的亞組分析,能初步探討IVO+IM是否優于IO+IM,但此類分析將限于描述性質,外推性相對較弱。此外,由于MRD-CR狀態與第二階段干預的潛在混淆,我們將無法進一步進行關于MRD-CR狀態對療效影響的次要比較。因此,在試驗設計階段需充分考慮這些潛在限制,以確保研究結果的準確性和可靠性。
3.4 CLL SMART替代試驗設計:三臂RCT
針對所設定的兩個研究目標,若開展一項嚴謹的三臂隨機臨床試驗,其中患者將被隨機分配至前述三個試驗臂之一。考慮到試驗效率與成本效益,CLL SMART通過從適應性干預(2,1)和(2,2)中未能達到MRD-CR的患者中借用信息,有效減少了所需樣本量[27,28]。然而,這種更為傳統的試驗設計方法存在一個主要挑戰,即相較于CLL SMART的設計,三臂試驗需要更大的樣本量。盡管如此,三臂試驗的設計仍因其能夠直接對比不同治療策略的有效性而具備獨特的科學價值。
CLL SMART證明,根據中間結果,指導患者治療的隨機臨床試驗中,SMART設計可用于確定高質量的ATS,并且在整個過程中維持了統計學的嚴謹性。并指出,在今后的臨床研究中,應充分考慮并應用SMART設計,以優化治療策略的選擇和效果評估。
4 SMART設計的前景展望與面臨的挑戰
4.1 AD及SMART設計的前景
2016年7月和2019年12月,美國食品藥品監督管理局發布了兩份重要指南,分別為Adaptive designs for medical device clinical studies和Adaptive designs for clinical trials of drugs and biologics guidance for industry。這兩份文件清晰地定義了AD在當今醫療研究中的應用背景[29]。2018年8月,美國食品藥品監督管理局啟動了復雜創新試驗設計(complex innovative trial design,CID)試點計劃。該計劃旨在科學應用CID方法,包括復雜AD、貝葉斯方法及其他新穎的臨床試驗設計,從而提升循證研究中醫療的精準性,并加速新藥的開發進程[30]。2021年1月,國家藥品監管評審中心發布了《藥物臨床試驗適應性指導原則(試行)》。該文件強調,適應性修改的特點在于按照預定計劃進行,并需對累計數據進行持續的自我學習[31]。
AD因其靈活性受到臨床研究人員和申辦方歡迎,尤其在預算和資源有限的情況下。考慮醫療安全、試驗完整性和安全性監管,AD成為首選。SMART作為一種有助于高效解決研究問題的復雜創新試驗設計,為構建高質量的適應性干預提供證據。
4.2 SMART設計的局限與應對
SMART設計是傳統RCT的擴展[32],SMART比傳統RCT更適應制定干預、貼近實際臨床、能研究特殊人群和罕見病,但證據質量較低。SMART和成組序貫設計均將試驗分為連續分析段,有定期分析和調整樣本量,但分析內容和目的不同,故適用范圍不同。SMART與交叉設計類似,但SMART多次隨機且干預無需交換,無需洗脫期,體現個體差異。在深入探討SMART設計的實際應用時,我們必須正視其存在的局限性。正如當前學術界的共識所指出,SMART設計因其設計復雜度高、對患者依從性要求高,以及樣本量估計[33]與統計分析領域尚未形成統一共識等因素,使得其在實際操作中面臨多重挑戰。同時,潛在的偏倚風險和實施難度的增加,也為該設計方法的廣泛應用帶來了阻礙。
針對上訴難題,卜志軍等[34]詳盡地探討了4種樣本量估算方法,并深入發掘了與之配套的網頁估算工具。這一舉措極大地促進了臨床研究者在實際操作中對樣本量進行實時、高效的估算,為SMART的科研設計與實施帶來便利。孫源等[32]在研究中系統地闡述了中醫藥領域SMART設計在數據整理與分析階段所遵循的統計假設及相應的統計分析思路與方法,特別強調了在SMART設計中,如何依據科學原則和規范流程,妥善且嚴謹地處理缺失數據的問題,以確保研究結果的可靠性與有效性。在中醫臨床研究的探索中,我們創新性地采納了多中心、分階段實施的SMART試驗設計策略,聚焦于金匱澤瀉湯加味在痰濕型良性陣發性位置性眩暈(benign paroxysmal positional vertigo,BPPV)治療中的辨證應用,并成功開展了一項臨床試驗(注冊編號:ChiCTR2100048603)[35]。此研究旨在深入驗證SMART設計框架在中醫領域臨床試驗中的實踐價值與應用潛力,以期促進中醫科研方法的標準化與國際化發展。
綜上所述,SMART設計在醫療研究領域具有廣闊的前景與潛力,但其實施過程也伴隨著諸多挑戰。未來,隨著技術的不斷進步與研究的深入,我們有理由相信,SMART設計將在克服挑戰中不斷完善與發展,為醫療事業的進步貢獻更大的力量。
5 結語
本文在對二分類、兩階段SMART設計進行全面梳理的基礎上,發現其設計思路已逐漸拓展至多分類、多階段設計領域。然而,這種設計的拓展并非毫無代價。隨著分類的細化和階段的增多,樣本量勢必增大,而實施難度亦會隨之提高。這不僅對研究者的專業素養提出了更高的要求,也對研究資源的配置和利用提出了更高的要求。因此,在推廣和應用SMART設計時,我們需要充分認識到其局限性和挑戰,并在實踐中不斷探索和創新,以期在保障研究質量的同時,最大限度地發揮其在實際工作中的作用和價值。
近年來,SMART設計在國際盛行,獲美國國家衛生基金會支持,正推動傳統隨機試驗向適應性干預變革。然而,我國在這方面稍顯滯后。學者們[36,37]憧憬其在中醫藥領域的巨大潛力,其精簡高效特性可助中醫藥綜合干預效果評價,構建最佳組合方案。盡管其新穎性和統計分析復雜性限制了應用,但引入SMART設計于臨床試驗探索期,特別是中醫藥研究,價值顯著,有望提升研究效率,滿足評估與優化治療需求。
近年來,我國在新藥研發上的投入持續增長,但仍存在兩大難題:一是新藥療效驗證難度大、失敗率高;二是臨床試驗成本高昂、耗時較長,導致企業對藥品臨床試驗意愿降低[1,2]。隨著降低研發成本、縮短周期及加速新藥上市的需求日益增強,傳統臨床試驗設計已難以滿足。因此,適應性設計(adaptive design,AD)在臨床試驗中逐漸受到廣泛關注。AD的臨床試驗可以提前終止,并根據期中分析結果調整方案。
順序多重分配隨機試驗(sequential multiple assignment randomized trial,SMART)設計專門用于解決適應性治療策略(adaptive treatment strategy,ATS)。國內對SMART設計的研究較少,其在臨床試驗案例更罕見。下面以臨床試驗常用的兩階段SMART設計為例來說明其方法學原理,將其與被視為臨床試驗“金標準”的隨機對照試驗(randomized controlled trial,RCT)、AD的標準成組序貫設計以及模式相似的交叉設計作比較,并結合典型實例,分析其優勢及應用前景,以啟發研究者設計方案。
1 AD與SMART設計
AD是一類在保持試驗有效性和完整性的前提下,根據前期成果調整后續試驗計劃參數,修改不合理假設,縮短研究周期、降低成本的研究設計方法,也被稱為可變性設計[3,4]。旨在盡早排除無效試驗藥物,同時確保受試者最大程度獲益。可調整參數包括:研究劑量或治療方案、治療持續時間、研究終點、實驗室試驗程序、診斷程序、可評價性標準、臨床反應評估、刪除/添加治療組,以及安全參數等。在臨床試驗操作中,統計程序的調整包括研究目的和假設、治療分配中的隨機化程序、樣本量重新評估、研究設計、數據監測和期中分析程序、統計分析計劃、數據分析方法等,并通過對預設的第I類錯誤率進行控制,提高試驗成功率。
其中,SMART設計最初由Murphy等研究者提出,是一種結合序貫治療和動態治療的臨床研究設計[5]。該設計包含2個或更多階段,每一個決策點上,受試者都會被隨機分配到不同的治療組,即隨機化過程不僅限于試驗初始階段,而是在后續每個決策節點均進行隨機分配。適應性特征體現在:后續治療方案的選擇,是基于前期已實施的治療措施、以及患者對相應治療方法的反應。這種設計試圖模擬實際臨床決策過程,旨在構建和優化ATS[6-8]。ATS以一序列的治療決策為特征,又被稱作動態治療法[9]、動態治療方案[10]、治療政策[11]、適應性干預[12]等。
SMART設計中,序貫治療根據患者隨時間變化而改變的臨床特征制定系列干預措施,而動態治療基于不同階段患者的臨床特征及療效進行臨床決策。
2 SMART設計的特點及與其他臨床試驗設計的異同
SMART是一種根據患者的特點來實施個性化干預方案(即干預類型和劑量),并根據患者的持續表現不斷調整干預方案的試驗設計。設計包含五大特點:① 嵌入和比較的干預措施為適應性干預;② 一個設計中嵌入多個任務,通過不同適應性干預的比較達到多個試驗目標;③ 多重隨機化;④ 樣本量可調整;⑤ 期中分析。SMART設計預先不固定樣本量(可設初始樣本量),設定關鍵決策點(期中分析),受試者陸續入組,及時獲取處理數據,分析關鍵指標,評估試驗實施及調整樣本量。如(π治療?π對照)≥20%,判定病例招募有效,試驗中止;若(π治療?π對照)≤5%,判定病例招募無效,試驗中止;若5%<(π治療?π對照)<20%,則繼續招募,重估樣本量,并進行第二終點分析。期中分析不影響病例入組。SMART設計在某種程度上與其他臨床試驗設計存在共通之處,但同時具有其獨特性。
2.1 SMART設計與RCT
RCT被稱為干預性臨床試驗的最佳方法和“金標準”[13],符合納入標準的研究對象會被隨機分配至試驗組和對照組,然后施加相應的干預,嚴格控制條件或環境的一致性,同步進行觀察和研究,通過采用客觀指標測量并評價試驗結果,從而最大程度地減小試驗組與對照組之間的不平衡因素[14]。SMART與RCT有相似之處:① 設置基線,納入同質性較高的研究疾病患者,提高可比性;② 遵循隨機、對照原則。
在對比總體目標時,SMART設計與RCT差異顯著:SMART設計的核心目標在于基于數據的分析,構建出高質量且具有適應性的干預策略,其重點在于根據實際數據動態調整干預方案。而與之相對,RCT則主要致力于評估已開發完成、固定不變的(非適應性)干預措施的效果和安全性。在評估干預效果時,RCT通過嚴謹的變量控制,確保研究對象具備相對同質性,并對研究人群實施盲法,以最大限度地減少主觀因素對療效評價的影響。然而,RCT中固定不變的干預措施以及嚴格的研究對象控制,使得其無法真實反映日常診療過程中療效的差異。實際治療中,患者個體差異、臨床反應異質性及慢性病復雜治療周期,導致RCT證據與藥物真實療效有較大差異。SMART設計根據個人需求和病情變化,逐步調整治療,更貼近臨床決策過程。
RCT旨在衡量試驗組是否優于對照組,SMART設計通過隨機比較試驗數據,確定最佳干預方案及適用受試者,并驗證是否應隨進展調整干預[15]。RCT整體評價最終效應,SMART設計則能找出最佳治療方案,包括最佳時機、先后順序等。分析依賴非隨機比較,證據等級低[16,17],但可通過SMART設計后的隨機驗證試驗彌補,比較開發出的適應性干預與替代方案。即SMART制定適應性干預,RCT評估適應性干預有效性。
RCT也具有一定的局限性:如高昂的成本、試驗可行性及倫理要求。篩選研究對象時,排除嚴重病情、多合并癥、特殊人群(如孕婦、兒童)[18],導致其結論難擴展至一般人群。針對特殊人群及罕見病研究,SMART設計彌補空缺,并提出新型snSMART設計[19]—小樣本、順序、多重分配、隨機試驗。
可見,SMART相較于RCT優勢在于制定適應性干預、貼近實際臨床決策、能夠研究特殊人群及罕見病(表1)。二者結合可彌補SMART證據質量不足。
2.2 SMART設計與成組序貫設計
成組序貫設計:試驗劃分成連續分析段,保證段內受試者數量及試驗組與對照組比例與總樣本一致。成組序貫設計類似SMART模式:① 試驗分連續分析段;② 可調整樣本量;③ 受試者序貫進入,定期評估結果。試驗期間,當病例數據滿足要求時,進行期中分析,判斷是否終止。兩種設計均表現出高靈活性。
期中分析在成組序貫設計中的應用價值在于,當證實組間差異確實存在時,可以提前得出結論,從而有效節省試驗樣本量,縮短試驗周期,同時避免受試者接受較差干預的風險,更符合倫理。然而,SMART設計不同于成組序貫設計,在于隨機化在一段時間內重復發生。SMART設計的獨特之處是中間結果,也稱為調整變量、裁剪變量[20],即再隨機化或重新隨機化所依據的變量。SMART設計包含一個額外的目標,是在再隨機點如何測量和管理調整變量。也就是說,SMART設計期中分析,除了判斷是否可以早期停止試驗,還包含了決定是否接受下一步治療以及治療內容,這個過程涉及二次隨機乃至多次隨機。
可見,SMART與RCT期中分析目的和內容迥異,前者適用于評估藥物療效安全性,后者用于尋找最優個性化治療方案(表2)。
2.3 SMART設計與交叉設計
交叉設計,作為臨床研究中的一級設計方案及主要研究方法之一,著重于通過隨機化手段來評估不同干預措施的療效。在此設計中,受試者首先被隨機分配至兩組,分別接受兩種不同的干預措施。隨后,在經過一個特定的洗脫期以消除可能存在的殘留效應后,兩組受試者互換干預措施,確保每位受試者均有機會先后接受兩種不同的干預。通過對比這兩種干預下的結果,為療效評估提供科學依據。
SMART設計作為交叉設計的一種衍生形式,特別適用于慢性病及復發性疾病的臨床研究。在此設計中,受試者可能基于其病情和治療反應接受多種不同的治療策略。與標準的交叉試驗不同,SMART設計中的治療策略是基于前一種治療反應而調整的,充分利用了治療間的相互作用,無需設置洗脫期來消除殘留效應。
在交叉試驗中,設置洗脫期是至關重要的。這一階段的設置旨在確保受試者在接受第二種干預時,其病情已盡可能恢復到初始狀態,從而消除前一種干預可能留下的影響,確保預后因素的均衡性和可比性。在統計結局指標之前,還需對洗脫期的順序效應[21]進行嚴格的檢驗,以確保結果的準確性。
值得注意的是,盡管交叉試驗和SMART設計在形式上有所相似,但其在處理個體差異和殘留效應上存在本質差異(表3)。交叉試驗通過洗脫期來消除個體差異和殘留效應,而SMART設計則更注重治療間的相互作用,無需設置洗脫期。這種差異使得兩種設計方法在臨床研究中具有不同的應用場景和優勢。
綜上所述,上述設計各有優勢,選擇臨床試驗設計需綜合考慮研究目的、研究對象、可分配資源和實施條件等。
3 實例分析
3.1 慢性淋巴細胞白血病(chronic lymphocytic leukemia,CLL)SMART實例設計
以下是一個針對CLL的兩階段SMART設計隨機Ⅲ期臨床研究(CLL SMART)[22]為實例。
伊布替尼(ibrutinib)是CLL的一線用藥,給藥時間越長,治療反應越好,大多數患者達到部分緩解,因此一線治療是伊布替尼維持治療(ibrutinib maintenance,IM),直至疾病進展[23,24]。研究目的是開發一線治療的聯合用藥方案,需要實現2個研究目標:① 確定伊布替尼、維奈托克和奧濱尤妥珠單抗聯用(ibrutinib+venetoclax+obinutuzumab,IVO)+IM是否優于伊布替尼和奧濱尤妥珠單抗聯用(ibrutinib+obinutuzumab,IO)+IM;② 確定對未達到微小殘留病灶完全緩解(MRD-CR)的患者,使用IVO+IM;對達到MRD-CR的患者,使用IVO+IM停藥的治療策略,是否優于IO+IM。在一個臨床試驗設計中解決2個問題、實現2個研究目標,該試驗采用了SMART設計。
如圖1所示,第一階段,受試者被隨機分配到IO或IVO組。中間結果定義為:是否實現微小殘留病灶完全緩解(MRD-CR/Not MRD-CR)。第一階段干預后,評估MRD-CR狀態。隨機分配到IO組的患者,無論MRD-CR狀態如何,都將接受IM作為第二階段干預。然而,隨機分配到IVO組的患者,第二階段干預將取決于中間結果,即MRD-CR狀態。IVO組,Not MRD-CR的患者將接受IM;IVO組,MRD-CR的患者將以1∶1的比例重新隨機分配至IM或IM停藥。因此,構建了3種適應性干預(圖1):(1,1)IO→Not MRD-CR→IM,IO→MRD-CR→IM;(2,1)IVO→Not MRD-CR→IM,IVO→MRD-CR→IM;(2,2)IVO→Not MRD-CR→IM,IVO→MRD-CR→IM停藥。比較適應性干預(2,1)和(1,1)之間的短期無進展生存期(progression-free survival,PFS),實現研究目標①;比較適應性干預(2,2)和(1,1)的長期PFS,實現研究目標②。
 圖1
慢性淋巴細胞白血病SMART*示意圖
圖1
慢性淋巴細胞白血病SMART*示意圖
IO:伊布替尼和奧濱尤妥珠單抗聯用;IVO:伊布替尼、維奈托克和奧濱尤妥珠單抗聯用;MRD-CR:微小殘留病灶完全緩解;IM:伊布替尼維持治療;*:CLL SMART中包含2次隨機,重新隨機化后,隨機分為IM停藥組的患者將不再接受任何伊魯替尼治療。適應性干預(1,1):包括第一階段被隨機分配到IO組,無論其MRD-CR狀態如何,第二階段都將接受IM的患者;適應性干預(2,1):包括第一階段被隨機分配到IVO組,無論MRD-CR狀態如何,第二階段都將接受IM的患者;適應性干預(2,2):包括第一階段被隨機分配到IVO組,對未達到MRD-CR狀態(Not MRD-CR)的患者,第二階段接受IM治療;對于達到MRD-CR狀態的患者,第二階段IM停藥。
3.2 CLL SMART:成組序貫設計
假設改用成組序貫設計,在SMART設計(圖1)使用的相同方案下,亞組IVO→MRD-CR→IM停藥的數據將被排除在主要分析之外。這種方法存在風險[25,26],因為基于中間結果對重新隨機化患者亞組的系統性納入(或排除),并使用標準log-rank檢驗進行分析,會導致有偏比較。而且,重新隨機分配到IM停藥亞組患者的臨床結局將是次要的,且可能信息不足。
3.3 CLL SMART 替代試驗設計:雙臂 RCT
若采用經典的雙臂RCT設計,我們擬對比以下三組治療方案:① IO+IM;② IVO+IM;③ IVO+IM治療Not MRD-CR患者或IVO+IM停藥治療MRD-CR患者。分別類似于CLL SMART研究中嵌入的三種適應性干預,即(1,1)、(2,1)和(2,2)。此舉旨在簡化與SMART設計及二次隨機相關的感知復雜性,并降低對樣本量的需求。
然而,若僅通過雙臂RCT對比① IO+IM與② IVO+IM兩種治療方案,我們將無法對IM停藥在反應強烈患者(MRD-CR)中的治療策略進行有效評估。同樣地,若僅比較① IO+IM與③ IVO+IM治療Not MRD-CR、IM+IVO停藥治療MRD-CR患者,雖然Not MRD-CR的亞組分析,能初步探討IVO+IM是否優于IO+IM,但此類分析將限于描述性質,外推性相對較弱。此外,由于MRD-CR狀態與第二階段干預的潛在混淆,我們將無法進一步進行關于MRD-CR狀態對療效影響的次要比較。因此,在試驗設計階段需充分考慮這些潛在限制,以確保研究結果的準確性和可靠性。
3.4 CLL SMART替代試驗設計:三臂RCT
針對所設定的兩個研究目標,若開展一項嚴謹的三臂隨機臨床試驗,其中患者將被隨機分配至前述三個試驗臂之一。考慮到試驗效率與成本效益,CLL SMART通過從適應性干預(2,1)和(2,2)中未能達到MRD-CR的患者中借用信息,有效減少了所需樣本量[27,28]。然而,這種更為傳統的試驗設計方法存在一個主要挑戰,即相較于CLL SMART的設計,三臂試驗需要更大的樣本量。盡管如此,三臂試驗的設計仍因其能夠直接對比不同治療策略的有效性而具備獨特的科學價值。
CLL SMART證明,根據中間結果,指導患者治療的隨機臨床試驗中,SMART設計可用于確定高質量的ATS,并且在整個過程中維持了統計學的嚴謹性。并指出,在今后的臨床研究中,應充分考慮并應用SMART設計,以優化治療策略的選擇和效果評估。
4 SMART設計的前景展望與面臨的挑戰
4.1 AD及SMART設計的前景
2016年7月和2019年12月,美國食品藥品監督管理局發布了兩份重要指南,分別為Adaptive designs for medical device clinical studies和Adaptive designs for clinical trials of drugs and biologics guidance for industry。這兩份文件清晰地定義了AD在當今醫療研究中的應用背景[29]。2018年8月,美國食品藥品監督管理局啟動了復雜創新試驗設計(complex innovative trial design,CID)試點計劃。該計劃旨在科學應用CID方法,包括復雜AD、貝葉斯方法及其他新穎的臨床試驗設計,從而提升循證研究中醫療的精準性,并加速新藥的開發進程[30]。2021年1月,國家藥品監管評審中心發布了《藥物臨床試驗適應性指導原則(試行)》。該文件強調,適應性修改的特點在于按照預定計劃進行,并需對累計數據進行持續的自我學習[31]。
AD因其靈活性受到臨床研究人員和申辦方歡迎,尤其在預算和資源有限的情況下。考慮醫療安全、試驗完整性和安全性監管,AD成為首選。SMART作為一種有助于高效解決研究問題的復雜創新試驗設計,為構建高質量的適應性干預提供證據。
4.2 SMART設計的局限與應對
SMART設計是傳統RCT的擴展[32],SMART比傳統RCT更適應制定干預、貼近實際臨床、能研究特殊人群和罕見病,但證據質量較低。SMART和成組序貫設計均將試驗分為連續分析段,有定期分析和調整樣本量,但分析內容和目的不同,故適用范圍不同。SMART與交叉設計類似,但SMART多次隨機且干預無需交換,無需洗脫期,體現個體差異。在深入探討SMART設計的實際應用時,我們必須正視其存在的局限性。正如當前學術界的共識所指出,SMART設計因其設計復雜度高、對患者依從性要求高,以及樣本量估計[33]與統計分析領域尚未形成統一共識等因素,使得其在實際操作中面臨多重挑戰。同時,潛在的偏倚風險和實施難度的增加,也為該設計方法的廣泛應用帶來了阻礙。
針對上訴難題,卜志軍等[34]詳盡地探討了4種樣本量估算方法,并深入發掘了與之配套的網頁估算工具。這一舉措極大地促進了臨床研究者在實際操作中對樣本量進行實時、高效的估算,為SMART的科研設計與實施帶來便利。孫源等[32]在研究中系統地闡述了中醫藥領域SMART設計在數據整理與分析階段所遵循的統計假設及相應的統計分析思路與方法,特別強調了在SMART設計中,如何依據科學原則和規范流程,妥善且嚴謹地處理缺失數據的問題,以確保研究結果的可靠性與有效性。在中醫臨床研究的探索中,我們創新性地采納了多中心、分階段實施的SMART試驗設計策略,聚焦于金匱澤瀉湯加味在痰濕型良性陣發性位置性眩暈(benign paroxysmal positional vertigo,BPPV)治療中的辨證應用,并成功開展了一項臨床試驗(注冊編號:ChiCTR2100048603)[35]。此研究旨在深入驗證SMART設計框架在中醫領域臨床試驗中的實踐價值與應用潛力,以期促進中醫科研方法的標準化與國際化發展。
綜上所述,SMART設計在醫療研究領域具有廣闊的前景與潛力,但其實施過程也伴隨著諸多挑戰。未來,隨著技術的不斷進步與研究的深入,我們有理由相信,SMART設計將在克服挑戰中不斷完善與發展,為醫療事業的進步貢獻更大的力量。
5 結語
本文在對二分類、兩階段SMART設計進行全面梳理的基礎上,發現其設計思路已逐漸拓展至多分類、多階段設計領域。然而,這種設計的拓展并非毫無代價。隨著分類的細化和階段的增多,樣本量勢必增大,而實施難度亦會隨之提高。這不僅對研究者的專業素養提出了更高的要求,也對研究資源的配置和利用提出了更高的要求。因此,在推廣和應用SMART設計時,我們需要充分認識到其局限性和挑戰,并在實踐中不斷探索和創新,以期在保障研究質量的同時,最大限度地發揮其在實際工作中的作用和價值。
近年來,SMART設計在國際盛行,獲美國國家衛生基金會支持,正推動傳統隨機試驗向適應性干預變革。然而,我國在這方面稍顯滯后。學者們[36,37]憧憬其在中醫藥領域的巨大潛力,其精簡高效特性可助中醫藥綜合干預效果評價,構建最佳組合方案。盡管其新穎性和統計分析復雜性限制了應用,但引入SMART設計于臨床試驗探索期,特別是中醫藥研究,價值顯著,有望提升研究效率,滿足評估與優化治療需求。