引用本文: 張迎春, 何誠成, 張興國, 張君臣, 謝林波, 武苗, 楊鑒洲, 趙新宇, 譚毅. 卒中后癲癇發作預測模型的構建及危險因素分析. 癲癇雜志, 2024, 10(4): 313-319. doi: 10.7507/2096-0247.202405001 復制
版權信息: ?四川大學華西醫院華西期刊社《癲癇雜志》版權所有,未經授權不得轉載、改編
卒中是對我國人民健康具有重大威脅的疾病,據 2019 年全球疾病負擔研究結果顯示,我國在 2019 年有 394 萬新的卒中病例,2876 萬現存患病病例,有 82.6%為缺血性卒中[1]。卒中具有其較高的致死率和致殘率,是我國成人致死、致殘的重要原因[2],而卒中后癲癇發作是卒中的重要并發癥,其發生率為5~7%[3]。因卒中患者數眾多[1],故而卒中后癲癇發作也較為多見。嚴重影響了患者的生存質量,并具有意外傷害發生風險。目前尚不能準確地解釋卒中后癲癇發作的發病機制[3]。卒中后癲癇發作尚不能被很好的預測,其危險因素也不十分明確。通過一些機器學習算法構建預測模型可以進行臨床預測并提取相關危險因素。可靠地預測卒中后癲癇發作的可能性將有助于臨床醫生決定是否對癲癇診斷治療做準備。構建卒中后癲癇發作的預測模型,可對卒中后癲癇發作高風險的卒中患者進行早期預警和防范,從而,降低對患者的生活質量的影響,減少患者意外傷害發生的風險,同時,可進一步提高對卒中后癲癇發作的危險因素的認識。
1 資料與方法
1.1 臨床資料
回顧性分析中江縣人民醫院 2020 年 7 月— 2022 年 9 月入院的卒中患者,隨訪卒中發生后 1 年內是否發生了卒中后癲癇發作。本研究通過了中江縣人民醫院倫理委員會審查并批準(批件號: JLS-2022-033)及所有患者或監護人知情同意。
1.1.1 納入標準
① 2020 年 7 月— 2022 年 9月間首次發作腦卒中入院的患者,且發病后隨訪 1 年期間內未再發腦卒中;② 住院期間計算機斷層掃描(Computed tomography,CT)、核磁共振成像(Magnetic resonance imaging,MRI)、數字剪影血管造影術(Digital subtraction angiography,DSA) 等影像學明確腦卒中患者;③ 癲癇發作診斷基于國際抗癲癇聯盟癲癇發作2017 年的診斷標準。
1.1.2 排除標準
① 既往發生過腦卒中的患者;② 隨訪期間再發腦卒中患者;③ 既往有癲癇病史;④ 腔隙性卒中;⑤ 住院期間及隨訪期間診斷有惡性腫瘤的患者;⑥ 患者既往及隨訪期間發生過嚴重腦外傷包括顱內出血、腦挫傷等,做過開顱手術,患過腦炎等;⑦ 癲癇發作不確切的患者;⑧ 存在非卒中的因其他嚴重疾病導致的癇樣發作。
1.2 方法
記錄患者性別、年齡、診斷、NIHSS評分、ADL評分、病灶部位、醫學檢驗結果、醫學影像檢查結果等數據。以是否發生卒中后癲癇發作為結果,對這些卒中患者的上述數據進行分析。采用最小絕對收縮和選擇算子(Least absolute shrinkage and selection operator,LASSO)回歸分析篩選預測變量,隨后,進行多因素Logistic 回歸分析。對這兩組患者中隨機獲取的70%的數據集作為訓練集,對他們的數據采用多元邏輯回歸算法構建卒中后癲癇發作的預測模型。然后使用剩下的30%未參與構建模型的患者作為驗證集,將他們的數據用于預測模型的驗證。采用C指數、受試者工作特征曲線(Receiver operating characteristic,ROC)、校準曲線及決策曲線分析(Decision curve analysis,DCA)評估模型效能。
1.3 數據處理與統計學分析
采用變量的均值填充數據中的缺失值。NIHSS評分≤4標記“1”,≥5且≤20標記“2”,≥21標記“3”。ADL評分≤40標記“1”,≥41且≤60標記“2”,≥61標記“3”。計算其余連續變量填充缺失值前的中位數和四分位數并為變量分配標簽,規則為:≤下四分位數值為“1”,> 下四分位數值且≤中位數值為“2”,> 中位數值≤上四分位數為“3”,>上四分位數值為“4”。首先,使用R軟件中的glmnet包進行了LASSO回歸分析對數據集中的變量進行篩選。隨后,根據LASSO回歸的結果,進行多因素Logistic 回歸分析,然后,再使用 R 軟件中的“caret”包、“rms”包、“ROCR”包、“rmda”包進行拆分數據、構建模型、計算C指數、繪制列線圖、校準圖、受試者工作特征曲線、決策曲線,進而評估模型的性能及臨床應用價值。所有數據均已匿名處理,使用了SPSS(版本20.0)和R(版本4.2.3)進行分析,P < 0.05 為差異具有統計學意義。
2 結 果
2.1 一般情況
共納入1 741例腦卒中患者,對這些患者隨訪1年,共有73例有癲癇發作。訓練集樣本數1 221,癲癇發作樣本數54。驗證集樣本數520,癲癇發作樣本數19。
2.2 LASSO回歸分析
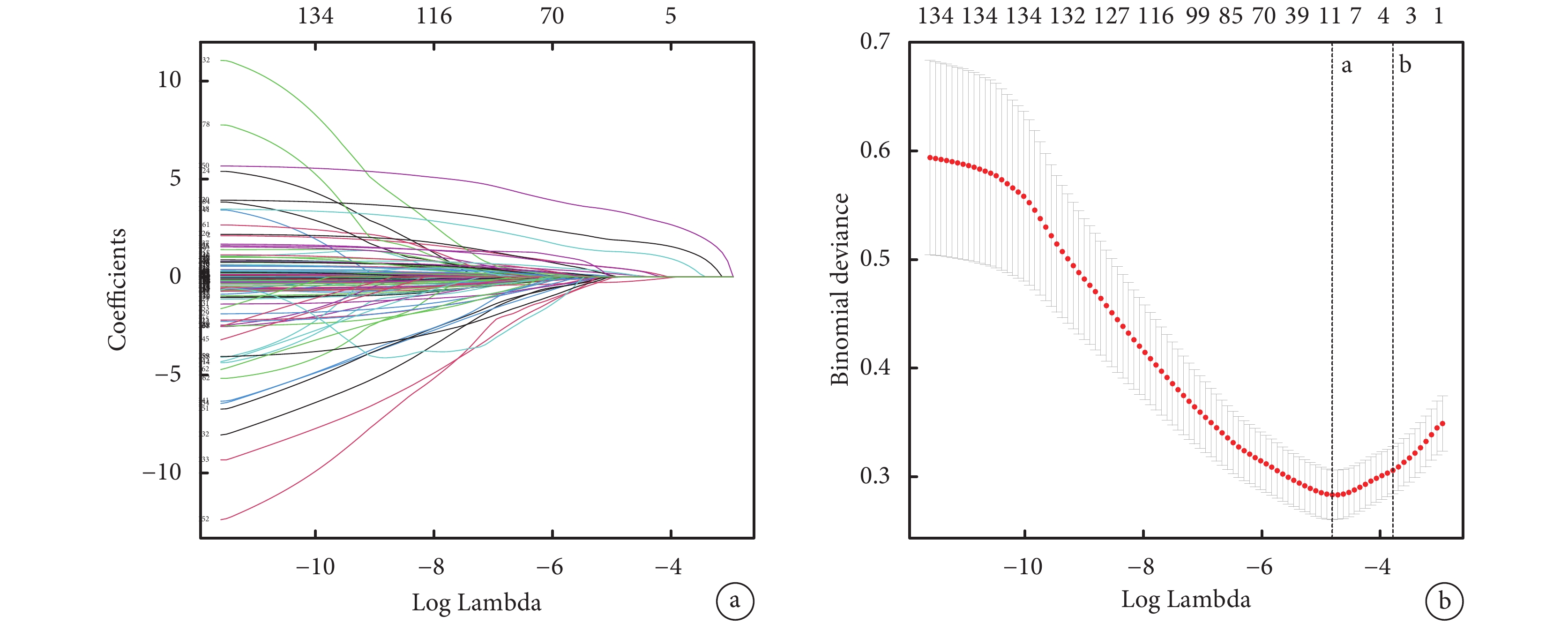
LASSO回歸分析是通過整合最佳性能參數來避免過擬合,從而生成更簡單且更易解釋的模型并篩選變量的一種流行方法。圖1展示了LASSO回歸分析的結果。總共有162個變量納入LASSO回歸分析,最終篩選得到了9個系數非零的預測變量,如表1所示。
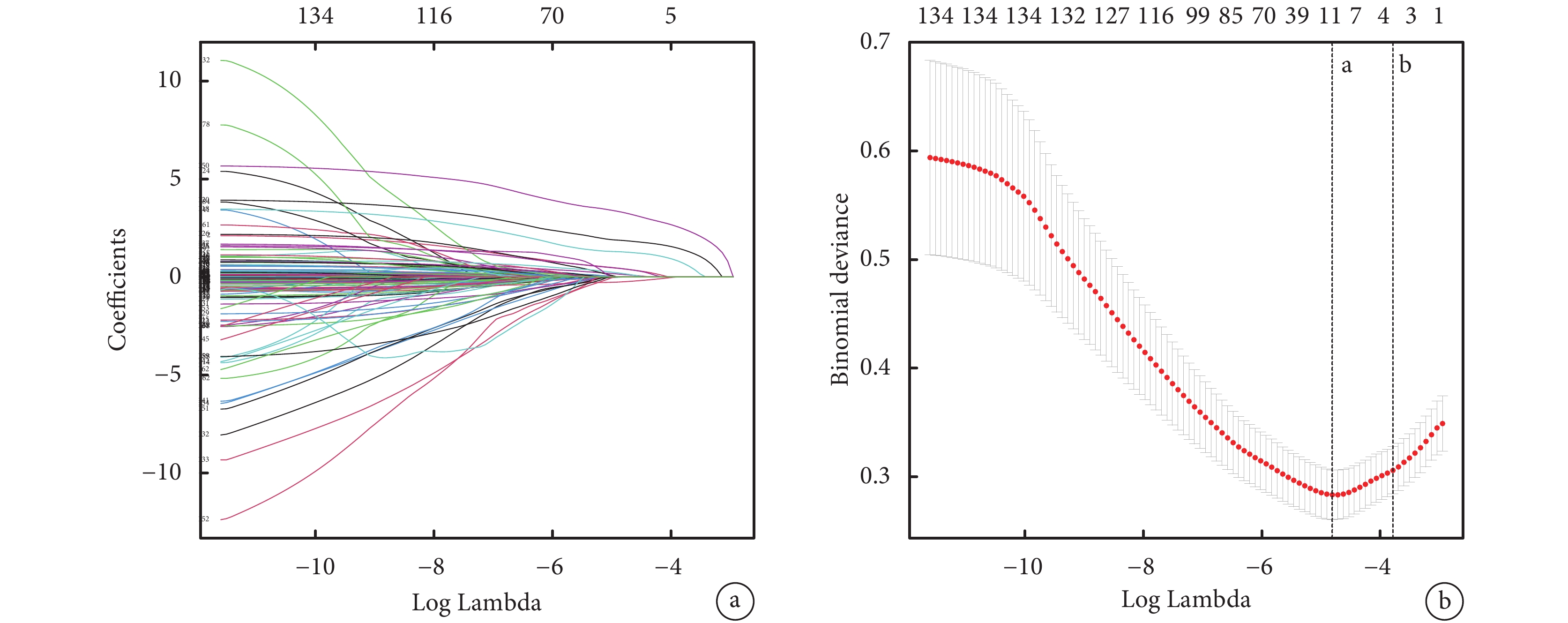 圖1
最小絕對收縮和選擇算子(LASSO)回歸分析
圖1
最小絕對收縮和選擇算子(LASSO)回歸分析
a為LASSO回歸選擇預測相關變量的路徑圖,Coefficients為回歸系數;b為LASSO回歸交叉驗證誤差與lambda關系圖,Binomial deviance為二項式偏差。虛線a表示對應于交叉驗證錯誤最小的λ值的自然對數。虛線b表示對應于交叉驗證錯誤在最小誤差一個標準誤差之內的最大λ值最大值的自然對數。其交叉驗證錯誤最小的λ值lambda.min=0.008166942
2.3 多因素 Logistic 回歸分析結果
表2列出了多因素邏輯回歸分析的結果。其中變量分級Level 1 - Level 4的具體情況詳見表3。結果表明,NIHSS評分、同型半胱氨酸、高尿酸血癥、低鈉血癥、橋腦病灶是與卒中后癲癇發作呈正相關的獨立因素。天門冬氨酸氨基轉移酶、血小板計數是與卒中后癲癇發作呈負相關的獨立因素。
2.4 構建預測模型
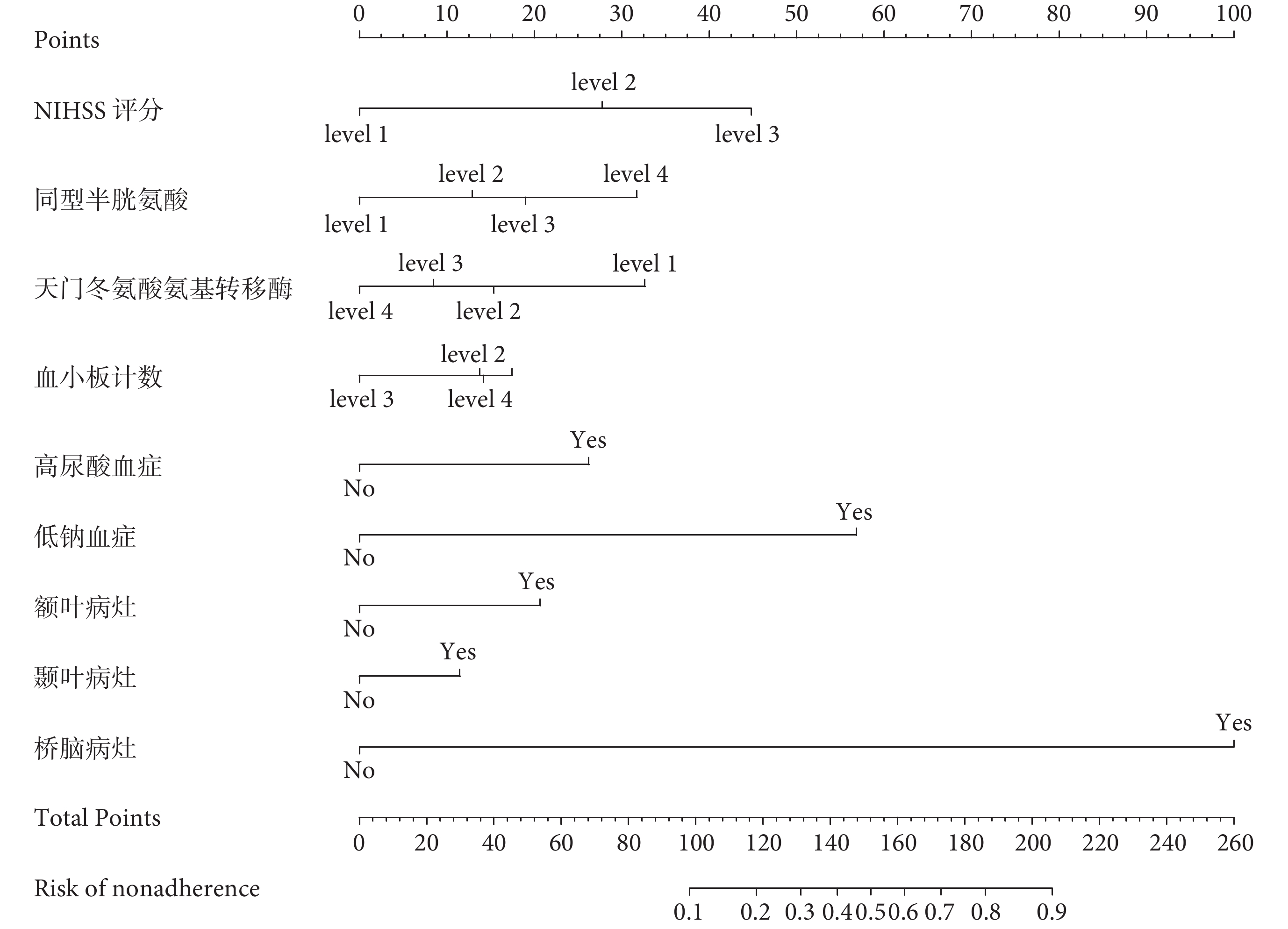
根據LASSO回歸結果,建立卒中后癲癇發作與否的預測模型的列線圖,如圖2所示。患者卒中發生后,依次對應列線圖中具體分值,并通過各項分值的總和對應卒中后癲癇發作與否的概率。
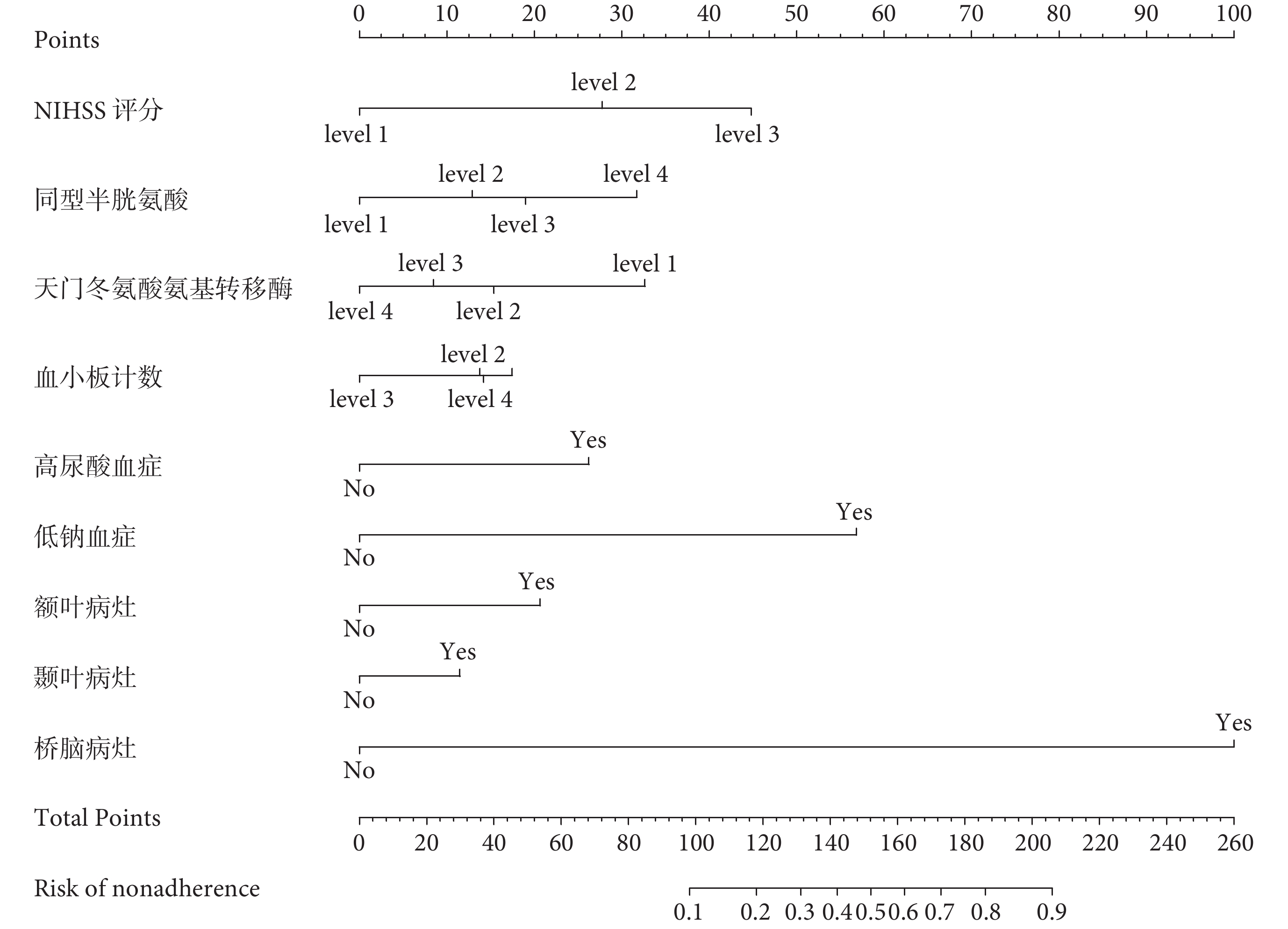 圖2
腦梗死后癲癇發作預測模型的列線圖
圖2
腦梗死后癲癇發作預測模型的列線圖
2.5 列線圖效能驗證
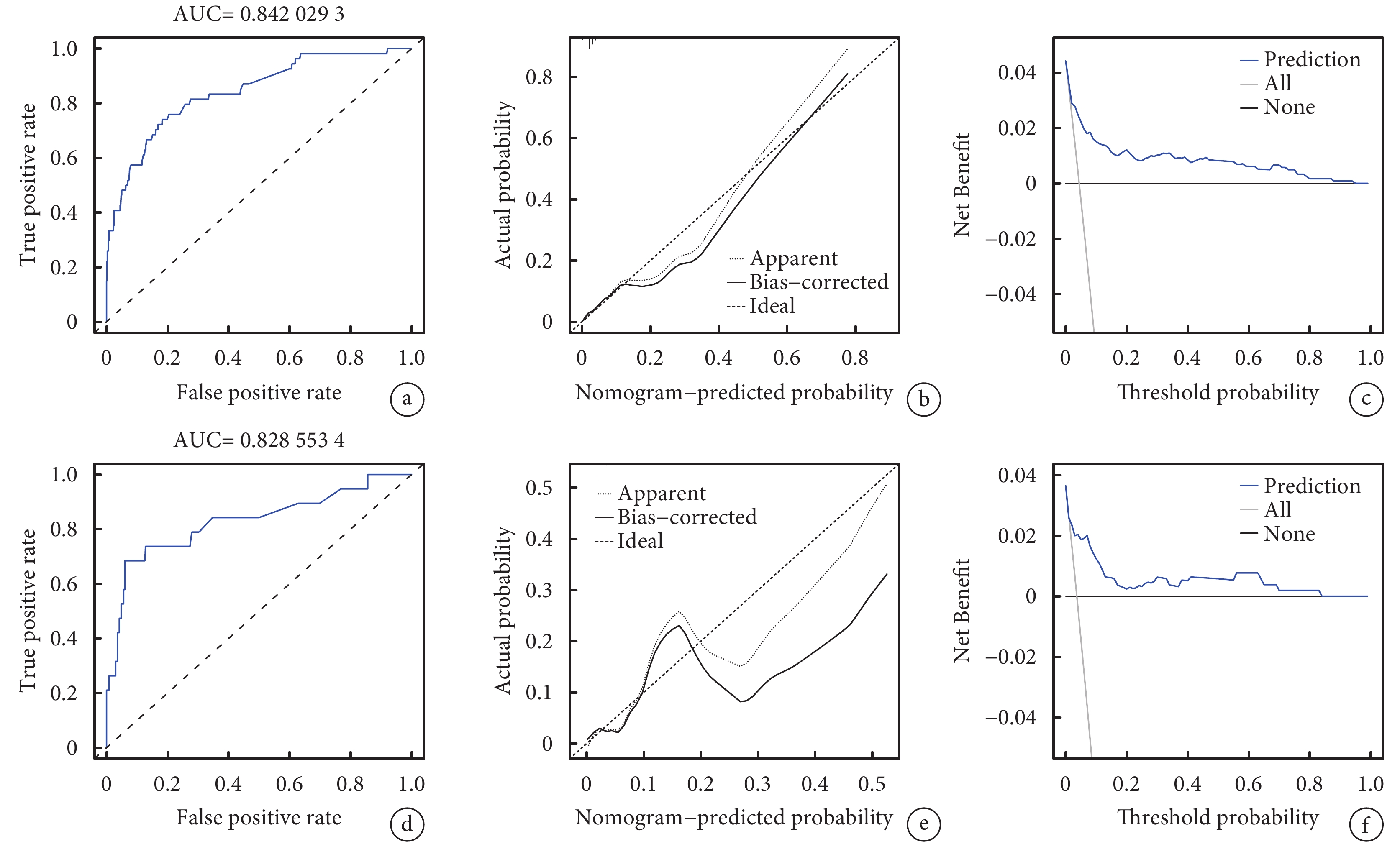
采用C指數、ROC曲線下面積、校準曲線及決策曲線分析驗證模型效能。如圖3所示。結果顯示,訓練集中C指數為0.854[95%CI,(0.841,0.947)],ROC曲線下面積(AUC)為0.842[95%CI(0.777,0.899)],驗證集中C指數為0.838[95%CI(0.800,0.988)],ROC- AUC為0.829[95%CI(0.694,0.936)],說明該模型預測卒中后癲癇發作風險具有中偏高的效能。校準曲線Bootstrap重復抽樣設置1 000次,訓練集平均絕對誤差為0.009;驗證集平均絕對誤差為0.015。同時,訓練集中校準曲線與標準曲線能較好貼合。決策曲線對該模型臨床效能評估顯示,當訓練集與驗證集閾概率分別為0.01~0.94與0.01~0.83時,具有臨床凈獲利,表明使用該模型具有臨床應用效能。
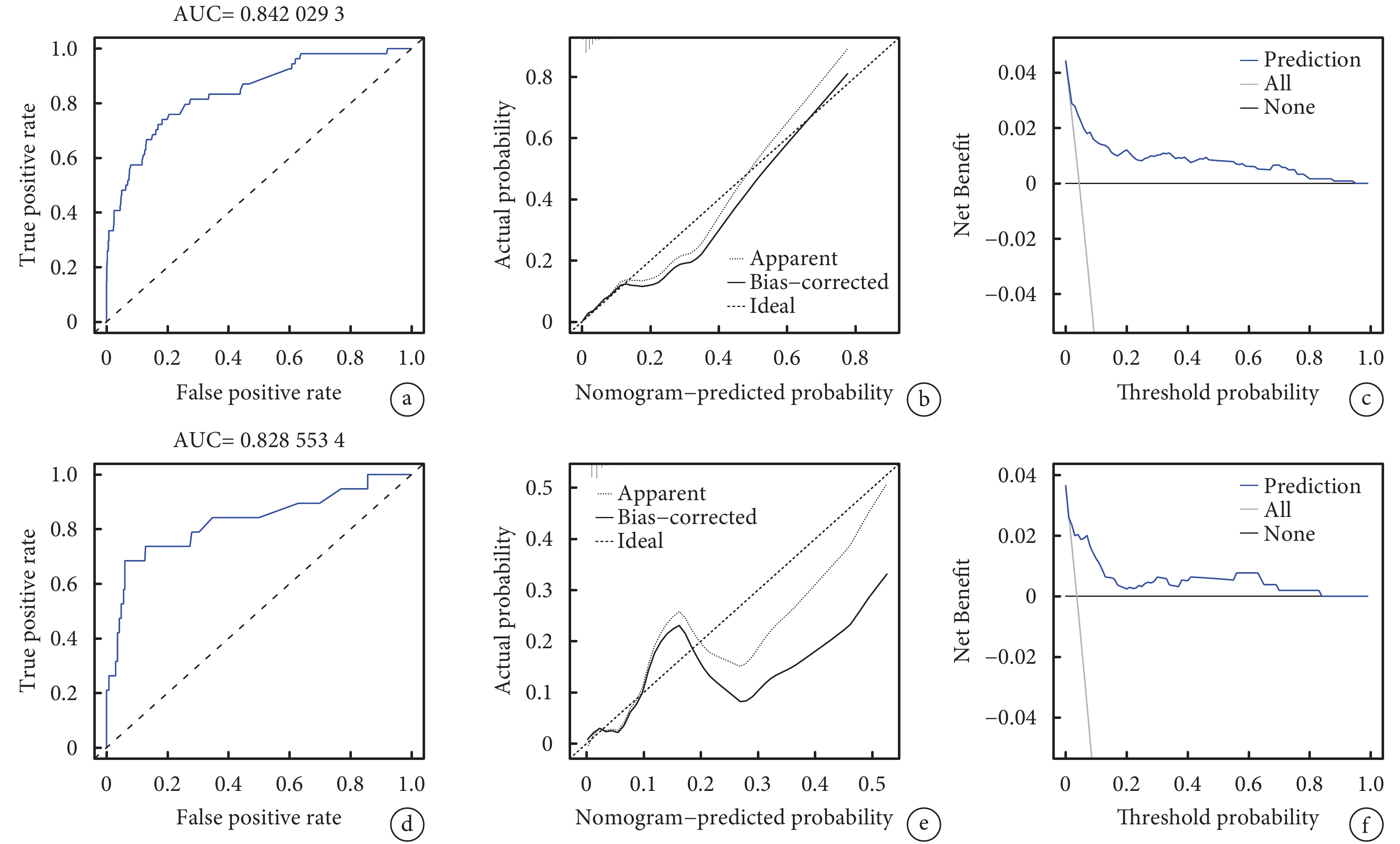 圖3
訓練集與驗證集的受試者工作特征曲線、校準曲線及決策曲線
圖3
訓練集與驗證集的受試者工作特征曲線、校準曲線及決策曲線
a、b、c分別為訓練集的受試者工作特征曲線、校準曲線及決策曲線;d、e、f分別為驗證集的受試者工作特征曲線、校準曲線及決策曲線。其中, True Positive Rate為真陽性率,False positive rate為假陽性率。Actual probability為實際概率,Nomogram-predicted probability為列線圖預測概率,Apparent為觀測曲線 Ideal 為理想曲線Bias-corrected偏差校正后曲線,Net Benefit為凈獲益值,Threshold probability為閾概率,Prediction為預測曲線,All表示所有樣本均為陽性(即對所有樣本采取干預措施)的曲線,None表示所有樣本均為陰性(即對不采取任何干預措施)的曲線
3 討論
本研究構建了基于NIHSS評分、同型半胱氨酸、天門冬氨酸氨基轉移酶、血小板計數、是否有高尿酸血癥與低鈉血癥、是否有額葉病灶、顳葉病灶及橋腦病灶這9項指標的一個卒中后癲癇發作的列線圖預測模型。多變量邏輯回歸分析顯示,NIHSS評分、血同型半胱氨酸濃度、高尿酸血癥、低鈉血癥、橋腦病灶是與卒中后癲癇發作呈正相關的危險因素。血天門冬氨酸氨基轉移酶濃度、血小板計數是與卒中后癲癇發作呈負相關的危險因素。
目前卒中后癲癇發作的發病機制不十分清楚,一般認為,卒中發生后,由于缺血缺氧、代謝紊亂、離子通道功能障礙、生化功能障礙導致的電生理穩定性和神經遞質平衡的變化等,以及大腦血流動力學改變,慢性炎癥反應、瘢痕形成、血管再生、神經變性等病理改變、遺傳因素等因素導致卒中后癲癇發作[3-4]。卒中后癲癇發作的預測模型構建與危險因素的分析可對卒中后癲癇發作高風險的卒中患者進行早期預警和防范,同時,可進一步提高對卒中后癲癇發作的危險因素的認識。
NIHSS評分[5-7]、卒中部位[8-9]、額葉病灶[10-11]、顳葉病灶[12]、血鈉值[13]等被發現為卒中后癲癇發作的危險因素,一些被用于構建預測模型。這些與我們這項研究結果一致。NIHSS評分體現了腦卒中嚴重程度,而額葉、顳葉病灶為大量前循環供血區。本研究還提示后循環供血區的橋腦病灶也是卒中后癲癇發作的危險因素,而且橋腦病灶在我們的列線圖上分值占比最高。橋腦梗死多具有嚴重癥狀,具有較高的致殘率、致死率,嚴重危害健康[14],這與NIHSS評分表現出的卒中嚴重程度與卒中后癲癇發作正相關一致。此外,卒中患者合并低鈉血癥時,低鈉血癥可引起神經系統的損傷引發癲癇[15-16]。
我們的研究發現了一些目前研究較少的與卒中后癲癇發作相關的因素:同型半胱氨酸、天門冬氨酸氨基轉移酶、血小板計數、合并高尿酸血癥。目前有研究表明高同型半胱氨酸血癥可能通過DNA甲基化、N-甲基-D-天冬氨酸(N-methyl-D-aspartic,NMDA)受體、Ca2+通道、高同型半胱氨酸-硫代內酯的神經毒性等機制促進癲癇發生[17]。有研究發現癲癇患者腦脊液中天門冬氨酸氨基轉移酶活性有升高,差異有統計學意義[18]。還有研究發現癲癇患者血清尿酸水平顯著高于對照組[19],同時,血清尿酸水平和癲癇發作、難治性癲癇對治療的反應密切相關[20]。有研究意外發現24%的兒童癲癇患者在接受生酮飲食治療前存在輕度血小板增多,且在尚未進行癲癇治療的患者中最為明顯,而他們血小板增多在生酮飲食治療期間逐漸緩解[21]。此外,部分抗癲癇發作藥物可引起低鈉血癥[16]、高同型半胱氨酸血癥[17]、血小板計數下降[22]及血尿酸水平升高[20],間接顯示了這些因素也與癲癇的發生發展有關。
該研究尚有一定局限性:為一項單中心研究,且未得到外部臨床數據的驗證。但該研究納入模型中的 9 個因素很易獲得,為卒中住院患者常規檢查結果,在臨床中容易得到應用。根據卒中后癲癇發作預測模型,對卒中后癲癇發病相關危險因素進行相應地風險評估和危險分層,有利于提高臨床對卒中后癲癇發作高風險的卒中患者進行早期預警和防范,降低意外傷害發生。同時,提供了一些對卒中后癲癇發作危險因素的新見解。部分危險因素在卒中后癲癇的發生發展中的作用尚待進一步的驗證和研究。
利益沖突聲明 所有作者無利益沖突。
卒中是對我國人民健康具有重大威脅的疾病,據 2019 年全球疾病負擔研究結果顯示,我國在 2019 年有 394 萬新的卒中病例,2876 萬現存患病病例,有 82.6%為缺血性卒中[1]。卒中具有其較高的致死率和致殘率,是我國成人致死、致殘的重要原因[2],而卒中后癲癇發作是卒中的重要并發癥,其發生率為5~7%[3]。因卒中患者數眾多[1],故而卒中后癲癇發作也較為多見。嚴重影響了患者的生存質量,并具有意外傷害發生風險。目前尚不能準確地解釋卒中后癲癇發作的發病機制[3]。卒中后癲癇發作尚不能被很好的預測,其危險因素也不十分明確。通過一些機器學習算法構建預測模型可以進行臨床預測并提取相關危險因素。可靠地預測卒中后癲癇發作的可能性將有助于臨床醫生決定是否對癲癇診斷治療做準備。構建卒中后癲癇發作的預測模型,可對卒中后癲癇發作高風險的卒中患者進行早期預警和防范,從而,降低對患者的生活質量的影響,減少患者意外傷害發生的風險,同時,可進一步提高對卒中后癲癇發作的危險因素的認識。
1 資料與方法
1.1 臨床資料
回顧性分析中江縣人民醫院 2020 年 7 月— 2022 年 9 月入院的卒中患者,隨訪卒中發生后 1 年內是否發生了卒中后癲癇發作。本研究通過了中江縣人民醫院倫理委員會審查并批準(批件號: JLS-2022-033)及所有患者或監護人知情同意。
1.1.1 納入標準
① 2020 年 7 月— 2022 年 9月間首次發作腦卒中入院的患者,且發病后隨訪 1 年期間內未再發腦卒中;② 住院期間計算機斷層掃描(Computed tomography,CT)、核磁共振成像(Magnetic resonance imaging,MRI)、數字剪影血管造影術(Digital subtraction angiography,DSA) 等影像學明確腦卒中患者;③ 癲癇發作診斷基于國際抗癲癇聯盟癲癇發作2017 年的診斷標準。
1.1.2 排除標準
① 既往發生過腦卒中的患者;② 隨訪期間再發腦卒中患者;③ 既往有癲癇病史;④ 腔隙性卒中;⑤ 住院期間及隨訪期間診斷有惡性腫瘤的患者;⑥ 患者既往及隨訪期間發生過嚴重腦外傷包括顱內出血、腦挫傷等,做過開顱手術,患過腦炎等;⑦ 癲癇發作不確切的患者;⑧ 存在非卒中的因其他嚴重疾病導致的癇樣發作。
1.2 方法
記錄患者性別、年齡、診斷、NIHSS評分、ADL評分、病灶部位、醫學檢驗結果、醫學影像檢查結果等數據。以是否發生卒中后癲癇發作為結果,對這些卒中患者的上述數據進行分析。采用最小絕對收縮和選擇算子(Least absolute shrinkage and selection operator,LASSO)回歸分析篩選預測變量,隨后,進行多因素Logistic 回歸分析。對這兩組患者中隨機獲取的70%的數據集作為訓練集,對他們的數據采用多元邏輯回歸算法構建卒中后癲癇發作的預測模型。然后使用剩下的30%未參與構建模型的患者作為驗證集,將他們的數據用于預測模型的驗證。采用C指數、受試者工作特征曲線(Receiver operating characteristic,ROC)、校準曲線及決策曲線分析(Decision curve analysis,DCA)評估模型效能。
1.3 數據處理與統計學分析
采用變量的均值填充數據中的缺失值。NIHSS評分≤4標記“1”,≥5且≤20標記“2”,≥21標記“3”。ADL評分≤40標記“1”,≥41且≤60標記“2”,≥61標記“3”。計算其余連續變量填充缺失值前的中位數和四分位數并為變量分配標簽,規則為:≤下四分位數值為“1”,> 下四分位數值且≤中位數值為“2”,> 中位數值≤上四分位數為“3”,>上四分位數值為“4”。首先,使用R軟件中的glmnet包進行了LASSO回歸分析對數據集中的變量進行篩選。隨后,根據LASSO回歸的結果,進行多因素Logistic 回歸分析,然后,再使用 R 軟件中的“caret”包、“rms”包、“ROCR”包、“rmda”包進行拆分數據、構建模型、計算C指數、繪制列線圖、校準圖、受試者工作特征曲線、決策曲線,進而評估模型的性能及臨床應用價值。所有數據均已匿名處理,使用了SPSS(版本20.0)和R(版本4.2.3)進行分析,P < 0.05 為差異具有統計學意義。
2 結 果
2.1 一般情況
共納入1 741例腦卒中患者,對這些患者隨訪1年,共有73例有癲癇發作。訓練集樣本數1 221,癲癇發作樣本數54。驗證集樣本數520,癲癇發作樣本數19。
2.2 LASSO回歸分析
LASSO回歸分析是通過整合最佳性能參數來避免過擬合,從而生成更簡單且更易解釋的模型并篩選變量的一種流行方法。圖1展示了LASSO回歸分析的結果。總共有162個變量納入LASSO回歸分析,最終篩選得到了9個系數非零的預測變量,如表1所示。
 圖1
最小絕對收縮和選擇算子(LASSO)回歸分析
圖1
最小絕對收縮和選擇算子(LASSO)回歸分析
a為LASSO回歸選擇預測相關變量的路徑圖,Coefficients為回歸系數;b為LASSO回歸交叉驗證誤差與lambda關系圖,Binomial deviance為二項式偏差。虛線a表示對應于交叉驗證錯誤最小的λ值的自然對數。虛線b表示對應于交叉驗證錯誤在最小誤差一個標準誤差之內的最大λ值最大值的自然對數。其交叉驗證錯誤最小的λ值lambda.min=0.008166942
2.3 多因素 Logistic 回歸分析結果
表2列出了多因素邏輯回歸分析的結果。其中變量分級Level 1 - Level 4的具體情況詳見表3。結果表明,NIHSS評分、同型半胱氨酸、高尿酸血癥、低鈉血癥、橋腦病灶是與卒中后癲癇發作呈正相關的獨立因素。天門冬氨酸氨基轉移酶、血小板計數是與卒中后癲癇發作呈負相關的獨立因素。
2.4 構建預測模型
根據LASSO回歸結果,建立卒中后癲癇發作與否的預測模型的列線圖,如圖2所示。患者卒中發生后,依次對應列線圖中具體分值,并通過各項分值的總和對應卒中后癲癇發作與否的概率。
 圖2
腦梗死后癲癇發作預測模型的列線圖
圖2
腦梗死后癲癇發作預測模型的列線圖
2.5 列線圖效能驗證
采用C指數、ROC曲線下面積、校準曲線及決策曲線分析驗證模型效能。如圖3所示。結果顯示,訓練集中C指數為0.854[95%CI,(0.841,0.947)],ROC曲線下面積(AUC)為0.842[95%CI(0.777,0.899)],驗證集中C指數為0.838[95%CI(0.800,0.988)],ROC- AUC為0.829[95%CI(0.694,0.936)],說明該模型預測卒中后癲癇發作風險具有中偏高的效能。校準曲線Bootstrap重復抽樣設置1 000次,訓練集平均絕對誤差為0.009;驗證集平均絕對誤差為0.015。同時,訓練集中校準曲線與標準曲線能較好貼合。決策曲線對該模型臨床效能評估顯示,當訓練集與驗證集閾概率分別為0.01~0.94與0.01~0.83時,具有臨床凈獲利,表明使用該模型具有臨床應用效能。
 圖3
訓練集與驗證集的受試者工作特征曲線、校準曲線及決策曲線
圖3
訓練集與驗證集的受試者工作特征曲線、校準曲線及決策曲線
a、b、c分別為訓練集的受試者工作特征曲線、校準曲線及決策曲線;d、e、f分別為驗證集的受試者工作特征曲線、校準曲線及決策曲線。其中, True Positive Rate為真陽性率,False positive rate為假陽性率。Actual probability為實際概率,Nomogram-predicted probability為列線圖預測概率,Apparent為觀測曲線 Ideal 為理想曲線Bias-corrected偏差校正后曲線,Net Benefit為凈獲益值,Threshold probability為閾概率,Prediction為預測曲線,All表示所有樣本均為陽性(即對所有樣本采取干預措施)的曲線,None表示所有樣本均為陰性(即對不采取任何干預措施)的曲線
3 討論
本研究構建了基于NIHSS評分、同型半胱氨酸、天門冬氨酸氨基轉移酶、血小板計數、是否有高尿酸血癥與低鈉血癥、是否有額葉病灶、顳葉病灶及橋腦病灶這9項指標的一個卒中后癲癇發作的列線圖預測模型。多變量邏輯回歸分析顯示,NIHSS評分、血同型半胱氨酸濃度、高尿酸血癥、低鈉血癥、橋腦病灶是與卒中后癲癇發作呈正相關的危險因素。血天門冬氨酸氨基轉移酶濃度、血小板計數是與卒中后癲癇發作呈負相關的危險因素。
目前卒中后癲癇發作的發病機制不十分清楚,一般認為,卒中發生后,由于缺血缺氧、代謝紊亂、離子通道功能障礙、生化功能障礙導致的電生理穩定性和神經遞質平衡的變化等,以及大腦血流動力學改變,慢性炎癥反應、瘢痕形成、血管再生、神經變性等病理改變、遺傳因素等因素導致卒中后癲癇發作[3-4]。卒中后癲癇發作的預測模型構建與危險因素的分析可對卒中后癲癇發作高風險的卒中患者進行早期預警和防范,同時,可進一步提高對卒中后癲癇發作的危險因素的認識。
NIHSS評分[5-7]、卒中部位[8-9]、額葉病灶[10-11]、顳葉病灶[12]、血鈉值[13]等被發現為卒中后癲癇發作的危險因素,一些被用于構建預測模型。這些與我們這項研究結果一致。NIHSS評分體現了腦卒中嚴重程度,而額葉、顳葉病灶為大量前循環供血區。本研究還提示后循環供血區的橋腦病灶也是卒中后癲癇發作的危險因素,而且橋腦病灶在我們的列線圖上分值占比最高。橋腦梗死多具有嚴重癥狀,具有較高的致殘率、致死率,嚴重危害健康[14],這與NIHSS評分表現出的卒中嚴重程度與卒中后癲癇發作正相關一致。此外,卒中患者合并低鈉血癥時,低鈉血癥可引起神經系統的損傷引發癲癇[15-16]。
我們的研究發現了一些目前研究較少的與卒中后癲癇發作相關的因素:同型半胱氨酸、天門冬氨酸氨基轉移酶、血小板計數、合并高尿酸血癥。目前有研究表明高同型半胱氨酸血癥可能通過DNA甲基化、N-甲基-D-天冬氨酸(N-methyl-D-aspartic,NMDA)受體、Ca2+通道、高同型半胱氨酸-硫代內酯的神經毒性等機制促進癲癇發生[17]。有研究發現癲癇患者腦脊液中天門冬氨酸氨基轉移酶活性有升高,差異有統計學意義[18]。還有研究發現癲癇患者血清尿酸水平顯著高于對照組[19],同時,血清尿酸水平和癲癇發作、難治性癲癇對治療的反應密切相關[20]。有研究意外發現24%的兒童癲癇患者在接受生酮飲食治療前存在輕度血小板增多,且在尚未進行癲癇治療的患者中最為明顯,而他們血小板增多在生酮飲食治療期間逐漸緩解[21]。此外,部分抗癲癇發作藥物可引起低鈉血癥[16]、高同型半胱氨酸血癥[17]、血小板計數下降[22]及血尿酸水平升高[20],間接顯示了這些因素也與癲癇的發生發展有關。
該研究尚有一定局限性:為一項單中心研究,且未得到外部臨床數據的驗證。但該研究納入模型中的 9 個因素很易獲得,為卒中住院患者常規檢查結果,在臨床中容易得到應用。根據卒中后癲癇發作預測模型,對卒中后癲癇發病相關危險因素進行相應地風險評估和危險分層,有利于提高臨床對卒中后癲癇發作高風險的卒中患者進行早期預警和防范,降低意外傷害發生。同時,提供了一些對卒中后癲癇發作危險因素的新見解。部分危險因素在卒中后癲癇的發生發展中的作用尚待進一步的驗證和研究。
利益沖突聲明 所有作者無利益沖突。