引用本文: 李艷, 程子萱, 羅婷, 呂紅彬. 地拉羅司抑制人視網膜血管內皮細胞脂質過氧化和鐵死亡. 中華眼底病雜志, 2024, 40(12): 947-953. doi: 10.3760/cma.j.cn511434-20240701-00243 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
糖尿病視網膜病變(DR)是一種慢性進行性致盲性眼病[1]。視網膜血管內皮細胞(HREC)參與構成血視網膜屏障,其完整性喪失導致的血管通透性增加是DR發病的根本原因[2]。盡管DR的發病機制復雜且尚未完全闡明,但近年來的研究揭示了蛋白質組學變化在DR中的重要角色,尤其是差異蛋白富集于鐵死亡通路,提示鐵死亡可能是DR的潛在治療靶點[3-4]。鐵死亡是一種以鐵依賴為特征的細胞程序性死亡方式,它與鐵代謝、脂質代謝等多種代謝途徑密切相關,鐵死亡可以被脂質活性氧(ROS)清除劑和鐵螯合劑抑制[5-7]。在糖尿病狀態下,體內鐵負荷增加可加速DR發展,特別是在小鼠模型中觀察到視網膜中鐵含量的上升損害了血視網膜屏障的結構與功能;此外,鐵濃度與增生性視網膜病變的嚴重程度呈正比關系,采用低鐵飲食或鐵螯合劑干預能有效減緩糖尿病引起的腎臟損傷進程[8]。地拉羅司(DFX)是一種鐵螯合劑,可以抑制Cys2剝奪、系統XC-抑制以及谷胱甘肽(GSH)過氧化物酶4(GPX4)抑制所致的鐵死亡[9-10]。然而,關于DFX是否能在高糖條件下抑制HREC的鐵死亡及其具體作用機制,仍需進一步探究。為此,本研究通過體外細胞實驗分析DFX對HREC的脂質過氧化和鐵死亡的作用,并初步探討DFX在高糖環境下抑制HREC鐵死亡的潛在機制。現將結果報道如下。
1 材料和方法
1.1 材料
HREC(河南北納生物技術有限公司);Dulbecco改良Eagle培養基(DMEM,L540KJ,美國Gibco公司);DFX(HY-17359)、檸檬酸鐵胺(FAC,HY-B1645)、磷酸鹽緩沖液(PBS)、Tris-HCl緩沖鹽溶液(TBST)(美國MedChemexpress公司);細胞計數試劑盒-8(CCK-8,上海碧云天生物技術有限公司);鈣黃綠素乙酰甲酯(Calcein-AM)細胞增殖活性檢測試劑盒(美國Yeasen公司);2',7'-二氯熒光素二乙酸酯)熒光探針(DCFH-DA)測定試劑盒、脂質過氧化物丙二醛(MDA)試劑盒、GSH和氧化型GSH(GSSG)測定試劑盒(南京建成科技有限公司);GPX4(ab125066)、溶質載體家族7成員11(SLC7A11,26864-1-AP)、β-肌動蛋白(β-actin,AF7018)一抗和二抗(美國Affinity公司);IX51倒置顯微鏡(日本OLYMPUS公司);SMR16.1酶鏈免疫檢測儀(美國TUSCNK公司);DYY-6C電泳儀、DYCZ-24DN垂直電泳槽儀(北京市六一儀器廠)。
1.2 方法
細胞培養與分組。HREC置于含10%胎牛血清和1%雙抗的DMEM培養基中常規培養。取對數生長期細胞用于實驗。HREC分為正常糖組(NG組,5.5 mmol/L葡萄糖培養細胞)、高糖組(HG組,25 mmol/L葡萄糖培養細胞)、正常糖+DFX組(NG+DFX組,5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞)、高糖+DFX組(HG+DFX組,25 mmol/L葡萄糖、50 μmol/L DFX培養細胞)、正常糖+DFX+FAC組(NG+DFX+FAC組,5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞)、高糖+DFX+FAC組(HG+DFX+FAC組,25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞)。所有細胞均孵育24 h進行后續實驗。
光學顯微鏡觀察各組細胞形態變化。將細胞以1×105個/ml的細胞密度接種于T25細胞培養瓶中,培養至細胞貼壁后,光學顯微鏡下觀察細胞形態并采集圖像。
CCK-8檢測各組細胞增殖活性。將細胞以5×104個/ml的密度接種于96孔板中,每100 μl細胞懸液滴加10 μl CCK-8試劑孵育4 h,采用酶鏈免疫檢測儀測量波長450 nm處的吸光度[A,舊稱光密度(OD)]值。每組設6個復孔,實驗重復3次。增殖率(%)=(實驗組-空白組)/(對照組-空白組)×100%。
Calcein-AM檢測各組細胞內不穩定鐵池(LIP)含量。Calcein-AM試劑在室溫下恢復30 min后用PBS配置成終濃度為4 μmol/L的溶液。將細胞以2×105個/ml的密度接種于6孔板中孵育24 h。PBS洗滌3次,胰酶消化并以12 000×g離心5 min,PBS洗滌細胞,向200 μl細胞懸液中加入100 μl Calcein-AM熒光探針染液,充分混勻后在37°C水浴鍋中避光孵育30 min。熒光顯微鏡下觀察并拍照。使用Image J Program軟件計算各組熒光強度。
酶鏈免疫檢測儀檢測各組細胞ROS、MDA、GSH/GSSG含量。ROS含量檢測:將細胞以1×106個/ml的密度接種于6孔板中,每孔滴加1 ml DCFH-DA熒光探針溶液,37℃避光孵育30 min,以12 000×g離心5 min,PBS洗滌2次,采用熒光酶鏈免疫檢測儀檢測波長488 nm處的A值。MDA含量檢測:將細胞以5×104個/ml的密度接種于6孔板中,95℃水浴鍋孵育40 min,以12 000×g離心10 min,每孔滴加250 μl提前配制的標準品和MDA工作液。采用酶鏈免疫檢測儀測量波長532 nm處的A值。GSH/GSSG含量檢測:將細胞以1×105個/ml密度接種于6孔板中,每100 μl待測細胞中滴加20 μl的標準品和GSH試劑,95℃水浴鍋孵育40 min,以4 000×g離心10 min。采用酶鏈免疫檢測儀測量波長405 nm處的A值。根據標準品的A值作出標準曲線后,樣品對照標準曲線計算出GSH和GSSG的含量。
蛋白質免疫印跡法(Western blot)檢測各組細胞GPX4、SLC7A11蛋白相對表達量。收集各組細胞總蛋白,調整蛋白濃度,每個樣品中加入40 μg待測樣品,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳中上樣電泳;80 V恒壓0.5 h,樣品進入分離膠后120 V恒壓2 h,300 mA轉膜2 h,5%脫脂牛奶常溫封閉1 h,一抗GPX4、SLC7A11、β-actin(1∶1 000)4℃過夜孵育(β-actin作為陽性對照),TBST洗膜5 min,重復3次;加入辣根過氧化物偶聯的二抗(1∶5 000),37℃孵育2 h,TBST洗膜5 min,重復4次;加入化學發光劑,暗室顯影成像。采用Image J Program軟件分析蛋白條帶灰度值,以目的條帶與β-actin條帶的比值代表蛋白的相對表達水平。
1.3 統計學方法
采用Graphpad prism 10.3軟件進行統計分析和圖表整理。計量資料以均數±標準差(x±s)表示。兩組間比較采用雙尾Student t檢驗;多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 DFX改善高糖誘導的HREC細胞增殖活力
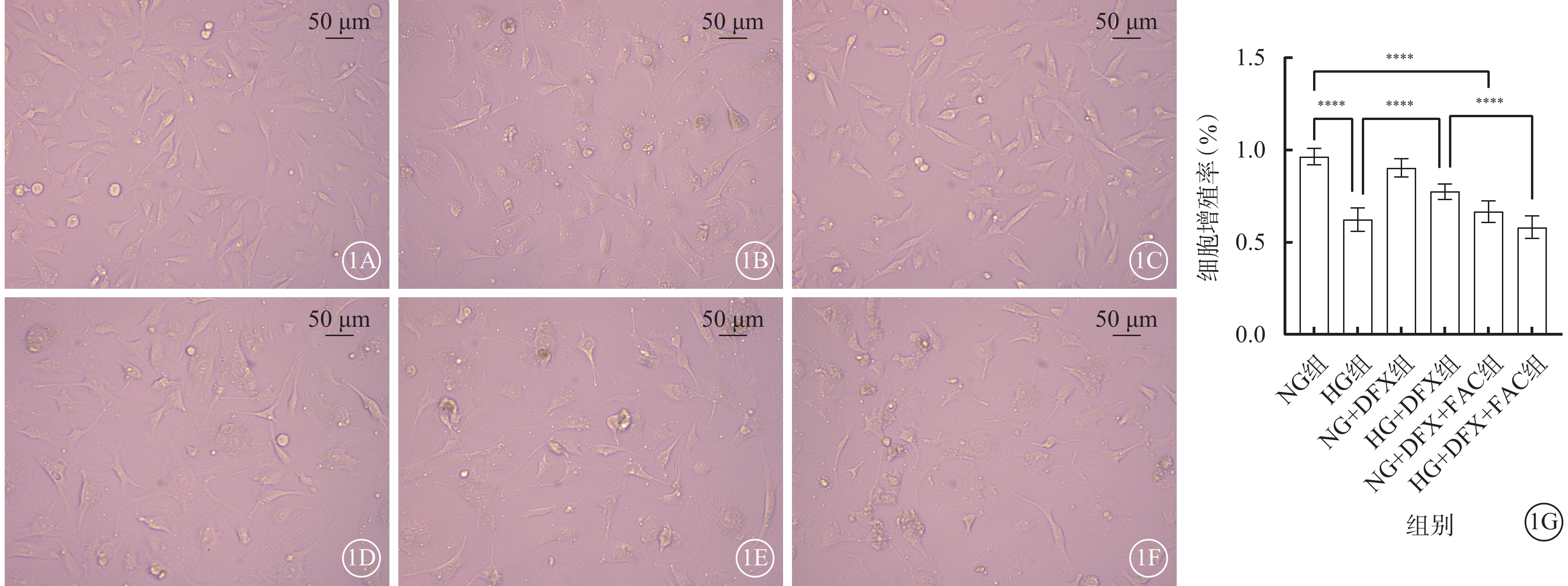
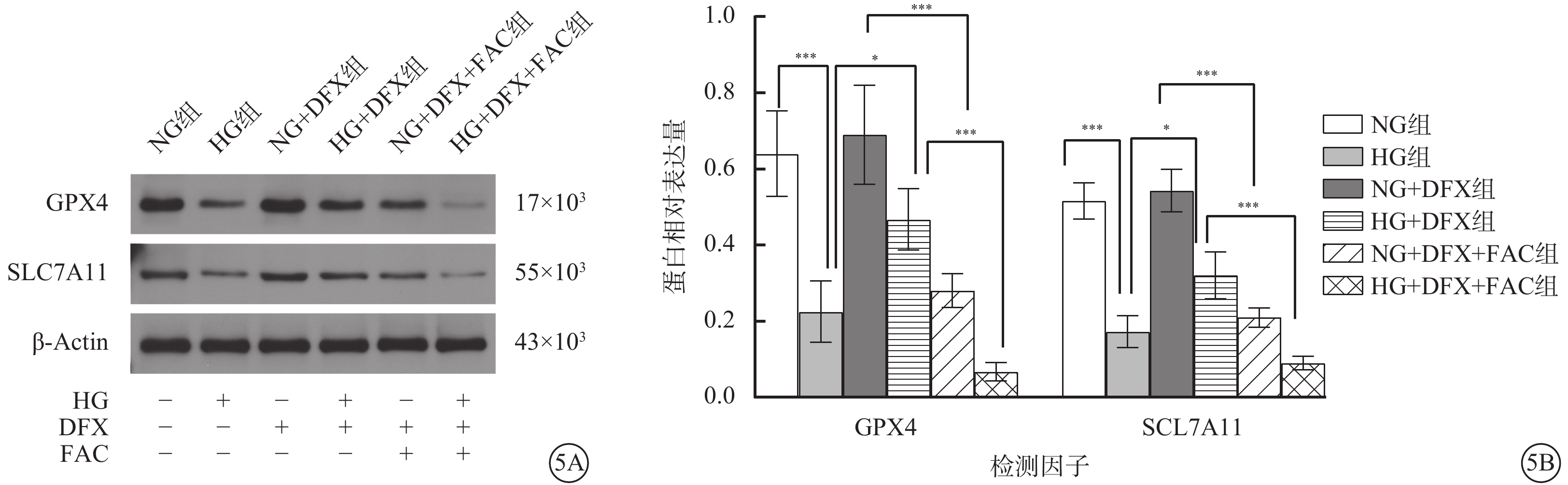
細胞培養24 h后,NG組細胞呈梭形,分布均勻,貼壁良好;HG組細胞貼壁不佳,部分細胞呈圓形漂浮于培養基中;NG+DFX組細胞生長情況良好,細胞狀態接近NG組;HG+DFX組大部分細胞貼壁生長,少量細胞呈圓形漂浮于培養基中;NG+DFX+FAC組細胞貼壁不佳,較多細胞呈圓形漂浮于培養基中;HG+DFX+FAC組少許細胞貼壁,大量細胞呈圓形漂浮于培養基中。6組間細胞增殖率比較,差異有統計學意義(F=150.70,P<0.000 1)。組間細胞增殖率兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=19.01、8.49、13.23、10.74,P<0.000 1)(圖1)。
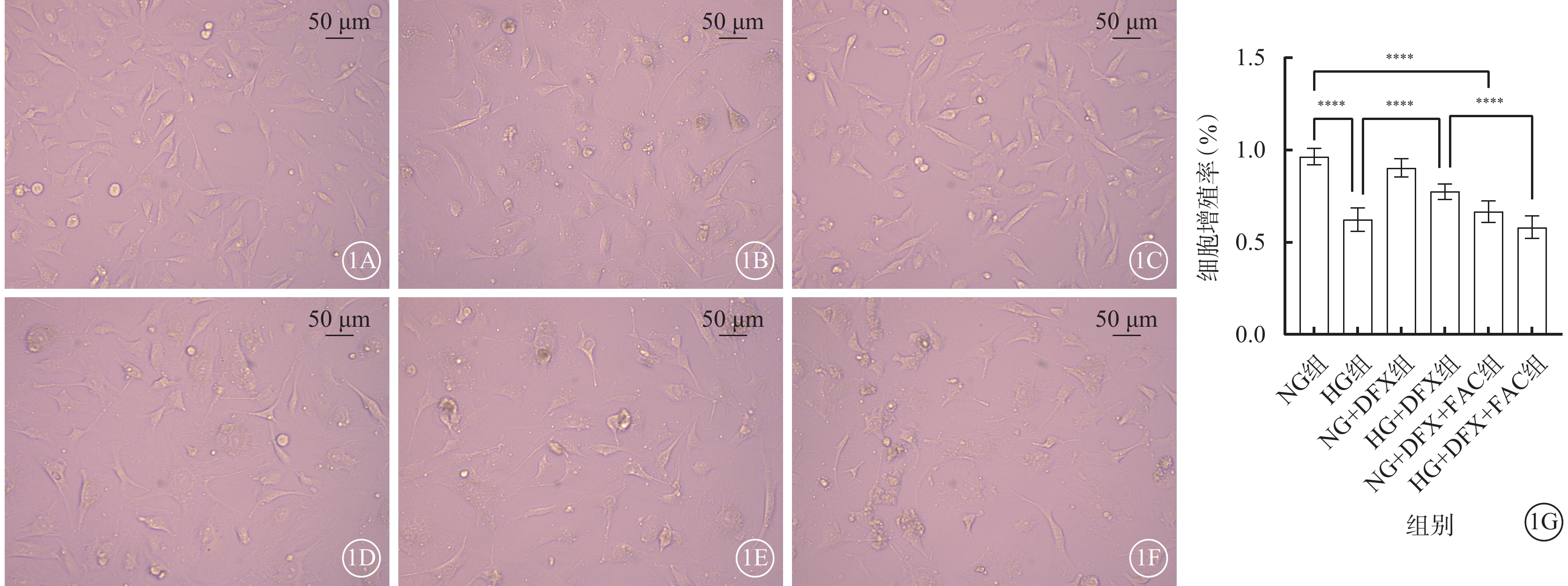 圖1
DFX改善高糖誘導的HREC細胞增殖(n=3) 1A~1F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC光學顯微鏡像(標尺:50 μm)。與NG組比較,HG組細胞貼壁不佳,部分細胞呈圓形漂浮于培養基中;加入DFX后細胞貼壁情況改善,浮游細胞減少,加入FAC則可逆轉DFX對HREC的保護作用。1G示6組細胞增殖率比較,****P<0.000 1 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖1
DFX改善高糖誘導的HREC細胞增殖(n=3) 1A~1F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC光學顯微鏡像(標尺:50 μm)。與NG組比較,HG組細胞貼壁不佳,部分細胞呈圓形漂浮于培養基中;加入DFX后細胞貼壁情況改善,浮游細胞減少,加入FAC則可逆轉DFX對HREC的保護作用。1G示6組細胞增殖率比較,****P<0.000 1 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.2 DFX抑制HREC鐵過載
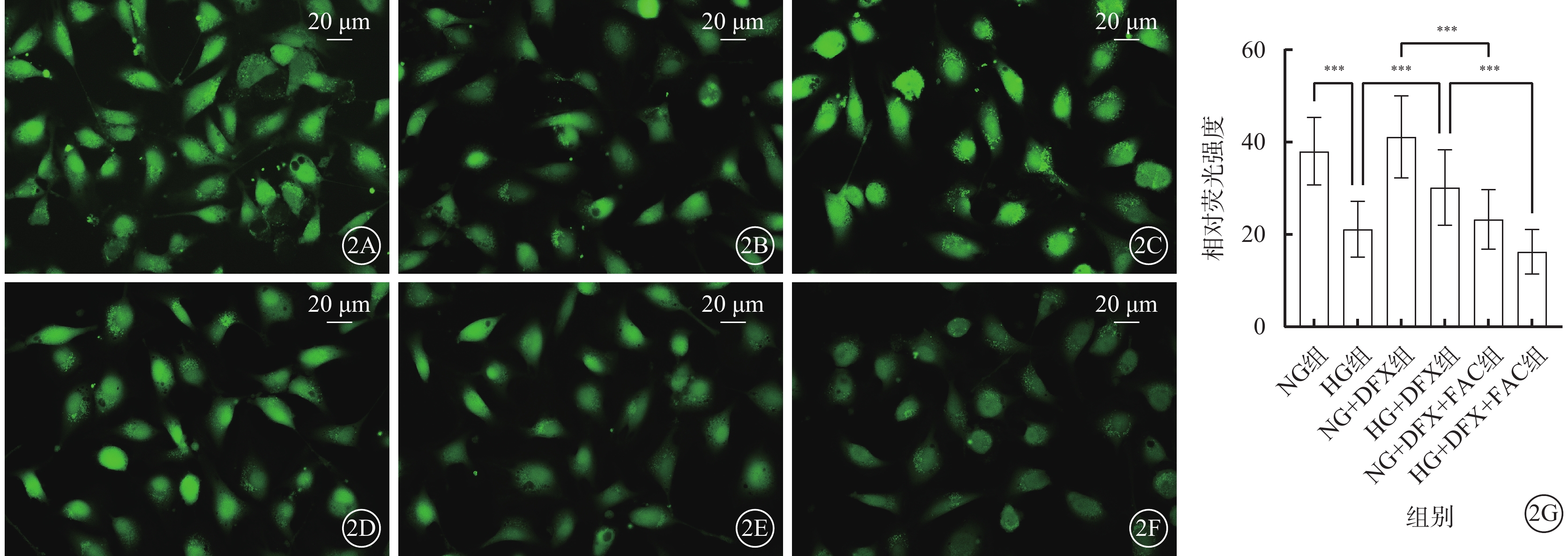
平均熒光強度與細胞內LIP含量成反比。熒光顯微鏡觀察發現,HG組、NG+DFX+FAC組、HG+DFX+FAC組熒光強度顯著下降,LIP含量上升;HG+DFX組熒光強度顯著增強,LIP含量下降。各組細胞間熒光強度比較,差異有統計學意義(F=807.20,P<0.001)。組間熒光強度兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=34.96、18.95、37.52、28.10,P<0.001)(圖2)。
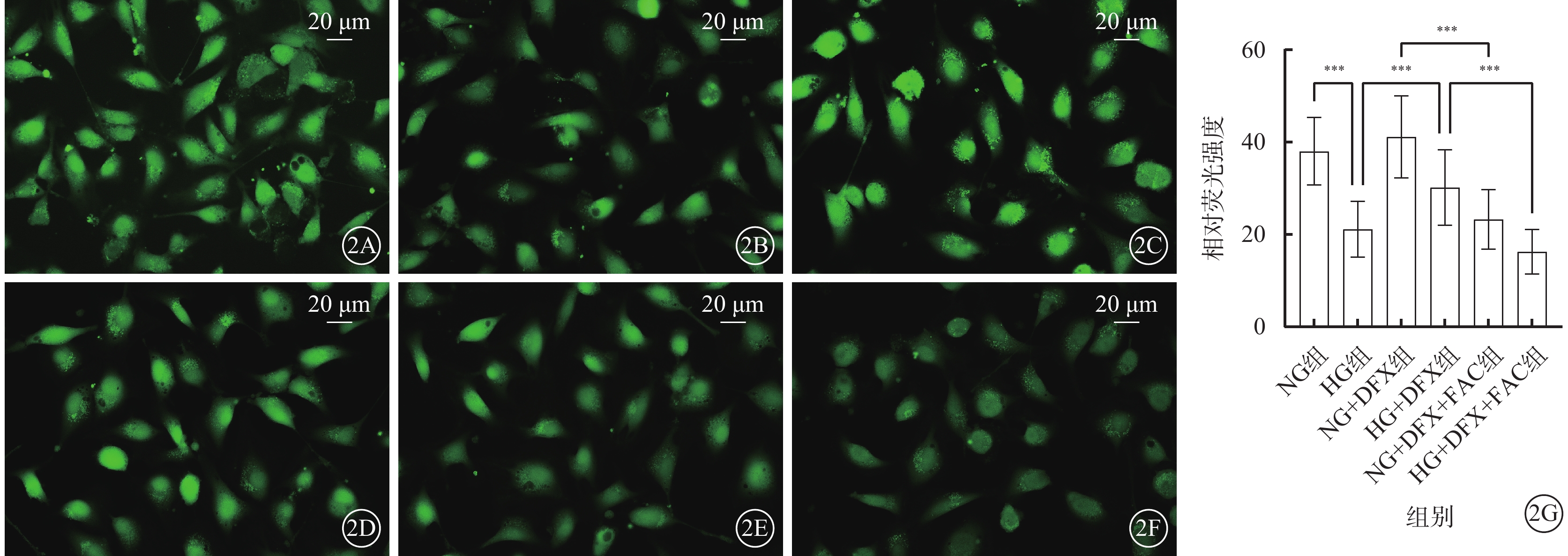 圖2
DFX抑制HREC中LIP含量(n=3) 2A~2F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC熒光顯微鏡像(標尺:20 μm)。與NG組比較,HG組熒光強度顯著下降,LIP含量上升;加入DFX后熒光強度顯著增強,LIP含量下降,加入FAC則可逆轉DFX的鐵螯合作用。2G示6組細胞熒光強度比較,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;LIP:不穩定鐵池;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖2
DFX抑制HREC中LIP含量(n=3) 2A~2F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC熒光顯微鏡像(標尺:20 μm)。與NG組比較,HG組熒光強度顯著下降,LIP含量上升;加入DFX后熒光強度顯著增強,LIP含量下降,加入FAC則可逆轉DFX的鐵螯合作用。2G示6組細胞熒光強度比較,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;LIP:不穩定鐵池;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.3 DFX抑制HREC中ROS生成
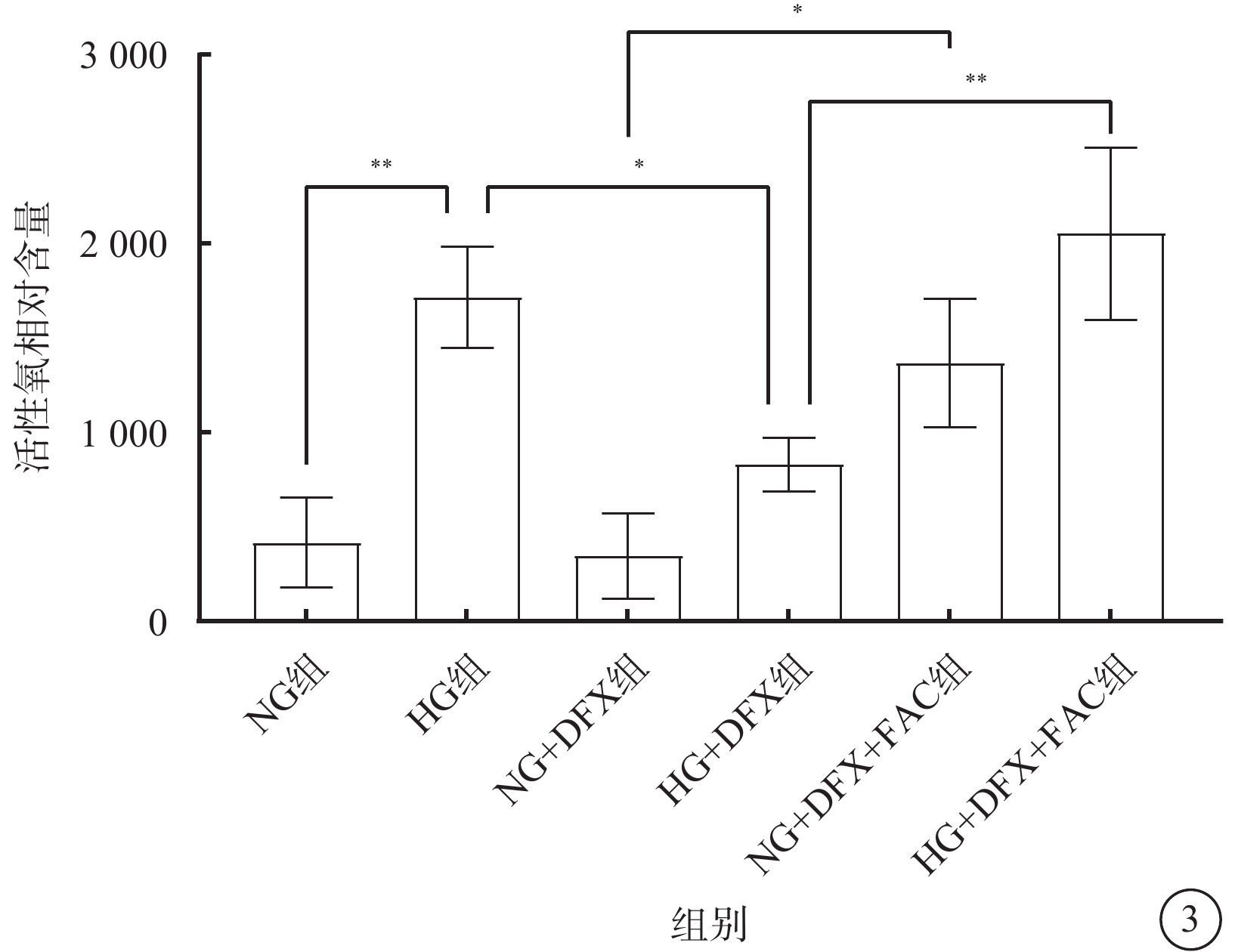
DCFH-DA檢測結果顯示,各組細胞間ROS水平差異有統計學意義(F=16.94,P<0.001)。組間ROS含量兩兩比較,HG組較NG組顯著升高,HG+DFX組較HG組顯著降低,NG+DFX+FAC組較NG+DFX組顯著升高,HG+DFX+FAC組較HG+DFX組顯著升高,差異均有統計學意義(t=5.38、3.66、4.24、5.07,P<0.01、0.05、0.05、0.01)(圖3)。
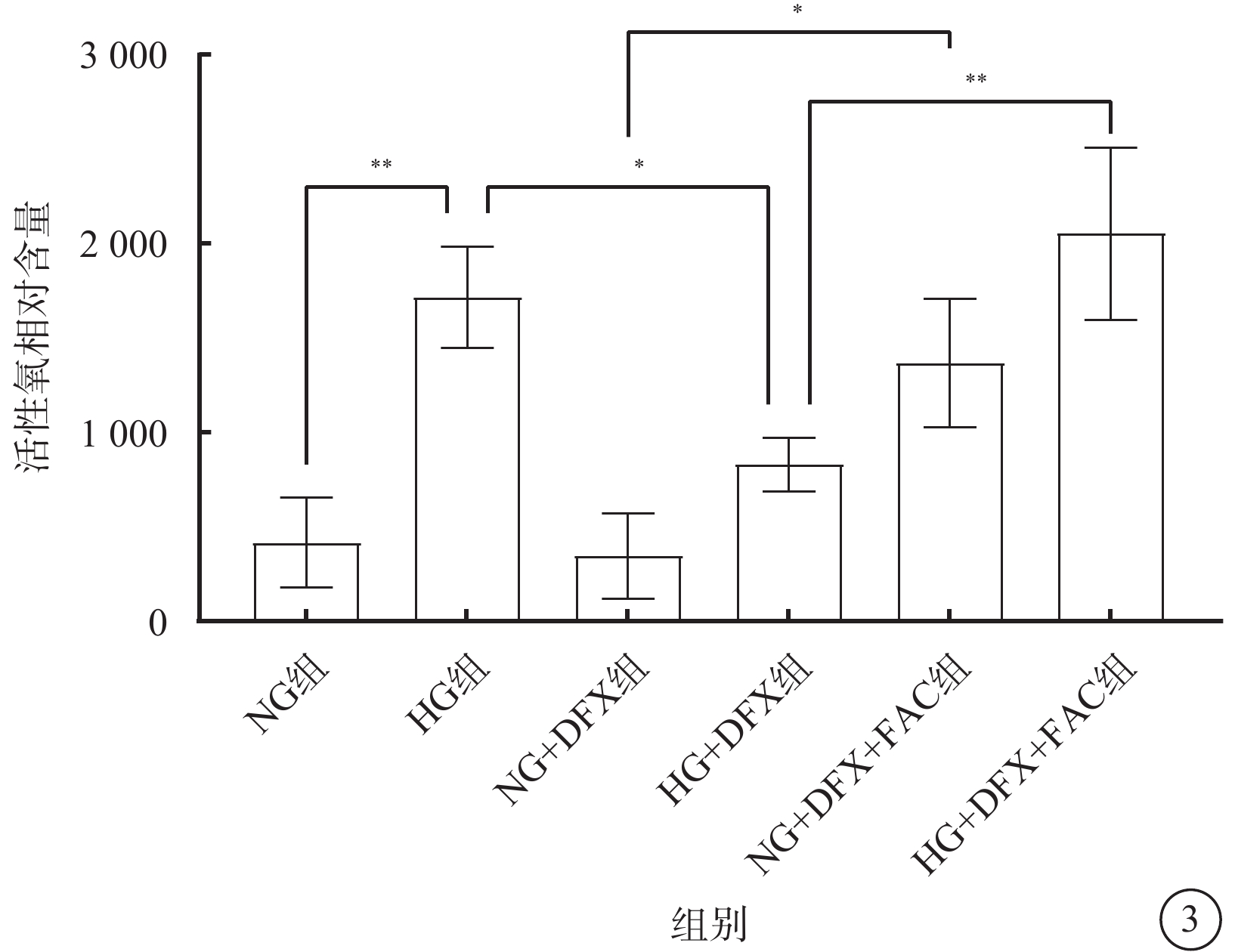 圖3
各組HREC中活性氧含量比較(n=3) *P<0.05,**P<0.01 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖3
各組HREC中活性氧含量比較(n=3) *P<0.05,**P<0.01 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.4 DFX抑制HREC脂質過氧化
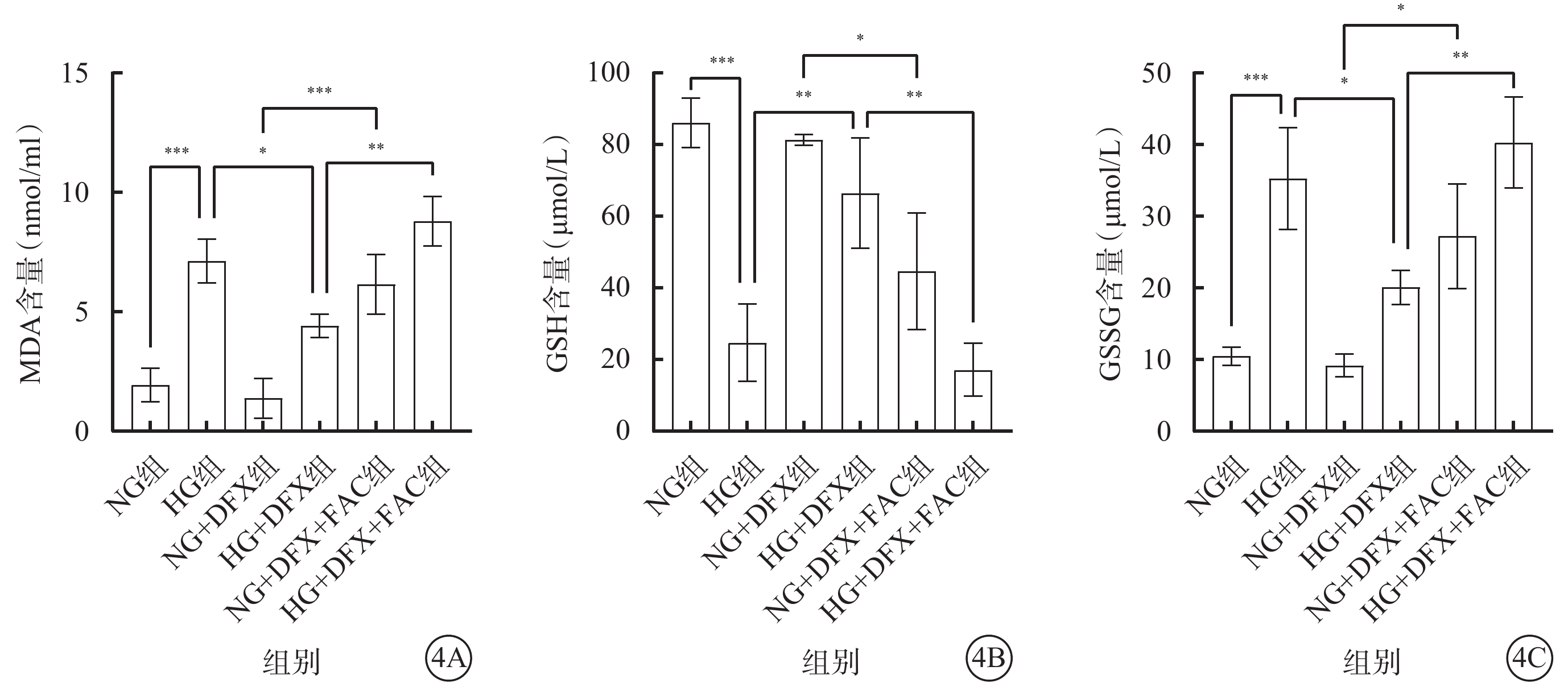
各組細胞間MDA、GSH、GSSG含量比較,差異均有統計學意義(F=31.62、21.02、19.21,P<0.001、0.001、0.000 1)(圖4)。組間MDA、GSSG含量兩兩比較,HG組較NG組顯著升高,HG+DFX組較HG組顯著降低,NG+DFX+FAC組較NG+DFX組顯著升高,HG+DFX+FAC組較HG+DFX組顯著升高,差異均有統計學意義(MDA:t=7.38、3.67、6.45、5.93,P<0.001、0.05、0.001、0.01;GSSG:t=6.00、3.68、4.37、4.90,P<0.001、0.05、0.05、0.01)。組間GSH兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=6.84、4.65、4.08、5.50,P<0.001、0.01、0.05、0.01)。
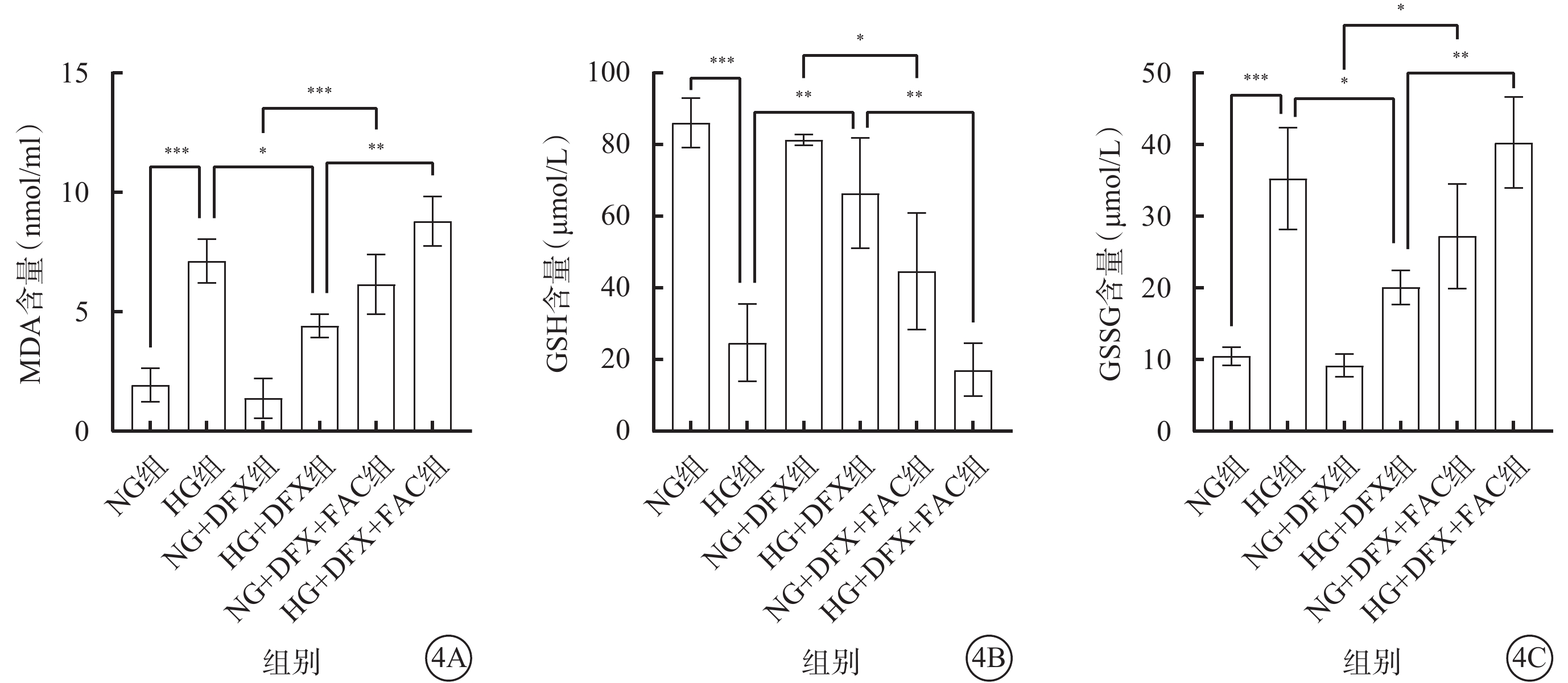 圖4
各組HREC中MDA、GSH、GSSG含量比較(n=3) 4A~ 4C分別示MDA、GSH、GSSG含量,*P<0.05,**P<0.01,***P<0.001 HREC:人視網膜血管內皮細胞;MDA:脂質過氧化物丙二醛;GSH:谷胱甘肽;GSSG:氧化型GSH;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖4
各組HREC中MDA、GSH、GSSG含量比較(n=3) 4A~ 4C分別示MDA、GSH、GSSG含量,*P<0.05,**P<0.01,***P<0.001 HREC:人視網膜血管內皮細胞;MDA:脂質過氧化物丙二醛;GSH:谷胱甘肽;GSSG:氧化型GSH;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.5 DFX減輕HREC XC-抑制
Western blot檢測結果顯示,各組細胞中GPX4、SLC7A11蛋白相對表達量比較,差異均有統計學意義(F=26.09、52.62,P<0.001)。組間GPX4、SLC7A11蛋白相對表達量兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=6.08、3.75、6.00、6.07、9.45、4.08、9.16、6.34,P<0.001、0.05、0.001、0.001)(圖5)。
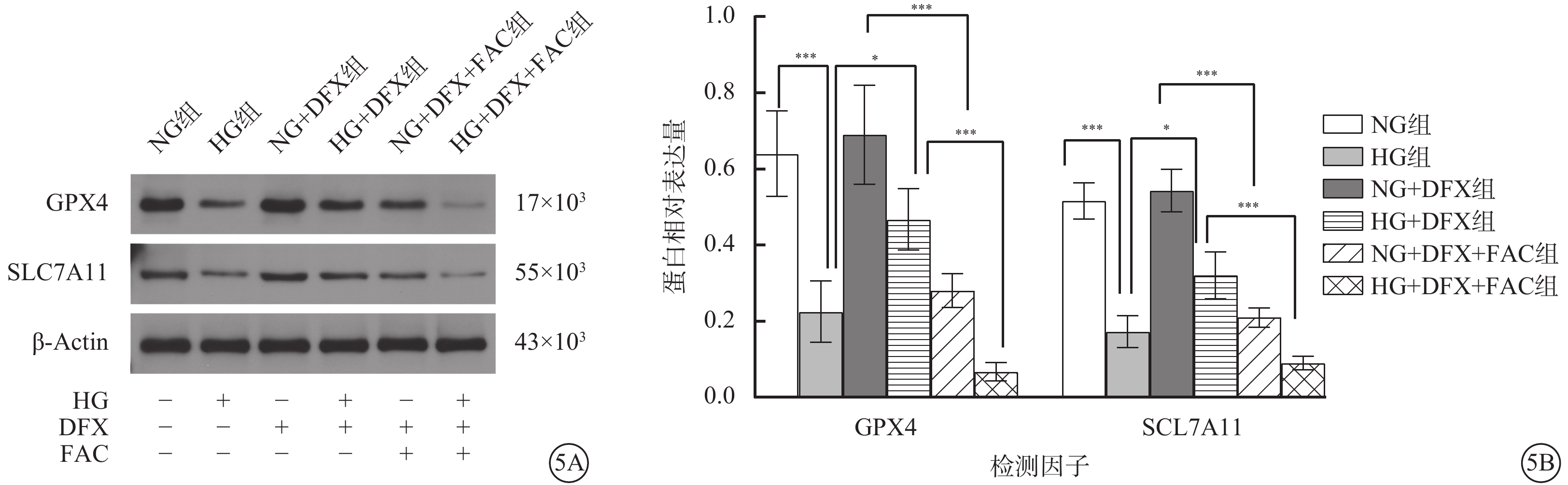 圖5
各組HREC中GPX4、SLC7A11蛋白相對表達量比較(n=3) 5A示GPX4、SLC7A11蛋白表達電泳圖。5B示GPX4、SLC7A11蛋白相對表達量比較,*P<0.05,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;GPX4:谷胱甘肽過氧化物酶4;SLC7A11:溶質載體家族7成員11;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖5
各組HREC中GPX4、SLC7A11蛋白相對表達量比較(n=3) 5A示GPX4、SLC7A11蛋白表達電泳圖。5B示GPX4、SLC7A11蛋白相對表達量比較,*P<0.05,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;GPX4:谷胱甘肽過氧化物酶4;SLC7A11:溶質載體家族7成員11;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
3 討論
長期高血糖是視網膜損傷的危險因素,視網膜血管屏障損傷是高糖致視網膜變性的關鍵事件[11]。各種細胞死亡模式,包括凋亡、壞死、鐵死亡和自噬,都會導致視網膜血管內皮細胞的損傷[12]。鐵死亡在DR中的作用尚不明確。研究表明,高糖在體外誘導視網膜血管內皮細胞發生鐵死亡,提示鐵死亡發生在視網膜細胞中[13]。本研究旨在探討鐵螯合劑DFX對高糖誘導的HREC鐵死亡的保護作用及其機制,為DR的治療提供新的思路。
本研究發現,高糖干預導致HREC中鐵過載,ROS水平及MDA、GSSG含量上升,GSH含量、GSH/GSSG比值降低,且鐵死亡關鍵蛋白GPX4和SLC7A11表達降低,表明視網膜血管內皮細胞發生了鐵死亡。在生物化學過程中,Fe2+通過芬頓反應生成大量ROS,導致細胞內GSH大量消耗,引起半胱氨酸缺乏,GPX4失活,無法有效還原異常脂質過氧化物,從而產生MDA,進一步破壞細胞結構[14]。GSH是由谷氨酸、半胱氨酸和甘氨酸組成的三肽,是機體最重要的抗氧化物質之一。其中,約90%~95%以GSH的形式存在,而5%~10%以GSSG的形式存在[15]。GPX4是細胞抵御脂質過氧化的重要物質,GPX家族成員使用GSH作為輔助因子,將脂質過氧化物解毒為脂質醇,從而抑制鐵死亡[16]。XC-系統在細胞內半胱氨酸平衡和GSH生物合成中起著重要作用,SLC7A11是XC-系統的一個重要亞基,其在細胞中過表達可以促進GSH合成從而阻斷鐵死亡[17]。目前,在高糖環境下檢測藥物對鐵死亡影響的研究較少。本研究首次探索鐵螯合劑在高糖誘導的HREC鐵死亡中的作用。DFX是一種對Fe3+具有高親和力的三齒螯合劑,以2∶1的比例與鐵結合形成復合物。2005年,美國食品藥品監督管理局批準DFX用于治療由輸血引起的鐵負荷增加[18]。本研究發現,高糖環境下細胞發生了鐵過載,而DFX通過螯合細胞內不穩定Fe2+,減輕細胞中的氧化應激,顯著降低了脂質過氧化產物MDA含量,提高了GSH含量,并增加了GPX4和SLC7A11蛋白的表達水平。GPX4在將脂質過氧化氫還原為相應的醇形式中發揮獨特的作用,從而中斷鐵催化的脂質過氧化[19]。GSH是GPX4激活的重要輔助因子。因此,GPX4的上調可能與SLC7A11基因上調和細胞內GSH的增加有關。然而,DFX影響SLC7A11基因表達的具體機制仍有待進一步研究。
本研究發現,鐵螯合劑DFX在高糖環境下能夠有效抑制HREC的鐵死亡,通過螯合細胞內不穩定的Fe2+,減輕氧化應激,提高GSH含量,增加GPX4和SLC7A11蛋白的表達水平,從而保護細胞免受損傷。這些結果表明,鐵螯合劑可能成為DR治療的新方法。然而,本研究也存在一些局限性。首先,實驗僅在體外細胞模型中進行,未能充分反映體內復雜的病理生理環境;其次,本研究雖揭示了DFX具有鐵螯合作用,但未深入研究其分子機制以及對鐵代謝的干擾。未來的研究應進一步探索DFX在動物模型中的作用及其安全性,以驗證其在體內環境中的療效和潛在副作用。此外,還需要深入研究DFX影響SLC7A11基因表達的具體機制,為開發針對鐵死亡的新型治療策略提供理論依據。通過這些研究,有望為DR的臨床治療提供新的藥物選擇和科學支持。
糖尿病視網膜病變(DR)是一種慢性進行性致盲性眼病[1]。視網膜血管內皮細胞(HREC)參與構成血視網膜屏障,其完整性喪失導致的血管通透性增加是DR發病的根本原因[2]。盡管DR的發病機制復雜且尚未完全闡明,但近年來的研究揭示了蛋白質組學變化在DR中的重要角色,尤其是差異蛋白富集于鐵死亡通路,提示鐵死亡可能是DR的潛在治療靶點[3-4]。鐵死亡是一種以鐵依賴為特征的細胞程序性死亡方式,它與鐵代謝、脂質代謝等多種代謝途徑密切相關,鐵死亡可以被脂質活性氧(ROS)清除劑和鐵螯合劑抑制[5-7]。在糖尿病狀態下,體內鐵負荷增加可加速DR發展,特別是在小鼠模型中觀察到視網膜中鐵含量的上升損害了血視網膜屏障的結構與功能;此外,鐵濃度與增生性視網膜病變的嚴重程度呈正比關系,采用低鐵飲食或鐵螯合劑干預能有效減緩糖尿病引起的腎臟損傷進程[8]。地拉羅司(DFX)是一種鐵螯合劑,可以抑制Cys2剝奪、系統XC-抑制以及谷胱甘肽(GSH)過氧化物酶4(GPX4)抑制所致的鐵死亡[9-10]。然而,關于DFX是否能在高糖條件下抑制HREC的鐵死亡及其具體作用機制,仍需進一步探究。為此,本研究通過體外細胞實驗分析DFX對HREC的脂質過氧化和鐵死亡的作用,并初步探討DFX在高糖環境下抑制HREC鐵死亡的潛在機制。現將結果報道如下。
1 材料和方法
1.1 材料
HREC(河南北納生物技術有限公司);Dulbecco改良Eagle培養基(DMEM,L540KJ,美國Gibco公司);DFX(HY-17359)、檸檬酸鐵胺(FAC,HY-B1645)、磷酸鹽緩沖液(PBS)、Tris-HCl緩沖鹽溶液(TBST)(美國MedChemexpress公司);細胞計數試劑盒-8(CCK-8,上海碧云天生物技術有限公司);鈣黃綠素乙酰甲酯(Calcein-AM)細胞增殖活性檢測試劑盒(美國Yeasen公司);2',7'-二氯熒光素二乙酸酯)熒光探針(DCFH-DA)測定試劑盒、脂質過氧化物丙二醛(MDA)試劑盒、GSH和氧化型GSH(GSSG)測定試劑盒(南京建成科技有限公司);GPX4(ab125066)、溶質載體家族7成員11(SLC7A11,26864-1-AP)、β-肌動蛋白(β-actin,AF7018)一抗和二抗(美國Affinity公司);IX51倒置顯微鏡(日本OLYMPUS公司);SMR16.1酶鏈免疫檢測儀(美國TUSCNK公司);DYY-6C電泳儀、DYCZ-24DN垂直電泳槽儀(北京市六一儀器廠)。
1.2 方法
細胞培養與分組。HREC置于含10%胎牛血清和1%雙抗的DMEM培養基中常規培養。取對數生長期細胞用于實驗。HREC分為正常糖組(NG組,5.5 mmol/L葡萄糖培養細胞)、高糖組(HG組,25 mmol/L葡萄糖培養細胞)、正常糖+DFX組(NG+DFX組,5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞)、高糖+DFX組(HG+DFX組,25 mmol/L葡萄糖、50 μmol/L DFX培養細胞)、正常糖+DFX+FAC組(NG+DFX+FAC組,5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞)、高糖+DFX+FAC組(HG+DFX+FAC組,25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞)。所有細胞均孵育24 h進行后續實驗。
光學顯微鏡觀察各組細胞形態變化。將細胞以1×105個/ml的細胞密度接種于T25細胞培養瓶中,培養至細胞貼壁后,光學顯微鏡下觀察細胞形態并采集圖像。
CCK-8檢測各組細胞增殖活性。將細胞以5×104個/ml的密度接種于96孔板中,每100 μl細胞懸液滴加10 μl CCK-8試劑孵育4 h,采用酶鏈免疫檢測儀測量波長450 nm處的吸光度[A,舊稱光密度(OD)]值。每組設6個復孔,實驗重復3次。增殖率(%)=(實驗組-空白組)/(對照組-空白組)×100%。
Calcein-AM檢測各組細胞內不穩定鐵池(LIP)含量。Calcein-AM試劑在室溫下恢復30 min后用PBS配置成終濃度為4 μmol/L的溶液。將細胞以2×105個/ml的密度接種于6孔板中孵育24 h。PBS洗滌3次,胰酶消化并以12 000×g離心5 min,PBS洗滌細胞,向200 μl細胞懸液中加入100 μl Calcein-AM熒光探針染液,充分混勻后在37°C水浴鍋中避光孵育30 min。熒光顯微鏡下觀察并拍照。使用Image J Program軟件計算各組熒光強度。
酶鏈免疫檢測儀檢測各組細胞ROS、MDA、GSH/GSSG含量。ROS含量檢測:將細胞以1×106個/ml的密度接種于6孔板中,每孔滴加1 ml DCFH-DA熒光探針溶液,37℃避光孵育30 min,以12 000×g離心5 min,PBS洗滌2次,采用熒光酶鏈免疫檢測儀檢測波長488 nm處的A值。MDA含量檢測:將細胞以5×104個/ml的密度接種于6孔板中,95℃水浴鍋孵育40 min,以12 000×g離心10 min,每孔滴加250 μl提前配制的標準品和MDA工作液。采用酶鏈免疫檢測儀測量波長532 nm處的A值。GSH/GSSG含量檢測:將細胞以1×105個/ml密度接種于6孔板中,每100 μl待測細胞中滴加20 μl的標準品和GSH試劑,95℃水浴鍋孵育40 min,以4 000×g離心10 min。采用酶鏈免疫檢測儀測量波長405 nm處的A值。根據標準品的A值作出標準曲線后,樣品對照標準曲線計算出GSH和GSSG的含量。
蛋白質免疫印跡法(Western blot)檢測各組細胞GPX4、SLC7A11蛋白相對表達量。收集各組細胞總蛋白,調整蛋白濃度,每個樣品中加入40 μg待測樣品,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳中上樣電泳;80 V恒壓0.5 h,樣品進入分離膠后120 V恒壓2 h,300 mA轉膜2 h,5%脫脂牛奶常溫封閉1 h,一抗GPX4、SLC7A11、β-actin(1∶1 000)4℃過夜孵育(β-actin作為陽性對照),TBST洗膜5 min,重復3次;加入辣根過氧化物偶聯的二抗(1∶5 000),37℃孵育2 h,TBST洗膜5 min,重復4次;加入化學發光劑,暗室顯影成像。采用Image J Program軟件分析蛋白條帶灰度值,以目的條帶與β-actin條帶的比值代表蛋白的相對表達水平。
1.3 統計學方法
采用Graphpad prism 10.3軟件進行統計分析和圖表整理。計量資料以均數±標準差(x±s)表示。兩組間比較采用雙尾Student t檢驗;多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 DFX改善高糖誘導的HREC細胞增殖活力
細胞培養24 h后,NG組細胞呈梭形,分布均勻,貼壁良好;HG組細胞貼壁不佳,部分細胞呈圓形漂浮于培養基中;NG+DFX組細胞生長情況良好,細胞狀態接近NG組;HG+DFX組大部分細胞貼壁生長,少量細胞呈圓形漂浮于培養基中;NG+DFX+FAC組細胞貼壁不佳,較多細胞呈圓形漂浮于培養基中;HG+DFX+FAC組少許細胞貼壁,大量細胞呈圓形漂浮于培養基中。6組間細胞增殖率比較,差異有統計學意義(F=150.70,P<0.000 1)。組間細胞增殖率兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=19.01、8.49、13.23、10.74,P<0.000 1)(圖1)。
 圖1
DFX改善高糖誘導的HREC細胞增殖(n=3) 1A~1F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC光學顯微鏡像(標尺:50 μm)。與NG組比較,HG組細胞貼壁不佳,部分細胞呈圓形漂浮于培養基中;加入DFX后細胞貼壁情況改善,浮游細胞減少,加入FAC則可逆轉DFX對HREC的保護作用。1G示6組細胞增殖率比較,****P<0.000 1 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖1
DFX改善高糖誘導的HREC細胞增殖(n=3) 1A~1F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC光學顯微鏡像(標尺:50 μm)。與NG組比較,HG組細胞貼壁不佳,部分細胞呈圓形漂浮于培養基中;加入DFX后細胞貼壁情況改善,浮游細胞減少,加入FAC則可逆轉DFX對HREC的保護作用。1G示6組細胞增殖率比較,****P<0.000 1 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.2 DFX抑制HREC鐵過載
平均熒光強度與細胞內LIP含量成反比。熒光顯微鏡觀察發現,HG組、NG+DFX+FAC組、HG+DFX+FAC組熒光強度顯著下降,LIP含量上升;HG+DFX組熒光強度顯著增強,LIP含量下降。各組細胞間熒光強度比較,差異有統計學意義(F=807.20,P<0.001)。組間熒光強度兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=34.96、18.95、37.52、28.10,P<0.001)(圖2)。
 圖2
DFX抑制HREC中LIP含量(n=3) 2A~2F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC熒光顯微鏡像(標尺:20 μm)。與NG組比較,HG組熒光強度顯著下降,LIP含量上升;加入DFX后熒光強度顯著增強,LIP含量下降,加入FAC則可逆轉DFX的鐵螯合作用。2G示6組細胞熒光強度比較,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;LIP:不穩定鐵池;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖2
DFX抑制HREC中LIP含量(n=3) 2A~2F分別示NG組、HG組、NG+DFX組、HG+DFX組、NG+DFX+FAC組和HG+DFX+FAC組HREC熒光顯微鏡像(標尺:20 μm)。與NG組比較,HG組熒光強度顯著下降,LIP含量上升;加入DFX后熒光強度顯著增強,LIP含量下降,加入FAC則可逆轉DFX的鐵螯合作用。2G示6組細胞熒光強度比較,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;LIP:不穩定鐵池;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.3 DFX抑制HREC中ROS生成
DCFH-DA檢測結果顯示,各組細胞間ROS水平差異有統計學意義(F=16.94,P<0.001)。組間ROS含量兩兩比較,HG組較NG組顯著升高,HG+DFX組較HG組顯著降低,NG+DFX+FAC組較NG+DFX組顯著升高,HG+DFX+FAC組較HG+DFX組顯著升高,差異均有統計學意義(t=5.38、3.66、4.24、5.07,P<0.01、0.05、0.05、0.01)(圖3)。
 圖3
各組HREC中活性氧含量比較(n=3) *P<0.05,**P<0.01 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖3
各組HREC中活性氧含量比較(n=3) *P<0.05,**P<0.01 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.4 DFX抑制HREC脂質過氧化
各組細胞間MDA、GSH、GSSG含量比較,差異均有統計學意義(F=31.62、21.02、19.21,P<0.001、0.001、0.000 1)(圖4)。組間MDA、GSSG含量兩兩比較,HG組較NG組顯著升高,HG+DFX組較HG組顯著降低,NG+DFX+FAC組較NG+DFX組顯著升高,HG+DFX+FAC組較HG+DFX組顯著升高,差異均有統計學意義(MDA:t=7.38、3.67、6.45、5.93,P<0.001、0.05、0.001、0.01;GSSG:t=6.00、3.68、4.37、4.90,P<0.001、0.05、0.05、0.01)。組間GSH兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=6.84、4.65、4.08、5.50,P<0.001、0.01、0.05、0.01)。
 圖4
各組HREC中MDA、GSH、GSSG含量比較(n=3) 4A~ 4C分別示MDA、GSH、GSSG含量,*P<0.05,**P<0.01,***P<0.001 HREC:人視網膜血管內皮細胞;MDA:脂質過氧化物丙二醛;GSH:谷胱甘肽;GSSG:氧化型GSH;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖4
各組HREC中MDA、GSH、GSSG含量比較(n=3) 4A~ 4C分別示MDA、GSH、GSSG含量,*P<0.05,**P<0.01,***P<0.001 HREC:人視網膜血管內皮細胞;MDA:脂質過氧化物丙二醛;GSH:谷胱甘肽;GSSG:氧化型GSH;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
2.5 DFX減輕HREC XC-抑制
Western blot檢測結果顯示,各組細胞中GPX4、SLC7A11蛋白相對表達量比較,差異均有統計學意義(F=26.09、52.62,P<0.001)。組間GPX4、SLC7A11蛋白相對表達量兩兩比較,HG組較NG組顯著降低,HG+DFX組較HG組顯著升高,NG+DFX+FAC組較NG+DFX組顯著降低,HG+DFX+FAC組較HG+DFX組顯著降低,差異均有統計學意義(t=6.08、3.75、6.00、6.07、9.45、4.08、9.16、6.34,P<0.001、0.05、0.001、0.001)(圖5)。
 圖5
各組HREC中GPX4、SLC7A11蛋白相對表達量比較(n=3) 5A示GPX4、SLC7A11蛋白表達電泳圖。5B示GPX4、SLC7A11蛋白相對表達量比較,*P<0.05,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;GPX4:谷胱甘肽過氧化物酶4;SLC7A11:溶質載體家族7成員11;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
圖5
各組HREC中GPX4、SLC7A11蛋白相對表達量比較(n=3) 5A示GPX4、SLC7A11蛋白表達電泳圖。5B示GPX4、SLC7A11蛋白相對表達量比較,*P<0.05,***P<0.001 HREC:人視網膜血管內皮細胞;NG:正常糖;HG:高糖;DFX:地拉羅司;FAC:檸檬酸鐵胺;GPX4:谷胱甘肽過氧化物酶4;SLC7A11:溶質載體家族7成員11;NG組:加入5.5 mmol/L葡萄糖培養細胞;HG組:加入25 mmol/L葡萄糖培養細胞;NG+DFX組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX培養細胞;HG+DFX組:加入25 mmol/L葡萄糖、50 μmol/L DFX培養細胞;NG+DFX+FAC組:加入5.5 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞;HG+DFX+ FAC組:加入25 mmol/L葡萄糖、50 μmol/L DFX、100 μmol/L FAC培養細胞
3 討論
長期高血糖是視網膜損傷的危險因素,視網膜血管屏障損傷是高糖致視網膜變性的關鍵事件[11]。各種細胞死亡模式,包括凋亡、壞死、鐵死亡和自噬,都會導致視網膜血管內皮細胞的損傷[12]。鐵死亡在DR中的作用尚不明確。研究表明,高糖在體外誘導視網膜血管內皮細胞發生鐵死亡,提示鐵死亡發生在視網膜細胞中[13]。本研究旨在探討鐵螯合劑DFX對高糖誘導的HREC鐵死亡的保護作用及其機制,為DR的治療提供新的思路。
本研究發現,高糖干預導致HREC中鐵過載,ROS水平及MDA、GSSG含量上升,GSH含量、GSH/GSSG比值降低,且鐵死亡關鍵蛋白GPX4和SLC7A11表達降低,表明視網膜血管內皮細胞發生了鐵死亡。在生物化學過程中,Fe2+通過芬頓反應生成大量ROS,導致細胞內GSH大量消耗,引起半胱氨酸缺乏,GPX4失活,無法有效還原異常脂質過氧化物,從而產生MDA,進一步破壞細胞結構[14]。GSH是由谷氨酸、半胱氨酸和甘氨酸組成的三肽,是機體最重要的抗氧化物質之一。其中,約90%~95%以GSH的形式存在,而5%~10%以GSSG的形式存在[15]。GPX4是細胞抵御脂質過氧化的重要物質,GPX家族成員使用GSH作為輔助因子,將脂質過氧化物解毒為脂質醇,從而抑制鐵死亡[16]。XC-系統在細胞內半胱氨酸平衡和GSH生物合成中起著重要作用,SLC7A11是XC-系統的一個重要亞基,其在細胞中過表達可以促進GSH合成從而阻斷鐵死亡[17]。目前,在高糖環境下檢測藥物對鐵死亡影響的研究較少。本研究首次探索鐵螯合劑在高糖誘導的HREC鐵死亡中的作用。DFX是一種對Fe3+具有高親和力的三齒螯合劑,以2∶1的比例與鐵結合形成復合物。2005年,美國食品藥品監督管理局批準DFX用于治療由輸血引起的鐵負荷增加[18]。本研究發現,高糖環境下細胞發生了鐵過載,而DFX通過螯合細胞內不穩定Fe2+,減輕細胞中的氧化應激,顯著降低了脂質過氧化產物MDA含量,提高了GSH含量,并增加了GPX4和SLC7A11蛋白的表達水平。GPX4在將脂質過氧化氫還原為相應的醇形式中發揮獨特的作用,從而中斷鐵催化的脂質過氧化[19]。GSH是GPX4激活的重要輔助因子。因此,GPX4的上調可能與SLC7A11基因上調和細胞內GSH的增加有關。然而,DFX影響SLC7A11基因表達的具體機制仍有待進一步研究。
本研究發現,鐵螯合劑DFX在高糖環境下能夠有效抑制HREC的鐵死亡,通過螯合細胞內不穩定的Fe2+,減輕氧化應激,提高GSH含量,增加GPX4和SLC7A11蛋白的表達水平,從而保護細胞免受損傷。這些結果表明,鐵螯合劑可能成為DR治療的新方法。然而,本研究也存在一些局限性。首先,實驗僅在體外細胞模型中進行,未能充分反映體內復雜的病理生理環境;其次,本研究雖揭示了DFX具有鐵螯合作用,但未深入研究其分子機制以及對鐵代謝的干擾。未來的研究應進一步探索DFX在動物模型中的作用及其安全性,以驗證其在體內環境中的療效和潛在副作用。此外,還需要深入研究DFX影響SLC7A11基因表達的具體機制,為開發針對鐵死亡的新型治療策略提供理論依據。通過這些研究,有望為DR的臨床治療提供新的藥物選擇和科學支持。