引用本文: 王霞, 李曉麗, 武斌, 韓泉洪, 王瑩. 41G超微針視網膜下注射平衡鹽溶液治療大直徑黃斑裂孔的臨床觀察. 中華眼底病雜志, 2024, 40(12): 924-929. doi: 10.3760/cma.j.cn511434-20240715-00267 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
玻璃體切割手術(PPV)聯合內界膜剝除是治療黃斑裂孔(MH)的標準方法,其初次手術后裂孔閉合率可達到90%以上[1-2]。但對于大直徑MH(裂孔直徑>400 μm)以及病程持續時間較長、高度近視性和外傷性MH,常規PPV聯合內界膜剝除手術后,其裂孔閉合率、視功能改善恢復均不理想[3]。為了解決這些問題,一些學者嘗試了多種改良的手術方式,如利用游離內界膜瓣填塞、內界膜翻轉覆蓋,或是應用羊膜、自體晶狀體囊膜瓣、自體神經視網膜瓣移植等技術,同時也有研究者探討了在手術過程中使用重水、自體血清和粘彈劑作為輔助固定材料[4-9]。然而,這些方法普遍存在操作復雜、獲取材料困難以及固定不易等問題,且手術后黃斑中心凹形態和視覺功能的恢復情況不一,還存在一定的MH復發風險[4, 10]。近年有研究表明,PPV聯合視網膜下液體注射能夠有效分離MH周圍神經上皮下的粘連,促進裂孔區視網膜的重新附著,進而提高其結構和功能的恢復[4, 10]。據文獻報道,這種方法在治療難治性MH時,裂孔閉合率可達到83.3%~100.0%[10-12]。本研究采用25G PPV聯合內界膜剝除及41G超微針視網膜下注射平衡鹽溶液(BSS)對一組大直徑MH患眼進行了治療,初步評價41G超微針視網膜下注射治療大直徑MH的療效和安全性。現將結果報道如下。
1 對象和方法
前瞻性臨床干預性研究。本研究經天津市眼科醫院倫理委員會審核(批準號:KY-2024016);遵循《赫爾辛基宣言》原則;所有參與者均獲得充分知情并簽署書面知情同意書。
2024年3~6月于天津市眼科醫院檢查確診的大直徑全層MH患者22例22只眼納入本研究。納入標準:(1)光相干斷層掃描(OCT)檢查確診全層MH,且裂孔直徑>400 μm;(2)患者年齡18~85歲;(3)均行41G超微針視網膜下注射BSS治療。排除標準:既往玻璃體視網膜手術后裂孔未閉合,或閉合后再次復發;伴有其他影響MH視覺功能觀察的視網膜和視神經病變;手術后不能規律隨訪者。
詳細采集患者病史,記錄病程和眼部手術史、用藥史、眼外傷史及全身疾病史等。所有患眼均行最佳矯正視力(BCVA)、驗光、眼壓、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、眼底自發熒光(FAF)、OCT、微視野以及眼軸長度(AL)測量。BCVA檢查采用標準對數視力表進行,統計時換算為最小分辨角對數(logMAR)視力。采用瑞士Haag-Streit公司光學生物測量儀LS 900測量AL。屈光度數以等效球鏡度數(SE)表示,SE=球鏡+1/2柱鏡。
采用德國Carl Zeiss公司Clarus500超廣角眼底照相機行眼底彩色照相檢查。采用英國Optos公司Daytona P200T成像系統行FAF檢查。采用美國Optovue公司RTVue XR OCT儀測量MH最小直徑和基底直徑。采用意大利CenterVue公司黃斑完整性評估儀行微視野檢查。選擇4-2閾值刺激策略,測試范圍為黃斑區10°。測試過程中記錄黃斑10°范圍內黃斑整體指數(MII)、黃斑閾值(MT)以及黃斑中心凹2°、4°固視率(分別記錄為P1、P2)。
患眼均行經睫狀體平坦部標準三通道25G PPV聯合內界膜剝除手術。合并白內障者聯合行白內障超聲乳化人工晶狀體(IOL)植入手術。手術中除常規操作外,切除玻璃體,剝離玻璃體后皮質,吲哚青綠染色,剝除黃斑區上下血管弓以內內界膜。使用自制的密閉微注射系統[13]連接41G超微針,于MH周圍距裂孔邊緣約1個視盤直徑處分別于上方、下方、顳側視網膜下注射BSS,注射量以裂孔邊緣出現至少270°視網膜脫離為準。視網膜下注射可以在穿透視網膜前開始,以避免潛在的視網膜色素上皮(RPE)損傷[14] 。注射結束后進行全氣液交換;手術完畢時,MH最小直徑>600 μm者,玻璃體腔填充C3F8 0.5 ml。手術后患者面朝下體位5 d。手術中仔細觀察是否出現視網膜和脈絡膜出血以及視網膜脫離、脈絡膜脫離等情況的發生。
手術后1周及1、3個月隨訪,平均隨訪時間1.91個月。其中,完成1、3個月隨訪分別為12、10例。手術后1周,行裂隙燈顯微鏡、間接檢眼鏡檢查和眼壓測量;手術后1、3個月,行BCVA、眼壓、眼底、FAF、OCT、微視野檢查。隨訪主要終點為手術后1個月時裂孔閉合情況。以OCT檢查結果評估裂孔閉合情況:Ⅰ型,完全閉合,黃斑中心凹上方可見神經上皮完全覆蓋,無裸露的RPE,并根據中心凹處有無組織分為U形閉合和V形閉合;Ⅱ型,不完全閉合,裂孔邊緣神經上皮附著于RPE,但中心凹有裸露的RPE(W形閉合)[5-6];Ⅲ型:未閉合,裂孔邊緣神經上皮脫離。次要終點為手術后視功能改善情況,對比觀察手術前后BCVA、MII、MT及P1、P2的變化。以BCVA提高大于2行及以上為視力提高,下降大于2行及以上為視力降低,BCVA變化介于2行之間為視力不變。此外,應用FAF檢查評估RPE的損傷情況。記錄手術后視網膜脫離、脈絡膜脫離、視網膜裂孔、黃斑區異常新生血管、高眼壓或低眼壓、眼內炎以及手術前晶狀體透明患者的白內障發生率等并發癥發生情況。
采用SPSS25.0軟件進行統計學分析。應用Kolmogorov-Smirnov檢驗連續變量的正態性。呈正態分布,以均數±標準差(x±s)表示;不符合正態分布,以中位數(四分位間距)[M(QL,QU)]表示。同一連續性指標的手術前后比較,呈正態分布且方差齊采用Stutent't檢驗;方差不齊或非正態分布采用Mann-Whitney U檢驗。不同指標之間的相關性采用Pearson相關性分析。分析結果包括BCVA和微視野變化情況、裂孔早期閉合率以及任何手術后并發癥發生率。檢驗水準α=0.05,雙側檢驗。P≤0.05為差異有統計學意義。
2 結果
22例患者中,男性4例,女性18例;均為單眼發病,其中右眼、左眼分別為13、9只眼。年齡66(60,71)歲,年齡范圍23~81歲。病程5(2.5,12.0)個月,病程范圍1~72個月。患眼SE為0(-1.63,0.31)D;AL為22.96(22.66,24.97)mm。有晶狀體眼、IOL分別為20、2只眼。特發性、高度近視性、外傷性全層MH分別為18、2、2只眼。裂孔最小直徑、基底直徑分別為(601.45±122.09)、(1 020.86±355.35)μm。
有晶狀體眼20只眼中,手術中聯合行白內障超聲乳化吸除及IOL植入18只眼。手術完畢時,玻璃體腔填充無菌空氣、C3F8分別為10、12只眼。
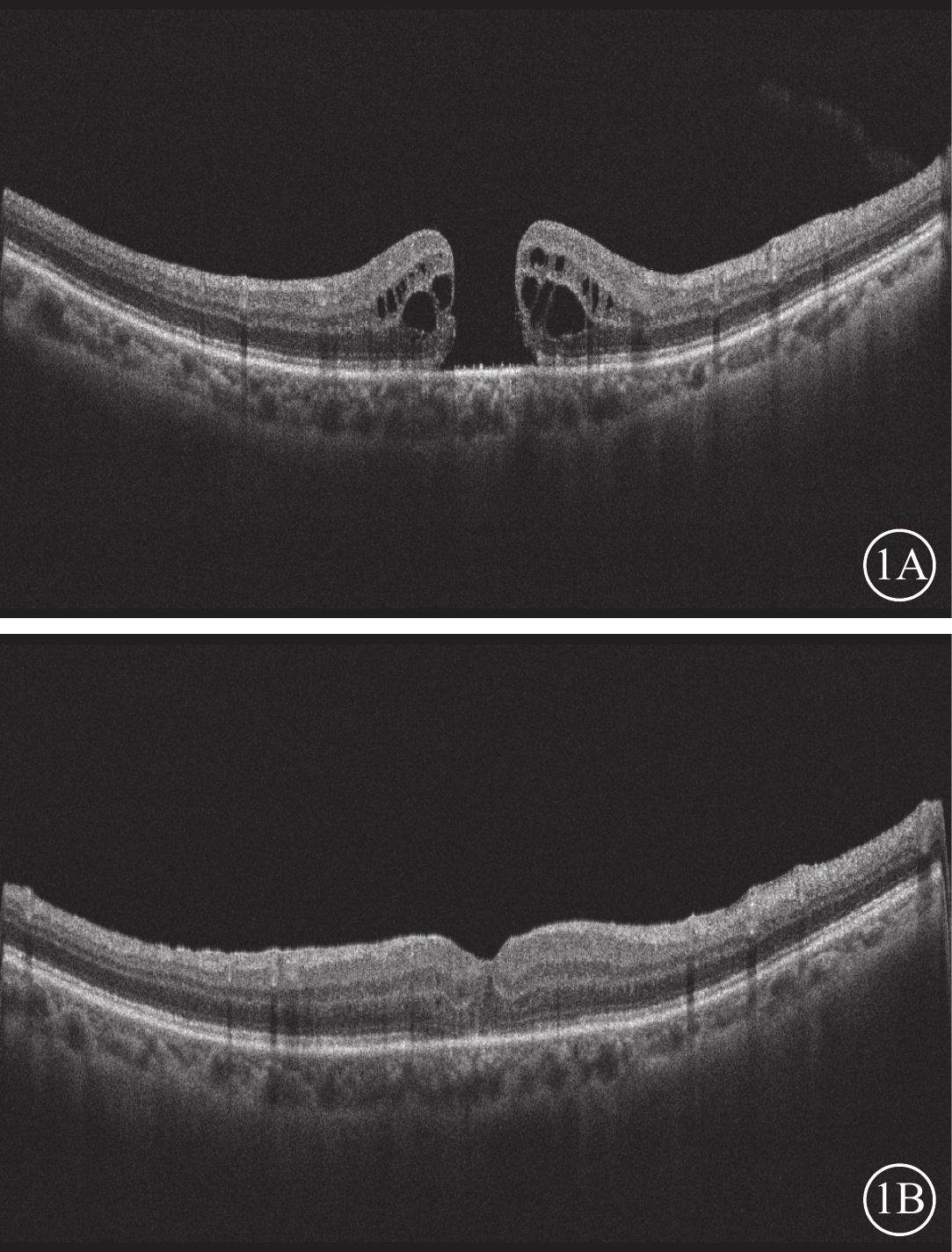
手術后1個月,22只眼中,裂孔Ⅰ型閉合(圖1,2)20只眼(90.91%,20/22);Ⅱ型閉合2只眼(9.09%,2/22)。
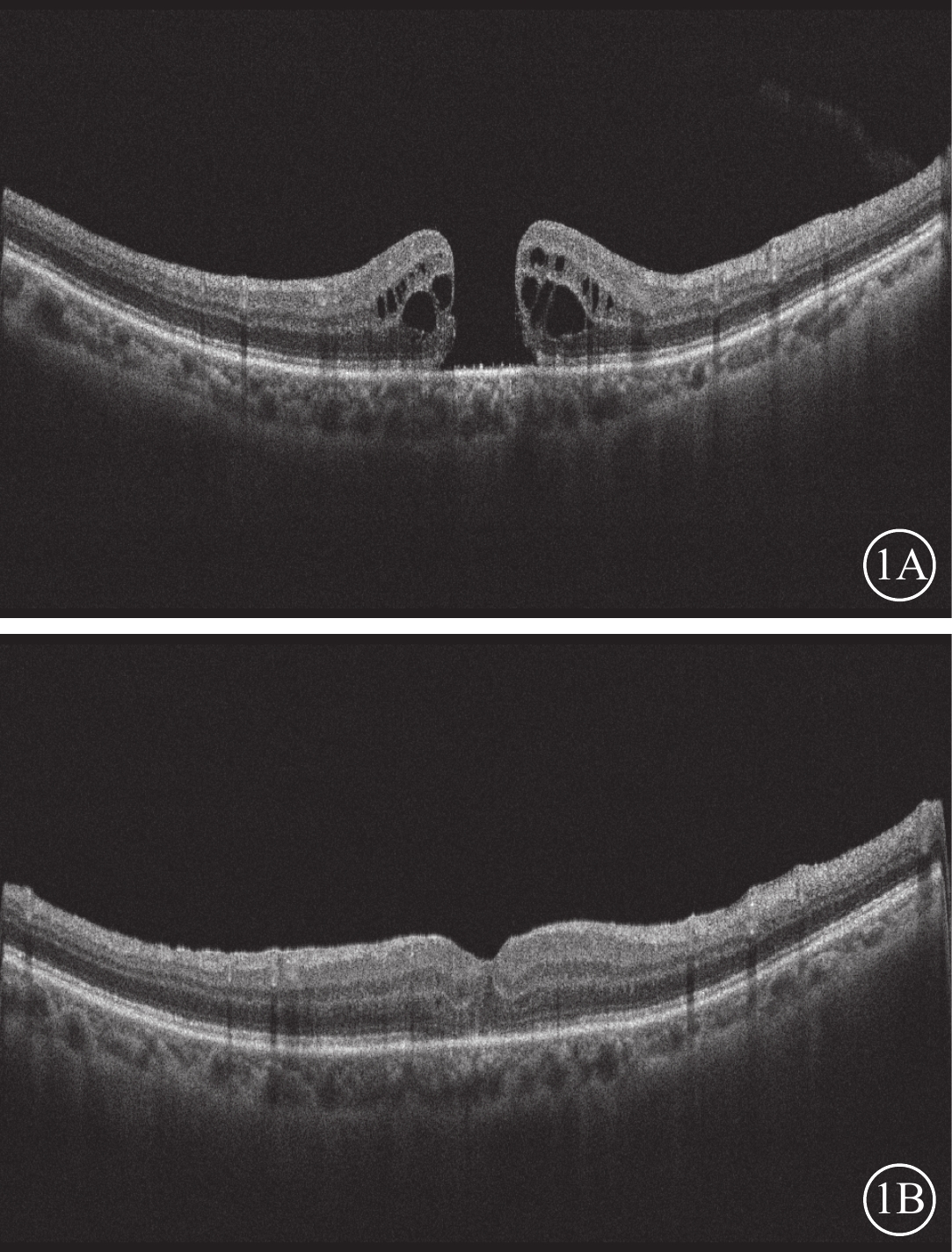 圖1
全層黃斑裂孔患眼光相干斷層掃描像 患者女,72歲;病程13個月;手術前裂孔最小直徑、基底直徑分別為670、1 140 μm;手術前及手術后1個月最佳矯正視力分別為數指/30 cm、0.05。1A示手術前,可見全層黃斑裂孔;1B示手術后1個月,裂孔完全閉合
圖1
全層黃斑裂孔患眼光相干斷層掃描像 患者女,72歲;病程13個月;手術前裂孔最小直徑、基底直徑分別為670、1 140 μm;手術前及手術后1個月最佳矯正視力分別為數指/30 cm、0.05。1A示手術前,可見全層黃斑裂孔;1B示手術后1個月,裂孔完全閉合
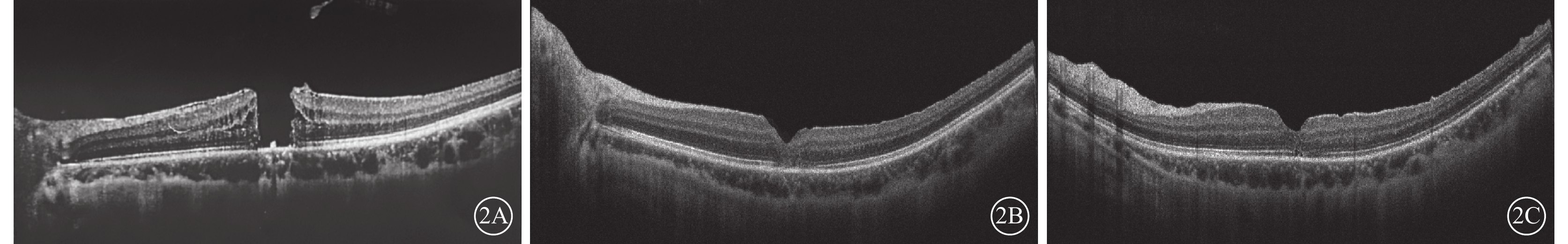
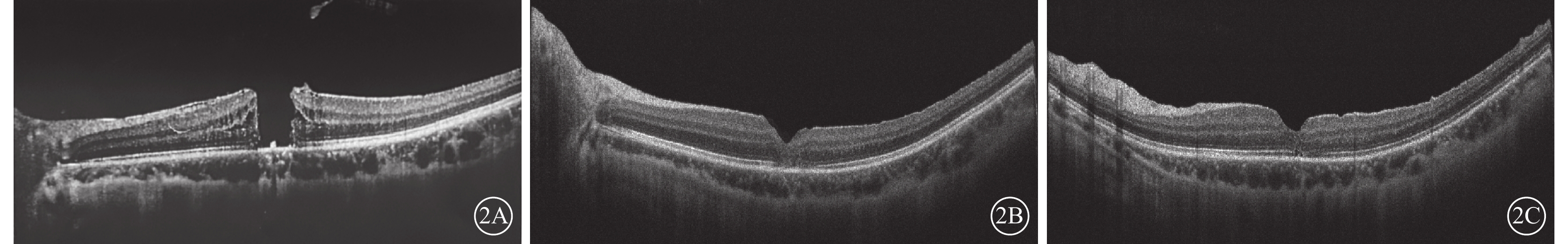 圖2
外傷性全層黃斑裂孔患眼手術前后光相干斷層掃描像 患者女,23歲。左眼鈍挫傷后視力下降2個月;眼軸長度27.5 mm;手術前及手術后1、3個月BCVA分別為0.2、0.6、0.8。2A示手術前,裂孔最小直徑620 μm;2B示手術后1個月,裂孔Ⅰ型閉合,黃斑區視網膜外層結構不清;2C示手術后3個月,視網膜層次清楚,中心凹橢圓體帶少許缺失
圖2
外傷性全層黃斑裂孔患眼手術前后光相干斷層掃描像 患者女,23歲。左眼鈍挫傷后視力下降2個月;眼軸長度27.5 mm;手術前及手術后1、3個月BCVA分別為0.2、0.6、0.8。2A示手術前,裂孔最小直徑620 μm;2B示手術后1個月,裂孔Ⅰ型閉合,黃斑區視網膜外層結構不清;2C示手術后3個月,視網膜層次清楚,中心凹橢圓體帶少許缺失
末次隨訪時,視力提高、不變分別為20、2只眼。視力不變的2只眼,均為裂孔Ⅱ型閉合者。其中,病程72、12個月各1只眼;裂孔最小直徑分別為896、738 μm,裂孔基底直徑均>1 300 μm;手術后均未遵醫囑保持面朝下體位。手術前、末次隨訪患眼logMAR BCVA、MII、MT比較,差異均有統計學意義(P<0.05);P1、P2比較,差異均無統計學意義(P>0.05)(表1)。
相關性分析結果顯示,手術后BCVA與手術前BCVA、裂孔最小直徑和基底直徑以及病程、年齡呈顯著正相關(P<0.05);手術后微視野P1、P2與手術前BCVA、裂孔基底直徑呈顯著負相關(P<0.05);手術后BCVA、MII、MT、P1、P2與AL之間均無相關性(P>0.05)(表2)。
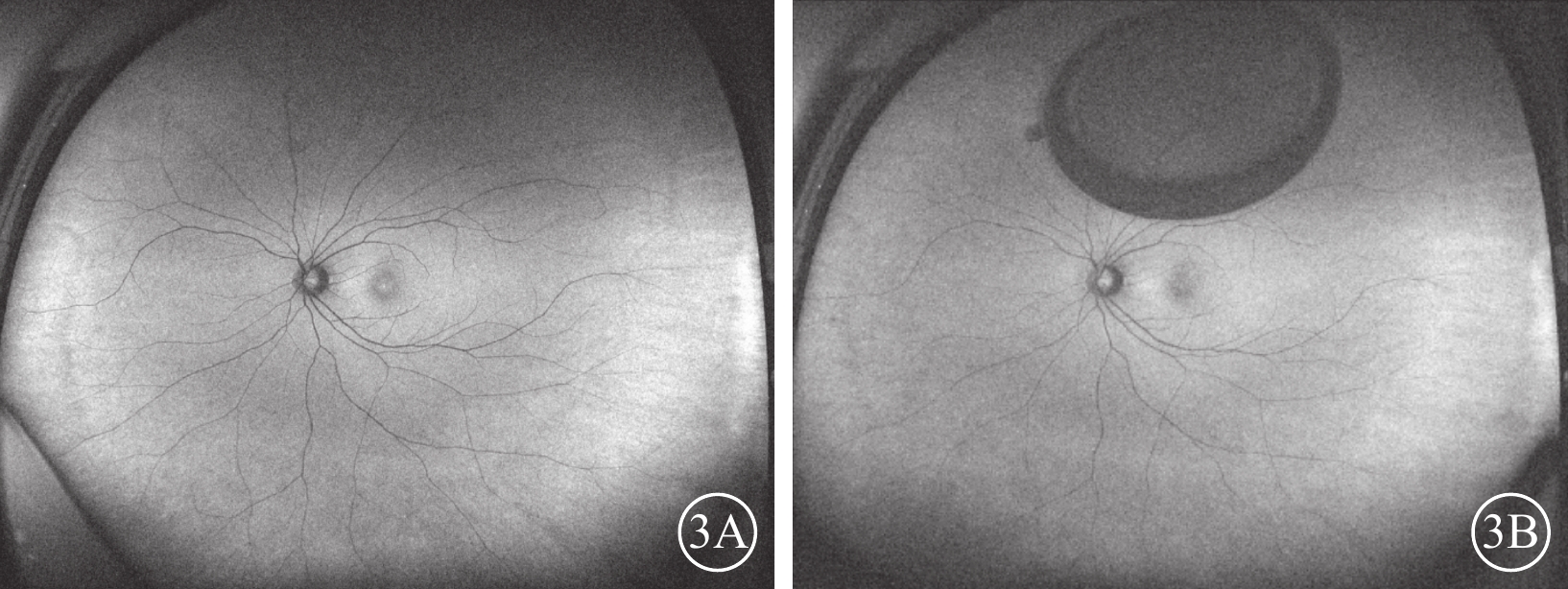
手術前及手術后1、3個月,所有患眼均未見異常FAF表現(圖3)。
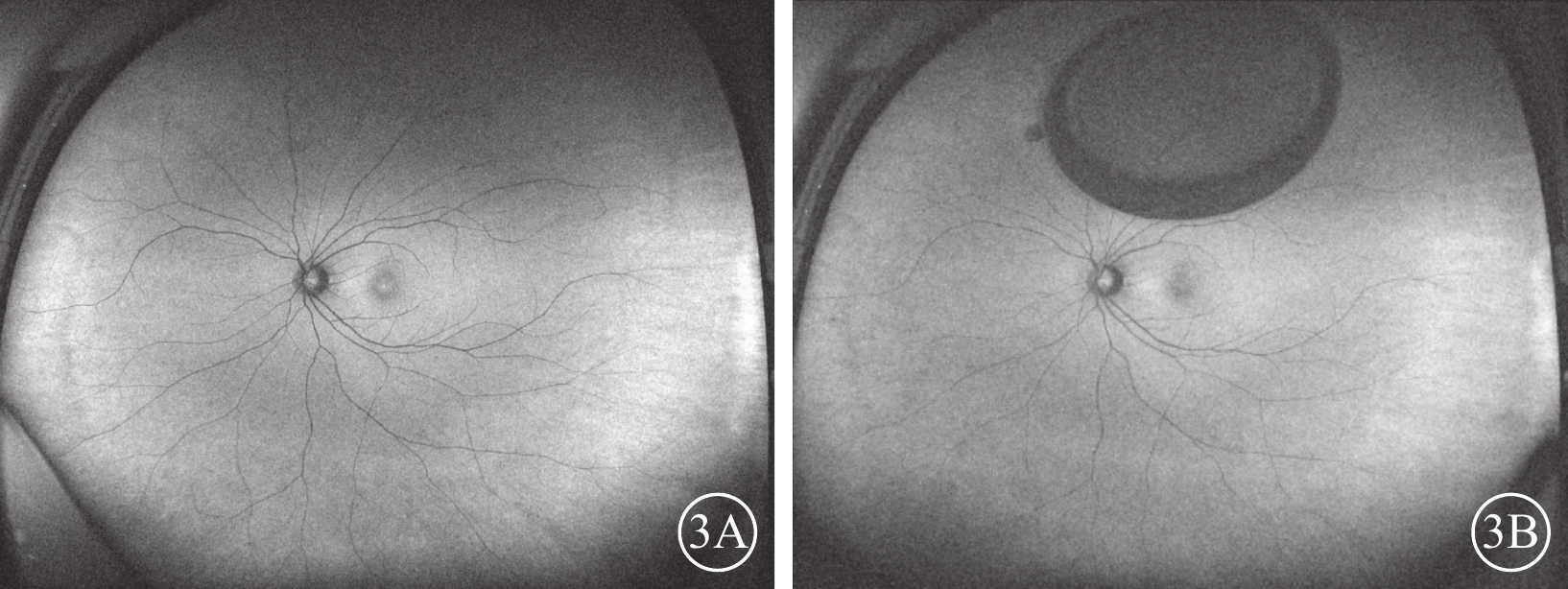 圖3
外傷性全層黃斑裂孔患眼(圖2同眼)手術前后眼底自發熒光像 3A、3B分別示手術前、手術后1個月,均未見異常自發熒光,圖3B上方為氣泡影
圖3
外傷性全層黃斑裂孔患眼(圖2同眼)手術前后眼底自發熒光像 3A、3B分別示手術前、手術后1個月,均未見異常自發熒光,圖3B上方為氣泡影
手術中和手術后隨訪期間,所有患眼均未出現高眼壓或低眼壓、視網膜和脈絡膜出血、視網膜脫離、脈絡膜脫離、眼內炎、黃斑區異常新生血管等并發癥;未聯合行白內障手術的2只眼,晶狀體透明,未發生白內障。
3 討論
玻璃體視網膜手術中,視網膜下注射為一種精細的手術操作方法,因其能直接將藥物輸送到視網膜下空間作用于RPE和光感受器細胞,近年被廣泛應用于遺傳性視網膜疾病的基因治療[7]。對于黃斑大量出血的患眼,可通過視網膜下注射纖溶酶原激活劑等藥物來達到治療效果[8]。另外,通過在裂孔周圍視網膜神經上皮下注射BSS能夠有效分離其周圍的神經上皮和RPE之間的粘連,使裂孔邊緣游離,減少視網膜張力,從而促進視網膜重新定位附著,利用視網膜的自然彈性和向心力促使裂孔閉合[4, 12]。隨著41G超微針的出現,使得視網膜下注射技術更加微創和安全。本研究旨在評估25G PPV中41G超微針視網膜下注射治療大直徑MH的效果和安全性。結果顯示,手術后1個月,裂孔Ⅰ型閉合(完全閉合)率達90.91%(20/22),Ⅱ型閉合(不完全閉合)率為9.09%(2/22);無1例發生手術相關并發癥。這初步證實了該方法治療大直徑MH的有效性和安全性。盡管本研究結果為手術后早期的研究結果,但與既往研究結果的長期隨訪數據相近[9, 15-16]。既往研究排除了高度近視性和外傷性MH,而本組2例高度近視性MH和2例外傷性MH患者手術后均達到Ⅰ型閉合,初步證實41G超微針視網膜下注射BSS治療高度近視性和外傷性MH的有效性。
視功能方面,本組患眼手術后1個月、末次隨訪時BCVA較手術前顯著提高。與視力比較,微視野檢查能夠更加客觀地評價黃斑區視覺敏感度。本組患眼末次隨訪時MII和MT較手術前顯著改善,與既往研究結果相似[17-18],說明手術后黃斑區10°范圍內的視覺功能得到提高。此外,固視穩定性對于視覺功能有重大影響,與視覺敏感度相關[18]。微視野檢查中P1、P2值可反映患者的固視穩定性,其值越大,代表固視穩定性越強。本組患眼末次隨訪時P1、P2值較手術前有所增加,但差異無統計學意義,考慮可能與本研究樣本量小以及隨訪時間較短,患者視功能未能完全恢復有關。
本研究相關性分析結果顯示,手術后末次隨訪時BCVA與手術前BCVA、裂孔最小直徑和基底直徑、病程以及年齡均呈顯著正相關,提示這些因素在大直徑MH的治療預后中可能具有重要作用。特別是裂孔最小直徑、基底直徑和病程與手術后BCVA具有較強的相關性,可能是影響視力預后的關鍵因素。本組裂孔Ⅱ型閉合的2只眼,與手術前BCVA比較,末次隨訪時BCVA不變,此2只眼裂孔基底直徑均>1 300 μm,且均未能在手術后早期遵醫囑執行面朝下體位。我們分析裂孔未能Ⅰ型閉合的原因可能與病程長、裂孔直徑較大以及患者未能保持面朝下體位有關。本研究結果及既往研究結果[3, 14]均提示,裂孔直徑較大、病程較長的難治性MH,手術后裂孔完全閉合率低,視力恢復較差。另外,既往研究已經證實,是否在手術后早期保持面朝下體位或俯臥位也是影響大直徑MH(裂孔直徑>400 μm)預后的重要因素[19]。在高齡患者中,由于患者身體狀況等原因無法很好遵醫囑執行面朝下體位的要求,這也可能是本研究結果中年齡與手術后BCVA相關的原因。這也提醒臨床在手術決策中需充分考慮和綜合評估患者裂孔特點、病程、年齡和身體狀況等因素。末次隨訪時,微視野P1、P2值與手術前BCVA和裂孔基底直徑呈顯著負相關,表明手術前BCVA和裂孔基底直徑可能是影響手術后固視穩定性的因素。
本研究采用自制微注射系統與玻璃體切割機結合使用,實現了BSS的視網膜下注射,并且在操作過程中未出現視網膜或脈絡膜出血、視網膜脫離、黃斑區異常新生血管等并發癥,手術后FAF檢查未發現RPE損傷,證明了該手術操作的安全性和可行性。
本研究存在的局限性是樣本量相對較小,隨訪時間較短,未能全面評估手術后長期療效和可能的遲發性并發癥。未來研究會納入更多患者,延長隨訪時間,以進一步驗證41G超微針視網膜下注射在較大直徑MH治療中的長期效果和安全性。
玻璃體切割手術(PPV)聯合內界膜剝除是治療黃斑裂孔(MH)的標準方法,其初次手術后裂孔閉合率可達到90%以上[1-2]。但對于大直徑MH(裂孔直徑>400 μm)以及病程持續時間較長、高度近視性和外傷性MH,常規PPV聯合內界膜剝除手術后,其裂孔閉合率、視功能改善恢復均不理想[3]。為了解決這些問題,一些學者嘗試了多種改良的手術方式,如利用游離內界膜瓣填塞、內界膜翻轉覆蓋,或是應用羊膜、自體晶狀體囊膜瓣、自體神經視網膜瓣移植等技術,同時也有研究者探討了在手術過程中使用重水、自體血清和粘彈劑作為輔助固定材料[4-9]。然而,這些方法普遍存在操作復雜、獲取材料困難以及固定不易等問題,且手術后黃斑中心凹形態和視覺功能的恢復情況不一,還存在一定的MH復發風險[4, 10]。近年有研究表明,PPV聯合視網膜下液體注射能夠有效分離MH周圍神經上皮下的粘連,促進裂孔區視網膜的重新附著,進而提高其結構和功能的恢復[4, 10]。據文獻報道,這種方法在治療難治性MH時,裂孔閉合率可達到83.3%~100.0%[10-12]。本研究采用25G PPV聯合內界膜剝除及41G超微針視網膜下注射平衡鹽溶液(BSS)對一組大直徑MH患眼進行了治療,初步評價41G超微針視網膜下注射治療大直徑MH的療效和安全性。現將結果報道如下。
1 對象和方法
前瞻性臨床干預性研究。本研究經天津市眼科醫院倫理委員會審核(批準號:KY-2024016);遵循《赫爾辛基宣言》原則;所有參與者均獲得充分知情并簽署書面知情同意書。
2024年3~6月于天津市眼科醫院檢查確診的大直徑全層MH患者22例22只眼納入本研究。納入標準:(1)光相干斷層掃描(OCT)檢查確診全層MH,且裂孔直徑>400 μm;(2)患者年齡18~85歲;(3)均行41G超微針視網膜下注射BSS治療。排除標準:既往玻璃體視網膜手術后裂孔未閉合,或閉合后再次復發;伴有其他影響MH視覺功能觀察的視網膜和視神經病變;手術后不能規律隨訪者。
詳細采集患者病史,記錄病程和眼部手術史、用藥史、眼外傷史及全身疾病史等。所有患眼均行最佳矯正視力(BCVA)、驗光、眼壓、裂隙燈顯微鏡、間接檢眼鏡、眼底彩色照相、眼底自發熒光(FAF)、OCT、微視野以及眼軸長度(AL)測量。BCVA檢查采用標準對數視力表進行,統計時換算為最小分辨角對數(logMAR)視力。采用瑞士Haag-Streit公司光學生物測量儀LS 900測量AL。屈光度數以等效球鏡度數(SE)表示,SE=球鏡+1/2柱鏡。
采用德國Carl Zeiss公司Clarus500超廣角眼底照相機行眼底彩色照相檢查。采用英國Optos公司Daytona P200T成像系統行FAF檢查。采用美國Optovue公司RTVue XR OCT儀測量MH最小直徑和基底直徑。采用意大利CenterVue公司黃斑完整性評估儀行微視野檢查。選擇4-2閾值刺激策略,測試范圍為黃斑區10°。測試過程中記錄黃斑10°范圍內黃斑整體指數(MII)、黃斑閾值(MT)以及黃斑中心凹2°、4°固視率(分別記錄為P1、P2)。
患眼均行經睫狀體平坦部標準三通道25G PPV聯合內界膜剝除手術。合并白內障者聯合行白內障超聲乳化人工晶狀體(IOL)植入手術。手術中除常規操作外,切除玻璃體,剝離玻璃體后皮質,吲哚青綠染色,剝除黃斑區上下血管弓以內內界膜。使用自制的密閉微注射系統[13]連接41G超微針,于MH周圍距裂孔邊緣約1個視盤直徑處分別于上方、下方、顳側視網膜下注射BSS,注射量以裂孔邊緣出現至少270°視網膜脫離為準。視網膜下注射可以在穿透視網膜前開始,以避免潛在的視網膜色素上皮(RPE)損傷[14] 。注射結束后進行全氣液交換;手術完畢時,MH最小直徑>600 μm者,玻璃體腔填充C3F8 0.5 ml。手術后患者面朝下體位5 d。手術中仔細觀察是否出現視網膜和脈絡膜出血以及視網膜脫離、脈絡膜脫離等情況的發生。
手術后1周及1、3個月隨訪,平均隨訪時間1.91個月。其中,完成1、3個月隨訪分別為12、10例。手術后1周,行裂隙燈顯微鏡、間接檢眼鏡檢查和眼壓測量;手術后1、3個月,行BCVA、眼壓、眼底、FAF、OCT、微視野檢查。隨訪主要終點為手術后1個月時裂孔閉合情況。以OCT檢查結果評估裂孔閉合情況:Ⅰ型,完全閉合,黃斑中心凹上方可見神經上皮完全覆蓋,無裸露的RPE,并根據中心凹處有無組織分為U形閉合和V形閉合;Ⅱ型,不完全閉合,裂孔邊緣神經上皮附著于RPE,但中心凹有裸露的RPE(W形閉合)[5-6];Ⅲ型:未閉合,裂孔邊緣神經上皮脫離。次要終點為手術后視功能改善情況,對比觀察手術前后BCVA、MII、MT及P1、P2的變化。以BCVA提高大于2行及以上為視力提高,下降大于2行及以上為視力降低,BCVA變化介于2行之間為視力不變。此外,應用FAF檢查評估RPE的損傷情況。記錄手術后視網膜脫離、脈絡膜脫離、視網膜裂孔、黃斑區異常新生血管、高眼壓或低眼壓、眼內炎以及手術前晶狀體透明患者的白內障發生率等并發癥發生情況。
采用SPSS25.0軟件進行統計學分析。應用Kolmogorov-Smirnov檢驗連續變量的正態性。呈正態分布,以均數±標準差(x±s)表示;不符合正態分布,以中位數(四分位間距)[M(QL,QU)]表示。同一連續性指標的手術前后比較,呈正態分布且方差齊采用Stutent't檢驗;方差不齊或非正態分布采用Mann-Whitney U檢驗。不同指標之間的相關性采用Pearson相關性分析。分析結果包括BCVA和微視野變化情況、裂孔早期閉合率以及任何手術后并發癥發生率。檢驗水準α=0.05,雙側檢驗。P≤0.05為差異有統計學意義。
2 結果
22例患者中,男性4例,女性18例;均為單眼發病,其中右眼、左眼分別為13、9只眼。年齡66(60,71)歲,年齡范圍23~81歲。病程5(2.5,12.0)個月,病程范圍1~72個月。患眼SE為0(-1.63,0.31)D;AL為22.96(22.66,24.97)mm。有晶狀體眼、IOL分別為20、2只眼。特發性、高度近視性、外傷性全層MH分別為18、2、2只眼。裂孔最小直徑、基底直徑分別為(601.45±122.09)、(1 020.86±355.35)μm。
有晶狀體眼20只眼中,手術中聯合行白內障超聲乳化吸除及IOL植入18只眼。手術完畢時,玻璃體腔填充無菌空氣、C3F8分別為10、12只眼。
手術后1個月,22只眼中,裂孔Ⅰ型閉合(圖1,2)20只眼(90.91%,20/22);Ⅱ型閉合2只眼(9.09%,2/22)。
 圖1
全層黃斑裂孔患眼光相干斷層掃描像 患者女,72歲;病程13個月;手術前裂孔最小直徑、基底直徑分別為670、1 140 μm;手術前及手術后1個月最佳矯正視力分別為數指/30 cm、0.05。1A示手術前,可見全層黃斑裂孔;1B示手術后1個月,裂孔完全閉合
圖1
全層黃斑裂孔患眼光相干斷層掃描像 患者女,72歲;病程13個月;手術前裂孔最小直徑、基底直徑分別為670、1 140 μm;手術前及手術后1個月最佳矯正視力分別為數指/30 cm、0.05。1A示手術前,可見全層黃斑裂孔;1B示手術后1個月,裂孔完全閉合
 圖2
外傷性全層黃斑裂孔患眼手術前后光相干斷層掃描像 患者女,23歲。左眼鈍挫傷后視力下降2個月;眼軸長度27.5 mm;手術前及手術后1、3個月BCVA分別為0.2、0.6、0.8。2A示手術前,裂孔最小直徑620 μm;2B示手術后1個月,裂孔Ⅰ型閉合,黃斑區視網膜外層結構不清;2C示手術后3個月,視網膜層次清楚,中心凹橢圓體帶少許缺失
圖2
外傷性全層黃斑裂孔患眼手術前后光相干斷層掃描像 患者女,23歲。左眼鈍挫傷后視力下降2個月;眼軸長度27.5 mm;手術前及手術后1、3個月BCVA分別為0.2、0.6、0.8。2A示手術前,裂孔最小直徑620 μm;2B示手術后1個月,裂孔Ⅰ型閉合,黃斑區視網膜外層結構不清;2C示手術后3個月,視網膜層次清楚,中心凹橢圓體帶少許缺失
末次隨訪時,視力提高、不變分別為20、2只眼。視力不變的2只眼,均為裂孔Ⅱ型閉合者。其中,病程72、12個月各1只眼;裂孔最小直徑分別為896、738 μm,裂孔基底直徑均>1 300 μm;手術后均未遵醫囑保持面朝下體位。手術前、末次隨訪患眼logMAR BCVA、MII、MT比較,差異均有統計學意義(P<0.05);P1、P2比較,差異均無統計學意義(P>0.05)(表1)。
相關性分析結果顯示,手術后BCVA與手術前BCVA、裂孔最小直徑和基底直徑以及病程、年齡呈顯著正相關(P<0.05);手術后微視野P1、P2與手術前BCVA、裂孔基底直徑呈顯著負相關(P<0.05);手術后BCVA、MII、MT、P1、P2與AL之間均無相關性(P>0.05)(表2)。
手術前及手術后1、3個月,所有患眼均未見異常FAF表現(圖3)。
 圖3
外傷性全層黃斑裂孔患眼(圖2同眼)手術前后眼底自發熒光像 3A、3B分別示手術前、手術后1個月,均未見異常自發熒光,圖3B上方為氣泡影
圖3
外傷性全層黃斑裂孔患眼(圖2同眼)手術前后眼底自發熒光像 3A、3B分別示手術前、手術后1個月,均未見異常自發熒光,圖3B上方為氣泡影
手術中和手術后隨訪期間,所有患眼均未出現高眼壓或低眼壓、視網膜和脈絡膜出血、視網膜脫離、脈絡膜脫離、眼內炎、黃斑區異常新生血管等并發癥;未聯合行白內障手術的2只眼,晶狀體透明,未發生白內障。
3 討論
玻璃體視網膜手術中,視網膜下注射為一種精細的手術操作方法,因其能直接將藥物輸送到視網膜下空間作用于RPE和光感受器細胞,近年被廣泛應用于遺傳性視網膜疾病的基因治療[7]。對于黃斑大量出血的患眼,可通過視網膜下注射纖溶酶原激活劑等藥物來達到治療效果[8]。另外,通過在裂孔周圍視網膜神經上皮下注射BSS能夠有效分離其周圍的神經上皮和RPE之間的粘連,使裂孔邊緣游離,減少視網膜張力,從而促進視網膜重新定位附著,利用視網膜的自然彈性和向心力促使裂孔閉合[4, 12]。隨著41G超微針的出現,使得視網膜下注射技術更加微創和安全。本研究旨在評估25G PPV中41G超微針視網膜下注射治療大直徑MH的效果和安全性。結果顯示,手術后1個月,裂孔Ⅰ型閉合(完全閉合)率達90.91%(20/22),Ⅱ型閉合(不完全閉合)率為9.09%(2/22);無1例發生手術相關并發癥。這初步證實了該方法治療大直徑MH的有效性和安全性。盡管本研究結果為手術后早期的研究結果,但與既往研究結果的長期隨訪數據相近[9, 15-16]。既往研究排除了高度近視性和外傷性MH,而本組2例高度近視性MH和2例外傷性MH患者手術后均達到Ⅰ型閉合,初步證實41G超微針視網膜下注射BSS治療高度近視性和外傷性MH的有效性。
視功能方面,本組患眼手術后1個月、末次隨訪時BCVA較手術前顯著提高。與視力比較,微視野檢查能夠更加客觀地評價黃斑區視覺敏感度。本組患眼末次隨訪時MII和MT較手術前顯著改善,與既往研究結果相似[17-18],說明手術后黃斑區10°范圍內的視覺功能得到提高。此外,固視穩定性對于視覺功能有重大影響,與視覺敏感度相關[18]。微視野檢查中P1、P2值可反映患者的固視穩定性,其值越大,代表固視穩定性越強。本組患眼末次隨訪時P1、P2值較手術前有所增加,但差異無統計學意義,考慮可能與本研究樣本量小以及隨訪時間較短,患者視功能未能完全恢復有關。
本研究相關性分析結果顯示,手術后末次隨訪時BCVA與手術前BCVA、裂孔最小直徑和基底直徑、病程以及年齡均呈顯著正相關,提示這些因素在大直徑MH的治療預后中可能具有重要作用。特別是裂孔最小直徑、基底直徑和病程與手術后BCVA具有較強的相關性,可能是影響視力預后的關鍵因素。本組裂孔Ⅱ型閉合的2只眼,與手術前BCVA比較,末次隨訪時BCVA不變,此2只眼裂孔基底直徑均>1 300 μm,且均未能在手術后早期遵醫囑執行面朝下體位。我們分析裂孔未能Ⅰ型閉合的原因可能與病程長、裂孔直徑較大以及患者未能保持面朝下體位有關。本研究結果及既往研究結果[3, 14]均提示,裂孔直徑較大、病程較長的難治性MH,手術后裂孔完全閉合率低,視力恢復較差。另外,既往研究已經證實,是否在手術后早期保持面朝下體位或俯臥位也是影響大直徑MH(裂孔直徑>400 μm)預后的重要因素[19]。在高齡患者中,由于患者身體狀況等原因無法很好遵醫囑執行面朝下體位的要求,這也可能是本研究結果中年齡與手術后BCVA相關的原因。這也提醒臨床在手術決策中需充分考慮和綜合評估患者裂孔特點、病程、年齡和身體狀況等因素。末次隨訪時,微視野P1、P2值與手術前BCVA和裂孔基底直徑呈顯著負相關,表明手術前BCVA和裂孔基底直徑可能是影響手術后固視穩定性的因素。
本研究采用自制微注射系統與玻璃體切割機結合使用,實現了BSS的視網膜下注射,并且在操作過程中未出現視網膜或脈絡膜出血、視網膜脫離、黃斑區異常新生血管等并發癥,手術后FAF檢查未發現RPE損傷,證明了該手術操作的安全性和可行性。
本研究存在的局限性是樣本量相對較小,隨訪時間較短,未能全面評估手術后長期療效和可能的遲發性并發癥。未來研究會納入更多患者,延長隨訪時間,以進一步驗證41G超微針視網膜下注射在較大直徑MH治療中的長期效果和安全性。