本文使用彌散張量成像及白質纖維束追蹤技術構建和分析了 15 名腦性癱瘓患兒和 30 名正常嬰兒大腦的白質腦網絡,發現腦性癱瘓患兒和正常嬰兒的白質腦網絡都具有”小世界”屬性,但患兒的最短路徑長度明顯變長,而標準聚類系數、全局效率和局部效率明顯下降。此外,我們還發現左腦楔葉、左右腦楔前葉以及左腦扣帶回后部是嬰兒白質腦網絡的核心節點,患兒白質腦網絡的部分節點存在異常,且異常節點多集中于顳葉、枕葉和頂葉。本文結果表明腦性癱瘓嬰兒的白質腦網絡已經出現紊亂的現象,這為我們進一步研究腦性癱瘓兒童的發病機制提供了幫助。
引用本文: 李均, 楊澄, 王遠軍, 聶生東. 腦性癱瘓嬰兒的白質腦網絡研究. 生物醫學工程學雜志, 2017, 34(5): 688-694. doi: 10.7507/1001-5515.201612044 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
腦性癱瘓是最常見的兒童慢性運動障礙疾病,它是指發育中的胎兒或剛出生的嬰兒因各種干擾而導致的非進行性腦損傷,通常是因為腦白質中出現彌漫性損傷或者局灶性病變,而當這些損傷或病變發生在腦室的周圍區域時最為嚴重。它引發的神經學缺陷癥狀與患兒大腦結構損傷的位置以及嚴重程度有關,主要表現為運動障礙,常常伴隨認知行為障礙、語言交流能力下降、癲癇等癥狀[1]。如今早產兒存活率的上升也提高了腦性癱瘓的患病率,每 1 000 個兒童中大約有 2~3 個腦性癱瘓的患兒[2],這些患兒及其家庭將遭遇到難以估量的健康、心理和經濟等問題。所以,針對腦性癱瘓這一疾病,最重要的是合理適當地采取防止其發生、降低患病率、改善患者病情等一系列措施。
目前腦性癱瘓的診斷主要是通過醫學影像技術做神經學評估[1],比如腦部的電子計算機斷層掃描(computed tomography,CT)、顱腦超聲、核磁共振 T1 加權圖像、T2 加權圖像等。然而這些腦部結構成像并不能精確反映腦性癱瘓患兒的受損腦區與臨床腦功能障礙之間的聯系。當白質損傷的面積較大時,在腦部結構成像中才容易被觀察到,而在腦性癱瘓患兒的大腦中,同等嚴重的腦功能損傷反映在腦部結構成像中可能只是很小的腦白質病變區域,甚至可能沒有明顯的神經影像結果[2],此時常規的腦部結構成像并不利于兒童腦性癱瘓的診斷。所以目前迫切需要一個新的工具來更好地衡量腦性癱瘓患兒腦結構異常與臨床腦功能障礙之間的關系。
彌散張量成像(diffusion tensor imaging,DTI)是一種研究腦白質結構變化的非侵入式醫學成像技術,雖然相關研究已經能將 DTI 用于探索腦性癱瘓患者的腦白質異常與認知行為功能缺陷之間的聯系,并指出解剖結構上腦白質變化和感覺運動區域的功能障礙之間存在一定的相關性,但是既往研究只是測量和比較感覺運動腦區的各向異性值(fraction anisotropy,FA)[3-6],部分研究會進一步利用腦白質神經纖維束追蹤方法來比較大腦神經纖維束數量的變化[7-10]。盡管這兩個方法能偵測到異常腦區,但是 FA 值與神經束數量并不能直接反映疾病狀態下大腦各個腦區之間的連通情況。
2005 年,Sporns 等[11]提出構建“人腦連接組”(human connectome)的設想,并且認為可以通過構建人腦網絡來探究人腦工作原理,甚至從腦網絡角度研究各種腦部神經疾病。近些年來,腦網絡作為一種新的腦認知功能測量工具正廣泛應用于多種腦疾病研究中,已經發現多種神經疾病與個體腦網絡的異常存在著相關性,比如抑郁癥[12]、阿爾茨海默病[13-14]、輕度認知障礙等[15]。因此,基于 DTI 圖像數據構建并分析腦性癱瘓患兒的結構腦網絡,能夠將患兒的腦功能進行量化,獲得各個腦區之間的連接關系,推測異常腦區的變化等。然而,目前仍少有研究者使用結構腦網絡來分析腦性癱瘓患兒的全腦異常,研究患兒的腦白質網絡的結構差異和病變程度,為診斷腦性癱瘓患兒提供神經病理學依據。
因此,本研究基于 DTI 圖像數據構建腦性癱瘓患兒(試驗組)與正常嬰兒(對照組)的結構腦網絡,然后從全腦以及局部腦區這兩個角度,計算腦網絡的拓撲屬性差異和局部節點特征差異,推測患兒的認知、運動、語言功能的異常。本研究旨在論證結構腦網絡作為一種新的研究工具用于衡量腦性癱瘓患兒大腦結構變化的可行性,以期在未來的研究中,結構腦網絡可能用于檢測和評估腦性癱瘓病情,并有助于病情診斷和選擇最佳治療方案。
1 數據與方法
1.1 數據采集
本研究使用的 DTI 圖像數據來自于復旦大學附屬兒童醫院,包括試驗組:15 名被確診為腦性癱瘓的嬰兒,其中男嬰 7 名,女嬰 8 名;對照組:30 名正常健康的嬰兒,其中男嬰 17 名,女嬰 13 名。所有受試嬰兒的年齡都是三個月。試驗組為經過醫生對腦部圖像檢查、體格檢查及輔助檢查后確診為腦性癱瘓的患兒;對照組是隨機篩選的體格匹配的正常健康嬰兒。
本研究使用的 DTI 圖像數據是由磁共振成像設備 MAGNETOM Avanto(1.5 T,西門子公司/德國)采用回波平面成像序列(Echo-planar imaging,EPI)采集獲得,DTI 圖像由 20 個彌散敏感系數 b 值為 1 000 s/mm2 的加權圖像和 1 個 b 值為 0 的無加權圖像(b0 圖像)組成。具體掃描參數為:重復時間(repetition time,TR)為 3 400 ms,回波時間(echo time,TE)為 89 ms,成像矩陣為 128×104,層厚為 4 mm。
1.2 腦網絡構建方法
腦網絡最基本和最關鍵的兩個組成元素是節點和邊:節點代表了大腦的各個腦區,邊則能反映各個腦區之間的聯系。本研究關于節點和邊的定義方法與相關文獻[12-15]類似,采用下述步驟完成定義。
1.2.1 節點定義 為了定義節點,本研究采用了自動解剖標記模板(automated anatomical labeling 90 atlas,AAL 90),將大腦定義為 90 個腦區,每一個腦區都代表腦網絡中的一個節點。首先使用腦部磁共振圖像綜合分析軟件 FSL 5.0(Oxford,英國)的線性配準算法(FMRIB’s linear image registration tool,FLIRT)與非線性配準算法(FMRIB’s non-linear image registration tool,FNIRT)相結合的方法,將每個受試者的 b0 圖像配準到蒙特利爾標準空間(Montreal Neurological Institute space,MNI)的 MNI 152 模板。再將得到的配準變換矩陣取逆后應用于 AAL 90 模板,使 MNI 空間的 AAL 90 模板逆變換到每個受試者的始空間(native space),最終讓 AAL 90 模板配準到 b0 圖像。節點定義中的所有圖像處理工作,包括圖像預處理中的“腦實質提取”、“渦流校正”以及圖像配準,都是使用開源 FSL 5.0 軟件包完成的。
1.2.2 邊定義 為了定義腦網絡中連接節點的邊,本研究在每個受試者的原始空間里重建出全腦的白質纖維束。白質纖維束重建工作主要是采用目前腦網絡研究中廣泛使用的確定性纖維束追蹤算法(fiber assignment by continuous tracking,FACT),以每一個體素為種子點,追蹤的條件為 FA 大于 0.2 以及纖維束追蹤過程兩個連接的轉角小于 60°[14]。由于 FACT 算法易受圖像的分辨率和噪聲影響,重建結果中容易包含偽連接。針對這個問題,本研究將當兩腦區之間的纖維束連接數目大于 3 時視為存在連接[16]。最后以 FA 和纖維束數目(fiber number,FN)為權重,構建出 FA 加權網絡和 FN 加權網絡。構建加權網絡的優點在于能重點反映受試者大腦的特定屬性,比如 FA 加權網絡側重反映了白質纖維束的完整性和導通性,而 FN 網絡則側重反映了白質纖維束的密度[16]。邊的定義工作主要是在矩陣實驗室 MATLAB 2012(MathWorks Inc.,美國)平臺上使用開源腦結構連接組分析軟件 PANDA 1.3.1(北京師范大學,中國)完成的,主要包括計算 FA 值、白質纖維束重建、加權網絡的構建。
1.3 網絡屬性分析
本研究主要使用圖論計算了兩種加權腦網絡(FA 加權網絡、FN 加權網絡)的拓撲參數,既往研究常用它們來確定腦網絡的特征屬性[17]。各參數均在 MATLAB 2012 平臺上使用開源圖論網絡分析軟件包 GRETNA 1.2(北京師范大學,中國)計算。
1.3.1 網絡參數 本研究主要計算了兩種加權腦網絡(FA 加權網絡、FN 加權網絡)的“小世界”特征參數,既往研究常用它們來確定腦網絡的特征屬性[17]。其中聚類系數(clustering coefficient,CC)(以符號
 表示)被定義為節點與周圍節點相連接的概率,反映了腦網絡局部區域的內部連接情況,它的表達式如下:
表示)被定義為節點與周圍節點相連接的概率,反映了腦網絡局部區域的內部連接情況,它的表達式如下:
 |
其中 Ei 表示網絡連接的邊的總數量,Ki 表示節點 i 連接的邊數。如果
 ,那么 Ki=0 或 Ki=1,說明該點是孤立點。
,那么 Ki=0 或 Ki=1,說明該點是孤立點。
最短路徑長度(shortest path length,SPL)(以符號
 表示)在腦網絡的信息傳遞與交流中扮演著重要角色,可以形象比喻成點與點之間的最佳路徑的平均長度,反映腦區間信息傳播的能力,它被定義為:
表示)在腦網絡的信息傳遞與交流中扮演著重要角色,可以形象比喻成點與點之間的最佳路徑的平均長度,反映腦區間信息傳播的能力,它被定義為:
 |
其中 N 為網絡中的節點數,G 代表腦網絡矩陣,dij 為節點 i 與節點 j 之間的距離。
為了計算“小世界”屬性 σ,本研究選取了 100 個匹配的隨機網絡(與真實網絡相同數量的節點、邊和度的分布)[14],計算隨機網絡的聚類系數 CCW-random 和最短路徑長度
 。最后我們計算出標準化聚類系數,
。最后我們計算出標準化聚類系數,
 ,以及標準化最短路徑長度,
,以及標準化最短路徑長度,
 。
。
“小世界”網絡具有與規則網絡類似的較高的聚類特性[17],又具有與隨機網絡類似的較短的
 ,即是
,即是
 且
且
 ,確保了“小世界”網絡在局部和全局水平上信息傳輸與交流的高效性。所以小世界屬性可以用
,確保了“小世界”網絡在局部和全局水平上信息傳輸與交流的高效性。所以小世界屬性可以用
 來衡量,
來衡量,
 。
。
由于
 是在全局連通的基礎上定義的,然而網絡中可能有部分點存在“失連接”的狀態,所以針對部分節點“失連接”的情況,以往研究給出全局效率(global efficiency,GE)(以符號 Eg 表示)的定義[17]:
是在全局連通的基礎上定義的,然而網絡中可能有部分點存在“失連接”的狀態,所以針對部分節點“失連接”的情況,以往研究給出全局效率(global efficiency,GE)(以符號 Eg 表示)的定義[17]:
 |
其中 Eg 的值越大,表示信息在這個網絡上進行交換所付的代價越小,相對的信息傳送和處理效率越高。
同樣,聚類系數也是基于全局連通的參數,針對部分節點“失連接”的情況,采用局部效率(local efficiency,LE)(以符號 Eloc 表示)這一參數,它的定義為:
 |
其中 Eloc 的值越大,說明網絡的局部效率越高,區域的節點信息交流能力越高。
1.3.2 節點效率 為了確定腦網絡結構的節點特征,本研究計算了節點的效率(nodal efficient,NE)(以符號 ei 表示),以此來衡量各個節點的連接以及信息傳輸效率[17],評估各個節點在大腦中的作用、地位以及疾病對各個節點的影響。
節點 i 的效率 ei 被定義為:
 |
節點效率 ei 測量了節點 i 與網絡中的其余節點之間的信息傳播能力。
1.4 統計分析
為了分析比較試驗組和對照組的網絡參數:聚類系數 CCW,最短路徑
 ,標準聚類系數 γ,標準最短路徑 λ,全局效率 Eg 和局部效率 Eloc 以及節點效率 ei,本研究采用獨立樣本 t 檢驗計算組間差異,其中 P<0.05 說明組間的差異具有統計學意義,使用柯爾莫諾夫-斯米爾諾夫檢驗(Kolmogorov-Smirnov test)用來檢驗連續變量是否符合正態分布以滿足t 檢驗要求。數據分析工作主要是使用 MATLAB 2012 的統計工具箱函數完成。
,標準聚類系數 γ,標準最短路徑 λ,全局效率 Eg 和局部效率 Eloc 以及節點效率 ei,本研究采用獨立樣本 t 檢驗計算組間差異,其中 P<0.05 說明組間的差異具有統計學意義,使用柯爾莫諾夫-斯米爾諾夫檢驗(Kolmogorov-Smirnov test)用來檢驗連續變量是否符合正態分布以滿足t 檢驗要求。數據分析工作主要是使用 MATLAB 2012 的統計工具箱函數完成。
2 實驗結果
2.1 人口學統計結果
既往研究已經報道了性別和年齡將對腦網絡產生較大的影響[18-20],為了排除性別和年齡對結果的影響,首先采用卡方檢驗檢查試驗組和對照組的性別差異,結果發現兩組受試患兒的性別差異不具有統計學意義(P=0.361)。而兩組受試患兒的年齡都是三個月,所以不存在年齡差異。
2.2 “小世界”屬性
以往研究顯示可以用“小世界”模型來表征腦網絡[12-16, 18-20],通過計算兩個受試者組以及與之相匹配的隨機網絡的 CCW-random 和
 ,發現這兩個受試者組的 γ 遠大于隨機網絡(γ試驗組=4.889±1.841,γ對照組=3.918±1.126),而λ 與隨機網絡很相近(λ試驗組=1.200±0.149,λ對照組=1.108±0.045)。所以兩個受試者組的“小世界”屬性(σ試驗組=4.037±1.328,σ對照組=3.521±0.942)都明顯大于 1。這一結果說明腦性癱瘓患兒與健康嬰兒的腦網絡都具有“小世界”網絡屬性。
,發現這兩個受試者組的 γ 遠大于隨機網絡(γ試驗組=4.889±1.841,γ對照組=3.918±1.126),而λ 與隨機網絡很相近(λ試驗組=1.200±0.149,λ對照組=1.108±0.045)。所以兩個受試者組的“小世界”屬性(σ試驗組=4.037±1.328,σ對照組=3.521±0.942)都明顯大于 1。這一結果說明腦性癱瘓患兒與健康嬰兒的腦網絡都具有“小世界”網絡屬性。
2.3 試驗組腦網絡拓撲屬性的異常
對兩組受試者的網絡參數進行 t 檢驗,結果發現與對照組相比,試驗組的腦網絡的 CCW 和 σ(PCC=0.284 和 Pσ=0.139,P 值都大于 0.05)不存在具有統計學意義的差異。而
 (t=2.200,P=0.033)和 λ(t=3.107,P=0.003)都明顯變大,γ(t=–1.970,P=0.034)明顯變小。并且 Eg(t=–2.175,P=0.035)和 Eloc(t=–2.284,P=0.027)也都出現明顯下降的現象。
(t=2.200,P=0.033)和 λ(t=3.107,P=0.003)都明顯變大,γ(t=–1.970,P=0.034)明顯變小。并且 Eg(t=–2.175,P=0.035)和 Eloc(t=–2.284,P=0.027)也都出現明顯下降的現象。
基于以上的結果可以看出,與正常嬰兒的腦網絡比較,腦性癱瘓患兒的拓撲結構出現了巨大的變化,可能由于疾病影響導致腦網絡結構受損,腦網絡的效率也出現下降的趨勢,這將造成患兒腦網絡的信息傳輸和處理能力下降[13-15]。
2.4 節點特征
2.4.1 核心節點的差異 對于腦網絡中的節點屬性,本研究通過計算節點效率 ei 來衡量腦網絡各個節點的效率。由于大腦需要高效率處理各種信息,所以腦網絡中會形成一些特殊的節點——核心節點(hub),這些節點往往具有較高的信息傳輸效率和信息處理效率,與周圍的其他節點緊密關連[21]。本研究中將那些比所有節點的平均節點效率高出一個標準差的節點定義為核心節點[14]。
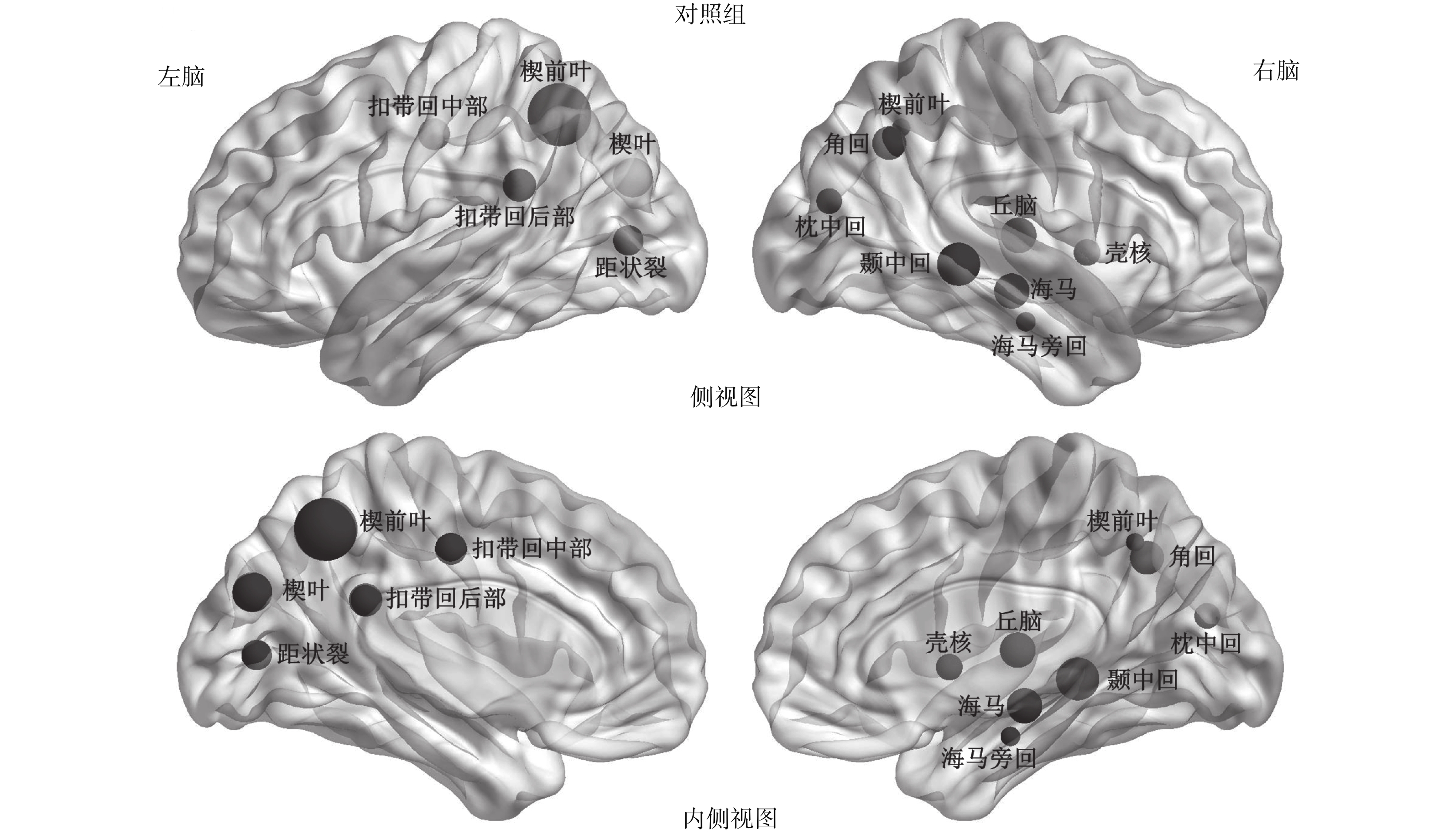
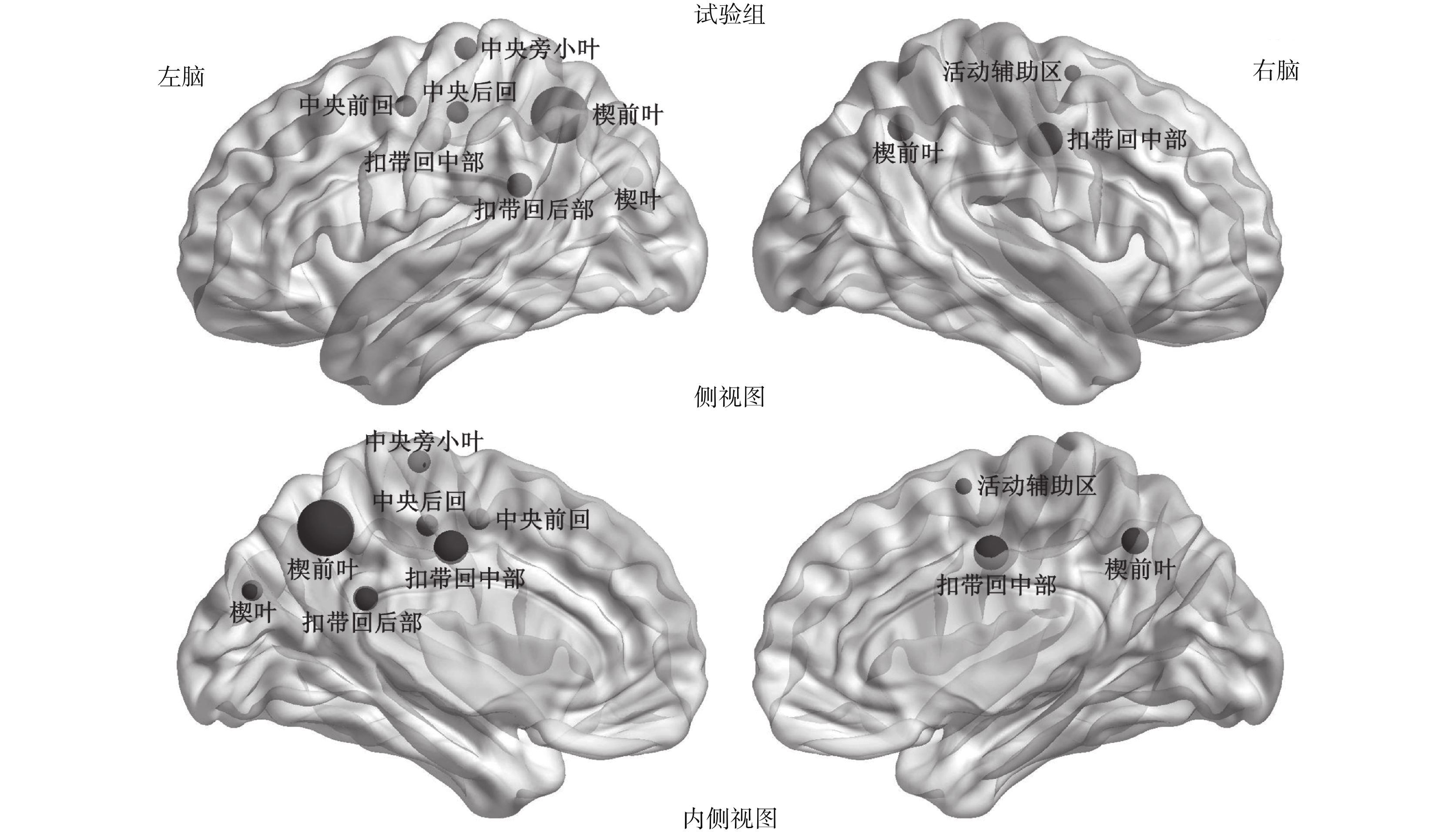
在對照組中,發現 13 個核心節點,主要包括了 7 個節點位于關聯皮層區(association cortex region)、1 個位于原發性皮質區(primary cortex region)、2 個位于皮質下區(subcortical regions)以及 3 個位于邊緣皮質區(paralimbic cortex regions),如圖 1 所示。然而在試驗組中,只存在 10 個核心節點,包括 5 個位于關聯皮層區、2 個位于原發性皮質區以及 3 個位于邊緣皮質區,如圖 2 所示。在圖 1 和圖 2 中,代表節點的小球的體積越大說明該節點效率越高,反之越低。通過比較兩組核心節點,我們發現試驗組與對照組存在 4 個共同的核心節點,分別是左腦的楔葉(cuneus,CUN)、左右腦的楔前葉(precuneus,PCUN)以及左腦扣帶回后部(posterior cingulate gyrus,PCG)。本次研究發現,無論是試驗組還是對照組,腦網絡中最重要的核心節點均是左腦扣帶回后部。以往研究顯示成年人腦網絡最重要的核心節點是扣帶回后部以及楔前葉[19, 22],與本次研究結果存在一定的相似點與差異點,主要是因為本次受試者組都是三個月大的嬰兒,而人類的大腦在不同的年齡階段存在一定的差異。
 圖1
對照組的核心節點
Figure1.
Control group hubs
圖1
對照組的核心節點
Figure1.
Control group hubs
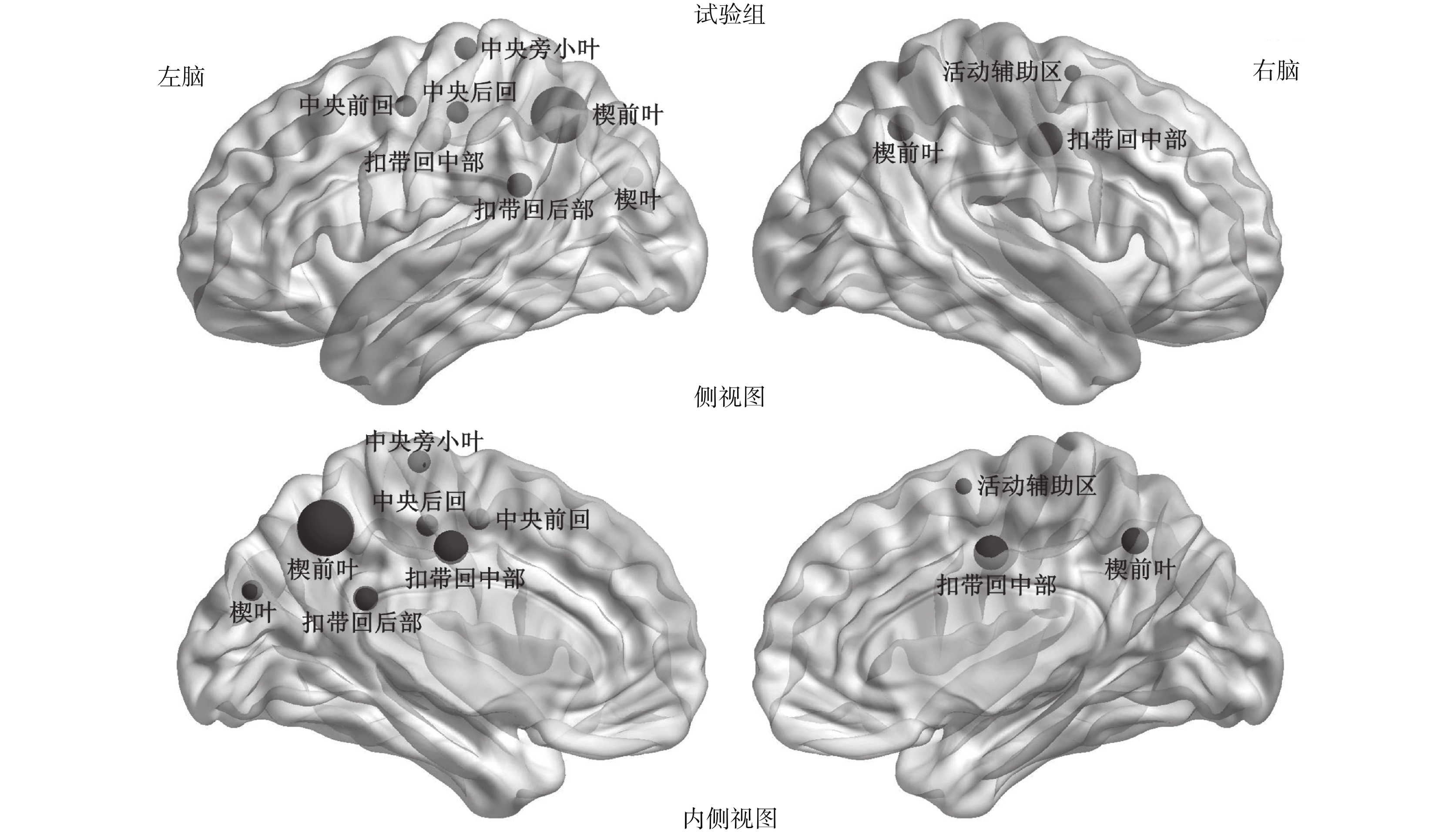 圖2
試驗組的核心節點
Figure2.
Cerebral palsy group hubs
圖2
試驗組的核心節點
Figure2.
Cerebral palsy group hubs
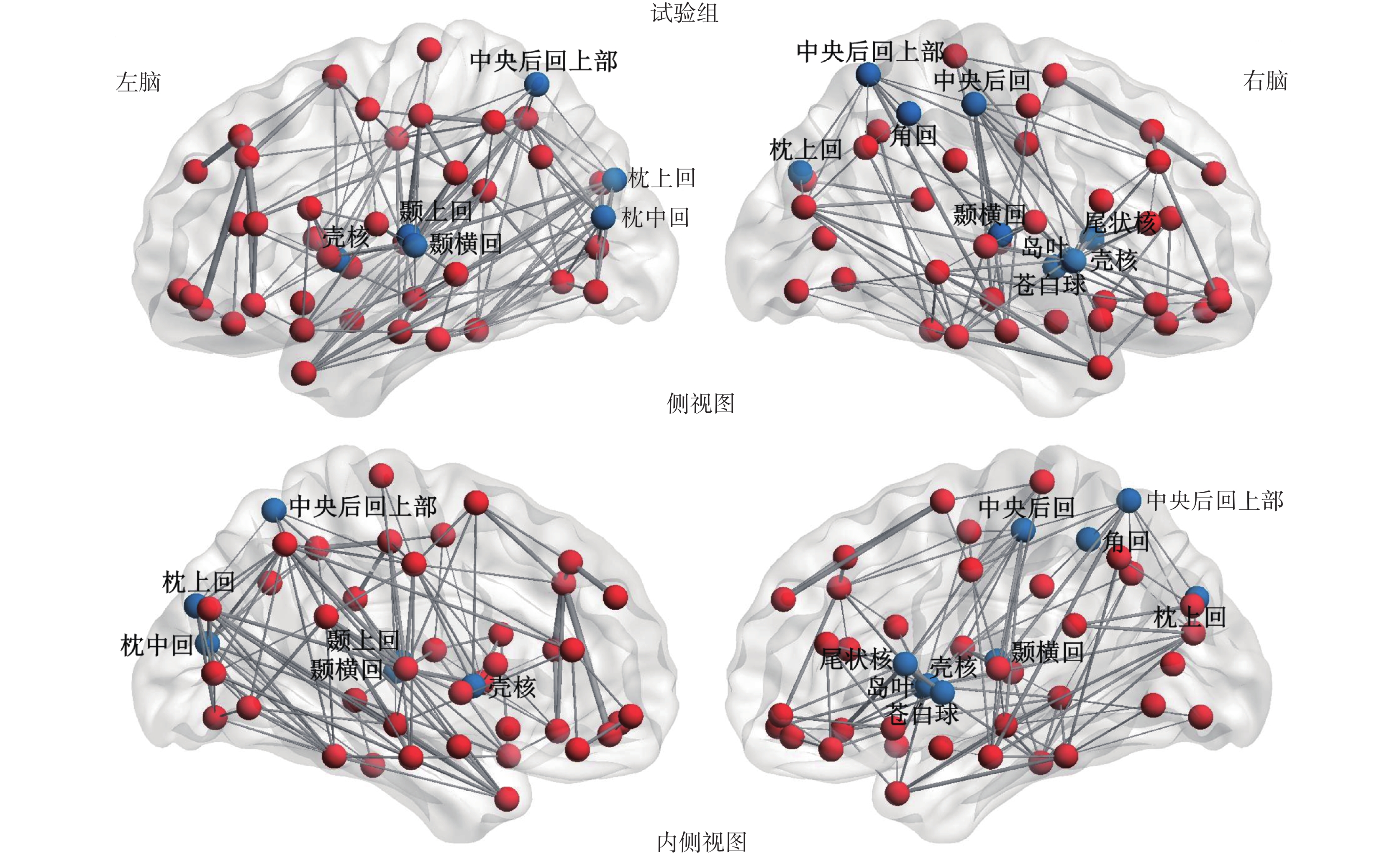
2.4.2 試驗組的節點效率異常 本次研究進一步計算和比較了兩組受試者的腦網絡的節點效率 ei。我們發現,與對照組相比,試驗組的右腦中央前回(right precentral gyrus,PoCG.R)、中央后回(superior parietal gyrus,SPG)、右腦島葉(right insula,INS.R)、顳橫回(heschl gyrus,HES)、左腦顳上回(left superior temporal gyrus,STG.L)、枕上回(superior occipital gyrus,SOG)、左腦枕中回(left middle occipital gyrus,MOG.L)、右腦中央后回上部(right inferior parietal,IPL.R)、右腦尾狀核(right caudate nucleus,CAU.R)、殼核(lenticular nucleus putamen,PUT)和右腦蒼白球(right lenticular nucleus pallidum,PAL.R)這些腦區的節點效率出現明顯下降的現象(P<0.05),這將導致試驗組的腦網絡的相應節點信息傳輸和處理效率降低,如圖 3 所示,其中紅色節點代表節點效率正常的節點,藍色節點代表節點效率明顯降低的節點,而邊的粗細代表連接的強弱。
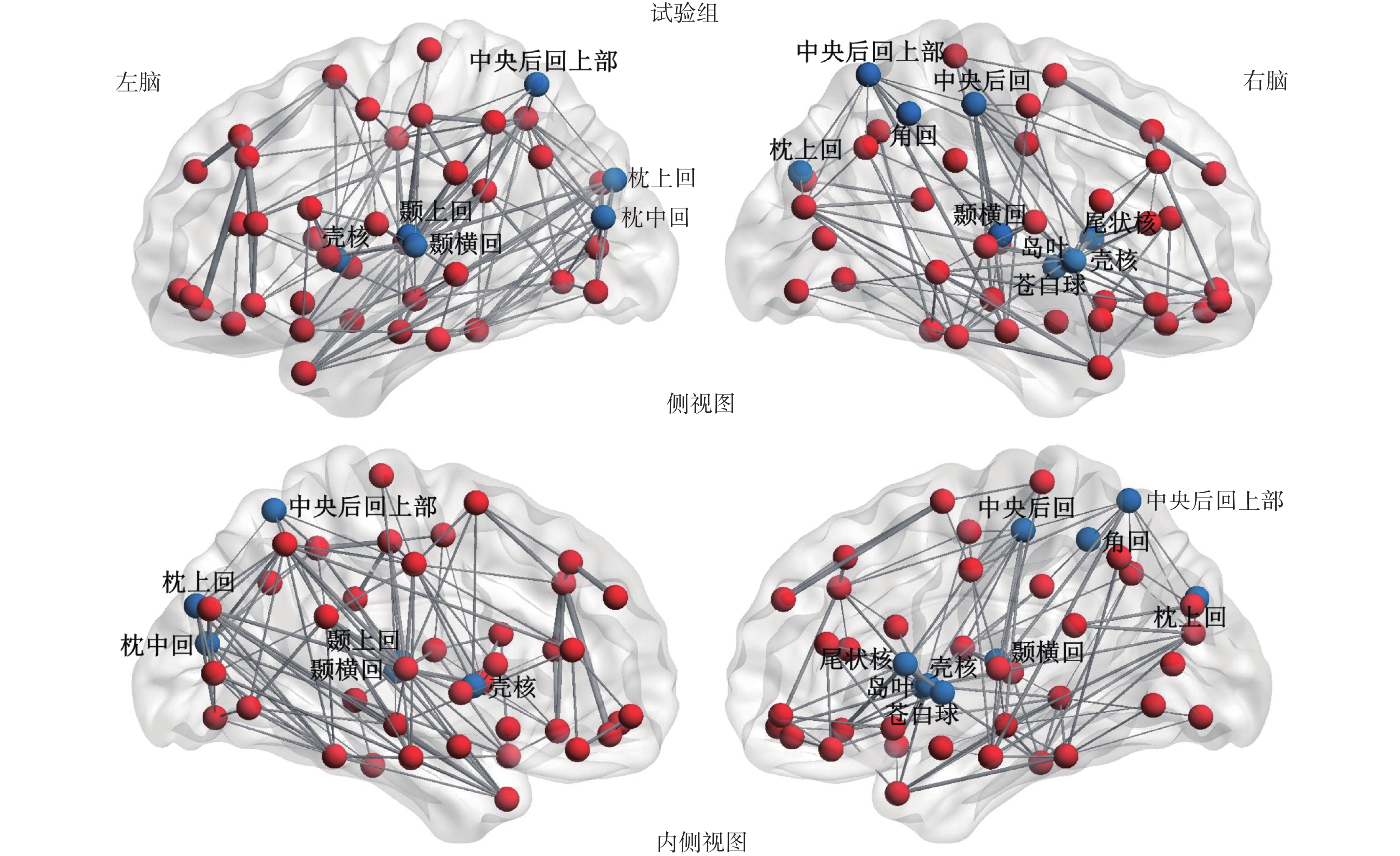 圖3
試驗組腦網絡的異常節點效率
Figure3.
Abnormal nodal efficiency in brain network of test group
圖3
試驗組腦網絡的異常節點效率
Figure3.
Abnormal nodal efficiency in brain network of test group
3 討論與總結
通過計算和比較兩組受試者的網絡參數及節點屬性,我們發現:① 兩組受試者的腦網絡都呈現“小世界”模型,但由于疾病的影響,試驗組的腦網絡的拓撲屬性出現異常;② 試驗組的腦網絡的節點屬性也發生了改變,與對照組對比,其中核心節點數量變少且位置變更,部分節點的節點效率也有明顯變小的趨勢。
3.1 試驗組腦網絡的網絡參數異常
本次研究發現兩組受試者的腦網絡都呈現“小世界”拓撲結構,這跟以往關于人類腦網絡相關研究報道的結果相符合[12-15, 18-22]。然而,盡管試驗組的腦網絡具有“小世界”屬性,但是部分網絡參數已經發生明顯變化,其中
 和 λ 明顯變大,γ 明顯變小,而 Eg 和 Eloc 出現明顯下降的現象。
和 λ 明顯變大,γ 明顯變小,而 Eg 和 Eloc 出現明顯下降的現象。
 被認為是測量腦網絡節點的有效性、完整性以及節點間信息傳遞能力的基礎參數之一。試驗組腦網絡的
被認為是測量腦網絡節點的有效性、完整性以及節點間信息傳遞能力的基礎參數之一。試驗組腦網絡的
 與 λ 明顯變長,主要是因為受疾病影響,患兒的大腦受損傷,導致其中部分負責傳輸信息的神經纖維束被破壞,所以與對照組相比,試驗組的神經纖維束的數量將出現明顯減少的現象,這與以往腦性癱瘓患兒的腦研究結果相符合。從這些腦網絡參數異常可以推測:受影響的腦區間的連接強度會變弱或者連接長度變長,甚至有些異常腦區出現了“失連接”的現象。
與 λ 明顯變長,主要是因為受疾病影響,患兒的大腦受損傷,導致其中部分負責傳輸信息的神經纖維束被破壞,所以與對照組相比,試驗組的神經纖維束的數量將出現明顯減少的現象,這與以往腦性癱瘓患兒的腦研究結果相符合。從這些腦網絡參數異常可以推測:受影響的腦區間的連接強度會變弱或者連接長度變長,甚至有些異常腦區出現了“失連接”的現象。
γ 是衡量局部節點間連接密集性的參數,試驗組腦網絡的 γ 變小,研究推測是因為部分異常腦區的“失連接”導致腦網絡功能受損,大腦失去了的部分正常連接集群,導致局部節點的連接密集性下降。如果腦網絡受損的范圍較大,節點“失連接”的現象越嚴重,γ 也將下降得更多。
人類腦網絡各個節點間存在動態平衡,當試驗組腦網絡的
 和 γ 發生改變后,其腦網絡的 Eg 和 Eloc 也會出現異常。研究表明當試驗組的腦網絡由于疾病影響而使節點受損,最終導致網絡的 Eg 和 Eloc 下降,節點間的信息傳輸效率將相應下降,腦網絡功能也會受影響,這些異常與腦性癱瘓患兒在臨床上的腦功能受損情況是相符的。
和 γ 發生改變后,其腦網絡的 Eg 和 Eloc 也會出現異常。研究表明當試驗組的腦網絡由于疾病影響而使節點受損,最終導致網絡的 Eg 和 Eloc 下降,節點間的信息傳輸效率將相應下降,腦網絡功能也會受影響,這些異常與腦性癱瘓患兒在臨床上的腦功能受損情況是相符的。
3.2 試驗組的腦網絡節點效率異常
腦性癱瘓患兒的既往研究通過分析病變腦白質體積變化和各病變皮層的 FA 值異常等現象發現[3-10],由于額葉、顳葉、枕葉和頂葉等部位出現病變而導致了患兒相關的腦功能受損,嚴重的甚至可能造成偏癱。神經影像學研究表明,額葉負責大腦的執行能力,比如注意力控制、認知學習、設立目標和信息整理[23]。患兒的額葉發生病變,可能出現認知能力下降、自主運動控制能力下降等臨床表現[24]。顳葉負責長期記憶和聽覺功能,它受到損傷可能導致患兒的聽覺和記憶出現障礙。枕葉部分包含視覺皮層,而體感皮層位于頂葉,枕葉和頂葉受損可能導致患兒出現視覺障礙[25]。
我們通過分析兩組受試者的節點屬性,發現試驗組的腦網絡的部分節點的 ei 出現明顯下降的情況,如圖 3 所示。這些異常節點主要分布在顳葉(比如 HES、STG.L)、枕葉(比如 SOG、MOG.L)、頂葉(比如 IPL.R、PoCG.R、SPG)、島葉(比如 INS.R)和基底核(CAU.R、PUT、PAL.R)。本次研究首次通過計算和比較兩組受試者的節點效率的組間差異,獲得與以往研究相符的結果[7-8, 23-25],而且對于試驗組腦網絡的節點分析能精確到大腦皮層的具體腦區位置。不僅如此,節點效率還能客觀量化異常腦區的病變程度,相比較于傳統研究方法更加精確。
本次研究的結論說明了將腦網絡作為新的研究方法用于分析腦性癱瘓患兒的腦白質病變狀況是可行的。在下階段的研究中,我們認為可以將腦網絡的異常與患兒的大腦執行能力、肢體控制能力和視聽覺能力障礙等相聯系,進一步分析該疾病對患兒腦功能的影響,這將有助于我們進一步加深對于腦性癱瘓疾病的理解。
引言
腦性癱瘓是最常見的兒童慢性運動障礙疾病,它是指發育中的胎兒或剛出生的嬰兒因各種干擾而導致的非進行性腦損傷,通常是因為腦白質中出現彌漫性損傷或者局灶性病變,而當這些損傷或病變發生在腦室的周圍區域時最為嚴重。它引發的神經學缺陷癥狀與患兒大腦結構損傷的位置以及嚴重程度有關,主要表現為運動障礙,常常伴隨認知行為障礙、語言交流能力下降、癲癇等癥狀[1]。如今早產兒存活率的上升也提高了腦性癱瘓的患病率,每 1 000 個兒童中大約有 2~3 個腦性癱瘓的患兒[2],這些患兒及其家庭將遭遇到難以估量的健康、心理和經濟等問題。所以,針對腦性癱瘓這一疾病,最重要的是合理適當地采取防止其發生、降低患病率、改善患者病情等一系列措施。
目前腦性癱瘓的診斷主要是通過醫學影像技術做神經學評估[1],比如腦部的電子計算機斷層掃描(computed tomography,CT)、顱腦超聲、核磁共振 T1 加權圖像、T2 加權圖像等。然而這些腦部結構成像并不能精確反映腦性癱瘓患兒的受損腦區與臨床腦功能障礙之間的聯系。當白質損傷的面積較大時,在腦部結構成像中才容易被觀察到,而在腦性癱瘓患兒的大腦中,同等嚴重的腦功能損傷反映在腦部結構成像中可能只是很小的腦白質病變區域,甚至可能沒有明顯的神經影像結果[2],此時常規的腦部結構成像并不利于兒童腦性癱瘓的診斷。所以目前迫切需要一個新的工具來更好地衡量腦性癱瘓患兒腦結構異常與臨床腦功能障礙之間的關系。
彌散張量成像(diffusion tensor imaging,DTI)是一種研究腦白質結構變化的非侵入式醫學成像技術,雖然相關研究已經能將 DTI 用于探索腦性癱瘓患者的腦白質異常與認知行為功能缺陷之間的聯系,并指出解剖結構上腦白質變化和感覺運動區域的功能障礙之間存在一定的相關性,但是既往研究只是測量和比較感覺運動腦區的各向異性值(fraction anisotropy,FA)[3-6],部分研究會進一步利用腦白質神經纖維束追蹤方法來比較大腦神經纖維束數量的變化[7-10]。盡管這兩個方法能偵測到異常腦區,但是 FA 值與神經束數量并不能直接反映疾病狀態下大腦各個腦區之間的連通情況。
2005 年,Sporns 等[11]提出構建“人腦連接組”(human connectome)的設想,并且認為可以通過構建人腦網絡來探究人腦工作原理,甚至從腦網絡角度研究各種腦部神經疾病。近些年來,腦網絡作為一種新的腦認知功能測量工具正廣泛應用于多種腦疾病研究中,已經發現多種神經疾病與個體腦網絡的異常存在著相關性,比如抑郁癥[12]、阿爾茨海默病[13-14]、輕度認知障礙等[15]。因此,基于 DTI 圖像數據構建并分析腦性癱瘓患兒的結構腦網絡,能夠將患兒的腦功能進行量化,獲得各個腦區之間的連接關系,推測異常腦區的變化等。然而,目前仍少有研究者使用結構腦網絡來分析腦性癱瘓患兒的全腦異常,研究患兒的腦白質網絡的結構差異和病變程度,為診斷腦性癱瘓患兒提供神經病理學依據。
因此,本研究基于 DTI 圖像數據構建腦性癱瘓患兒(試驗組)與正常嬰兒(對照組)的結構腦網絡,然后從全腦以及局部腦區這兩個角度,計算腦網絡的拓撲屬性差異和局部節點特征差異,推測患兒的認知、運動、語言功能的異常。本研究旨在論證結構腦網絡作為一種新的研究工具用于衡量腦性癱瘓患兒大腦結構變化的可行性,以期在未來的研究中,結構腦網絡可能用于檢測和評估腦性癱瘓病情,并有助于病情診斷和選擇最佳治療方案。
1 數據與方法
1.1 數據采集
本研究使用的 DTI 圖像數據來自于復旦大學附屬兒童醫院,包括試驗組:15 名被確診為腦性癱瘓的嬰兒,其中男嬰 7 名,女嬰 8 名;對照組:30 名正常健康的嬰兒,其中男嬰 17 名,女嬰 13 名。所有受試嬰兒的年齡都是三個月。試驗組為經過醫生對腦部圖像檢查、體格檢查及輔助檢查后確診為腦性癱瘓的患兒;對照組是隨機篩選的體格匹配的正常健康嬰兒。
本研究使用的 DTI 圖像數據是由磁共振成像設備 MAGNETOM Avanto(1.5 T,西門子公司/德國)采用回波平面成像序列(Echo-planar imaging,EPI)采集獲得,DTI 圖像由 20 個彌散敏感系數 b 值為 1 000 s/mm2 的加權圖像和 1 個 b 值為 0 的無加權圖像(b0 圖像)組成。具體掃描參數為:重復時間(repetition time,TR)為 3 400 ms,回波時間(echo time,TE)為 89 ms,成像矩陣為 128×104,層厚為 4 mm。
1.2 腦網絡構建方法
腦網絡最基本和最關鍵的兩個組成元素是節點和邊:節點代表了大腦的各個腦區,邊則能反映各個腦區之間的聯系。本研究關于節點和邊的定義方法與相關文獻[12-15]類似,采用下述步驟完成定義。
1.2.1 節點定義 為了定義節點,本研究采用了自動解剖標記模板(automated anatomical labeling 90 atlas,AAL 90),將大腦定義為 90 個腦區,每一個腦區都代表腦網絡中的一個節點。首先使用腦部磁共振圖像綜合分析軟件 FSL 5.0(Oxford,英國)的線性配準算法(FMRIB’s linear image registration tool,FLIRT)與非線性配準算法(FMRIB’s non-linear image registration tool,FNIRT)相結合的方法,將每個受試者的 b0 圖像配準到蒙特利爾標準空間(Montreal Neurological Institute space,MNI)的 MNI 152 模板。再將得到的配準變換矩陣取逆后應用于 AAL 90 模板,使 MNI 空間的 AAL 90 模板逆變換到每個受試者的始空間(native space),最終讓 AAL 90 模板配準到 b0 圖像。節點定義中的所有圖像處理工作,包括圖像預處理中的“腦實質提取”、“渦流校正”以及圖像配準,都是使用開源 FSL 5.0 軟件包完成的。
1.2.2 邊定義 為了定義腦網絡中連接節點的邊,本研究在每個受試者的原始空間里重建出全腦的白質纖維束。白質纖維束重建工作主要是采用目前腦網絡研究中廣泛使用的確定性纖維束追蹤算法(fiber assignment by continuous tracking,FACT),以每一個體素為種子點,追蹤的條件為 FA 大于 0.2 以及纖維束追蹤過程兩個連接的轉角小于 60°[14]。由于 FACT 算法易受圖像的分辨率和噪聲影響,重建結果中容易包含偽連接。針對這個問題,本研究將當兩腦區之間的纖維束連接數目大于 3 時視為存在連接[16]。最后以 FA 和纖維束數目(fiber number,FN)為權重,構建出 FA 加權網絡和 FN 加權網絡。構建加權網絡的優點在于能重點反映受試者大腦的特定屬性,比如 FA 加權網絡側重反映了白質纖維束的完整性和導通性,而 FN 網絡則側重反映了白質纖維束的密度[16]。邊的定義工作主要是在矩陣實驗室 MATLAB 2012(MathWorks Inc.,美國)平臺上使用開源腦結構連接組分析軟件 PANDA 1.3.1(北京師范大學,中國)完成的,主要包括計算 FA 值、白質纖維束重建、加權網絡的構建。
1.3 網絡屬性分析
本研究主要使用圖論計算了兩種加權腦網絡(FA 加權網絡、FN 加權網絡)的拓撲參數,既往研究常用它們來確定腦網絡的特征屬性[17]。各參數均在 MATLAB 2012 平臺上使用開源圖論網絡分析軟件包 GRETNA 1.2(北京師范大學,中國)計算。
1.3.1 網絡參數 本研究主要計算了兩種加權腦網絡(FA 加權網絡、FN 加權網絡)的“小世界”特征參數,既往研究常用它們來確定腦網絡的特征屬性[17]。其中聚類系數(clustering coefficient,CC)(以符號
 表示)被定義為節點與周圍節點相連接的概率,反映了腦網絡局部區域的內部連接情況,它的表達式如下:
表示)被定義為節點與周圍節點相連接的概率,反映了腦網絡局部區域的內部連接情況,它的表達式如下:
 |
其中 Ei 表示網絡連接的邊的總數量,Ki 表示節點 i 連接的邊數。如果
 ,那么 Ki=0 或 Ki=1,說明該點是孤立點。
,那么 Ki=0 或 Ki=1,說明該點是孤立點。
最短路徑長度(shortest path length,SPL)(以符號
 表示)在腦網絡的信息傳遞與交流中扮演著重要角色,可以形象比喻成點與點之間的最佳路徑的平均長度,反映腦區間信息傳播的能力,它被定義為:
表示)在腦網絡的信息傳遞與交流中扮演著重要角色,可以形象比喻成點與點之間的最佳路徑的平均長度,反映腦區間信息傳播的能力,它被定義為:
 |
其中 N 為網絡中的節點數,G 代表腦網絡矩陣,dij 為節點 i 與節點 j 之間的距離。
為了計算“小世界”屬性 σ,本研究選取了 100 個匹配的隨機網絡(與真實網絡相同數量的節點、邊和度的分布)[14],計算隨機網絡的聚類系數 CCW-random 和最短路徑長度
 。最后我們計算出標準化聚類系數,
。最后我們計算出標準化聚類系數,
 ,以及標準化最短路徑長度,
,以及標準化最短路徑長度,
 。
。
“小世界”網絡具有與規則網絡類似的較高的聚類特性[17],又具有與隨機網絡類似的較短的
 ,即是
,即是
 且
且
 ,確保了“小世界”網絡在局部和全局水平上信息傳輸與交流的高效性。所以小世界屬性可以用
,確保了“小世界”網絡在局部和全局水平上信息傳輸與交流的高效性。所以小世界屬性可以用
 來衡量,
來衡量,
 。
。
由于
 是在全局連通的基礎上定義的,然而網絡中可能有部分點存在“失連接”的狀態,所以針對部分節點“失連接”的情況,以往研究給出全局效率(global efficiency,GE)(以符號 Eg 表示)的定義[17]:
是在全局連通的基礎上定義的,然而網絡中可能有部分點存在“失連接”的狀態,所以針對部分節點“失連接”的情況,以往研究給出全局效率(global efficiency,GE)(以符號 Eg 表示)的定義[17]:
 |
其中 Eg 的值越大,表示信息在這個網絡上進行交換所付的代價越小,相對的信息傳送和處理效率越高。
同樣,聚類系數也是基于全局連通的參數,針對部分節點“失連接”的情況,采用局部效率(local efficiency,LE)(以符號 Eloc 表示)這一參數,它的定義為:
 |
其中 Eloc 的值越大,說明網絡的局部效率越高,區域的節點信息交流能力越高。
1.3.2 節點效率 為了確定腦網絡結構的節點特征,本研究計算了節點的效率(nodal efficient,NE)(以符號 ei 表示),以此來衡量各個節點的連接以及信息傳輸效率[17],評估各個節點在大腦中的作用、地位以及疾病對各個節點的影響。
節點 i 的效率 ei 被定義為:
 |
節點效率 ei 測量了節點 i 與網絡中的其余節點之間的信息傳播能力。
1.4 統計分析
為了分析比較試驗組和對照組的網絡參數:聚類系數 CCW,最短路徑
 ,標準聚類系數 γ,標準最短路徑 λ,全局效率 Eg 和局部效率 Eloc 以及節點效率 ei,本研究采用獨立樣本 t 檢驗計算組間差異,其中 P<0.05 說明組間的差異具有統計學意義,使用柯爾莫諾夫-斯米爾諾夫檢驗(Kolmogorov-Smirnov test)用來檢驗連續變量是否符合正態分布以滿足t 檢驗要求。數據分析工作主要是使用 MATLAB 2012 的統計工具箱函數完成。
,標準聚類系數 γ,標準最短路徑 λ,全局效率 Eg 和局部效率 Eloc 以及節點效率 ei,本研究采用獨立樣本 t 檢驗計算組間差異,其中 P<0.05 說明組間的差異具有統計學意義,使用柯爾莫諾夫-斯米爾諾夫檢驗(Kolmogorov-Smirnov test)用來檢驗連續變量是否符合正態分布以滿足t 檢驗要求。數據分析工作主要是使用 MATLAB 2012 的統計工具箱函數完成。
2 實驗結果
2.1 人口學統計結果
既往研究已經報道了性別和年齡將對腦網絡產生較大的影響[18-20],為了排除性別和年齡對結果的影響,首先采用卡方檢驗檢查試驗組和對照組的性別差異,結果發現兩組受試患兒的性別差異不具有統計學意義(P=0.361)。而兩組受試患兒的年齡都是三個月,所以不存在年齡差異。
2.2 “小世界”屬性
以往研究顯示可以用“小世界”模型來表征腦網絡[12-16, 18-20],通過計算兩個受試者組以及與之相匹配的隨機網絡的 CCW-random 和
 ,發現這兩個受試者組的 γ 遠大于隨機網絡(γ試驗組=4.889±1.841,γ對照組=3.918±1.126),而λ 與隨機網絡很相近(λ試驗組=1.200±0.149,λ對照組=1.108±0.045)。所以兩個受試者組的“小世界”屬性(σ試驗組=4.037±1.328,σ對照組=3.521±0.942)都明顯大于 1。這一結果說明腦性癱瘓患兒與健康嬰兒的腦網絡都具有“小世界”網絡屬性。
,發現這兩個受試者組的 γ 遠大于隨機網絡(γ試驗組=4.889±1.841,γ對照組=3.918±1.126),而λ 與隨機網絡很相近(λ試驗組=1.200±0.149,λ對照組=1.108±0.045)。所以兩個受試者組的“小世界”屬性(σ試驗組=4.037±1.328,σ對照組=3.521±0.942)都明顯大于 1。這一結果說明腦性癱瘓患兒與健康嬰兒的腦網絡都具有“小世界”網絡屬性。
2.3 試驗組腦網絡拓撲屬性的異常
對兩組受試者的網絡參數進行 t 檢驗,結果發現與對照組相比,試驗組的腦網絡的 CCW 和 σ(PCC=0.284 和 Pσ=0.139,P 值都大于 0.05)不存在具有統計學意義的差異。而
 (t=2.200,P=0.033)和 λ(t=3.107,P=0.003)都明顯變大,γ(t=–1.970,P=0.034)明顯變小。并且 Eg(t=–2.175,P=0.035)和 Eloc(t=–2.284,P=0.027)也都出現明顯下降的現象。
(t=2.200,P=0.033)和 λ(t=3.107,P=0.003)都明顯變大,γ(t=–1.970,P=0.034)明顯變小。并且 Eg(t=–2.175,P=0.035)和 Eloc(t=–2.284,P=0.027)也都出現明顯下降的現象。
基于以上的結果可以看出,與正常嬰兒的腦網絡比較,腦性癱瘓患兒的拓撲結構出現了巨大的變化,可能由于疾病影響導致腦網絡結構受損,腦網絡的效率也出現下降的趨勢,這將造成患兒腦網絡的信息傳輸和處理能力下降[13-15]。
2.4 節點特征
2.4.1 核心節點的差異 對于腦網絡中的節點屬性,本研究通過計算節點效率 ei 來衡量腦網絡各個節點的效率。由于大腦需要高效率處理各種信息,所以腦網絡中會形成一些特殊的節點——核心節點(hub),這些節點往往具有較高的信息傳輸效率和信息處理效率,與周圍的其他節點緊密關連[21]。本研究中將那些比所有節點的平均節點效率高出一個標準差的節點定義為核心節點[14]。
在對照組中,發現 13 個核心節點,主要包括了 7 個節點位于關聯皮層區(association cortex region)、1 個位于原發性皮質區(primary cortex region)、2 個位于皮質下區(subcortical regions)以及 3 個位于邊緣皮質區(paralimbic cortex regions),如圖 1 所示。然而在試驗組中,只存在 10 個核心節點,包括 5 個位于關聯皮層區、2 個位于原發性皮質區以及 3 個位于邊緣皮質區,如圖 2 所示。在圖 1 和圖 2 中,代表節點的小球的體積越大說明該節點效率越高,反之越低。通過比較兩組核心節點,我們發現試驗組與對照組存在 4 個共同的核心節點,分別是左腦的楔葉(cuneus,CUN)、左右腦的楔前葉(precuneus,PCUN)以及左腦扣帶回后部(posterior cingulate gyrus,PCG)。本次研究發現,無論是試驗組還是對照組,腦網絡中最重要的核心節點均是左腦扣帶回后部。以往研究顯示成年人腦網絡最重要的核心節點是扣帶回后部以及楔前葉[19, 22],與本次研究結果存在一定的相似點與差異點,主要是因為本次受試者組都是三個月大的嬰兒,而人類的大腦在不同的年齡階段存在一定的差異。
 圖1
對照組的核心節點
Figure1.
Control group hubs
圖1
對照組的核心節點
Figure1.
Control group hubs
 圖2
試驗組的核心節點
Figure2.
Cerebral palsy group hubs
圖2
試驗組的核心節點
Figure2.
Cerebral palsy group hubs
2.4.2 試驗組的節點效率異常 本次研究進一步計算和比較了兩組受試者的腦網絡的節點效率 ei。我們發現,與對照組相比,試驗組的右腦中央前回(right precentral gyrus,PoCG.R)、中央后回(superior parietal gyrus,SPG)、右腦島葉(right insula,INS.R)、顳橫回(heschl gyrus,HES)、左腦顳上回(left superior temporal gyrus,STG.L)、枕上回(superior occipital gyrus,SOG)、左腦枕中回(left middle occipital gyrus,MOG.L)、右腦中央后回上部(right inferior parietal,IPL.R)、右腦尾狀核(right caudate nucleus,CAU.R)、殼核(lenticular nucleus putamen,PUT)和右腦蒼白球(right lenticular nucleus pallidum,PAL.R)這些腦區的節點效率出現明顯下降的現象(P<0.05),這將導致試驗組的腦網絡的相應節點信息傳輸和處理效率降低,如圖 3 所示,其中紅色節點代表節點效率正常的節點,藍色節點代表節點效率明顯降低的節點,而邊的粗細代表連接的強弱。
 圖3
試驗組腦網絡的異常節點效率
Figure3.
Abnormal nodal efficiency in brain network of test group
圖3
試驗組腦網絡的異常節點效率
Figure3.
Abnormal nodal efficiency in brain network of test group
3 討論與總結
通過計算和比較兩組受試者的網絡參數及節點屬性,我們發現:① 兩組受試者的腦網絡都呈現“小世界”模型,但由于疾病的影響,試驗組的腦網絡的拓撲屬性出現異常;② 試驗組的腦網絡的節點屬性也發生了改變,與對照組對比,其中核心節點數量變少且位置變更,部分節點的節點效率也有明顯變小的趨勢。
3.1 試驗組腦網絡的網絡參數異常
本次研究發現兩組受試者的腦網絡都呈現“小世界”拓撲結構,這跟以往關于人類腦網絡相關研究報道的結果相符合[12-15, 18-22]。然而,盡管試驗組的腦網絡具有“小世界”屬性,但是部分網絡參數已經發生明顯變化,其中
 和 λ 明顯變大,γ 明顯變小,而 Eg 和 Eloc 出現明顯下降的現象。
和 λ 明顯變大,γ 明顯變小,而 Eg 和 Eloc 出現明顯下降的現象。
 被認為是測量腦網絡節點的有效性、完整性以及節點間信息傳遞能力的基礎參數之一。試驗組腦網絡的
被認為是測量腦網絡節點的有效性、完整性以及節點間信息傳遞能力的基礎參數之一。試驗組腦網絡的
 與 λ 明顯變長,主要是因為受疾病影響,患兒的大腦受損傷,導致其中部分負責傳輸信息的神經纖維束被破壞,所以與對照組相比,試驗組的神經纖維束的數量將出現明顯減少的現象,這與以往腦性癱瘓患兒的腦研究結果相符合。從這些腦網絡參數異常可以推測:受影響的腦區間的連接強度會變弱或者連接長度變長,甚至有些異常腦區出現了“失連接”的現象。
與 λ 明顯變長,主要是因為受疾病影響,患兒的大腦受損傷,導致其中部分負責傳輸信息的神經纖維束被破壞,所以與對照組相比,試驗組的神經纖維束的數量將出現明顯減少的現象,這與以往腦性癱瘓患兒的腦研究結果相符合。從這些腦網絡參數異常可以推測:受影響的腦區間的連接強度會變弱或者連接長度變長,甚至有些異常腦區出現了“失連接”的現象。
γ 是衡量局部節點間連接密集性的參數,試驗組腦網絡的 γ 變小,研究推測是因為部分異常腦區的“失連接”導致腦網絡功能受損,大腦失去了的部分正常連接集群,導致局部節點的連接密集性下降。如果腦網絡受損的范圍較大,節點“失連接”的現象越嚴重,γ 也將下降得更多。
人類腦網絡各個節點間存在動態平衡,當試驗組腦網絡的
 和 γ 發生改變后,其腦網絡的 Eg 和 Eloc 也會出現異常。研究表明當試驗組的腦網絡由于疾病影響而使節點受損,最終導致網絡的 Eg 和 Eloc 下降,節點間的信息傳輸效率將相應下降,腦網絡功能也會受影響,這些異常與腦性癱瘓患兒在臨床上的腦功能受損情況是相符的。
和 γ 發生改變后,其腦網絡的 Eg 和 Eloc 也會出現異常。研究表明當試驗組的腦網絡由于疾病影響而使節點受損,最終導致網絡的 Eg 和 Eloc 下降,節點間的信息傳輸效率將相應下降,腦網絡功能也會受影響,這些異常與腦性癱瘓患兒在臨床上的腦功能受損情況是相符的。
3.2 試驗組的腦網絡節點效率異常
腦性癱瘓患兒的既往研究通過分析病變腦白質體積變化和各病變皮層的 FA 值異常等現象發現[3-10],由于額葉、顳葉、枕葉和頂葉等部位出現病變而導致了患兒相關的腦功能受損,嚴重的甚至可能造成偏癱。神經影像學研究表明,額葉負責大腦的執行能力,比如注意力控制、認知學習、設立目標和信息整理[23]。患兒的額葉發生病變,可能出現認知能力下降、自主運動控制能力下降等臨床表現[24]。顳葉負責長期記憶和聽覺功能,它受到損傷可能導致患兒的聽覺和記憶出現障礙。枕葉部分包含視覺皮層,而體感皮層位于頂葉,枕葉和頂葉受損可能導致患兒出現視覺障礙[25]。
我們通過分析兩組受試者的節點屬性,發現試驗組的腦網絡的部分節點的 ei 出現明顯下降的情況,如圖 3 所示。這些異常節點主要分布在顳葉(比如 HES、STG.L)、枕葉(比如 SOG、MOG.L)、頂葉(比如 IPL.R、PoCG.R、SPG)、島葉(比如 INS.R)和基底核(CAU.R、PUT、PAL.R)。本次研究首次通過計算和比較兩組受試者的節點效率的組間差異,獲得與以往研究相符的結果[7-8, 23-25],而且對于試驗組腦網絡的節點分析能精確到大腦皮層的具體腦區位置。不僅如此,節點效率還能客觀量化異常腦區的病變程度,相比較于傳統研究方法更加精確。
本次研究的結論說明了將腦網絡作為新的研究方法用于分析腦性癱瘓患兒的腦白質病變狀況是可行的。在下階段的研究中,我們認為可以將腦網絡的異常與患兒的大腦執行能力、肢體控制能力和視聽覺能力障礙等相聯系,進一步分析該疾病對患兒腦功能的影響,這將有助于我們進一步加深對于腦性癱瘓疾病的理解。