規律性短重復回文序列簇(CRISPR)和 CRISPR 輔助蛋白 9(Cas9)構成的 CRISPR/Cas9 基因編輯技術快速推進了基因修飾豬作為醫學研究模式動物的廣泛應用。而高效的靶基因單鏈向導 RNA(sgRNA)是利用 CRISPR/Cas9 技術進行基因編輯成功的關鍵,對于豬等繁殖周期較長的大動物,則需要在實施動物實驗前,在體外篩選出高效的 sgRNA 以避免時間和資源成本浪費。另外,如何高效獲得陽性基因編輯單克隆細胞是目前尚待解決的難題。本研究建立了靶向豬基因組的 sgRNA 快速篩選方法,利用熒光載體富集基因編輯細胞,同時探索利用圖案微陣列培養技術快速獲得單克隆細胞的方法,在此基礎上高效獲得延胡索酰乙酰乙酸酶(Fah)基因編輯細胞,為后續生產作為人類肝細胞生物反應器的Fah基因敲除豬奠定基礎。
引用本文: 高孟雨, 朱星龍, 王詩盛, 張炳琪, 張蕓琳, 何宇婷, 周燕燕, 李順, 楊光, 廖光能, 包驥, 步宏. 靶向豬基因組單鏈向導RNA快速篩選以及利用圖案微陣列收獲單克隆細胞的研究. 生物醫學工程學雜志, 2021, 38(1): 111-121. doi: 10.7507/1001-5515.202006032 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
目前,規律性短重復回文序列簇(clustered regularly interspersed short palindromic repeat,CRISPR)和 CRISPR 輔助蛋白 9(CRISPR-associated 9,Cas9)構成的 CRISPR/Cas9 已經廣泛用于鼠[1-2]、兔[3]、豬[4]、猴[5-6]等多種動物的研究,研究領域包括基因功能研究、基因治療、疾病模型生產等。利用 CRISPR/Cas9 技術結合體細胞核移植(somatic cell nuclear transplantation,SCNT)獲得基因編輯豬、猴等大動物模型,是目前最常用的方法,而獲得經過基因編輯的單克隆細胞作為核移植供體是生產基因改造動物的前提[7-8]。另外,CRISPR/Cas9 技術高效發揮作用的關鍵是靶基因的單鏈向導 RNA(single guide RNA,sgRNA)篩選,由于豬繁育周期平均為 114 d,因此在實施動物實驗前,在體外通過細胞實驗篩選出高效的 sgRNA,對于快速獲得基因修飾豬是十分必要的,而且還能避免時間、資源等的浪費[9]。CRISPR/Cas9 系統發揮作用需要通用的 Cas9 核酸酶蛋白[10-11],但由于 Cas9 核酸酶蛋白基因片段較大,通常一個載體無法將 Cas9、sgRNA 以及抗性基因或熒光蛋白標簽等多個元件同時包含,導致無法對基因編輯細胞進行篩選,以至于加大了獲得基因編輯細胞的難度。另外,即使一個質粒能夠完整包裝篩選標簽,但是過大的質粒,也使細胞轉染難度隨之增大,導致轉染效率降低。
目前獲得基因編輯單克隆細胞的常用方法主要是極限稀釋法以及機械挑取法,然而這兩種方法獲得的單克隆往往混有其他細胞,無法真正獲得由一個細胞分化而來的細胞群[12-13]。并且由于機械力度的損傷,收獲的細胞通常狀態較差,并且操作時間長,單克隆收獲率低,對于需要大批量獲得單克隆細胞的實驗而言,將大大影響實驗進程[14]。若通過傳統方法獲得單基因乃至多基因編輯的單克隆細胞,則操作難度將更大。另外,即使通過極限稀釋法或者流式細胞術將一個細胞分置到一個孔中進行培養,由于缺乏細胞生長的微環境,在單個細胞的環境中,有的細胞往往也無法正常分裂增殖。
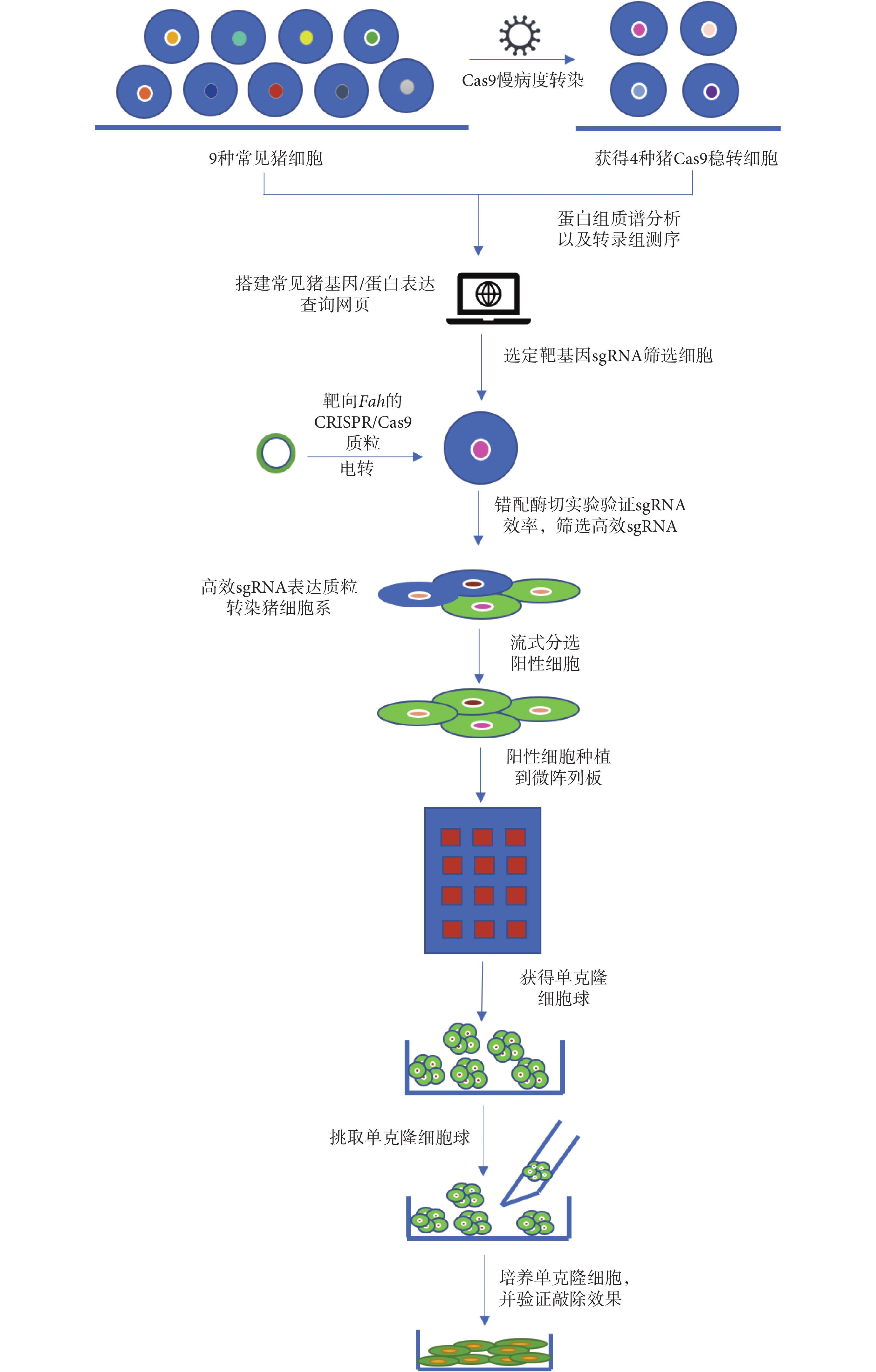
基于以上原因,本研究的目的是構建一套靶向豬基因組 sgRNA 快速篩選平臺,并利用熒光報告載體,建立一種可以富集基因突變細胞的策略,同時利用圖案微陣列技術探索一種快速、對細胞損傷較小的單克隆細胞獲得方式,并以延胡索酰乙酰乙酸酶(fumarylacetoacetate hydrolase,Fah)基因(簡稱:Fah基因)敲除為例,以期實現高效快速地獲得Fah基因敲除細胞。本研究流程圖如圖 1 所示。
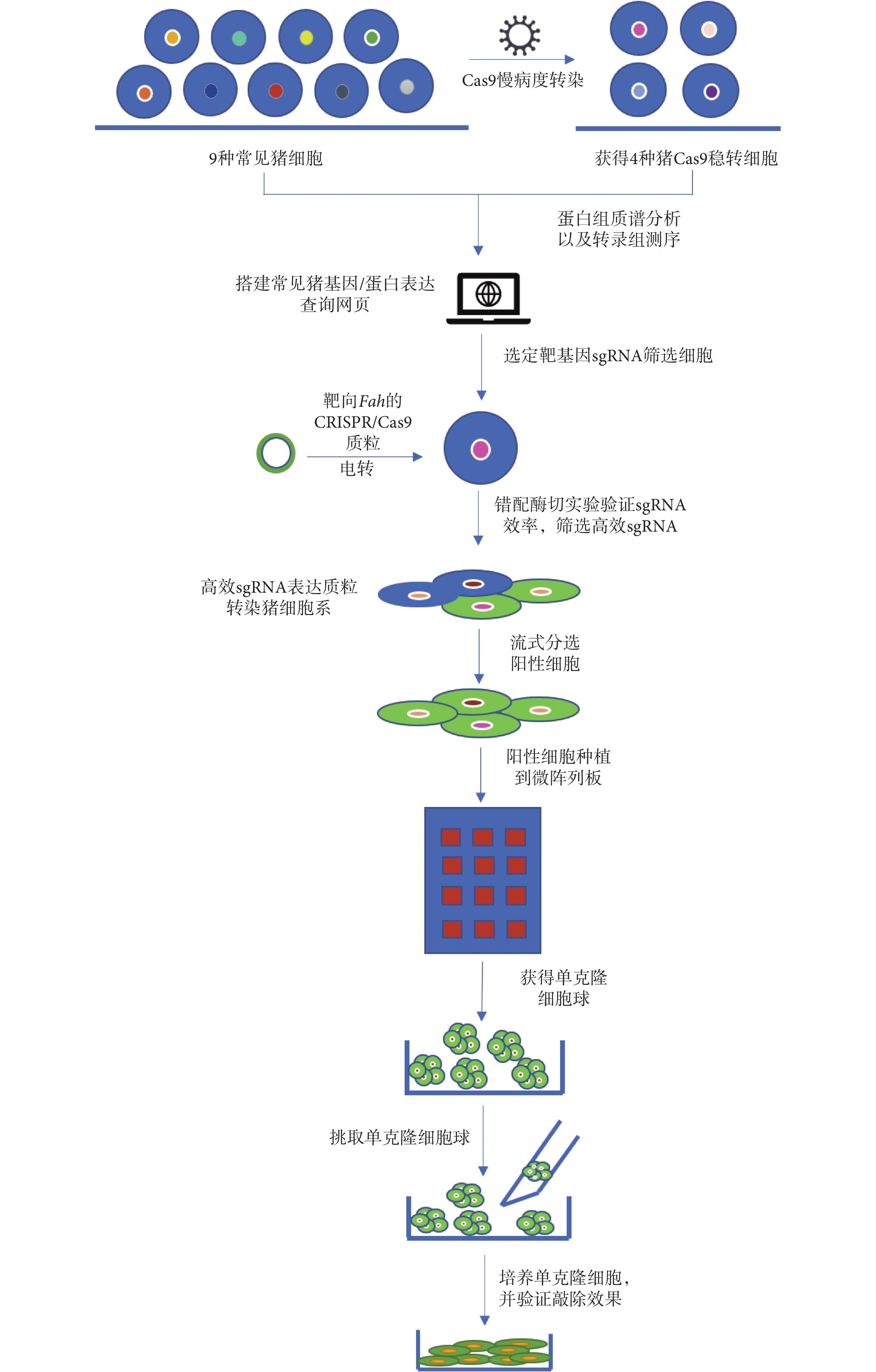 圖1
高效獲得豬基因編輯單克隆細胞實驗流程圖
Figure1.
Flow chart of experiments for efficient acquisition of pig gene-edited monoclonal cells
圖1
高效獲得豬基因編輯單克隆細胞實驗流程圖
Figure1.
Flow chart of experiments for efficient acquisition of pig gene-edited monoclonal cells
1 材料和方法
1.1 實驗材料與試劑
實驗中所使用的細胞株包括:家豬皮膚細胞(domestic pig skin cells,SSC-S1),小香豬皮膚細胞(small pig skin cells,SSC-S2),小耳豬腎細胞(small ear pig kidney cells,SEPfk),小耳豬肺細胞(small ear pig-lung cells 1,SEP-L1)以及豬腎上皮細胞(porcine kidney epithelial cells,PK15)來于中國科學院昆明動物所;豬髖動脈內皮細胞(porcine hip arteries endothelial cells,PIEC)來自于中科院上海細胞庫;小型豬腎細胞(mini pig kidney epithelial cells,MPK),來自于中國食品藥品檢定研究院;豬睪丸細胞(porcine testicular cell,ST),豬腎傳代細胞(porcine kidney cells-2,IBRS-2)來自于中國典型培養物保藏中心細胞庫,總計 9 種細胞。sgRNA 骨架表達載體 pHBLV-U6-MCS-CMV-ZsCreen,購自中國漢恒生物公司;Cas9 慢病毒購自中國漢恒生物公司。兔抗 Cas9 抗體購自美國 Abcam 公司;T4 多聚核苷酸激酶、快速連接試劑盒均購自美國 NEW ENGLAND BioLabs 公司;無內毒素小提中量試劑盒購自中國天根生化科技有限公司;磷酸鹽緩沖液(phosphate buffered saline,PBS)、DMEM 高糖培養基、RPMI 1640 培養基、MEM 培養基、胎牛血清(fetal bovine serum,FBS)購自美國 Gibco 公司;兔抗人、鼠 Fah 抗體購自中國 BIOSS 公司;用于細胞測序的 T 克隆載體 pClone007 試劑盒購自中國擎科生物公司。
1.2 構建豬 Cas9 穩定表達細胞株
用 MEM 培養基+10%FBS 培養 IBRS-2、ST 細胞;用 DMEM 高糖培養基+10 % FBS 培養 PK15、MPK、SSC-S2、SEPfk、SEP-L1、SSC-S1 細胞;用 RPMI 1640 培養基+10 % FBS 培養 PIEC 細胞。隨后將生長狀態良好的細胞制成細胞懸液,并以 1 × 105 個/孔的細胞密度接種到 24 孔板中。待目的細胞達到約 30%~50%融合密度時加入 Cas9 慢病毒。Cas9 慢病毒滴度為:108 TU/mL;PIEC、ST、IBRS-2、PK15 細胞的最適感染復數(multiplicity of infection,MOI)為:30;SEPfk、SEP-L1、SSC-S1 細胞的最適 MOI 值為:20。病毒感染細胞 72 h 后,在培養液中加入嘌呤霉素,進行抗性篩選并獲得 Cas9 穩定表達細胞株。PIEC 細胞篩選濃度為 1 μg/mL,IBRS-2 細胞篩選濃度為 2.5 μg/mL;PK15 細胞篩選濃度為 2 μg/mL;ST 細胞篩選濃度為 2.5 μg/mL;SEPfk、SEP-L1、SSC-S1 細胞篩選濃度為 0.5 μg/mL。
1.3 Cas9 穩定表達細胞株免疫組織化學染色
將 2 × 105個細胞接種于底部放有玻片的 24 孔板中,進行細胞接種實驗。細胞培養過夜后,用 PBS 清洗三遍,10% 福爾馬林固定細胞 5 min,PBS 再次清洗三遍,取出細胞玻片,黏于載玻片干燥過夜,隨后使用兔抗 Cas9 抗體對細胞玻片進行常規免疫組化(immunohistochemistry,IHC)染色。
1.4 Cas9 穩轉豬細胞轉錄組測序以及蛋白質組定量分析
抽提 PIEC、PK15、IBRS-2、ST 細胞以及相對應的 Cas9 穩轉細胞的 RNA 樣品,送到華大基因公司進行細胞表達譜信息采集。提取 PIEC- Cas9,PK15- Cas9,IBRS-2-Cas9,ST- Cas9 四種穩轉細胞的蛋白送到上海易算生物公司進行蛋白質組學定量分析。將測序結果整理后,搭建常見豬基因組/蛋白表達情況查詢網頁,便于查詢以及比較不同豬細胞的基因以及蛋白表達量。
1.5 構建 Fah基因的 sgRNA 表達載體
合成 3 條靶向Fah基因的 sgRNA,即Fah-sgRNA1、Fah-sgRNA2、Fah-sgRNA3,其正向和反向寡核苷酸序列分別如表 1 所示。將Fah-sgRNA 對應的正向和反向寡核苷酸序列進行磷酸化、退火、復性,形成具有粘性末端的雙鏈 DNA 片段。利用 BamHI、EcoRI 限制性內切酶酶切目標載體 pHBLV-U6-MCS-CMV-ZsCreen,隨后電泳分離并膠回收 pHBLV-U6-MCS-CMV-ZsCreen 線性載體。將復性得到的Fah-sgRNA 雙鏈 DNA 片段與回收得到的線性載體片段進行連接反應,然后將連接混合物轉化到大腸桿菌 DH5α 菌株。將連接正確的質粒擴增后,采用無內毒素小提中量試劑盒抽提質粒,用于細胞轉染實驗。
1.6 Fah基因的 sgRNA 表達載體轉染實驗
本實驗采用電轉儀將質粒轉入 PIEC-Cas9 靶細胞,方法如下:將生長狀態良好的細胞經胰蛋白酶消化,并用電轉液稀釋成濃度為 1 × 106~2 × 106 個/mL 的細胞懸液。將上述提取的 1 μg sgRNA 表達質粒,與約 2 × 105 個細胞混合置于 96 孔板中,按照電壓 200 V、脈寬 200 μs、間隔 1 000 ms 的條件進行電轉實驗,然后將電轉后的細胞平均三等分轉入 24 孔板中培養。
1.7 流式分析細胞感染效率以及分選陽性轉染細胞
細胞轉染 48 h 后先進行擴增培養,然后將貼壁細胞經胰酶消化,離心后用新鮮培養基重懸,將細胞懸液移至無菌的流式檢測管,檢測質粒轉染效率并分選熒光表達陽性的細胞到 24 孔板中,進一步擴增陽性細胞。
1.8 錯配酶切法檢測Fah基因敲除效果
收集部分目的細胞,抽提基因組 DNA,同時抽提野生型目的細胞的基因組 DNA。以基因組 DNA 為模板分別用聚合酶鏈式反應(polymerase chain reaction,PCR)擴增靶基因Fah序列片段。擴增靶基因片段的引物如表 2 所示。電泳檢測 PCR 產物并回收純化,將純化后的 DNA 片段分別加熱變性、復性,形成雜交 DNA 分子。用 T7 核酸內切酶 I(T7 endonuclease I,T7EI)切割復性后的雜交 DNA,檢測 sgRNA 介導的 Fah基因敲除效果。
1.9 利用圖案微陣列法快速獲得Fah基因敲除單克隆細胞以及鑒定
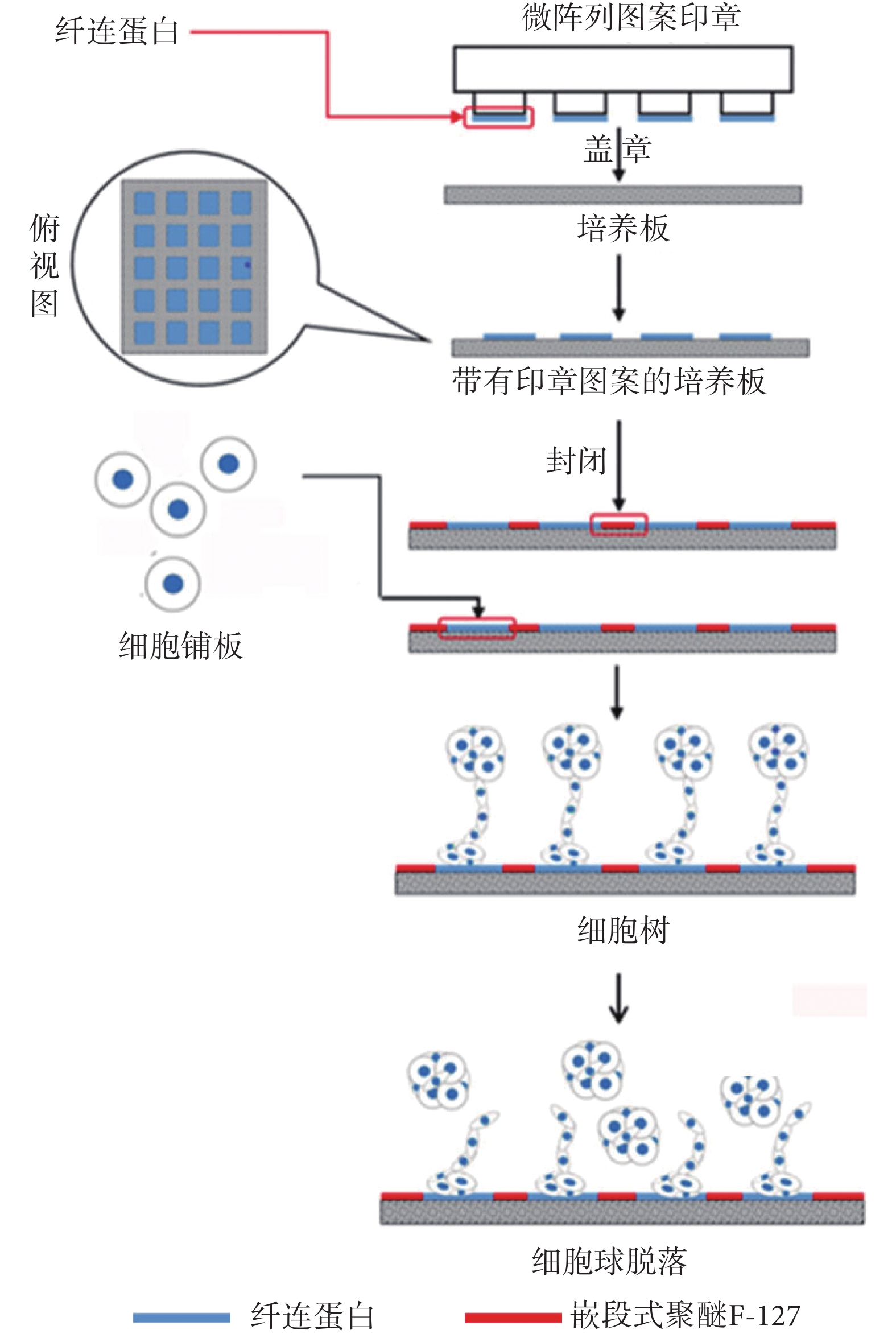
使用激光蝕刻的特定圖案硅片為模板,倒模獲得聚二甲基硅氧烷(polydimethylsiloxane,PDMS)印章,制備出具有特定微圖案的 PDMS 印章(面積為 225 μm2的矩形)。將濃度為 100 μg/mL 的纖連蛋白涂布于印章表面,室溫孵育 20 min 后洗去多余的溶液。在 37 oC 孵箱中干燥,然后將圖案印壓于細胞非黏附培養皿底部,待圖案形成后移去印章。圖案干燥后,加入 1% 嵌段式聚醚 F-127 室溫孵育 2 h,封閉剩余培養皿底部上的空間。具體制備方法如圖 2 所示。隨后將經過流式分選的 1 × 103 個細胞種植到微陣列培養皿中連續監測細胞生長,并挑取單克隆細胞球。
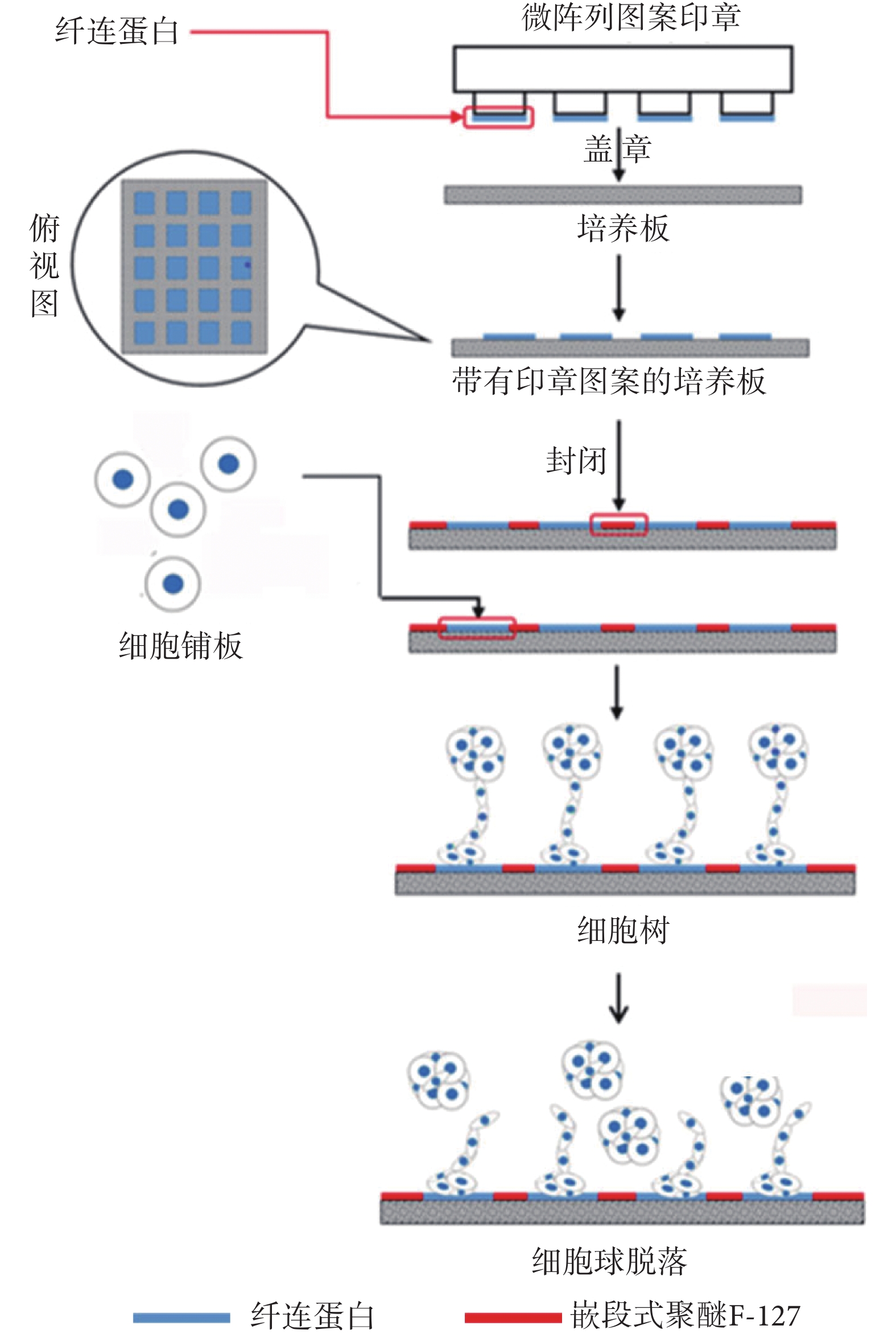 圖2
圖案微陣列印章法獲得單克隆細胞流程
Figure2.
The process of obtaining monoclonal by microarray seal
圖2
圖案微陣列印章法獲得單克隆細胞流程
Figure2.
The process of obtaining monoclonal by microarray seal
1.10 T 載體測序鑒定單克隆細胞Fah基因敲除情況
收集待檢測的單克隆細胞,抽提基因組。PCR 擴增單克隆細胞的Fah基因片段,使用膠回收試劑盒切膠回收Fah目的片段,利用 pClone007 試劑盒將Fah PCR 產物連接到 T 載體。為了分析每個單細胞克隆的正義鏈以及反義鏈的突變情況,對每個單克隆細胞進行 6 個 T 載體的克隆測序,以確保單克隆的純度。
1.11 Fah基因敲除細胞免疫熒光染色以及 IHC 染色
在 24 孔板底部放入玻片,將 2 × 105個細胞接種于 24 孔板,細胞培養過夜。使用 10% 福爾馬林固定細胞 5 min,用 PBS 清洗三遍,隨后取出細胞玻片,黏于載玻片上干燥過夜。使用兔抗人、鼠 Fah 抗體進行常規 IHC 以及免疫熒光(immunofluorescence,IF)染色。
2 結果
2.1 利用慢病毒載體構建豬 Cas9 穩定表達細胞株
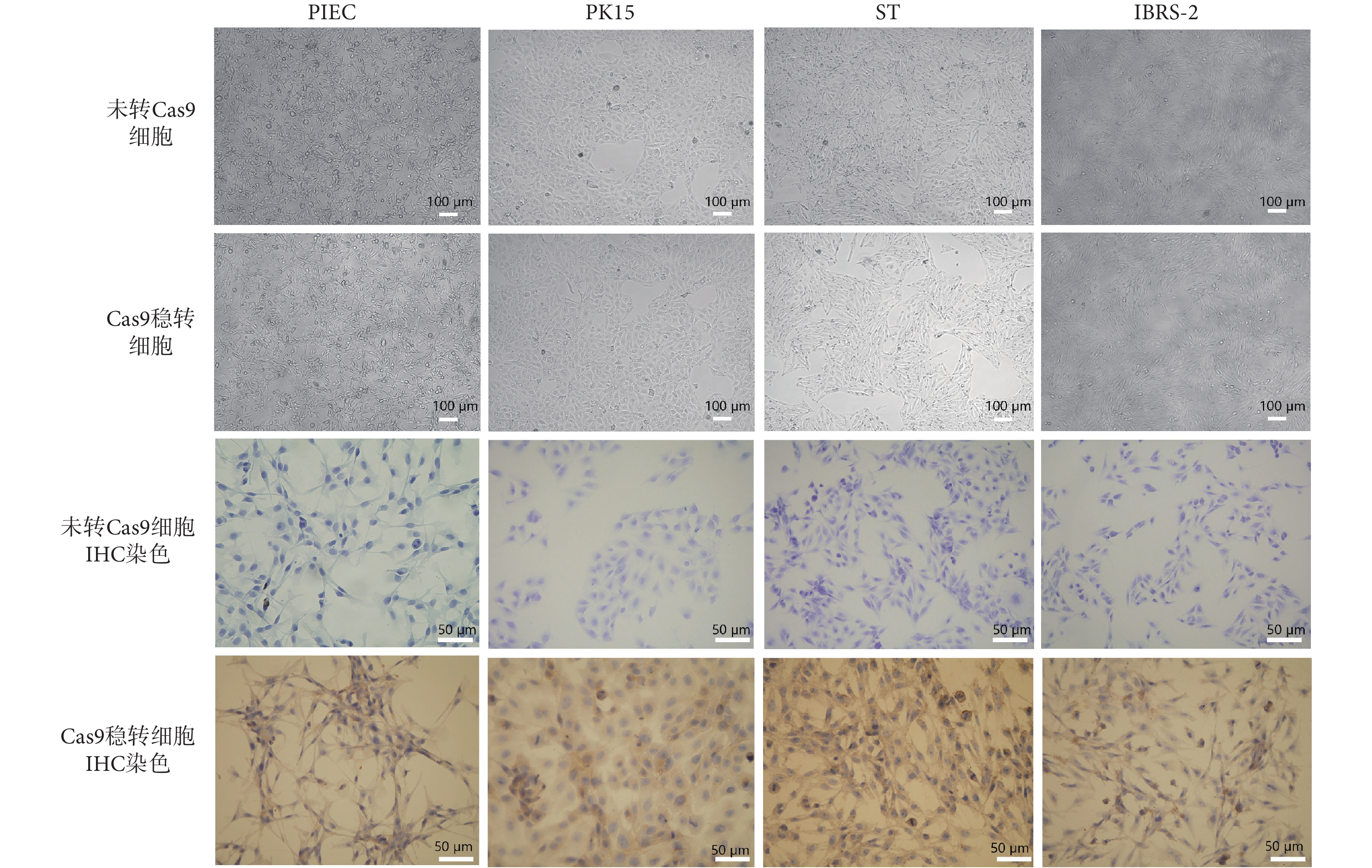
在本研究中,SSC-S2、SEPfk、SSC-S1、SEP-L1、MPK 這五種細胞,本身增殖就相對較緩慢,在經過慢病毒轉染以及加入嘌呤霉素篩選兩個連續過程后,細胞增殖則更加緩慢,細胞狀態較差,死亡較多,無法構建成 Cas9 穩定表達細胞株,不適合作為工具細胞長時間使用。經過慢病毒轉染以及嘌呤霉素抗性篩選兩個過程,PIEC、PK15、ST、IBRS-2 這四種豬細胞仍保持良好的細胞形態以及增殖能力。與轉染了 Cas9 慢病毒的細胞相比較,未轉染 Cas9 慢病毒的對照組細胞在加入嘌呤霉素 72 h 以后幾乎全部死亡,意味著篩選效率達 100%。在經過連續 7 d 的嘌呤霉素篩選后,四種 Cas9 穩轉細胞生長狀態良好,與正常細胞相比無明顯差異,如圖 3 所示。因此,最終經過對常見豬細胞株的篩選實驗,獲得了 PIEC-Cas9、PK15-Cas9、ST-Cas9、IBRS-2-Cas9 四種豬 Cas9 穩轉細胞。為進一步證實穩轉細胞的 Cas9 表達情況,利用 IHC 對穩轉細胞進行驗證,直觀可見四種細胞均高效表達 Cas9 核酸酶蛋白,如圖 3 所示。
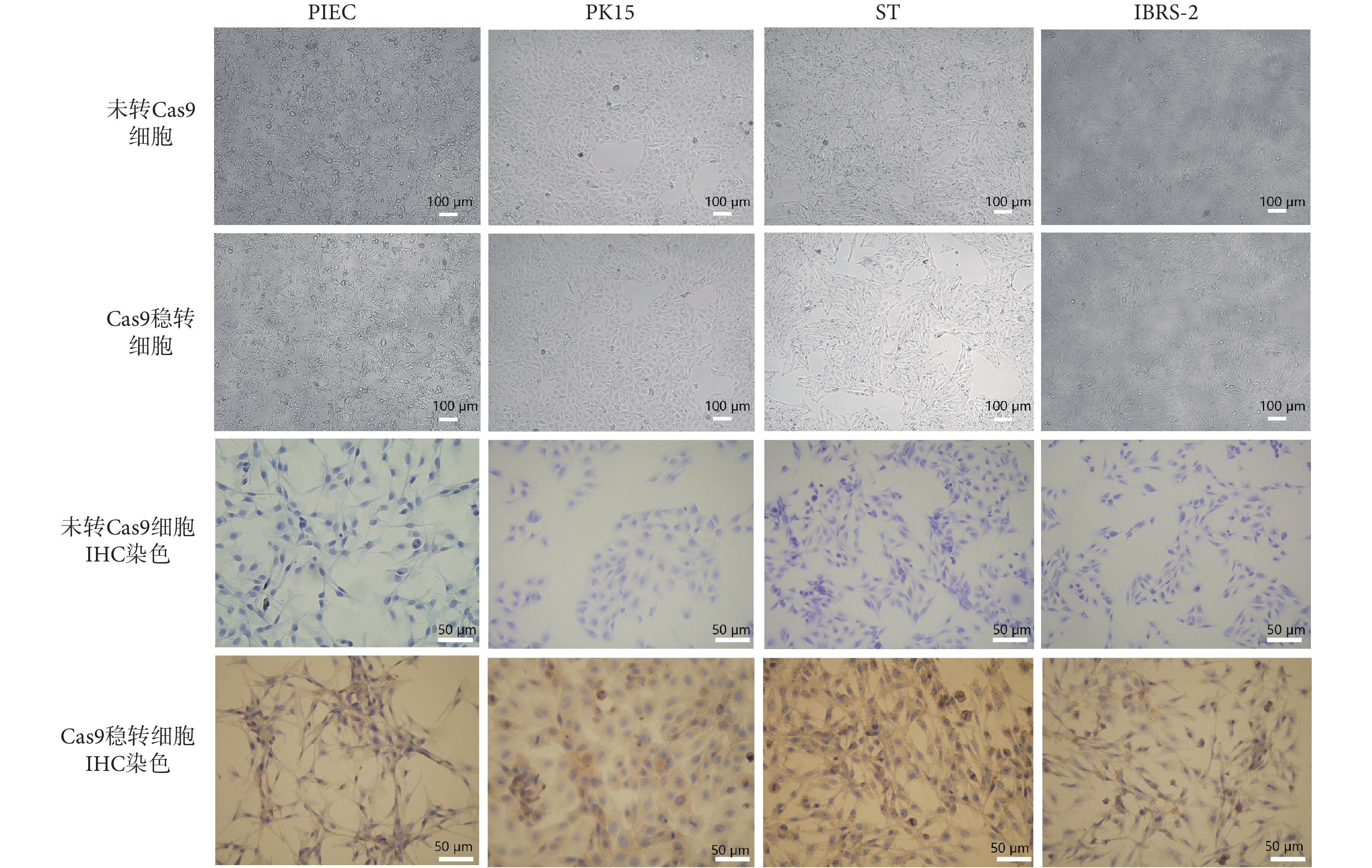 圖3
豬 Cas9 穩定表達細胞株的構建
Figure3.
Construction of stable Cas9-expressing cell lines of pigs
圖3
豬 Cas9 穩定表達細胞株的構建
Figure3.
Construction of stable Cas9-expressing cell lines of pigs
2.2 轉錄組測序分析豬 Cas9 穩定表達細胞株
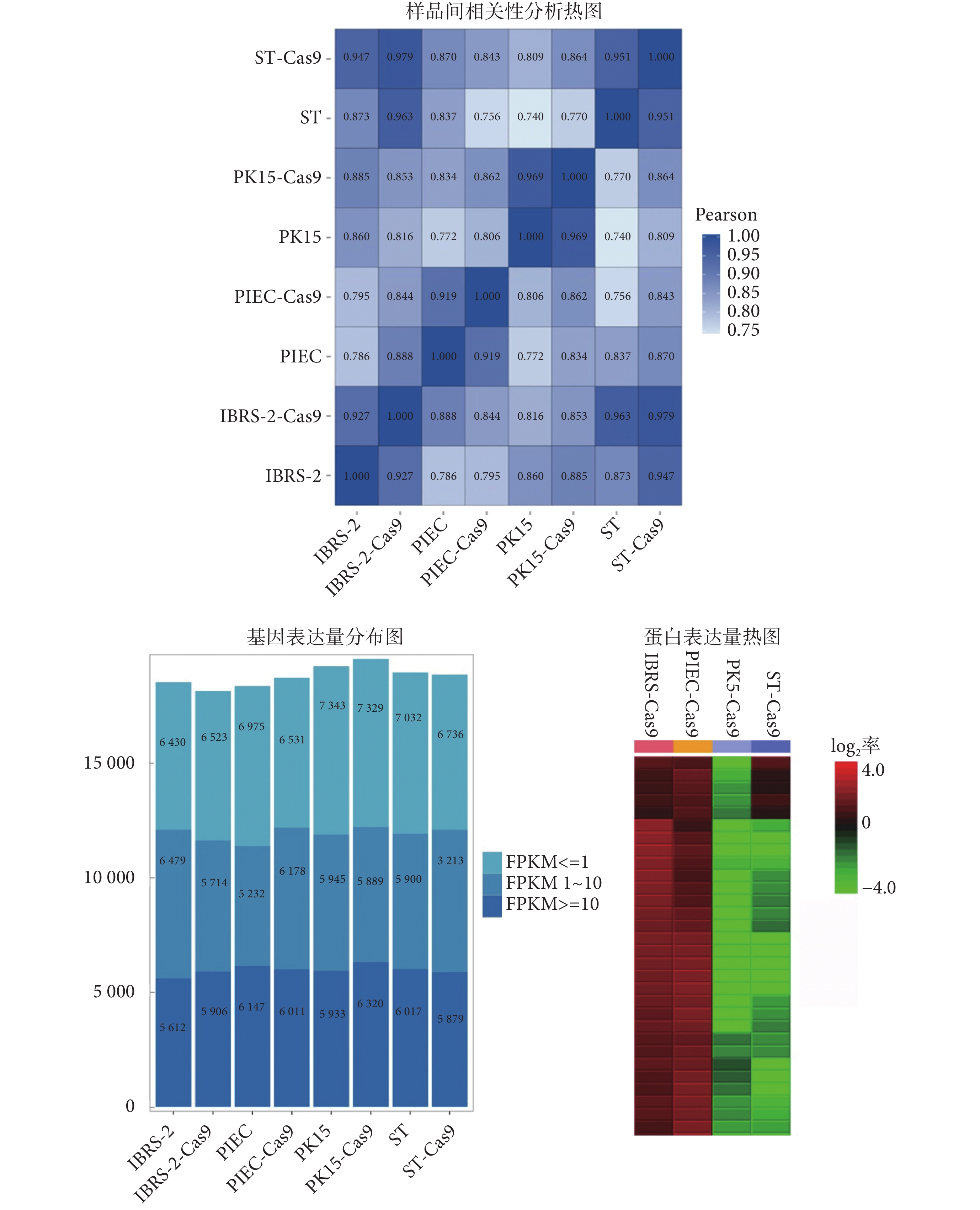
本研究對 PIEC、PK15、IBRS-2、ST 四株細胞系以及對應的 Cas9 穩轉細胞即 PIEC-Cas9、PK15-Cas9、IBRS-2-Cas9、ST-Cas9 進行轉錄組測序,并且進行比較分析。為了反映樣本間基因表達的相關性,本研究計算了每兩個樣品之間所有基因表達量的皮爾森(Pearson)相關系數,并將這些系數以熱圖的形式反映出來,如圖 4 所示。從樣品間相關性分析結果可以看出 PIEC 與 PIEC-Cas9、PK15 與 PK15-Cas9、IBRS-2 與 IBRS-2-Cas9、ST 與 ST-Cas9,呈現相關性最高,Pearson 相關系數均在 0.9 以上,而 PIEC、PK15、IBRS-2、ST 四種細胞之間基因表達相關性則相對較低。
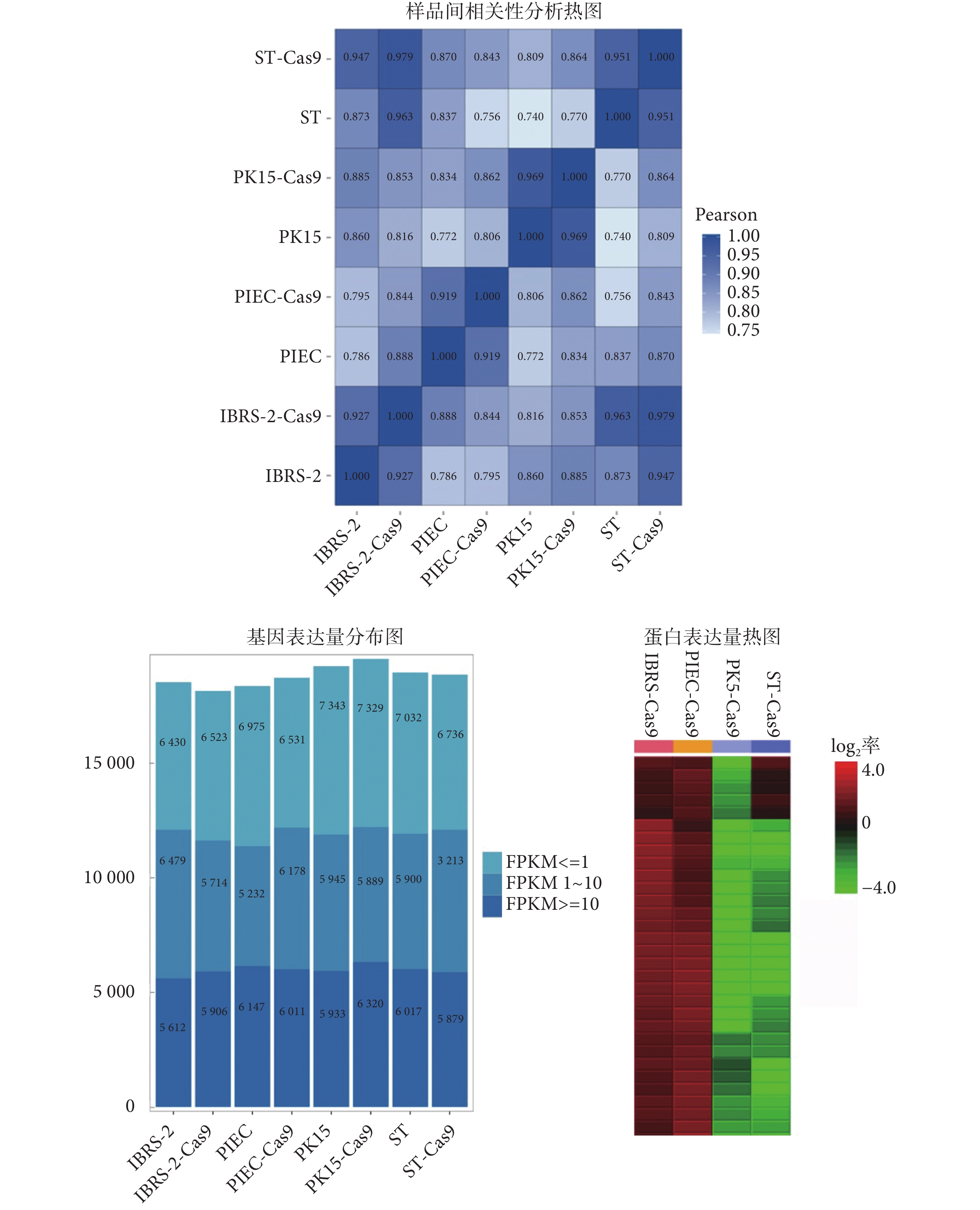 圖4
細胞基因以及蛋白表達分析
Figure4.
Analysis of cell gene and protein expression
圖4
細胞基因以及蛋白表達分析
Figure4.
Analysis of cell gene and protein expression
轉錄組基因表達量以每千個堿基的轉錄每百萬映射讀取的片段數(fragments per kilobase per millions base pairs sequenced,FPKM)值來衡量。對 FPKM(FPKM ≤ 1、FPKM 1~10、FPKM ≥ 10)的三種情況進行基因數目的統計,結果表明不同細胞存在不同基因的表達量區別,說明利用細胞篩選靶向豬基因組的 sgRNA 要根據基因表達情況,選定不同的豬細胞進行實驗,更有益于篩選并驗證出靶基因的 sgRNA 打靶效果。同時,由于慢病毒是隨機整合到細胞基因組,因此會無法避免地造成原有細胞基因組的微小改變,而引入 Cas9 核酸酶蛋白基因后,細胞基因表達量雖有所改變,但與對應的野生型細胞(wide type,WT)相比較仍然顯示出很強的相關性。
2.3 豬 Cas9 穩定表達細胞株蛋白質組定量分析
對豬 PIEC-Cas9、PK15-Cas9、IBRS-2-Cas9、ST-Cas9 穩轉細胞進行蛋白質組定量分析,本研究獲得了每種穩轉細胞的蛋白組表達情況。如圖 4 所示,由截選的部分蛋白表達熱圖可見四種 Cas9 穩轉細胞的蛋白表達差異。為方便流程化檢索,搭建了常見豬細胞系基因以及蛋白表達檢索平臺 PiGenEditer(網址為:https://www.omicsolution.org/wukong/PiGenEditer/)。通過輸入基因或蛋白號即可查詢并比較不同細胞的基因或者蛋白表達量。利用該平臺快速查出目的細胞基因或蛋白表達水平,綜合二者表達情況,以快速確定靶基因表達較高的 Cas9 穩轉豬細胞,進行 sgRNA 體外篩選實驗。經綜合評估 mRNA 以及蛋白表達情況,本實驗用于構建Fah基因敲除的細胞選定為 PIEC-Cas9。
2.4 靶向Fah基因 sgRNA 設計以及篩選
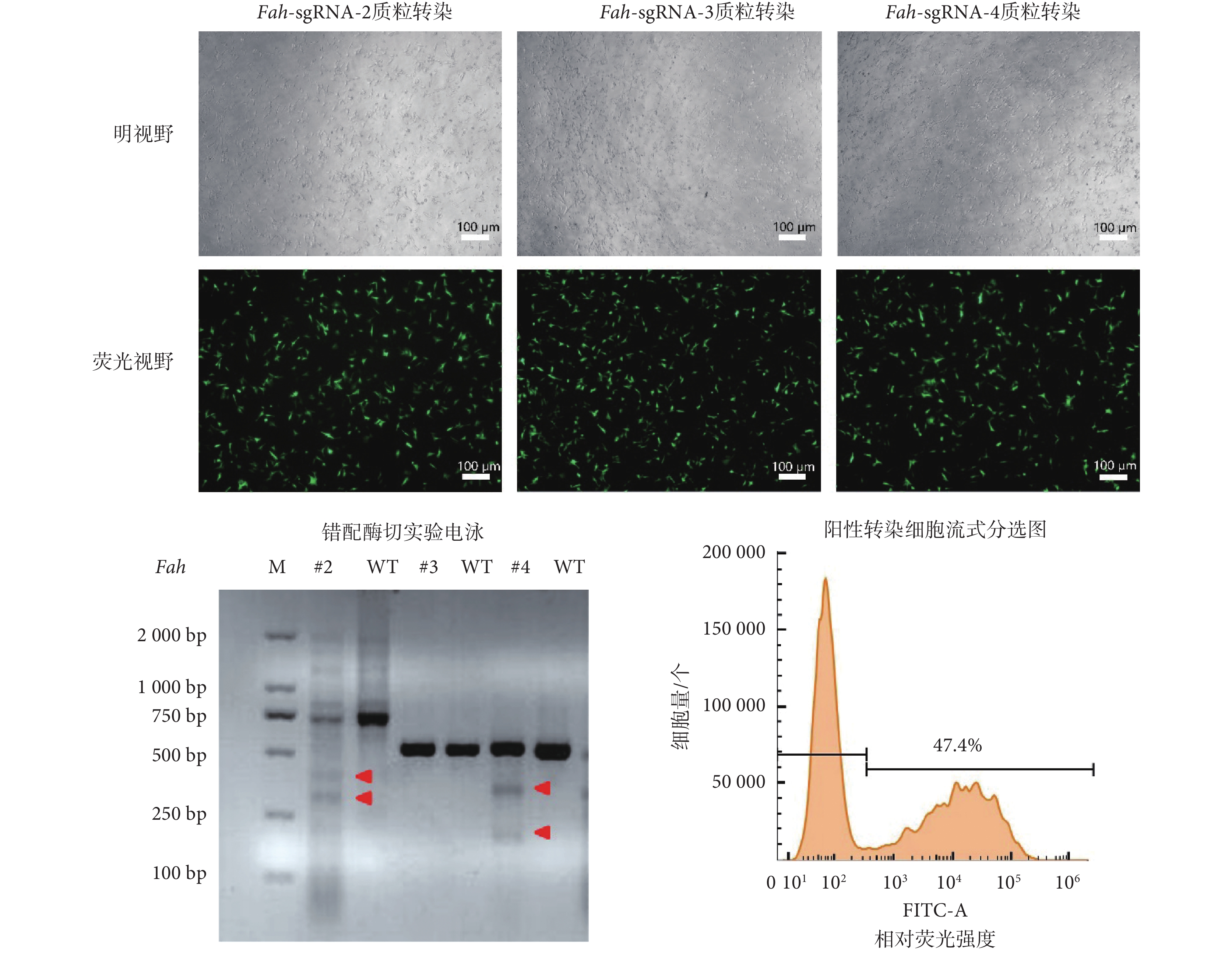
對Fah基因前 5 個外顯子編碼區序列進行 sgRNA 設計,根據 sgRNA 設計軟件所示綜合評分,選擇 3 條Fah-sgRNA,即Fah-sgRNA-2、Fah-sgRNA-3、Fah-sgRNA-4,分別打靶 2 號(#2)、3 號(#3)、4 號(#4)外顯子。將選擇的 sgRNA 序列連接到表達載體后,利用電轉儀將Fah-sgRNA 表達質粒快速轉入 PIEC-Cas9 細胞,轉染 24 h 后使用顯微鏡觀察細胞,細胞生長狀況良好,無明顯死亡。在熒光顯微鏡下觀察到綠色熒光蛋白(green fluorescent protein,GFP)高效表達,指示了 sgRNA 在細胞內的高效表達,如圖 5 所示。
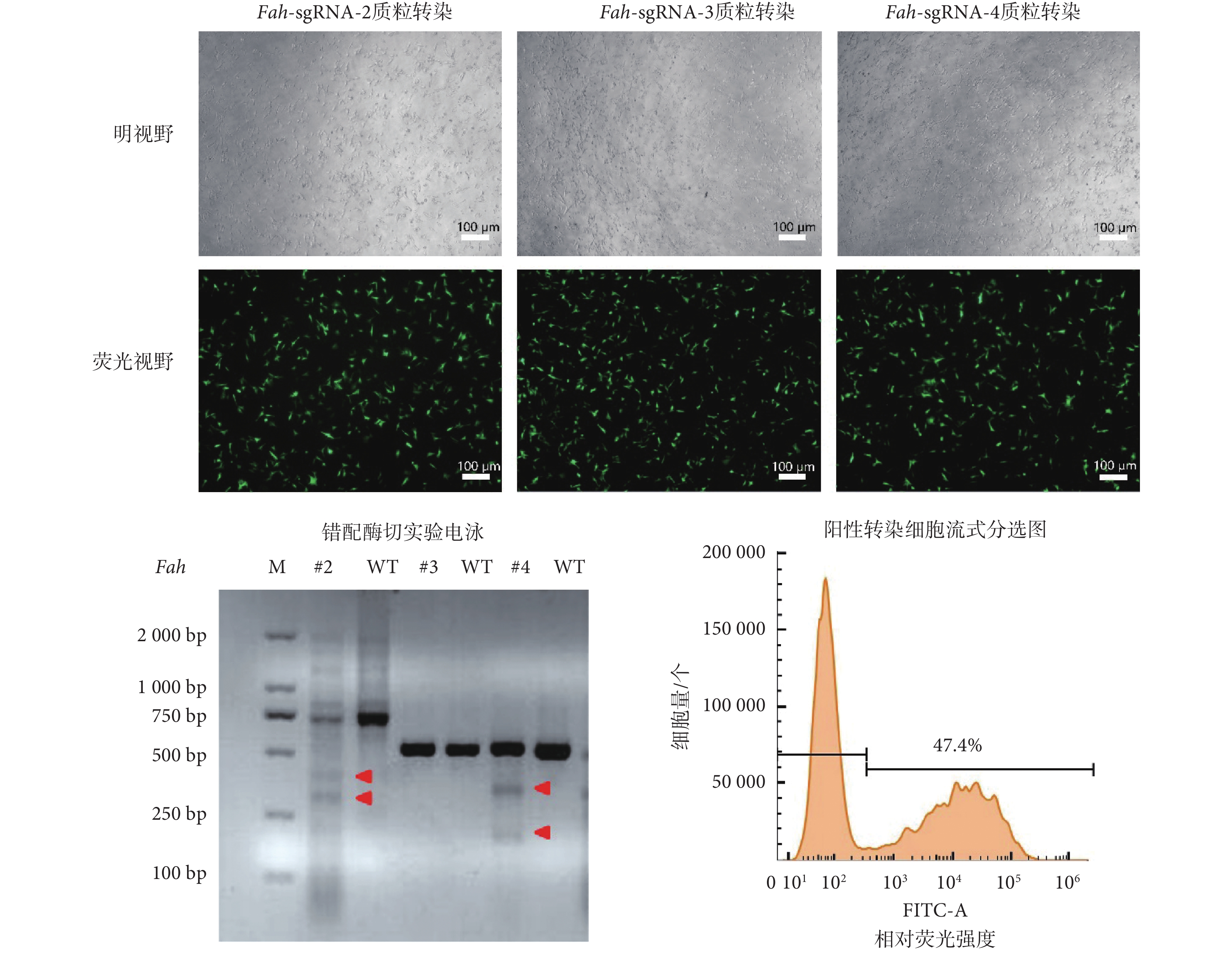 圖5
sgRNA 篩選以及富集基因編輯細胞
Figure5.
sgRNA screening and enrichment of gene-edited cells
圖5
sgRNA 篩選以及富集基因編輯細胞
Figure5.
sgRNA screening and enrichment of gene-edited cells
為篩選出有效的 sgRNA,在電轉 72 h 后收集細胞,提取細胞基因組 DNA,利用 PCR 擴增靶序列,隨后進行 T7EI 錯配酶切實驗。如圖 5 所示,靶向Fah基因 2 號、4 號外顯子的 sgRNA 為 T7EI 錯配酶切陽性結果,表明 sgRNA 對靶序列基因片段進行了有效切割,并引入了突變。結合 T7EI 錯配酶切結果以及 sgRNA 選擇原則,即選用比較靠前的外顯子為靶序列,因此本實驗選擇靶向Fah基因 2 號外顯子的 sgRNA 即Fah-sgRNA-2,用于構建Fah基因敲除細胞。隨后將電轉了Fah-sgRNA-2 質粒的細胞利用流式進行檢測,結果顯示表達 GFP 的陽性細胞占 47.4%,同時本文通過無菌分選富集這部分陽性細胞,用于后續單克隆挑選。
2.5 利用微陣列培養技術快速獲得基因敲除單克隆細胞
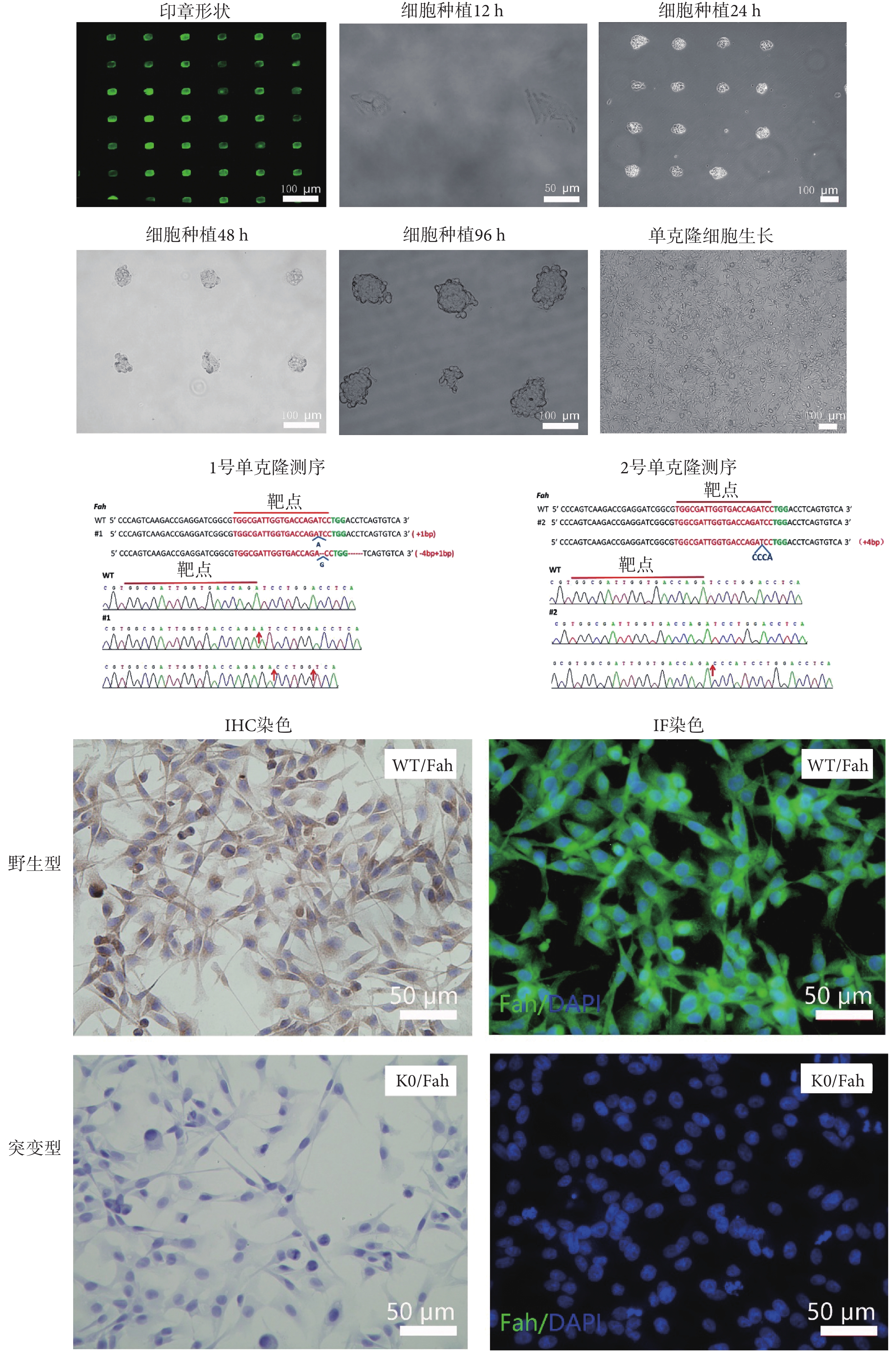
為了克服單克隆細胞獲得率低、狀態差、生長周期長的問題,本研究通過圖案微陣列培養技術,可以快速收獲由單個細胞增殖而來的細胞球。如圖 6 所示為熒光蛋白標記的微陣列印章形狀,細胞將在每個熒光小方格所示的位置上生長。
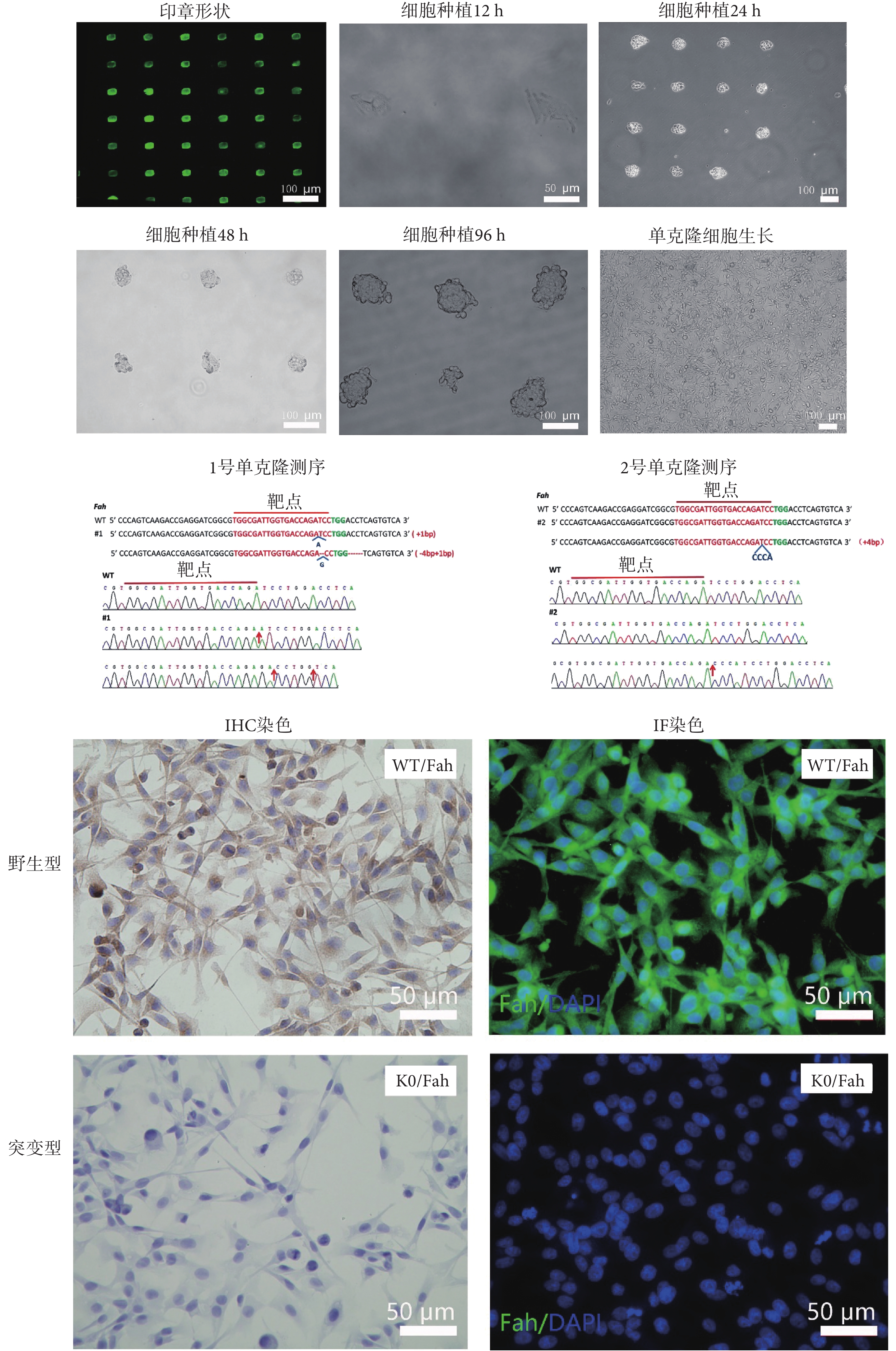 圖6
微陣列孔板培養細胞獲得Fah基因敲除細胞
Figure6.
Fah gene knockout cells were obtained from microarray plate
圖6
微陣列孔板培養細胞獲得Fah基因敲除細胞
Figure6.
Fah gene knockout cells were obtained from microarray plate
如圖 6 所示,將細胞按一定密度種植于微陣列孔板中,通過對細胞進行連續 4 d 的監測,在固定位置上清晰可見單個細胞以及分裂增殖了的細胞貼壁生長。在 24~48 h 內,細胞開始由貼壁狀態轉為呈三維球狀生長,逐漸形成約 50 μm 的細胞球。在 96 h 以后細胞球幾乎不再繼續增長,保持在約 100 μm,同時可見個別細胞球開始松動,欲脫離原有位置。第 5 d 開始細胞球經過搖晃或使用移液槍輕輕吹打,可以自動成球脫落。將脫落的細胞球進行稀釋,肉眼即可看見懸浮的細胞球。將單個細胞球吸出吹散后,進行擴增培養,48 h 即可快速獲得生長狀態良好的細胞。本實驗隨機吸取兩個細胞球,進行 T 載體測序分析,分別獲得了一個純和突變以及一個雜合突變的基因編輯細胞。對純和突變的細胞進行 IHC 以及 IF 驗證,通過與 WT 細胞相比較,經過基因敲除的細胞(knockout,KO)不表達 Fah 蛋白,表明成功獲得Fah基因突變細胞。
3 討論
CRISPR/Cas9 系統發揮作用主要依賴于高效的特異性 sgRNA 以及通用的 Cas9 核酸酶蛋白[15]。目前,CRISPR/Cas9 系統導入細胞最常見的方式主要包括兩種。一種是病毒介導的,即通過慢病毒、腺病毒或者腺相關病毒載體攜帶 CRISPR/Cas9 系統轉染到細胞中。另外一種是非病毒方式介導的,如通過脂質體等轉染試劑將 CRISPR/Cas9 系統表達質粒轉入到細胞中[16-18]。但以上方式都因為 Cas9 核酸酶蛋白基因片段較大,很難將 Cas9 核酸酶蛋白以及熒光蛋白或者其他抗性篩選基因同時包裝到一個載體中,以至于無法評估轉染效率[19-21]。另外還有一種方式是將 Cas9 核酸酶蛋白以及 sgRNA 在體外轉錄后形成復合物,再通過轉染試劑或電轉儀將其轉染到細胞。然而由于蛋白分子較大,因此轉染效率也非常的低[22-23]。針對一些懸浮細胞,轉染難度則更大,轉染效率更低。CRISPR/Cas9 系統轉染效率直接影響了獲得基因編輯細胞的效率,而以上提到的轉染大片段質粒或者蛋白都會大大降低轉染效率。基于以上原因,先構建 Cas9 穩轉細胞,再轉入 sgRNA 則可以大大提高 CRISPR/Cas9 系統轉染效率,進而提高獲得基因編輯細胞的效率。本實驗利用慢病毒成功構建了四種豬 Cas9 穩轉細胞,這些穩轉細胞可以作為篩選靶向豬基因組的 sgRNA 工具細胞,在后續實驗中僅需在細胞里引入帶 GFP 的 sgRNA 質粒即可實現基因編輯,并觀察轉染效率。
利用 CRISPR/Cas9 技術進行高效率的基因編輯,其中一個關鍵在于 sgRNA 的篩選[24]。尤其對于繁育周期較長的大動物,為節約時間和資金成本,必須在體外驗證出高效的 sgRNA,因此需要選定一株合適的細胞進行 sgRNA 效率篩選實驗。然而由于不同的細胞在 mRNA 水平以及蛋白水平表達存在差異,因此本實驗對構建的 PK15-Cas9、PIEC-Cas9、IBRS-2-Cas9、ST-Cas9 穩轉細胞進行 mRNA 以及蛋白水平的測定,并且搭建了常見豬細胞 mRNA/蛋白水平表達查詢網頁,可以快速選擇一株適合的細胞,在基因以及蛋白水平對 sgRNA 敲除效果進行篩選以及驗證。
另外,富集成功轉染 CRISPR/Cas9 系統的目的細胞,以期獲得基因編輯的活細胞也十分重要[25-28]。因此本文研究探索了一種利用 Cas9 穩轉豬細胞結合熒光報告的質粒載體來富集含有基因突變細胞的有效方法,即以 Cas9 穩定表達細胞作為工具細胞,將帶有 GFP 篩選標簽的靶基因 sgRNA 導入細胞,快速實現了基因編輯。另外為了高效地將 sgRNA 轉入細胞,同時避免較高成本的病毒包裝,采用電轉染的方式將包含 GFP 的 sgRNA 表達質粒轉入 Cas9 穩轉細胞,建立了高效的 Cas9 穩轉細胞電轉染方案,以此增加轉染效率,進一步增強基因編輯效率,篩選出高效的 sgRNA。
人類肝細胞的短缺是肝細胞移植治療代謝性肝病的一個重要障礙[29-30],因此本研究期望Fah缺陷豬可以成為人肝細胞的體內孵育器,從而為治療人類代謝性肝病以及肝細胞移植提供個體化的方法,因而選定Fah為靶基因。本研究利用 PIEC-Cas9 細胞,經過電轉的方式將帶有 GFP 指示的 sgRNA 高效轉入細胞,篩選得到有效靶向Fah基因的 sgRNA,隨后利用流式細胞術對 GFP 強表達的細胞進行無菌分選,以此富集陽性細胞。
另外,為了提升單克隆細胞的獲得效率,本研究使用圖案微陣列技術,在細胞培養皿底部限制細胞生長以及黏附空間,使得細胞在培養 24 h 后形成三維細胞樹樣結構,進而在培養 96 h 后形成直徑在 100 μm 左右的三維細胞微球。由于該微球與培養底面接觸面狹小,黏附不牢固,所以當細胞球長成一定大小以后,搖動或者用移液槍輕輕吹打,其會自動從底面脫落。脫落的細胞球肉眼可見,將這些脫落的細胞球稀釋,吸取單個細胞球分別于孔板中吹散后培養,僅需一周即可快速獲得生長狀態良好的單克隆細胞。基于以上策略,本研究快速獲得了兩個Fah基因敲除單克隆,大大縮短了單克隆細胞的獲得時間。
綜上所述,本文方法能夠高效富集靶向豬基因組修飾的細胞,并且創新性地利用圖案微陣列技術獲得單克隆,大大加速單克隆的獲取效率,為大批量挑取單克隆提供了有效方法,同時,獲得的Fah基因突變細胞也為生產基因編輯豬以及基礎醫學研究等后續工作奠定了基礎。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
目前,規律性短重復回文序列簇(clustered regularly interspersed short palindromic repeat,CRISPR)和 CRISPR 輔助蛋白 9(CRISPR-associated 9,Cas9)構成的 CRISPR/Cas9 已經廣泛用于鼠[1-2]、兔[3]、豬[4]、猴[5-6]等多種動物的研究,研究領域包括基因功能研究、基因治療、疾病模型生產等。利用 CRISPR/Cas9 技術結合體細胞核移植(somatic cell nuclear transplantation,SCNT)獲得基因編輯豬、猴等大動物模型,是目前最常用的方法,而獲得經過基因編輯的單克隆細胞作為核移植供體是生產基因改造動物的前提[7-8]。另外,CRISPR/Cas9 技術高效發揮作用的關鍵是靶基因的單鏈向導 RNA(single guide RNA,sgRNA)篩選,由于豬繁育周期平均為 114 d,因此在實施動物實驗前,在體外通過細胞實驗篩選出高效的 sgRNA,對于快速獲得基因修飾豬是十分必要的,而且還能避免時間、資源等的浪費[9]。CRISPR/Cas9 系統發揮作用需要通用的 Cas9 核酸酶蛋白[10-11],但由于 Cas9 核酸酶蛋白基因片段較大,通常一個載體無法將 Cas9、sgRNA 以及抗性基因或熒光蛋白標簽等多個元件同時包含,導致無法對基因編輯細胞進行篩選,以至于加大了獲得基因編輯細胞的難度。另外,即使一個質粒能夠完整包裝篩選標簽,但是過大的質粒,也使細胞轉染難度隨之增大,導致轉染效率降低。
目前獲得基因編輯單克隆細胞的常用方法主要是極限稀釋法以及機械挑取法,然而這兩種方法獲得的單克隆往往混有其他細胞,無法真正獲得由一個細胞分化而來的細胞群[12-13]。并且由于機械力度的損傷,收獲的細胞通常狀態較差,并且操作時間長,單克隆收獲率低,對于需要大批量獲得單克隆細胞的實驗而言,將大大影響實驗進程[14]。若通過傳統方法獲得單基因乃至多基因編輯的單克隆細胞,則操作難度將更大。另外,即使通過極限稀釋法或者流式細胞術將一個細胞分置到一個孔中進行培養,由于缺乏細胞生長的微環境,在單個細胞的環境中,有的細胞往往也無法正常分裂增殖。
基于以上原因,本研究的目的是構建一套靶向豬基因組 sgRNA 快速篩選平臺,并利用熒光報告載體,建立一種可以富集基因突變細胞的策略,同時利用圖案微陣列技術探索一種快速、對細胞損傷較小的單克隆細胞獲得方式,并以延胡索酰乙酰乙酸酶(fumarylacetoacetate hydrolase,Fah)基因(簡稱:Fah基因)敲除為例,以期實現高效快速地獲得Fah基因敲除細胞。本研究流程圖如圖 1 所示。
 圖1
高效獲得豬基因編輯單克隆細胞實驗流程圖
Figure1.
Flow chart of experiments for efficient acquisition of pig gene-edited monoclonal cells
圖1
高效獲得豬基因編輯單克隆細胞實驗流程圖
Figure1.
Flow chart of experiments for efficient acquisition of pig gene-edited monoclonal cells
1 材料和方法
1.1 實驗材料與試劑
實驗中所使用的細胞株包括:家豬皮膚細胞(domestic pig skin cells,SSC-S1),小香豬皮膚細胞(small pig skin cells,SSC-S2),小耳豬腎細胞(small ear pig kidney cells,SEPfk),小耳豬肺細胞(small ear pig-lung cells 1,SEP-L1)以及豬腎上皮細胞(porcine kidney epithelial cells,PK15)來于中國科學院昆明動物所;豬髖動脈內皮細胞(porcine hip arteries endothelial cells,PIEC)來自于中科院上海細胞庫;小型豬腎細胞(mini pig kidney epithelial cells,MPK),來自于中國食品藥品檢定研究院;豬睪丸細胞(porcine testicular cell,ST),豬腎傳代細胞(porcine kidney cells-2,IBRS-2)來自于中國典型培養物保藏中心細胞庫,總計 9 種細胞。sgRNA 骨架表達載體 pHBLV-U6-MCS-CMV-ZsCreen,購自中國漢恒生物公司;Cas9 慢病毒購自中國漢恒生物公司。兔抗 Cas9 抗體購自美國 Abcam 公司;T4 多聚核苷酸激酶、快速連接試劑盒均購自美國 NEW ENGLAND BioLabs 公司;無內毒素小提中量試劑盒購自中國天根生化科技有限公司;磷酸鹽緩沖液(phosphate buffered saline,PBS)、DMEM 高糖培養基、RPMI 1640 培養基、MEM 培養基、胎牛血清(fetal bovine serum,FBS)購自美國 Gibco 公司;兔抗人、鼠 Fah 抗體購自中國 BIOSS 公司;用于細胞測序的 T 克隆載體 pClone007 試劑盒購自中國擎科生物公司。
1.2 構建豬 Cas9 穩定表達細胞株
用 MEM 培養基+10%FBS 培養 IBRS-2、ST 細胞;用 DMEM 高糖培養基+10 % FBS 培養 PK15、MPK、SSC-S2、SEPfk、SEP-L1、SSC-S1 細胞;用 RPMI 1640 培養基+10 % FBS 培養 PIEC 細胞。隨后將生長狀態良好的細胞制成細胞懸液,并以 1 × 105 個/孔的細胞密度接種到 24 孔板中。待目的細胞達到約 30%~50%融合密度時加入 Cas9 慢病毒。Cas9 慢病毒滴度為:108 TU/mL;PIEC、ST、IBRS-2、PK15 細胞的最適感染復數(multiplicity of infection,MOI)為:30;SEPfk、SEP-L1、SSC-S1 細胞的最適 MOI 值為:20。病毒感染細胞 72 h 后,在培養液中加入嘌呤霉素,進行抗性篩選并獲得 Cas9 穩定表達細胞株。PIEC 細胞篩選濃度為 1 μg/mL,IBRS-2 細胞篩選濃度為 2.5 μg/mL;PK15 細胞篩選濃度為 2 μg/mL;ST 細胞篩選濃度為 2.5 μg/mL;SEPfk、SEP-L1、SSC-S1 細胞篩選濃度為 0.5 μg/mL。
1.3 Cas9 穩定表達細胞株免疫組織化學染色
將 2 × 105個細胞接種于底部放有玻片的 24 孔板中,進行細胞接種實驗。細胞培養過夜后,用 PBS 清洗三遍,10% 福爾馬林固定細胞 5 min,PBS 再次清洗三遍,取出細胞玻片,黏于載玻片干燥過夜,隨后使用兔抗 Cas9 抗體對細胞玻片進行常規免疫組化(immunohistochemistry,IHC)染色。
1.4 Cas9 穩轉豬細胞轉錄組測序以及蛋白質組定量分析
抽提 PIEC、PK15、IBRS-2、ST 細胞以及相對應的 Cas9 穩轉細胞的 RNA 樣品,送到華大基因公司進行細胞表達譜信息采集。提取 PIEC- Cas9,PK15- Cas9,IBRS-2-Cas9,ST- Cas9 四種穩轉細胞的蛋白送到上海易算生物公司進行蛋白質組學定量分析。將測序結果整理后,搭建常見豬基因組/蛋白表達情況查詢網頁,便于查詢以及比較不同豬細胞的基因以及蛋白表達量。
1.5 構建 Fah基因的 sgRNA 表達載體
合成 3 條靶向Fah基因的 sgRNA,即Fah-sgRNA1、Fah-sgRNA2、Fah-sgRNA3,其正向和反向寡核苷酸序列分別如表 1 所示。將Fah-sgRNA 對應的正向和反向寡核苷酸序列進行磷酸化、退火、復性,形成具有粘性末端的雙鏈 DNA 片段。利用 BamHI、EcoRI 限制性內切酶酶切目標載體 pHBLV-U6-MCS-CMV-ZsCreen,隨后電泳分離并膠回收 pHBLV-U6-MCS-CMV-ZsCreen 線性載體。將復性得到的Fah-sgRNA 雙鏈 DNA 片段與回收得到的線性載體片段進行連接反應,然后將連接混合物轉化到大腸桿菌 DH5α 菌株。將連接正確的質粒擴增后,采用無內毒素小提中量試劑盒抽提質粒,用于細胞轉染實驗。
1.6 Fah基因的 sgRNA 表達載體轉染實驗
本實驗采用電轉儀將質粒轉入 PIEC-Cas9 靶細胞,方法如下:將生長狀態良好的細胞經胰蛋白酶消化,并用電轉液稀釋成濃度為 1 × 106~2 × 106 個/mL 的細胞懸液。將上述提取的 1 μg sgRNA 表達質粒,與約 2 × 105 個細胞混合置于 96 孔板中,按照電壓 200 V、脈寬 200 μs、間隔 1 000 ms 的條件進行電轉實驗,然后將電轉后的細胞平均三等分轉入 24 孔板中培養。
1.7 流式分析細胞感染效率以及分選陽性轉染細胞
細胞轉染 48 h 后先進行擴增培養,然后將貼壁細胞經胰酶消化,離心后用新鮮培養基重懸,將細胞懸液移至無菌的流式檢測管,檢測質粒轉染效率并分選熒光表達陽性的細胞到 24 孔板中,進一步擴增陽性細胞。
1.8 錯配酶切法檢測Fah基因敲除效果
收集部分目的細胞,抽提基因組 DNA,同時抽提野生型目的細胞的基因組 DNA。以基因組 DNA 為模板分別用聚合酶鏈式反應(polymerase chain reaction,PCR)擴增靶基因Fah序列片段。擴增靶基因片段的引物如表 2 所示。電泳檢測 PCR 產物并回收純化,將純化后的 DNA 片段分別加熱變性、復性,形成雜交 DNA 分子。用 T7 核酸內切酶 I(T7 endonuclease I,T7EI)切割復性后的雜交 DNA,檢測 sgRNA 介導的 Fah基因敲除效果。
1.9 利用圖案微陣列法快速獲得Fah基因敲除單克隆細胞以及鑒定
使用激光蝕刻的特定圖案硅片為模板,倒模獲得聚二甲基硅氧烷(polydimethylsiloxane,PDMS)印章,制備出具有特定微圖案的 PDMS 印章(面積為 225 μm2的矩形)。將濃度為 100 μg/mL 的纖連蛋白涂布于印章表面,室溫孵育 20 min 后洗去多余的溶液。在 37 oC 孵箱中干燥,然后將圖案印壓于細胞非黏附培養皿底部,待圖案形成后移去印章。圖案干燥后,加入 1% 嵌段式聚醚 F-127 室溫孵育 2 h,封閉剩余培養皿底部上的空間。具體制備方法如圖 2 所示。隨后將經過流式分選的 1 × 103 個細胞種植到微陣列培養皿中連續監測細胞生長,并挑取單克隆細胞球。
 圖2
圖案微陣列印章法獲得單克隆細胞流程
Figure2.
The process of obtaining monoclonal by microarray seal
圖2
圖案微陣列印章法獲得單克隆細胞流程
Figure2.
The process of obtaining monoclonal by microarray seal
1.10 T 載體測序鑒定單克隆細胞Fah基因敲除情況
收集待檢測的單克隆細胞,抽提基因組。PCR 擴增單克隆細胞的Fah基因片段,使用膠回收試劑盒切膠回收Fah目的片段,利用 pClone007 試劑盒將Fah PCR 產物連接到 T 載體。為了分析每個單細胞克隆的正義鏈以及反義鏈的突變情況,對每個單克隆細胞進行 6 個 T 載體的克隆測序,以確保單克隆的純度。
1.11 Fah基因敲除細胞免疫熒光染色以及 IHC 染色
在 24 孔板底部放入玻片,將 2 × 105個細胞接種于 24 孔板,細胞培養過夜。使用 10% 福爾馬林固定細胞 5 min,用 PBS 清洗三遍,隨后取出細胞玻片,黏于載玻片上干燥過夜。使用兔抗人、鼠 Fah 抗體進行常規 IHC 以及免疫熒光(immunofluorescence,IF)染色。
2 結果
2.1 利用慢病毒載體構建豬 Cas9 穩定表達細胞株
在本研究中,SSC-S2、SEPfk、SSC-S1、SEP-L1、MPK 這五種細胞,本身增殖就相對較緩慢,在經過慢病毒轉染以及加入嘌呤霉素篩選兩個連續過程后,細胞增殖則更加緩慢,細胞狀態較差,死亡較多,無法構建成 Cas9 穩定表達細胞株,不適合作為工具細胞長時間使用。經過慢病毒轉染以及嘌呤霉素抗性篩選兩個過程,PIEC、PK15、ST、IBRS-2 這四種豬細胞仍保持良好的細胞形態以及增殖能力。與轉染了 Cas9 慢病毒的細胞相比較,未轉染 Cas9 慢病毒的對照組細胞在加入嘌呤霉素 72 h 以后幾乎全部死亡,意味著篩選效率達 100%。在經過連續 7 d 的嘌呤霉素篩選后,四種 Cas9 穩轉細胞生長狀態良好,與正常細胞相比無明顯差異,如圖 3 所示。因此,最終經過對常見豬細胞株的篩選實驗,獲得了 PIEC-Cas9、PK15-Cas9、ST-Cas9、IBRS-2-Cas9 四種豬 Cas9 穩轉細胞。為進一步證實穩轉細胞的 Cas9 表達情況,利用 IHC 對穩轉細胞進行驗證,直觀可見四種細胞均高效表達 Cas9 核酸酶蛋白,如圖 3 所示。
 圖3
豬 Cas9 穩定表達細胞株的構建
Figure3.
Construction of stable Cas9-expressing cell lines of pigs
圖3
豬 Cas9 穩定表達細胞株的構建
Figure3.
Construction of stable Cas9-expressing cell lines of pigs
2.2 轉錄組測序分析豬 Cas9 穩定表達細胞株
本研究對 PIEC、PK15、IBRS-2、ST 四株細胞系以及對應的 Cas9 穩轉細胞即 PIEC-Cas9、PK15-Cas9、IBRS-2-Cas9、ST-Cas9 進行轉錄組測序,并且進行比較分析。為了反映樣本間基因表達的相關性,本研究計算了每兩個樣品之間所有基因表達量的皮爾森(Pearson)相關系數,并將這些系數以熱圖的形式反映出來,如圖 4 所示。從樣品間相關性分析結果可以看出 PIEC 與 PIEC-Cas9、PK15 與 PK15-Cas9、IBRS-2 與 IBRS-2-Cas9、ST 與 ST-Cas9,呈現相關性最高,Pearson 相關系數均在 0.9 以上,而 PIEC、PK15、IBRS-2、ST 四種細胞之間基因表達相關性則相對較低。
 圖4
細胞基因以及蛋白表達分析
Figure4.
Analysis of cell gene and protein expression
圖4
細胞基因以及蛋白表達分析
Figure4.
Analysis of cell gene and protein expression
轉錄組基因表達量以每千個堿基的轉錄每百萬映射讀取的片段數(fragments per kilobase per millions base pairs sequenced,FPKM)值來衡量。對 FPKM(FPKM ≤ 1、FPKM 1~10、FPKM ≥ 10)的三種情況進行基因數目的統計,結果表明不同細胞存在不同基因的表達量區別,說明利用細胞篩選靶向豬基因組的 sgRNA 要根據基因表達情況,選定不同的豬細胞進行實驗,更有益于篩選并驗證出靶基因的 sgRNA 打靶效果。同時,由于慢病毒是隨機整合到細胞基因組,因此會無法避免地造成原有細胞基因組的微小改變,而引入 Cas9 核酸酶蛋白基因后,細胞基因表達量雖有所改變,但與對應的野生型細胞(wide type,WT)相比較仍然顯示出很強的相關性。
2.3 豬 Cas9 穩定表達細胞株蛋白質組定量分析
對豬 PIEC-Cas9、PK15-Cas9、IBRS-2-Cas9、ST-Cas9 穩轉細胞進行蛋白質組定量分析,本研究獲得了每種穩轉細胞的蛋白組表達情況。如圖 4 所示,由截選的部分蛋白表達熱圖可見四種 Cas9 穩轉細胞的蛋白表達差異。為方便流程化檢索,搭建了常見豬細胞系基因以及蛋白表達檢索平臺 PiGenEditer(網址為:https://www.omicsolution.org/wukong/PiGenEditer/)。通過輸入基因或蛋白號即可查詢并比較不同細胞的基因或者蛋白表達量。利用該平臺快速查出目的細胞基因或蛋白表達水平,綜合二者表達情況,以快速確定靶基因表達較高的 Cas9 穩轉豬細胞,進行 sgRNA 體外篩選實驗。經綜合評估 mRNA 以及蛋白表達情況,本實驗用于構建Fah基因敲除的細胞選定為 PIEC-Cas9。
2.4 靶向Fah基因 sgRNA 設計以及篩選
對Fah基因前 5 個外顯子編碼區序列進行 sgRNA 設計,根據 sgRNA 設計軟件所示綜合評分,選擇 3 條Fah-sgRNA,即Fah-sgRNA-2、Fah-sgRNA-3、Fah-sgRNA-4,分別打靶 2 號(#2)、3 號(#3)、4 號(#4)外顯子。將選擇的 sgRNA 序列連接到表達載體后,利用電轉儀將Fah-sgRNA 表達質粒快速轉入 PIEC-Cas9 細胞,轉染 24 h 后使用顯微鏡觀察細胞,細胞生長狀況良好,無明顯死亡。在熒光顯微鏡下觀察到綠色熒光蛋白(green fluorescent protein,GFP)高效表達,指示了 sgRNA 在細胞內的高效表達,如圖 5 所示。
 圖5
sgRNA 篩選以及富集基因編輯細胞
Figure5.
sgRNA screening and enrichment of gene-edited cells
圖5
sgRNA 篩選以及富集基因編輯細胞
Figure5.
sgRNA screening and enrichment of gene-edited cells
為篩選出有效的 sgRNA,在電轉 72 h 后收集細胞,提取細胞基因組 DNA,利用 PCR 擴增靶序列,隨后進行 T7EI 錯配酶切實驗。如圖 5 所示,靶向Fah基因 2 號、4 號外顯子的 sgRNA 為 T7EI 錯配酶切陽性結果,表明 sgRNA 對靶序列基因片段進行了有效切割,并引入了突變。結合 T7EI 錯配酶切結果以及 sgRNA 選擇原則,即選用比較靠前的外顯子為靶序列,因此本實驗選擇靶向Fah基因 2 號外顯子的 sgRNA 即Fah-sgRNA-2,用于構建Fah基因敲除細胞。隨后將電轉了Fah-sgRNA-2 質粒的細胞利用流式進行檢測,結果顯示表達 GFP 的陽性細胞占 47.4%,同時本文通過無菌分選富集這部分陽性細胞,用于后續單克隆挑選。
2.5 利用微陣列培養技術快速獲得基因敲除單克隆細胞
為了克服單克隆細胞獲得率低、狀態差、生長周期長的問題,本研究通過圖案微陣列培養技術,可以快速收獲由單個細胞增殖而來的細胞球。如圖 6 所示為熒光蛋白標記的微陣列印章形狀,細胞將在每個熒光小方格所示的位置上生長。
 圖6
微陣列孔板培養細胞獲得Fah基因敲除細胞
Figure6.
Fah gene knockout cells were obtained from microarray plate
圖6
微陣列孔板培養細胞獲得Fah基因敲除細胞
Figure6.
Fah gene knockout cells were obtained from microarray plate
如圖 6 所示,將細胞按一定密度種植于微陣列孔板中,通過對細胞進行連續 4 d 的監測,在固定位置上清晰可見單個細胞以及分裂增殖了的細胞貼壁生長。在 24~48 h 內,細胞開始由貼壁狀態轉為呈三維球狀生長,逐漸形成約 50 μm 的細胞球。在 96 h 以后細胞球幾乎不再繼續增長,保持在約 100 μm,同時可見個別細胞球開始松動,欲脫離原有位置。第 5 d 開始細胞球經過搖晃或使用移液槍輕輕吹打,可以自動成球脫落。將脫落的細胞球進行稀釋,肉眼即可看見懸浮的細胞球。將單個細胞球吸出吹散后,進行擴增培養,48 h 即可快速獲得生長狀態良好的細胞。本實驗隨機吸取兩個細胞球,進行 T 載體測序分析,分別獲得了一個純和突變以及一個雜合突變的基因編輯細胞。對純和突變的細胞進行 IHC 以及 IF 驗證,通過與 WT 細胞相比較,經過基因敲除的細胞(knockout,KO)不表達 Fah 蛋白,表明成功獲得Fah基因突變細胞。
3 討論
CRISPR/Cas9 系統發揮作用主要依賴于高效的特異性 sgRNA 以及通用的 Cas9 核酸酶蛋白[15]。目前,CRISPR/Cas9 系統導入細胞最常見的方式主要包括兩種。一種是病毒介導的,即通過慢病毒、腺病毒或者腺相關病毒載體攜帶 CRISPR/Cas9 系統轉染到細胞中。另外一種是非病毒方式介導的,如通過脂質體等轉染試劑將 CRISPR/Cas9 系統表達質粒轉入到細胞中[16-18]。但以上方式都因為 Cas9 核酸酶蛋白基因片段較大,很難將 Cas9 核酸酶蛋白以及熒光蛋白或者其他抗性篩選基因同時包裝到一個載體中,以至于無法評估轉染效率[19-21]。另外還有一種方式是將 Cas9 核酸酶蛋白以及 sgRNA 在體外轉錄后形成復合物,再通過轉染試劑或電轉儀將其轉染到細胞。然而由于蛋白分子較大,因此轉染效率也非常的低[22-23]。針對一些懸浮細胞,轉染難度則更大,轉染效率更低。CRISPR/Cas9 系統轉染效率直接影響了獲得基因編輯細胞的效率,而以上提到的轉染大片段質粒或者蛋白都會大大降低轉染效率。基于以上原因,先構建 Cas9 穩轉細胞,再轉入 sgRNA 則可以大大提高 CRISPR/Cas9 系統轉染效率,進而提高獲得基因編輯細胞的效率。本實驗利用慢病毒成功構建了四種豬 Cas9 穩轉細胞,這些穩轉細胞可以作為篩選靶向豬基因組的 sgRNA 工具細胞,在后續實驗中僅需在細胞里引入帶 GFP 的 sgRNA 質粒即可實現基因編輯,并觀察轉染效率。
利用 CRISPR/Cas9 技術進行高效率的基因編輯,其中一個關鍵在于 sgRNA 的篩選[24]。尤其對于繁育周期較長的大動物,為節約時間和資金成本,必須在體外驗證出高效的 sgRNA,因此需要選定一株合適的細胞進行 sgRNA 效率篩選實驗。然而由于不同的細胞在 mRNA 水平以及蛋白水平表達存在差異,因此本實驗對構建的 PK15-Cas9、PIEC-Cas9、IBRS-2-Cas9、ST-Cas9 穩轉細胞進行 mRNA 以及蛋白水平的測定,并且搭建了常見豬細胞 mRNA/蛋白水平表達查詢網頁,可以快速選擇一株適合的細胞,在基因以及蛋白水平對 sgRNA 敲除效果進行篩選以及驗證。
另外,富集成功轉染 CRISPR/Cas9 系統的目的細胞,以期獲得基因編輯的活細胞也十分重要[25-28]。因此本文研究探索了一種利用 Cas9 穩轉豬細胞結合熒光報告的質粒載體來富集含有基因突變細胞的有效方法,即以 Cas9 穩定表達細胞作為工具細胞,將帶有 GFP 篩選標簽的靶基因 sgRNA 導入細胞,快速實現了基因編輯。另外為了高效地將 sgRNA 轉入細胞,同時避免較高成本的病毒包裝,采用電轉染的方式將包含 GFP 的 sgRNA 表達質粒轉入 Cas9 穩轉細胞,建立了高效的 Cas9 穩轉細胞電轉染方案,以此增加轉染效率,進一步增強基因編輯效率,篩選出高效的 sgRNA。
人類肝細胞的短缺是肝細胞移植治療代謝性肝病的一個重要障礙[29-30],因此本研究期望Fah缺陷豬可以成為人肝細胞的體內孵育器,從而為治療人類代謝性肝病以及肝細胞移植提供個體化的方法,因而選定Fah為靶基因。本研究利用 PIEC-Cas9 細胞,經過電轉的方式將帶有 GFP 指示的 sgRNA 高效轉入細胞,篩選得到有效靶向Fah基因的 sgRNA,隨后利用流式細胞術對 GFP 強表達的細胞進行無菌分選,以此富集陽性細胞。
另外,為了提升單克隆細胞的獲得效率,本研究使用圖案微陣列技術,在細胞培養皿底部限制細胞生長以及黏附空間,使得細胞在培養 24 h 后形成三維細胞樹樣結構,進而在培養 96 h 后形成直徑在 100 μm 左右的三維細胞微球。由于該微球與培養底面接觸面狹小,黏附不牢固,所以當細胞球長成一定大小以后,搖動或者用移液槍輕輕吹打,其會自動從底面脫落。脫落的細胞球肉眼可見,將這些脫落的細胞球稀釋,吸取單個細胞球分別于孔板中吹散后培養,僅需一周即可快速獲得生長狀態良好的單克隆細胞。基于以上策略,本研究快速獲得了兩個Fah基因敲除單克隆,大大縮短了單克隆細胞的獲得時間。
綜上所述,本文方法能夠高效富集靶向豬基因組修飾的細胞,并且創新性地利用圖案微陣列技術獲得單克隆,大大加速單克隆的獲取效率,為大批量挑取單克隆提供了有效方法,同時,獲得的Fah基因突變細胞也為生產基因編輯豬以及基礎醫學研究等后續工作奠定了基礎。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。