時間干涉(TI)作為一種新的神經調控技術可以應用于非侵入性深部腦刺激。為了驗證它在動物運動行為調控中的有效性,本文使用TI方法將包絡電場聚焦到小鼠腦深部的丘腦腹后外側核(VPL)調控左、右轉運動行為。通過有限元方法分析TI在小鼠VPL的聚焦性,利用數值計算獲得聚焦面積和體積,采用刺激器產生TI電流對小鼠VPL進行刺激,驗證TI刺激方法的有效性,進一步通過c-Fos免疫熒光實驗確定聚焦位置的準確性。結果表明,通過調整電極位置,當刺激電流達到800 μA時,TI刺激產生的電場能夠聚焦到VPL核團;小鼠能夠根據刺激位置進行相應的左、右轉;刺激后VPL核團c-Fos陽性細胞標記明顯增加。本研究證實了TI在動物運動行為調控中的可行性,為動物機器人提供了一種對腦組織無創的刺激方法。
引用本文: 朱浩然, 槐瑞托, 張平丘, 汪慧, 楊俊卿, 殷濤, 于志豪, 邵峰. 基于時間干涉的小鼠運動行為調控研究. 生物醫學工程學雜志, 2024, 41(2): 342-350. doi: 10.7507/1001-5515.202305032 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
運動行為調控研究廣泛應用于動物機器人控制,其基本原理是根據動物的神經生物學特點,選取能夠導致發生預期運動行為的相關腦區,利用適宜的人工電信號刺激所選腦區的適宜神經位點,導致動物發生相應的運動行為[1-2]。傳統調控方式是以植入電極的深部腦刺激方法進行的,在大鼠、鯉魚、鴿子等動物體均取得了較好的控制效果[3-6]。然而,長期電極植入及刺激引起的膠質細胞增生,會使得動物運動控制效果減弱或消失,同時也存在感染等傷害的局限[7-8]。因此,尋找新的對腦組織無創的調控方法具有重要意義。
在動物機器人非侵入式運動行為調控中,Pi等[9]利用多種刺激方式,將超聲波刺激源、表皮電極刺激和光輔助刺激相結合,控制了大鼠的基本運動行為;彭勇等[10-11]則利用光刺激裝置及光控實驗方法控制鯉魚機器人的轉向和前進行為;Kim等[12]通過光、電和食物獎勵等聯合刺激誘導形成操作式條件反射,完成對海龜運動行為的調控。上述研究主要為光源、超聲以及多種方式的結合刺激,刺激位置在皮層或外周感受器官。
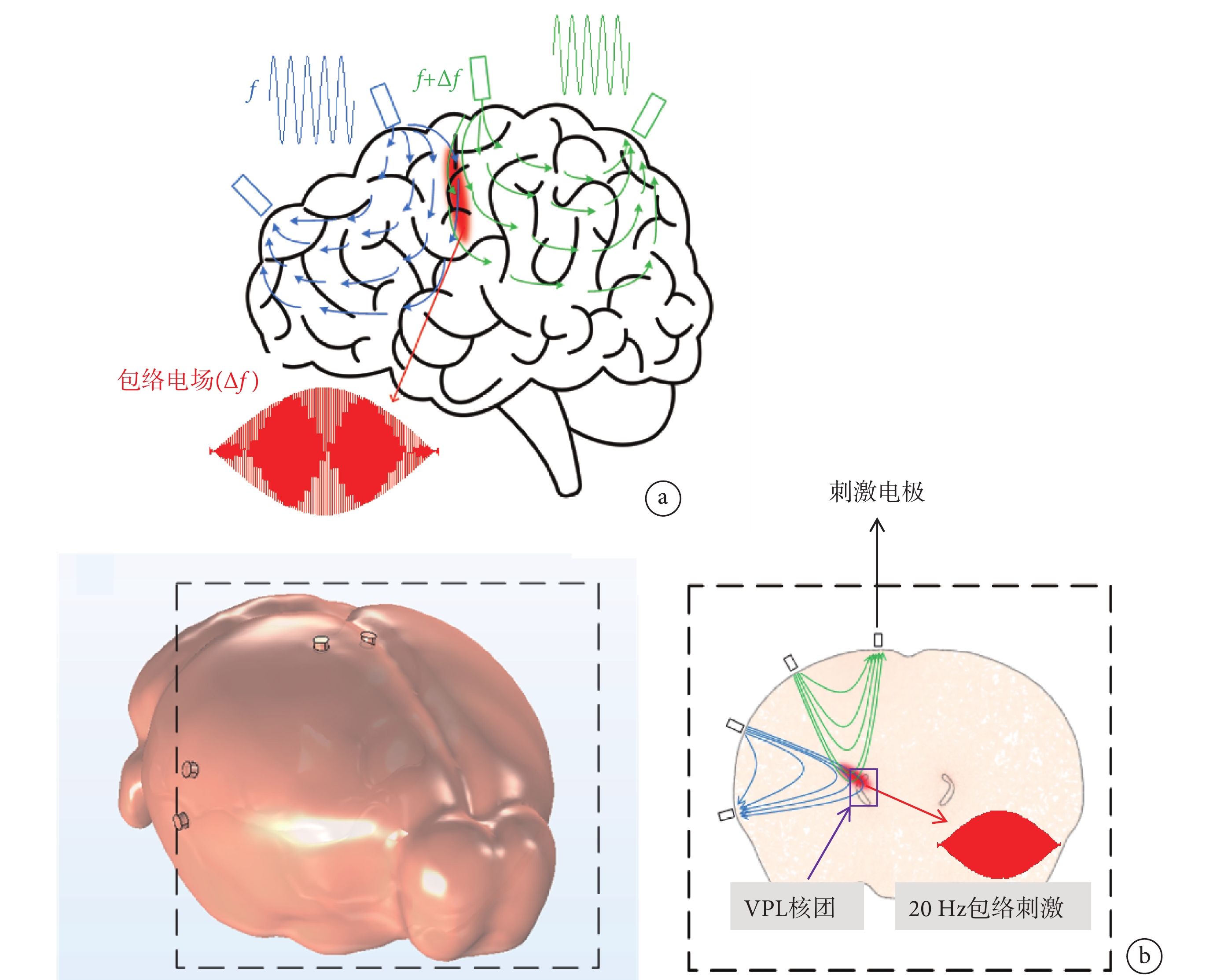
時間干涉(temporal interference,TI)是Grossman等[13]提出的一種新型非侵入性神經調控方式,該方法通過兩組流經組織的互不干擾的高頻交變電流產生的頻率差,改變作用區域神經元的活動(見圖1a),從而實現以無創方式調控深部腦區神經功能的目的。TI神經調控方法的提出引起了廣泛的關注,Rampersad等[14]通過TI方法注入總電流776 μA,在模擬的小鼠腦中可以產生383 V/m的電場強度。Gomez-Tames等使用多尺度小鼠模型計算研究,發現TI神經調控產生閾值隨著載波頻率的增加而增加,并且拍頻不影響閾值[15]。為了精確定位腦內的較小區域,Song等[16]提出了一種多通道TI策略,該策略使用多對電極,能夠產生多組干擾電場,通過嘗試不同的頻率進行動物實驗,成功激活了小鼠的運功皮層神經元。Missey等[17-18]使用方向可調的時間干擾方法(ot-TI)和激光驅動的無線TI方法,在小鼠海馬體(CA1、CA3)成功地喚起了具有快速放電特征頻率的癲癇事件。然而,當前對于TI刺激的研究都是在較大的核團中進行研究的,且核團的深度相對較淺。
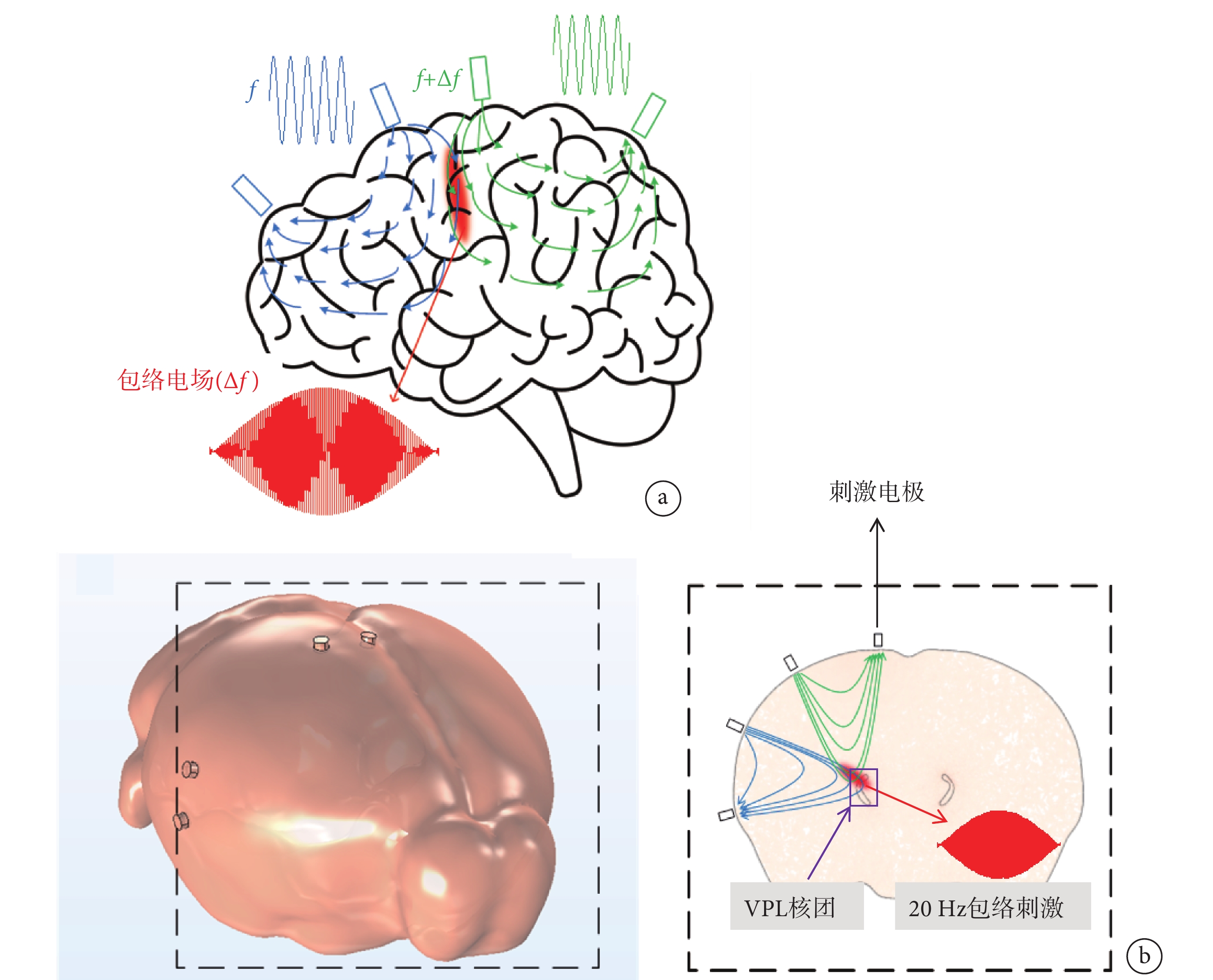 圖1
時間干涉刺激作用方式
圖1
時間干涉刺激作用方式
a. 時間干涉原理圖;b. 小鼠頭部模型以及VPL的截面原理圖
Figure1. Time interference stimulation mode of actiona. a principle diagram of temporal interference; b. a diagram of the mouse brain model and a cross-sectional of VPL
動物機器人研究中,采用丘腦腹后外側核(ventral posterolateral nucleus of the thalamus,VPL)能夠有效完成對動物的左、右轉運動行為調控。VPL核團的深度為4.1~4.6 mm,在此區域實現電場的聚焦和對動物運動行為的調控具有挑戰性。本研究通過仿真和動物實驗驗證TI神經調控方法的可行性。首先建立精確的小鼠頭部以及VPL模型,利用有限元方法計算TI刺激在小鼠頭部模型中電場大小和分布情況,運用數值計算的方法研究TI的聚焦性,以確定TI刺激是否精確定位到小鼠腦中體積較小、深度較深的VPL核團(見圖1b)。再結合仿真實驗,進行動物實驗驗證,并通過c-Fos免疫熒光實驗確定其聚焦位置。
1 方法
1.1 小鼠頭部模型和VPL模型構建
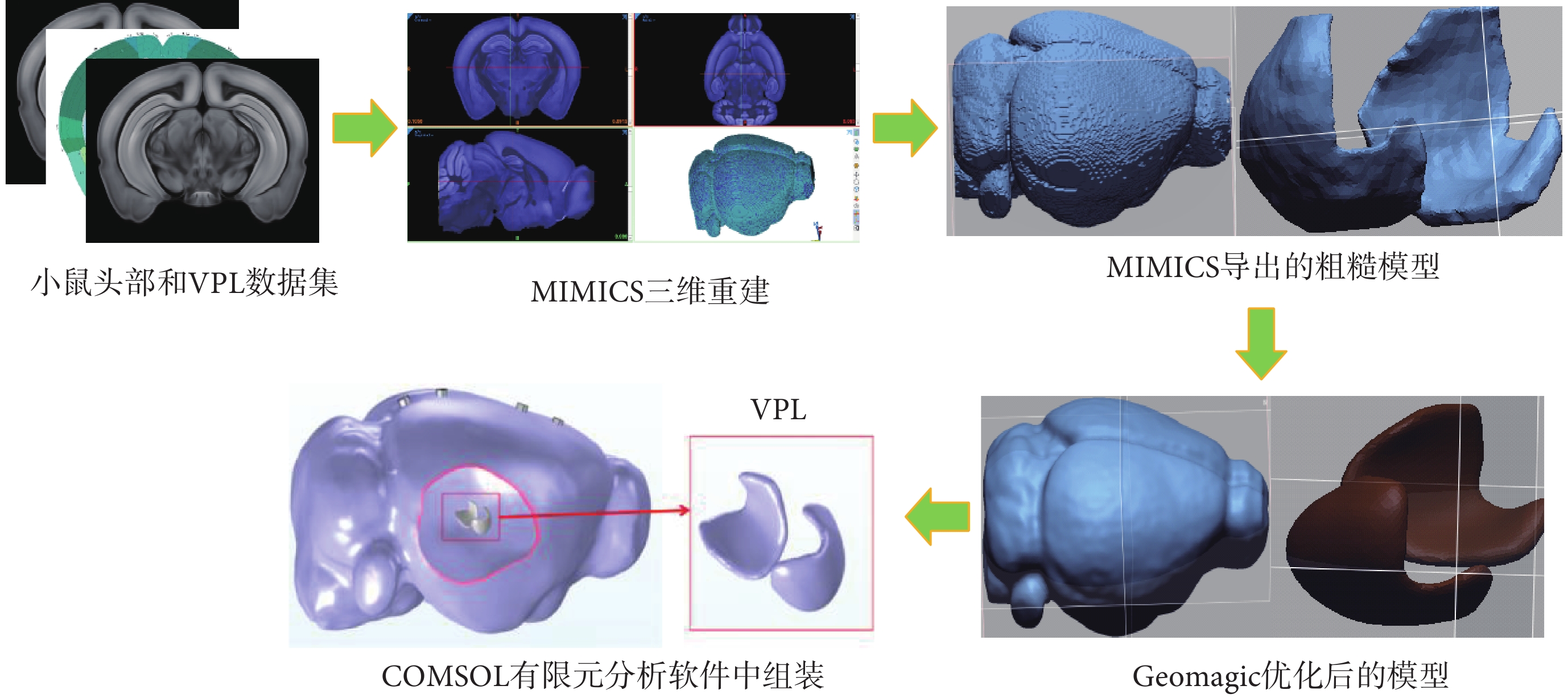
建立小鼠頭部和VPL模型使用的數據集來自Allen Brain Atlas研究機構[19]。將數據集圖片導入MIMICS軟件中,通過MASK指令重建小鼠頭部模型和VPL模型,對模型進行光滑處理后,再通過GeoMagic軟件對模型進行優化處理以滿足有限元分析要求。建立的頭部模型尺寸為19.21 mm × 16.20 mm × 11.70 mm,分辨率為10 μm。整體建模過程如圖2所示。
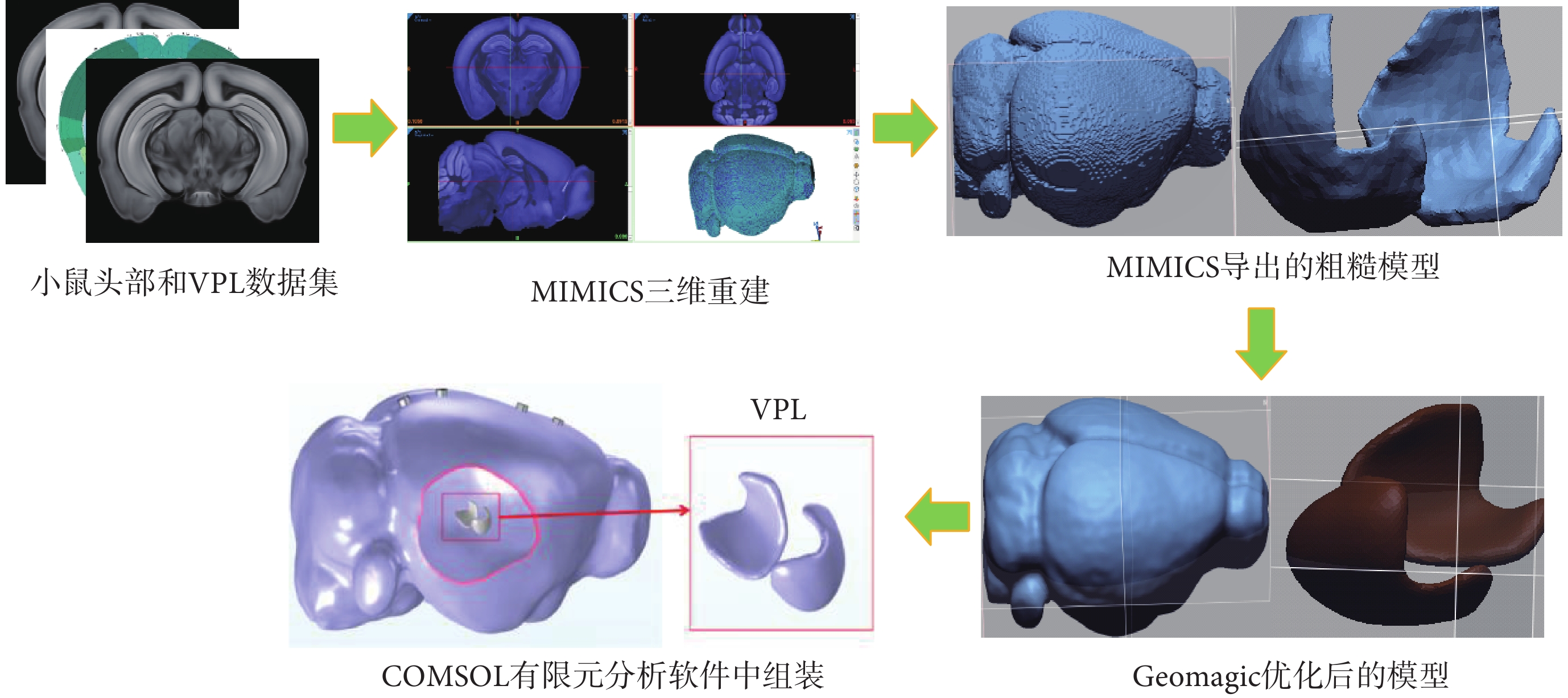 圖2
小鼠頭部模型和VPL模型的構建過程
Figure2.
Construction of mouse brain and VPL model
圖2
小鼠頭部模型和VPL模型的構建過程
Figure2.
Construction of mouse brain and VPL model
1.2 虛擬仿真方法
在COMSOL軟件中,將刺激電極和接地電極嵌入組織模型環境中,電極半徑為0.3 mm,高度為0.4 mm,以lambda點為坐標原點,將電極布置在小鼠腦表面上左右± 2 mm,從后到前依次為–0.3、1.7、4.7、6.7 mm。設置電極的電導率為6 × 106 S/m,小鼠腦部模型的電導率為0.333 S/m,兩組電極刺激參數(f1 = 2 kHz,f2 = 2.02 kHz,?f = 20 Hz),總刺激時間1 s,并以時間間隔為0.001 s產生一個仿真結果。
1.3 動物及手術
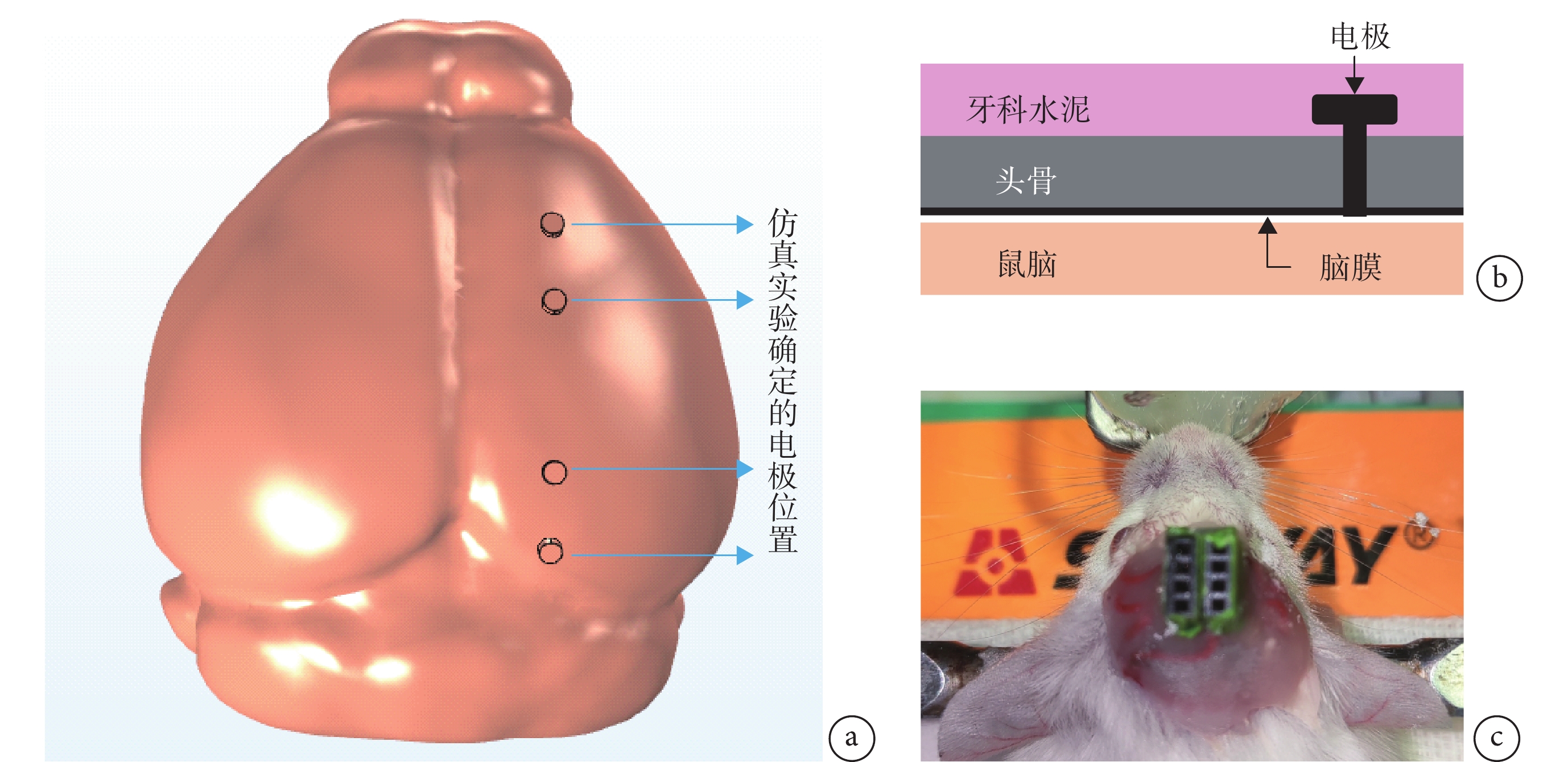
雄性昆明小鼠(8~10周,購于北京維通利華實驗動物有限公司),體重30~40 g,實驗前后均放置于透明籠中,房間溫度控制在(20 ± 3)℃。手術前12 h停止喂食,術前用10%的水合氯醛(400 mg/kg)腹腔注射麻醉。將小鼠固定在立體定位儀上,切開頭皮,分離兩側皮膚除去肌肉和骨膜。以lambda點為參考點,使用仿真得到的坐標將四個不銹鋼螺釘電極固定于顱骨,并用牙科水泥將與之相連的排母固定于顱骨(見圖3)。術后5~7 d,經檢查傷口愈合較好、無異常反應、各項生理參數均正常的小鼠,可進行TI刺激行為學實驗。
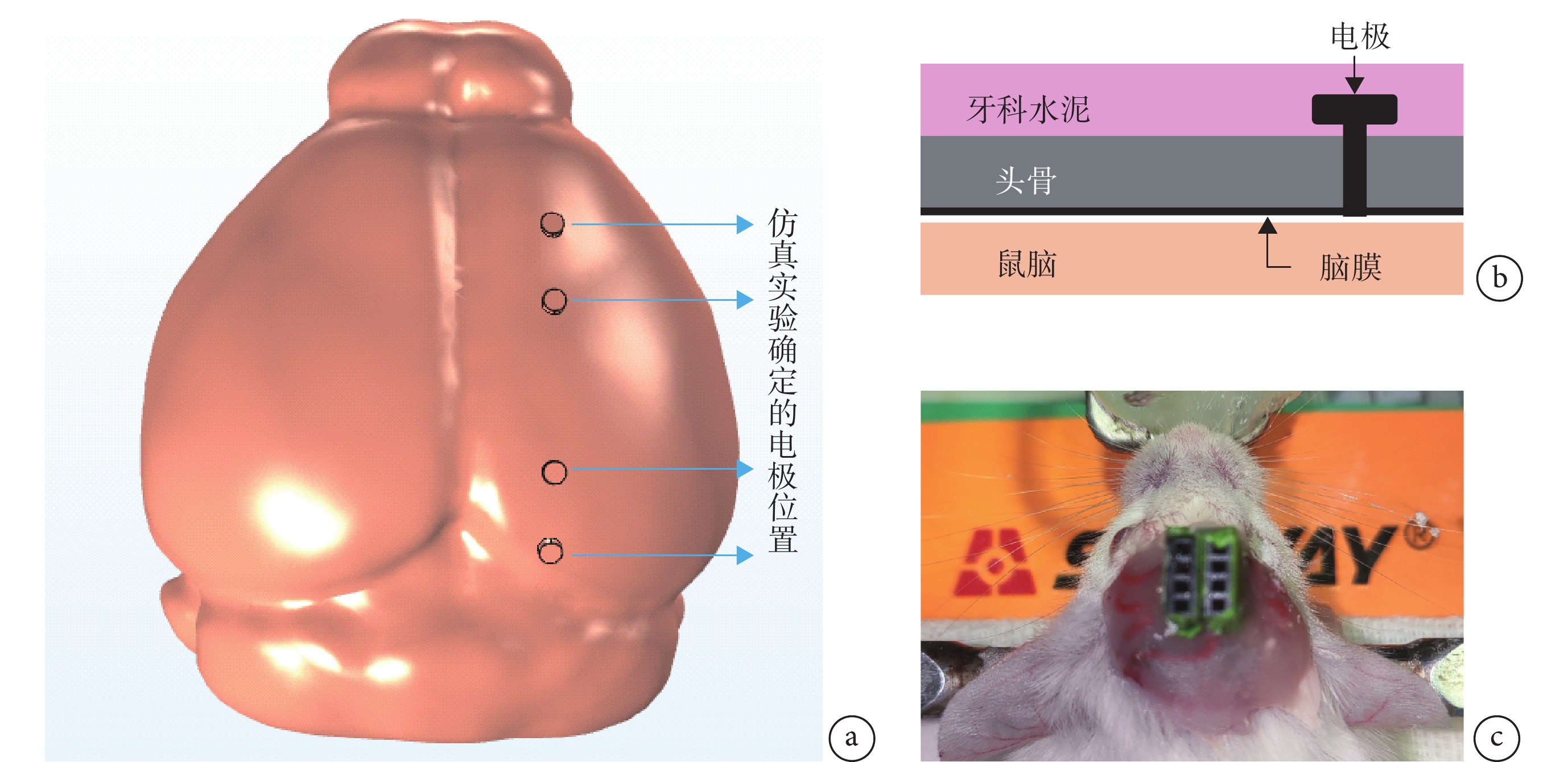 圖3
動物手術模型
圖3
動物手術模型
a. 仿真實驗確定的電極放置位置;b. 電極放置位置模式圖;c. 電極固定完成
Figure3. Animal surgical modela. electrode placement position determined by simulation experiments; b. electrode placement pattern diagram; c. electrode fixation completed
1.4 c-Fos免疫熒光實驗
選取小鼠的單側VPL核團進行TI刺激,另一側不刺激作為對照。以刺激10 s、停止刺激10 s的方式,刺激10 min,選取刺激轉向效果較好的小鼠進行后續實驗。刺激結束后2 h,使用10%水合氯醛對小鼠過量麻醉,灌流,固定,取腦,并將腦組織置于4%的多聚甲醛溶液中后固定4 h,然后依次移入含有15%和30%蔗糖的磷酸緩沖液(phosphate buffer solution,PBS)中進行梯度脫水。冰凍連續切片,厚度35 μm。
選取含有VPL核團的切片進行免疫熒光實驗,步驟如下(每個步驟完成后均使用PBS漂洗5次,每次5 min):① 含2%正常驢血清的PBS溶液常溫孵育2 h。② c-Fos兔單克隆抗體(1∶500),4 ℃孵育過夜。③ FITC(1∶500)標記的山羊抗兔IgG溶液,常溫避光4 h。④ DAPI溶液常溫避光10 min。反應結束后,將切片貼附于多聚賴氨酸處理的載玻片上,使用甘油和PBS(1∶1)溶液封片。通過熒光顯微鏡(LEICA,DMi8,德國)觀察,標記結果采用ImageJ軟件分析。
2 結果
2.1 TI刺激在VPL的聚焦性仿真
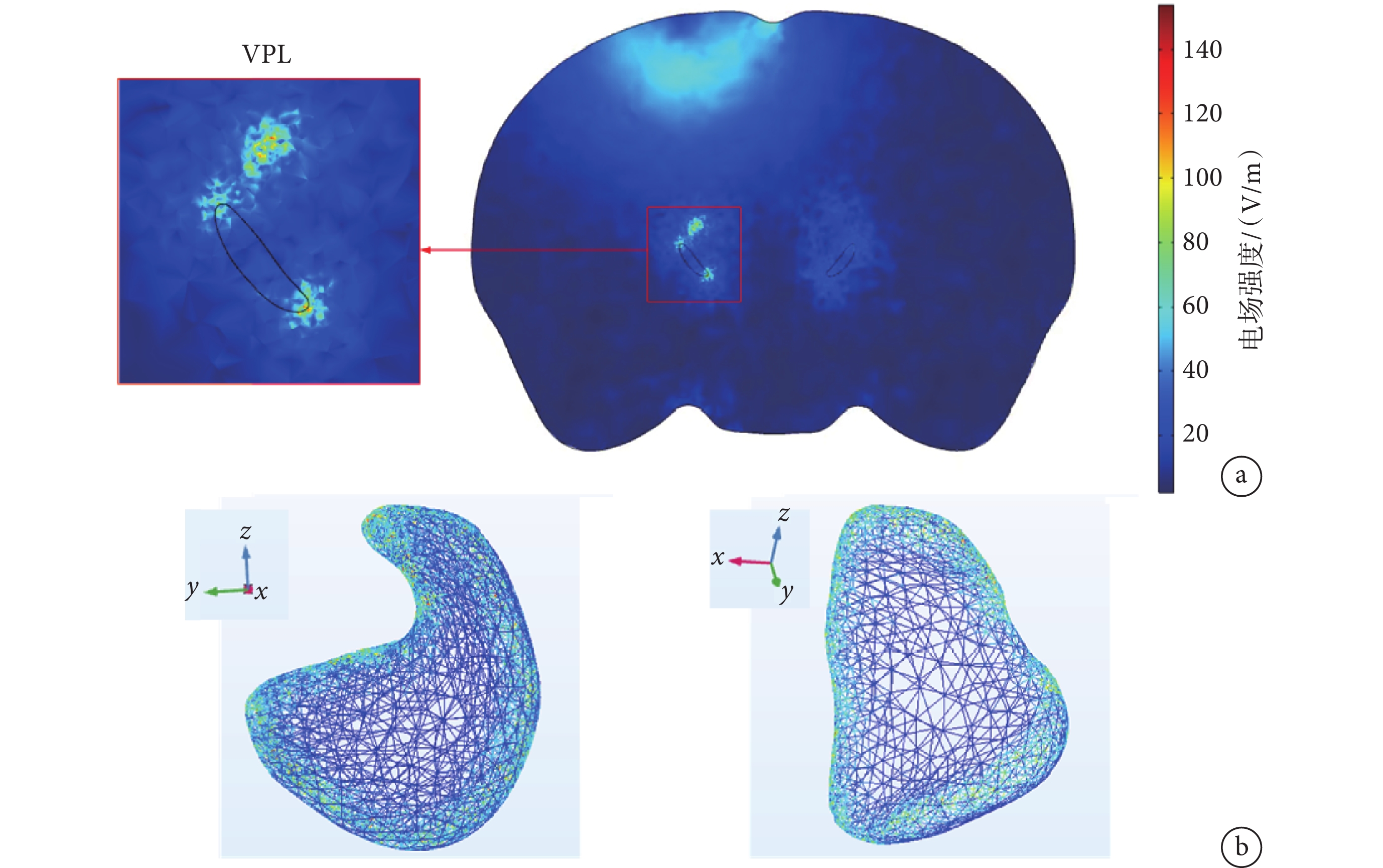
將注入電流以每組300 μA增加到1 000 μA(步長100 μA),觀察到電場聚焦位置由淺到深(見附件1),其中電流為800 μA時,在VPL核團邊界聚焦較好(見圖4a)。測得VPL處電場強度結果如表1所示,從表中數據可知,隨著電流的增加,聚焦的電場強度也隨之增加。小鼠頭部模型實驗結果表明,800 μA時在小鼠頭皮處的電場強度比較小(≤ 27.516 V/m),在VPL核團邊界處的電場強度較大,并且在1 s時VPL核團邊界處最大電場可以達到153.667 V/m。
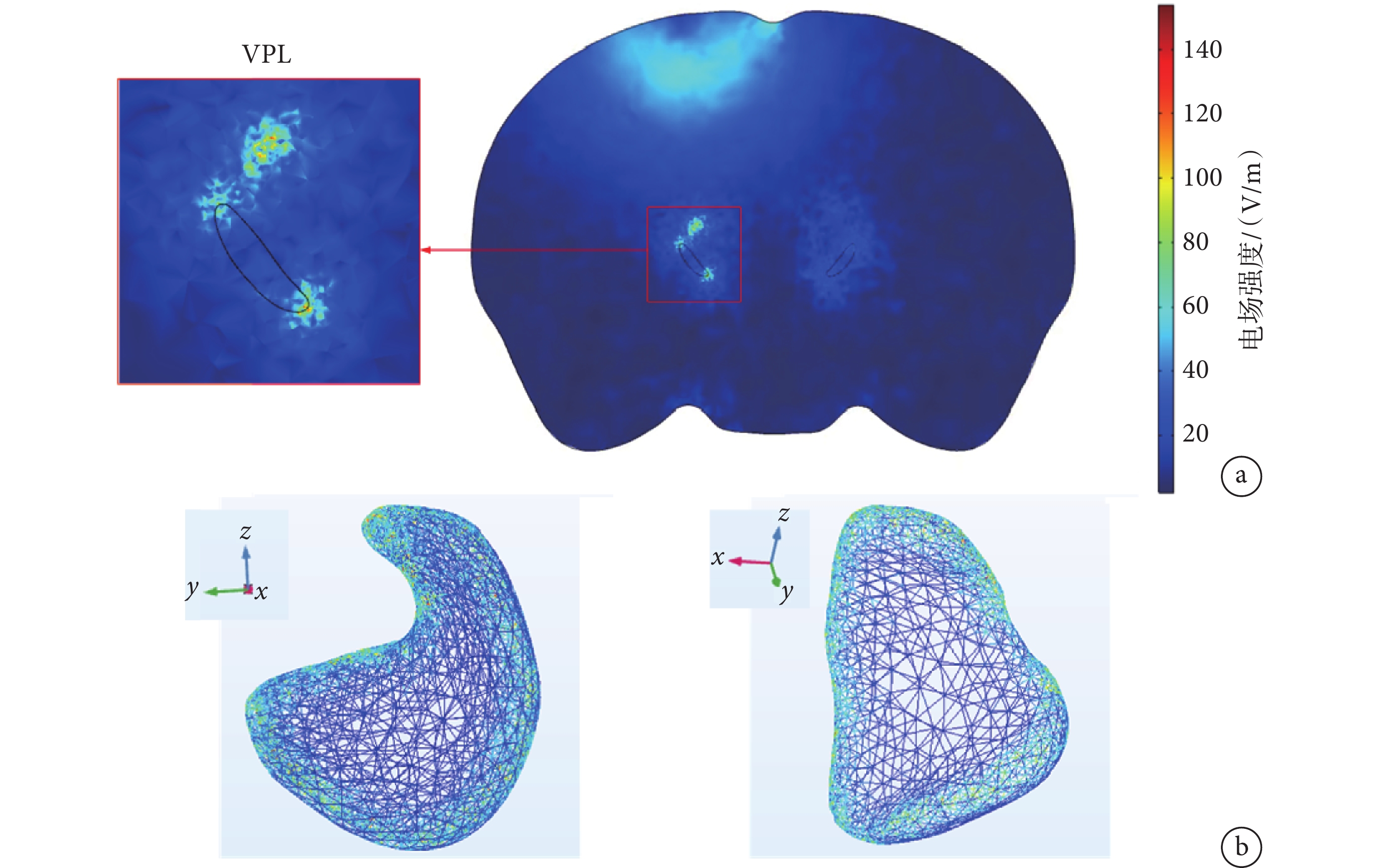 圖4
電場在VPL核團處聚焦效果
圖4
電場在VPL核團處聚焦效果
a. 二維平面圖以及VPL處局部放大圖;b. VPL核團表面電場分布圖
Figure4. Focusing effect of electric field on VPL nucleia. two-dimensional plan view and partial enlargement at VPL; b. surface electric field distribution map of VPL nuclear clusters
二維圖像(見圖4a)只能反映一個截面的聚焦分布,無法直觀反映電場在VPL核團實際的電場聚焦分布情況。為此,通過三維模型呈現了VPL核團表面的電場聚焦情況(見圖4b)。通過二維-三維的TI聚焦分布情況可以觀察到,在VPL核團周邊產生的包絡電場強度較高,在核團內部產生的電場強度較低,這與Missey等[17]的結果一致。
2.2 聚焦性計算
TI神經調控聚焦性的評判主要包括刺激強度、刺激深度、聚焦面積等幾個方面[18, 20]。本研究中,刺激強度為聚焦位置的最大電場強度,實驗中采用了800 μA的注入電流,通過小鼠模型仿真實驗,得到VPL邊界周圍的最大電場強度 為153.667 V/m。Koponen等[21]使用了超出最大電場值的
為153.667 V/m。Koponen等[21]使用了超出最大電場值的 部分來定義聚焦點的體積,這種聚焦性的定義方法適用于最大刺激在明確目標區域內的情況。從仿真二維平面結果可以觀察到本實驗的聚焦范圍在VPL核團組織附近,因此采用該方法進行聚焦性的數值計算。刺激深度表征TI刺激在小鼠腦內部的穿透能力,計算頭皮位置與感應電場強度為
部分來定義聚焦點的體積,這種聚焦性的定義方法適用于最大刺激在明確目標區域內的情況。從仿真二維平面結果可以觀察到本實驗的聚焦范圍在VPL核團組織附近,因此采用該方法進行聚焦性的數值計算。刺激深度表征TI刺激在小鼠腦內部的穿透能力,計算頭皮位置與感應電場強度為 的最大距離表示刺激深度
的最大距離表示刺激深度 ,通過坐標位置的計算得到本研究中的
,通過坐標位置的計算得到本研究中的 為4.52 mm,該深度在VPL深度范圍之內。聚焦面積計算公式如下:
為4.52 mm,該深度在VPL深度范圍之內。聚焦面積計算公式如下:
 |
式中 表示聚焦面積;
表示聚焦面積; 表示半值體積,指暴露在大于或等于
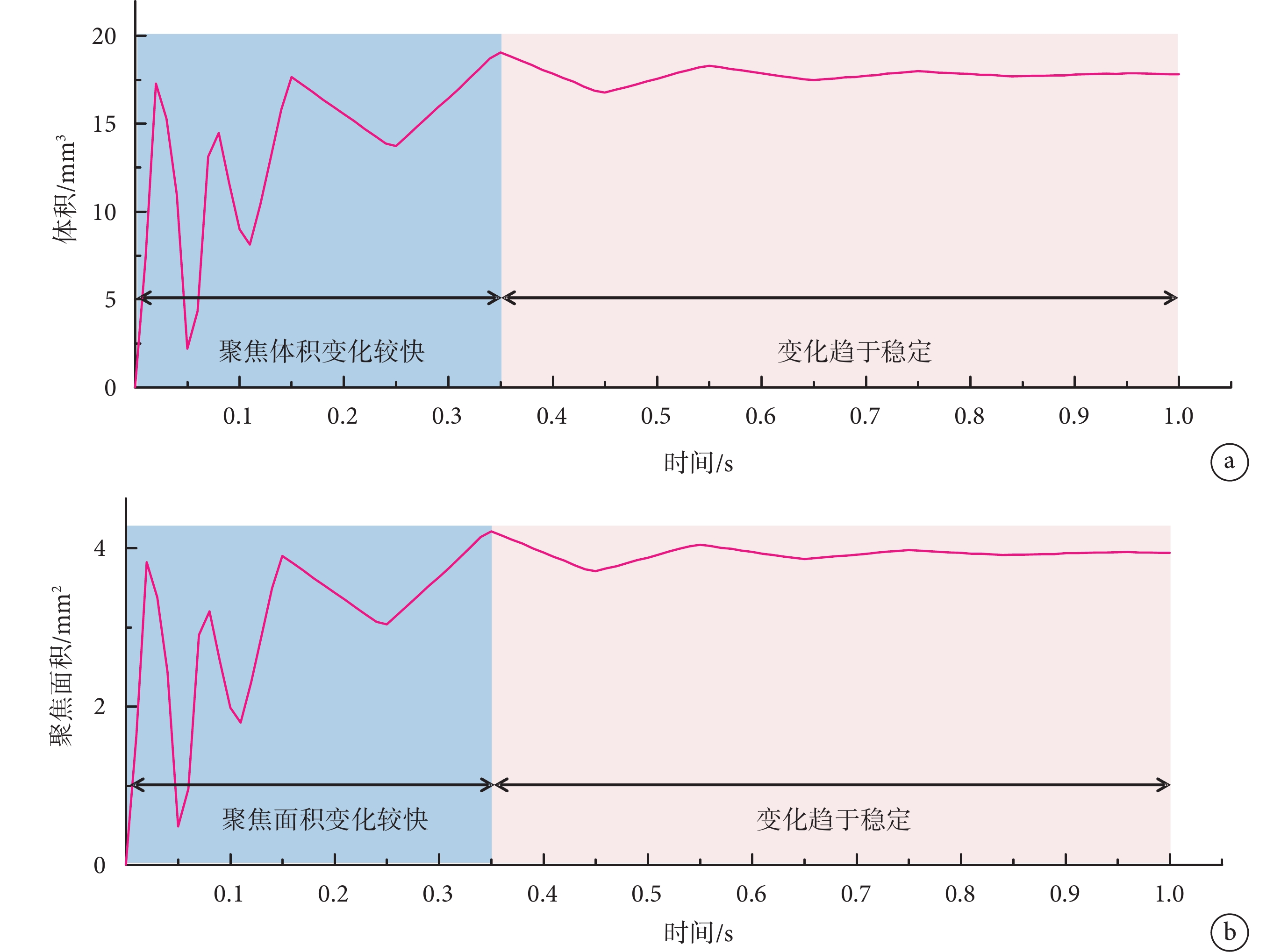
表示半值體積,指暴露在大于或等于 中的腦區域的體積。通過COMSOL軟件算出小鼠模型中每個時間點的半值體積,如圖5a所示,計算出的聚焦體積
中的腦區域的體積。通過COMSOL軟件算出小鼠模型中每個時間點的半值體積,如圖5a所示,計算出的聚焦體積 最大值為19.1 mm3,根據式(1)可以計算出聚焦面積
最大值為19.1 mm3,根據式(1)可以計算出聚焦面積 的最大值為4.22 mm2;1 s時聚焦體積
的最大值為4.22 mm2;1 s時聚焦體積 為17.81 mm3,1 s時聚焦面積
為17.81 mm3,1 s時聚焦面積 為3.94 mm2。聚焦面積隨時間的變化如圖5b所示。從聚焦面積和體積隨時間變化的曲線圖可知,聚焦性在0.35 s之前變化較大,而在0.80 s以后聚焦面積和體積數值趨于穩定,故仿真實驗中設計刺激時長為1 s可以滿足實驗的要求。
為3.94 mm2。聚焦面積隨時間的變化如圖5b所示。從聚焦面積和體積隨時間變化的曲線圖可知,聚焦性在0.35 s之前變化較大,而在0.80 s以后聚焦面積和體積數值趨于穩定,故仿真實驗中設計刺激時長為1 s可以滿足實驗的要求。
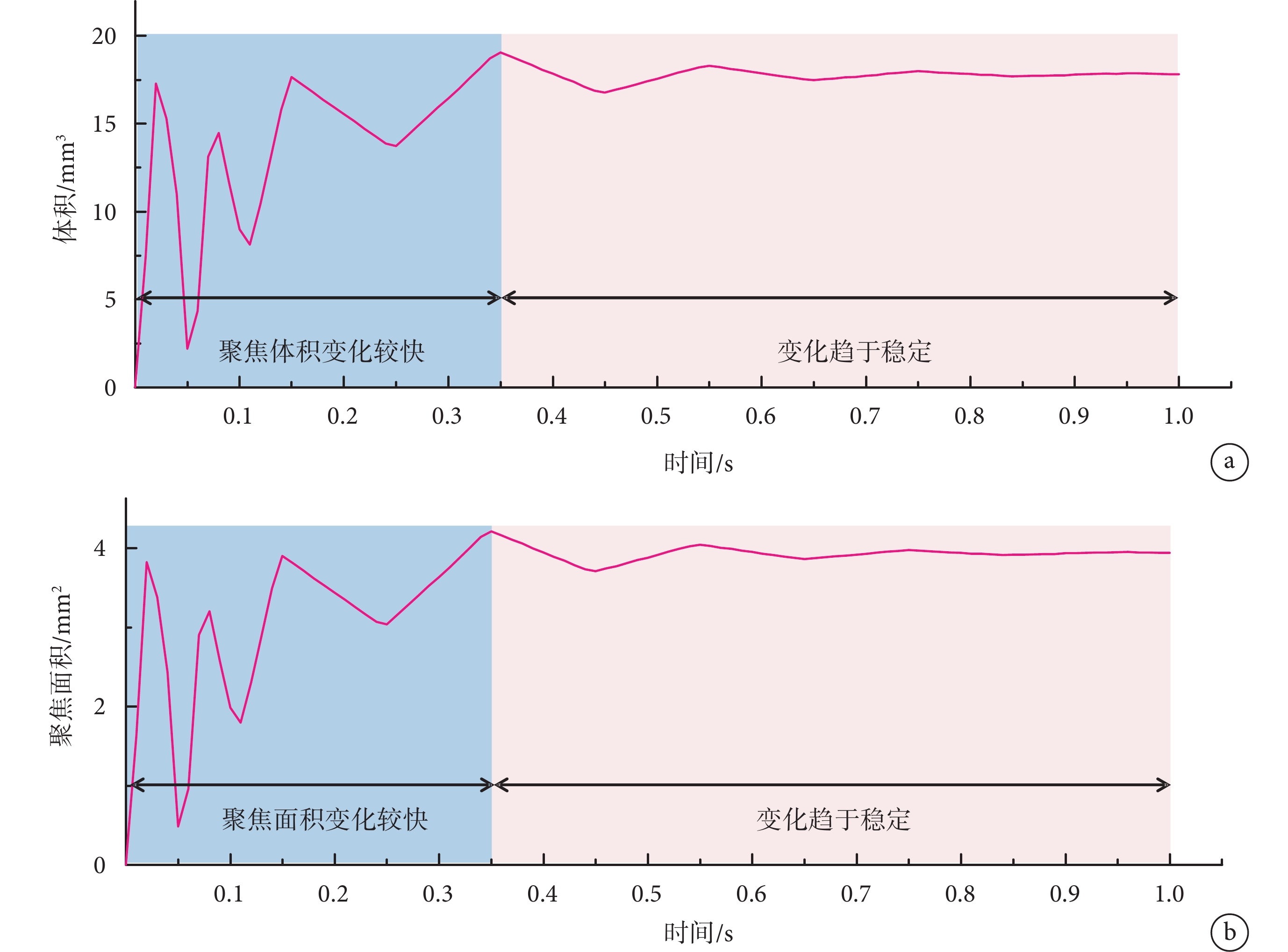 圖5
聚焦體積和聚焦面積變化趨勢圖
圖5
聚焦體積和聚焦面積變化趨勢圖
a. 體積變化圖;b. 面積變化圖
Figure5. Change trend in focus volume and focus areaa. volume change chart; b. area change chart
通過COMSOL軟件可以計算出單個VPL核團模型的表面積為3.5946 mm2,數值計算得出的聚焦面積比單個核團的表面積略大,這可能是在計算時把VPL核團周圍的部分電場計算在內。
2.3 小鼠刺激結果
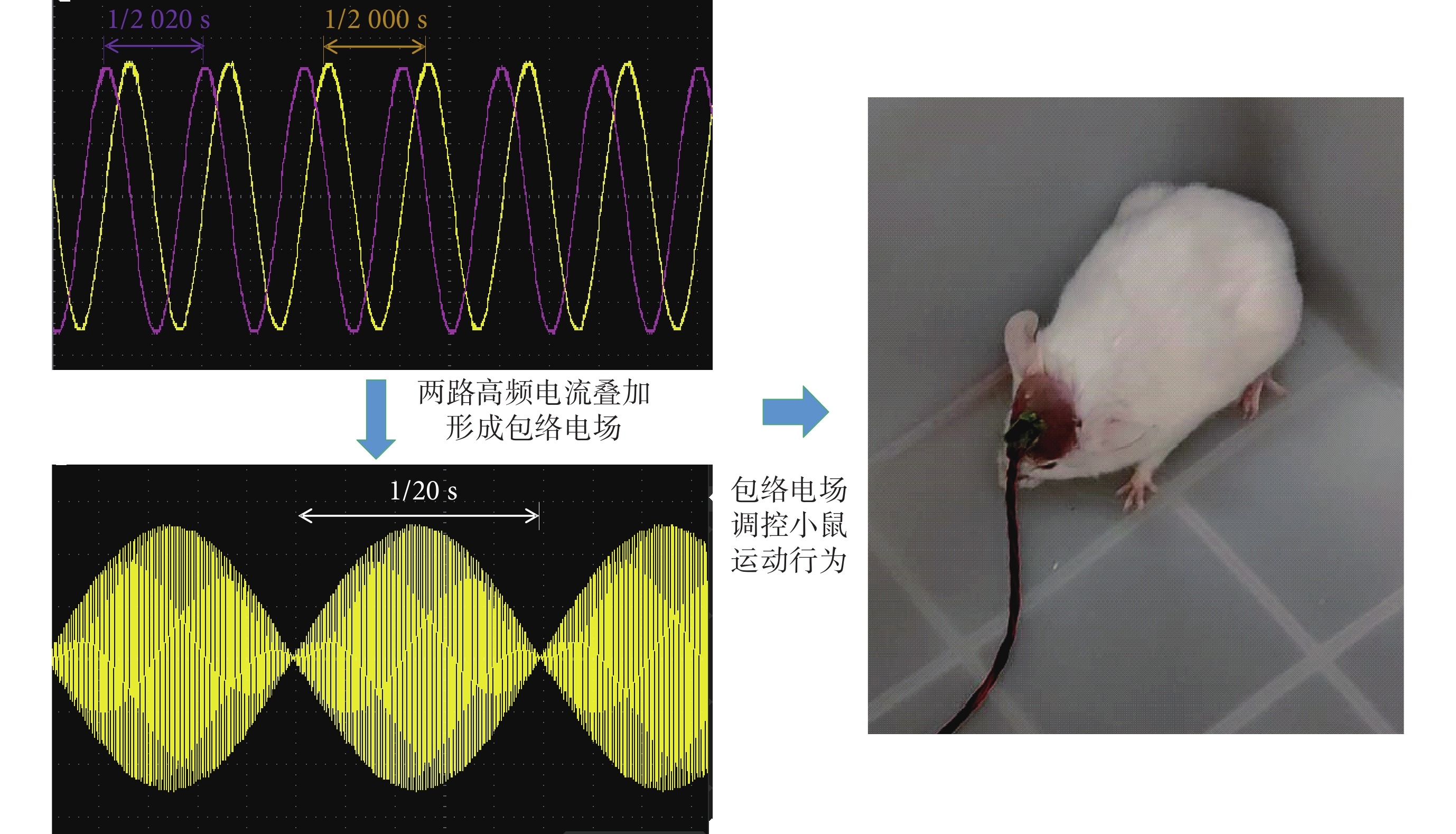
通過兩個刺激器(成都儀器廠,RM6240E/EC多道生理信號采集處理系統,中國)產生一組頻率為2 kHz、另一組為2.02 kHz,電流大小同為800 μA可調的TI刺激進行動物實驗驗證。將刺激器連接到小鼠頭部固定電極,施加TI刺激調控小鼠的運動行為(見圖6)。為了驗證TI刺激對小鼠的控制效果,本研究分別在10只小鼠中進行了雙側VPL刺激實驗。
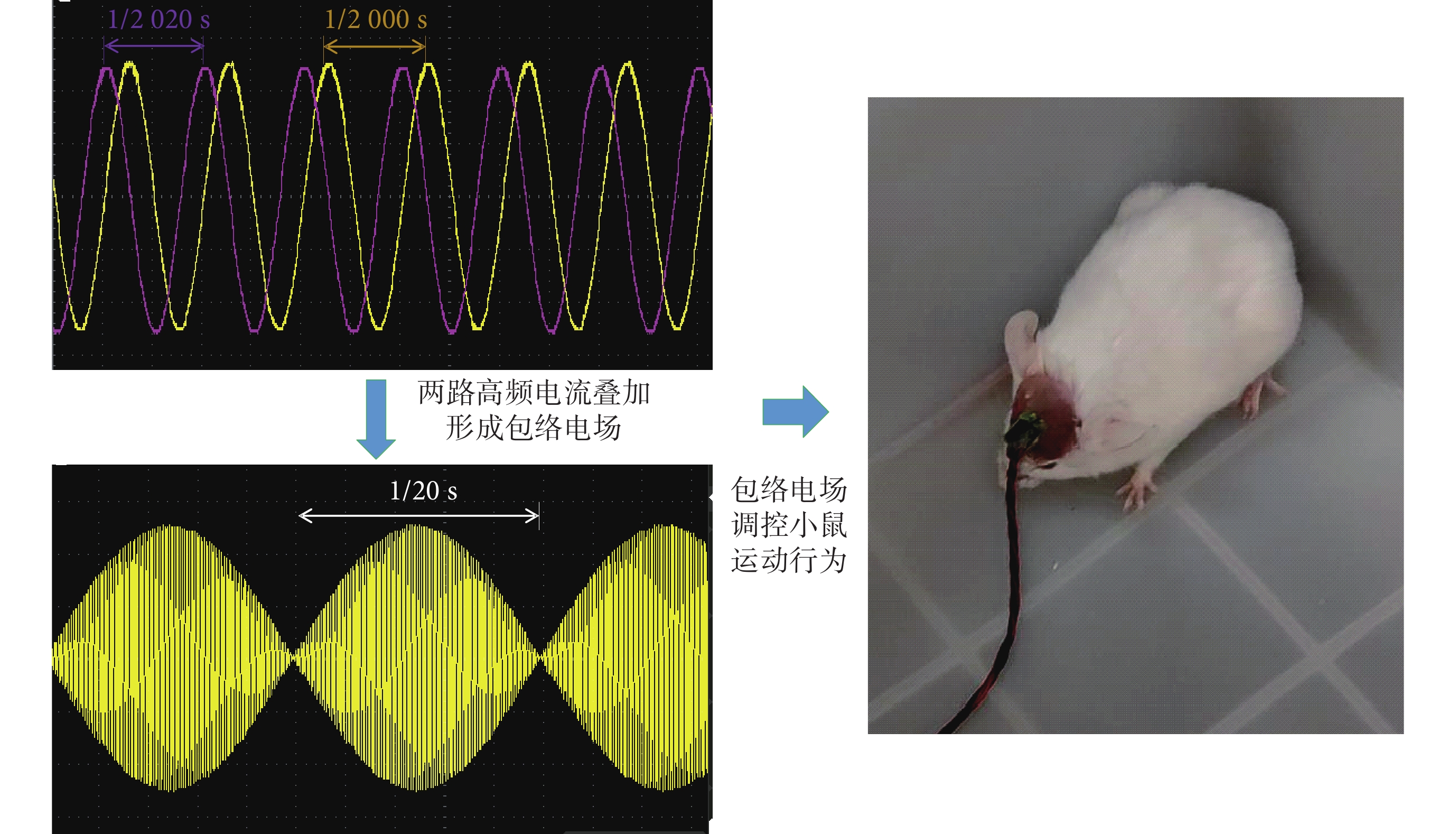 圖6
RM6240E系統形成包絡電場刺激小鼠
Figure6.
RM6240E systems form an enveloping electric field to stimulate mice
圖6
RM6240E系統形成包絡電場刺激小鼠
Figure6.
RM6240E systems form an enveloping electric field to stimulate mice
分別刺激10只小鼠左、右兩側VPL各20次,其中有8只成功地完成了左、右轉向調控(以轉向成功率達到80%為標準),實驗成功率80%。為了達到理想的調控效果,不同小鼠實驗時施加的電流略不同,變動范圍750~850 μA,小鼠刺激實驗施加電流和轉向成功率如表2所示。動物左、右轉向調控視頻見附件2~3。
2.4 c-Fos熒光反應實驗結果
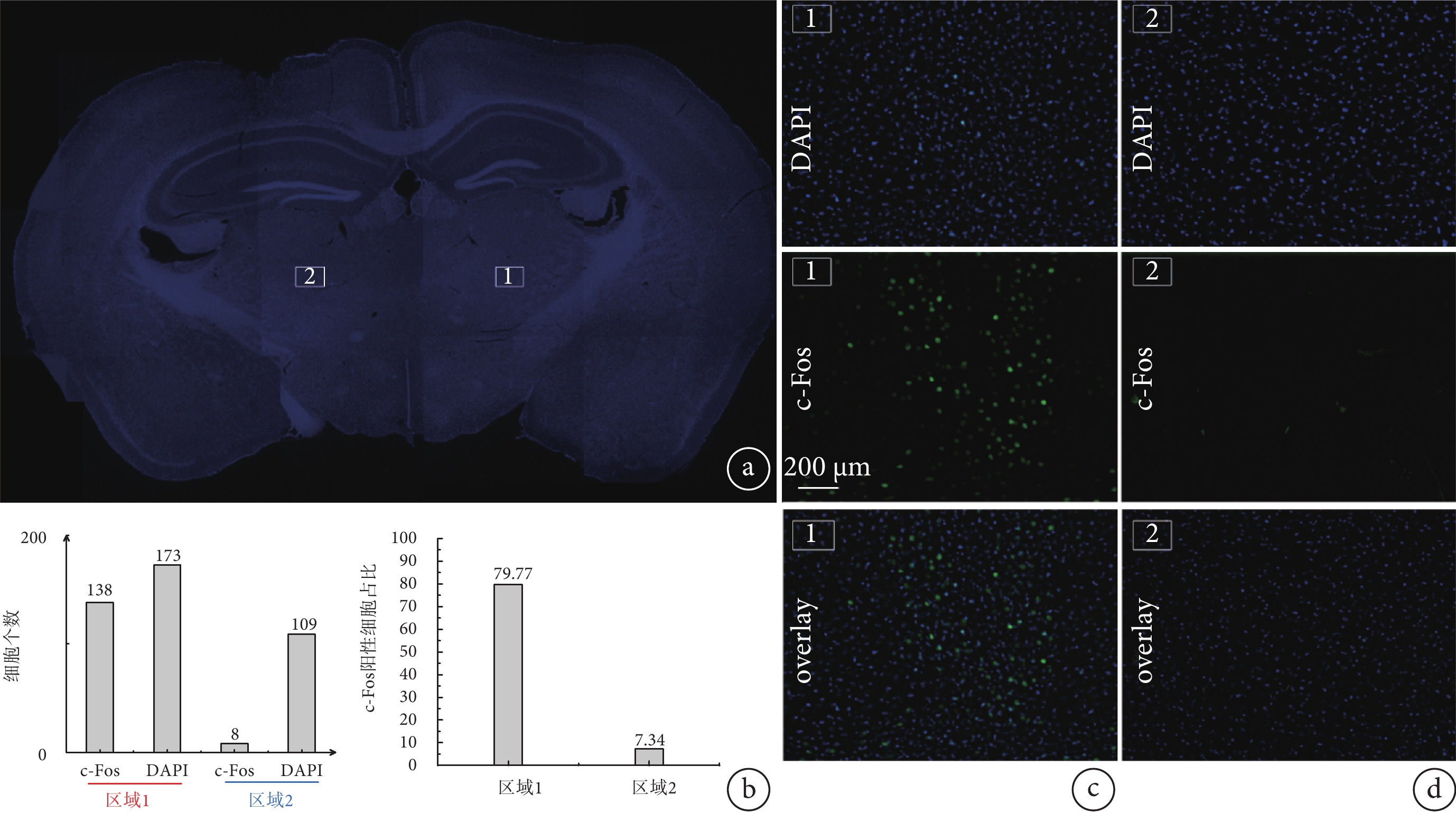
對采集的圖像進行分析,將同一位置的DAPI細胞染色圖像和c-Fos陽性細胞圖像重合,如圖7所示,1號VPL刺激區域的c-Fos陽性細胞較多,并且幾乎與DAPI細胞重疊。2號對照區域的c-Fos陽性細胞較少,在重疊圖像中幾乎看不到與DAPI的重疊。使用ImageJ軟件對細胞進行計數,如圖7b所示,1號區域c-Fos陽性細胞占比為79.77%,遠遠高于2號區域的7.34%。從c-Fos陽性細胞占比數據以及重疊圖像中,可以直觀地發現刺激區域與非刺激區域的差別。
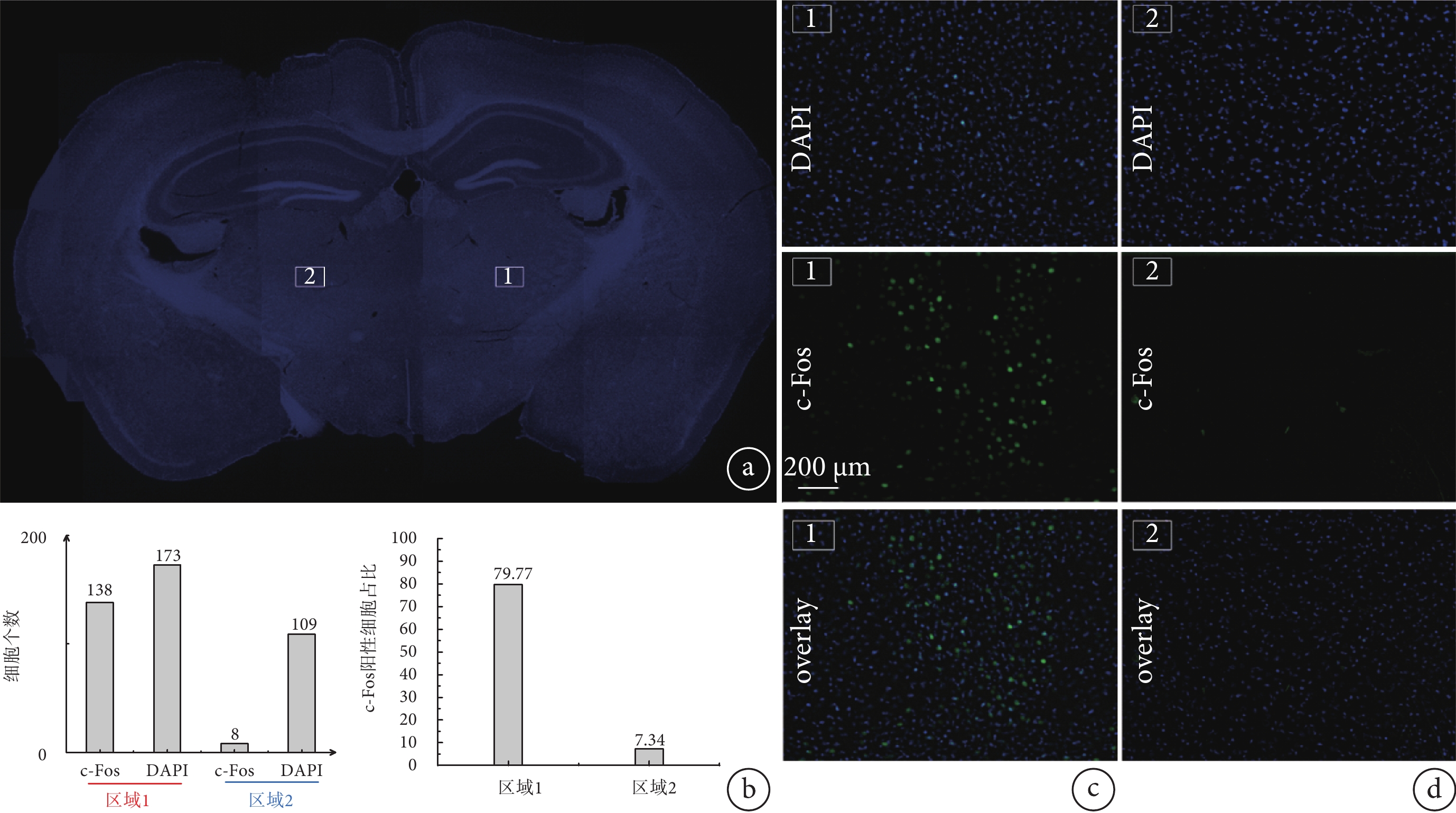 圖7
c-Fos反應對比結果
圖7
c-Fos反應對比結果
a. 熒光顯微鏡下采集的小鼠腦切片整體圖;b. 區域1和區域2采集的DAPI、c-fos陽性細胞個數統計圖以及c-fos陽性細胞占比對比圖;c. 1號刺激區域DAPI、c-fos陽性細胞及其疊加圖;d. 2號未刺激區域DAPI、c-fos陽性細胞及其疊加圖
Figure7. Comparison of c-Fos reaction resultsa. overall view of a mouse brain section collected under fluorescence microscope; b. statistical graphs of the number of DAPI and c-fos positive cells collected from regions 1 and 2 and the comparison of the percentage of c-fos positive cells; c. DAPI, c-fos-positive cells and their merged image on the map of stimulation region #1; d. DAPI, c-fos-positive cells and their merged image on the map of unstimulated region #2
為驗證TI神經調控刺激方法作用的區域,本文對電極下方的皮層區域Ⅰ和Ⅱ以及偏離電極的VPL核團Ⅲ、皮層區域Ⅳ分別采集圖像,發現區域Ⅰ、Ⅱ、Ⅳ無明顯c-Fos陽性細胞,而VPL核團Ⅲ附近陽性細胞較多(具體圖示見附件4)。這與TI神經調控刺激原理相吻合,即TI神經調控刺激方法不會作用于電極周邊的皮層區域,而是聚焦到特定的腦區發揮作用。
3 討論
已有的TI刺激大多以動物的海馬體(CA1-CA3)或其他淺層腦區作為靶點[18-19],實現特定功能的調控。Missey等以50 μA為步長增加刺激電流,實現了TI刺激小鼠海馬體誘發癲癇事件;Zhang等通過TI成功激活大鼠的初級運動皮層。根據動物機器人的調控原理,本文選取能夠引起小鼠左、右轉行為的VPL核團。相比于已有研究,VPL核團深度更深,體積小,TI刺激聚焦到該腦區具有一定挑戰性。本文將刺激電流大小以100 μA為步長從每組300 μA開始逐漸遞增,直到出現良好的聚焦性為止。仿真結果發現電流強度在300~500 μA時,包絡電場在皮層區域聚焦,并且隨著電流強度的增加,聚焦深度和電場強度也在逐漸增加;當電流增加到每組600 μA時,在鼠腦VPL核團周邊出現良好的聚焦性,繼續提高電流強度,聚焦深度不再增加,僅聚焦位置的電場強度不斷增大。表1記錄了不同電流強度下,所產生的最大電場值,結合附件1可知包絡電場能夠聚焦到深度較深的VPL核團處,通過仿真實驗與動物實驗結合,發現電流強度在800 μA時能夠實現小鼠左右轉控制,當電流繼續增大時,則會引起小鼠痙攣反應。因此,文中刺激實驗采用了800 μA左右的電流強度進行調控測試。
為了更直觀地獲得TI刺激位置的數據,本文通過二維和三維圖像和數值計算進一步優化了聚焦結果。Missey等建立的模型可以從三維模型中看到電場線的表達,由二維平面結果反映場強大小。在此基礎上,本文通過二維平面結果進行數值運算,可以計算出TI電場作用的深度和聚焦性,通過三維模型可以觀察到TI產生的電場在VPL核團周圍的表達結果,并發現電場集中在VPL核團邊界。本研究采用Koponen等[21]的方法,計算了TI刺激方法聚焦的深度為4.52 mm,在VPL實際深度范圍中;同時計算了聚焦面積為3.94 mm2,該數值與實際VPL核團的截面積接近。仿真和數值計算結果驗證了TI刺激聚焦到VPL核團的可行性。
已有的動物機器人運動行為調控研究大部分為植入式電極刺激,Huai等[22]對10只大鼠進行了測試,其中8只可以按照指定的路線進行引導。2只大鼠因電極植入不準確未能得到有效控制,刺激成功率達到80%。該團隊另一項研究[23]中指出控制大鼠的成功率可達90%。王浩等[24]對鴿子的運動行為調控成功率為90%。本文在TI調控小鼠運動行為的實驗中,對10只小鼠進行實驗,其中有8只小鼠能夠根據刺激指令進行左、右轉,成功率達到80%,與植入式電極刺激方式相當。
非侵入式刺激調控生物機器人目前主要集中在刺激表層腦區及光控動物外部視覺誘導方面。Pi等[9]針對大鼠機器人,利用超聲波刺激其聽覺、表皮電極刺激其痛覺及LED燈光輔助刺激器刺激其視覺,從而控制動物運動行為。Kim等[12]采用LED刺激誘導,并通過反復的刺激-獎勵交互形成操作式條件反射,完成對海龜運動行為的調控。彭勇等[11]提出了一種用于鯉魚機器人的光刺激裝置及光控實驗方法,誘導鯉魚在水迷宮中完成轉向和前進動作,且不同波長的光對運動速度產生了不同的影響。TI作為一種可聚焦到腦內深部核團的神經調控方法,近年來引起了廣泛關注[25-27],本文通過模型驗證了TI刺激小鼠VPL核團的可行性,在此基礎上,提出了TI刺激調控動物機器人的一種新方法,并完成了對小鼠左、右轉向行為的控制。盡管本文已經驗證了TI刺激深部腦區對動物運動行為調控的可行性,但要想達到完全的非侵入式TI刺激,需要對小鼠頭部模型中的顱骨、頭皮等部位深入建模,這也是下一步需要開展的工作之一。此外,對于動物機器人應用而言,多個神經核團同時刺激以調控不同運動行為以及TI遙控刺激系統兩方面的工作也需要進一步探索。
本研究采用即刻早期基因c-Fos來標記刺激后VPL核團周圍的神經激活情況,驗證TI在腦內的聚焦效果。通過細胞計數發現,VPL靶區激活神經元數與總神經元數的比值為79.77%,非靶區激活神經元數為7.34%,刺激區域與非刺激區域神經元激活數存在明顯的差異。Song等將TI神經調控后的小鼠腦進行切片,通過免疫熒光標記觀察c-Fos的表達[16],研究發現,靶區激活神經元數與總神經元數的比值為82.4%,非靶區激活神經元數為18.2%,該研究中靶區和非靶區中激活神經元數占比略高于本研究,可能與靶向深度或抗體的敏感性有關。c-Fos免疫反應實驗并非驗證TI刺激效果的唯一方法,通過采集小鼠特定位點的場電位信號也可以體現TI刺激產生的電場在小鼠腦內引起的反應[16-17],在刺激后使用肌電信號及時觀察動物的響應也是一種無損且實時的評價方式。為了從多方面驗證TI刺激方法在動物運動行為調控中的應用效果,在今后的研究中,將繼續探索TI刺激后特定腦區場電位或特定肌肉的電信號變化,通過實時分析電信號有效評價動物對TI刺激的反應。
4 結論
本文通過TI刺激方法聚焦到腦內深度較深、體積較小的VPL核團,從而調控小鼠左、右轉向的運動行為。首先,仿真和數值計算方法證實了TI方法聚焦的有效性。通過調節電極放置的位置和電流強度大小將包絡電場聚焦到VPL核團,確定了當電流為800 μA時電場聚焦性良好。通過數值計算方法,得出聚焦深度為4.52 mm,該深度在VPL核團深度范圍之內,同時計算出聚焦面積在0~0.35 s時波動較大,在0.80 s后趨于穩定,為3.94 mm2,此面積較小,能夠聚焦到VPL核團。其次,動物實驗證明了TI方法能夠有效調控小鼠左、右轉向的運動行為。在小鼠實驗中,根據數值模擬實驗確定的顱骨位置放置電極,施加的電流強度為800 μA,發現小鼠能夠根據控制指令進行相應的左、右轉向行為。最后,c-Fos熒光反應實驗驗證了小鼠實驗中TI聚焦的位置為VPL核團。在c-Fos熒光反應實驗中,能夠從腦切片上觀察到VPL核團附近的c-Fos陽性細胞較多,而小鼠淺層區域以及非刺激區域的c-Fos陽性細胞較少。結果表明,TI刺激能夠聚焦到VPL核團,并調控小鼠左、右轉向的運動行為。本文為動物機器人運動行為調控提供了一種對腦組織無創的刺激方法。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:朱浩然負責實驗平臺搭建,論文撰寫、修訂。于志豪負責實驗設計與指導。張平丘、殷濤負責動物實驗手術及數據記錄。汪慧負責動物實驗設計與分析。楊俊卿負責實驗平臺指導與維護。槐瑞托負責研究計劃安排、實驗指導、論文審閱修訂。邵峰負責提供動物及實驗規范性指導。
倫理聲明:本研究通過了山東本明生物科技股份有限公司動物倫理委員會的審批。
本文附件見本刊網站的電子版本(biomedeng.cn)。
0 引言
運動行為調控研究廣泛應用于動物機器人控制,其基本原理是根據動物的神經生物學特點,選取能夠導致發生預期運動行為的相關腦區,利用適宜的人工電信號刺激所選腦區的適宜神經位點,導致動物發生相應的運動行為[1-2]。傳統調控方式是以植入電極的深部腦刺激方法進行的,在大鼠、鯉魚、鴿子等動物體均取得了較好的控制效果[3-6]。然而,長期電極植入及刺激引起的膠質細胞增生,會使得動物運動控制效果減弱或消失,同時也存在感染等傷害的局限[7-8]。因此,尋找新的對腦組織無創的調控方法具有重要意義。
在動物機器人非侵入式運動行為調控中,Pi等[9]利用多種刺激方式,將超聲波刺激源、表皮電極刺激和光輔助刺激相結合,控制了大鼠的基本運動行為;彭勇等[10-11]則利用光刺激裝置及光控實驗方法控制鯉魚機器人的轉向和前進行為;Kim等[12]通過光、電和食物獎勵等聯合刺激誘導形成操作式條件反射,完成對海龜運動行為的調控。上述研究主要為光源、超聲以及多種方式的結合刺激,刺激位置在皮層或外周感受器官。
時間干涉(temporal interference,TI)是Grossman等[13]提出的一種新型非侵入性神經調控方式,該方法通過兩組流經組織的互不干擾的高頻交變電流產生的頻率差,改變作用區域神經元的活動(見圖1a),從而實現以無創方式調控深部腦區神經功能的目的。TI神經調控方法的提出引起了廣泛的關注,Rampersad等[14]通過TI方法注入總電流776 μA,在模擬的小鼠腦中可以產生383 V/m的電場強度。Gomez-Tames等使用多尺度小鼠模型計算研究,發現TI神經調控產生閾值隨著載波頻率的增加而增加,并且拍頻不影響閾值[15]。為了精確定位腦內的較小區域,Song等[16]提出了一種多通道TI策略,該策略使用多對電極,能夠產生多組干擾電場,通過嘗試不同的頻率進行動物實驗,成功激活了小鼠的運功皮層神經元。Missey等[17-18]使用方向可調的時間干擾方法(ot-TI)和激光驅動的無線TI方法,在小鼠海馬體(CA1、CA3)成功地喚起了具有快速放電特征頻率的癲癇事件。然而,當前對于TI刺激的研究都是在較大的核團中進行研究的,且核團的深度相對較淺。
 圖1
時間干涉刺激作用方式
圖1
時間干涉刺激作用方式
a. 時間干涉原理圖;b. 小鼠頭部模型以及VPL的截面原理圖
Figure1. Time interference stimulation mode of actiona. a principle diagram of temporal interference; b. a diagram of the mouse brain model and a cross-sectional of VPL
動物機器人研究中,采用丘腦腹后外側核(ventral posterolateral nucleus of the thalamus,VPL)能夠有效完成對動物的左、右轉運動行為調控。VPL核團的深度為4.1~4.6 mm,在此區域實現電場的聚焦和對動物運動行為的調控具有挑戰性。本研究通過仿真和動物實驗驗證TI神經調控方法的可行性。首先建立精確的小鼠頭部以及VPL模型,利用有限元方法計算TI刺激在小鼠頭部模型中電場大小和分布情況,運用數值計算的方法研究TI的聚焦性,以確定TI刺激是否精確定位到小鼠腦中體積較小、深度較深的VPL核團(見圖1b)。再結合仿真實驗,進行動物實驗驗證,并通過c-Fos免疫熒光實驗確定其聚焦位置。
1 方法
1.1 小鼠頭部模型和VPL模型構建
建立小鼠頭部和VPL模型使用的數據集來自Allen Brain Atlas研究機構[19]。將數據集圖片導入MIMICS軟件中,通過MASK指令重建小鼠頭部模型和VPL模型,對模型進行光滑處理后,再通過GeoMagic軟件對模型進行優化處理以滿足有限元分析要求。建立的頭部模型尺寸為19.21 mm × 16.20 mm × 11.70 mm,分辨率為10 μm。整體建模過程如圖2所示。
 圖2
小鼠頭部模型和VPL模型的構建過程
Figure2.
Construction of mouse brain and VPL model
圖2
小鼠頭部模型和VPL模型的構建過程
Figure2.
Construction of mouse brain and VPL model
1.2 虛擬仿真方法
在COMSOL軟件中,將刺激電極和接地電極嵌入組織模型環境中,電極半徑為0.3 mm,高度為0.4 mm,以lambda點為坐標原點,將電極布置在小鼠腦表面上左右± 2 mm,從后到前依次為–0.3、1.7、4.7、6.7 mm。設置電極的電導率為6 × 106 S/m,小鼠腦部模型的電導率為0.333 S/m,兩組電極刺激參數(f1 = 2 kHz,f2 = 2.02 kHz,?f = 20 Hz),總刺激時間1 s,并以時間間隔為0.001 s產生一個仿真結果。
1.3 動物及手術
雄性昆明小鼠(8~10周,購于北京維通利華實驗動物有限公司),體重30~40 g,實驗前后均放置于透明籠中,房間溫度控制在(20 ± 3)℃。手術前12 h停止喂食,術前用10%的水合氯醛(400 mg/kg)腹腔注射麻醉。將小鼠固定在立體定位儀上,切開頭皮,分離兩側皮膚除去肌肉和骨膜。以lambda點為參考點,使用仿真得到的坐標將四個不銹鋼螺釘電極固定于顱骨,并用牙科水泥將與之相連的排母固定于顱骨(見圖3)。術后5~7 d,經檢查傷口愈合較好、無異常反應、各項生理參數均正常的小鼠,可進行TI刺激行為學實驗。
 圖3
動物手術模型
圖3
動物手術模型
a. 仿真實驗確定的電極放置位置;b. 電極放置位置模式圖;c. 電極固定完成
Figure3. Animal surgical modela. electrode placement position determined by simulation experiments; b. electrode placement pattern diagram; c. electrode fixation completed
1.4 c-Fos免疫熒光實驗
選取小鼠的單側VPL核團進行TI刺激,另一側不刺激作為對照。以刺激10 s、停止刺激10 s的方式,刺激10 min,選取刺激轉向效果較好的小鼠進行后續實驗。刺激結束后2 h,使用10%水合氯醛對小鼠過量麻醉,灌流,固定,取腦,并將腦組織置于4%的多聚甲醛溶液中后固定4 h,然后依次移入含有15%和30%蔗糖的磷酸緩沖液(phosphate buffer solution,PBS)中進行梯度脫水。冰凍連續切片,厚度35 μm。
選取含有VPL核團的切片進行免疫熒光實驗,步驟如下(每個步驟完成后均使用PBS漂洗5次,每次5 min):① 含2%正常驢血清的PBS溶液常溫孵育2 h。② c-Fos兔單克隆抗體(1∶500),4 ℃孵育過夜。③ FITC(1∶500)標記的山羊抗兔IgG溶液,常溫避光4 h。④ DAPI溶液常溫避光10 min。反應結束后,將切片貼附于多聚賴氨酸處理的載玻片上,使用甘油和PBS(1∶1)溶液封片。通過熒光顯微鏡(LEICA,DMi8,德國)觀察,標記結果采用ImageJ軟件分析。
2 結果
2.1 TI刺激在VPL的聚焦性仿真
將注入電流以每組300 μA增加到1 000 μA(步長100 μA),觀察到電場聚焦位置由淺到深(見附件1),其中電流為800 μA時,在VPL核團邊界聚焦較好(見圖4a)。測得VPL處電場強度結果如表1所示,從表中數據可知,隨著電流的增加,聚焦的電場強度也隨之增加。小鼠頭部模型實驗結果表明,800 μA時在小鼠頭皮處的電場強度比較小(≤ 27.516 V/m),在VPL核團邊界處的電場強度較大,并且在1 s時VPL核團邊界處最大電場可以達到153.667 V/m。
 圖4
電場在VPL核團處聚焦效果
圖4
電場在VPL核團處聚焦效果
a. 二維平面圖以及VPL處局部放大圖;b. VPL核團表面電場分布圖
Figure4. Focusing effect of electric field on VPL nucleia. two-dimensional plan view and partial enlargement at VPL; b. surface electric field distribution map of VPL nuclear clusters
二維圖像(見圖4a)只能反映一個截面的聚焦分布,無法直觀反映電場在VPL核團實際的電場聚焦分布情況。為此,通過三維模型呈現了VPL核團表面的電場聚焦情況(見圖4b)。通過二維-三維的TI聚焦分布情況可以觀察到,在VPL核團周邊產生的包絡電場強度較高,在核團內部產生的電場強度較低,這與Missey等[17]的結果一致。
2.2 聚焦性計算
TI神經調控聚焦性的評判主要包括刺激強度、刺激深度、聚焦面積等幾個方面[18, 20]。本研究中,刺激強度為聚焦位置的最大電場強度,實驗中采用了800 μA的注入電流,通過小鼠模型仿真實驗,得到VPL邊界周圍的最大電場強度 為153.667 V/m。Koponen等[21]使用了超出最大電場值的
為153.667 V/m。Koponen等[21]使用了超出最大電場值的 部分來定義聚焦點的體積,這種聚焦性的定義方法適用于最大刺激在明確目標區域內的情況。從仿真二維平面結果可以觀察到本實驗的聚焦范圍在VPL核團組織附近,因此采用該方法進行聚焦性的數值計算。刺激深度表征TI刺激在小鼠腦內部的穿透能力,計算頭皮位置與感應電場強度為
部分來定義聚焦點的體積,這種聚焦性的定義方法適用于最大刺激在明確目標區域內的情況。從仿真二維平面結果可以觀察到本實驗的聚焦范圍在VPL核團組織附近,因此采用該方法進行聚焦性的數值計算。刺激深度表征TI刺激在小鼠腦內部的穿透能力,計算頭皮位置與感應電場強度為 的最大距離表示刺激深度
的最大距離表示刺激深度 ,通過坐標位置的計算得到本研究中的
,通過坐標位置的計算得到本研究中的 為4.52 mm,該深度在VPL深度范圍之內。聚焦面積計算公式如下:
為4.52 mm,該深度在VPL深度范圍之內。聚焦面積計算公式如下:
 |
式中 表示聚焦面積;
表示聚焦面積; 表示半值體積,指暴露在大于或等于
表示半值體積,指暴露在大于或等于 中的腦區域的體積。通過COMSOL軟件算出小鼠模型中每個時間點的半值體積,如圖5a所示,計算出的聚焦體積
中的腦區域的體積。通過COMSOL軟件算出小鼠模型中每個時間點的半值體積,如圖5a所示,計算出的聚焦體積 最大值為19.1 mm3,根據式(1)可以計算出聚焦面積
最大值為19.1 mm3,根據式(1)可以計算出聚焦面積 的最大值為4.22 mm2;1 s時聚焦體積
的最大值為4.22 mm2;1 s時聚焦體積 為17.81 mm3,1 s時聚焦面積
為17.81 mm3,1 s時聚焦面積 為3.94 mm2。聚焦面積隨時間的變化如圖5b所示。從聚焦面積和體積隨時間變化的曲線圖可知,聚焦性在0.35 s之前變化較大,而在0.80 s以后聚焦面積和體積數值趨于穩定,故仿真實驗中設計刺激時長為1 s可以滿足實驗的要求。
為3.94 mm2。聚焦面積隨時間的變化如圖5b所示。從聚焦面積和體積隨時間變化的曲線圖可知,聚焦性在0.35 s之前變化較大,而在0.80 s以后聚焦面積和體積數值趨于穩定,故仿真實驗中設計刺激時長為1 s可以滿足實驗的要求。
 圖5
聚焦體積和聚焦面積變化趨勢圖
圖5
聚焦體積和聚焦面積變化趨勢圖
a. 體積變化圖;b. 面積變化圖
Figure5. Change trend in focus volume and focus areaa. volume change chart; b. area change chart
通過COMSOL軟件可以計算出單個VPL核團模型的表面積為3.5946 mm2,數值計算得出的聚焦面積比單個核團的表面積略大,這可能是在計算時把VPL核團周圍的部分電場計算在內。
2.3 小鼠刺激結果
通過兩個刺激器(成都儀器廠,RM6240E/EC多道生理信號采集處理系統,中國)產生一組頻率為2 kHz、另一組為2.02 kHz,電流大小同為800 μA可調的TI刺激進行動物實驗驗證。將刺激器連接到小鼠頭部固定電極,施加TI刺激調控小鼠的運動行為(見圖6)。為了驗證TI刺激對小鼠的控制效果,本研究分別在10只小鼠中進行了雙側VPL刺激實驗。
 圖6
RM6240E系統形成包絡電場刺激小鼠
Figure6.
RM6240E systems form an enveloping electric field to stimulate mice
圖6
RM6240E系統形成包絡電場刺激小鼠
Figure6.
RM6240E systems form an enveloping electric field to stimulate mice
分別刺激10只小鼠左、右兩側VPL各20次,其中有8只成功地完成了左、右轉向調控(以轉向成功率達到80%為標準),實驗成功率80%。為了達到理想的調控效果,不同小鼠實驗時施加的電流略不同,變動范圍750~850 μA,小鼠刺激實驗施加電流和轉向成功率如表2所示。動物左、右轉向調控視頻見附件2~3。
2.4 c-Fos熒光反應實驗結果
對采集的圖像進行分析,將同一位置的DAPI細胞染色圖像和c-Fos陽性細胞圖像重合,如圖7所示,1號VPL刺激區域的c-Fos陽性細胞較多,并且幾乎與DAPI細胞重疊。2號對照區域的c-Fos陽性細胞較少,在重疊圖像中幾乎看不到與DAPI的重疊。使用ImageJ軟件對細胞進行計數,如圖7b所示,1號區域c-Fos陽性細胞占比為79.77%,遠遠高于2號區域的7.34%。從c-Fos陽性細胞占比數據以及重疊圖像中,可以直觀地發現刺激區域與非刺激區域的差別。
 圖7
c-Fos反應對比結果
圖7
c-Fos反應對比結果
a. 熒光顯微鏡下采集的小鼠腦切片整體圖;b. 區域1和區域2采集的DAPI、c-fos陽性細胞個數統計圖以及c-fos陽性細胞占比對比圖;c. 1號刺激區域DAPI、c-fos陽性細胞及其疊加圖;d. 2號未刺激區域DAPI、c-fos陽性細胞及其疊加圖
Figure7. Comparison of c-Fos reaction resultsa. overall view of a mouse brain section collected under fluorescence microscope; b. statistical graphs of the number of DAPI and c-fos positive cells collected from regions 1 and 2 and the comparison of the percentage of c-fos positive cells; c. DAPI, c-fos-positive cells and their merged image on the map of stimulation region #1; d. DAPI, c-fos-positive cells and their merged image on the map of unstimulated region #2
為驗證TI神經調控刺激方法作用的區域,本文對電極下方的皮層區域Ⅰ和Ⅱ以及偏離電極的VPL核團Ⅲ、皮層區域Ⅳ分別采集圖像,發現區域Ⅰ、Ⅱ、Ⅳ無明顯c-Fos陽性細胞,而VPL核團Ⅲ附近陽性細胞較多(具體圖示見附件4)。這與TI神經調控刺激原理相吻合,即TI神經調控刺激方法不會作用于電極周邊的皮層區域,而是聚焦到特定的腦區發揮作用。
3 討論
已有的TI刺激大多以動物的海馬體(CA1-CA3)或其他淺層腦區作為靶點[18-19],實現特定功能的調控。Missey等以50 μA為步長增加刺激電流,實現了TI刺激小鼠海馬體誘發癲癇事件;Zhang等通過TI成功激活大鼠的初級運動皮層。根據動物機器人的調控原理,本文選取能夠引起小鼠左、右轉行為的VPL核團。相比于已有研究,VPL核團深度更深,體積小,TI刺激聚焦到該腦區具有一定挑戰性。本文將刺激電流大小以100 μA為步長從每組300 μA開始逐漸遞增,直到出現良好的聚焦性為止。仿真結果發現電流強度在300~500 μA時,包絡電場在皮層區域聚焦,并且隨著電流強度的增加,聚焦深度和電場強度也在逐漸增加;當電流增加到每組600 μA時,在鼠腦VPL核團周邊出現良好的聚焦性,繼續提高電流強度,聚焦深度不再增加,僅聚焦位置的電場強度不斷增大。表1記錄了不同電流強度下,所產生的最大電場值,結合附件1可知包絡電場能夠聚焦到深度較深的VPL核團處,通過仿真實驗與動物實驗結合,發現電流強度在800 μA時能夠實現小鼠左右轉控制,當電流繼續增大時,則會引起小鼠痙攣反應。因此,文中刺激實驗采用了800 μA左右的電流強度進行調控測試。
為了更直觀地獲得TI刺激位置的數據,本文通過二維和三維圖像和數值計算進一步優化了聚焦結果。Missey等建立的模型可以從三維模型中看到電場線的表達,由二維平面結果反映場強大小。在此基礎上,本文通過二維平面結果進行數值運算,可以計算出TI電場作用的深度和聚焦性,通過三維模型可以觀察到TI產生的電場在VPL核團周圍的表達結果,并發現電場集中在VPL核團邊界。本研究采用Koponen等[21]的方法,計算了TI刺激方法聚焦的深度為4.52 mm,在VPL實際深度范圍中;同時計算了聚焦面積為3.94 mm2,該數值與實際VPL核團的截面積接近。仿真和數值計算結果驗證了TI刺激聚焦到VPL核團的可行性。
已有的動物機器人運動行為調控研究大部分為植入式電極刺激,Huai等[22]對10只大鼠進行了測試,其中8只可以按照指定的路線進行引導。2只大鼠因電極植入不準確未能得到有效控制,刺激成功率達到80%。該團隊另一項研究[23]中指出控制大鼠的成功率可達90%。王浩等[24]對鴿子的運動行為調控成功率為90%。本文在TI調控小鼠運動行為的實驗中,對10只小鼠進行實驗,其中有8只小鼠能夠根據刺激指令進行左、右轉,成功率達到80%,與植入式電極刺激方式相當。
非侵入式刺激調控生物機器人目前主要集中在刺激表層腦區及光控動物外部視覺誘導方面。Pi等[9]針對大鼠機器人,利用超聲波刺激其聽覺、表皮電極刺激其痛覺及LED燈光輔助刺激器刺激其視覺,從而控制動物運動行為。Kim等[12]采用LED刺激誘導,并通過反復的刺激-獎勵交互形成操作式條件反射,完成對海龜運動行為的調控。彭勇等[11]提出了一種用于鯉魚機器人的光刺激裝置及光控實驗方法,誘導鯉魚在水迷宮中完成轉向和前進動作,且不同波長的光對運動速度產生了不同的影響。TI作為一種可聚焦到腦內深部核團的神經調控方法,近年來引起了廣泛關注[25-27],本文通過模型驗證了TI刺激小鼠VPL核團的可行性,在此基礎上,提出了TI刺激調控動物機器人的一種新方法,并完成了對小鼠左、右轉向行為的控制。盡管本文已經驗證了TI刺激深部腦區對動物運動行為調控的可行性,但要想達到完全的非侵入式TI刺激,需要對小鼠頭部模型中的顱骨、頭皮等部位深入建模,這也是下一步需要開展的工作之一。此外,對于動物機器人應用而言,多個神經核團同時刺激以調控不同運動行為以及TI遙控刺激系統兩方面的工作也需要進一步探索。
本研究采用即刻早期基因c-Fos來標記刺激后VPL核團周圍的神經激活情況,驗證TI在腦內的聚焦效果。通過細胞計數發現,VPL靶區激活神經元數與總神經元數的比值為79.77%,非靶區激活神經元數為7.34%,刺激區域與非刺激區域神經元激活數存在明顯的差異。Song等將TI神經調控后的小鼠腦進行切片,通過免疫熒光標記觀察c-Fos的表達[16],研究發現,靶區激活神經元數與總神經元數的比值為82.4%,非靶區激活神經元數為18.2%,該研究中靶區和非靶區中激活神經元數占比略高于本研究,可能與靶向深度或抗體的敏感性有關。c-Fos免疫反應實驗并非驗證TI刺激效果的唯一方法,通過采集小鼠特定位點的場電位信號也可以體現TI刺激產生的電場在小鼠腦內引起的反應[16-17],在刺激后使用肌電信號及時觀察動物的響應也是一種無損且實時的評價方式。為了從多方面驗證TI刺激方法在動物運動行為調控中的應用效果,在今后的研究中,將繼續探索TI刺激后特定腦區場電位或特定肌肉的電信號變化,通過實時分析電信號有效評價動物對TI刺激的反應。
4 結論
本文通過TI刺激方法聚焦到腦內深度較深、體積較小的VPL核團,從而調控小鼠左、右轉向的運動行為。首先,仿真和數值計算方法證實了TI方法聚焦的有效性。通過調節電極放置的位置和電流強度大小將包絡電場聚焦到VPL核團,確定了當電流為800 μA時電場聚焦性良好。通過數值計算方法,得出聚焦深度為4.52 mm,該深度在VPL核團深度范圍之內,同時計算出聚焦面積在0~0.35 s時波動較大,在0.80 s后趨于穩定,為3.94 mm2,此面積較小,能夠聚焦到VPL核團。其次,動物實驗證明了TI方法能夠有效調控小鼠左、右轉向的運動行為。在小鼠實驗中,根據數值模擬實驗確定的顱骨位置放置電極,施加的電流強度為800 μA,發現小鼠能夠根據控制指令進行相應的左、右轉向行為。最后,c-Fos熒光反應實驗驗證了小鼠實驗中TI聚焦的位置為VPL核團。在c-Fos熒光反應實驗中,能夠從腦切片上觀察到VPL核團附近的c-Fos陽性細胞較多,而小鼠淺層區域以及非刺激區域的c-Fos陽性細胞較少。結果表明,TI刺激能夠聚焦到VPL核團,并調控小鼠左、右轉向的運動行為。本文為動物機器人運動行為調控提供了一種對腦組織無創的刺激方法。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:朱浩然負責實驗平臺搭建,論文撰寫、修訂。于志豪負責實驗設計與指導。張平丘、殷濤負責動物實驗手術及數據記錄。汪慧負責動物實驗設計與分析。楊俊卿負責實驗平臺指導與維護。槐瑞托負責研究計劃安排、實驗指導、論文審閱修訂。邵峰負責提供動物及實驗規范性指導。
倫理聲明:本研究通過了山東本明生物科技股份有限公司動物倫理委員會的審批。
本文附件見本刊網站的電子版本(biomedeng.cn)。