以往研究表明,經過多代培養后的細胞會出現生長停滯、去分化和喪失原有功能等問題,其原因是缺乏應力刺激。為探討多模化仿生應力(MMBS)對人膀胱平滑肌細胞(HBSMCs)生物學功能的影響,本實驗建立了MMBS培養系統來模擬膀胱所受的應力環境,并對HBSMCs加載不同強度的仿生應力持續24 h,然后檢測細胞生長、增殖及功能分化。結果顯示,MMBS可以促進HBSMCs的生長和增殖,以80 cm H2O壓力附加4%牽張應力,對促進HBSMCs的生長、增殖以及α—平滑肌肌動蛋白和平滑肌蛋白22—α的表達最有效。綜上,在構建組織工程膀胱時,MMBS培養系統將有助于調節HBSMCs的生長、增殖以及功能分化成熟。
引用本文: 韋堂墻, 陳林, 胡海峰, 楊進. 多模化仿生應力調節膀胱平滑肌細胞的生物學功能. 生物醫學工程學雜志, 2024, 41(2): 321-327. doi: 10.7507/1001-5515.202306036 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
越來越多的證據表明,力學環境或應力對組織和器官的發育至關重要。在組織工程心血管的研究中發現,缺乏適當的應力會導致細胞從支架脫落、細胞去分化等現象,而給予適宜的應力刺激后,細胞生長活力增加,細胞功能更加完善[1-3]。膀胱發育也需要應力。在胎兒期,膀胱每小時充盈伴隨壓力升高,然后通過持續幾秒的收縮,排空膀胱[4-5]。若轉流膀胱尿液,讓膀胱失去尿液周期性的充盈與排空,會造成膀胱細胞生長停滯、膀胱壁變薄[6]。因此可以看出,應力對組織或器官的發育起著重要作用。
運用應力促進組織器官發育及功能成熟已在組織工程骨骼系統及心血管系統中得到廣泛深入的研究[7-9]。然而,應力對組織工程膀胱的作用還未得到足夠重視[10]。膀胱的結構與骨骼、心血管相差巨大,且日常體內所處的應力環境也不同,比如:骨骼承受的應力強度巨大,但產生形變僅有0.1%,而膀胱內壓一般不超過40 cm H2O,但會產生很大的形變;心血管系統主要受到剪切力及壓力的調節,而膀胱受到的壓力遠小于血管,但卻承受著巨大的牽張應力。因此,不能簡單地將其它系統中的研究成果直接應用到組織工程膀胱的研究中。此外,現有的生物反應器施加應力比較單一,不能很好地模擬膀胱所受到的復合應力[11-12]。故,有必要構建一套適合組織工程膀胱的應力培養系統,即多模化仿生應力(multi-modal biomimetic stress,MMBS)培養系統,該系統能同時或交替加載壓力、牽張應力及剪切力。本研究將運用MMBS培養系統模擬膀胱體內所承受到的復合應力,以研究這些應力對人膀胱平滑肌細胞(human bladder smooth muscle cells,HBSMCs)的生物學功能的影響,為研究應力如何促進組織工程種子細胞生長和功能成熟提供基礎。
1 材料與方法
1.1 材料與儀器
細胞培養相關耗材:HBSMCs(ScienCell,美國);胎牛血清與杜爾貝科改良伊格爾培養基(Dulbecco’s modified Eagle’s medium,DMEM)(Hyclone,美國);胰蛋白酶(GIBCO,美國)。檢測基因轉錄相關試劑:提取總RNA試劑、反轉錄試劑盒及熒光聚合酶鏈反應(Polymerase chain reaction,PCR)試劑盒(寶生物工程(大連)有限公司,中國);PCR引物(上海生工公司,中國)。檢測細胞生長及增殖相關試劑與設備:細胞計數試劑盒8(cell counting kit-8,CCK-8)及碘化丙啶(碧云天,中國);5-乙炔基-2’脫氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EdU)細胞增殖檢測試劑盒(翌圣生物科技,中國);4',6-二脒基-2苯基吲哚(賽維爾生物,中國);流式細胞儀(Gallios,Beckman Coulter,美國)。檢測蛋白表達相關抗體:抗甘油醛-3-磷酸脫氫酶(Glyceraldehyde -3-phosphate dehydrogenase,GAPDH)抗體(Cell Signaling Technology,美國);抗α-平滑肌肌動蛋白(alpha-smooth muscle actin,α-SMA)和平滑肌蛋白22-α(smooth muscle protein 22-α,SM22-α)抗體(Abcam,英國)。
1.2 細胞培養
HBSMCs置于含10%胎牛血清的DMEM(含0.1 mg/L鏈霉素和100 U/mL青霉素)中貼壁培養,放入37 ℃、5% CO2體積分數及飽和濕度的培養箱中。選取3~7代生長活力良好、形態正常的HBSMCs進行實驗。
1.3 MMBS培養系統的構建與運用
1.3.1 構建MMBS培養系統
為了模擬生理狀態下膀胱受到的周期性壓力和牽張應力,本實驗采用自主設計的生物反應器,即MMBS培養系統,如圖1所示。該系統通過水泵提供動力,使培養艙內的壓力升高,導致彈性膜的擴張,隨著壓力逐漸降低,彈性膜逐漸恢復正常,模擬膀胱從空虛到充盈再到空虛的應力過程。通過測量體積監測艙內液體體積的變化來評估膜形變大小,即牽張應力=體積監測艙內流出液體的體積/體積監測艙原有液體體積 × 100%。
 圖1
MMBS培養系統
Figure1.
MMBS culture system
圖1
MMBS培養系統
Figure1.
MMBS culture system
1.3.2 MMBS的加載模式及實驗分組
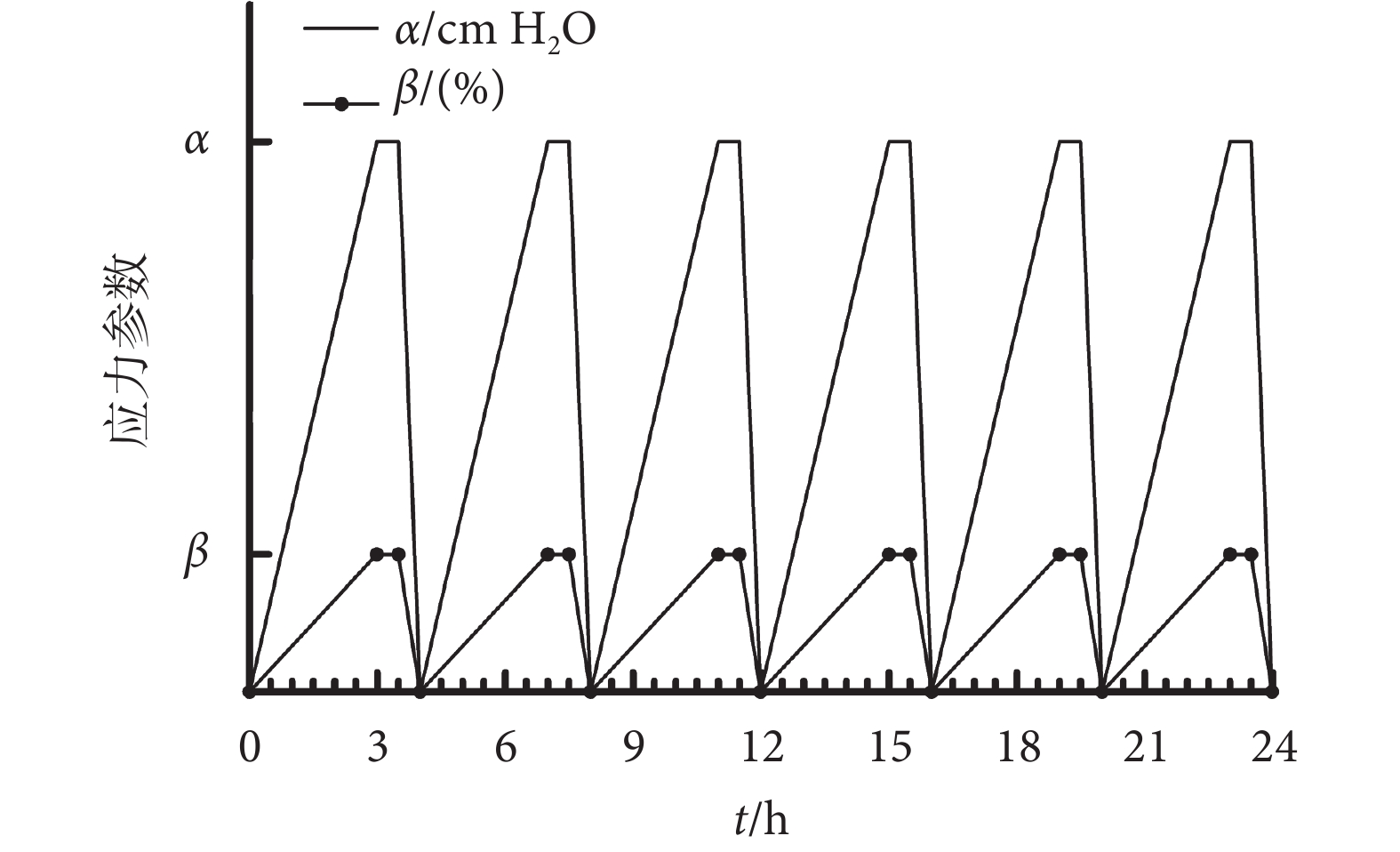
MMBS培養艙置于37 ℃,5% CO2孵箱里,如圖1所示。在培養艙內種植一定數量的HBSMCs(1 × 105 個/mL),并靜置培養6 h,以確保細胞充分貼壁后再施加MMBS。應力加載方式如圖2所示:每4 h循環一次,模擬膀胱從空虛到充盈再到空虛的過程,在前3 h,培養艙內壓力(以符號α表示)及牽張應力(以符號β表示)分別緩慢上升,并維持0.5 h,然后在0.5 h內下降至0;共完成6個周期的MMBS加載。體內膀胱內壓上限為40 cm H2O,結合預實驗及前期牽張應力研究結果,選擇了40 cm H2O的壓力梯度來進行實驗分組[13]。α取值為0、40、80、120 cm H2O;對應β取值0%、2%、4%、6%。即,實驗共分4組:① 靜態培養組(以下簡稱:0組):α及β均取值為0;② 40 cm H2O壓力 + 2%牽張應力組:α取值為40 cm H2O,β取值為2%;③ 80 cm H2O壓力+4%牽張應力組:α取值為80 cm H2O,β取值為4%;④ 120 cm H2O壓力 + 6%牽張應力組:α取值為120 cm H2O,β取值為6%。
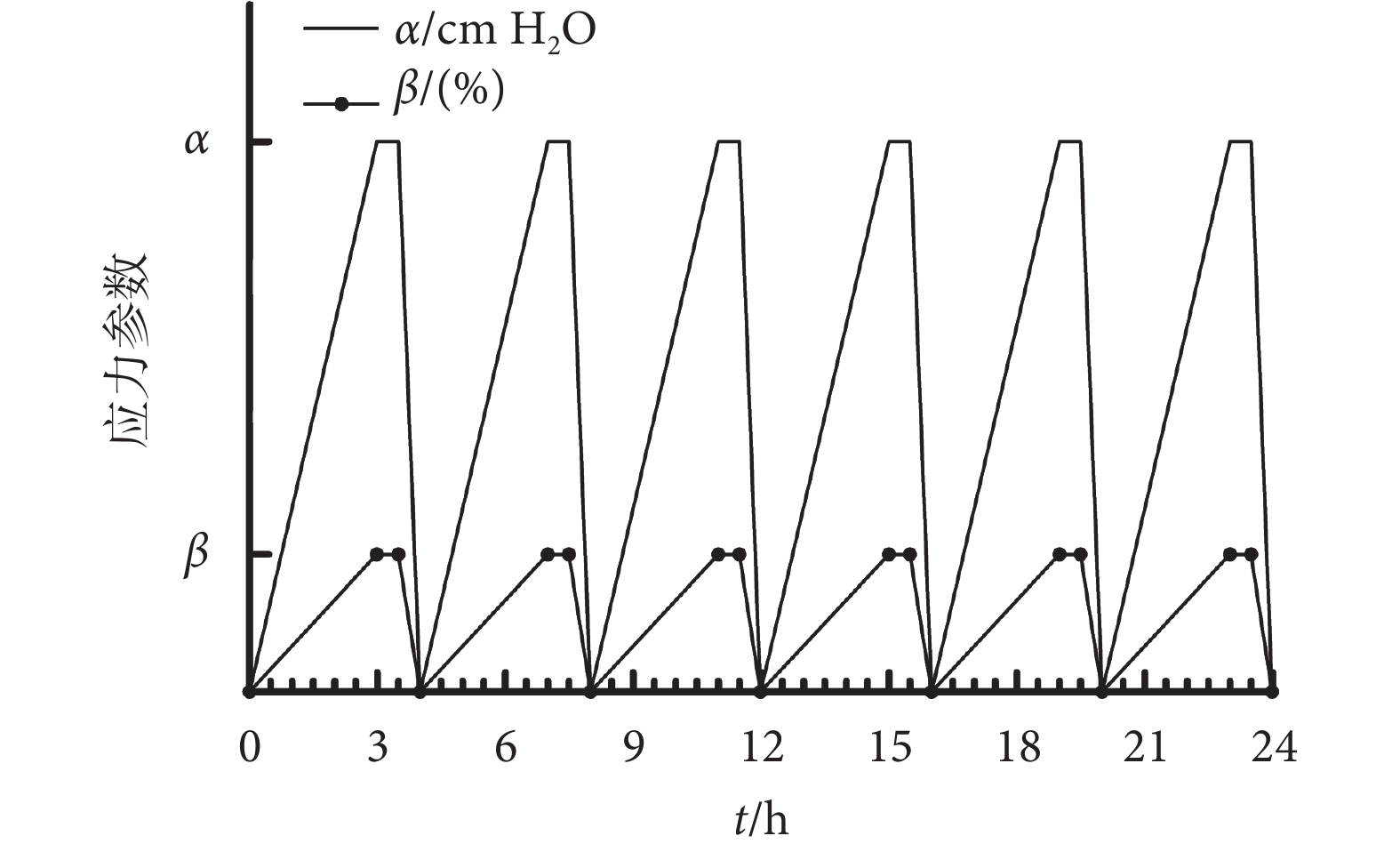 圖2
MMBS加載模式
Figure2.
MMBS loading mode
圖2
MMBS加載模式
Figure2.
MMBS loading mode
1.4 MMBS對HBSMCs生長及增殖的影響
1.4.1 MMBS對HBSMCs生長的影響
對HBSMCs加載MMBS持續24 h,然后使用胰蛋白酶消化細胞,并制成5×105 個/mL的細胞懸液。根據CCK-8試劑說明,在96孔板中每孔加入200 μL細胞懸液,37 ℃中孵育培養4 h,然后加入20 μL CCK-8試劑,再在37 ℃中孵育培養2 h。最后,使用全自動酶標儀在波長450 nm下測吸光度A值。
1.4.2 MMBS對HBSMCs增殖的影響
將HBSMCs與硅膠膜復合后,置于無血清的DMEM中饑餓過夜。經過加載MMBS后,使用流式細胞術檢測細胞周期,并使用流式周期分析軟件ModFit 3.2(Verity Software House,美國)進行結果分析,以細胞增殖指數衡量細胞增殖活性。另外,經過加載MMBS后的細胞繼續靜態培養48 h,然后EdU染色檢測細胞增殖:首先EdU染色HBSMCs,緊接著4',6-二脒基-2苯基吲哚染色細胞核,最后在熒光顯微鏡下觀察染色結果并采集圖片。
1.5 MMBS對HBSMCs功能分化成熟的影響
1.5.1 熒光PCR檢測功能分化成熟基因的轉錄
參照1.3.2小節,實驗分組為:① 0組;② 40 cm H2O壓力+2%牽張應力組;③ 80 cm H2O壓力 + 4%牽張應力組(以下簡稱為:MMBS組);④ 120 cm H2O壓力 + 6%牽張應力組。對HBSMCs完成MMBS作用后,提取總RNA。隨后,根據反轉錄試劑盒試劑說明書合成互補DNA。最后,使用熒光PCR檢測α-SMA和SM 22-α基因的轉錄水平[14]。
1.5.2 蛋白免疫印跡檢測功能分化成熟標志物的蛋白表達
根據熒光PCR的檢測結果,參照1.3.2小節和1.5.1小節,實驗分組為:① 0組;② MMBS組。收獲HBSMCs后,使用蛋白免疫印跡檢測α-SMA和SM 22-α的表達水平,然后用圖像處理軟件ImageJ 1.46(National Institutes of Health,美國)分析條帶灰度。
1.6 統計學方法
采用統計分析軟件SPSS 25.0(International Business Machines Corporation,美國)進行統計學分析。數據均以x±s表示。兩組組間比較采用t檢驗,多組間比較采用單因素方差分析,差異應具有統計學意義,檢驗水準為0.05。
2 結果
2.1 MMBS促進HBSMCs生長與增殖
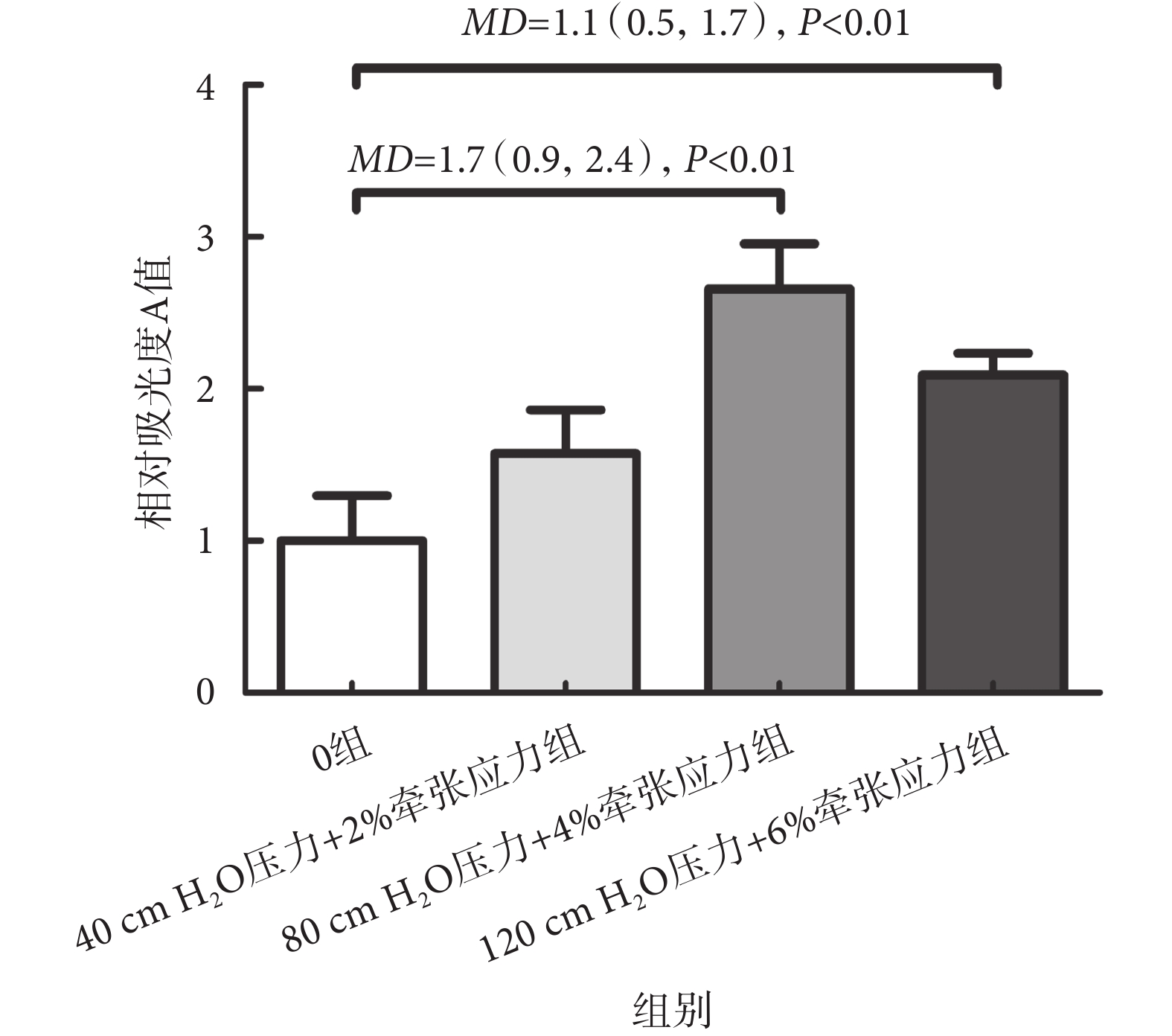
經過24 h的MMBS加載后,使用CCK-8檢測HBSMCs的生長情況,結果如圖3所示,MMBS具有促進HBSMCs生長的效應,其中,80 cm H2O壓力+4%牽張應力組顯示其促進作用最明顯。與0組相比,相對吸光度A值升高了(2.66 ± 0.30)倍,[MD = 1.7(0.9,2.4),P < 0.01]。
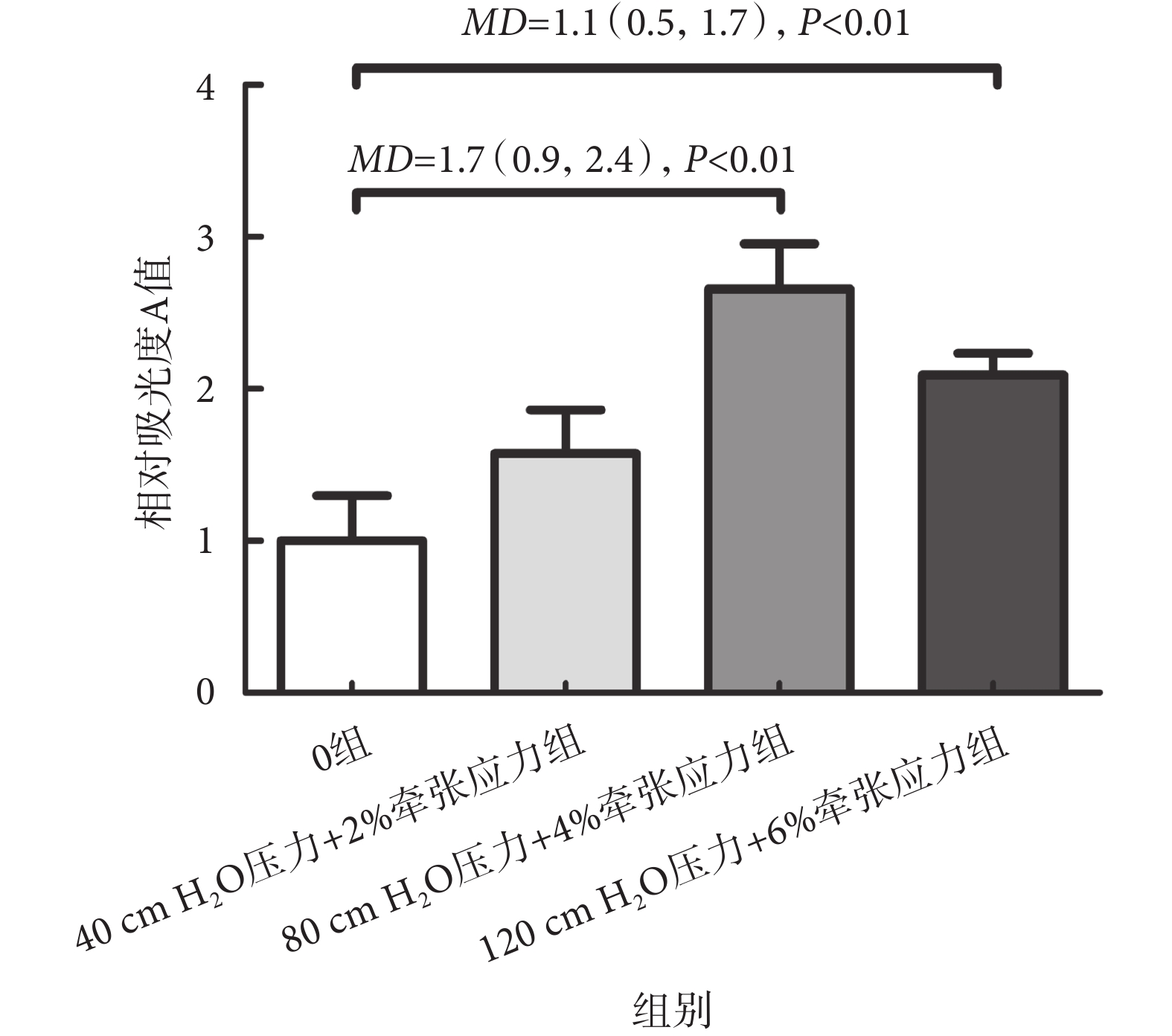 圖3
MMBS對HBSMCs生長的影響
Figure3.
Effects of MMBS on the growth of HBSMCs
圖3
MMBS對HBSMCs生長的影響
Figure3.
Effects of MMBS on the growth of HBSMCs
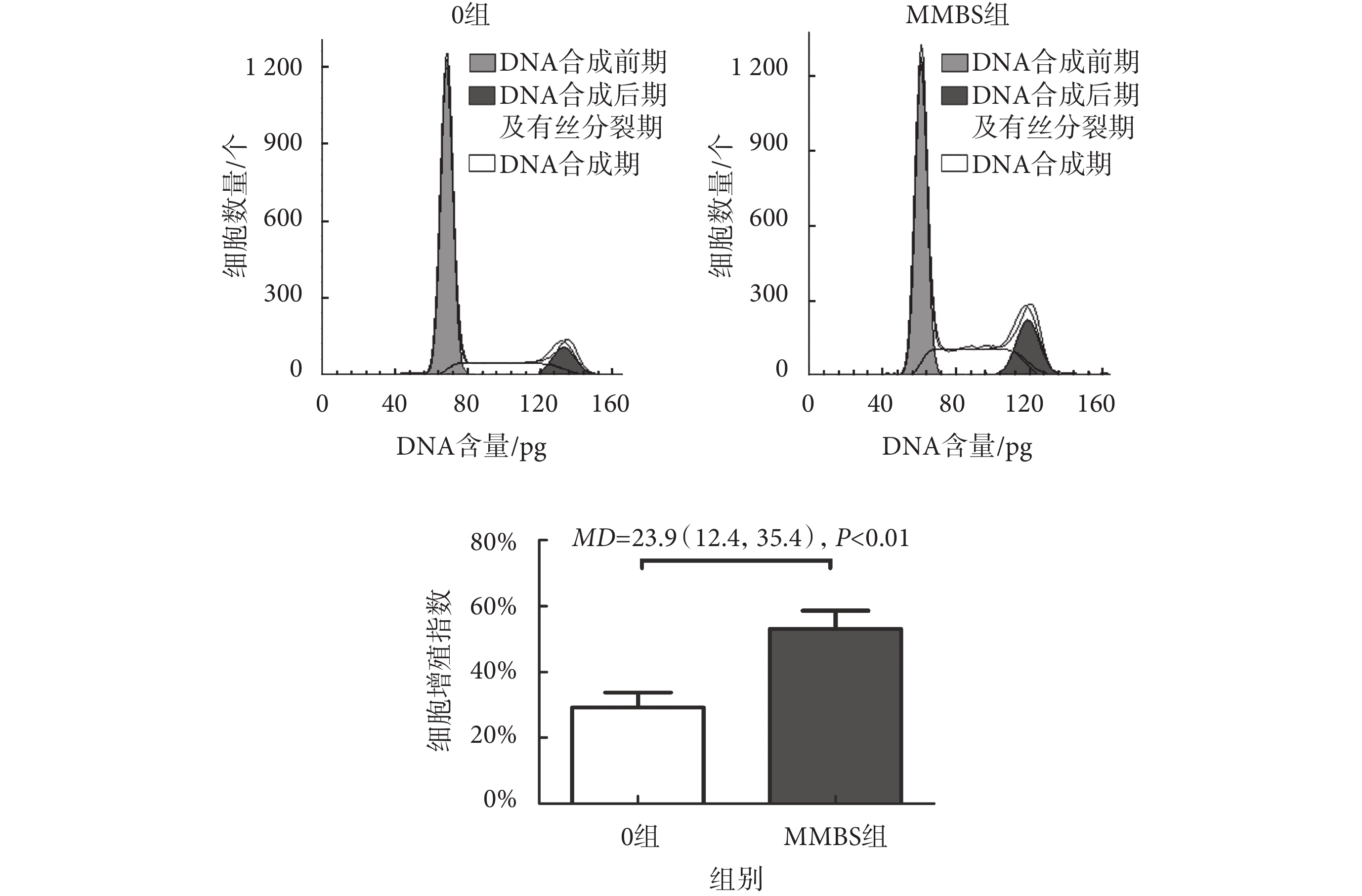
根據CCK-8檢測結果,實驗分為0組及MMBS組,采用流式細胞技術檢測HBSMCs周期變化,結果如圖4所示,MMBS組的細胞增殖指數從(29.19 ± 4.52)%升高至(53.09 ± 5.57)%,[MD = 23.9(12.4,35.4),P < 0.01]。
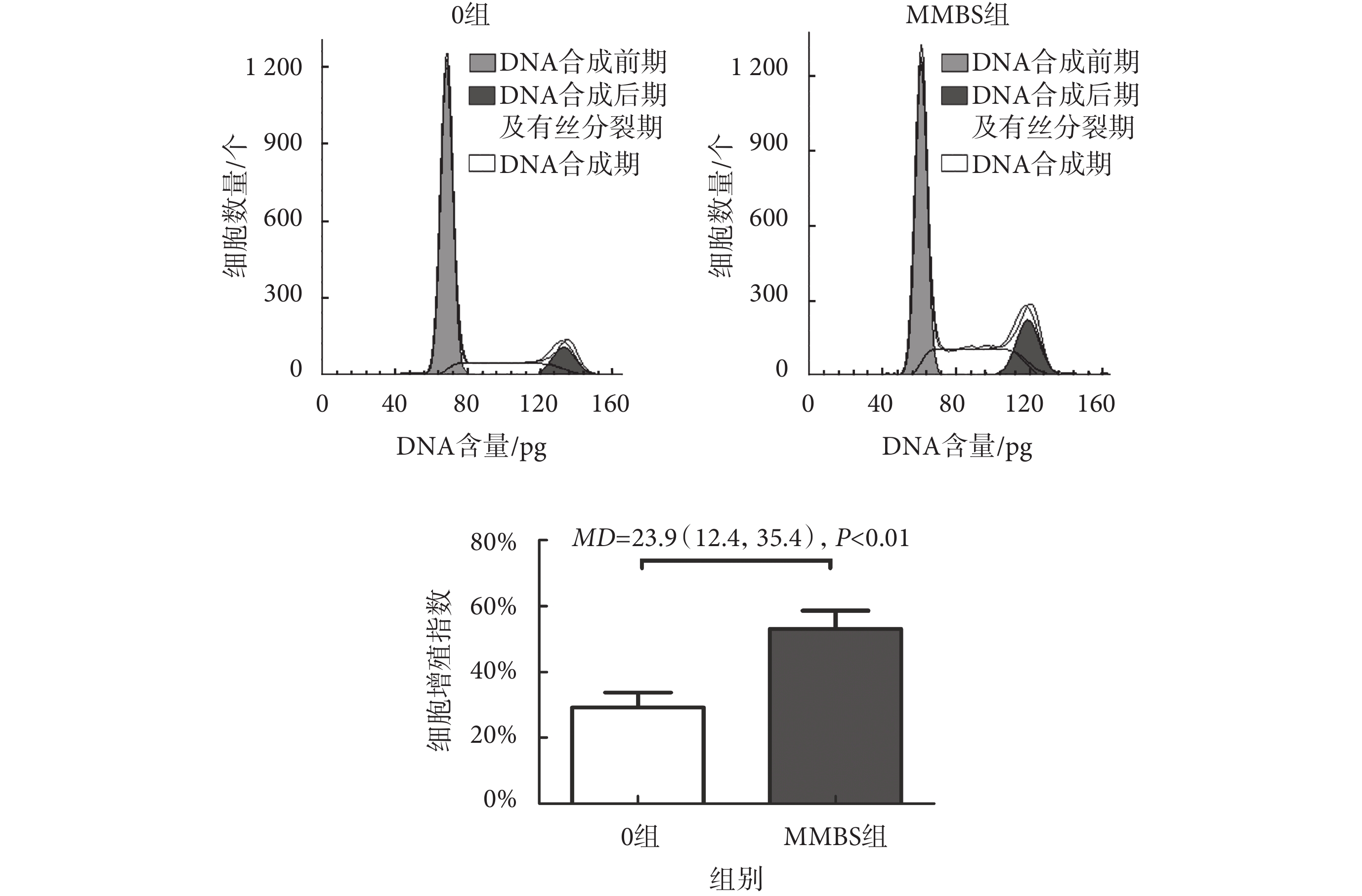 圖4
MMBS對HBSMCs的增殖影響
Figure4.
Effects of MMBS on the proliferation of HBSMCs
圖4
MMBS對HBSMCs的增殖影響
Figure4.
Effects of MMBS on the proliferation of HBSMCs
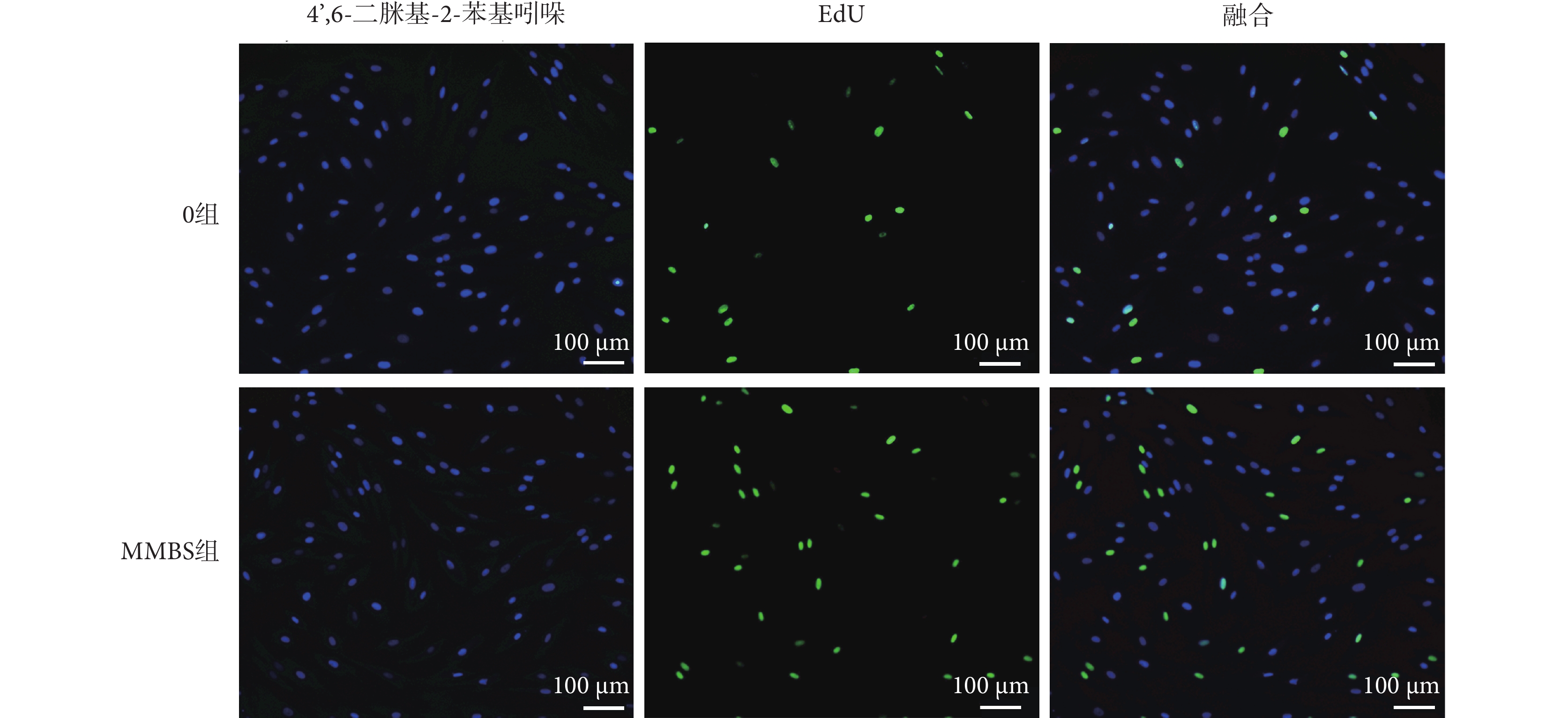
如圖5所示,經MMBS加載的HBSMCs在靜態培養48 h后仍保持明顯的增殖活性。
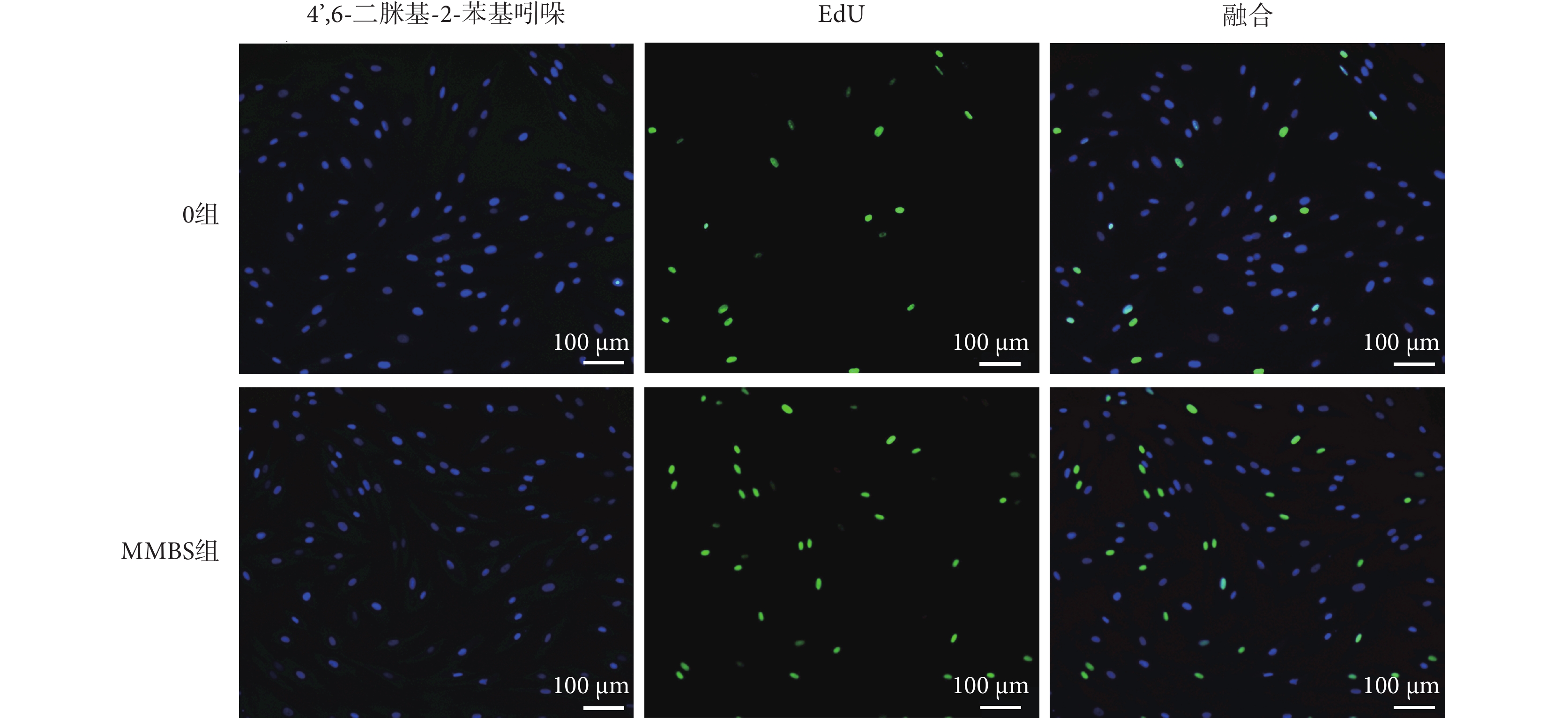 圖5
EdU染色檢測MMBS對HBSMCs的增殖影響
Figure5.
Effects of MMBS on the proliferation of HBSMCs detected by EdU staining
圖5
EdU染色檢測MMBS對HBSMCs的增殖影響
Figure5.
Effects of MMBS on the proliferation of HBSMCs detected by EdU staining
根據以上結果可得出結論:80 cm H2O壓力 + 4%牽張應力組的參數,是最佳的MMBS加載參數,最有效地促進HBSMCs的生長和增殖。
2.2 MMBS促進HBSMCs功能分化成熟標志物的表達
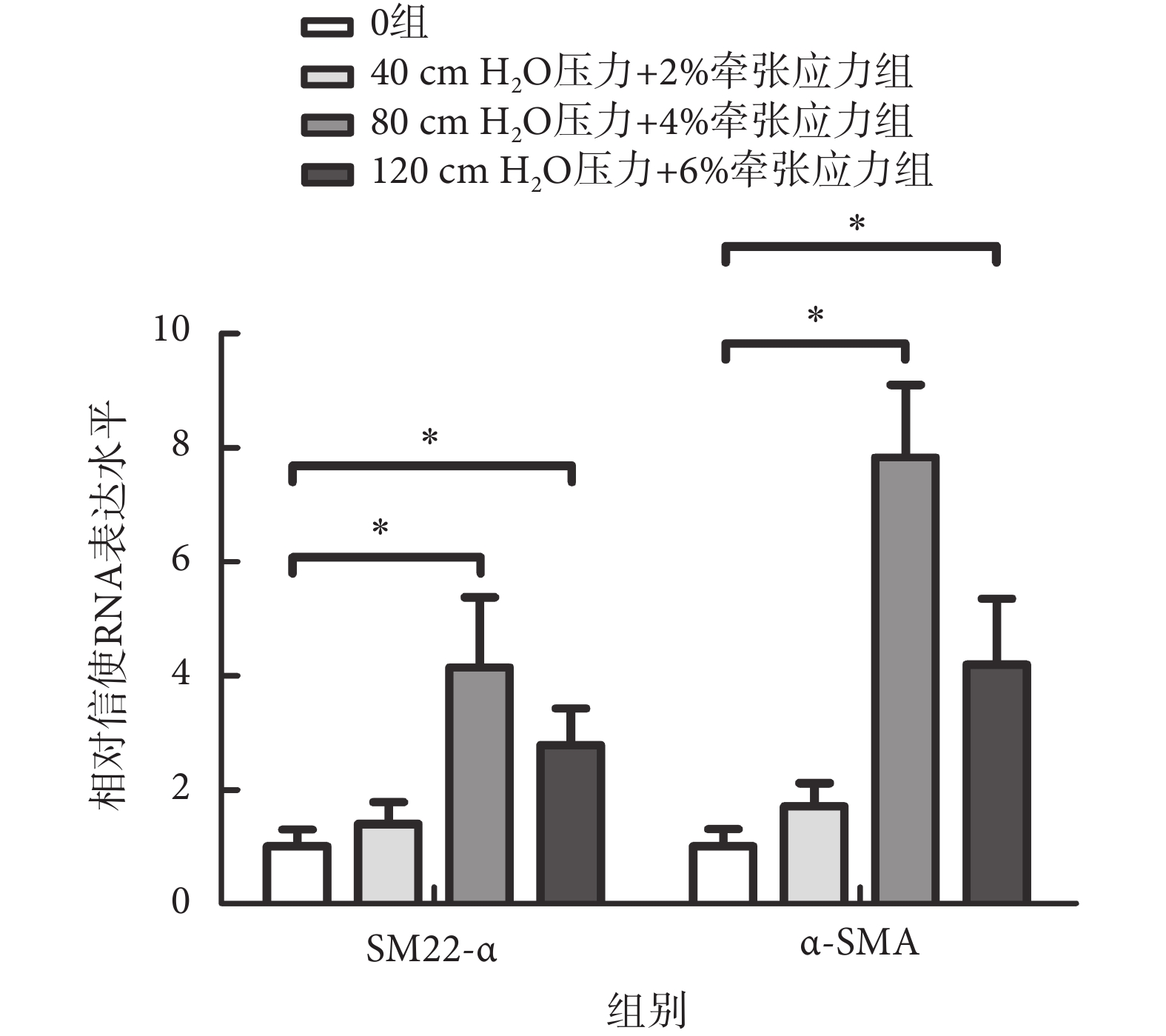
熒光PCR檢測α-SMA及SM22-α基因的轉錄水平,結果如圖6所示,MMBS促進這兩個基因的轉錄,尤其是在80 cm H2O壓力 + 4%牽張應力作用下,SM22-α及α-SMA基因的轉錄水平分別上升了(4.15 ± 1.23)倍,[MD = 3.1(1.1,5.2),P < 0.01]及(7.83 ± 1.27)倍,[MD = 6.8(5.1,8.5),P < 0.01]。
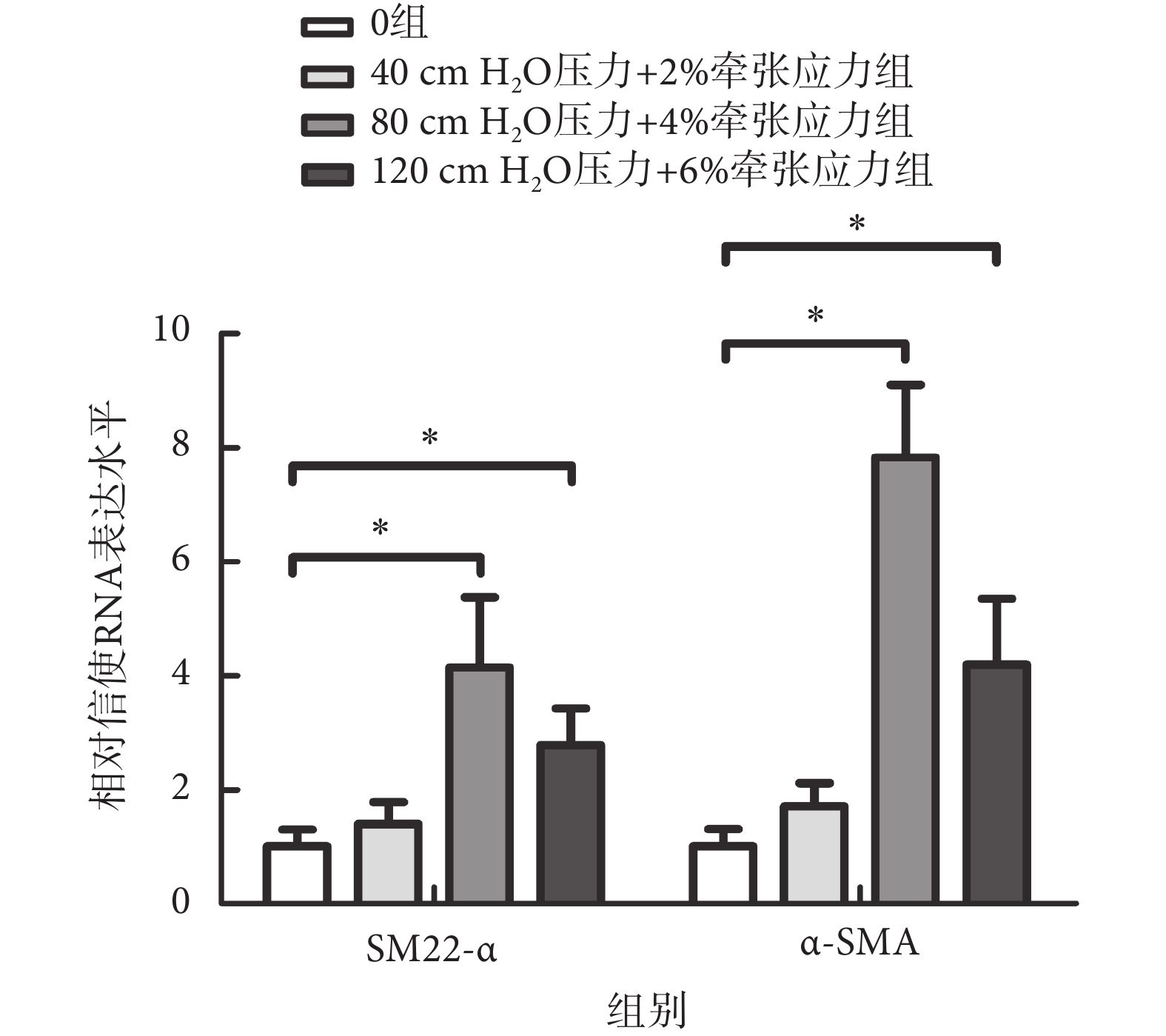 圖6
MMBS對SM22-α及α-SMA基因轉錄的影響
圖6
MMBS對SM22-α及α-SMA基因轉錄的影響
*
*
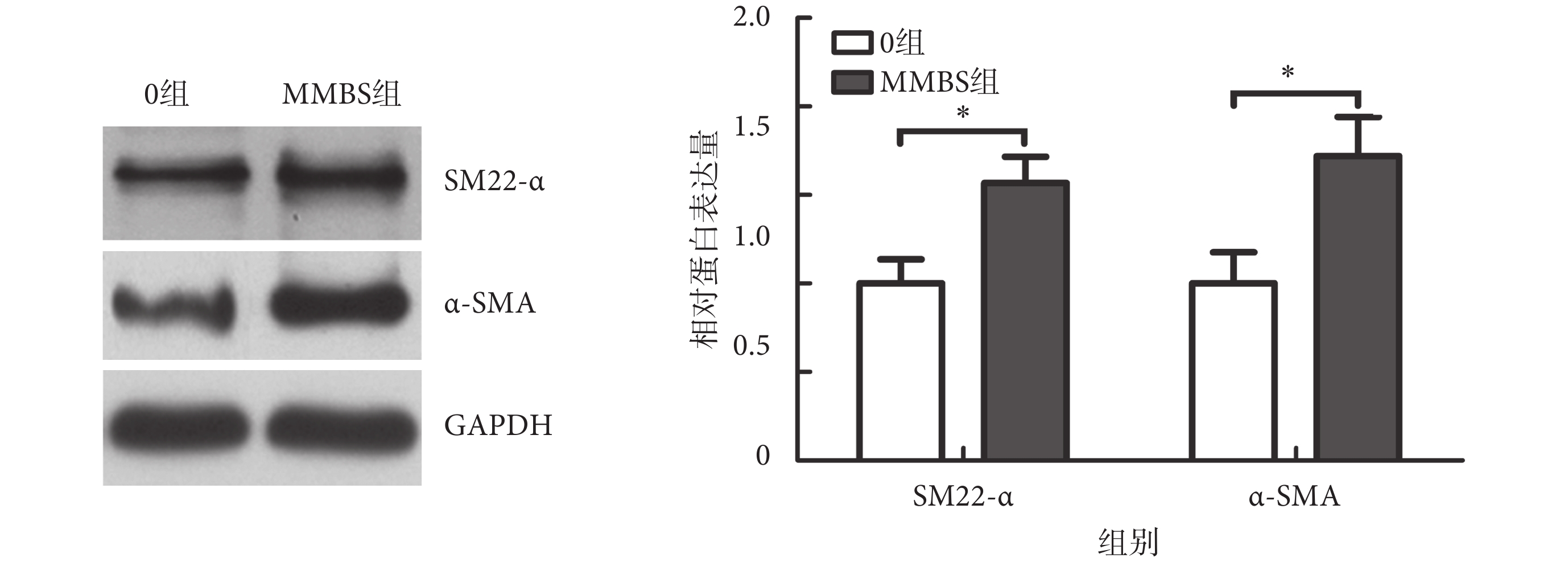
進一步檢測蛋白水平表達,如圖7所示,MMBS促進了α-SMA及SM22-α蛋白的表達。與0組相比,MMBS組的SM22-α及α-SMA蛋白表達分別上升(1.57 ± 0.15)倍,[MD = 0.6(0.2,0.9),P < 0.01]及(1.72 ± 0.22)倍,[MD = 0.7(0.3,1.2),P = 0.01]。
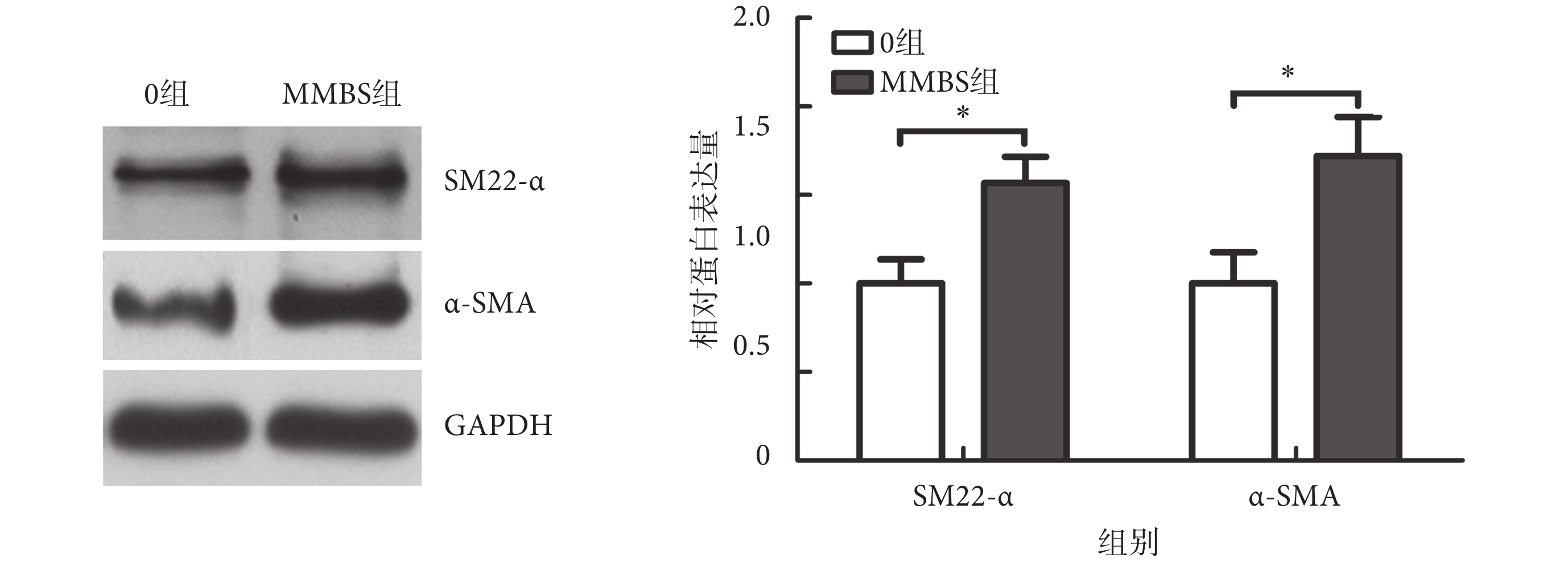 圖7
MMBS對SM22-α及α-SMA蛋白表達的影響
圖7
MMBS對SM22-α及α-SMA蛋白表達的影響
*
*
3 討論
種子細胞、支架材料和調控因素是組織工程的三大要素,在適宜的條件下,通過體外種子細胞與支架材料的復合培養,最終移植到體內進行器官或組織功能的修復。其中,獲取大量有功能的種子細胞是實現組織工程的關鍵先決條件。因此,如何快速、大量擴增細胞及促進細胞分化成熟,成為制約泌尿系統組織工程發展的需首要解決的問題之一[15-16]。研究發現,由于缺乏相應的應力刺激,細胞在體外經過多代培養后,生長活力降低,甚至出現去細胞分化等現象[17-19]。
在組織工程領域骨骼系統及心血管系統相關的研究發現,應力具有改善細胞活力及促進細胞分化的作用,但目前在泌尿系統膀胱方面相關研究比較少。越來越多證據表明,模擬體內應力環境有益于種子細胞增殖、生長、分化及功能的維持。因此,構建生物反應器,模擬體內生物應力環境,達到調控種子細胞生物學行為,已成為組織工程器官的研究熱點[17, 20-21]。例如,在組織工程心血管系統研究中發現應力具有優化組織結構及功能的效應[7, 22]。類似地,在組織工程骨骼系統的研究中也發現,機械應力對體外構建的骨骼及骨組織是有益的[8-9]。膀胱與心臟、血管及骨骼一樣,其發育也需要應力的調節[6, 23]。為探索應力對膀胱組織工程的作用,研究者們開始了一些初步的探索。在國外,一研究小組構建了一個氣壓生物反應器,該反應器在一定程度上模擬了膀胱的內壓力,但缺乏牽張應力的作用。此外,該壓力由壓縮氣體產生,而膀胱實際體內壓力主要由液體充盈產生[24]。因此,模擬膀胱內應力的研究仍需要進一步探索。為在體外模擬日常狀態下膀胱所受的力學環境,本研究小組在前期研究中成功建立了兩套應力加載培養系統,其中一套是牽張應力加載培養系統BioDynamic?,能加載不同強度的軸向牽張應力。在牽張應力的研究發現,對HBSMCs加載周期性牽張應力后,細胞排列更加有序,同時HBSMCs由分泌表型向收縮表型轉換[14]。另一套是壓力施加系統,能施加不同強度的壓力。在壓力研究中發現,一定大小的周期性壓力對HBSMCs增殖有促進作用[25-27]。綜合上述研究結果發現,不同種類的應力施加模式可產生不同的生物學效應。顯然,促進種子細胞生長,同時促進或維持細胞功能分化成熟,單靠牽張應力或壓力施加培養系統是無法實現的。
上述生物反應器加載應力單一的缺陷,可以通過自主設計的MMBS培養系統加以彌補,如圖1所示。該系統可以將壓力、剪切力及非軸向牽張應力同時或單獨、順序或交替加載,從而更好地模擬膀胱所處的應力環境。如圖3~圖5所示,MMBS促進了HBSMCs生長及增殖,80 cm H2O壓力聯合4%牽張應力是促進HBSMCs生長及增殖的最佳應力加載參數。這些最佳應力加載參數的研究將有利于為解決在構建組織工程器官過程中所遇到的細胞生長活力低下等問題提供有效的方法,找到適合組織工程種子細胞生長和增殖的力學培養微環境。
在組織工程領域,細胞的分化和功能對于構建功能性組織工程器官至關重要。血管再生醫學領域的研究表明,通過控制干細胞或成體細胞向平滑肌細胞的分化,可以促進血管組織的再生和修復[28]。膀胱是一個動態運動器官,能儲存尿液,同時也能收縮排空。維持膀胱這些生理功能依賴于正常分化的HBSMCs。α-SMA和SM22-α是HBSMCs中常用的兩種標志物,它們在細胞功能中起著重要作用[29]。α-SMA是平滑肌肌動蛋白的一種亞型,在肌肉收縮和細胞骨架的維持中發揮關鍵作用,α-SMA的表達反映了細胞的收縮能力和肌肉功能[30]。另一方面,SM22-α是一種結構蛋白,在細胞的收縮和運動過程中發揮作用,SM22-α的表達也能反映細胞的收縮能力和肌肉功能[31]。如圖6~圖7所示,本研究發現MMBC可以促進α-SMA和SM22-α的表達,使得去細胞分化等問題得到了一定程度上的解決。這一發現奠定了HBSMCs功能分化成熟研究的基礎,并將最終幫助構建具有功能性的組織工程膀胱。
與早期的結果相比較,該系統不僅能更好地模擬真實膀胱所受到的應力,還能用較小強度的應力調節HBSMCs的生物學功能[25]。以往需要達到200 cm H2O的壓力才能促進細胞增殖,而本研究僅需要80 cm H2O,加載MMBS的細胞在停止力學刺激48 h后依然保持著明顯的增殖活性。此外,不適的應力可導致組織或器官功能障礙,例如膀胱出口梗阻及神經源性膀胱產生的病理性應力可導致膀胱功能受損,而高血壓會引起心血管疾病等[32-35]。該系統能產生的壓力范圍為0~200 cm H2O,根據需要增加模塊還可以增加壓力。因此,該系統不僅能模擬生理狀況下的應力,還能模擬一些病理狀態下的應力,為一些力學相關的組織重塑性疾病提供研究模型。
本實驗尚存一些不足。由于本實驗為細胞實驗,為驗證結果的可靠性,下一步將進行體內動物實驗。受實驗設備的限制,牽張應力的產生是依賴壓力作用在彈性生物膜上產生的,因此后續的研究需增加牽張應力的獨立加載控制裝備。此外,由于研究時間的限制,應力加載時長僅為24 h,所以后續研究需要對應力加載時間進行延長。
4 結論
MMBS培養系統成功地模擬了膀胱所受的復合應力,并能促進HBSMCs的生長、增殖和功能的分化。利用該系統來調節細胞生物學功能,有助于確定適宜組織工程種子細胞生長和增殖的力學培養微環境,為解決構建組織工程器官時所遇到的細胞生長活力低下和細胞失去分化成熟等問題提供了有效的研究方法。此外,該系統還可以模擬一些病理狀態下的應力,為研究力學相關的組織重塑性疾病提供研究模型。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:韋堂墻主要負責實驗的設計、執行、數據的分析及論文的撰寫;陳林主要負責實驗的指導及數據的分析;胡海峰負責數據收集及整理;楊進主要負責實驗的設計、實驗指導、論文寫作指導及修改。
0 引言
越來越多的證據表明,力學環境或應力對組織和器官的發育至關重要。在組織工程心血管的研究中發現,缺乏適當的應力會導致細胞從支架脫落、細胞去分化等現象,而給予適宜的應力刺激后,細胞生長活力增加,細胞功能更加完善[1-3]。膀胱發育也需要應力。在胎兒期,膀胱每小時充盈伴隨壓力升高,然后通過持續幾秒的收縮,排空膀胱[4-5]。若轉流膀胱尿液,讓膀胱失去尿液周期性的充盈與排空,會造成膀胱細胞生長停滯、膀胱壁變薄[6]。因此可以看出,應力對組織或器官的發育起著重要作用。
運用應力促進組織器官發育及功能成熟已在組織工程骨骼系統及心血管系統中得到廣泛深入的研究[7-9]。然而,應力對組織工程膀胱的作用還未得到足夠重視[10]。膀胱的結構與骨骼、心血管相差巨大,且日常體內所處的應力環境也不同,比如:骨骼承受的應力強度巨大,但產生形變僅有0.1%,而膀胱內壓一般不超過40 cm H2O,但會產生很大的形變;心血管系統主要受到剪切力及壓力的調節,而膀胱受到的壓力遠小于血管,但卻承受著巨大的牽張應力。因此,不能簡單地將其它系統中的研究成果直接應用到組織工程膀胱的研究中。此外,現有的生物反應器施加應力比較單一,不能很好地模擬膀胱所受到的復合應力[11-12]。故,有必要構建一套適合組織工程膀胱的應力培養系統,即多模化仿生應力(multi-modal biomimetic stress,MMBS)培養系統,該系統能同時或交替加載壓力、牽張應力及剪切力。本研究將運用MMBS培養系統模擬膀胱體內所承受到的復合應力,以研究這些應力對人膀胱平滑肌細胞(human bladder smooth muscle cells,HBSMCs)的生物學功能的影響,為研究應力如何促進組織工程種子細胞生長和功能成熟提供基礎。
1 材料與方法
1.1 材料與儀器
細胞培養相關耗材:HBSMCs(ScienCell,美國);胎牛血清與杜爾貝科改良伊格爾培養基(Dulbecco’s modified Eagle’s medium,DMEM)(Hyclone,美國);胰蛋白酶(GIBCO,美國)。檢測基因轉錄相關試劑:提取總RNA試劑、反轉錄試劑盒及熒光聚合酶鏈反應(Polymerase chain reaction,PCR)試劑盒(寶生物工程(大連)有限公司,中國);PCR引物(上海生工公司,中國)。檢測細胞生長及增殖相關試劑與設備:細胞計數試劑盒8(cell counting kit-8,CCK-8)及碘化丙啶(碧云天,中國);5-乙炔基-2’脫氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EdU)細胞增殖檢測試劑盒(翌圣生物科技,中國);4',6-二脒基-2苯基吲哚(賽維爾生物,中國);流式細胞儀(Gallios,Beckman Coulter,美國)。檢測蛋白表達相關抗體:抗甘油醛-3-磷酸脫氫酶(Glyceraldehyde -3-phosphate dehydrogenase,GAPDH)抗體(Cell Signaling Technology,美國);抗α-平滑肌肌動蛋白(alpha-smooth muscle actin,α-SMA)和平滑肌蛋白22-α(smooth muscle protein 22-α,SM22-α)抗體(Abcam,英國)。
1.2 細胞培養
HBSMCs置于含10%胎牛血清的DMEM(含0.1 mg/L鏈霉素和100 U/mL青霉素)中貼壁培養,放入37 ℃、5% CO2體積分數及飽和濕度的培養箱中。選取3~7代生長活力良好、形態正常的HBSMCs進行實驗。
1.3 MMBS培養系統的構建與運用
1.3.1 構建MMBS培養系統
為了模擬生理狀態下膀胱受到的周期性壓力和牽張應力,本實驗采用自主設計的生物反應器,即MMBS培養系統,如圖1所示。該系統通過水泵提供動力,使培養艙內的壓力升高,導致彈性膜的擴張,隨著壓力逐漸降低,彈性膜逐漸恢復正常,模擬膀胱從空虛到充盈再到空虛的應力過程。通過測量體積監測艙內液體體積的變化來評估膜形變大小,即牽張應力=體積監測艙內流出液體的體積/體積監測艙原有液體體積 × 100%。
 圖1
MMBS培養系統
Figure1.
MMBS culture system
圖1
MMBS培養系統
Figure1.
MMBS culture system
1.3.2 MMBS的加載模式及實驗分組
MMBS培養艙置于37 ℃,5% CO2孵箱里,如圖1所示。在培養艙內種植一定數量的HBSMCs(1 × 105 個/mL),并靜置培養6 h,以確保細胞充分貼壁后再施加MMBS。應力加載方式如圖2所示:每4 h循環一次,模擬膀胱從空虛到充盈再到空虛的過程,在前3 h,培養艙內壓力(以符號α表示)及牽張應力(以符號β表示)分別緩慢上升,并維持0.5 h,然后在0.5 h內下降至0;共完成6個周期的MMBS加載。體內膀胱內壓上限為40 cm H2O,結合預實驗及前期牽張應力研究結果,選擇了40 cm H2O的壓力梯度來進行實驗分組[13]。α取值為0、40、80、120 cm H2O;對應β取值0%、2%、4%、6%。即,實驗共分4組:① 靜態培養組(以下簡稱:0組):α及β均取值為0;② 40 cm H2O壓力 + 2%牽張應力組:α取值為40 cm H2O,β取值為2%;③ 80 cm H2O壓力+4%牽張應力組:α取值為80 cm H2O,β取值為4%;④ 120 cm H2O壓力 + 6%牽張應力組:α取值為120 cm H2O,β取值為6%。
 圖2
MMBS加載模式
Figure2.
MMBS loading mode
圖2
MMBS加載模式
Figure2.
MMBS loading mode
1.4 MMBS對HBSMCs生長及增殖的影響
1.4.1 MMBS對HBSMCs生長的影響
對HBSMCs加載MMBS持續24 h,然后使用胰蛋白酶消化細胞,并制成5×105 個/mL的細胞懸液。根據CCK-8試劑說明,在96孔板中每孔加入200 μL細胞懸液,37 ℃中孵育培養4 h,然后加入20 μL CCK-8試劑,再在37 ℃中孵育培養2 h。最后,使用全自動酶標儀在波長450 nm下測吸光度A值。
1.4.2 MMBS對HBSMCs增殖的影響
將HBSMCs與硅膠膜復合后,置于無血清的DMEM中饑餓過夜。經過加載MMBS后,使用流式細胞術檢測細胞周期,并使用流式周期分析軟件ModFit 3.2(Verity Software House,美國)進行結果分析,以細胞增殖指數衡量細胞增殖活性。另外,經過加載MMBS后的細胞繼續靜態培養48 h,然后EdU染色檢測細胞增殖:首先EdU染色HBSMCs,緊接著4',6-二脒基-2苯基吲哚染色細胞核,最后在熒光顯微鏡下觀察染色結果并采集圖片。
1.5 MMBS對HBSMCs功能分化成熟的影響
1.5.1 熒光PCR檢測功能分化成熟基因的轉錄
參照1.3.2小節,實驗分組為:① 0組;② 40 cm H2O壓力+2%牽張應力組;③ 80 cm H2O壓力 + 4%牽張應力組(以下簡稱為:MMBS組);④ 120 cm H2O壓力 + 6%牽張應力組。對HBSMCs完成MMBS作用后,提取總RNA。隨后,根據反轉錄試劑盒試劑說明書合成互補DNA。最后,使用熒光PCR檢測α-SMA和SM 22-α基因的轉錄水平[14]。
1.5.2 蛋白免疫印跡檢測功能分化成熟標志物的蛋白表達
根據熒光PCR的檢測結果,參照1.3.2小節和1.5.1小節,實驗分組為:① 0組;② MMBS組。收獲HBSMCs后,使用蛋白免疫印跡檢測α-SMA和SM 22-α的表達水平,然后用圖像處理軟件ImageJ 1.46(National Institutes of Health,美國)分析條帶灰度。
1.6 統計學方法
采用統計分析軟件SPSS 25.0(International Business Machines Corporation,美國)進行統計學分析。數據均以x±s表示。兩組組間比較采用t檢驗,多組間比較采用單因素方差分析,差異應具有統計學意義,檢驗水準為0.05。
2 結果
2.1 MMBS促進HBSMCs生長與增殖
經過24 h的MMBS加載后,使用CCK-8檢測HBSMCs的生長情況,結果如圖3所示,MMBS具有促進HBSMCs生長的效應,其中,80 cm H2O壓力+4%牽張應力組顯示其促進作用最明顯。與0組相比,相對吸光度A值升高了(2.66 ± 0.30)倍,[MD = 1.7(0.9,2.4),P < 0.01]。
 圖3
MMBS對HBSMCs生長的影響
Figure3.
Effects of MMBS on the growth of HBSMCs
圖3
MMBS對HBSMCs生長的影響
Figure3.
Effects of MMBS on the growth of HBSMCs
根據CCK-8檢測結果,實驗分為0組及MMBS組,采用流式細胞技術檢測HBSMCs周期變化,結果如圖4所示,MMBS組的細胞增殖指數從(29.19 ± 4.52)%升高至(53.09 ± 5.57)%,[MD = 23.9(12.4,35.4),P < 0.01]。
 圖4
MMBS對HBSMCs的增殖影響
Figure4.
Effects of MMBS on the proliferation of HBSMCs
圖4
MMBS對HBSMCs的增殖影響
Figure4.
Effects of MMBS on the proliferation of HBSMCs
如圖5所示,經MMBS加載的HBSMCs在靜態培養48 h后仍保持明顯的增殖活性。
 圖5
EdU染色檢測MMBS對HBSMCs的增殖影響
Figure5.
Effects of MMBS on the proliferation of HBSMCs detected by EdU staining
圖5
EdU染色檢測MMBS對HBSMCs的增殖影響
Figure5.
Effects of MMBS on the proliferation of HBSMCs detected by EdU staining
根據以上結果可得出結論:80 cm H2O壓力 + 4%牽張應力組的參數,是最佳的MMBS加載參數,最有效地促進HBSMCs的生長和增殖。
2.2 MMBS促進HBSMCs功能分化成熟標志物的表達
熒光PCR檢測α-SMA及SM22-α基因的轉錄水平,結果如圖6所示,MMBS促進這兩個基因的轉錄,尤其是在80 cm H2O壓力 + 4%牽張應力作用下,SM22-α及α-SMA基因的轉錄水平分別上升了(4.15 ± 1.23)倍,[MD = 3.1(1.1,5.2),P < 0.01]及(7.83 ± 1.27)倍,[MD = 6.8(5.1,8.5),P < 0.01]。
 圖6
MMBS對SM22-α及α-SMA基因轉錄的影響
圖6
MMBS對SM22-α及α-SMA基因轉錄的影響
*
*
進一步檢測蛋白水平表達,如圖7所示,MMBS促進了α-SMA及SM22-α蛋白的表達。與0組相比,MMBS組的SM22-α及α-SMA蛋白表達分別上升(1.57 ± 0.15)倍,[MD = 0.6(0.2,0.9),P < 0.01]及(1.72 ± 0.22)倍,[MD = 0.7(0.3,1.2),P = 0.01]。
 圖7
MMBS對SM22-α及α-SMA蛋白表達的影響
圖7
MMBS對SM22-α及α-SMA蛋白表達的影響
*
*
3 討論
種子細胞、支架材料和調控因素是組織工程的三大要素,在適宜的條件下,通過體外種子細胞與支架材料的復合培養,最終移植到體內進行器官或組織功能的修復。其中,獲取大量有功能的種子細胞是實現組織工程的關鍵先決條件。因此,如何快速、大量擴增細胞及促進細胞分化成熟,成為制約泌尿系統組織工程發展的需首要解決的問題之一[15-16]。研究發現,由于缺乏相應的應力刺激,細胞在體外經過多代培養后,生長活力降低,甚至出現去細胞分化等現象[17-19]。
在組織工程領域骨骼系統及心血管系統相關的研究發現,應力具有改善細胞活力及促進細胞分化的作用,但目前在泌尿系統膀胱方面相關研究比較少。越來越多證據表明,模擬體內應力環境有益于種子細胞增殖、生長、分化及功能的維持。因此,構建生物反應器,模擬體內生物應力環境,達到調控種子細胞生物學行為,已成為組織工程器官的研究熱點[17, 20-21]。例如,在組織工程心血管系統研究中發現應力具有優化組織結構及功能的效應[7, 22]。類似地,在組織工程骨骼系統的研究中也發現,機械應力對體外構建的骨骼及骨組織是有益的[8-9]。膀胱與心臟、血管及骨骼一樣,其發育也需要應力的調節[6, 23]。為探索應力對膀胱組織工程的作用,研究者們開始了一些初步的探索。在國外,一研究小組構建了一個氣壓生物反應器,該反應器在一定程度上模擬了膀胱的內壓力,但缺乏牽張應力的作用。此外,該壓力由壓縮氣體產生,而膀胱實際體內壓力主要由液體充盈產生[24]。因此,模擬膀胱內應力的研究仍需要進一步探索。為在體外模擬日常狀態下膀胱所受的力學環境,本研究小組在前期研究中成功建立了兩套應力加載培養系統,其中一套是牽張應力加載培養系統BioDynamic?,能加載不同強度的軸向牽張應力。在牽張應力的研究發現,對HBSMCs加載周期性牽張應力后,細胞排列更加有序,同時HBSMCs由分泌表型向收縮表型轉換[14]。另一套是壓力施加系統,能施加不同強度的壓力。在壓力研究中發現,一定大小的周期性壓力對HBSMCs增殖有促進作用[25-27]。綜合上述研究結果發現,不同種類的應力施加模式可產生不同的生物學效應。顯然,促進種子細胞生長,同時促進或維持細胞功能分化成熟,單靠牽張應力或壓力施加培養系統是無法實現的。
上述生物反應器加載應力單一的缺陷,可以通過自主設計的MMBS培養系統加以彌補,如圖1所示。該系統可以將壓力、剪切力及非軸向牽張應力同時或單獨、順序或交替加載,從而更好地模擬膀胱所處的應力環境。如圖3~圖5所示,MMBS促進了HBSMCs生長及增殖,80 cm H2O壓力聯合4%牽張應力是促進HBSMCs生長及增殖的最佳應力加載參數。這些最佳應力加載參數的研究將有利于為解決在構建組織工程器官過程中所遇到的細胞生長活力低下等問題提供有效的方法,找到適合組織工程種子細胞生長和增殖的力學培養微環境。
在組織工程領域,細胞的分化和功能對于構建功能性組織工程器官至關重要。血管再生醫學領域的研究表明,通過控制干細胞或成體細胞向平滑肌細胞的分化,可以促進血管組織的再生和修復[28]。膀胱是一個動態運動器官,能儲存尿液,同時也能收縮排空。維持膀胱這些生理功能依賴于正常分化的HBSMCs。α-SMA和SM22-α是HBSMCs中常用的兩種標志物,它們在細胞功能中起著重要作用[29]。α-SMA是平滑肌肌動蛋白的一種亞型,在肌肉收縮和細胞骨架的維持中發揮關鍵作用,α-SMA的表達反映了細胞的收縮能力和肌肉功能[30]。另一方面,SM22-α是一種結構蛋白,在細胞的收縮和運動過程中發揮作用,SM22-α的表達也能反映細胞的收縮能力和肌肉功能[31]。如圖6~圖7所示,本研究發現MMBC可以促進α-SMA和SM22-α的表達,使得去細胞分化等問題得到了一定程度上的解決。這一發現奠定了HBSMCs功能分化成熟研究的基礎,并將最終幫助構建具有功能性的組織工程膀胱。
與早期的結果相比較,該系統不僅能更好地模擬真實膀胱所受到的應力,還能用較小強度的應力調節HBSMCs的生物學功能[25]。以往需要達到200 cm H2O的壓力才能促進細胞增殖,而本研究僅需要80 cm H2O,加載MMBS的細胞在停止力學刺激48 h后依然保持著明顯的增殖活性。此外,不適的應力可導致組織或器官功能障礙,例如膀胱出口梗阻及神經源性膀胱產生的病理性應力可導致膀胱功能受損,而高血壓會引起心血管疾病等[32-35]。該系統能產生的壓力范圍為0~200 cm H2O,根據需要增加模塊還可以增加壓力。因此,該系統不僅能模擬生理狀況下的應力,還能模擬一些病理狀態下的應力,為一些力學相關的組織重塑性疾病提供研究模型。
本實驗尚存一些不足。由于本實驗為細胞實驗,為驗證結果的可靠性,下一步將進行體內動物實驗。受實驗設備的限制,牽張應力的產生是依賴壓力作用在彈性生物膜上產生的,因此后續的研究需增加牽張應力的獨立加載控制裝備。此外,由于研究時間的限制,應力加載時長僅為24 h,所以后續研究需要對應力加載時間進行延長。
4 結論
MMBS培養系統成功地模擬了膀胱所受的復合應力,并能促進HBSMCs的生長、增殖和功能的分化。利用該系統來調節細胞生物學功能,有助于確定適宜組織工程種子細胞生長和增殖的力學培養微環境,為解決構建組織工程器官時所遇到的細胞生長活力低下和細胞失去分化成熟等問題提供了有效的研究方法。此外,該系統還可以模擬一些病理狀態下的應力,為研究力學相關的組織重塑性疾病提供研究模型。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:韋堂墻主要負責實驗的設計、執行、數據的分析及論文的撰寫;陳林主要負責實驗的指導及數據的分析;胡海峰負責數據收集及整理;楊進主要負責實驗的設計、實驗指導、論文寫作指導及修改。