腫瘤治療電場(TTFields)對腫瘤細胞增殖具有抑制效應,但其抑制機制尚不明晰。TTFields通過電場力破壞細胞微管結構被認為是抑制腫瘤細胞增殖的主要原因,然而這一猜想成立與否還缺乏介觀層面的探究。因此,本文基于細胞微管蛋白的物理結構和電學特性,建立腫瘤細胞微管蛋白在TTFields電場作用下的受力模型,通過理論和仿真分析電場力、力矩分別對微管蛋白單體聚合及α/β異二聚體微管蛋白排列取向的動力學影響。研究結果表明,TTFields對微管蛋白單體的電場力遠小于微管蛋白單體之間的靜電聚合力,對α/β異二聚體微管蛋白所產生的力矩也難以影響其隨機排列取向,進而在介觀尺度上,證明了TTFields難以通過電場力學效應破壞細胞微管結構的穩定性。該結果對TTFields通過電場力破壞細胞微管結構這一傳統觀點表示質疑,并提出在TTFields機制研究中應當更加關注TTFields“非力”效應的新思路。本文的研究可為TTFields的介觀生物電學機制揭示提供可靠的理論依據和激發新的研究方向。
引用本文: 李星, 劉開達, 郭琮, 房天瑞, 楊帆. 腫瘤治療電場對細胞微管蛋白的介觀動力學影響研究. 生物醫學工程學雜志, 2024, 41(3): 569-576. doi: 10.7507/1001-5515.202312063 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
腫瘤治療電場(tumor treating fields,TTFields)是一類中頻(100~300 kHz)、低強度(100~300 V/m)正弦電場,對多種腫瘤細胞的增殖具有抑制效應[1]。臨床試驗證實了TTFields對多種實體腫瘤具有良好的治療效果,有效提高了患者生存期,并具有無侵入、副作用低等優點[2]。據此,美國食品藥品監督管理局(U.S. Food and Drug Administration,FDA)分別于2011年、2015年和2019年授權了TTFields在復發性膠質瘤[3]、新診斷性膠質瘤[3]和間皮瘤[4]治療中的應用。雖然TTFields在臨床中表現良好,但其抑制腫瘤細胞增殖的內在機制尚不明晰,部分醫療人員和患者對該技術持保守甚至懷疑態度。另外,機制不清也不利于臨床應用中的治療方案優化和療效提高,限制了該技術的發展和推廣。
在現有較成熟的電磁場腫瘤治療技術中,電磁場的力學作用和熱效應是殺傷腫瘤細胞的主要機制,例如:電穿孔通過電場力破壞細胞膜結構[5-7],微波消融通過電磁熱燒蝕腫瘤細胞[8]。目前,在TTFields的機制研究中,電場通過電場力、力矩破壞細胞微管的結構,進而抑制腫瘤細胞有絲分裂被認為是TTFields抑制腫瘤細胞增殖的主要原因。這一猜想觀點基于以下事實:細胞骨架是真核細胞中重要的亞結構,在維持細胞正常形態、有絲分裂和胞內物質運輸中發揮著重要作用,細胞骨架由大量的微管構成,而單個微管是由一種具有強電偶極矩的α/β異二聚體微管蛋白(以下簡稱為:微管蛋白二聚體)聚合而成[9];一方面,在微管解聚和聚合活動十分活躍的有絲分裂前中期,TTFields電場通過庫侖力破壞微管蛋白二聚體的正常聚合;另一方面,電場對微管蛋白二聚體電偶極子的力矩將促使微管蛋白二聚體與外電場平行,干擾微管蛋白二聚體在細胞內部正常的排列取向,從而影響微管生長及其結構穩定性,導致有絲分裂失敗[10]。雖然在離體細胞實驗中,已有研究通過熒光圖像觀察到細胞骨架形態異常、子細胞染色體分配不均等現象[10],但這不足以證明TTFields是通過電場力、力矩破壞了微管結構,而有可能是電場所激發的細胞內化學環境失衡等“非力”原因所造成。
針對TTFields對細胞微管電生理活動的潛在影響,為厘清TTFields是否能夠產生足夠強的電場力、力矩效應來破壞細胞微管結構穩定性,本文建立TTFields對微管蛋白單體聚合和微管蛋白二聚體排列取向干擾的力學模型,從生物物理角度,理論研究介觀層面上TTFields對微管蛋白的動力學效應。研究結果表明,腫瘤細胞暴露于TTFields中時,微弱的電場庫侖力和電場力矩對細胞內微管蛋白單體之間的聚合及微管蛋白二聚體的排列取向影響甚微,從而不足以破壞微管結構穩定性,以往細胞實驗現象中所觀察到的細胞骨架異常原因更可能來自于其他“非力”效應。
1 細胞微管蛋白介觀物理模型
1.1 幾何模型
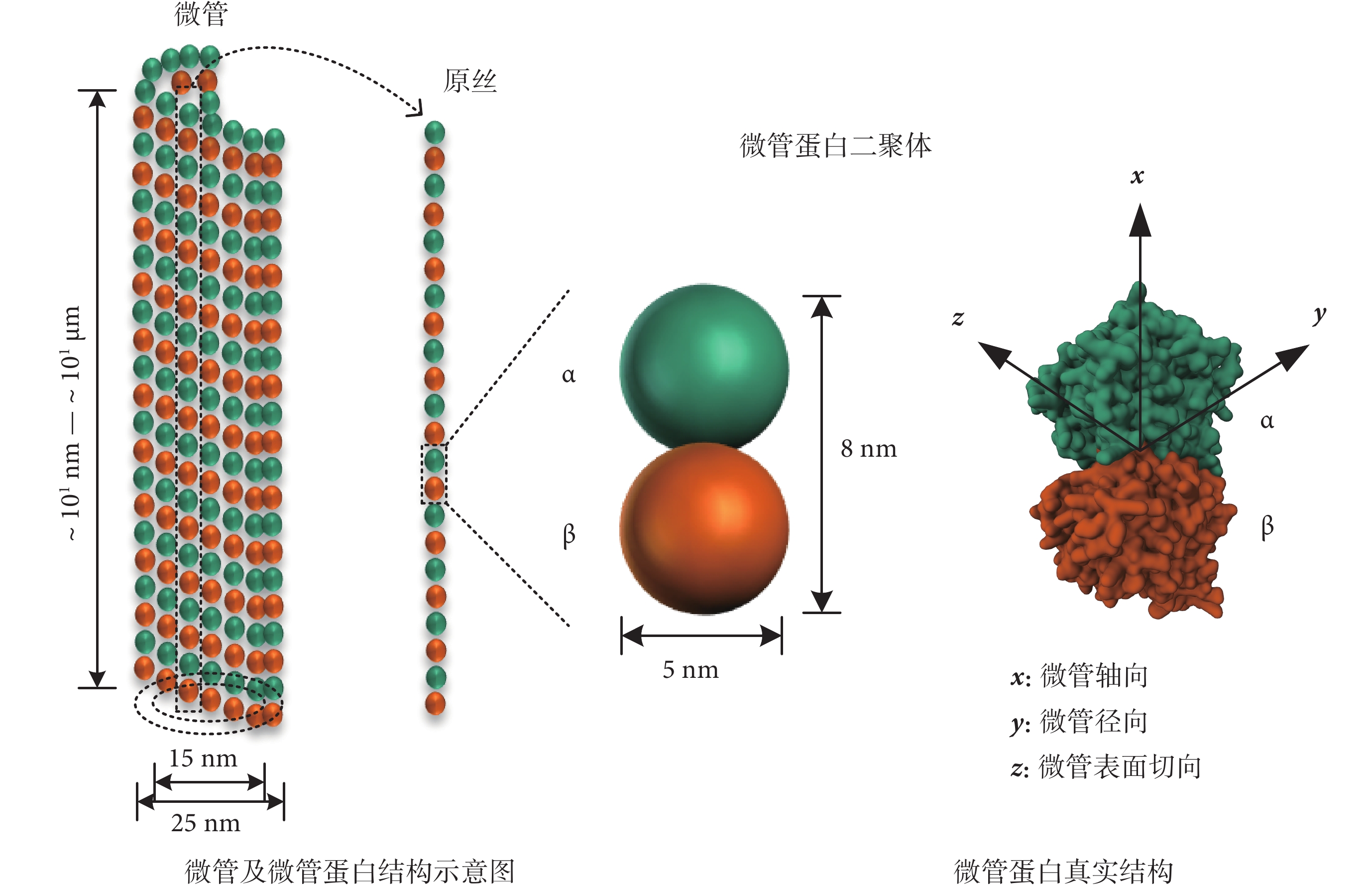
如圖1所示,細胞微管是真核細胞中一種圓柱管狀蛋白質結構,其內、外徑分別約為15 nm和25 nm,其長度一般為幾十納米(nm)到幾十微米(μm)[11]。單個微管一般由13條原絲構成,每一條原絲由微管蛋白二聚體首尾聚合而成,微管蛋白二聚體長度約8 nm,單個微管蛋白二聚體由直徑約5 nm的近似球形微管蛋白單體聚合而成[11]。
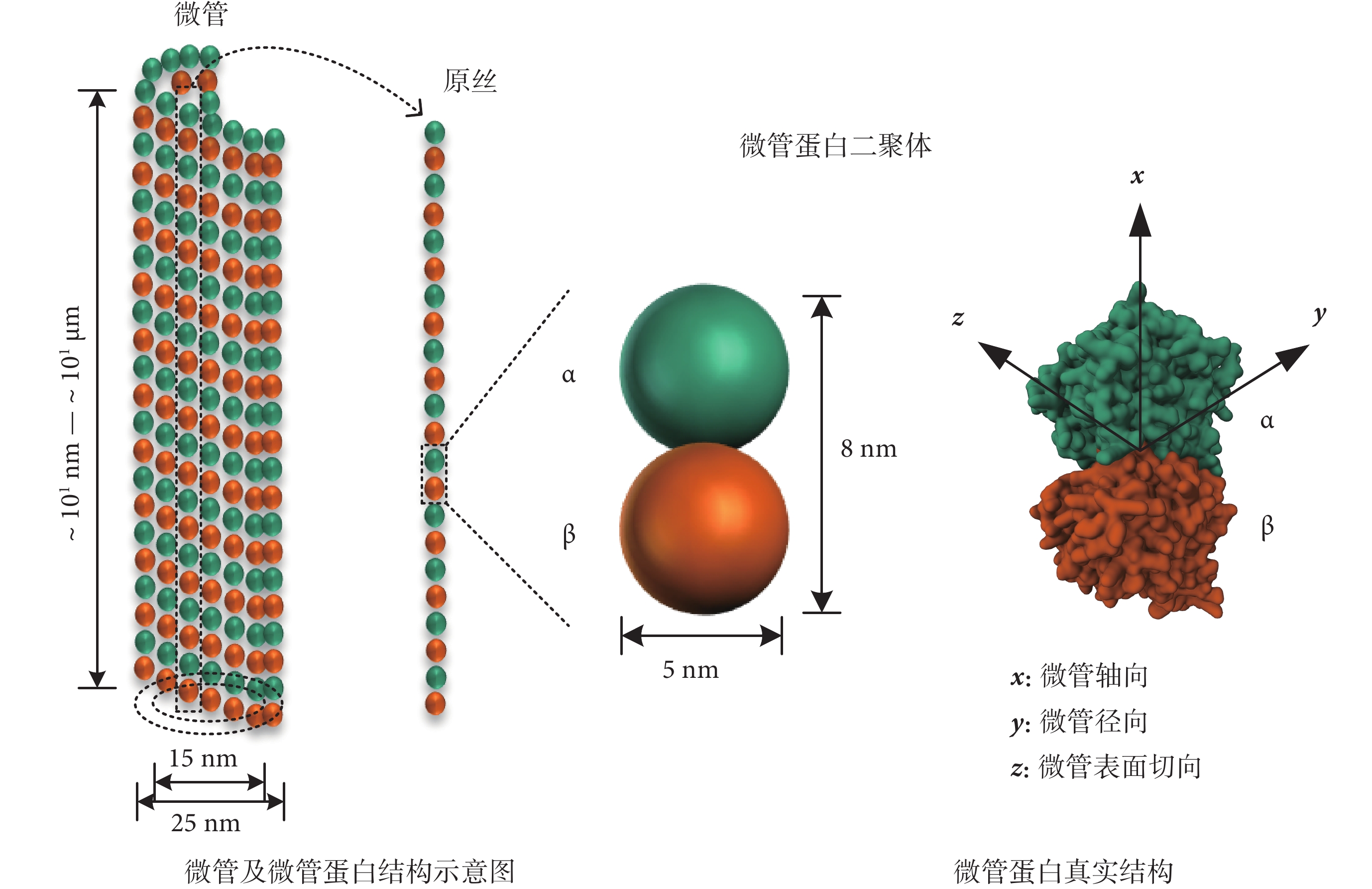 圖1
細胞微管及微管蛋白介觀模型
Figure1.
Mesoscopic model of cell microtubule and tublin
圖1
細胞微管及微管蛋白介觀模型
Figure1.
Mesoscopic model of cell microtubule and tublin
1.2 電學特性
由于氨基酸殘基的存在和非均勻分布,微管蛋白二聚體表面有部分殘余電荷,表現出電極性。在生理條件下的弱堿性環境中,微管蛋白二聚體整體呈負電性[11]。微管蛋白二聚體的整體電極性可以等效為電磁理論中的電偶極子,但其電偶極矩并不是單方向的。在如圖1所示的直角坐標系下,通過分子動力學計算,得到微管蛋白二聚體的電偶極矩分布如表1所示[12]。其中,微管蛋白二聚體的y方向電偶極矩最大,約為1 700 D[單位:德拜(D),1 D ≈ 3.33 × 10?30 C·m]。
2 TTFields作用下細胞內電場分布
為研究TTFields對細胞微管的影響,首先需要明確TTFields在單細胞內部的分布狀態,由于現有實驗技術難以對細胞內部的電場直接測量,本文將對腫瘤細胞處于TTFields中時細胞內部的電場強度分布狀態進行仿真模擬。
人體大多數細胞一般呈不規則梭形,大小在幾十微米左右,典型TTFields的頻率在幾百千赫茲(kHz),因此電磁波的波長遠大于細胞尺度,電磁場的輻射效應可以忽略。當細胞暴露于TTFields中時,由電流連續性原理和全電流定律可以得出細胞內部電場的控制方程,如式(1)所示:
 |
電場與電位之間的關系,如式(2)所示:
 |
其中,E和 分別為電場強度和電位分布,γ和ε分別為細胞仿真計算場域的電導率和介電常數分布,t為時間,?為哈密頓算子。考慮到電場頻率非高頻,TTFields可簡化為準靜態電磁場,即式(1)中第二項位移電流項可以忽略。
分別為電場強度和電位分布,γ和ε分別為細胞仿真計算場域的電導率和介電常數分布,t為時間,?為哈密頓算子。考慮到電場頻率非高頻,TTFields可簡化為準靜態電磁場,即式(1)中第二項位移電流項可以忽略。
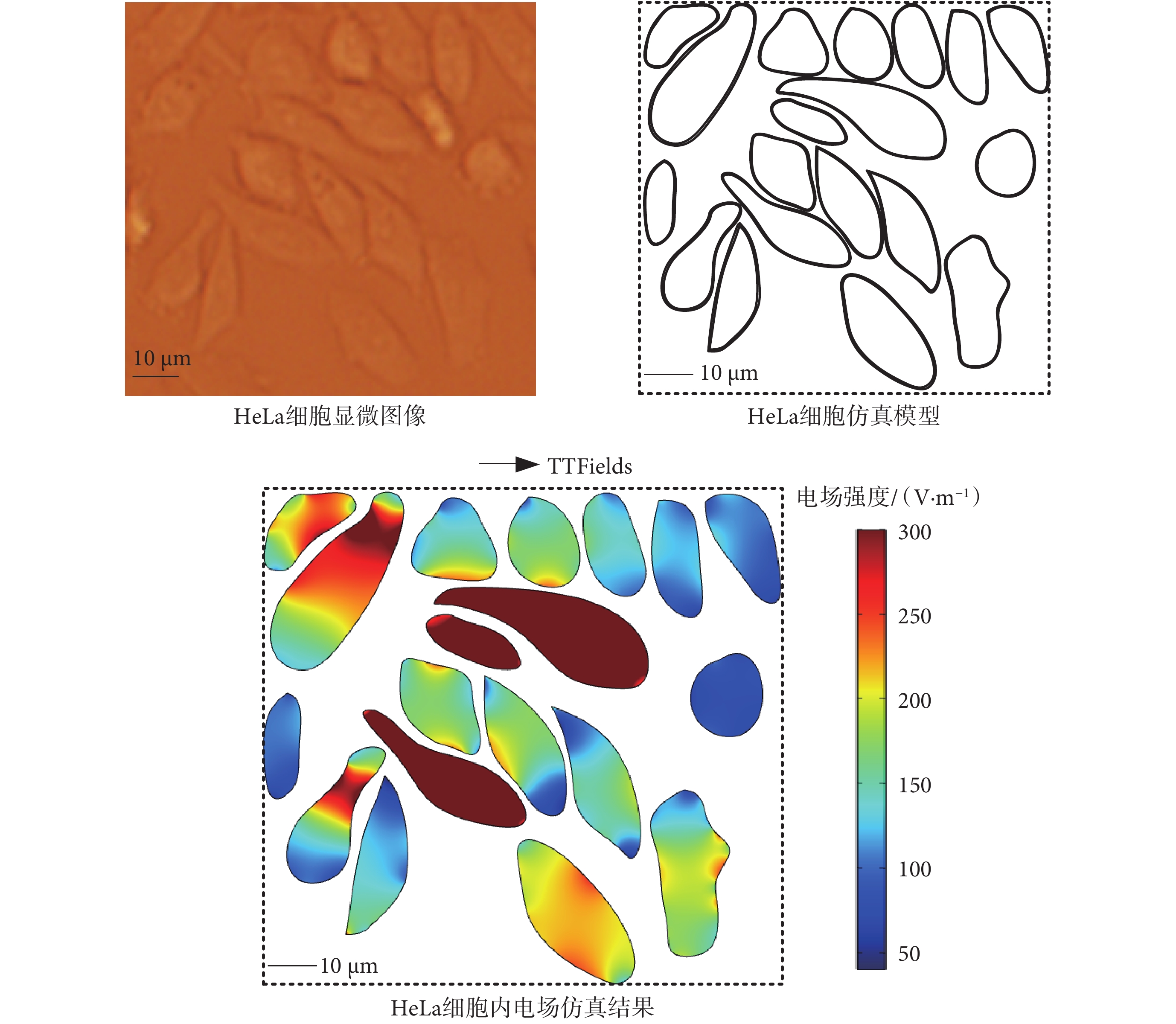
為了更加真實地模擬細胞內電場分布,以宮頸癌HeLa腫瘤細胞(來自加州大學伯克利分校Life Science Addition Storeroom)(以下簡稱為:腫瘤細胞)為例,根據其真實顯微形態,建立不規則腫瘤細胞群體模型如圖2所示。在腫瘤細胞建模中,由于微管結構處于細胞質中,因此忽略了細胞核,并將細胞質等效為各向同性的電解質媒質,單細胞的幾何參數和電學參數如表2所示[13-14]。在仿真模型中,設置TTFields電場方向為水平方向,其頻率和幅值設置為典型值(200 kHz、200 V/m),在多物理場仿真軟件COMSOL(5.3,COMSOL Inc.,瑞士)中,通過交流電(alternating current,AC)/直流電(direct current,DC)模塊頻域穩態求解器對細胞內電場進行計算,得到腫瘤細胞內部的電場分布情況如圖2所示。
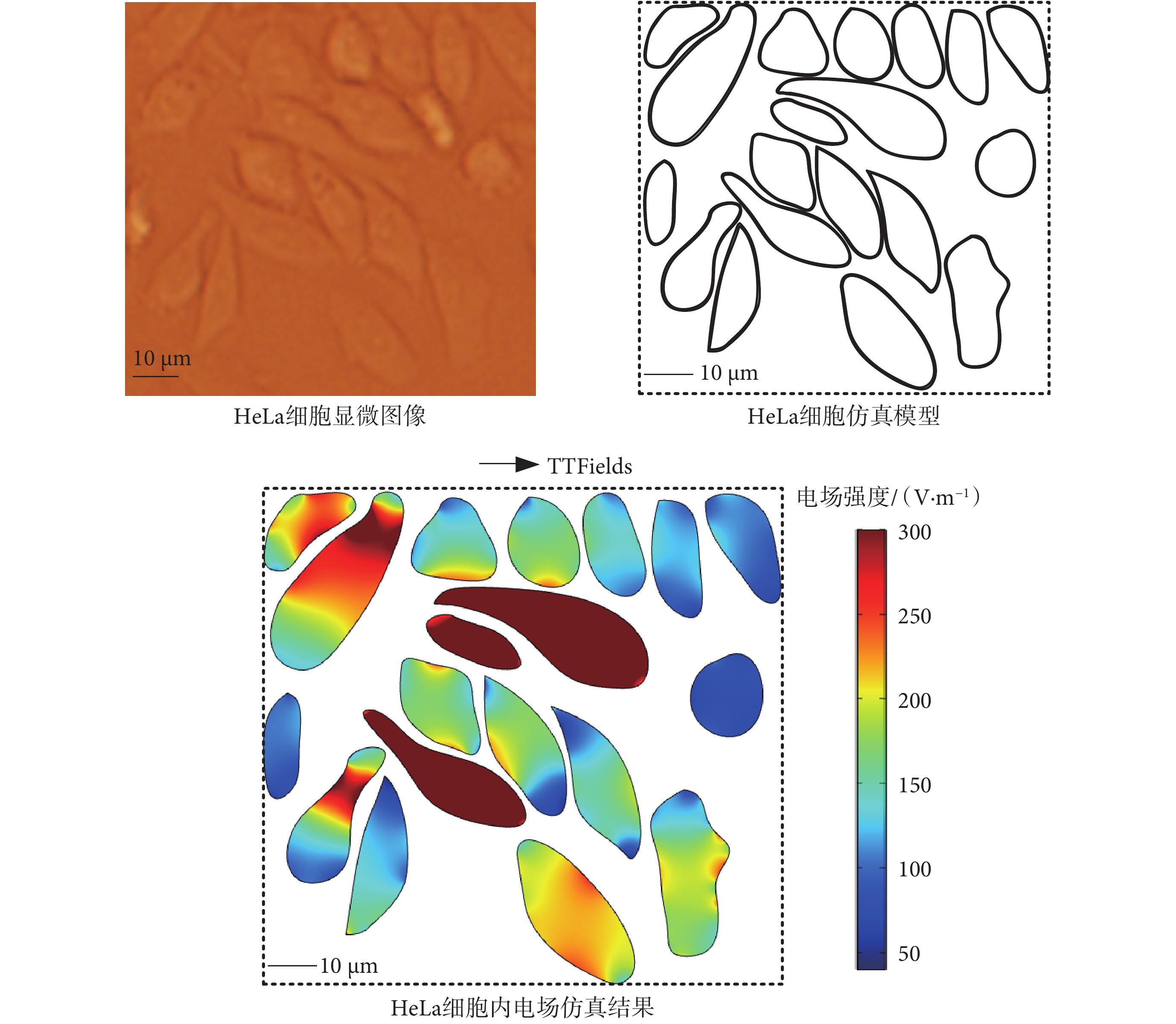 圖2
HeLa細胞內的TTFields強度分布
Figure2.
TTFields intensity distribution in HeLa cells
圖2
HeLa細胞內的TTFields強度分布
Figure2.
TTFields intensity distribution in HeLa cells
根據歐姆定律的微分形式,在電場作用下,場域內電流密度計算如式(3)所示:
 |
其中,J為電流密度,E為電場強度,γ為計算場域的電導率分布。
由于細胞膜的電導率極低,在電流密度一定的情況下,腫瘤細胞膜內的電場強度遠大于細胞質內電場強度,因此仿真結果僅展示細胞質內的電場強度大小分布。從仿真結果看出,當腫瘤細胞處于TTFields中時,由于腫瘤細胞形態的不同,其內部電場大小略有不同。在腫瘤細胞密集處,較大的電壓降落在細胞膜上,導致腫瘤細胞內電場較低,且當腫瘤細胞長軸越傾向于與外電場方向平行時,腫瘤細胞內部電場較強。實際人體組織中,腫瘤細胞以三維形式存在,在同一TTFields作用下,三維腫瘤細胞與二維腫瘤細胞模型中的電場仿真結果略有不同,但整體上腫瘤細胞內電場強度均約為100~300 V/m[15],不會對后續電場力和力矩分析結果產生數量上的差異,因此為簡化建模、提高數值計算效率,本文采用上述二維腫瘤細胞模型進行電場仿真研究。
3 TTFields對微管蛋白的動力學影響
3.1 對微管蛋白單體聚合的影響
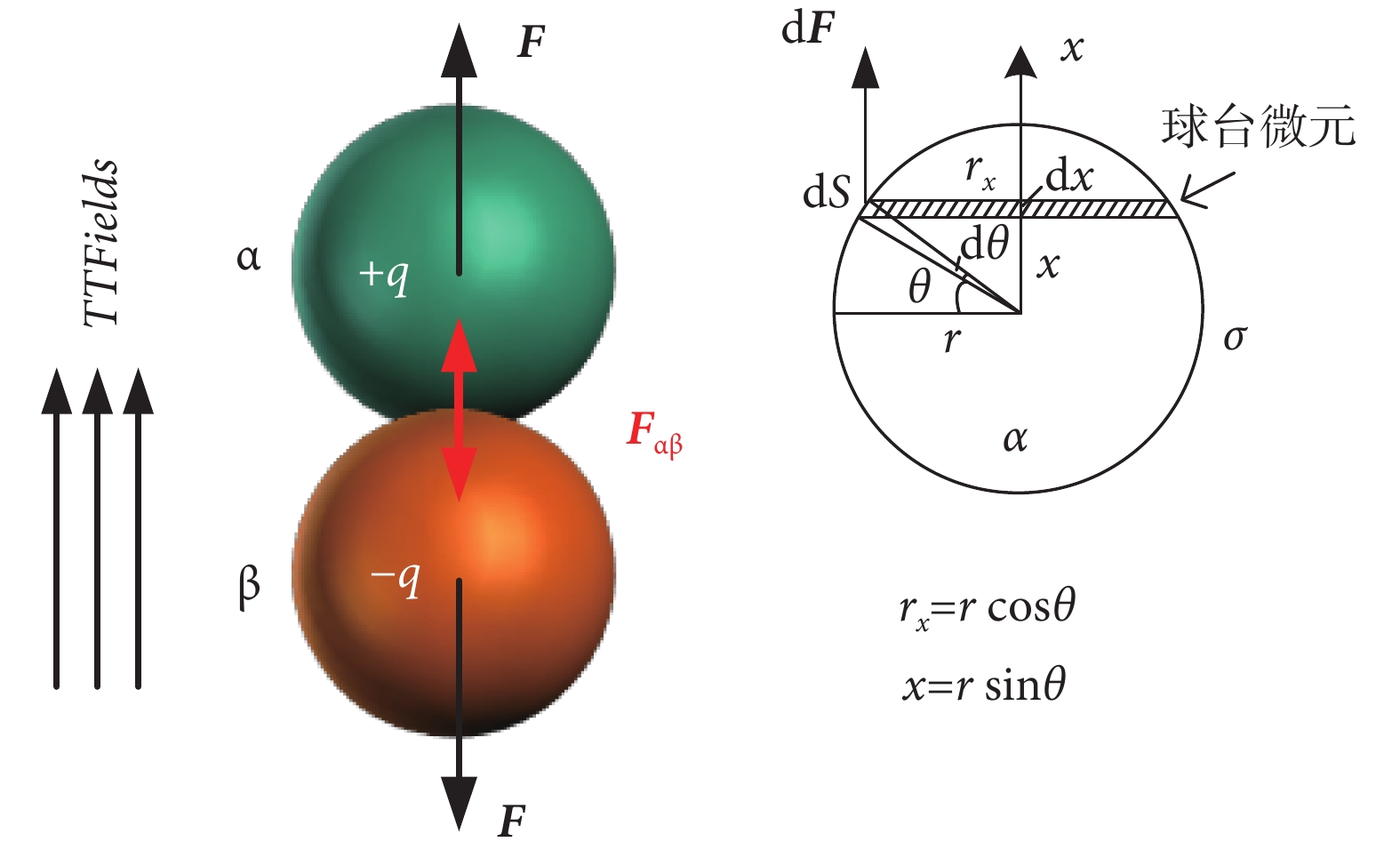
在介觀層面上,細胞內蛋白質之間的聚合依賴于電荷或極性分子之間的靜電力。在微管的裝配過程中,α或β微管蛋白單體先聚合成微管蛋白二聚體,然后微管蛋白二聚體再首尾相接排列裝配形成管狀微管。在上述過程中,α或β微管蛋白單體之間的靜電吸引力發揮著重要作用。當細胞處于外電場中時,外電場對微管蛋白單體的電場力是否有潛在“拉開”微管蛋白單體之間的正常聚合狀態,進而破壞微管穩定聚合結構的影響,是值得探究的。如表1所示,已經表明微管蛋白二聚體有較強的電偶極矩,其x方向電偶極矩約為337 D,且外電場作用在x方向電偶極矩上的電場力最有可能影響微管蛋白聚合穩定性。假設微管蛋白的殘余電荷分布于近似球形的蛋白表面,其面密度分布為σ。由于電偶極矩的存在,可等效為α或β微管蛋白單體帶異種電荷,則在TTFields作用下,微管蛋白α和β單體的受力模型如圖3所示。
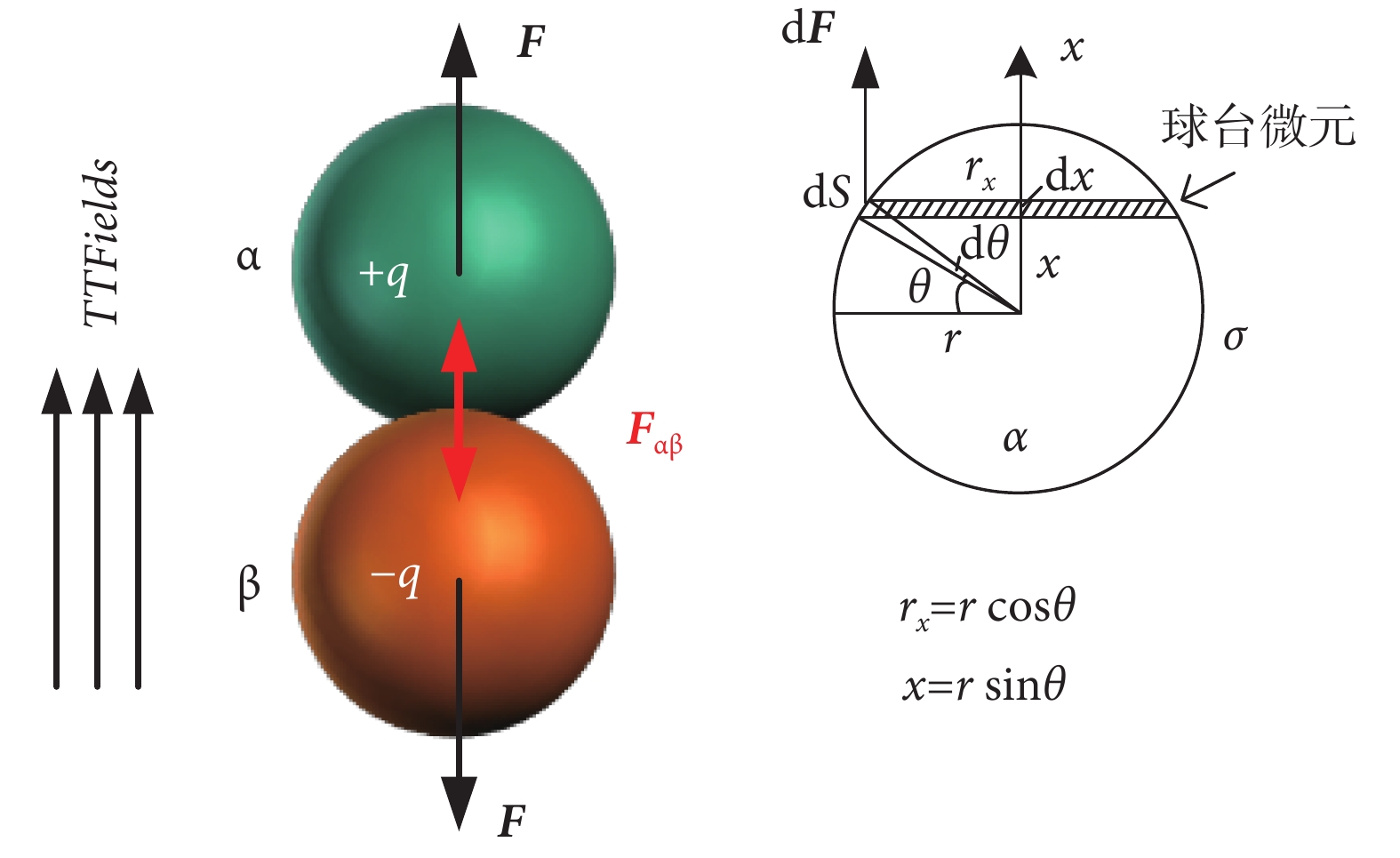 圖3
TTFields對微管蛋白單體的電場力受力模型
Figure3.
The force model of tubulin monomers subjected to TTFields
圖3
TTFields對微管蛋白單體的電場力受力模型
Figure3.
The force model of tubulin monomers subjected to TTFields
由圖3右圖中的幾何關系,對微管蛋白單體球體模型微元化,可得球臺微元側面積,如式(4)所示:
 |
TTFields對α微管蛋白單體的球臺微元的電場力計算,如式(5)所示:
 |
積分可得α微管蛋白單體整體所受電場力,如式(6)所示:
 |
一般地,微管蛋白表面的電荷分布并不均勻,即σ是坐標的函數,如式(6)所示,為簡化積分計算,可認為電荷均勻分布于微管蛋白表面,則可得α微管蛋白單體受到TTFields的電場力,如式(7)所示:
 |
在式(4)~(7)中,dS,dF分別為微管蛋白單體微元球臺側面積及其受到的電場力,E和F分別為TTFields電場強度和微管蛋白單體整體受到的電場力,σ為微管蛋白單體表面電荷密度,r和θ分別為微管蛋白單體半徑及其與水平向左方向的夾角。
由微管蛋白二聚體的x方向電偶極矩可估算得出α微管蛋白單體表面電荷密度約為5.6 mC/m2,若考慮三維方向上的全部電偶極矩,這一數據將與文獻[16]十分吻合。因此,將電荷密度數5.6 mC/m2據代入式(7)可計算得到:強度為200 V/m的典型TTFields對α微管蛋白單體的電場力約為8.8 × 10?5 pN,由于TTFields是交變電場,這也是TTFields在一個作用周期中對微管蛋白單體產生的最大電場力,或稱之為破壞力上限。
在正常的微管聚合活動中,α和β微管蛋白單體之間的靜電吸引力Fαβ在皮牛(pN)級別[17],更有文獻指出,只有當微管受到的張力大于6.59 pN時[18],才有可能破壞微管結構穩定性。從TTFields對微管蛋白單體的電場力計算結果與微管蛋白單體正常聚合的靜電力對比分析來看,TTFields電場力遠小于正常的微管蛋白單體聚合靜電力,因此TTFields難以通過電場力來破壞微管蛋白單體之間的正常聚合。
3.2 對微管蛋白二聚體取向的影響
從電磁場角度看,電場不僅對電偶極子正負電荷有相反的電場力,若外電場與電偶極矩方向不平行,電場力還會產生改變電偶極子取向的電場力扭矩。在TTFields作用下,電場力難以破壞微管蛋白單體之間的正常聚合,但電場力矩是否會改變微管蛋白二聚體的隨機排列取向,從而干擾微管蛋白二聚體裝配成微管的生理過程,是值得探究的另一個問題。
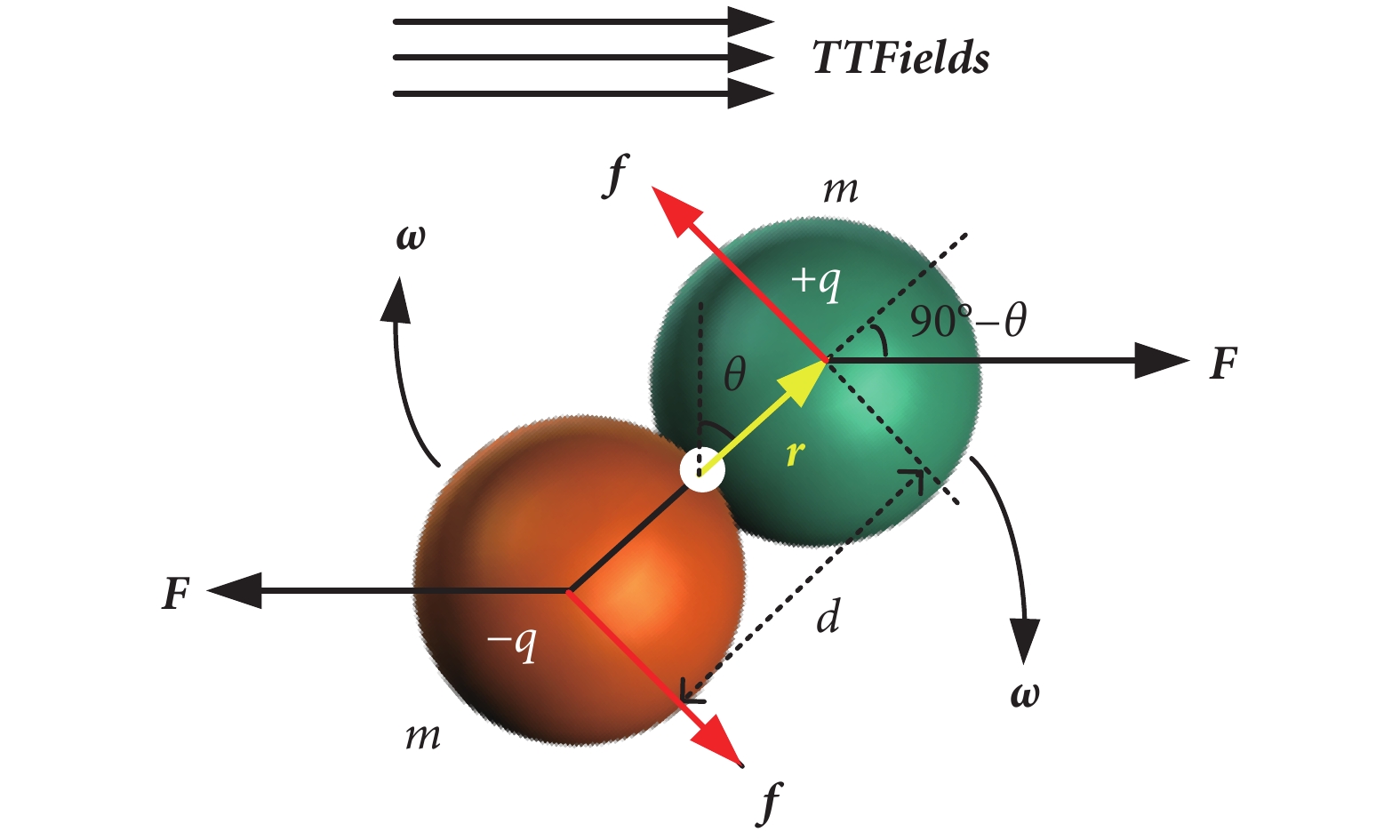
在電場作用下,只有微管蛋白二聚體軸向(x方向)電偶極矩所受的電場力矩有可能改變微管蛋白二聚體的排列取向,因此對微管蛋白二聚體在TTFields作用下進行受力分析如圖4所示。
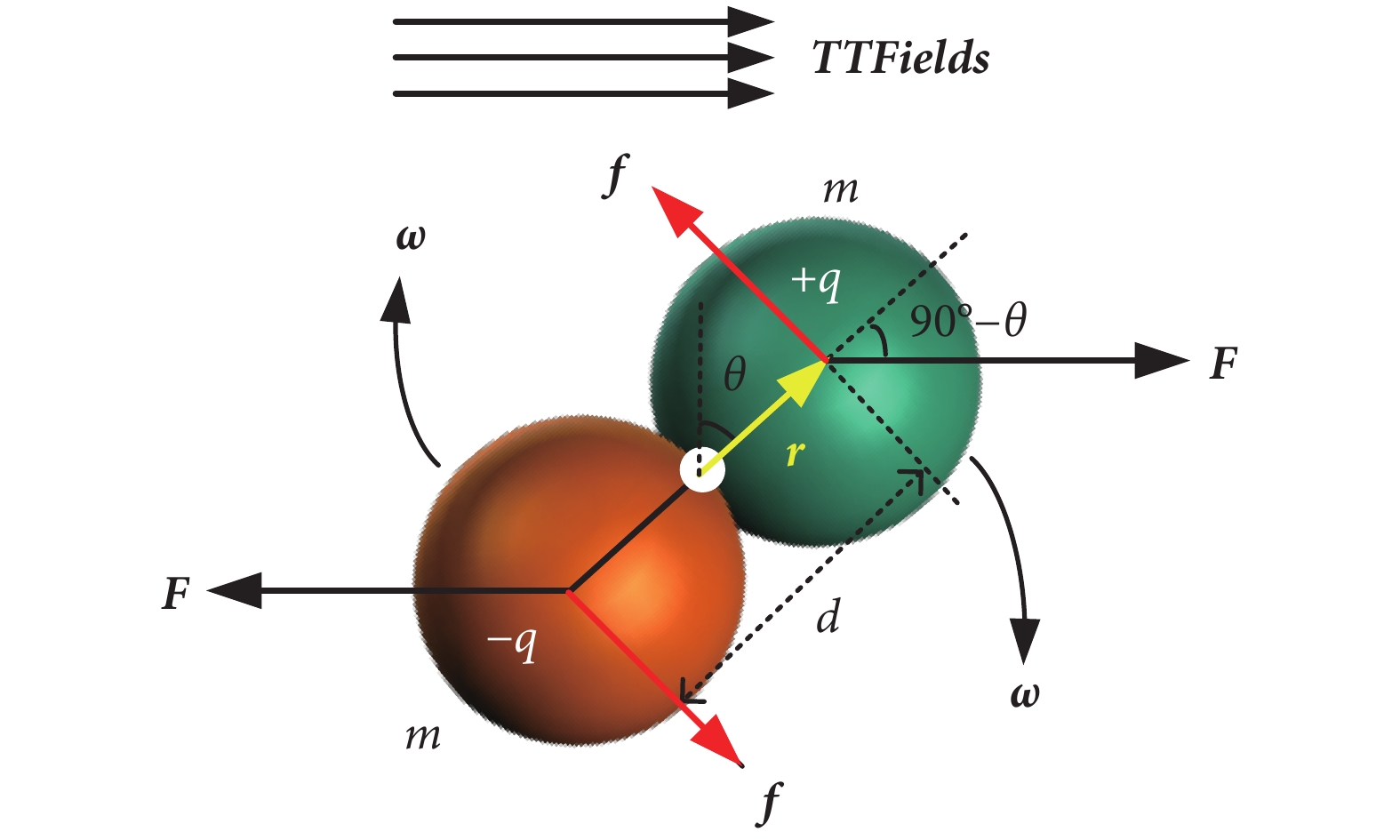 圖4
微管蛋白二聚體受TTFields電場力矩模型
Figure4.
The rotation model of tubulin dimer subjected to TTFields torque
圖4
微管蛋白二聚體受TTFields電場力矩模型
Figure4.
The rotation model of tubulin dimer subjected to TTFields torque
將微管蛋白二聚體視為不可形變的剛體,由剛體轉動定律可得其在電場力矩和阻力矩作用下的轉動方程,如式(8)所示:
 |
其中,ME為電場力矩,Mf為微管蛋白二聚體在細胞質中運動受到的粘滯阻力矩,I為微管蛋白二聚體轉動慣量, 為轉動角加速度。
為轉動角加速度。
TTFields電場對微管蛋白二聚體產生的力矩,如式(9)所示:
 |
其中,E為TTFields電場,F為微管蛋白單體受到的電場力,r為旋轉中心指向α微管蛋白單體質心的向量,q為微管蛋白單體所帶電荷量大小。
微管蛋白二聚體旋轉運動受到的細胞質粘滯阻力矩,如式(10)所示:
 |
其中粘滯阻力由斯托克斯公式[19]給出,如式(11)所示:
 |
式中,f為微管蛋白單體受到的細胞質粘滯阻力,r為微管蛋白單體半徑,η為細胞質粘滯系數,v為微管蛋白二聚體旋轉的線速度,其與角速度的大小關系為v = ωr。
結合幾何關系可得微管蛋白二聚體在電場力矩作用下的旋轉控制方程,如式(12)所示:
 |
其中,θ為微管蛋白二聚體x方向電偶極矩與豎直方向的夾角,t為旋轉時間,m為微管蛋白單體的質量,r為微管蛋白單體半徑,η為細胞質粘滯系數,px為微管蛋白二聚體x方向電偶極矩大小,E為TTFields電場大小。
由于TTFields是交變電場,上式(12)中電場大小E是關于時間的函數,為簡化計算,令E為TTFields電場的幅值,以此來計算電場力矩扭轉微管蛋白二聚體角度的上限。
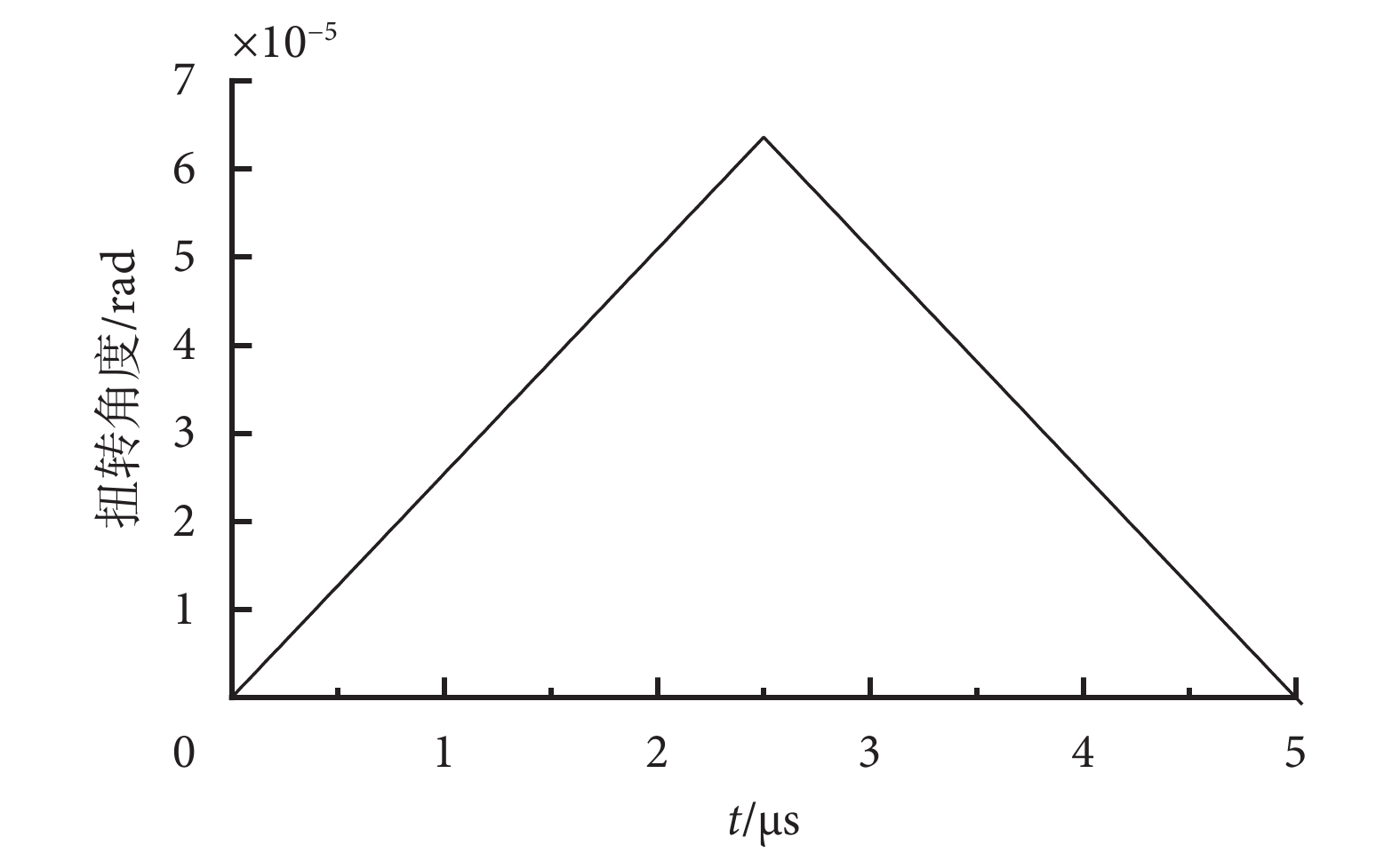
α和β微管蛋白單體具有相似的球體形狀,且具有近似的質量,約55 kDa(1 Da ≈ 1.66 × 10?27 kg)[20],細胞質的粘滯系數約為3 mPa·s[21],TTFields電場強度大小E取典型幅值200 V/m,設初始角度θ = 0,將上述數據代入式(12),由2/3階龍格—庫塔法解得一個TTFields周期內微管蛋白二聚體扭轉角度數值解如圖5所示。
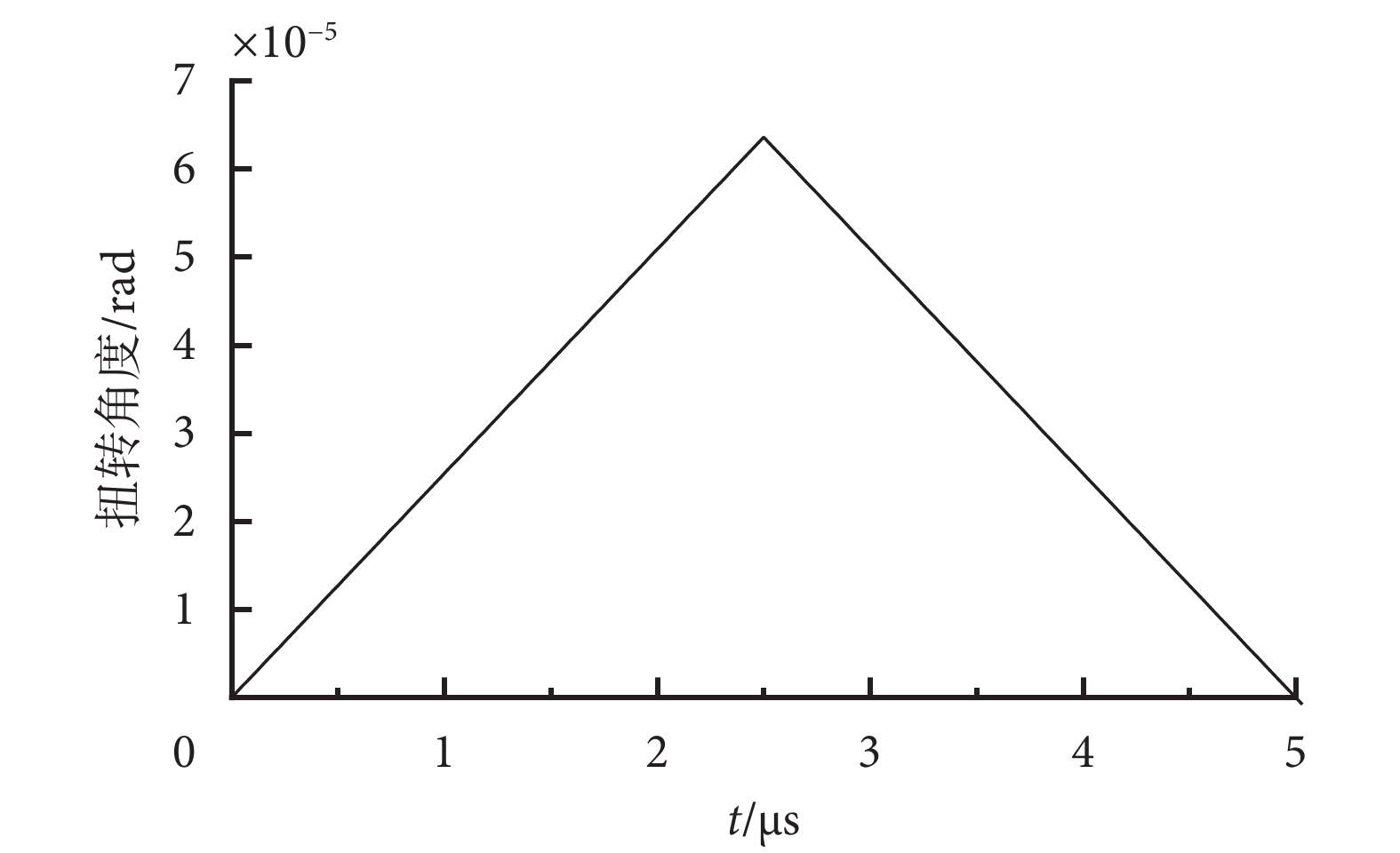 圖5
一個TTFields周期內微管蛋白二聚體扭轉角度
Figure5.
Rotation angle of tubulin dimer within one TTFields period
圖5
一個TTFields周期內微管蛋白二聚體扭轉角度
Figure5.
Rotation angle of tubulin dimer within one TTFields period
從計算結果看出,在前半個周期內,微管蛋白二聚體扭轉角度最大達到約6.4 × 10?5 rad,半個周期后,電場發生改變,微管蛋白二聚體反向旋轉,削弱微管蛋白二聚體的扭轉取向,但整體上,微管蛋白二聚體幾乎保持著原有初始取向。因此可以證明,在TTFields作用下,微管蛋白二聚體受到電場力矩和粘滯阻力矩的共同作用,其扭轉角度極小、可以忽略,TTFields電場力矩將難以對微管蛋白二聚體的排列取向產生實質性的影響,其正常排列取向更多地依賴于隨機熱運動。
4 仿真模擬與討論
對細胞內部的介觀力學進行直接測量需要極其精密的實驗條件和先進技術,在基礎研究中,仿真模擬往往是驗證理論分析的重要研究方法。本文將建立有限元仿真模型,仿真模擬TTFields對微管蛋白的電場力和力矩分布,從而印證電場對微管蛋白單體聚合和微管蛋白二聚體排列取向的影響。
4.1 TTFields對微管蛋白單體的電場力
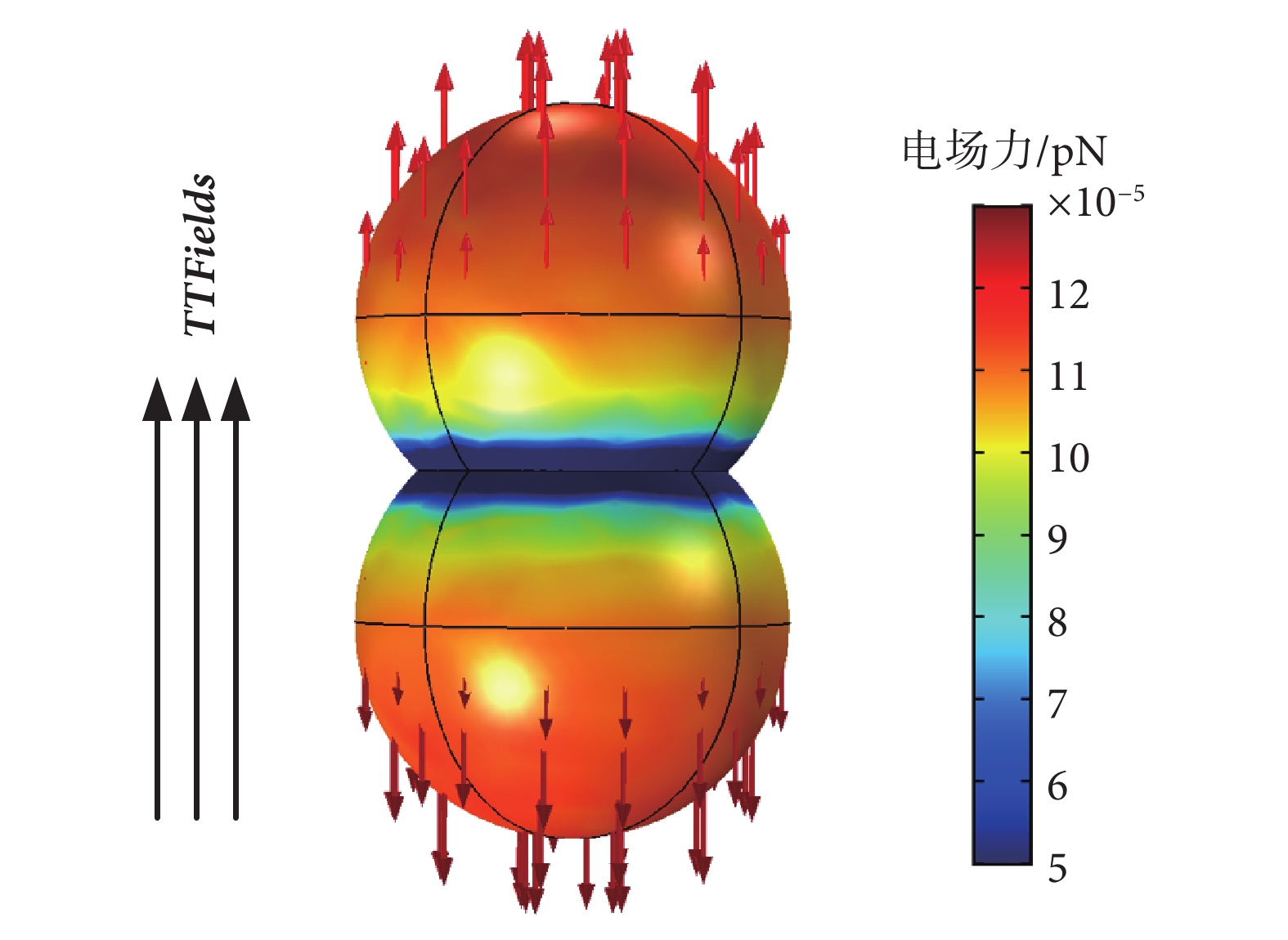
在多物理場分析軟件COMSOL(5.3,COMSOL Inc.,瑞士)中按照真實尺寸建立微管蛋白二聚體模型,設定其相對介電常數為2、電導率為0.5 S/m[17],電荷密度為±5.6 mC/m2(α微管蛋白單體為正,β微管蛋白單體為負),計算場域其他參數設置如表2所示,當設置平行于微管蛋白二聚體軸向的典型TTFields時,微管蛋白二聚體所受電場力分布如圖6所示。
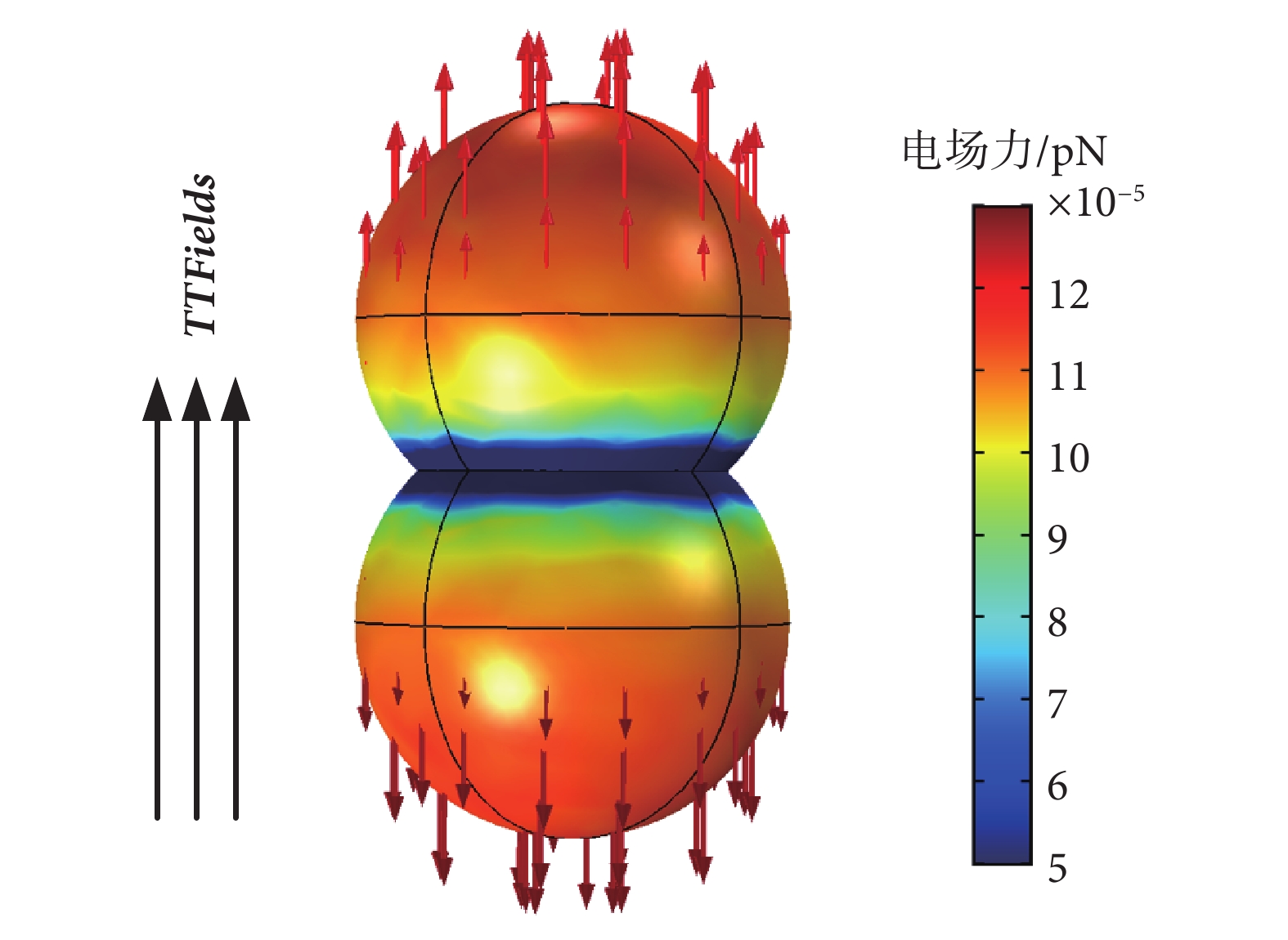 圖6
TTFields作用于微管蛋白二聚體的電場力
Figure6.
TTFields electric field force on tubulin dimer
圖6
TTFields作用于微管蛋白二聚體的電場力
Figure6.
TTFields electric field force on tubulin dimer
從電場力仿真結果來看,由于電場在微管蛋白二聚體兩端集中,因此所產生的電場力略大,但整體上微管蛋白單體受到的電場力大小在10?4~10?5 pN數量級,遠遠小于皮牛級的微管蛋白單體之間正常靜電吸引力。另外,在生物體內,細胞亞結構自身的抗破壞強度一般在皮牛級,例如DNA雙螺旋之間的結合力強度大約在12 pN[22 ],單個微管原絲的抗彎剛度大約為2.3 pN[23],側面印證了TTFields電場力難以破壞微管正常結構。
4.2 TTFields對微管蛋白二聚體的電場力矩
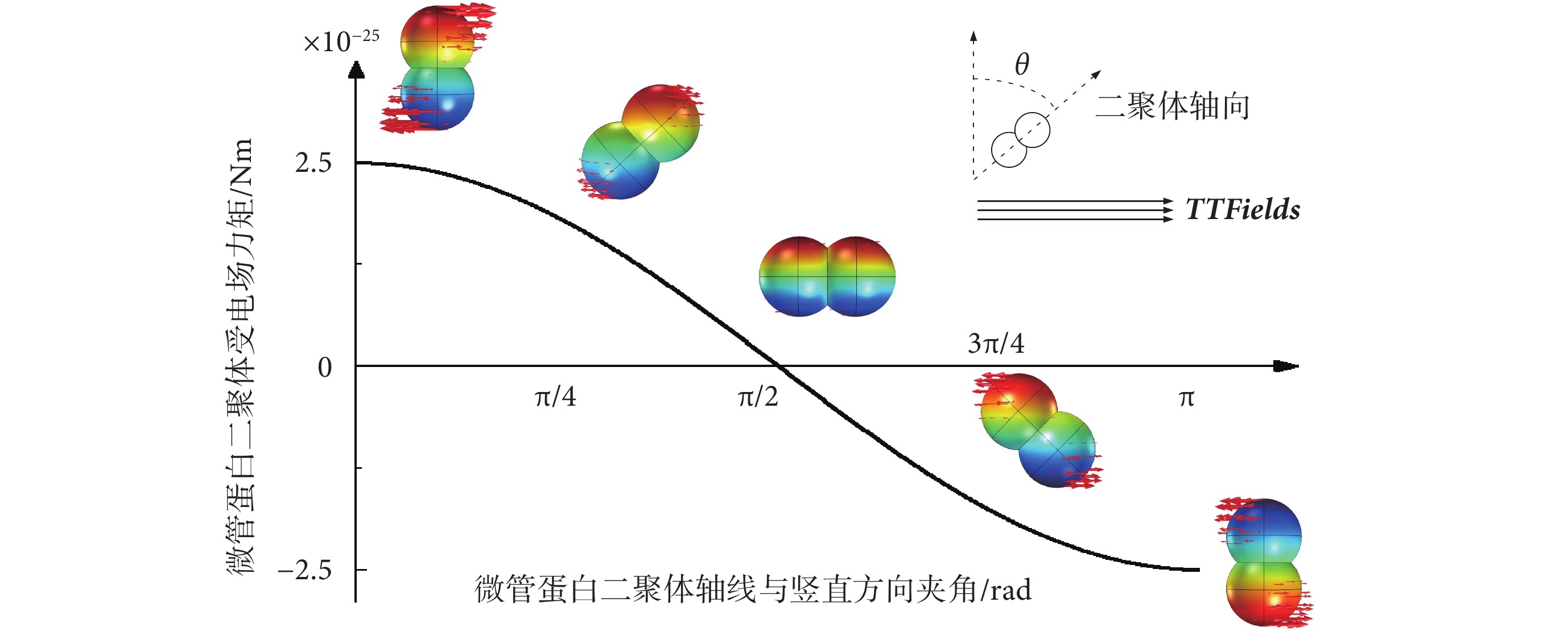
為驗證TTFields對微管蛋白二聚體的排列取向影響,對微管蛋白二聚體在典型TTFields作用下所受到的電場力矩進行了仿真模擬。由于單個微管蛋白二聚體在細胞質中的排列具有隨機性,其軸線方向可能與外界施加的電場呈0~π rad夾角,因此對不同初始排列取向的微管蛋白二聚體受到的TTFields電場力矩進行仿真計算分析,得到力矩分布如圖7所示。其中,仿真模型參數的設置與4.1小節中一致。
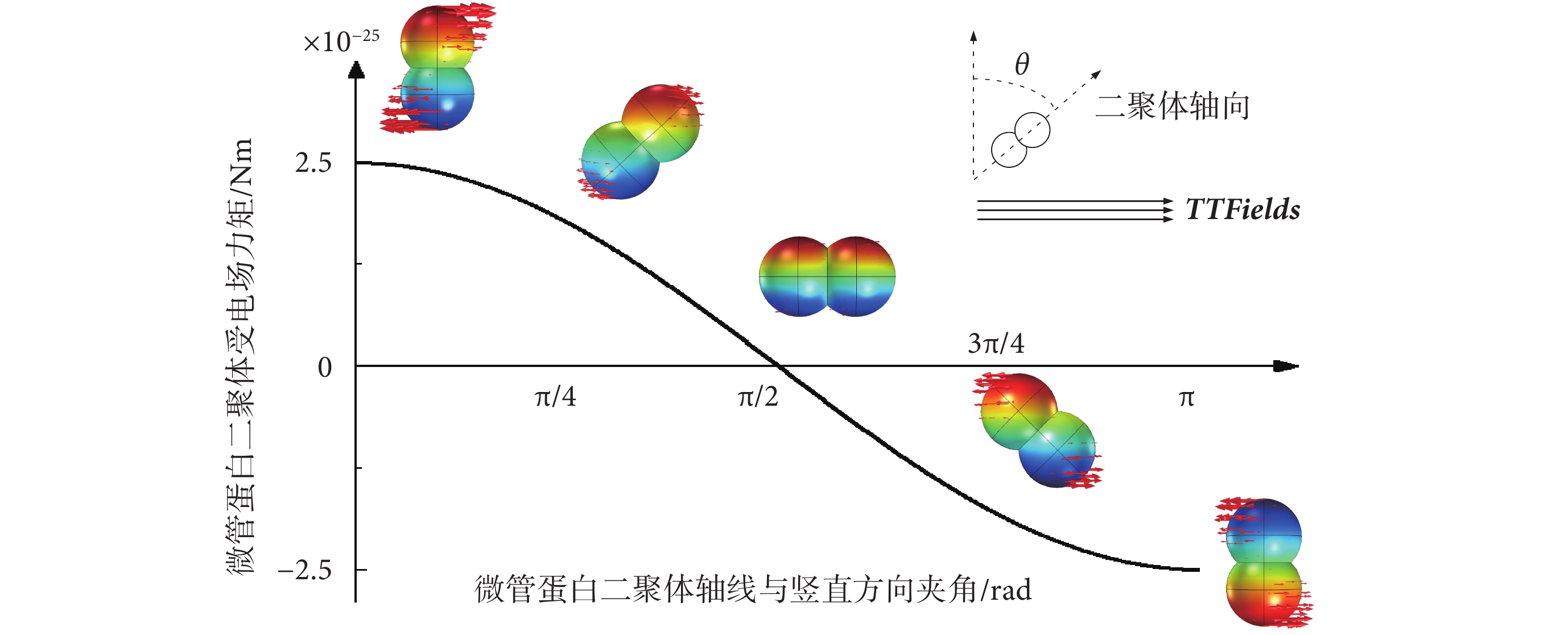 圖7
TTFields作用于微管蛋白二聚體的電場力矩
Figure7.
TTFields electric field force torque on tubulin dimer
圖7
TTFields作用于微管蛋白二聚體的電場力矩
Figure7.
TTFields electric field force torque on tubulin dimer
從仿真結果看出,當電場方向與微管蛋白二聚體軸向垂直時,微管蛋白二聚體受到的電場力矩最大,約為2.5 × 10?25 Nm,隨著電場方向與微管蛋白二聚體軸線夾角的增大,由于力臂的減小,力矩也逐漸減小,并呈現余弦衰減規律。整體上,仿真模擬得到的典型TTFields對微管蛋白二聚體的扭轉力矩在10?25 Nm數量級,這一數值與式(8)計算得到的電場最大力矩2.2 × 10?25 Nm近似。并且10?25 Nm級別的電場力矩遠小于細胞處于正常生理條件下的隨機熱運動能量ET = kBT = 4.3 × 10?21 J(kB為玻爾茲曼常數,T為生理溫度310 K)[15]。另外,有實驗表明,要通過交流電場旋轉隨機排列的微管,其電場強度需達到約107 V/m[24],遠高于典型TTFields的電場強度(200 V/m)。因此,TTFields的電場力矩作用難以對細胞質內游離的微管蛋白二聚體排列取向造成可觀影響。
5 結論
本文從生物物理角度,開展TTFields對細胞微管蛋白聚合和排列取向干擾的介觀動力學影響研究,進而揭示TTFields對細胞微管結構穩定性影響的力學效應。研究結果表明:
(1)典型TTFields對微管蛋白單體的電場力約在10?5 pN數量級,這一數值遠小于皮牛級別的微管蛋白單體之間的正常靜電聚合力;
(2)典型TTFields對微管蛋白二聚體的電場力矩約在10?25 Nm數量級,這一數值遠小于10?21 J級別的正常生理隨機熱運動能量;
(3)在電場力矩和細胞質粘滯阻力矩的共同作用下,典型TTFields對微管蛋白二聚體的扭轉角度約在10?5 rad級別。
因此,在介觀水平上,TTFields難以對微管蛋白單體的正常聚合和微管蛋白二聚體隨機取向造成干擾,從而難以通過力學效應破壞細胞微管結構的穩定性,TTFields對細胞骨架的破壞更有可能是通過“非力”效應造成。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:李星負責仿真建模、理論分析和論文撰寫;劉開達、郭琮負責仿真數據處理、論文修訂;房天瑞負責圖表制作;楊帆負責整體研究指導。
致謝
感謝加州大學伯克利分校Bio-thermal實驗室Boris Rubinsky教授對本文研究工作的支持。
0 引言
腫瘤治療電場(tumor treating fields,TTFields)是一類中頻(100~300 kHz)、低強度(100~300 V/m)正弦電場,對多種腫瘤細胞的增殖具有抑制效應[1]。臨床試驗證實了TTFields對多種實體腫瘤具有良好的治療效果,有效提高了患者生存期,并具有無侵入、副作用低等優點[2]。據此,美國食品藥品監督管理局(U.S. Food and Drug Administration,FDA)分別于2011年、2015年和2019年授權了TTFields在復發性膠質瘤[3]、新診斷性膠質瘤[3]和間皮瘤[4]治療中的應用。雖然TTFields在臨床中表現良好,但其抑制腫瘤細胞增殖的內在機制尚不明晰,部分醫療人員和患者對該技術持保守甚至懷疑態度。另外,機制不清也不利于臨床應用中的治療方案優化和療效提高,限制了該技術的發展和推廣。
在現有較成熟的電磁場腫瘤治療技術中,電磁場的力學作用和熱效應是殺傷腫瘤細胞的主要機制,例如:電穿孔通過電場力破壞細胞膜結構[5-7],微波消融通過電磁熱燒蝕腫瘤細胞[8]。目前,在TTFields的機制研究中,電場通過電場力、力矩破壞細胞微管的結構,進而抑制腫瘤細胞有絲分裂被認為是TTFields抑制腫瘤細胞增殖的主要原因。這一猜想觀點基于以下事實:細胞骨架是真核細胞中重要的亞結構,在維持細胞正常形態、有絲分裂和胞內物質運輸中發揮著重要作用,細胞骨架由大量的微管構成,而單個微管是由一種具有強電偶極矩的α/β異二聚體微管蛋白(以下簡稱為:微管蛋白二聚體)聚合而成[9];一方面,在微管解聚和聚合活動十分活躍的有絲分裂前中期,TTFields電場通過庫侖力破壞微管蛋白二聚體的正常聚合;另一方面,電場對微管蛋白二聚體電偶極子的力矩將促使微管蛋白二聚體與外電場平行,干擾微管蛋白二聚體在細胞內部正常的排列取向,從而影響微管生長及其結構穩定性,導致有絲分裂失敗[10]。雖然在離體細胞實驗中,已有研究通過熒光圖像觀察到細胞骨架形態異常、子細胞染色體分配不均等現象[10],但這不足以證明TTFields是通過電場力、力矩破壞了微管結構,而有可能是電場所激發的細胞內化學環境失衡等“非力”原因所造成。
針對TTFields對細胞微管電生理活動的潛在影響,為厘清TTFields是否能夠產生足夠強的電場力、力矩效應來破壞細胞微管結構穩定性,本文建立TTFields對微管蛋白單體聚合和微管蛋白二聚體排列取向干擾的力學模型,從生物物理角度,理論研究介觀層面上TTFields對微管蛋白的動力學效應。研究結果表明,腫瘤細胞暴露于TTFields中時,微弱的電場庫侖力和電場力矩對細胞內微管蛋白單體之間的聚合及微管蛋白二聚體的排列取向影響甚微,從而不足以破壞微管結構穩定性,以往細胞實驗現象中所觀察到的細胞骨架異常原因更可能來自于其他“非力”效應。
1 細胞微管蛋白介觀物理模型
1.1 幾何模型
如圖1所示,細胞微管是真核細胞中一種圓柱管狀蛋白質結構,其內、外徑分別約為15 nm和25 nm,其長度一般為幾十納米(nm)到幾十微米(μm)[11]。單個微管一般由13條原絲構成,每一條原絲由微管蛋白二聚體首尾聚合而成,微管蛋白二聚體長度約8 nm,單個微管蛋白二聚體由直徑約5 nm的近似球形微管蛋白單體聚合而成[11]。
 圖1
細胞微管及微管蛋白介觀模型
Figure1.
Mesoscopic model of cell microtubule and tublin
圖1
細胞微管及微管蛋白介觀模型
Figure1.
Mesoscopic model of cell microtubule and tublin
1.2 電學特性
由于氨基酸殘基的存在和非均勻分布,微管蛋白二聚體表面有部分殘余電荷,表現出電極性。在生理條件下的弱堿性環境中,微管蛋白二聚體整體呈負電性[11]。微管蛋白二聚體的整體電極性可以等效為電磁理論中的電偶極子,但其電偶極矩并不是單方向的。在如圖1所示的直角坐標系下,通過分子動力學計算,得到微管蛋白二聚體的電偶極矩分布如表1所示[12]。其中,微管蛋白二聚體的y方向電偶極矩最大,約為1 700 D[單位:德拜(D),1 D ≈ 3.33 × 10?30 C·m]。
2 TTFields作用下細胞內電場分布
為研究TTFields對細胞微管的影響,首先需要明確TTFields在單細胞內部的分布狀態,由于現有實驗技術難以對細胞內部的電場直接測量,本文將對腫瘤細胞處于TTFields中時細胞內部的電場強度分布狀態進行仿真模擬。
人體大多數細胞一般呈不規則梭形,大小在幾十微米左右,典型TTFields的頻率在幾百千赫茲(kHz),因此電磁波的波長遠大于細胞尺度,電磁場的輻射效應可以忽略。當細胞暴露于TTFields中時,由電流連續性原理和全電流定律可以得出細胞內部電場的控制方程,如式(1)所示:
 |
電場與電位之間的關系,如式(2)所示:
 |
其中,E和 分別為電場強度和電位分布,γ和ε分別為細胞仿真計算場域的電導率和介電常數分布,t為時間,?為哈密頓算子。考慮到電場頻率非高頻,TTFields可簡化為準靜態電磁場,即式(1)中第二項位移電流項可以忽略。
分別為電場強度和電位分布,γ和ε分別為細胞仿真計算場域的電導率和介電常數分布,t為時間,?為哈密頓算子。考慮到電場頻率非高頻,TTFields可簡化為準靜態電磁場,即式(1)中第二項位移電流項可以忽略。
為了更加真實地模擬細胞內電場分布,以宮頸癌HeLa腫瘤細胞(來自加州大學伯克利分校Life Science Addition Storeroom)(以下簡稱為:腫瘤細胞)為例,根據其真實顯微形態,建立不規則腫瘤細胞群體模型如圖2所示。在腫瘤細胞建模中,由于微管結構處于細胞質中,因此忽略了細胞核,并將細胞質等效為各向同性的電解質媒質,單細胞的幾何參數和電學參數如表2所示[13-14]。在仿真模型中,設置TTFields電場方向為水平方向,其頻率和幅值設置為典型值(200 kHz、200 V/m),在多物理場仿真軟件COMSOL(5.3,COMSOL Inc.,瑞士)中,通過交流電(alternating current,AC)/直流電(direct current,DC)模塊頻域穩態求解器對細胞內電場進行計算,得到腫瘤細胞內部的電場分布情況如圖2所示。
 圖2
HeLa細胞內的TTFields強度分布
Figure2.
TTFields intensity distribution in HeLa cells
圖2
HeLa細胞內的TTFields強度分布
Figure2.
TTFields intensity distribution in HeLa cells
根據歐姆定律的微分形式,在電場作用下,場域內電流密度計算如式(3)所示:
 |
其中,J為電流密度,E為電場強度,γ為計算場域的電導率分布。
由于細胞膜的電導率極低,在電流密度一定的情況下,腫瘤細胞膜內的電場強度遠大于細胞質內電場強度,因此仿真結果僅展示細胞質內的電場強度大小分布。從仿真結果看出,當腫瘤細胞處于TTFields中時,由于腫瘤細胞形態的不同,其內部電場大小略有不同。在腫瘤細胞密集處,較大的電壓降落在細胞膜上,導致腫瘤細胞內電場較低,且當腫瘤細胞長軸越傾向于與外電場方向平行時,腫瘤細胞內部電場較強。實際人體組織中,腫瘤細胞以三維形式存在,在同一TTFields作用下,三維腫瘤細胞與二維腫瘤細胞模型中的電場仿真結果略有不同,但整體上腫瘤細胞內電場強度均約為100~300 V/m[15],不會對后續電場力和力矩分析結果產生數量上的差異,因此為簡化建模、提高數值計算效率,本文采用上述二維腫瘤細胞模型進行電場仿真研究。
3 TTFields對微管蛋白的動力學影響
3.1 對微管蛋白單體聚合的影響
在介觀層面上,細胞內蛋白質之間的聚合依賴于電荷或極性分子之間的靜電力。在微管的裝配過程中,α或β微管蛋白單體先聚合成微管蛋白二聚體,然后微管蛋白二聚體再首尾相接排列裝配形成管狀微管。在上述過程中,α或β微管蛋白單體之間的靜電吸引力發揮著重要作用。當細胞處于外電場中時,外電場對微管蛋白單體的電場力是否有潛在“拉開”微管蛋白單體之間的正常聚合狀態,進而破壞微管穩定聚合結構的影響,是值得探究的。如表1所示,已經表明微管蛋白二聚體有較強的電偶極矩,其x方向電偶極矩約為337 D,且外電場作用在x方向電偶極矩上的電場力最有可能影響微管蛋白聚合穩定性。假設微管蛋白的殘余電荷分布于近似球形的蛋白表面,其面密度分布為σ。由于電偶極矩的存在,可等效為α或β微管蛋白單體帶異種電荷,則在TTFields作用下,微管蛋白α和β單體的受力模型如圖3所示。
 圖3
TTFields對微管蛋白單體的電場力受力模型
Figure3.
The force model of tubulin monomers subjected to TTFields
圖3
TTFields對微管蛋白單體的電場力受力模型
Figure3.
The force model of tubulin monomers subjected to TTFields
由圖3右圖中的幾何關系,對微管蛋白單體球體模型微元化,可得球臺微元側面積,如式(4)所示:
 |
TTFields對α微管蛋白單體的球臺微元的電場力計算,如式(5)所示:
 |
積分可得α微管蛋白單體整體所受電場力,如式(6)所示:
 |
一般地,微管蛋白表面的電荷分布并不均勻,即σ是坐標的函數,如式(6)所示,為簡化積分計算,可認為電荷均勻分布于微管蛋白表面,則可得α微管蛋白單體受到TTFields的電場力,如式(7)所示:
 |
在式(4)~(7)中,dS,dF分別為微管蛋白單體微元球臺側面積及其受到的電場力,E和F分別為TTFields電場強度和微管蛋白單體整體受到的電場力,σ為微管蛋白單體表面電荷密度,r和θ分別為微管蛋白單體半徑及其與水平向左方向的夾角。
由微管蛋白二聚體的x方向電偶極矩可估算得出α微管蛋白單體表面電荷密度約為5.6 mC/m2,若考慮三維方向上的全部電偶極矩,這一數據將與文獻[16]十分吻合。因此,將電荷密度數5.6 mC/m2據代入式(7)可計算得到:強度為200 V/m的典型TTFields對α微管蛋白單體的電場力約為8.8 × 10?5 pN,由于TTFields是交變電場,這也是TTFields在一個作用周期中對微管蛋白單體產生的最大電場力,或稱之為破壞力上限。
在正常的微管聚合活動中,α和β微管蛋白單體之間的靜電吸引力Fαβ在皮牛(pN)級別[17],更有文獻指出,只有當微管受到的張力大于6.59 pN時[18],才有可能破壞微管結構穩定性。從TTFields對微管蛋白單體的電場力計算結果與微管蛋白單體正常聚合的靜電力對比分析來看,TTFields電場力遠小于正常的微管蛋白單體聚合靜電力,因此TTFields難以通過電場力來破壞微管蛋白單體之間的正常聚合。
3.2 對微管蛋白二聚體取向的影響
從電磁場角度看,電場不僅對電偶極子正負電荷有相反的電場力,若外電場與電偶極矩方向不平行,電場力還會產生改變電偶極子取向的電場力扭矩。在TTFields作用下,電場力難以破壞微管蛋白單體之間的正常聚合,但電場力矩是否會改變微管蛋白二聚體的隨機排列取向,從而干擾微管蛋白二聚體裝配成微管的生理過程,是值得探究的另一個問題。
在電場作用下,只有微管蛋白二聚體軸向(x方向)電偶極矩所受的電場力矩有可能改變微管蛋白二聚體的排列取向,因此對微管蛋白二聚體在TTFields作用下進行受力分析如圖4所示。
 圖4
微管蛋白二聚體受TTFields電場力矩模型
Figure4.
The rotation model of tubulin dimer subjected to TTFields torque
圖4
微管蛋白二聚體受TTFields電場力矩模型
Figure4.
The rotation model of tubulin dimer subjected to TTFields torque
將微管蛋白二聚體視為不可形變的剛體,由剛體轉動定律可得其在電場力矩和阻力矩作用下的轉動方程,如式(8)所示:
 |
其中,ME為電場力矩,Mf為微管蛋白二聚體在細胞質中運動受到的粘滯阻力矩,I為微管蛋白二聚體轉動慣量, 為轉動角加速度。
為轉動角加速度。
TTFields電場對微管蛋白二聚體產生的力矩,如式(9)所示:
 |
其中,E為TTFields電場,F為微管蛋白單體受到的電場力,r為旋轉中心指向α微管蛋白單體質心的向量,q為微管蛋白單體所帶電荷量大小。
微管蛋白二聚體旋轉運動受到的細胞質粘滯阻力矩,如式(10)所示:
 |
其中粘滯阻力由斯托克斯公式[19]給出,如式(11)所示:
 |
式中,f為微管蛋白單體受到的細胞質粘滯阻力,r為微管蛋白單體半徑,η為細胞質粘滯系數,v為微管蛋白二聚體旋轉的線速度,其與角速度的大小關系為v = ωr。
結合幾何關系可得微管蛋白二聚體在電場力矩作用下的旋轉控制方程,如式(12)所示:
 |
其中,θ為微管蛋白二聚體x方向電偶極矩與豎直方向的夾角,t為旋轉時間,m為微管蛋白單體的質量,r為微管蛋白單體半徑,η為細胞質粘滯系數,px為微管蛋白二聚體x方向電偶極矩大小,E為TTFields電場大小。
由于TTFields是交變電場,上式(12)中電場大小E是關于時間的函數,為簡化計算,令E為TTFields電場的幅值,以此來計算電場力矩扭轉微管蛋白二聚體角度的上限。
α和β微管蛋白單體具有相似的球體形狀,且具有近似的質量,約55 kDa(1 Da ≈ 1.66 × 10?27 kg)[20],細胞質的粘滯系數約為3 mPa·s[21],TTFields電場強度大小E取典型幅值200 V/m,設初始角度θ = 0,將上述數據代入式(12),由2/3階龍格—庫塔法解得一個TTFields周期內微管蛋白二聚體扭轉角度數值解如圖5所示。
 圖5
一個TTFields周期內微管蛋白二聚體扭轉角度
Figure5.
Rotation angle of tubulin dimer within one TTFields period
圖5
一個TTFields周期內微管蛋白二聚體扭轉角度
Figure5.
Rotation angle of tubulin dimer within one TTFields period
從計算結果看出,在前半個周期內,微管蛋白二聚體扭轉角度最大達到約6.4 × 10?5 rad,半個周期后,電場發生改變,微管蛋白二聚體反向旋轉,削弱微管蛋白二聚體的扭轉取向,但整體上,微管蛋白二聚體幾乎保持著原有初始取向。因此可以證明,在TTFields作用下,微管蛋白二聚體受到電場力矩和粘滯阻力矩的共同作用,其扭轉角度極小、可以忽略,TTFields電場力矩將難以對微管蛋白二聚體的排列取向產生實質性的影響,其正常排列取向更多地依賴于隨機熱運動。
4 仿真模擬與討論
對細胞內部的介觀力學進行直接測量需要極其精密的實驗條件和先進技術,在基礎研究中,仿真模擬往往是驗證理論分析的重要研究方法。本文將建立有限元仿真模型,仿真模擬TTFields對微管蛋白的電場力和力矩分布,從而印證電場對微管蛋白單體聚合和微管蛋白二聚體排列取向的影響。
4.1 TTFields對微管蛋白單體的電場力
在多物理場分析軟件COMSOL(5.3,COMSOL Inc.,瑞士)中按照真實尺寸建立微管蛋白二聚體模型,設定其相對介電常數為2、電導率為0.5 S/m[17],電荷密度為±5.6 mC/m2(α微管蛋白單體為正,β微管蛋白單體為負),計算場域其他參數設置如表2所示,當設置平行于微管蛋白二聚體軸向的典型TTFields時,微管蛋白二聚體所受電場力分布如圖6所示。
 圖6
TTFields作用于微管蛋白二聚體的電場力
Figure6.
TTFields electric field force on tubulin dimer
圖6
TTFields作用于微管蛋白二聚體的電場力
Figure6.
TTFields electric field force on tubulin dimer
從電場力仿真結果來看,由于電場在微管蛋白二聚體兩端集中,因此所產生的電場力略大,但整體上微管蛋白單體受到的電場力大小在10?4~10?5 pN數量級,遠遠小于皮牛級的微管蛋白單體之間正常靜電吸引力。另外,在生物體內,細胞亞結構自身的抗破壞強度一般在皮牛級,例如DNA雙螺旋之間的結合力強度大約在12 pN[22 ],單個微管原絲的抗彎剛度大約為2.3 pN[23],側面印證了TTFields電場力難以破壞微管正常結構。
4.2 TTFields對微管蛋白二聚體的電場力矩
為驗證TTFields對微管蛋白二聚體的排列取向影響,對微管蛋白二聚體在典型TTFields作用下所受到的電場力矩進行了仿真模擬。由于單個微管蛋白二聚體在細胞質中的排列具有隨機性,其軸線方向可能與外界施加的電場呈0~π rad夾角,因此對不同初始排列取向的微管蛋白二聚體受到的TTFields電場力矩進行仿真計算分析,得到力矩分布如圖7所示。其中,仿真模型參數的設置與4.1小節中一致。
 圖7
TTFields作用于微管蛋白二聚體的電場力矩
Figure7.
TTFields electric field force torque on tubulin dimer
圖7
TTFields作用于微管蛋白二聚體的電場力矩
Figure7.
TTFields electric field force torque on tubulin dimer
從仿真結果看出,當電場方向與微管蛋白二聚體軸向垂直時,微管蛋白二聚體受到的電場力矩最大,約為2.5 × 10?25 Nm,隨著電場方向與微管蛋白二聚體軸線夾角的增大,由于力臂的減小,力矩也逐漸減小,并呈現余弦衰減規律。整體上,仿真模擬得到的典型TTFields對微管蛋白二聚體的扭轉力矩在10?25 Nm數量級,這一數值與式(8)計算得到的電場最大力矩2.2 × 10?25 Nm近似。并且10?25 Nm級別的電場力矩遠小于細胞處于正常生理條件下的隨機熱運動能量ET = kBT = 4.3 × 10?21 J(kB為玻爾茲曼常數,T為生理溫度310 K)[15]。另外,有實驗表明,要通過交流電場旋轉隨機排列的微管,其電場強度需達到約107 V/m[24],遠高于典型TTFields的電場強度(200 V/m)。因此,TTFields的電場力矩作用難以對細胞質內游離的微管蛋白二聚體排列取向造成可觀影響。
5 結論
本文從生物物理角度,開展TTFields對細胞微管蛋白聚合和排列取向干擾的介觀動力學影響研究,進而揭示TTFields對細胞微管結構穩定性影響的力學效應。研究結果表明:
(1)典型TTFields對微管蛋白單體的電場力約在10?5 pN數量級,這一數值遠小于皮牛級別的微管蛋白單體之間的正常靜電聚合力;
(2)典型TTFields對微管蛋白二聚體的電場力矩約在10?25 Nm數量級,這一數值遠小于10?21 J級別的正常生理隨機熱運動能量;
(3)在電場力矩和細胞質粘滯阻力矩的共同作用下,典型TTFields對微管蛋白二聚體的扭轉角度約在10?5 rad級別。
因此,在介觀水平上,TTFields難以對微管蛋白單體的正常聚合和微管蛋白二聚體隨機取向造成干擾,從而難以通過力學效應破壞細胞微管結構的穩定性,TTFields對細胞骨架的破壞更有可能是通過“非力”效應造成。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:李星負責仿真建模、理論分析和論文撰寫;劉開達、郭琮負責仿真數據處理、論文修訂;房天瑞負責圖表制作;楊帆負責整體研究指導。
致謝
感謝加州大學伯克利分校Bio-thermal實驗室Boris Rubinsky教授對本文研究工作的支持。