中性粒細胞胞外誘捕網(NETs)在促進膿毒癥患者微血管血栓形成、加劇病情嚴重度方面的作用已廣受關注。然而,在膿毒癥中,中性粒細胞與血管內皮細胞互作釋放NETs的機制及參與其中的關鍵信號分子仍有待進一步探究。因此,我們利用革蘭氏陽性菌細胞壁的共有成分——脂磷壁酸(LTA)誘導穩定黏附于包被了細胞間黏附分子-1(ICAM-1)的玻璃底板上的中性粒細胞釋放NETs。我們使用Sytox green標記NET-DNA,Flou-4 AM作為胞內鈣離子信號指示劑,探究NETs的形成過程及其中的鈣信號變化。結果表明,LTA能誘導穩定黏附于包被了ICAM-1的玻璃底板上的中性粒細胞釋放NETs,且這一過程呈現時間依賴性。此外,我們的研究顯示,LTA誘導的穩定黏附于ICAM-1上的中性粒細胞NETs的釋放過程依賴于鈣離子,而非胞內活性氧(ROS)。本研究揭示了革蘭氏陽性菌引發的膿毒癥環境下,內皮表面關鍵分子ICAM-1與中性粒細胞直接相互作用引發NETs形成及其關鍵信號分子,為相關藥物的開發及相關疾病的治療提供了理論基礎。
引用本文: 黃嘉祺, 方金花, 吳芝偉, 吳建華, 方穎, 林蔣國. 脂磷壁酸誘導穩定黏附于ICAM-1上的中性粒細胞胞外誘捕網形成. 生物醫學工程學雜志, 2024, 41(2): 304-312. doi: 10.7507/1001-5515.202401062 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
膿毒癥(sepsis)是以多器官功能紊亂為特點的系統性炎癥反應綜合征[1]。患者增速快、致死率高[2],在膿毒癥患者血管內中伴隨有大量彌散性血栓的出現[3]。膿毒癥可以由革蘭氏陽性菌及革蘭氏陰性菌引起。其中,由革蘭氏陽性菌感染導致的膿毒癥病例超過總報告病例的50%[4]。黃金葡萄球菌(Staphylococcus aureus,S. aureus)是一種常見的革蘭氏陽性菌。有報道稱,S. aureus能上調膿毒癥血管內皮細胞分子表達水平,加強內皮細胞與單核細胞之間的黏附力,導致內皮促凝血能力上調[5]。
在膿毒癥的病程發展過程中,中性粒細胞從循環血液中被招募到受感染的部位,產生中性粒細胞胞外誘捕網(neutrophil extracellular traps,NETs),并促進免疫血栓形成[6]。NETs是鑲嵌有多種抗菌蛋白的DNA三維骨架結構,能發揮“顯微機械篩”功能,捕獲并限制病原菌擴散[7-8]。盡管NETs作為中性粒細胞抗菌策略的正面作用已廣受報道,然而不恰當的NETs釋放也會加劇促炎反應[9-10],誘導血栓形成[11-12],造成組織損傷[13]及器官纖維化[14-15],引發多種疾病[16-18],對機體產生負面影響。
中性粒細胞的招募需要經過滾動、黏附、穩定黏附、鋪展、爬行、遷移等一系列級聯反應。其中,內皮細胞表面持續表達的細胞間黏附分子-1(intercellular adhesion molecule-1,ICAM-1)能通過與中性粒細胞表面β2整合素家族相互作用,將中性粒細胞捕獲到內皮上,對中性粒細胞的穩定黏附至關重要[5-6]。有報道稱,NETs能提升內皮活化程度,上調ICAM-1的表達[19]。此外,NETs及NETs成分還能通過直接或間接相互作用損傷內皮,改變內皮細胞透性,破壞內皮細胞骨架重排[20]。綜上所述,膿毒癥內皮環境的改變與膿毒癥背景下NETs誘導的血栓形成之間存在緊密聯系。
目前,已有大量研究報道了不同刺激劑可誘導NETs形成及信號通路[21]。有研究表明,在膿毒癥背景下,革蘭氏陰性菌細胞壁成分脂多糖(lipopolysaccharide,LPS)誘導的NETs及免疫血栓形成需要內皮細胞、活化血小板以及補體的相互作用[6, 22]。本實驗室此前研究發現,在LPS刺激下,內皮細胞與中性粒細胞的直接相互作用足以誘導NETs釋放[23]。然而,在由革蘭氏陽性菌感染引發的膿毒癥中,內皮細胞-中性粒細胞直接相互作用是否能誘導NETs產生,其過程如何,以及有哪些信號分子參與其中,仍有待進一步探明。本研究聚焦于由革蘭氏陽性菌侵染造成的膿毒癥病理環境,利用革蘭氏陽性菌細胞壁的共有成分脂磷壁酸(lipoteichoic acid,LTA)對穩定黏附在ICAM-1底板上的中性粒細胞進行刺激,通過抑制實驗及活細胞成像技術,探究LTA刺激下中性粒細胞與ICAM-1直接相互作用誘導的NETs釋放過程及參與其中的關鍵信號分子,為膿毒癥的臨床判斷及以信號通路上關鍵信號分子為靶點的相關藥物開發提供理論依據。
1 材料與方法
1.1 試劑與耗材
8孔μ-slide玻璃底板購于Ibidi(德國);枸櫞酸鈉真空采血管來自寶舜(中國);ICAM-1/CD54來自R&D Systems(美國);LTA(來源于黃金葡萄球菌)、佛波酯(phorbol-12-myristate-13-acetate,PMA)、二甲基亞砜(dimethyl sulfoxide,DMSO)、Pluronic? F127購自Sigma-Aldrich(美國);膜透性染料Hoechst 33342、BAPTA-AM細胞通透性螯合劑、鈣離子熒光探針Flou-4 AM購于InvitrogenTM(美國);非膜透性染料Sytox green來自Thermo Fisher(美國);人外周血中性粒細胞提取試劑盒來自TBD(中國);N-乙酰半胱氨酸(N-acetylcysteine,NAC)、CellROX orange購于Yeasen(中國)。
1.2 底板功能化處理
將終濃度為100 μg/mL的ICAM-1均勻鋪在8孔μ-slide玻璃底板上,37 ℃、5% CO2培養箱中孵育1 h。使用2% BSA清洗后,再次加入200 μL的2% BSA封閉1 h,阻斷非特異性黏附。
1.3 人外周血中性粒細胞分離
人外周血樣本來自健康志愿者,使用人外周血中性粒細胞提取試劑盒進行分離。本研究涉及的實驗內容及方法均已通過廣東省人民醫院倫理委員會的審查,符合赫爾辛基宣言。簡單來說,以1∶1比例將血樣注入細胞分離液上層,700 × g離心30 min;隨后,收集含有中性粒細胞的第三層細胞分離液,PBS清洗后用紅細胞裂解液去除殘余的紅細胞。使用含10% FBS的RPMI 1640培養基或加載液(含1% BSA、1.9 g/L葡萄糖、1 mmol/L HEPES)重懸中性粒細胞,調整終濃度至2 × 106/mL(細胞純度>95%)。
1.4 抑制劑或熒光探針處理
在部分實驗中,按1.3所述方法分離的中性粒細胞需在避光條件下提前用抑制劑BAPTA-AM(10 μmol/L)、NAC(10 mmol/L)或熒光檢測探針CellROX orange(1 μmol/L)預處理,并設置空白對照組及溶劑對照組,分別加入等體積含10% FBS的RPMI 1640細胞培養基或DMSO;對于活細胞成像實驗,將1.3中使用加載液重懸的中性粒細胞與Flou-4(1 mmol/L)及20% F127混合。
1.5 熒光成像觀察NETs形成
將1.4中經處理的中性粒細胞均勻鋪在ICAM-1功能化底板上,200 μL/孔;于37 ℃,5% CO2培養箱中孵育30 min,確保中性粒細胞穩定黏附于ICAM-1底板;去除未黏附的細胞后,加入LTA(4 μg/mL),37 ℃、5% CO2培養箱靜置孵育0、2、4 h。抑制實驗在同等條件下孵育4 h。刺激結束后,避光加入Sytox green(5 μmol/L)和Hoechst 33342(10 μg/mL)孵育15 min,使用Nikon Eclipse Ti2倒置熒光顯微鏡60倍鏡下隨機記錄多個視野下的NET-DNA熒光信號,包括明場、FITC通道及DAPI通道。
1.6 活細胞成像檢測中性粒細胞胞內鈣水平
將用Flou-4熒光探針預處理的中性粒細胞均勻鋪在ICAM-1功能化底板上,靜置孵育30 min;用加載液清洗后,使用含1 mmol/L Mn2+的加載液孵育30 min,去除殘留的Flou-4。在1 × 成像液(含0.1 mol/L NaCl、0.01 mol/L KCl、3 mmol/L CaCl2、0.1 mol/L HEPES、21 mmol/L 葡萄糖、1% BSA,pH 7.4)環境下,使用Nikon Eclipse Ti2倒置熒光顯微鏡定位中性粒細胞,以5 s/幀的速率拍攝5 min,記錄刺激前細胞的基礎熒光;隨后向細胞溶液中加入100 μg/mL的PMA(陽性對照組)和4 μg/mL的LTA(實驗組)各10 μL,空白對照組(Blank)加等體積的1×成像液,記錄FITC 488 nm通道下Flou-4的熒光信號變化,每組分別記錄30 min(包含預拍攝5 min)。以相對熒光強度(FIN)表示鈣信號的動態變化。FIN計算公式為:FIN = FIi / FIunstimulated,其中,FIN為單個細胞的相對熒光強度,FIi為i 時刻單個細胞熒光強度減去同一時刻下背景的熒光強度,FIunstimulated為0~5 min時單個細胞熒光強度減去同一時刻下背景的平均熒光強度。
1.7 酶標儀測定中性粒細胞胞內活性氧(reactive oxygen species,ROS)水平
避光條件下,將用CellROX orange預處理的中性粒細胞均勻鋪板;隨后,向實驗組中加入LTA(4 μg/mL)刺激劑,以PMA(100 μg/mL)為陽性對照組,空白對照組(Blank)加入等體積的細胞培養基;立即將96孔板置于Perkin Elmer多功能酶標儀上,在激發光/發射光為527/572條件下每2.5 min記錄一次,共30 min。FIN計算公式為:FIN = FIi – FI0,其中,FIi為i 時刻的細胞熒光強度,FI0為0時刻的相對細胞熒光強度。
1.8 統計學分析
使用ImageJ統計明場下的中性粒細胞總數,計算熒光圖片中陽性熒光信號面積及熒光強度;為排除細胞個數對熒光信號造成的影響,熒光信號面積及熒光強度均除以細胞總數。實驗數據以使用對照組進行歸一化的倍數變化呈現。實驗結果使用GraphPad Prism 9進行分析和繪制;所有數據以均值±標準誤(mean ± SEM)表示,均來自至少3次獨立重復實驗。兩組數據之間的差異使用雙尾Student’s t-檢驗進行分析,正態分布通過D’Agostino Pearson 正態檢驗分析;使用One-way ANOVA和Dunnett’s檢驗對兩組以上的數據進行多重比較。
2 結果
2.1 LTA誘導穩定黏附于ICAM-1分子層的中性粒細胞產生NETs
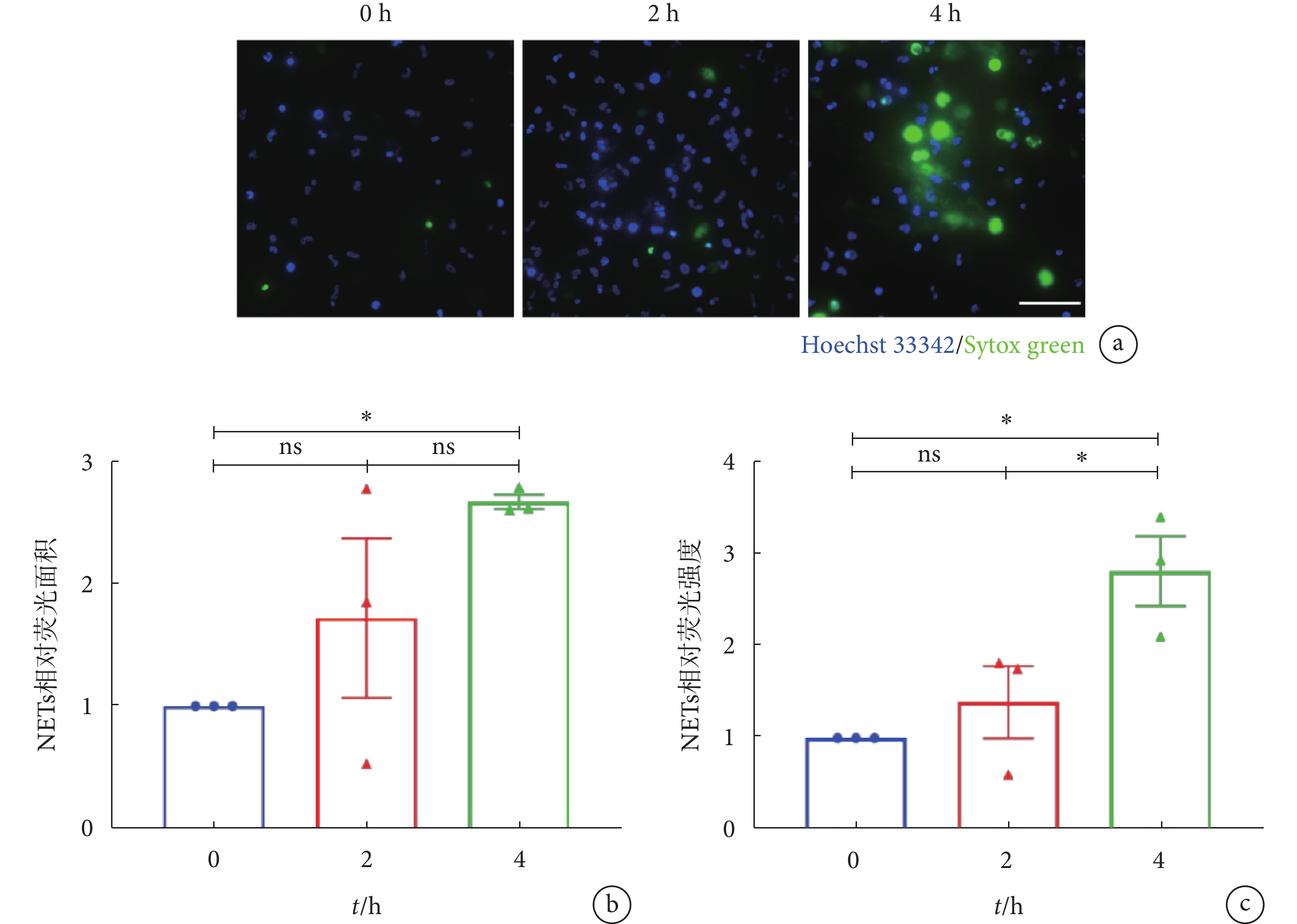
LTA能激活Toll樣受體2(toll-like receptor 2,TLR2),是革蘭氏陽性菌細胞壁的重要組成成分[24]。本研究使用來自S. aureus的LTA模擬革蘭氏陽性菌感染的病理環境,對穩定黏附在ICAM-1分子層的中性粒細胞進行不同時間的刺激。結果表明,使用LTA刺激穩定黏附的中性粒細胞能成功誘導NETs產生;與LTA刺激0 h組相比,LTA刺激4 h組能觀察到大部分中性粒細胞已丟失其典型的分葉核形態,細胞核發生膨大,且視野內有大量彌散性網狀DNA結構出現(見圖1a)。由圖1b~c可見,與0 h組相比,LTA刺激4 h時的NETs相對熒光面積及相對熒光強度發生明顯上升,分別為LTA刺激0 h組的(2.67 ± 0.06)倍(P < 0.05)和(2.82 ± 0.38)倍(P < 0.05);而與LTA刺激2 h組相比,LTA刺激4 h組的NETs相對熒光面積有升高趨勢,且NETs相對熒光強度提升了(1.03 ± 0.03)倍(P < 0.05)。值得注意的是,雖然LTA刺激2 h組的NETs熒光信號相較于0 h組表現出輕微上升趨勢,但未見明顯差異,且視野中并未出現大片NET-DNA網狀結構(見圖1a),因此,在后續的研究中,我們將刺激時間設定為4 h,以探究LTA誘導穩定黏附于ICAM-1分子層上的中性粒細胞產生NETs的過程。上述結果表明,LTA能誘導穩定黏附在ICAM-1分子層的中性粒細胞釋放NETs,且NET-DNA的釋放量呈現時間依賴性。
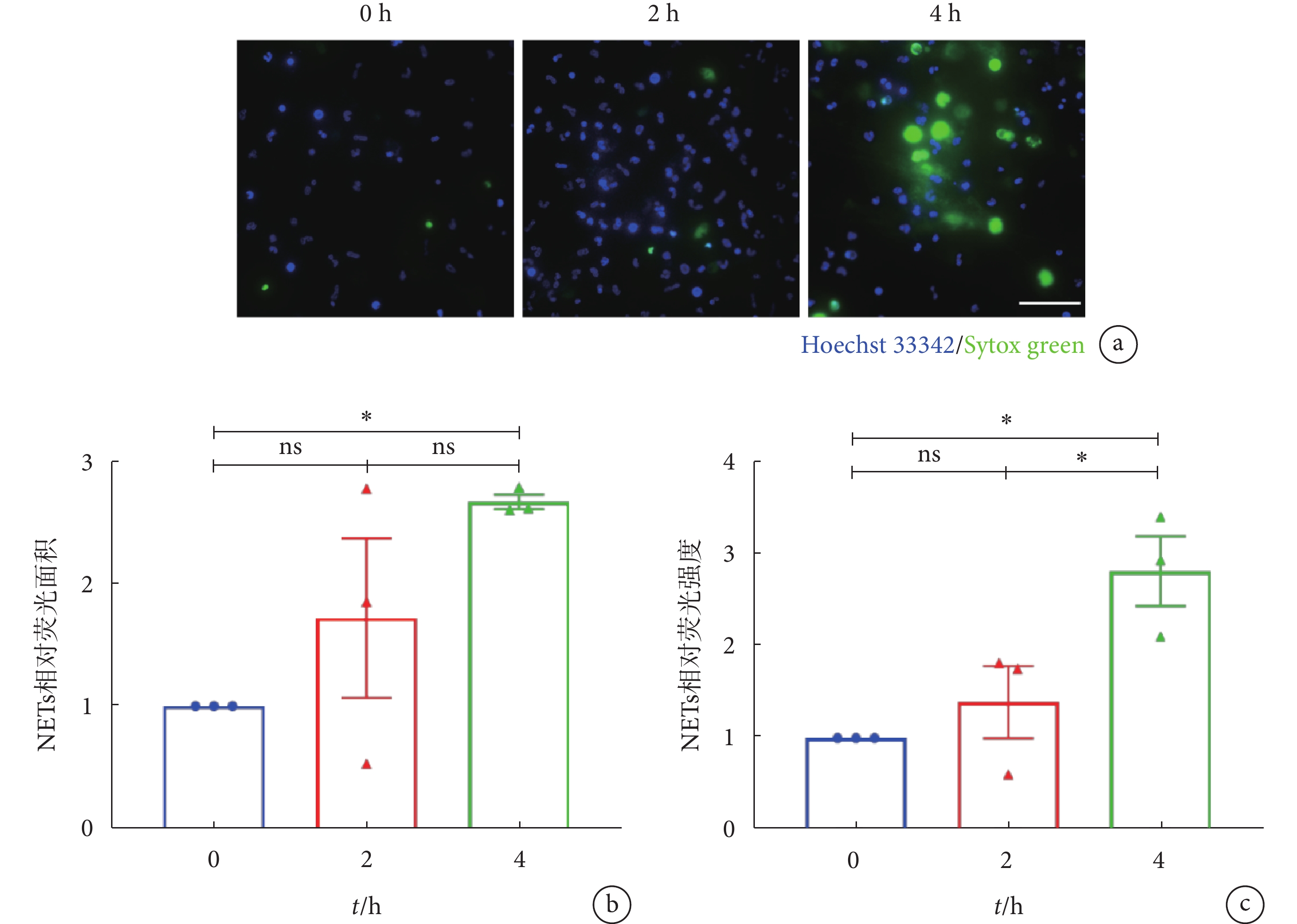 圖1
LTA刺激穩定黏附于ICAM-1的中性粒細胞NETs釋放具有時間依賴性
圖1
LTA刺激穩定黏附于ICAM-1的中性粒細胞NETs釋放具有時間依賴性
a. LTA(4 μg/mL)分別刺激0、2、4 h時NETs形成的代表性熒光顯微圖;NET-DNA使用Sytox green(綠色)標記,細胞核形態使用Hoechst 33342(藍色)標記,比例尺:50 µm。b~c. LTA刺激不同時間下,NETs相對熒光面積及相對熒光強度;數據進行One-way ANOVA 檢驗并使用多重比較計算統計學差異。*,
a. representative images of NET formation by 0, 2 and 4 h of 4 μg/mL LTA stimulation. NET-DNA were stained with Sytox green (green) and nuclei of neutrophils were labeled by Hoechst 33342 (blue). Scale bar was 50 µm. b-c. relative NETs coverage area and relative NETs fluorescent intensity by LTA stimulation of different time. One-way ANOVA and multiple comparisons were applied to identify statistical significance. *,
2.2 Ca2+參與了由LTA誘導的NETs釋放過程
Ca2+是中性粒細胞中負責傳遞信號的重要信使,參與了NETs形成過程中的多個關鍵事件[25]。本研究使用具有細胞膜通透性的鈣離子螯合劑BAPTA-AM來螯合中性粒細胞胞內Ca2+,探究胞內Ca2+水平對LTA刺激下ICAM-1與中性粒細胞相互作用誘導的NETs形成的影響(見圖2)。
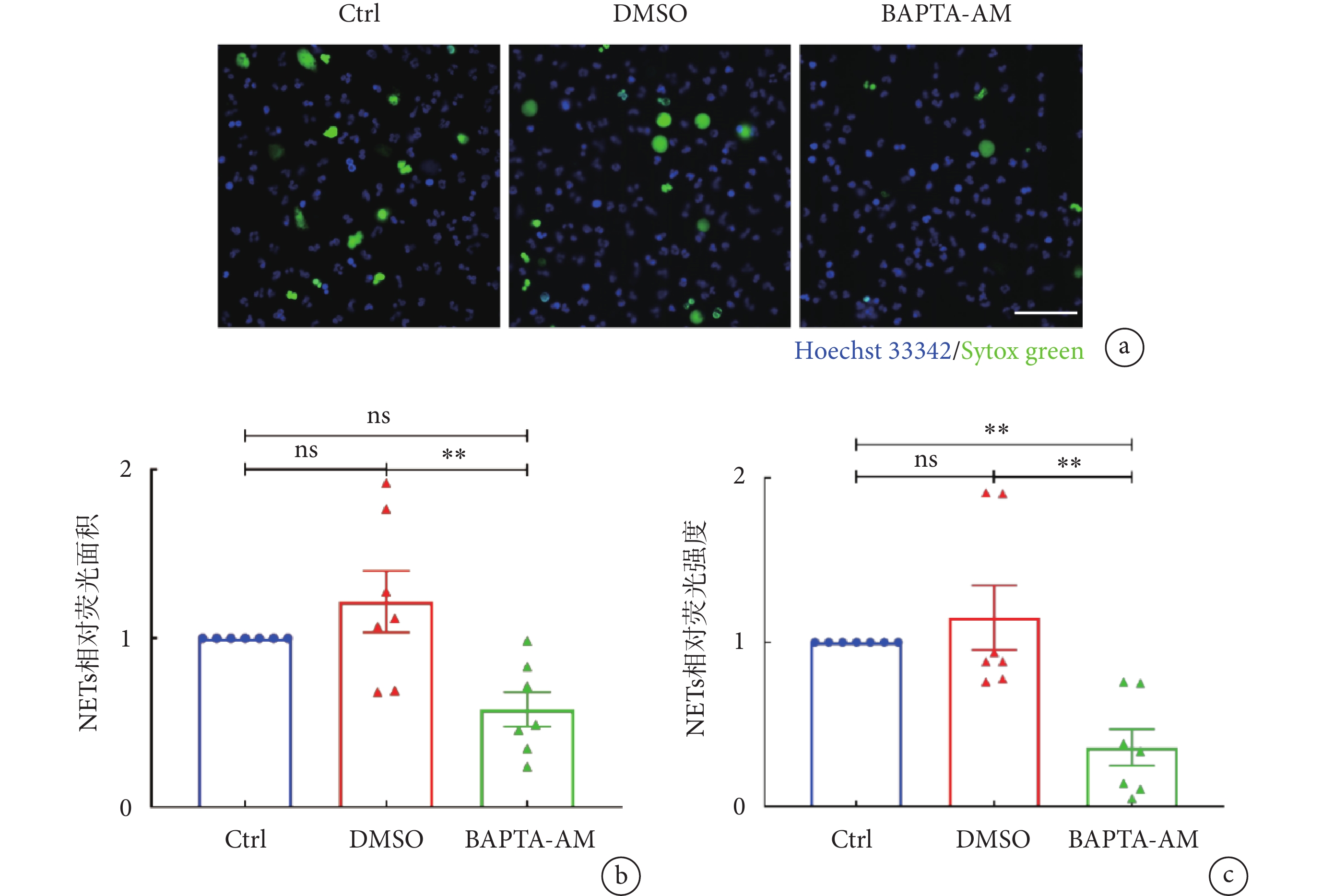 圖2
BAPTA-AM螯合胞內鈣能明顯下調LTA誘導的NETs形成
圖2
BAPTA-AM螯合胞內鈣能明顯下調LTA誘導的NETs形成
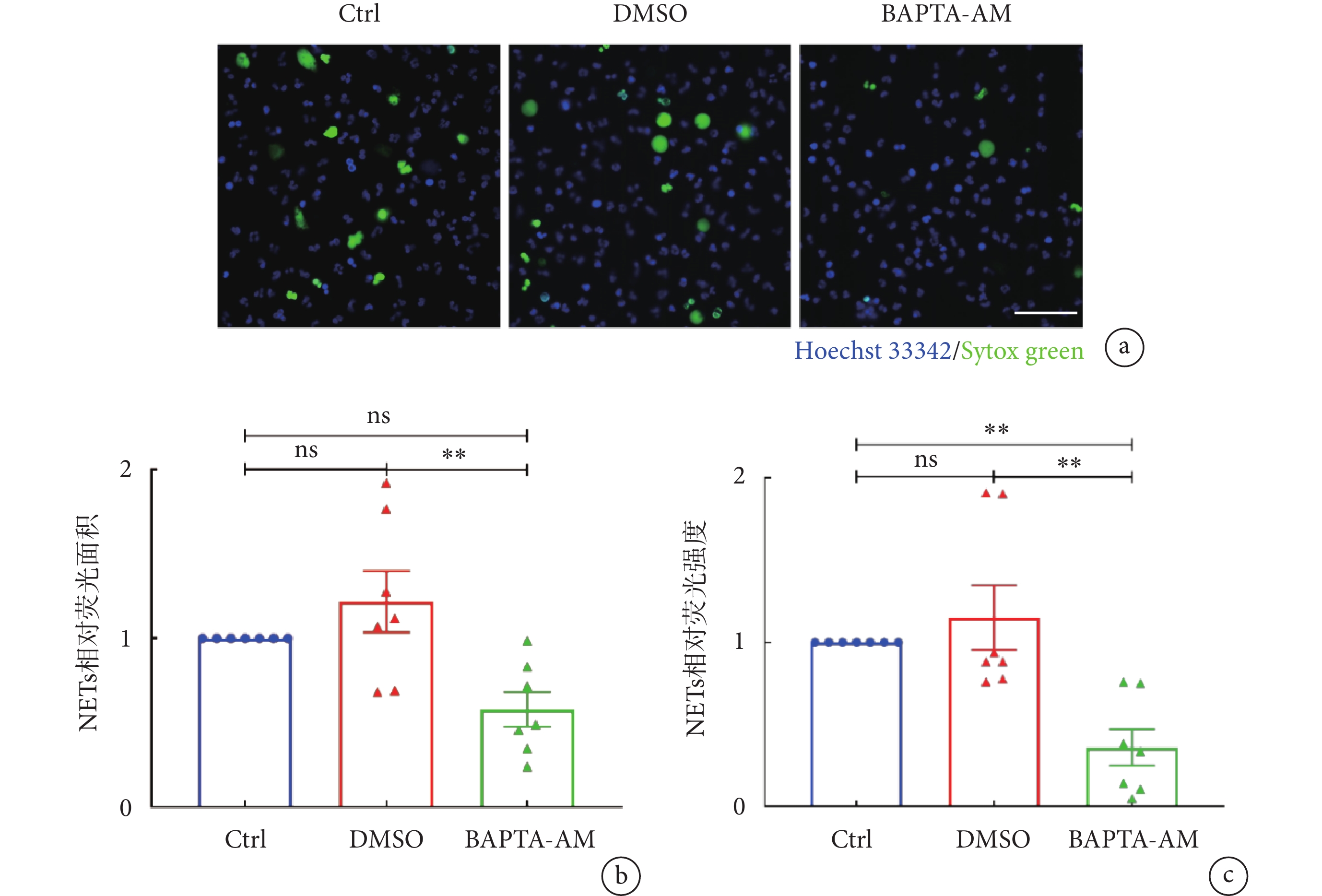
a. 使用BAPTA-AM(10 μmol/L)螯合中性粒細胞胞內Ca2+后,利用LTA誘導NETs形成的代表性熒光顯微圖;NET-DNA使用Sytox green(綠色)標記,細胞核形態使用Hoechst 33342(藍色)標記,比例尺:50 µm。b~c. BAPTA-AM螯合胞內鈣后的NETs相對熒光面積及相對熒光強度;數據進行One-way ANOVA 檢驗并使用多重比較計算統計學差異。**,
a. representative images of NET formation upon intracellular Ca2+ chelation of neutrophils with BAPTA-AM (10 μmol/L) and followed by LTA stimulation. NET-DNA were stained with Sytox green (green) and nuclei of neutrophils were labeled by Hoechst 33342 (blue). Scale bar was 50 µm. b-c. relative NETs coverage area and relative NETs fluorescent intensity from experiment of BAPTA-AM chelation. One-way ANOVA and multiple comparisons were applied to identify statistical significance. **,
結果表明,中性粒細胞用BAPTA-AM預處理后會造成NET-DNA信號下降,且視野中的大部分中性粒細胞均能保持其分葉核形態,僅少數中性粒細胞產生NETs(見圖2a)。與未經抑制劑處理的LTA刺激組(Ctrl組)相比,BAPTA-AM組的NETs相對熒光強度明顯下降,減少了(63.9 ± 11.1)%(P < 0.01);與DMSO組相比,BAPTA-AM處理組的NETs相對熒光面積及NETs相對熒光強度均明顯降低,分別減少(52.3±8.0)%(P < 0.01)和(63.9 ± 11.1)%(P < 0.01)(見圖2b~c)。DMSO組與Ctrl組之間相對熒光面積和相對熒光強度則無明顯差異,表明BAPTA-AM組NETs形成的下調并非由溶劑DMSO引起,而是因胞內鈣水平下調造成的。上述結果顯示,LTA誘導的NETs釋放過程需要Ca2+的參與。
2.3 LTA能引發中性粒細胞胞內鈣水平上升
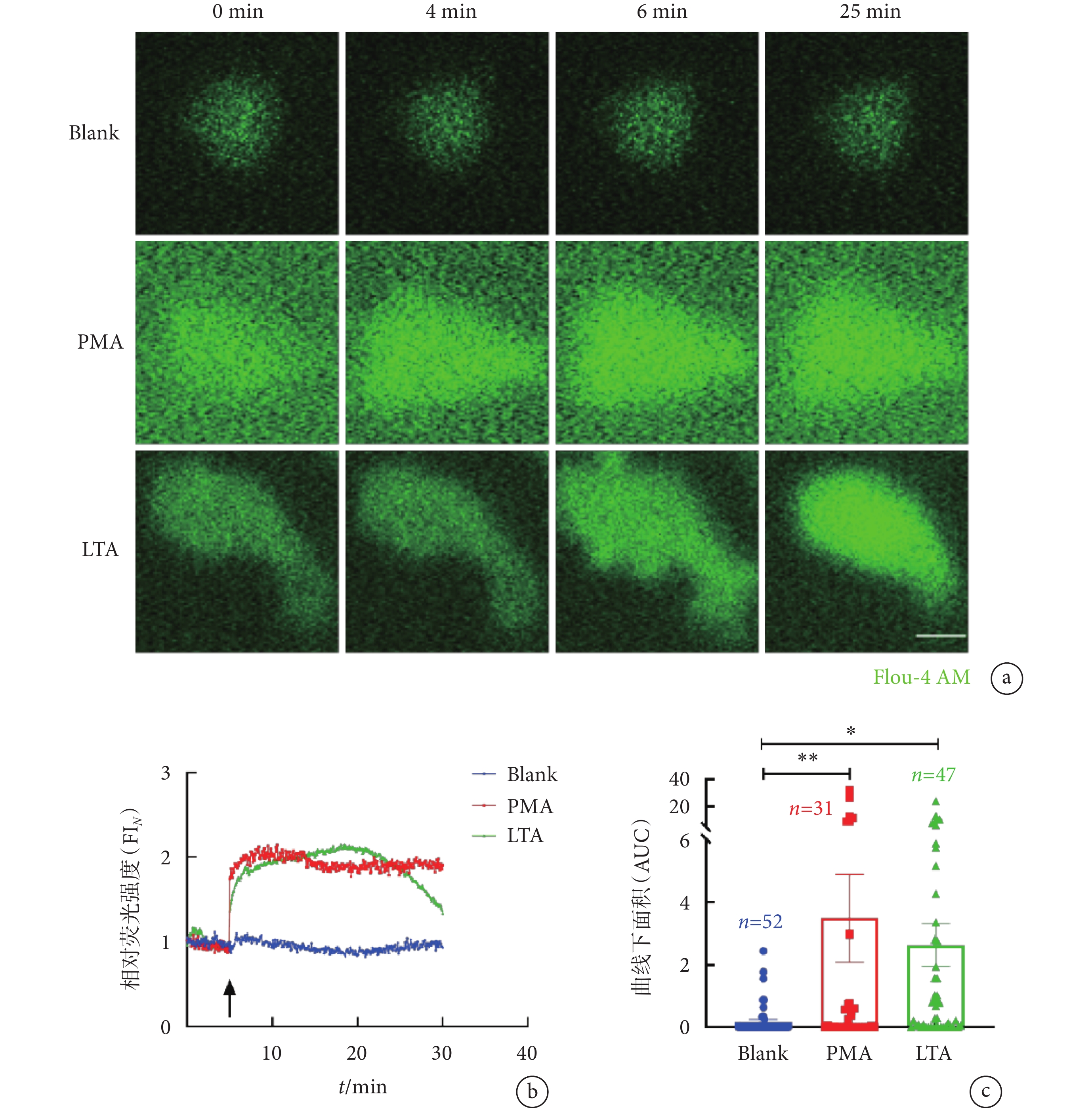
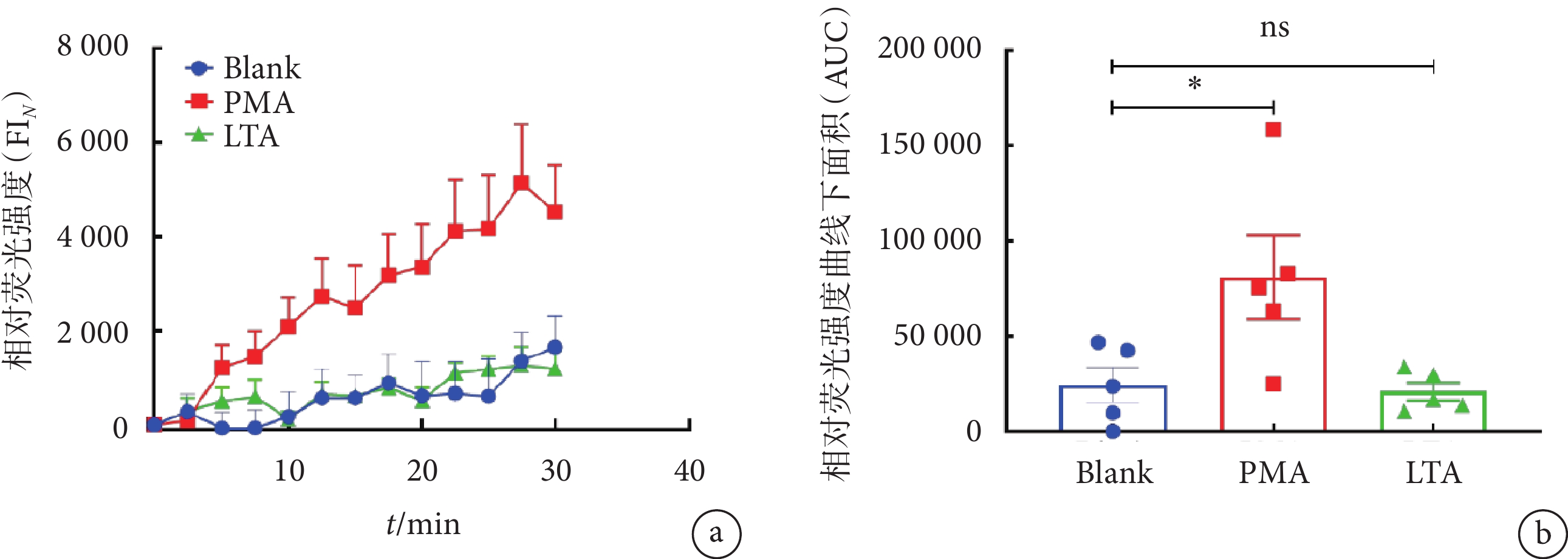
為了探究LTA誘導下中性粒細胞胞內Ca2+水平的動態變化,本研究使用鈣離子熒光探針Flou-4 AM指示胞內Ca2+水平,結合活細胞成像技術實時觀察LTA誘導的中性粒細胞中鈣信號波動。PMA是研究NETs形成機制中使用最廣泛的強力化學誘導劑。研究表明,PMA會引發中性粒細胞胞內鈣離子發生短暫變化,并導致鈣離子濃度的逐步累積,直至細胞質膜發生破裂,最終造成NETs釋放[26]。因此,我們選擇PMA作為陽性對照組。在分別加入PMA及LTA后,中性粒細胞胞內Ca2+信號均急速上升,PMA組的胞內Ca2+信號相對熒光強度在刺激9 min左右達到峰值,隨后發生輕微下降并維持動態平衡;而LTA組胞內鈣相對熒光強度在刺激約19 min時達到峰值,隨后其相對熒光強度逐漸下降(見圖3a~b);PMA組及LTA組的曲線下面積(area under the curve,AUC)分別為Blank組的(3.32 ± 1.34)倍(P<0.01)和(2.46 ± 0.61)倍(P < 0.05)(見圖3c)。綜上所述,LTA能引發中性粒細胞胞內Ca2+水平的上升及NETs釋放。
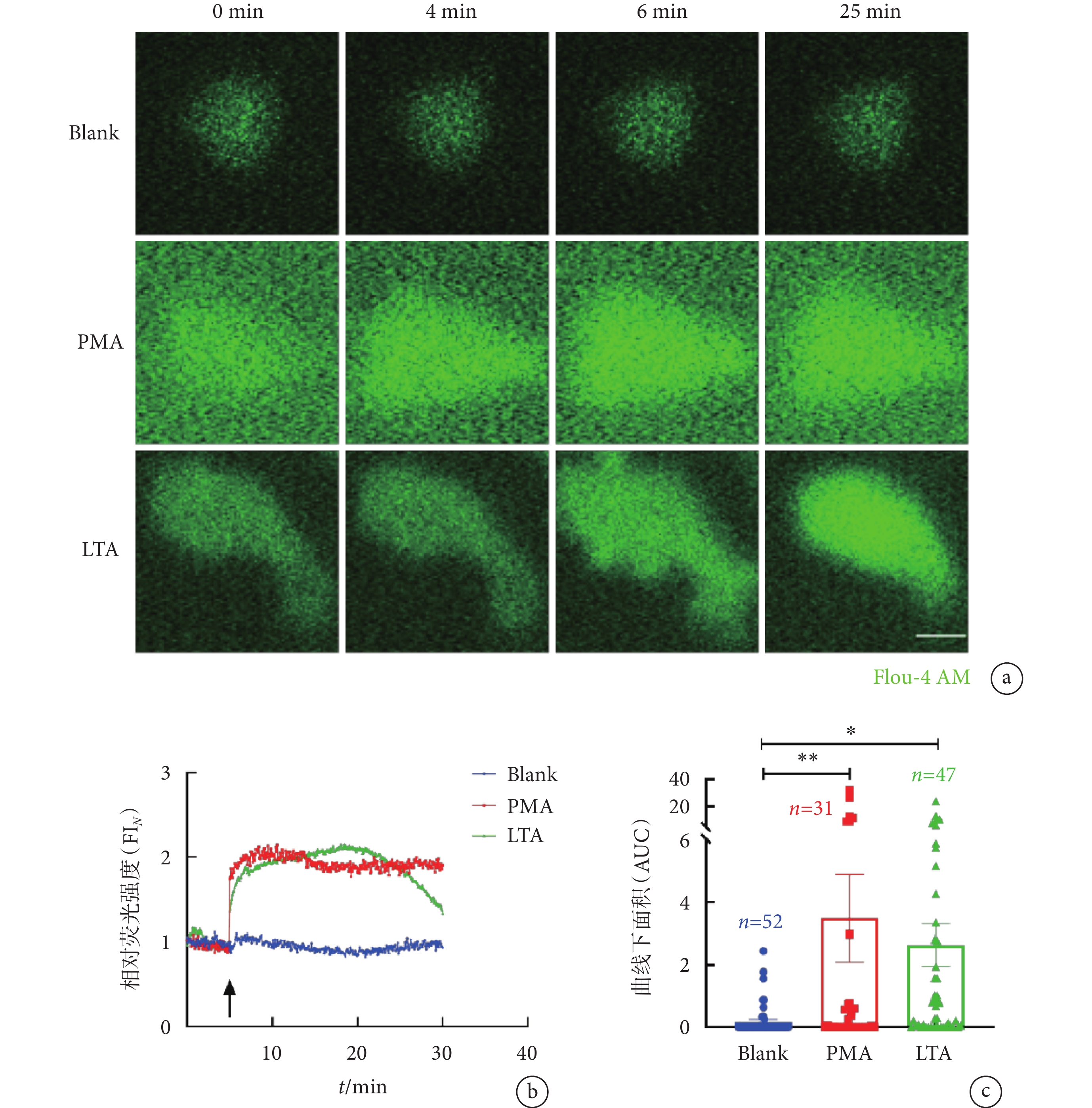 圖3
LTA引發中性粒細胞胞內鈣上升
圖3
LTA引發中性粒細胞胞內鈣上升
a. 使用Flou-4 AM(2 μmol/L)檢測PMA或LTA刺激后單個中性粒細胞在FITC 488 nm通道下的胞內Ca2+變化的活細胞成像圖;比例尺:5 µm。b~c. LTA刺激中性粒細胞過程中,胞內鈣信號相對熒光強度(FI
a. live-cell imaging of intracellular Ca2+ fluctuation of single neutrophil stimulated with LTA or PMA and detected by 2 μmol/L of Flou-4 AM (green) at FITC 488 nm channel. Scale bar, 5 µm. b-c. normalized intensity (FI
2.4 NAC抑制胞內ROS對LTA誘導的NETs釋放無影響
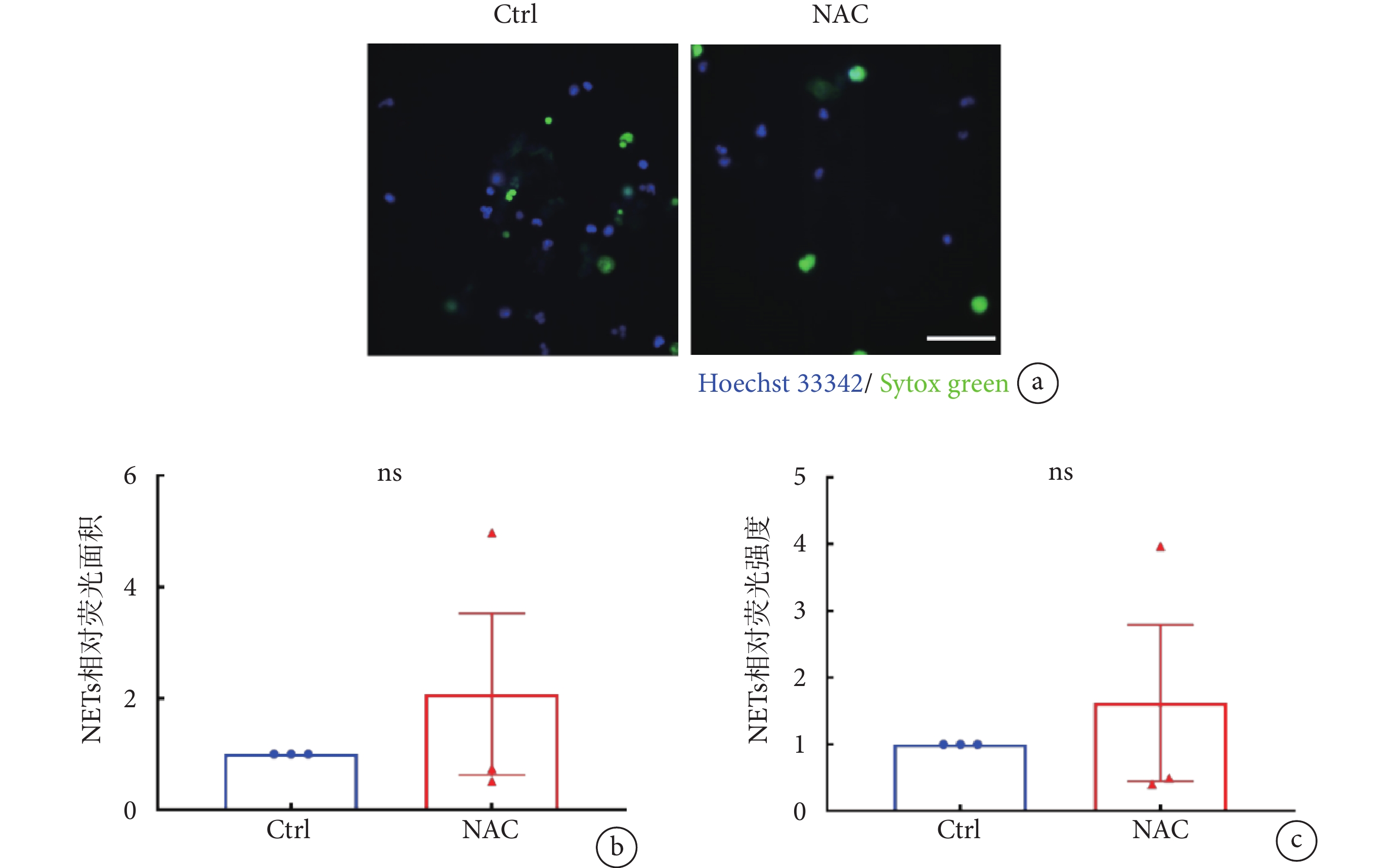
除鈣信號外,ROS也是參與NETs釋放過程中的關鍵分子之一。但有研究表明,中性粒細胞也可以通過不依賴于ROS的信號通路釋放NETs[27-28]。為探究ROS是否參與LTA誘導穩定黏附于ICAM-1分子層的中性粒細胞產生NETs,我們利用NAC預處理中性粒細胞,再考察LTA刺激下NETs形成的變化,以未經抑制劑處理的Ctrl組作為對照。NAC是谷胱甘肽(glutathione,GSH)的前體,能通過抑制ROS迸發,進而抑制PMA誘導的NETs形成[29]。結果顯示,NAC預處理對于LTA誘導中性粒細胞NETs形成未見明顯影響(見圖4a);NAC組的NETs相對熒光面積及相對熒光強度與Ctrl組之間的差異均無統計學意義(見圖4b~c),表明ROS不參與LTA誘導的穩定黏附于ICAM-1分子層上的中性粒細胞NETs釋放。
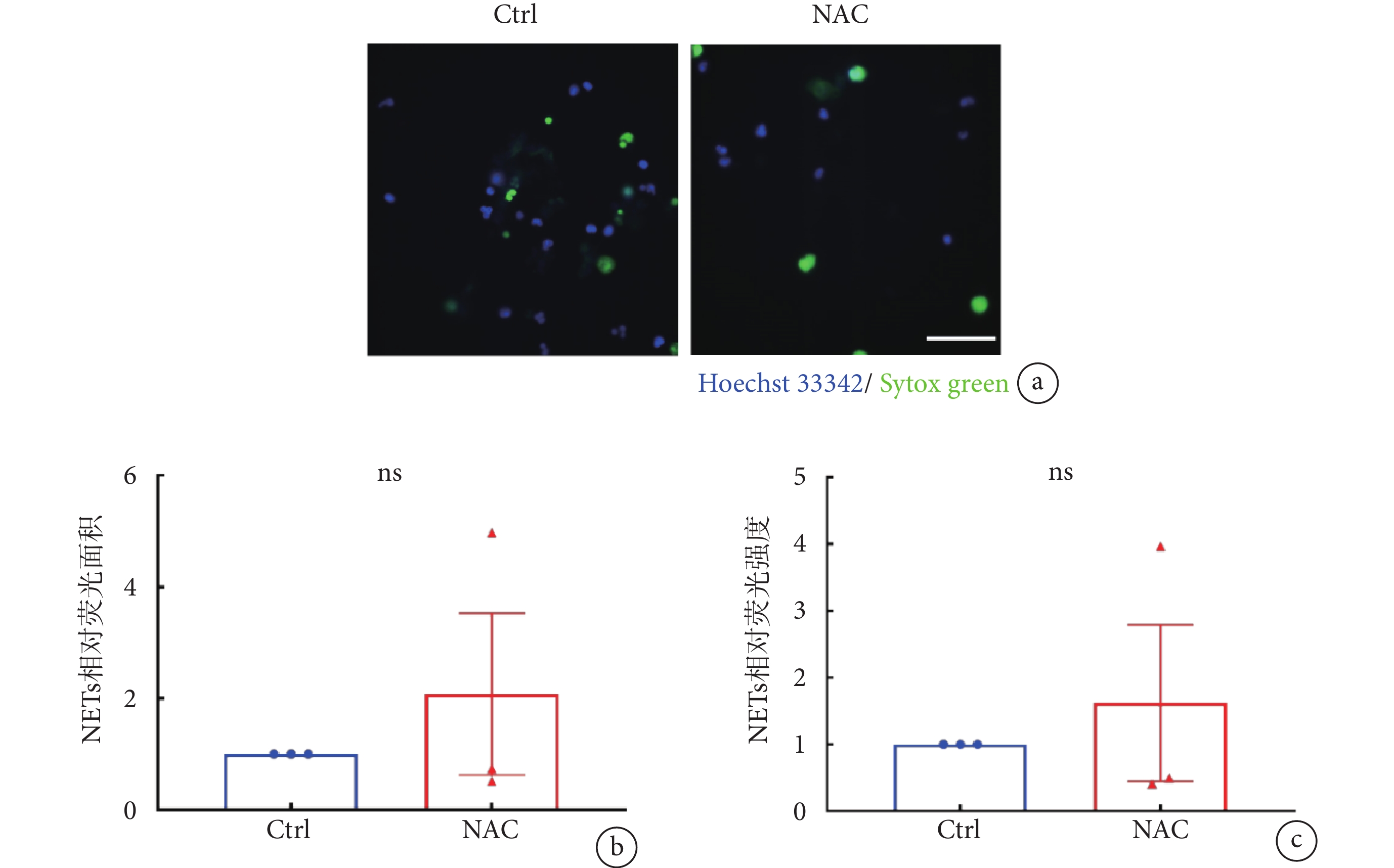 圖4
NAC抑制ROS不影響LTA誘導的NETs釋放
圖4
NAC抑制ROS不影響LTA誘導的NETs釋放
a. 經NAC(10 mmol/L)預處理的中性粒細胞在LTA刺激下形成NETs的代表性熒光顯微圖;NET-DNA使用Sytox green(綠色)標記,細胞核形態使用Hoechst 33342(藍色)標記,比例尺:50 µm。b~c. 使用NAC抑制ROS后,各組的NETs相對熒光面積及相對熒光強度。數據進行雙尾Student’s
a. representative images of NETs formation of neutrophils incubated with NAC (10 mmol/L) induced by LTA. NET-DNA were stained with Sytox green (green) and nuclei of neutrophils were labeled by Hoechst 33342 (blue). Scale bar, 50 µm. b-c. relative NETs coverage area and relative NETs fluorescent intensity from experiment of ROS inhibited by NAC. Two-tailed Student’s
2.5 LTA刺激無法引發中性粒細胞胞內ROS生成
上述結果顯示,清除胞內ROS不影響LTA誘導的中性粒細胞NETs形成。進一步地,我們利用ROS熒光探針CellROX orange結合多功能酶標儀來探測LTA刺激下中性粒細胞的胞內ROS動態變化。PMA可以刺激中性粒細胞引發ROS生成,作為陽性對照。使用PMA刺激中性粒細胞后,10 min內觀察到CellROX orange信號的上升;而LTA組與未加刺激劑的空白對照組(Blank)的ROS水平在30 min內均保持在較低水平(見圖5 a);與Blank組相比,PMA組ROS相對熒光強度AUC明顯上升(P < 0.05),而LTA組與Blank組之間的差異無統計學意義。上述實驗表明,LTA無法誘導中性粒細胞胞內ROS生成。
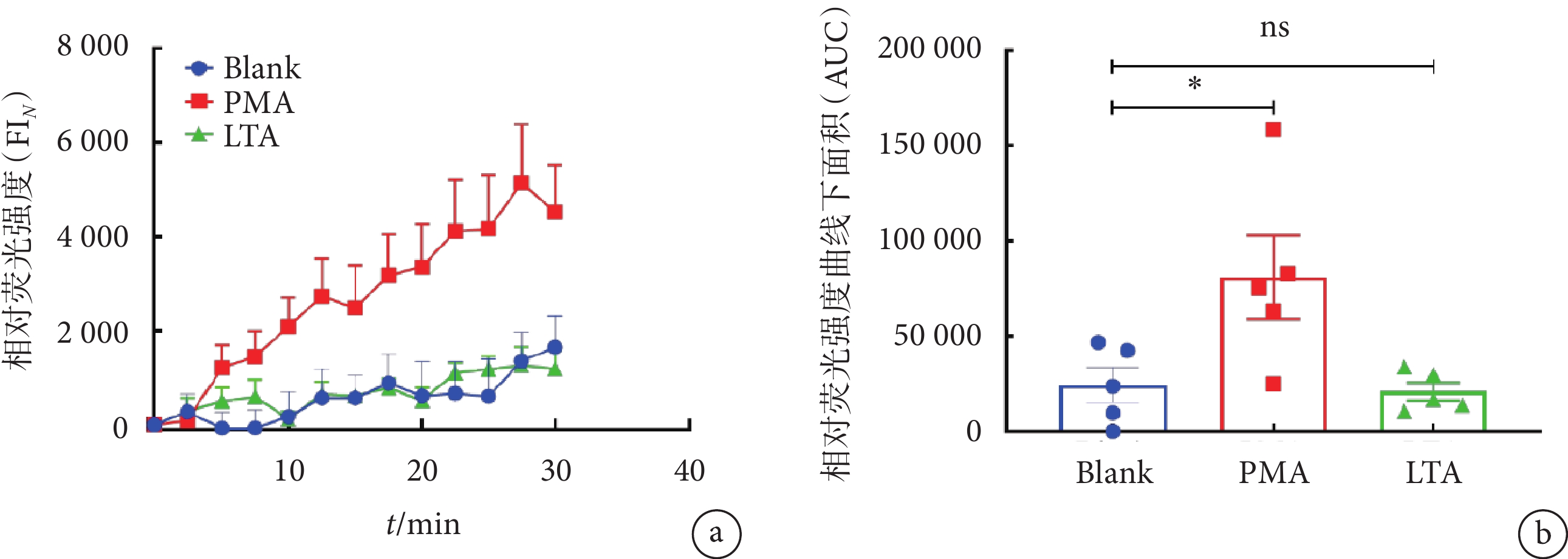 圖5
LTA無法引發中性粒細胞胞內ROS迸發
圖5
LTA無法引發中性粒細胞胞內ROS迸發
a. 利用CellROX orange(1 μmol/L)檢測LTA刺激30 min內中性粒細胞胞內ROS相對熒光強度(FI
a. normalized fluorescent intensity (FI
3 討論
在大部分膿毒癥病例中,很難檢測分離到特定致病微生物,這提示細菌的成分可能是造成膿毒癥的主要原因[30-31]。本研究使用來自S. aureus的LTA模擬革蘭氏陽性菌引發的膿毒癥病理場景,并探究在這一病理環境下,內皮細胞高表達的ICAM-1與中性粒細胞相互作用導致的NETs形成過程。本研究顯示,在LTA作用下,ICAM-1與中性粒細胞相互作用導致的NETs釋放具有時間依賴性,刺激4 h時才能明顯產生NETs,這與S. aureus誘導的快速NETs釋放僅需10 min即可發生有所區別[32]。這也提示,S. aureus的其他成分也參與誘導NETs的形成,尤其是快速NETs的形成。
Ca2+在NETs形成中的重要作用最早見于PMA誘導的NETs釋放。de Bont等[26]報道,PMA刺激使中性粒細胞胞漿Ca2+濃度逐漸升高,直至細胞質膜破裂。本研究表明,在對中性粒細胞施加LTA刺激后,胞內Ca2+水平發生迅速上升,與PMA刺激中性粒細胞表現相似;利用BAPTA-AM螯合胞內鈣后,中性粒細胞在LTA刺激下釋放的NETs明顯下調,說明LTA刺激下的NETs形成同樣需要Ca2+的參與。
作為NETs形成的關鍵事件之一,ROS迸發參與NETs形成已得到廣泛報道。有研究認為,LTA可引發中性粒細胞的ROS釋放,以協同增強對細胞的破壞程度[31]。我們的研究發現,使用NAC抑制ROS后,LTA誘導的NETs形成并未明顯減少;用CellROX orange探針檢測LTA刺激30 min的胞內ROS信號變化實驗表明,LTA刺激無法引發中性粒細胞內大量ROS迸發,這與Lee等[33]用流式細胞術檢測到LTA能明顯引發懸浮中性粒細胞ROS水平升高不同;而與Pilsczek等[34]報道用S. aureus刺激中性粒細胞產生NETs的過程不需要ROS參與相一致。造成這一結果的原因可能與ICAM-1與中性粒細胞相互作用的信號通路改變了單純由LTA誘導NETs形成的信號通路有關。
4 總結
在由S. aureus引發的膿毒癥病程后期,血管內大量彌散性血栓的形成是造成膿毒癥患者死亡的重要原因。本研究利用來自黃金葡萄球菌的LTA模擬S. aureus感染造成的膿毒癥病理場景,探究了內皮細胞表面分子ICAM-1與中性粒細胞相互作用下,LTA誘導NETs釋放的過程;同時,通過抑制實驗和對中性粒細胞胞內Ca2+和ROS動態變化的觀察,闡述了LTA誘導的NETs形成是一個依賴于Ca2+而不依賴ROS的過程。基于上述實驗結果,本研究有利于加深對由S. aureus感染造成的膿毒癥病理條件下,血管中NETs形成過程及其機制的認識,為膿毒癥治療干預以及相關新藥物的開發提供了理論參考。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:黃嘉祺負責實驗操作、數據記錄分析、論文撰寫;方金花與吳芝偉負責實驗設計、數據分析、論文審閱修訂;吳建華提供平臺支持和論文指導;方穎與林蔣國負責研究選題指導、實驗安排、論文審閱修訂。
倫理聲明:本研究通過了廣東省人民醫院倫理委員會的審批(批文編號:KY2020-051-02)。
0 引言
膿毒癥(sepsis)是以多器官功能紊亂為特點的系統性炎癥反應綜合征[1]。患者增速快、致死率高[2],在膿毒癥患者血管內中伴隨有大量彌散性血栓的出現[3]。膿毒癥可以由革蘭氏陽性菌及革蘭氏陰性菌引起。其中,由革蘭氏陽性菌感染導致的膿毒癥病例超過總報告病例的50%[4]。黃金葡萄球菌(Staphylococcus aureus,S. aureus)是一種常見的革蘭氏陽性菌。有報道稱,S. aureus能上調膿毒癥血管內皮細胞分子表達水平,加強內皮細胞與單核細胞之間的黏附力,導致內皮促凝血能力上調[5]。
在膿毒癥的病程發展過程中,中性粒細胞從循環血液中被招募到受感染的部位,產生中性粒細胞胞外誘捕網(neutrophil extracellular traps,NETs),并促進免疫血栓形成[6]。NETs是鑲嵌有多種抗菌蛋白的DNA三維骨架結構,能發揮“顯微機械篩”功能,捕獲并限制病原菌擴散[7-8]。盡管NETs作為中性粒細胞抗菌策略的正面作用已廣受報道,然而不恰當的NETs釋放也會加劇促炎反應[9-10],誘導血栓形成[11-12],造成組織損傷[13]及器官纖維化[14-15],引發多種疾病[16-18],對機體產生負面影響。
中性粒細胞的招募需要經過滾動、黏附、穩定黏附、鋪展、爬行、遷移等一系列級聯反應。其中,內皮細胞表面持續表達的細胞間黏附分子-1(intercellular adhesion molecule-1,ICAM-1)能通過與中性粒細胞表面β2整合素家族相互作用,將中性粒細胞捕獲到內皮上,對中性粒細胞的穩定黏附至關重要[5-6]。有報道稱,NETs能提升內皮活化程度,上調ICAM-1的表達[19]。此外,NETs及NETs成分還能通過直接或間接相互作用損傷內皮,改變內皮細胞透性,破壞內皮細胞骨架重排[20]。綜上所述,膿毒癥內皮環境的改變與膿毒癥背景下NETs誘導的血栓形成之間存在緊密聯系。
目前,已有大量研究報道了不同刺激劑可誘導NETs形成及信號通路[21]。有研究表明,在膿毒癥背景下,革蘭氏陰性菌細胞壁成分脂多糖(lipopolysaccharide,LPS)誘導的NETs及免疫血栓形成需要內皮細胞、活化血小板以及補體的相互作用[6, 22]。本實驗室此前研究發現,在LPS刺激下,內皮細胞與中性粒細胞的直接相互作用足以誘導NETs釋放[23]。然而,在由革蘭氏陽性菌感染引發的膿毒癥中,內皮細胞-中性粒細胞直接相互作用是否能誘導NETs產生,其過程如何,以及有哪些信號分子參與其中,仍有待進一步探明。本研究聚焦于由革蘭氏陽性菌侵染造成的膿毒癥病理環境,利用革蘭氏陽性菌細胞壁的共有成分脂磷壁酸(lipoteichoic acid,LTA)對穩定黏附在ICAM-1底板上的中性粒細胞進行刺激,通過抑制實驗及活細胞成像技術,探究LTA刺激下中性粒細胞與ICAM-1直接相互作用誘導的NETs釋放過程及參與其中的關鍵信號分子,為膿毒癥的臨床判斷及以信號通路上關鍵信號分子為靶點的相關藥物開發提供理論依據。
1 材料與方法
1.1 試劑與耗材
8孔μ-slide玻璃底板購于Ibidi(德國);枸櫞酸鈉真空采血管來自寶舜(中國);ICAM-1/CD54來自R&D Systems(美國);LTA(來源于黃金葡萄球菌)、佛波酯(phorbol-12-myristate-13-acetate,PMA)、二甲基亞砜(dimethyl sulfoxide,DMSO)、Pluronic? F127購自Sigma-Aldrich(美國);膜透性染料Hoechst 33342、BAPTA-AM細胞通透性螯合劑、鈣離子熒光探針Flou-4 AM購于InvitrogenTM(美國);非膜透性染料Sytox green來自Thermo Fisher(美國);人外周血中性粒細胞提取試劑盒來自TBD(中國);N-乙酰半胱氨酸(N-acetylcysteine,NAC)、CellROX orange購于Yeasen(中國)。
1.2 底板功能化處理
將終濃度為100 μg/mL的ICAM-1均勻鋪在8孔μ-slide玻璃底板上,37 ℃、5% CO2培養箱中孵育1 h。使用2% BSA清洗后,再次加入200 μL的2% BSA封閉1 h,阻斷非特異性黏附。
1.3 人外周血中性粒細胞分離
人外周血樣本來自健康志愿者,使用人外周血中性粒細胞提取試劑盒進行分離。本研究涉及的實驗內容及方法均已通過廣東省人民醫院倫理委員會的審查,符合赫爾辛基宣言。簡單來說,以1∶1比例將血樣注入細胞分離液上層,700 × g離心30 min;隨后,收集含有中性粒細胞的第三層細胞分離液,PBS清洗后用紅細胞裂解液去除殘余的紅細胞。使用含10% FBS的RPMI 1640培養基或加載液(含1% BSA、1.9 g/L葡萄糖、1 mmol/L HEPES)重懸中性粒細胞,調整終濃度至2 × 106/mL(細胞純度>95%)。
1.4 抑制劑或熒光探針處理
在部分實驗中,按1.3所述方法分離的中性粒細胞需在避光條件下提前用抑制劑BAPTA-AM(10 μmol/L)、NAC(10 mmol/L)或熒光檢測探針CellROX orange(1 μmol/L)預處理,并設置空白對照組及溶劑對照組,分別加入等體積含10% FBS的RPMI 1640細胞培養基或DMSO;對于活細胞成像實驗,將1.3中使用加載液重懸的中性粒細胞與Flou-4(1 mmol/L)及20% F127混合。
1.5 熒光成像觀察NETs形成
將1.4中經處理的中性粒細胞均勻鋪在ICAM-1功能化底板上,200 μL/孔;于37 ℃,5% CO2培養箱中孵育30 min,確保中性粒細胞穩定黏附于ICAM-1底板;去除未黏附的細胞后,加入LTA(4 μg/mL),37 ℃、5% CO2培養箱靜置孵育0、2、4 h。抑制實驗在同等條件下孵育4 h。刺激結束后,避光加入Sytox green(5 μmol/L)和Hoechst 33342(10 μg/mL)孵育15 min,使用Nikon Eclipse Ti2倒置熒光顯微鏡60倍鏡下隨機記錄多個視野下的NET-DNA熒光信號,包括明場、FITC通道及DAPI通道。
1.6 活細胞成像檢測中性粒細胞胞內鈣水平
將用Flou-4熒光探針預處理的中性粒細胞均勻鋪在ICAM-1功能化底板上,靜置孵育30 min;用加載液清洗后,使用含1 mmol/L Mn2+的加載液孵育30 min,去除殘留的Flou-4。在1 × 成像液(含0.1 mol/L NaCl、0.01 mol/L KCl、3 mmol/L CaCl2、0.1 mol/L HEPES、21 mmol/L 葡萄糖、1% BSA,pH 7.4)環境下,使用Nikon Eclipse Ti2倒置熒光顯微鏡定位中性粒細胞,以5 s/幀的速率拍攝5 min,記錄刺激前細胞的基礎熒光;隨后向細胞溶液中加入100 μg/mL的PMA(陽性對照組)和4 μg/mL的LTA(實驗組)各10 μL,空白對照組(Blank)加等體積的1×成像液,記錄FITC 488 nm通道下Flou-4的熒光信號變化,每組分別記錄30 min(包含預拍攝5 min)。以相對熒光強度(FIN)表示鈣信號的動態變化。FIN計算公式為:FIN = FIi / FIunstimulated,其中,FIN為單個細胞的相對熒光強度,FIi為i 時刻單個細胞熒光強度減去同一時刻下背景的熒光強度,FIunstimulated為0~5 min時單個細胞熒光強度減去同一時刻下背景的平均熒光強度。
1.7 酶標儀測定中性粒細胞胞內活性氧(reactive oxygen species,ROS)水平
避光條件下,將用CellROX orange預處理的中性粒細胞均勻鋪板;隨后,向實驗組中加入LTA(4 μg/mL)刺激劑,以PMA(100 μg/mL)為陽性對照組,空白對照組(Blank)加入等體積的細胞培養基;立即將96孔板置于Perkin Elmer多功能酶標儀上,在激發光/發射光為527/572條件下每2.5 min記錄一次,共30 min。FIN計算公式為:FIN = FIi – FI0,其中,FIi為i 時刻的細胞熒光強度,FI0為0時刻的相對細胞熒光強度。
1.8 統計學分析
使用ImageJ統計明場下的中性粒細胞總數,計算熒光圖片中陽性熒光信號面積及熒光強度;為排除細胞個數對熒光信號造成的影響,熒光信號面積及熒光強度均除以細胞總數。實驗數據以使用對照組進行歸一化的倍數變化呈現。實驗結果使用GraphPad Prism 9進行分析和繪制;所有數據以均值±標準誤(mean ± SEM)表示,均來自至少3次獨立重復實驗。兩組數據之間的差異使用雙尾Student’s t-檢驗進行分析,正態分布通過D’Agostino Pearson 正態檢驗分析;使用One-way ANOVA和Dunnett’s檢驗對兩組以上的數據進行多重比較。
2 結果
2.1 LTA誘導穩定黏附于ICAM-1分子層的中性粒細胞產生NETs
LTA能激活Toll樣受體2(toll-like receptor 2,TLR2),是革蘭氏陽性菌細胞壁的重要組成成分[24]。本研究使用來自S. aureus的LTA模擬革蘭氏陽性菌感染的病理環境,對穩定黏附在ICAM-1分子層的中性粒細胞進行不同時間的刺激。結果表明,使用LTA刺激穩定黏附的中性粒細胞能成功誘導NETs產生;與LTA刺激0 h組相比,LTA刺激4 h組能觀察到大部分中性粒細胞已丟失其典型的分葉核形態,細胞核發生膨大,且視野內有大量彌散性網狀DNA結構出現(見圖1a)。由圖1b~c可見,與0 h組相比,LTA刺激4 h時的NETs相對熒光面積及相對熒光強度發生明顯上升,分別為LTA刺激0 h組的(2.67 ± 0.06)倍(P < 0.05)和(2.82 ± 0.38)倍(P < 0.05);而與LTA刺激2 h組相比,LTA刺激4 h組的NETs相對熒光面積有升高趨勢,且NETs相對熒光強度提升了(1.03 ± 0.03)倍(P < 0.05)。值得注意的是,雖然LTA刺激2 h組的NETs熒光信號相較于0 h組表現出輕微上升趨勢,但未見明顯差異,且視野中并未出現大片NET-DNA網狀結構(見圖1a),因此,在后續的研究中,我們將刺激時間設定為4 h,以探究LTA誘導穩定黏附于ICAM-1分子層上的中性粒細胞產生NETs的過程。上述結果表明,LTA能誘導穩定黏附在ICAM-1分子層的中性粒細胞釋放NETs,且NET-DNA的釋放量呈現時間依賴性。
 圖1
LTA刺激穩定黏附于ICAM-1的中性粒細胞NETs釋放具有時間依賴性
圖1
LTA刺激穩定黏附于ICAM-1的中性粒細胞NETs釋放具有時間依賴性
a. LTA(4 μg/mL)分別刺激0、2、4 h時NETs形成的代表性熒光顯微圖;NET-DNA使用Sytox green(綠色)標記,細胞核形態使用Hoechst 33342(藍色)標記,比例尺:50 µm。b~c. LTA刺激不同時間下,NETs相對熒光面積及相對熒光強度;數據進行One-way ANOVA 檢驗并使用多重比較計算統計學差異。*,
a. representative images of NET formation by 0, 2 and 4 h of 4 μg/mL LTA stimulation. NET-DNA were stained with Sytox green (green) and nuclei of neutrophils were labeled by Hoechst 33342 (blue). Scale bar was 50 µm. b-c. relative NETs coverage area and relative NETs fluorescent intensity by LTA stimulation of different time. One-way ANOVA and multiple comparisons were applied to identify statistical significance. *,
2.2 Ca2+參與了由LTA誘導的NETs釋放過程
Ca2+是中性粒細胞中負責傳遞信號的重要信使,參與了NETs形成過程中的多個關鍵事件[25]。本研究使用具有細胞膜通透性的鈣離子螯合劑BAPTA-AM來螯合中性粒細胞胞內Ca2+,探究胞內Ca2+水平對LTA刺激下ICAM-1與中性粒細胞相互作用誘導的NETs形成的影響(見圖2)。
 圖2
BAPTA-AM螯合胞內鈣能明顯下調LTA誘導的NETs形成
圖2
BAPTA-AM螯合胞內鈣能明顯下調LTA誘導的NETs形成
a. 使用BAPTA-AM(10 μmol/L)螯合中性粒細胞胞內Ca2+后,利用LTA誘導NETs形成的代表性熒光顯微圖;NET-DNA使用Sytox green(綠色)標記,細胞核形態使用Hoechst 33342(藍色)標記,比例尺:50 µm。b~c. BAPTA-AM螯合胞內鈣后的NETs相對熒光面積及相對熒光強度;數據進行One-way ANOVA 檢驗并使用多重比較計算統計學差異。**,
a. representative images of NET formation upon intracellular Ca2+ chelation of neutrophils with BAPTA-AM (10 μmol/L) and followed by LTA stimulation. NET-DNA were stained with Sytox green (green) and nuclei of neutrophils were labeled by Hoechst 33342 (blue). Scale bar was 50 µm. b-c. relative NETs coverage area and relative NETs fluorescent intensity from experiment of BAPTA-AM chelation. One-way ANOVA and multiple comparisons were applied to identify statistical significance. **,
結果表明,中性粒細胞用BAPTA-AM預處理后會造成NET-DNA信號下降,且視野中的大部分中性粒細胞均能保持其分葉核形態,僅少數中性粒細胞產生NETs(見圖2a)。與未經抑制劑處理的LTA刺激組(Ctrl組)相比,BAPTA-AM組的NETs相對熒光強度明顯下降,減少了(63.9 ± 11.1)%(P < 0.01);與DMSO組相比,BAPTA-AM處理組的NETs相對熒光面積及NETs相對熒光強度均明顯降低,分別減少(52.3±8.0)%(P < 0.01)和(63.9 ± 11.1)%(P < 0.01)(見圖2b~c)。DMSO組與Ctrl組之間相對熒光面積和相對熒光強度則無明顯差異,表明BAPTA-AM組NETs形成的下調并非由溶劑DMSO引起,而是因胞內鈣水平下調造成的。上述結果顯示,LTA誘導的NETs釋放過程需要Ca2+的參與。
2.3 LTA能引發中性粒細胞胞內鈣水平上升
為了探究LTA誘導下中性粒細胞胞內Ca2+水平的動態變化,本研究使用鈣離子熒光探針Flou-4 AM指示胞內Ca2+水平,結合活細胞成像技術實時觀察LTA誘導的中性粒細胞中鈣信號波動。PMA是研究NETs形成機制中使用最廣泛的強力化學誘導劑。研究表明,PMA會引發中性粒細胞胞內鈣離子發生短暫變化,并導致鈣離子濃度的逐步累積,直至細胞質膜發生破裂,最終造成NETs釋放[26]。因此,我們選擇PMA作為陽性對照組。在分別加入PMA及LTA后,中性粒細胞胞內Ca2+信號均急速上升,PMA組的胞內Ca2+信號相對熒光強度在刺激9 min左右達到峰值,隨后發生輕微下降并維持動態平衡;而LTA組胞內鈣相對熒光強度在刺激約19 min時達到峰值,隨后其相對熒光強度逐漸下降(見圖3a~b);PMA組及LTA組的曲線下面積(area under the curve,AUC)分別為Blank組的(3.32 ± 1.34)倍(P<0.01)和(2.46 ± 0.61)倍(P < 0.05)(見圖3c)。綜上所述,LTA能引發中性粒細胞胞內Ca2+水平的上升及NETs釋放。
 圖3
LTA引發中性粒細胞胞內鈣上升
圖3
LTA引發中性粒細胞胞內鈣上升
a. 使用Flou-4 AM(2 μmol/L)檢測PMA或LTA刺激后單個中性粒細胞在FITC 488 nm通道下的胞內Ca2+變化的活細胞成像圖;比例尺:5 µm。b~c. LTA刺激中性粒細胞過程中,胞內鈣信號相對熒光強度(FI
a. live-cell imaging of intracellular Ca2+ fluctuation of single neutrophil stimulated with LTA or PMA and detected by 2 μmol/L of Flou-4 AM (green) at FITC 488 nm channel. Scale bar, 5 µm. b-c. normalized intensity (FI
2.4 NAC抑制胞內ROS對LTA誘導的NETs釋放無影響
除鈣信號外,ROS也是參與NETs釋放過程中的關鍵分子之一。但有研究表明,中性粒細胞也可以通過不依賴于ROS的信號通路釋放NETs[27-28]。為探究ROS是否參與LTA誘導穩定黏附于ICAM-1分子層的中性粒細胞產生NETs,我們利用NAC預處理中性粒細胞,再考察LTA刺激下NETs形成的變化,以未經抑制劑處理的Ctrl組作為對照。NAC是谷胱甘肽(glutathione,GSH)的前體,能通過抑制ROS迸發,進而抑制PMA誘導的NETs形成[29]。結果顯示,NAC預處理對于LTA誘導中性粒細胞NETs形成未見明顯影響(見圖4a);NAC組的NETs相對熒光面積及相對熒光強度與Ctrl組之間的差異均無統計學意義(見圖4b~c),表明ROS不參與LTA誘導的穩定黏附于ICAM-1分子層上的中性粒細胞NETs釋放。
 圖4
NAC抑制ROS不影響LTA誘導的NETs釋放
圖4
NAC抑制ROS不影響LTA誘導的NETs釋放
a. 經NAC(10 mmol/L)預處理的中性粒細胞在LTA刺激下形成NETs的代表性熒光顯微圖;NET-DNA使用Sytox green(綠色)標記,細胞核形態使用Hoechst 33342(藍色)標記,比例尺:50 µm。b~c. 使用NAC抑制ROS后,各組的NETs相對熒光面積及相對熒光強度。數據進行雙尾Student’s
a. representative images of NETs formation of neutrophils incubated with NAC (10 mmol/L) induced by LTA. NET-DNA were stained with Sytox green (green) and nuclei of neutrophils were labeled by Hoechst 33342 (blue). Scale bar, 50 µm. b-c. relative NETs coverage area and relative NETs fluorescent intensity from experiment of ROS inhibited by NAC. Two-tailed Student’s
2.5 LTA刺激無法引發中性粒細胞胞內ROS生成
上述結果顯示,清除胞內ROS不影響LTA誘導的中性粒細胞NETs形成。進一步地,我們利用ROS熒光探針CellROX orange結合多功能酶標儀來探測LTA刺激下中性粒細胞的胞內ROS動態變化。PMA可以刺激中性粒細胞引發ROS生成,作為陽性對照。使用PMA刺激中性粒細胞后,10 min內觀察到CellROX orange信號的上升;而LTA組與未加刺激劑的空白對照組(Blank)的ROS水平在30 min內均保持在較低水平(見圖5 a);與Blank組相比,PMA組ROS相對熒光強度AUC明顯上升(P < 0.05),而LTA組與Blank組之間的差異無統計學意義。上述實驗表明,LTA無法誘導中性粒細胞胞內ROS生成。
 圖5
LTA無法引發中性粒細胞胞內ROS迸發
圖5
LTA無法引發中性粒細胞胞內ROS迸發
a. 利用CellROX orange(1 μmol/L)檢測LTA刺激30 min內中性粒細胞胞內ROS相對熒光強度(FI
a. normalized fluorescent intensity (FI
3 討論
在大部分膿毒癥病例中,很難檢測分離到特定致病微生物,這提示細菌的成分可能是造成膿毒癥的主要原因[30-31]。本研究使用來自S. aureus的LTA模擬革蘭氏陽性菌引發的膿毒癥病理場景,并探究在這一病理環境下,內皮細胞高表達的ICAM-1與中性粒細胞相互作用導致的NETs形成過程。本研究顯示,在LTA作用下,ICAM-1與中性粒細胞相互作用導致的NETs釋放具有時間依賴性,刺激4 h時才能明顯產生NETs,這與S. aureus誘導的快速NETs釋放僅需10 min即可發生有所區別[32]。這也提示,S. aureus的其他成分也參與誘導NETs的形成,尤其是快速NETs的形成。
Ca2+在NETs形成中的重要作用最早見于PMA誘導的NETs釋放。de Bont等[26]報道,PMA刺激使中性粒細胞胞漿Ca2+濃度逐漸升高,直至細胞質膜破裂。本研究表明,在對中性粒細胞施加LTA刺激后,胞內Ca2+水平發生迅速上升,與PMA刺激中性粒細胞表現相似;利用BAPTA-AM螯合胞內鈣后,中性粒細胞在LTA刺激下釋放的NETs明顯下調,說明LTA刺激下的NETs形成同樣需要Ca2+的參與。
作為NETs形成的關鍵事件之一,ROS迸發參與NETs形成已得到廣泛報道。有研究認為,LTA可引發中性粒細胞的ROS釋放,以協同增強對細胞的破壞程度[31]。我們的研究發現,使用NAC抑制ROS后,LTA誘導的NETs形成并未明顯減少;用CellROX orange探針檢測LTA刺激30 min的胞內ROS信號變化實驗表明,LTA刺激無法引發中性粒細胞內大量ROS迸發,這與Lee等[33]用流式細胞術檢測到LTA能明顯引發懸浮中性粒細胞ROS水平升高不同;而與Pilsczek等[34]報道用S. aureus刺激中性粒細胞產生NETs的過程不需要ROS參與相一致。造成這一結果的原因可能與ICAM-1與中性粒細胞相互作用的信號通路改變了單純由LTA誘導NETs形成的信號通路有關。
4 總結
在由S. aureus引發的膿毒癥病程后期,血管內大量彌散性血栓的形成是造成膿毒癥患者死亡的重要原因。本研究利用來自黃金葡萄球菌的LTA模擬S. aureus感染造成的膿毒癥病理場景,探究了內皮細胞表面分子ICAM-1與中性粒細胞相互作用下,LTA誘導NETs釋放的過程;同時,通過抑制實驗和對中性粒細胞胞內Ca2+和ROS動態變化的觀察,闡述了LTA誘導的NETs形成是一個依賴于Ca2+而不依賴ROS的過程。基于上述實驗結果,本研究有利于加深對由S. aureus感染造成的膿毒癥病理條件下,血管中NETs形成過程及其機制的認識,為膿毒癥治療干預以及相關新藥物的開發提供了理論參考。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:黃嘉祺負責實驗操作、數據記錄分析、論文撰寫;方金花與吳芝偉負責實驗設計、數據分析、論文審閱修訂;吳建華提供平臺支持和論文指導;方穎與林蔣國負責研究選題指導、實驗安排、論文審閱修訂。
倫理聲明:本研究通過了廣東省人民醫院倫理委員會的審批(批文編號:KY2020-051-02)。