引用本文: 李明鵬, 張凌, 楊瑩瑩, 唐雪, 王芳, 李旭, 陳德政. 不同濾過分數計算公式對連續性腎臟替代治療體外循環壽命的影響. 華西醫學, 2024, 39(7): 1088-1095. doi: 10.7507/1002-0179.202306164 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
連續性腎臟替代治療(continuous renal replacement therapy, CRRT)已被廣泛應用于急性腎損傷(acute kidney injury, AKI)、終末期腎衰竭、全身炎癥反應綜合征、急性呼吸窘迫綜合征、重癥胰腺炎、橫紋肌溶解等疾病中[1],治療模式主要包括連續性靜脈-靜脈血液濾過(continuous veno-venous hemofiltration, CVVH)、連續性靜脈-靜脈血液透析(continuous veno-venous hemodialysis, CVVHD)、連續性靜脈-靜脈血液透析濾過(continuous veno-venous hemodiafiltration, CVVHDF)等。然而,CRRT 治療的有效性取決于接受治療的時間,體外循環過早凝血可減少溶質清除和超濾,降低 CRRT 療效,安全有效的抗凝方式是避免體外循環過早凝血的重要措施,是 CRRT 能夠順利完成的關鍵。局部枸櫞酸抗凝(regional citrate anticoagulation, RCA)已在 CRRT 中廣泛使用,2012 年改善全球腎臟病預后組織(Kidney Disease: Improving Global Outcomes, KDIGO)關于 AKI 的臨床指南推薦接受 CRRT 治療的 AKI 患者只要不存在使用枸櫞酸鈉的禁忌證,應優先選擇 RCA,而不是肝素抗凝[2]。
除抗凝方式外,影響 CRRT 體外循環壽命的其他因素也廣受關注,濾過分數(filtration fraction, FF)便是其中一項重要因素[3]。在相同治療劑量下,CVVHDF 與 CVVHD 的 FF 明顯低于 CVVH,因此,我國《連續性腎臟替代治療的抗凝管理指南》指出,采用 RCA 時,建議采用 CVVHDF 或者 CVVHD 的治療模式,若采用 CVVH 治療模式,應控制 FF 在 25%~30%[4]。目前,對于 FF 的計算,國際上通用有 2 種公式[5-6],在臨床工作中,哪種公式計算出的 FF 與體外循環壽命有更好的相關性尚無相關報道。因此,本研究分析了四川大學華西醫院 2022 年 6 月—2023 年 4 月收治的采用 RCA 行 CRRT 的 AKI 患者,給予不同腎臟替代治療模式,通過分析不同的 FF 計算公式對體外循環壽命的影響,以指導今后基于 RCA 行 CRRT 的參數設置。
1 對象與方法
1.1 研究對象
選擇 2022 年 6 月—2023 年 4 月在四川大學華西醫院接受 CRRT 治療,并以枸櫞酸鈉抗凝的患者。納入標準:① 接受 CRRT 治療的 AKI 患者,AKI 診斷標準參照 2012 年全球腎臟病預后組織(Kidney Disease: Improving Global Outcomes, KDIGO)AKI 臨床實踐指南[2],CRRT 指征參照 RENAL 試驗[7];② 預計 CRRT 時間>24 h;③ 患者或家屬同意參與并簽署知情同意書。排除標準:① 有枸櫞酸鈉過敏史;② 在 CRRT 前 3 d 內接受其他治療性或預防性抗凝;③ 血清總膽紅素>60 μmol/L,乳酸水平>4 mmol/L;④ 同時接受血漿置換、血液吸附等其他血液凈化治療模式;⑤ 孕產婦。退出標準:① 在研究過程中使用全身抗凝劑;② 研究過程中患者或家屬要求退出此項研究;③ 因轉科、手術、出院等導致體外循環未凝血也未滿 72 h 而下機。
本研究方案經四川大學華西醫院生物醫學倫理審查委員會批準[2022 年審(554)號],并在中國臨床試驗注冊中心進行臨床試驗注冊,注冊號:ChiCTR2200061065。
樣本量計算:按照完全隨機設計多樣本均數比較的樣本量估算公式估計樣本量,采用95% 置信區間(雙側檢驗水準α=0.025)作為判斷等效的允許變異范圍,該試驗的把握度(1–β)為 80% (β=0.2),估算公式為 。n 為各組樣本所需的例數,σi為各組的總體標準差,μi 為各組總體均數,
。n 為各組樣本所需的例數,σi為各組的總體標準差,μi 為各組總體均數, ,k 為所比較的樣本組數,ψ 值是由α、β、vi= k ? 1、v2 = ∞ 查ψ 值表。結合既往文獻報道,枸櫞酸抗凝在CVVH、CVVHDF、CVVHD治療中體外循環壽命分別為(63.5±27.1)、(55.1±21.8)、(45.6±25.6)h[8-10],計算需最小樣本量約為39例。結果表明,每組需至少納入39例。考慮失訪率為15% ,則每組應納入45.8例。故本研究擬每組納入46例患者,共計138例。
,k 為所比較的樣本組數,ψ 值是由α、β、vi= k ? 1、v2 = ∞ 查ψ 值表。結合既往文獻報道,枸櫞酸抗凝在CVVH、CVVHDF、CVVHD治療中體外循環壽命分別為(63.5±27.1)、(55.1±21.8)、(45.6±25.6)h[8-10],計算需最小樣本量約為39例。結果表明,每組需至少納入39例。考慮失訪率為15% ,則每組應納入45.8例。故本研究擬每組納入46例患者,共計138例。
1.2 研究方法
1.2.1 分組
按照計算機中心隨機方案,根據 CRRT 模式不同將納入患者隨機分為 CVVH 組、CVVHD 組和 CVVHDF 組。隨機化是基于計算機 Excel 隨機數字表程序,由不參與患者治療的工作人員進行。
1.2.2 CRRT 處方設置
3 組患者均使用百特 Prismaflex 機器(濾器膜面積 1.5 m2,型號:AN69-ST150 膜中空纖維過濾器)進行 CRRT 治療。采用股靜脈或頸內靜脈留置透析導管建立血管通路,使用商品化含鈣血液濾過置換基礎液(鈣離子濃度 1.5 mmol/L)(成都青山利康藥業有限公司)。在實施 CRRT 治療之前,配制普通肝素 50 mg+生理鹽水 1 000 mL 對體外循環濾器和管路進行預沖,讓設備充分肝素化之后,再取生理鹽水 500 mL 對管路進行沖洗。CRRT 治療劑量為 20~35 mL/(kg·h),CVVHD 組均為透析液;CVVH 組采用前后置換模式(前置換液∶后置換液流速為 1∶1);CVVHDF 組采用后置換模式(置換液∶透析液為 1∶1)。3 組起始血流速度均為 150 mL/min,4%抗凝血用枸櫞酸鈉溶液按照 200 mL/h 的速度自管路動脈端泵入。在沒有凝血的情況下,按照制造商的建議,在 72 h 常規更換濾器管路。在 CRRT 過程中,使用微量泵在濾器后按照每 2 000 mL 血液濾過置換基礎液泵入 30 mL 5%碳酸氫鈉注射液。在 CRRT 開始前及開始 2、6 h 及之后每 6 小時采集濾器前及濾器后血液進行血氣分析,并根據酸堿情況調整 5%碳酸氫鈉用量,以糾正代謝性酸中毒或堿中毒。根據游離鈣離子濃度,調整枸櫞酸鈉輸注速率,確保濾器后游離鈣離子濃度維持在 0.25~0.35 mmol/L,濾器前游離鈣離子濃度維持在 1.0~1.1 mmol/L。
1.2.3 觀察指標
在 CRRT 開始前收集人口統計學數據,包括患者年齡、性別、身高、體重、AKI 分期、AKI 病因、血管通路部位、機械通氣、序貫器官衰竭評分(Sequential Organ Failure Assessment, SOFA)。收集每套體外循環壽命及體外循環凝血的原因,CRRT 開始時血清尿素、肌酐、血紅蛋白、血小板計數、紅細胞壓積(hematocrit, HCT)、凝血酶原時間、活化部分凝血活酶時間、D-二聚體、游離鈣離子濃度和總膽紅素水平。收集 CRRT 開始時血流速率、4%枸櫞酸鈉溶液速率、置換液流量、透析液流量、超濾率,并用不同公式分別計算 FF[5-6]。
公式 1:FF=(后置換液量+脫水量)/[血流速(mL/min)×(1?HCT)×60]
公式 2:FF=(前置換液量+后置換液量+脫水量)/[血流速(mL/min)×(1?HCT)×60+前置換液量]
1.2.4 體外循環壽命計算方法
體外循環壽命指使用同一套體外循環期間,從體外血液循環開始,到因凝血或治療時間達到 72 h 而更換濾器管路的時間。體外循環凝血分為濾器凝血及靜脈壺凝血。跨膜壓≥200 mm Hg(1 mm Hg=0.133 kPa)或濾器壓降≥150 mm Hg 時被定義為“濾器凝血”。
1.3 數據篩選
嚴格按照納排標準篩選入組患者,對登記數據進行雙人錄入,校對后剔除基本信息或觀察指標測量缺失的患者。
1.4 質量控制
所有數據均由臨床經驗豐富的 CRRT 專科醫師及護士記錄。對臨床測量登記數據進行雙錄入,避免錯漏。數據錄入完畢后統一交由第三人進行統計分析。
1.5 統計學方法
采用 SPSS 23.0 軟件進行數據分析。符合正態分布的計量資料采用均數±標準差表示,反之采用中位數(下四分位數,上四分位數)表示。對于正態分布且方差齊的資料,采用單因素方差分析,若 3 組間存在統計學差異,再使用 SNK-q 檢驗進行組間兩兩比較;對于非正態分布或(和)方差不齊的資料,進行變量轉換后采用 Kruskal-Wallis H 檢驗。計數資料采用例數和百分比表示,二分類變量組間比較采用χ2 檢驗或 Fisher 確切概率法,有序分類變量組間比較采用 Mann-Whitney 秩和檢驗。采用 Kaplan-Meier 生存曲線,對 3 組體外循環壽命進行分析。以 2 種計算公式得出的 FF 值為檢驗變量,是否達到體外循環壽命最長組的中位壽命為狀態變量,通過 GraphPadPrism(9.4.1 版)繪制受試者操作特征(receiver operating characteristic, ROC)曲線,計算曲線下面積(area under the curve, AUC)和 95%置信區間(confidence interval, CI)。雙側檢驗水準α=0.05。
2 結果
2.1 3 組患者治療前基線資料比較
共篩選需要 CRRT 治療的患者 1 158 例,其中有 626 例預計治療時間<24 h,預計治療時間>24 h 的患者中有 86 例為非 AKI,余下 446 例中有 307 例因存在一項及以上排除標準被排除,剩余 139 例患者被納入本研究,隨機分配到 CVVH 組(47 例)、CVVHD 組(46 例)和 CVVHDF 組(46 例)。共退出研究 18 例。其中,CVVH 組 7 例(3 例在 CRRT 期間因轉科而非計劃下機,4 例接受治療性全身抗凝),CVVHD 組 6 例(3 例因自動出院而停止 CRRT,1 例在 CRRT 期間因轉科而下機,2 例接受治療性全身抗凝),CVVHDF 組 5 例(1 例因自動出院而停止 CRRT,2 例在 CRRT 期間因轉科而下機,2 例接受治療性全身抗凝)。
最終完成研究患者 121 例,其中 CVVH 組 40 例(33.1%)、CVVHD 組 40 例(33.1%)、CVVHDF 組 41 例(33.8%),無 AKI 1 期患者。3 組患者 CRRT 前基線資料比較見表1。可見,3組患者的基線資料比較,差異均無統計學意義(P>0.05)。
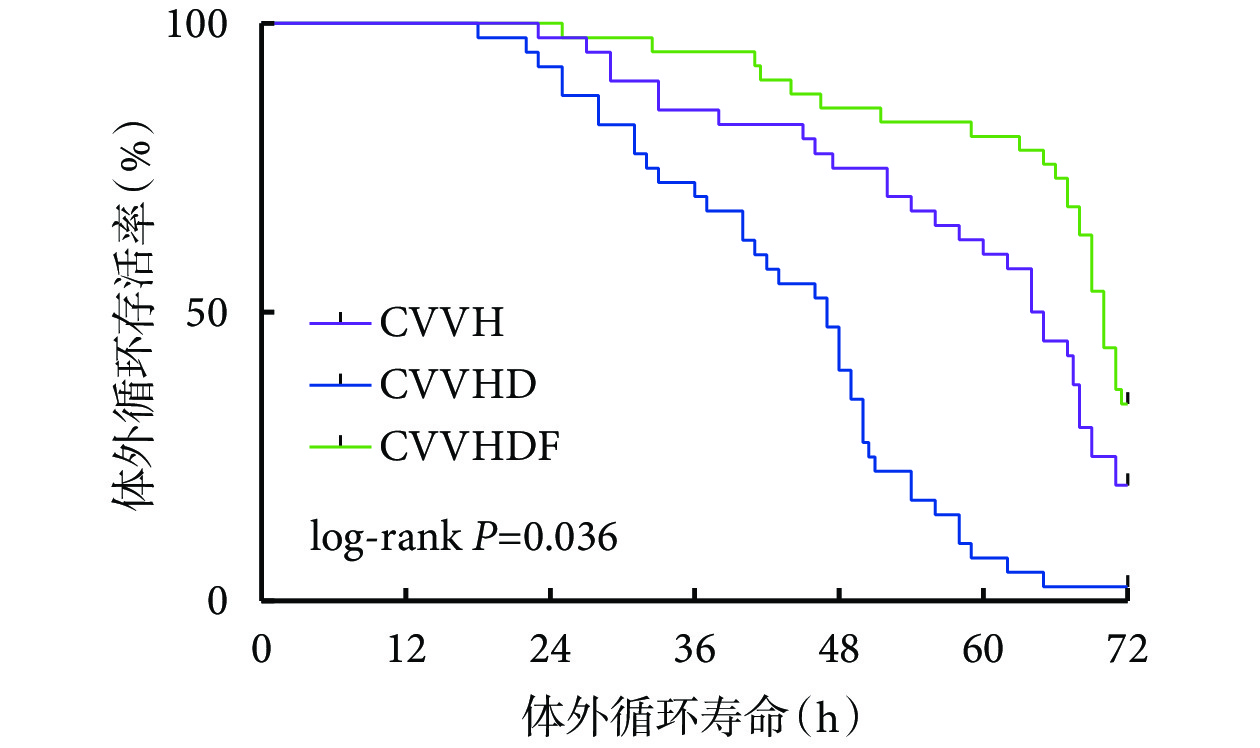
2.2 3 組患者體外循環壽命比較
所有患者體外循環壽命為 60(44.5,70)h。其中,CVVH 組為 64(46,71)h,CVVHD 組為 47(31.5,54)h,CVVHDF 組為 70(65,72)h。在 12、24、36、48、60、72 h,CVVH 組體外循環存活 40、39、34、31、25、10 例,CVVHD 組體外循環存活 40、37、29、19、3、1 例、CVVHDF 組體外循環存活 41、41、39、36、33、16 例。3 組患者 CRRT 體外循環壽命 Kaplan-Meier 曲線見圖1。可見,3 組間體外循環壽命比較,差異有統計學意義(log-rank P=0.036)。其中,CVVH 組和 CVVHD 組(χ2=18.428,P<0.001)、CVVHD 組和 CVVHDF 組(χ2=40.838,P<0.001)、CVVH 組和 CVVHDF 組(χ2=5.155,P=0.023)間體外循環壽命差異均有統計學意義。
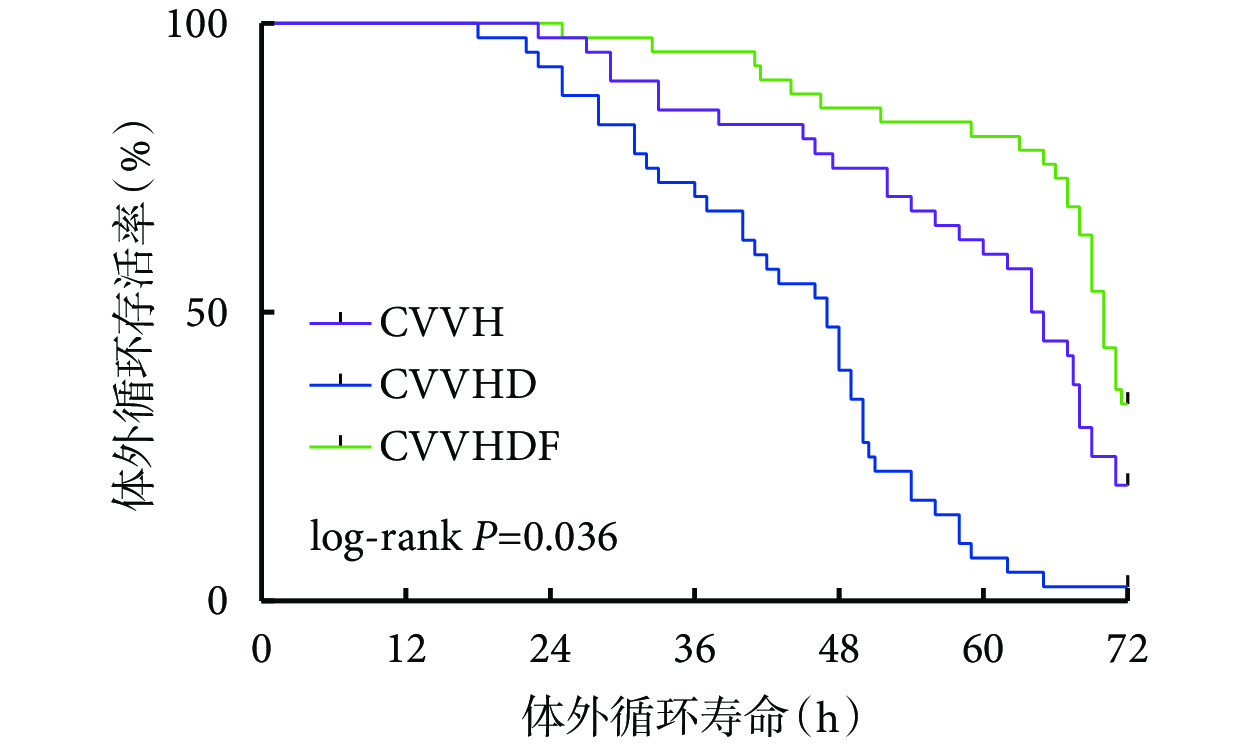 圖1
3 組患者 CRRT 體外循環壽命 Kaplan-Meier 曲線
圖1
3 組患者 CRRT 體外循環壽命 Kaplan-Meier 曲線
CVVH:連續性靜脈-靜脈血液濾過;CVVHD:連續性靜脈-靜脈血液透析;CVVHDF:連續性靜脈-靜脈血液透析濾過
2.3 3 組患者體外循環未使用至 72 h 而更換的原因
在 CRRT 過程中,因體外循環未使用至 72 h 出現濾器或靜脈壺凝血而更換濾器管路共計 94 例(77.7%),其中 CVVH 組 30 例、CVVHD 組 39 例、CVVHDF 組 25 例;3 組發生體外循環凝血比較,差異有統計學意義(χ2=15.83,P<0.001)。其中,CVVHD 組與 CVVH 組(χ2=8.538,P=0.007)、CVVHD 組與 CVVHDF 組(χ2=16.288,P<0.001)比較,差異均有統計學意義;但 CVVH 組與 CVVHDF 組比較,差異無統計學意義(χ2=1.827,P=0.235)。
在 94 例體外循環凝血的患者中,23 例(24.5%)為靜脈壺凝血導致 CRRT 終止,其中 CVVH 組 2 例、CVVHD 組 20 例、CVVHDF 組 1 例;3 組靜脈壺凝血比較,差異有統計學意義(χ2=37.366,P<0.001)。其中,CVVHD 組與 CVVH 組(χ2=20.313,P<0.001)、CVVHD 組與 CVVHDF 組(χ2=23.848,P<0.001)比較,差異均有統計學意義;但 CVVH 組與 CVVHDF 組比較(χ2=0.372,P=0.616),差異無統計學意義。
2.4 3 組患者 FF 比較
2.4.1 2 種公式計算 3 組患者 FF 比較
2 種公式計算 3 組患者 FF 比較見表2。可見,根據公式 1 計算,CVVH 組、CVVHD 組及 CVVHDF 組 FF 比較,差異有統計學意義(H=69.402,P<0.001)。組間兩兩比較顯示,CVVH 組和 CVVHD 組(H=54.084,P<0.001)、CVVHD 組和 CVVHDF 組(H=56.914,P<0.001)比較,差異均有統計學意義;但 CVVH 組和 CVVHDF 組(H=2.830,P=0.700)比較,差異無統計學意義。
根據公式 2 計算,CVVH 組、CVVHD 組及 CVVHDF 組 FF 比較,差異有統計學意義(H=97.962,P<0.001)。組間比較顯示,CVVH 組和 CVVHD 組(H=36.565,P<0.001)、CVVHD 組和 CVVHDF 組(H=75.765,P<0.001)、CVVH 組和 CVVHDF 組(H=39.200,P<0.001)比較,差異均有統計學意義。在 CVVH、CVVHD 及 CVVHDF3 種模式下,公式 2 計算的 FF 均高于公式 1,差異均有統計學意義(Z=?7.502、?6.501、?5.495,P<0.001)。
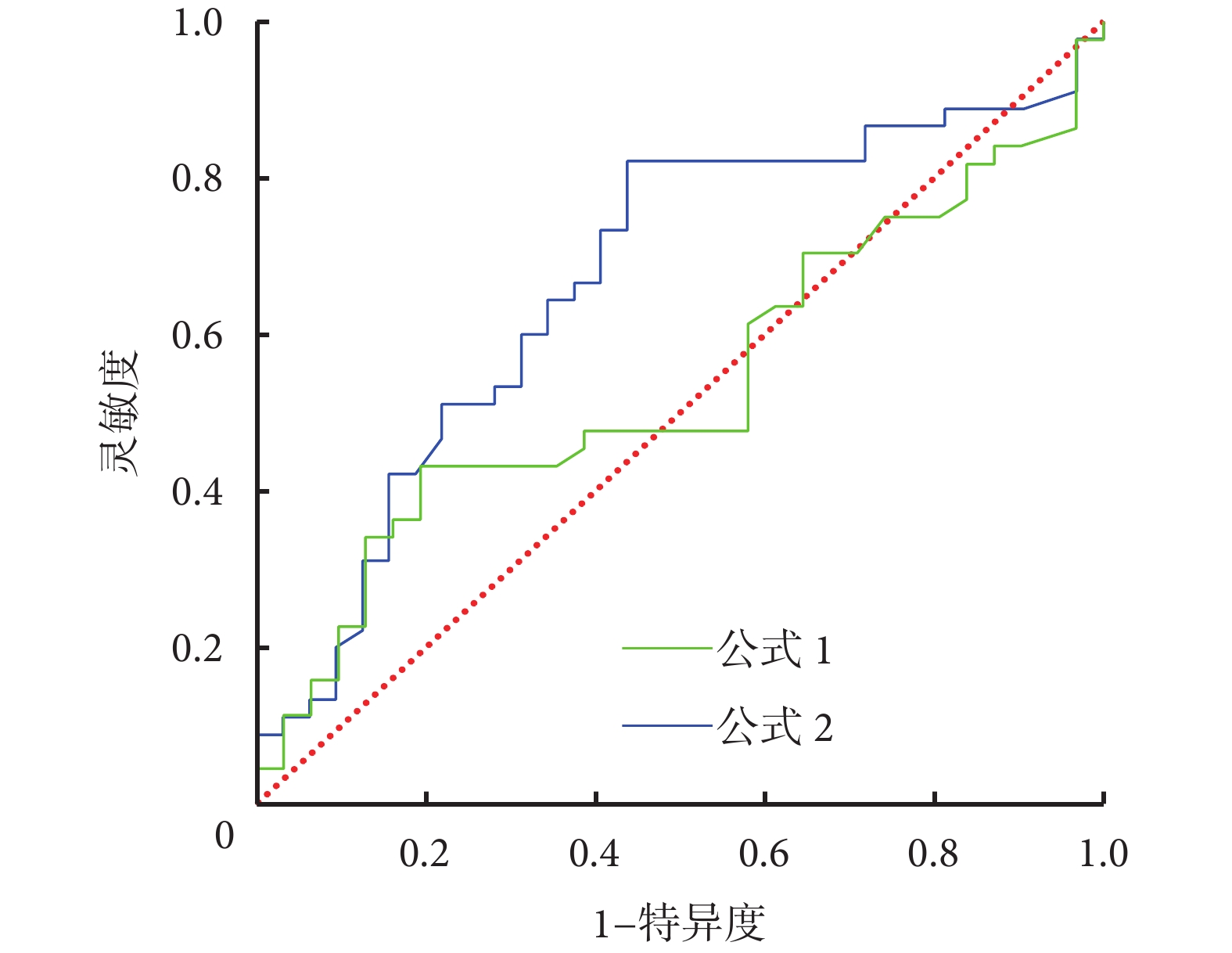
2.4.2 FF 對體外循環壽命影響的 ROC 曲線
因 CVVHDF 組患者體外循環壽命最長,以 CVVHDF 組中位體外循環壽命 70 h 為標準,將 CVVH 組和 CVVHDF 組共 81 例患者,按照體外循環壽命是否達到 70 h 分為 2 種狀態,繪制兩種 FF 計算公式得出的 FF 值對體外循環壽命影響的 ROC 曲線,見圖2。不同公式計算的 FF 對 CRRT 體外循環壽命影響的 ROC 曲線分析見表3。可見,與公式 1[AUC=0.539,95%CI(0.408,0.670),P=0.565]比較,公式 2[AUC=0.668,95%CI(0.543,0.792),P=0.013]得出的 FF 對體外循環壽命影響更大、靈敏度高,但特異度較低。
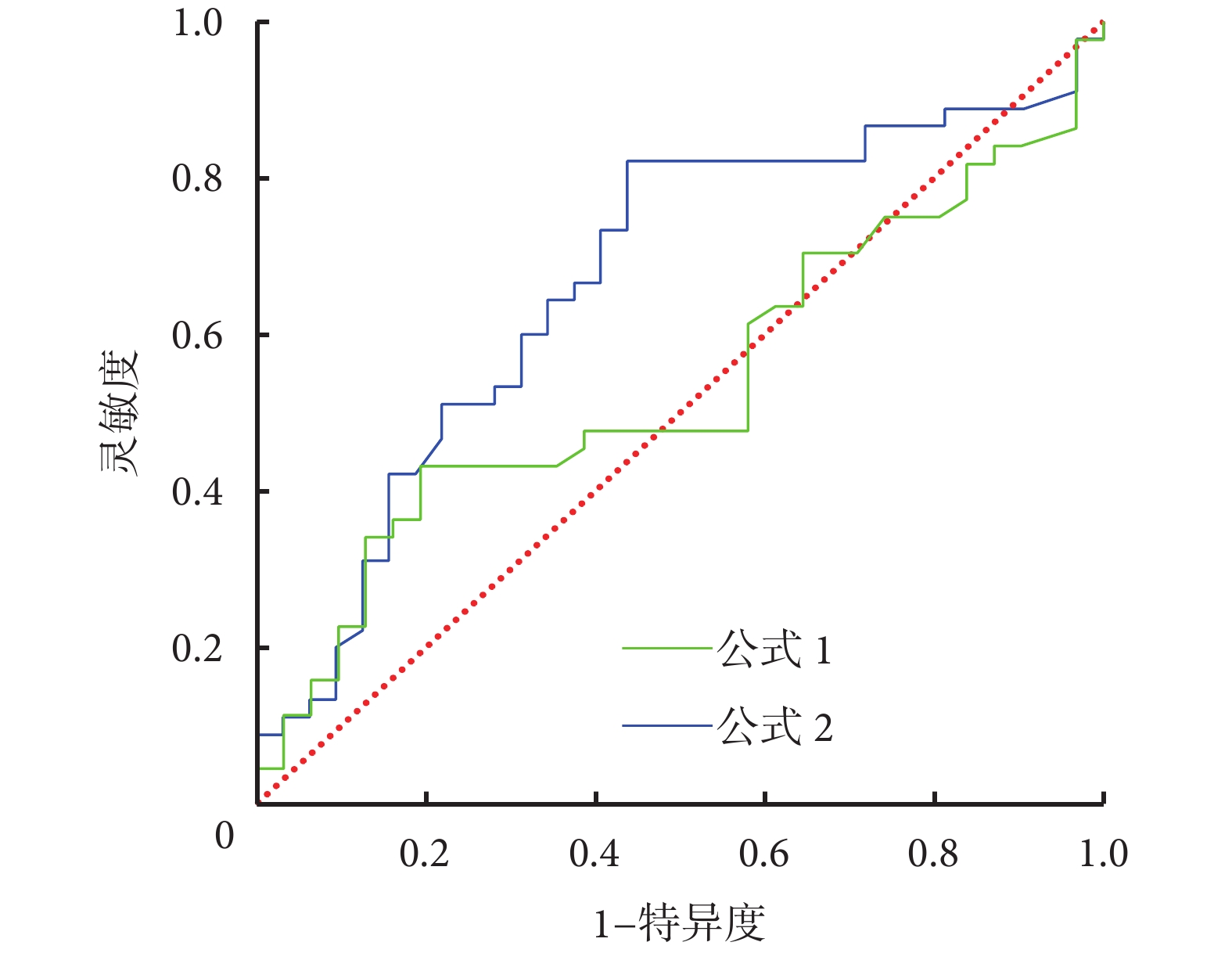 圖2
不同公式計算的 FF 對 CRRT 體外循環壽命影響的 ROC 曲線分析
圖2
不同公式計算的 FF 對 CRRT 體外循環壽命影響的 ROC 曲線分析
FF:濾過分數;CRRT:連續性腎臟替代治療;ROC:受試者操作特征
3 討論
本研究觀察了在 3 種 CRRT 模式下,采用 RCA,分析了不同 CRRT 模式下的體外循環壽命,同時分析了 2 種 FF 計算公式對 CRRT 體外循環壽命的影響。本研究結果顯示,在使用 Prismaflex 機型進行 CRRT 時,CVVHDF 體外循環壽命最長,達到 70(65,72)h,CVVH 次之,CVVHD 最短。在 CVVHDF 與 CVVH 模式下濾器使用至 72 h 比例比較,差異無統計學意義(P>0.05)。分別采用 2 種公式計算 3 組患者 FF ,發現通過公式 1 計算的 FF,CVVHDF 組和 CVVH 組比較差異無統計學意義(P>0.05);而通過公式 2 計算的 FF,CVVHDF 組和 CVVH 組比較,差異有統計學意義(P>0.05)。
CRRT 體外循環正常使用是保障 CRRT 順利進行的前提,不同 CRRT 模式下體外循環壽命不一致。Zarbock 等[11]研究發現,CVVHD 體外循環壽命最長[CVVHD 與 CVVH 平均差 4.68 h,95%CI(5.71,23.65)h,P=0 .001;CVVHD 與 CVVHDF 平均差 5.14 h,95%CI(0.23,10.05)h,P=0.04],其次是 CVVHDF,體外循環壽命最短為 CVVH。還有研究報道,CVVHD 期間的平均體外循環壽命明顯長于 CVVH[12-13]。上述研究均提示,在相同治療劑量條件下,CVVHD 的 FF 最小,而 CVVH 的 FF 最大。而 FF 與 CRRT 體外循環壽命有很強的相關性,FF 越高,當血液流經濾器時,濃縮更明顯,導致濾器跨膜壓增高,因此更易凝血[14]。MacEwen 等[5]研究發現,FF 每增加 1%,濾器凝血的風險就會增加 7%,FF 降低 3%,對濾器壽命的影響與活化部分凝血活酶增加 10 s 相同,而沒有伴隨出血風險。由此,2012 年 KDIGO-AKI 指南及 2016 年國際急性疾病質量倡議協會制定的 CRRT 專家共識建議將 FF 控制在 25%~30%[2,15]。
如上所述,FF 越高,體外循環壽命相對更短,已成為 CRRT 領域公認的話題。雖然 CVVHD 模式下濾過分數最低,CVVHDF 及 CVVH 模式 FF 均高于 CVVHD,但本研究發現,在 3 種 CRRT 模式中,CVVHD 體外循環壽命最短,CVVHDF 體外循環壽命最長。進一步對體外循環凝血原因分析顯示,由于在 CVVHD 模式下,靜脈壺無液體沖刷,因此發生靜脈壺凝血的比例較 CVVHDF 及 CVVH 模式明顯更高。因此,單純通過 FF 來預測體外循環壽命還需要進一步驗證。
FF 是超濾率和血漿流量的比值,對于其計算,2 種計算公式的區別在于是否將前置換納入總超濾量及血漿流量中,目前多數專家建議在分子和分母中同時加入前置換液量[6,16]。不論通過哪種計算公式,在血流量和凈超濾相同的情況下,等量后置換的 FF 高于前置換,研究證實增加前置換液量能降低濾器凝血的風險[17-18]。但是,本研究結果顯示,不論采用哪種 CRRT 模式,由公式 2 計算出的 FF 均高于公式 1(P<0.001)。不論是公式 1 還是公式 2,CVVHD 和 CVVHDF 模式下的 FF 中位數均<25%,達到目前指南要求的控制范圍。但是在 1∶1 前后置換的 CVVH 模式中,采用公式 1 計算出的 FF 為 15.8%(15.2%,17.0%),達到 25%的控制目標,且與同治療劑量透析液∶置換液為 1∶1 的 CVVHDF 模式的 FF 無統計學差異(P=0.700);而采用公式 2 計算出 CVVH 的 FF 則達到 33.1%(32.4%,35.7%),超過了同治療劑量 CVVHDF 模式的 FF(P<0.001)。
目前,用 FF 預測 CRRT 濾器凝血風險還無強有力證據[16,19]。因此,本研究將 CVVH 組和 CVVHDF 組共 81 例患者,根據體外循環壽命是否達到 CVVHDF 組中位體外循環壽命 70 h 分為 2 種狀態,繪制 2 種公式得出的 FF 值對體外循環壽命影響的 ROC 曲線,發現公式 2 得出的 FF 對體外循環壽命影響的 ROC 曲線 AUC 大于公式 1,且特異度也明顯更高,提示公示 2 得出的 FF 對體外循環壽命的預測比公式 1 更有價值。本研究結果也發現,CVVHDF 組體外循環壽命長于 CVVH 組[70(65,72) vs. 64(46,71)h,P=0.014]。根據公式 2 計算 FF,1∶1 前后置換的 CVVH 模式的 FF 超過 30%,理論上體外循環壽命應該偏短,但在本研究中,該組患者體外循環壽命仍達到 64(46,71)h,雖然比同劑量的 CVVHDF 模式體外循環壽命短,但超過了多項研究報道的 RCA-CRRT 體外循環壽命[9,20-22],且與 CVVHDF 組患者濾器使用至 72 h 比較,差異無統計學意義(P=0.235)。因此,單純將 FF 作為 CRRT 濾器凝血風險分層的指標尚有局限性,特別是對于本研究所采取的前后置換的 RCA-CVVH 模式。
綜上所述,雖然 CVVHD 模式 FF 最低,但其體外循環壽命比 CVVH 和 CVVHDF 模式更短,主要由于靜脈壺無液體沖刷,導致靜脈壺凝血所致。不論對于哪種 CRRT 模式,2 種公式計算出的 FF 間均有統計學差異,特別對于 1∶1 前后置換的 CVVH 模式,采用公式 2 計算的 FF 明顯大于同等治療劑量的 CVVHDF 模式,而實則此 2 種模式間濾器使用至 72 h 比較,差異無統計學意義。公式 2 計算的 FF 預測 CRRT 體外循環壽命靈敏度更高,但特異度更低,因此,單純使用 FF 作為 CRRT 體外循環凝血風險評估尚有局限性,特別是對于前后置換的 CVVH 模式。但本研究存在一些局限性:首先,研究樣本量有限,僅納入 121 例患者,且每例患者僅納入 1 套濾器觀察;其次,本研究患者全部為 RCA,而在其他全身抗凝或者無抗凝下是否有類似結果尚不明確;第三,本研究選擇的 CRRT 機型均為 Prismaflex,而每種 CRRT 機具有自身特點。因此,還需要大樣本、多中心隨機對照試驗來進一步證實哪種 FF 計算公式更有利于評估 CRRT 體外循環凝血風險。
利益沖突:所有作者聲明不存在利益沖突。
連續性腎臟替代治療(continuous renal replacement therapy, CRRT)已被廣泛應用于急性腎損傷(acute kidney injury, AKI)、終末期腎衰竭、全身炎癥反應綜合征、急性呼吸窘迫綜合征、重癥胰腺炎、橫紋肌溶解等疾病中[1],治療模式主要包括連續性靜脈-靜脈血液濾過(continuous veno-venous hemofiltration, CVVH)、連續性靜脈-靜脈血液透析(continuous veno-venous hemodialysis, CVVHD)、連續性靜脈-靜脈血液透析濾過(continuous veno-venous hemodiafiltration, CVVHDF)等。然而,CRRT 治療的有效性取決于接受治療的時間,體外循環過早凝血可減少溶質清除和超濾,降低 CRRT 療效,安全有效的抗凝方式是避免體外循環過早凝血的重要措施,是 CRRT 能夠順利完成的關鍵。局部枸櫞酸抗凝(regional citrate anticoagulation, RCA)已在 CRRT 中廣泛使用,2012 年改善全球腎臟病預后組織(Kidney Disease: Improving Global Outcomes, KDIGO)關于 AKI 的臨床指南推薦接受 CRRT 治療的 AKI 患者只要不存在使用枸櫞酸鈉的禁忌證,應優先選擇 RCA,而不是肝素抗凝[2]。
除抗凝方式外,影響 CRRT 體外循環壽命的其他因素也廣受關注,濾過分數(filtration fraction, FF)便是其中一項重要因素[3]。在相同治療劑量下,CVVHDF 與 CVVHD 的 FF 明顯低于 CVVH,因此,我國《連續性腎臟替代治療的抗凝管理指南》指出,采用 RCA 時,建議采用 CVVHDF 或者 CVVHD 的治療模式,若采用 CVVH 治療模式,應控制 FF 在 25%~30%[4]。目前,對于 FF 的計算,國際上通用有 2 種公式[5-6],在臨床工作中,哪種公式計算出的 FF 與體外循環壽命有更好的相關性尚無相關報道。因此,本研究分析了四川大學華西醫院 2022 年 6 月—2023 年 4 月收治的采用 RCA 行 CRRT 的 AKI 患者,給予不同腎臟替代治療模式,通過分析不同的 FF 計算公式對體外循環壽命的影響,以指導今后基于 RCA 行 CRRT 的參數設置。
1 對象與方法
1.1 研究對象
選擇 2022 年 6 月—2023 年 4 月在四川大學華西醫院接受 CRRT 治療,并以枸櫞酸鈉抗凝的患者。納入標準:① 接受 CRRT 治療的 AKI 患者,AKI 診斷標準參照 2012 年全球腎臟病預后組織(Kidney Disease: Improving Global Outcomes, KDIGO)AKI 臨床實踐指南[2],CRRT 指征參照 RENAL 試驗[7];② 預計 CRRT 時間>24 h;③ 患者或家屬同意參與并簽署知情同意書。排除標準:① 有枸櫞酸鈉過敏史;② 在 CRRT 前 3 d 內接受其他治療性或預防性抗凝;③ 血清總膽紅素>60 μmol/L,乳酸水平>4 mmol/L;④ 同時接受血漿置換、血液吸附等其他血液凈化治療模式;⑤ 孕產婦。退出標準:① 在研究過程中使用全身抗凝劑;② 研究過程中患者或家屬要求退出此項研究;③ 因轉科、手術、出院等導致體外循環未凝血也未滿 72 h 而下機。
本研究方案經四川大學華西醫院生物醫學倫理審查委員會批準[2022 年審(554)號],并在中國臨床試驗注冊中心進行臨床試驗注冊,注冊號:ChiCTR2200061065。
樣本量計算:按照完全隨機設計多樣本均數比較的樣本量估算公式估計樣本量,采用95% 置信區間(雙側檢驗水準α=0.025)作為判斷等效的允許變異范圍,該試驗的把握度(1–β)為 80% (β=0.2),估算公式為 。n 為各組樣本所需的例數,σi為各組的總體標準差,μi 為各組總體均數,
。n 為各組樣本所需的例數,σi為各組的總體標準差,μi 為各組總體均數, ,k 為所比較的樣本組數,ψ 值是由α、β、vi= k ? 1、v2 = ∞ 查ψ 值表。結合既往文獻報道,枸櫞酸抗凝在CVVH、CVVHDF、CVVHD治療中體外循環壽命分別為(63.5±27.1)、(55.1±21.8)、(45.6±25.6)h[8-10],計算需最小樣本量約為39例。結果表明,每組需至少納入39例。考慮失訪率為15% ,則每組應納入45.8例。故本研究擬每組納入46例患者,共計138例。
,k 為所比較的樣本組數,ψ 值是由α、β、vi= k ? 1、v2 = ∞ 查ψ 值表。結合既往文獻報道,枸櫞酸抗凝在CVVH、CVVHDF、CVVHD治療中體外循環壽命分別為(63.5±27.1)、(55.1±21.8)、(45.6±25.6)h[8-10],計算需最小樣本量約為39例。結果表明,每組需至少納入39例。考慮失訪率為15% ,則每組應納入45.8例。故本研究擬每組納入46例患者,共計138例。
1.2 研究方法
1.2.1 分組
按照計算機中心隨機方案,根據 CRRT 模式不同將納入患者隨機分為 CVVH 組、CVVHD 組和 CVVHDF 組。隨機化是基于計算機 Excel 隨機數字表程序,由不參與患者治療的工作人員進行。
1.2.2 CRRT 處方設置
3 組患者均使用百特 Prismaflex 機器(濾器膜面積 1.5 m2,型號:AN69-ST150 膜中空纖維過濾器)進行 CRRT 治療。采用股靜脈或頸內靜脈留置透析導管建立血管通路,使用商品化含鈣血液濾過置換基礎液(鈣離子濃度 1.5 mmol/L)(成都青山利康藥業有限公司)。在實施 CRRT 治療之前,配制普通肝素 50 mg+生理鹽水 1 000 mL 對體外循環濾器和管路進行預沖,讓設備充分肝素化之后,再取生理鹽水 500 mL 對管路進行沖洗。CRRT 治療劑量為 20~35 mL/(kg·h),CVVHD 組均為透析液;CVVH 組采用前后置換模式(前置換液∶后置換液流速為 1∶1);CVVHDF 組采用后置換模式(置換液∶透析液為 1∶1)。3 組起始血流速度均為 150 mL/min,4%抗凝血用枸櫞酸鈉溶液按照 200 mL/h 的速度自管路動脈端泵入。在沒有凝血的情況下,按照制造商的建議,在 72 h 常規更換濾器管路。在 CRRT 過程中,使用微量泵在濾器后按照每 2 000 mL 血液濾過置換基礎液泵入 30 mL 5%碳酸氫鈉注射液。在 CRRT 開始前及開始 2、6 h 及之后每 6 小時采集濾器前及濾器后血液進行血氣分析,并根據酸堿情況調整 5%碳酸氫鈉用量,以糾正代謝性酸中毒或堿中毒。根據游離鈣離子濃度,調整枸櫞酸鈉輸注速率,確保濾器后游離鈣離子濃度維持在 0.25~0.35 mmol/L,濾器前游離鈣離子濃度維持在 1.0~1.1 mmol/L。
1.2.3 觀察指標
在 CRRT 開始前收集人口統計學數據,包括患者年齡、性別、身高、體重、AKI 分期、AKI 病因、血管通路部位、機械通氣、序貫器官衰竭評分(Sequential Organ Failure Assessment, SOFA)。收集每套體外循環壽命及體外循環凝血的原因,CRRT 開始時血清尿素、肌酐、血紅蛋白、血小板計數、紅細胞壓積(hematocrit, HCT)、凝血酶原時間、活化部分凝血活酶時間、D-二聚體、游離鈣離子濃度和總膽紅素水平。收集 CRRT 開始時血流速率、4%枸櫞酸鈉溶液速率、置換液流量、透析液流量、超濾率,并用不同公式分別計算 FF[5-6]。
公式 1:FF=(后置換液量+脫水量)/[血流速(mL/min)×(1?HCT)×60]
公式 2:FF=(前置換液量+后置換液量+脫水量)/[血流速(mL/min)×(1?HCT)×60+前置換液量]
1.2.4 體外循環壽命計算方法
體外循環壽命指使用同一套體外循環期間,從體外血液循環開始,到因凝血或治療時間達到 72 h 而更換濾器管路的時間。體外循環凝血分為濾器凝血及靜脈壺凝血。跨膜壓≥200 mm Hg(1 mm Hg=0.133 kPa)或濾器壓降≥150 mm Hg 時被定義為“濾器凝血”。
1.3 數據篩選
嚴格按照納排標準篩選入組患者,對登記數據進行雙人錄入,校對后剔除基本信息或觀察指標測量缺失的患者。
1.4 質量控制
所有數據均由臨床經驗豐富的 CRRT 專科醫師及護士記錄。對臨床測量登記數據進行雙錄入,避免錯漏。數據錄入完畢后統一交由第三人進行統計分析。
1.5 統計學方法
采用 SPSS 23.0 軟件進行數據分析。符合正態分布的計量資料采用均數±標準差表示,反之采用中位數(下四分位數,上四分位數)表示。對于正態分布且方差齊的資料,采用單因素方差分析,若 3 組間存在統計學差異,再使用 SNK-q 檢驗進行組間兩兩比較;對于非正態分布或(和)方差不齊的資料,進行變量轉換后采用 Kruskal-Wallis H 檢驗。計數資料采用例數和百分比表示,二分類變量組間比較采用χ2 檢驗或 Fisher 確切概率法,有序分類變量組間比較采用 Mann-Whitney 秩和檢驗。采用 Kaplan-Meier 生存曲線,對 3 組體外循環壽命進行分析。以 2 種計算公式得出的 FF 值為檢驗變量,是否達到體外循環壽命最長組的中位壽命為狀態變量,通過 GraphPadPrism(9.4.1 版)繪制受試者操作特征(receiver operating characteristic, ROC)曲線,計算曲線下面積(area under the curve, AUC)和 95%置信區間(confidence interval, CI)。雙側檢驗水準α=0.05。
2 結果
2.1 3 組患者治療前基線資料比較
共篩選需要 CRRT 治療的患者 1 158 例,其中有 626 例預計治療時間<24 h,預計治療時間>24 h 的患者中有 86 例為非 AKI,余下 446 例中有 307 例因存在一項及以上排除標準被排除,剩余 139 例患者被納入本研究,隨機分配到 CVVH 組(47 例)、CVVHD 組(46 例)和 CVVHDF 組(46 例)。共退出研究 18 例。其中,CVVH 組 7 例(3 例在 CRRT 期間因轉科而非計劃下機,4 例接受治療性全身抗凝),CVVHD 組 6 例(3 例因自動出院而停止 CRRT,1 例在 CRRT 期間因轉科而下機,2 例接受治療性全身抗凝),CVVHDF 組 5 例(1 例因自動出院而停止 CRRT,2 例在 CRRT 期間因轉科而下機,2 例接受治療性全身抗凝)。
最終完成研究患者 121 例,其中 CVVH 組 40 例(33.1%)、CVVHD 組 40 例(33.1%)、CVVHDF 組 41 例(33.8%),無 AKI 1 期患者。3 組患者 CRRT 前基線資料比較見表1。可見,3組患者的基線資料比較,差異均無統計學意義(P>0.05)。
2.2 3 組患者體外循環壽命比較
所有患者體外循環壽命為 60(44.5,70)h。其中,CVVH 組為 64(46,71)h,CVVHD 組為 47(31.5,54)h,CVVHDF 組為 70(65,72)h。在 12、24、36、48、60、72 h,CVVH 組體外循環存活 40、39、34、31、25、10 例,CVVHD 組體外循環存活 40、37、29、19、3、1 例、CVVHDF 組體外循環存活 41、41、39、36、33、16 例。3 組患者 CRRT 體外循環壽命 Kaplan-Meier 曲線見圖1。可見,3 組間體外循環壽命比較,差異有統計學意義(log-rank P=0.036)。其中,CVVH 組和 CVVHD 組(χ2=18.428,P<0.001)、CVVHD 組和 CVVHDF 組(χ2=40.838,P<0.001)、CVVH 組和 CVVHDF 組(χ2=5.155,P=0.023)間體外循環壽命差異均有統計學意義。
 圖1
3 組患者 CRRT 體外循環壽命 Kaplan-Meier 曲線
圖1
3 組患者 CRRT 體外循環壽命 Kaplan-Meier 曲線
CVVH:連續性靜脈-靜脈血液濾過;CVVHD:連續性靜脈-靜脈血液透析;CVVHDF:連續性靜脈-靜脈血液透析濾過
2.3 3 組患者體外循環未使用至 72 h 而更換的原因
在 CRRT 過程中,因體外循環未使用至 72 h 出現濾器或靜脈壺凝血而更換濾器管路共計 94 例(77.7%),其中 CVVH 組 30 例、CVVHD 組 39 例、CVVHDF 組 25 例;3 組發生體外循環凝血比較,差異有統計學意義(χ2=15.83,P<0.001)。其中,CVVHD 組與 CVVH 組(χ2=8.538,P=0.007)、CVVHD 組與 CVVHDF 組(χ2=16.288,P<0.001)比較,差異均有統計學意義;但 CVVH 組與 CVVHDF 組比較,差異無統計學意義(χ2=1.827,P=0.235)。
在 94 例體外循環凝血的患者中,23 例(24.5%)為靜脈壺凝血導致 CRRT 終止,其中 CVVH 組 2 例、CVVHD 組 20 例、CVVHDF 組 1 例;3 組靜脈壺凝血比較,差異有統計學意義(χ2=37.366,P<0.001)。其中,CVVHD 組與 CVVH 組(χ2=20.313,P<0.001)、CVVHD 組與 CVVHDF 組(χ2=23.848,P<0.001)比較,差異均有統計學意義;但 CVVH 組與 CVVHDF 組比較(χ2=0.372,P=0.616),差異無統計學意義。
2.4 3 組患者 FF 比較
2.4.1 2 種公式計算 3 組患者 FF 比較
2 種公式計算 3 組患者 FF 比較見表2。可見,根據公式 1 計算,CVVH 組、CVVHD 組及 CVVHDF 組 FF 比較,差異有統計學意義(H=69.402,P<0.001)。組間兩兩比較顯示,CVVH 組和 CVVHD 組(H=54.084,P<0.001)、CVVHD 組和 CVVHDF 組(H=56.914,P<0.001)比較,差異均有統計學意義;但 CVVH 組和 CVVHDF 組(H=2.830,P=0.700)比較,差異無統計學意義。
根據公式 2 計算,CVVH 組、CVVHD 組及 CVVHDF 組 FF 比較,差異有統計學意義(H=97.962,P<0.001)。組間比較顯示,CVVH 組和 CVVHD 組(H=36.565,P<0.001)、CVVHD 組和 CVVHDF 組(H=75.765,P<0.001)、CVVH 組和 CVVHDF 組(H=39.200,P<0.001)比較,差異均有統計學意義。在 CVVH、CVVHD 及 CVVHDF3 種模式下,公式 2 計算的 FF 均高于公式 1,差異均有統計學意義(Z=?7.502、?6.501、?5.495,P<0.001)。
2.4.2 FF 對體外循環壽命影響的 ROC 曲線
因 CVVHDF 組患者體外循環壽命最長,以 CVVHDF 組中位體外循環壽命 70 h 為標準,將 CVVH 組和 CVVHDF 組共 81 例患者,按照體外循環壽命是否達到 70 h 分為 2 種狀態,繪制兩種 FF 計算公式得出的 FF 值對體外循環壽命影響的 ROC 曲線,見圖2。不同公式計算的 FF 對 CRRT 體外循環壽命影響的 ROC 曲線分析見表3。可見,與公式 1[AUC=0.539,95%CI(0.408,0.670),P=0.565]比較,公式 2[AUC=0.668,95%CI(0.543,0.792),P=0.013]得出的 FF 對體外循環壽命影響更大、靈敏度高,但特異度較低。
 圖2
不同公式計算的 FF 對 CRRT 體外循環壽命影響的 ROC 曲線分析
圖2
不同公式計算的 FF 對 CRRT 體外循環壽命影響的 ROC 曲線分析
FF:濾過分數;CRRT:連續性腎臟替代治療;ROC:受試者操作特征
3 討論
本研究觀察了在 3 種 CRRT 模式下,采用 RCA,分析了不同 CRRT 模式下的體外循環壽命,同時分析了 2 種 FF 計算公式對 CRRT 體外循環壽命的影響。本研究結果顯示,在使用 Prismaflex 機型進行 CRRT 時,CVVHDF 體外循環壽命最長,達到 70(65,72)h,CVVH 次之,CVVHD 最短。在 CVVHDF 與 CVVH 模式下濾器使用至 72 h 比例比較,差異無統計學意義(P>0.05)。分別采用 2 種公式計算 3 組患者 FF ,發現通過公式 1 計算的 FF,CVVHDF 組和 CVVH 組比較差異無統計學意義(P>0.05);而通過公式 2 計算的 FF,CVVHDF 組和 CVVH 組比較,差異有統計學意義(P>0.05)。
CRRT 體外循環正常使用是保障 CRRT 順利進行的前提,不同 CRRT 模式下體外循環壽命不一致。Zarbock 等[11]研究發現,CVVHD 體外循環壽命最長[CVVHD 與 CVVH 平均差 4.68 h,95%CI(5.71,23.65)h,P=0 .001;CVVHD 與 CVVHDF 平均差 5.14 h,95%CI(0.23,10.05)h,P=0.04],其次是 CVVHDF,體外循環壽命最短為 CVVH。還有研究報道,CVVHD 期間的平均體外循環壽命明顯長于 CVVH[12-13]。上述研究均提示,在相同治療劑量條件下,CVVHD 的 FF 最小,而 CVVH 的 FF 最大。而 FF 與 CRRT 體外循環壽命有很強的相關性,FF 越高,當血液流經濾器時,濃縮更明顯,導致濾器跨膜壓增高,因此更易凝血[14]。MacEwen 等[5]研究發現,FF 每增加 1%,濾器凝血的風險就會增加 7%,FF 降低 3%,對濾器壽命的影響與活化部分凝血活酶增加 10 s 相同,而沒有伴隨出血風險。由此,2012 年 KDIGO-AKI 指南及 2016 年國際急性疾病質量倡議協會制定的 CRRT 專家共識建議將 FF 控制在 25%~30%[2,15]。
如上所述,FF 越高,體外循環壽命相對更短,已成為 CRRT 領域公認的話題。雖然 CVVHD 模式下濾過分數最低,CVVHDF 及 CVVH 模式 FF 均高于 CVVHD,但本研究發現,在 3 種 CRRT 模式中,CVVHD 體外循環壽命最短,CVVHDF 體外循環壽命最長。進一步對體外循環凝血原因分析顯示,由于在 CVVHD 模式下,靜脈壺無液體沖刷,因此發生靜脈壺凝血的比例較 CVVHDF 及 CVVH 模式明顯更高。因此,單純通過 FF 來預測體外循環壽命還需要進一步驗證。
FF 是超濾率和血漿流量的比值,對于其計算,2 種計算公式的區別在于是否將前置換納入總超濾量及血漿流量中,目前多數專家建議在分子和分母中同時加入前置換液量[6,16]。不論通過哪種計算公式,在血流量和凈超濾相同的情況下,等量后置換的 FF 高于前置換,研究證實增加前置換液量能降低濾器凝血的風險[17-18]。但是,本研究結果顯示,不論采用哪種 CRRT 模式,由公式 2 計算出的 FF 均高于公式 1(P<0.001)。不論是公式 1 還是公式 2,CVVHD 和 CVVHDF 模式下的 FF 中位數均<25%,達到目前指南要求的控制范圍。但是在 1∶1 前后置換的 CVVH 模式中,采用公式 1 計算出的 FF 為 15.8%(15.2%,17.0%),達到 25%的控制目標,且與同治療劑量透析液∶置換液為 1∶1 的 CVVHDF 模式的 FF 無統計學差異(P=0.700);而采用公式 2 計算出 CVVH 的 FF 則達到 33.1%(32.4%,35.7%),超過了同治療劑量 CVVHDF 模式的 FF(P<0.001)。
目前,用 FF 預測 CRRT 濾器凝血風險還無強有力證據[16,19]。因此,本研究將 CVVH 組和 CVVHDF 組共 81 例患者,根據體外循環壽命是否達到 CVVHDF 組中位體外循環壽命 70 h 分為 2 種狀態,繪制 2 種公式得出的 FF 值對體外循環壽命影響的 ROC 曲線,發現公式 2 得出的 FF 對體外循環壽命影響的 ROC 曲線 AUC 大于公式 1,且特異度也明顯更高,提示公示 2 得出的 FF 對體外循環壽命的預測比公式 1 更有價值。本研究結果也發現,CVVHDF 組體外循環壽命長于 CVVH 組[70(65,72) vs. 64(46,71)h,P=0.014]。根據公式 2 計算 FF,1∶1 前后置換的 CVVH 模式的 FF 超過 30%,理論上體外循環壽命應該偏短,但在本研究中,該組患者體外循環壽命仍達到 64(46,71)h,雖然比同劑量的 CVVHDF 模式體外循環壽命短,但超過了多項研究報道的 RCA-CRRT 體外循環壽命[9,20-22],且與 CVVHDF 組患者濾器使用至 72 h 比較,差異無統計學意義(P=0.235)。因此,單純將 FF 作為 CRRT 濾器凝血風險分層的指標尚有局限性,特別是對于本研究所采取的前后置換的 RCA-CVVH 模式。
綜上所述,雖然 CVVHD 模式 FF 最低,但其體外循環壽命比 CVVH 和 CVVHDF 模式更短,主要由于靜脈壺無液體沖刷,導致靜脈壺凝血所致。不論對于哪種 CRRT 模式,2 種公式計算出的 FF 間均有統計學差異,特別對于 1∶1 前后置換的 CVVH 模式,采用公式 2 計算的 FF 明顯大于同等治療劑量的 CVVHDF 模式,而實則此 2 種模式間濾器使用至 72 h 比較,差異無統計學意義。公式 2 計算的 FF 預測 CRRT 體外循環壽命靈敏度更高,但特異度更低,因此,單純使用 FF 作為 CRRT 體外循環凝血風險評估尚有局限性,特別是對于前后置換的 CVVH 模式。但本研究存在一些局限性:首先,研究樣本量有限,僅納入 121 例患者,且每例患者僅納入 1 套濾器觀察;其次,本研究患者全部為 RCA,而在其他全身抗凝或者無抗凝下是否有類似結果尚不明確;第三,本研究選擇的 CRRT 機型均為 Prismaflex,而每種 CRRT 機具有自身特點。因此,還需要大樣本、多中心隨機對照試驗來進一步證實哪種 FF 計算公式更有利于評估 CRRT 體外循環凝血風險。
利益沖突:所有作者聲明不存在利益沖突。