引用本文: 王良芳, 曹鈺彬, 段世豪, 張燕. 基于生物信息學的抑郁癥加重克羅恩病關鍵基因和機制探討. 華西醫學, 2024, 39(1): 71-79. doi: 10.7507/1002-0179.202307032 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
克羅恩病是一種慢性非特異性胃腸道炎癥性疾病,其發病機制不清,可能與環境因素、基因、微生物以及免疫因素有關[1]。現有研究發現,炎癥性腸病(inflammatory bowel disease, IBD)患者抑郁癥狀的發生率明顯高于一般人群,克羅恩病患者抑郁癥狀的發生率為 24.8%[95% 置信區間(confidence interval, CI)(20.7%,29.3%)][2],活動期 IBD 患者抑郁癥狀發生率更是高達 40.7%[95%CI(31.1%,50.3%)][3]。抑郁會加重 IBD 的病情[4],伴抑郁的 IBD 患者類固醇或生物制劑使用率、住院率、手術率、復發率和緊急資源使用率均更高[5-6]。一項樣本量近 600 萬、中位隨訪時間為 6.7 年的前瞻性研究發現,抑郁患者發展為克羅恩病的風險比為 2.11[95%CI(1.65,2.70)][7]。Ghia 等[8]在動物實驗中也得到了一致的結果,研究者通過葡聚糖硫酸鈉(dextran sodium sulfate, DSS)喂養小鼠建立慢性結腸炎模型,并通過嗅球切除或腦室注射利血平誘導小鼠抑郁,結果發現抑郁可誘導小鼠結腸炎復發。三環類抗抑郁藥可預防抑郁誘導的結腸炎復發,但對無抑郁的結腸炎小鼠無影響[8]。以上證據表明,抑郁與克羅恩病密切相關。然而,關于抑郁如何影響克羅恩病的發生、發展,目前還沒有深入系統的研究。本研究旨在篩選參與抑郁癥加重克羅恩病的關鍵基因,并進一步探討這些關鍵基因的功能,探索其在克羅恩病伴抑郁患者臨床治療中的意義。
1 資料與方法
1.1 數據收集
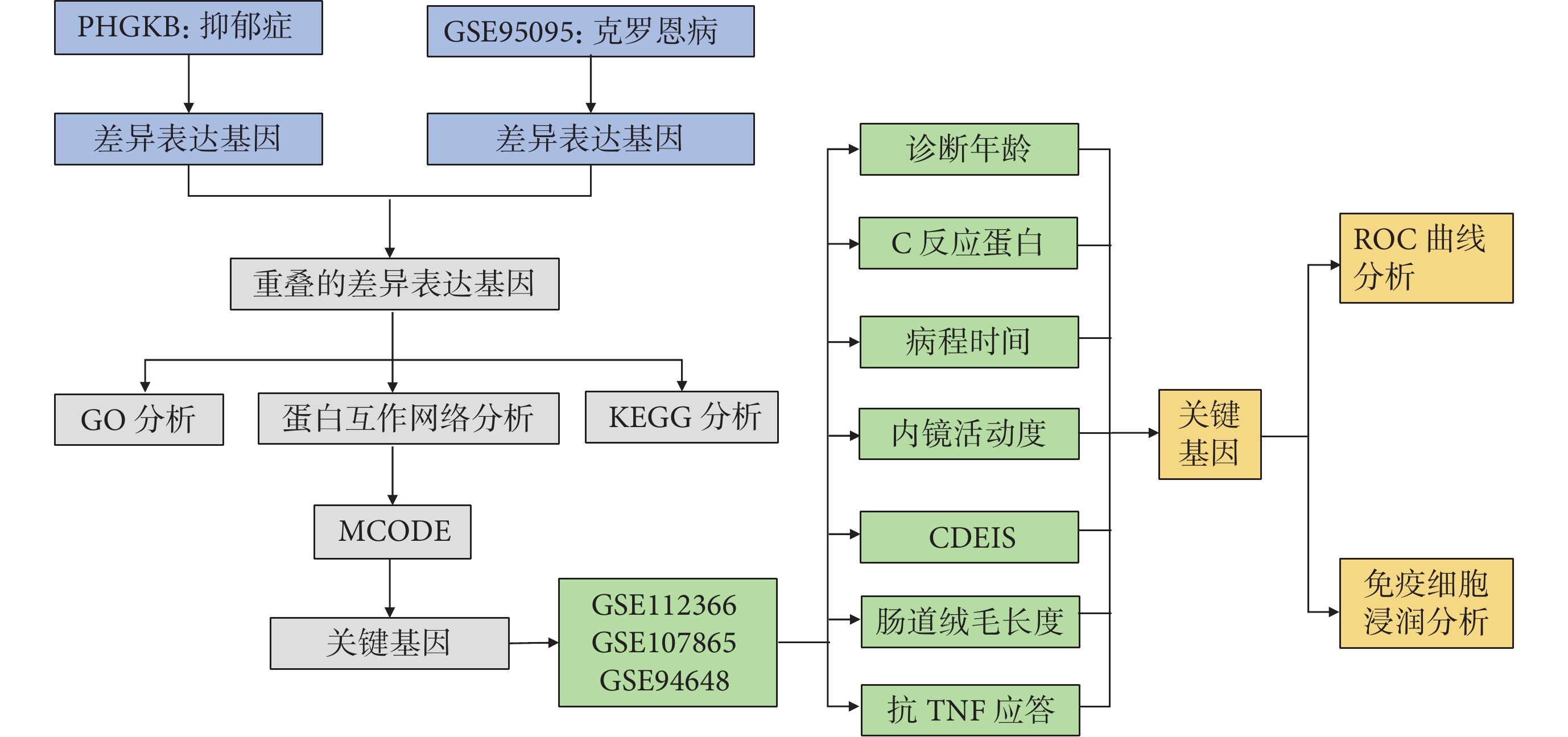
為研究抑郁癥與克羅恩病基因的重疊,于 2023 年 3 月從公共衛生基因組學知識庫(Public Health Genomics and Precision Health Knowledge Base, PHGKB)中下載抑郁癥相關基因;從基因表達綜合(Gene Expression Omnibus, GEO)數據庫中下載 GSE95095 的表達微陣列數據集和系列矩陣文件,后者包括 GSE112366、GSE107865、GSE94648 和 GSE119600[9]。GSE95095 包括 24 個克羅恩病樣本和 12 個正常樣本;GSE112366 包括 141 例克羅恩病患者和 26 例正常人的微絨毛長度及胃腸道受累情況;GSE107865 包括 17 例克羅恩病患者和 5 例正常人的 C 反應蛋白(C-reactive protein, CRP)和抗腫瘤壞死因子(tumor necrosis factor, TNF)應答數據;GSE94648 包括 50 例克羅恩病患者和 22 例正常人的臨床病理資料,包括克羅恩病內鏡嚴重程度指數(Crohn Disease Endoscopic Index of Severity, CDEIS)、局部 CDEIS、病程、診斷年齡和內鏡活動度;GSE119600 包括 48 個克羅恩病樣本和 47 個正常樣本。研究工作流程見圖1。
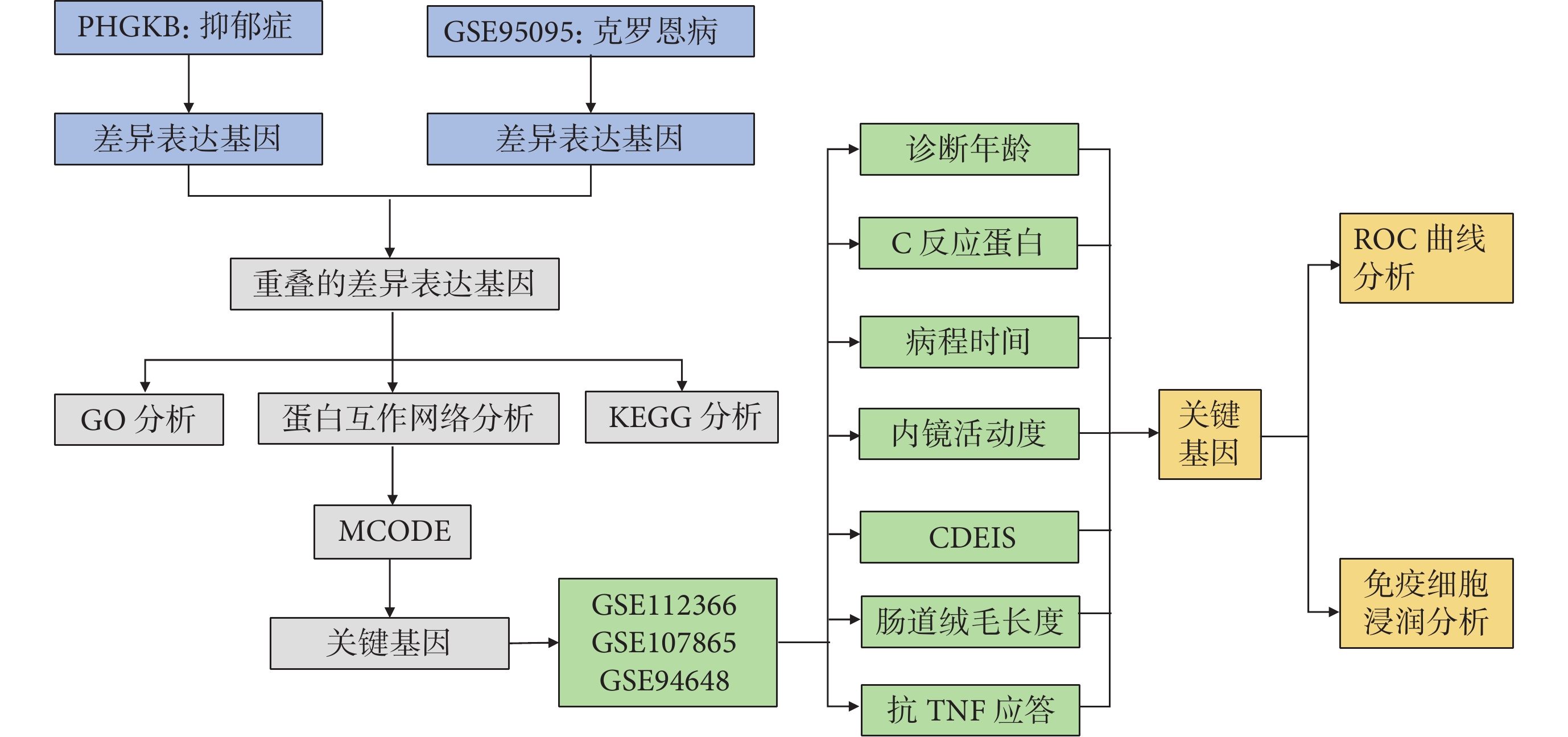 圖1
研究的工作流程
圖1
研究的工作流程
PHGKB:公共衛生基因組學知識庫;GO:基因本體論;KEGG:京都基因與基因組百科全書;MCODE:分子復合物檢測;CDEIS:克羅恩病內鏡嚴重程度指數;TNF:腫瘤壞死因子;ROC:受試者操作特征
1.2 基因表達微陣列分析
通過在線工具 GEO2R 篩選 GSE95095 中克羅恩病患者與正常人的差異表達基因(differentially expressed gene, DEG)[9],以 P<0.05 和|log2FC|>1(FC:fold change,表示兩樣品間表達量的比值)作為本研究篩選 DEG 的臨界標準。使用 ImageGP 繪圖網站構建 GSE95095 的 DEG 火山圖。
1.3 富集分析及關鍵基因篩選
使用在線程序 Metascape 對 DEG 進行基因本體論(gene ontology, GO)和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes, KEGG)途徑富集分析。利用 STRING(Search Tool for the Retrieval of Interacting Genes/Proteins)檢索工具,檢索置信度>0.9 的交互基因數據庫,并隱藏斷開連接的節點,構建可視化的蛋白互作網絡[10]。
關鍵基因的篩選需首先鑒定抑郁癥與克羅恩病的重疊基因,進一步收集富集分析 P<0.01、最小計數為 3、富集因子>1.5 的術語,并根據其成員相似性分組。通過 Metascape 篩選出前 3 個分子復合物檢測(molecular complex detection, MCODE)模塊,鑒定出關鍵基因。最后,利用 GSE112366、GSE107865 和 GSE94648 對不同臨床病理參數(CDEIS、局部 CDEIS、回腸絨毛長度、CRP、病程、確診年齡、內鏡活動度、胃腸道受累情況和抗 TNF 治療應答)進行關聯性分析,鎖定與臨床病理參數顯著關聯的關鍵基因。
1.4 關鍵基因的受試者操作特征(receiver operating characteristic, ROC)曲線分析
采用 ROC 曲線分析關鍵基因區分克羅恩病和正常組織的能力,定義 ROC 曲線下面積>0.5 時具有診斷價值[11]。
1.5 EPIC 網站檢測免疫細胞浸潤
為了比較克羅恩病患者和正常人免疫細胞的浸潤情況,將來自 GSE119600 的 48 份克羅恩病樣本和 47 份正常樣本的基因表達譜上傳至 EPIC 門戶網站,并選擇“血液循環免疫細胞”作為參考譜[12]。用 EPIC 法檢測免疫細胞浸潤情況。
1.6 統計學方法
所有分析均在 R 3.5.3 軟件中進行。正態分布計量資料采用 Student t 檢驗進行統計分析,非正態分布計量資料采用 Mann-Whitney U 檢驗進行統計分析;對于關鍵基因與克羅恩病臨床病理參數關聯性的探討,臨床病理參數為計量資料時采用線性相關分析,臨床病理參數為二分類變量時,按照分類進行分組,并采用 Student t 檢驗或 Mann-Whitney U 檢驗進行差異性分析。檢驗水準為雙側 α=0.05。
2 結果
2.1 識別克羅恩病和抑郁癥之間的重疊 DEG
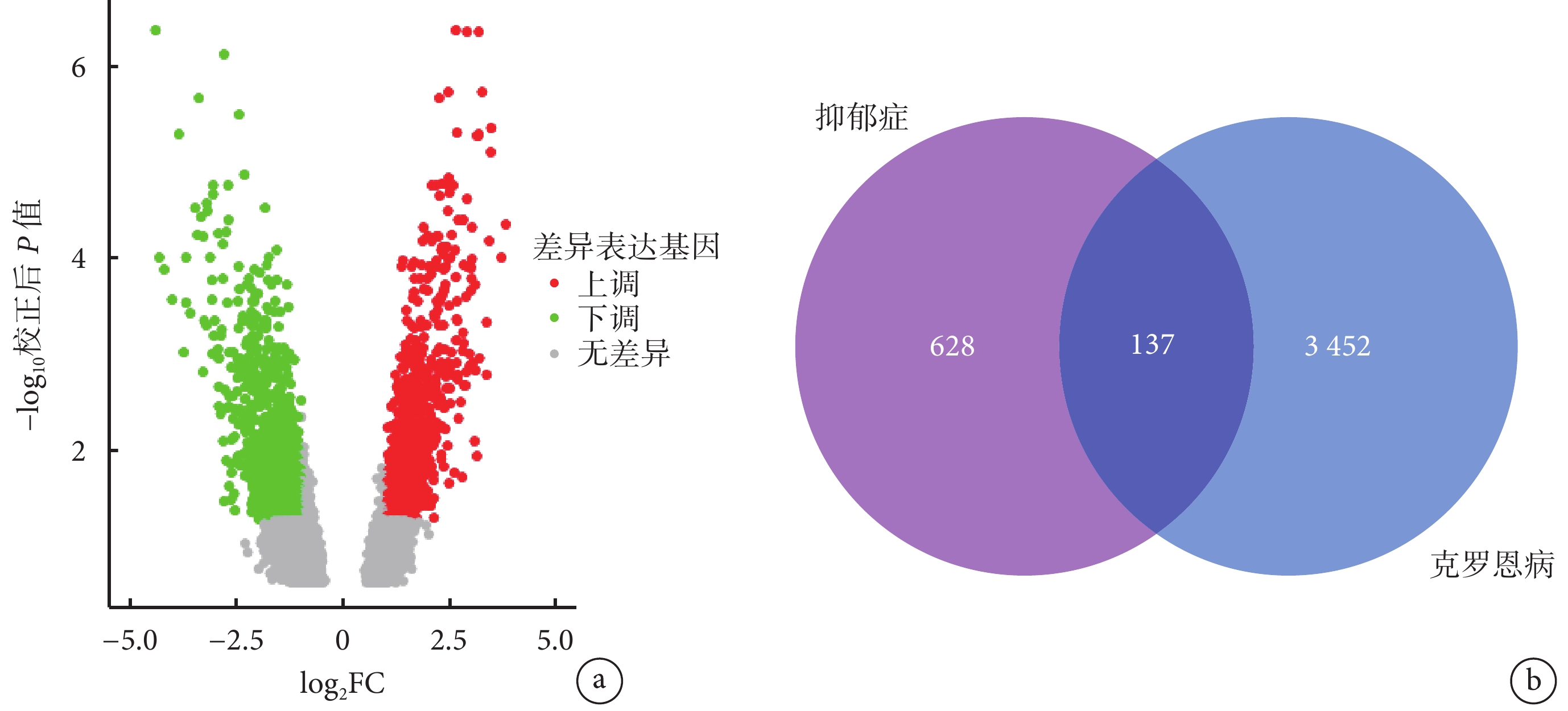
PHGKB 數據庫中下載抑郁癥相關基因共 628 個;GSE95095 中克羅恩病 DEG 共 3452 個(圖2a),其中 137 個 DEG 與抑郁癥相關基因重疊(圖2b)。
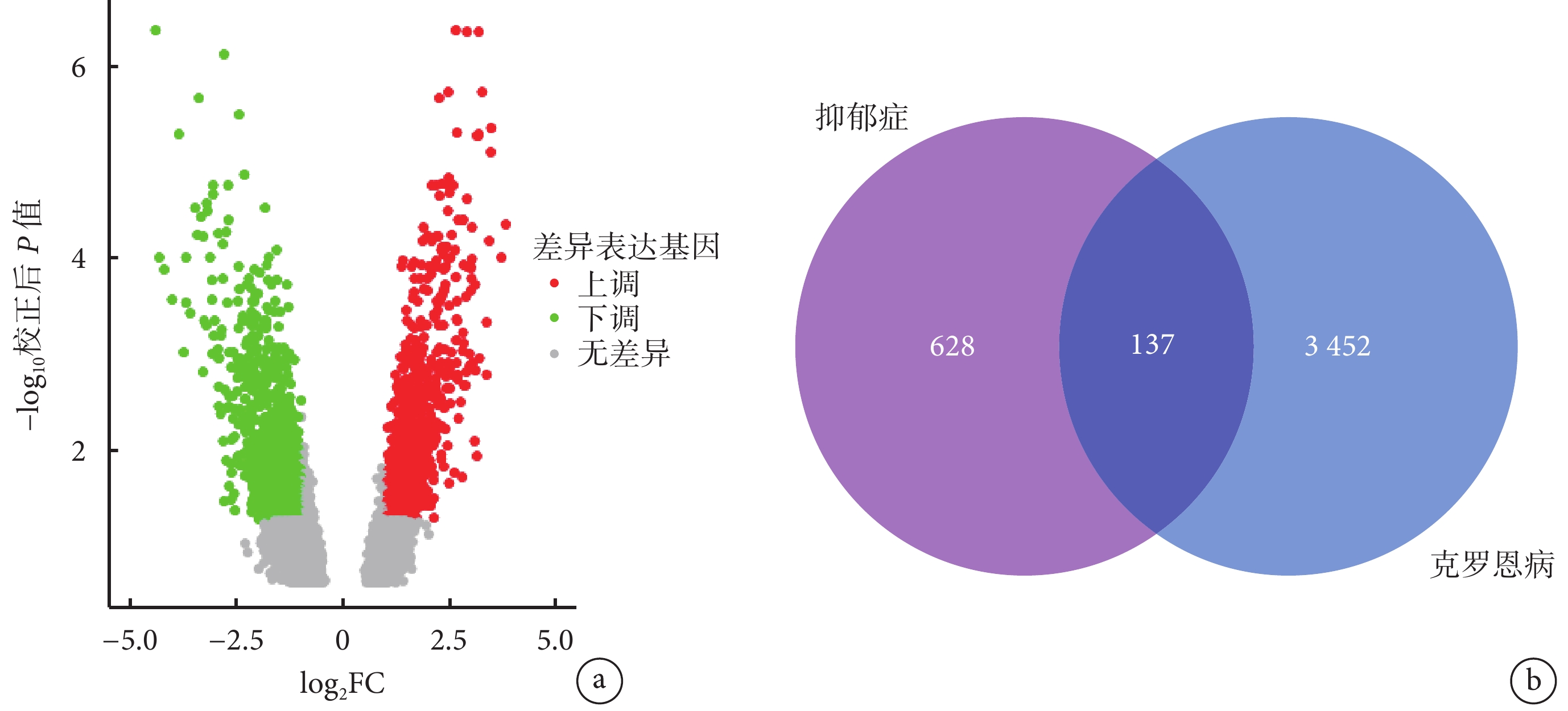 圖2
篩選克羅恩病和抑郁癥之間的重疊差異表達基因
圖2
篩選克羅恩病和抑郁癥之間的重疊差異表達基因
a. 克羅恩病患者和對照組基因 mRNA 的差異表達;b. 克羅恩病基因和抑郁癥相關基因中的重疊差異表達基因
2.2 重疊 DEG 分析及關鍵基因鑒定
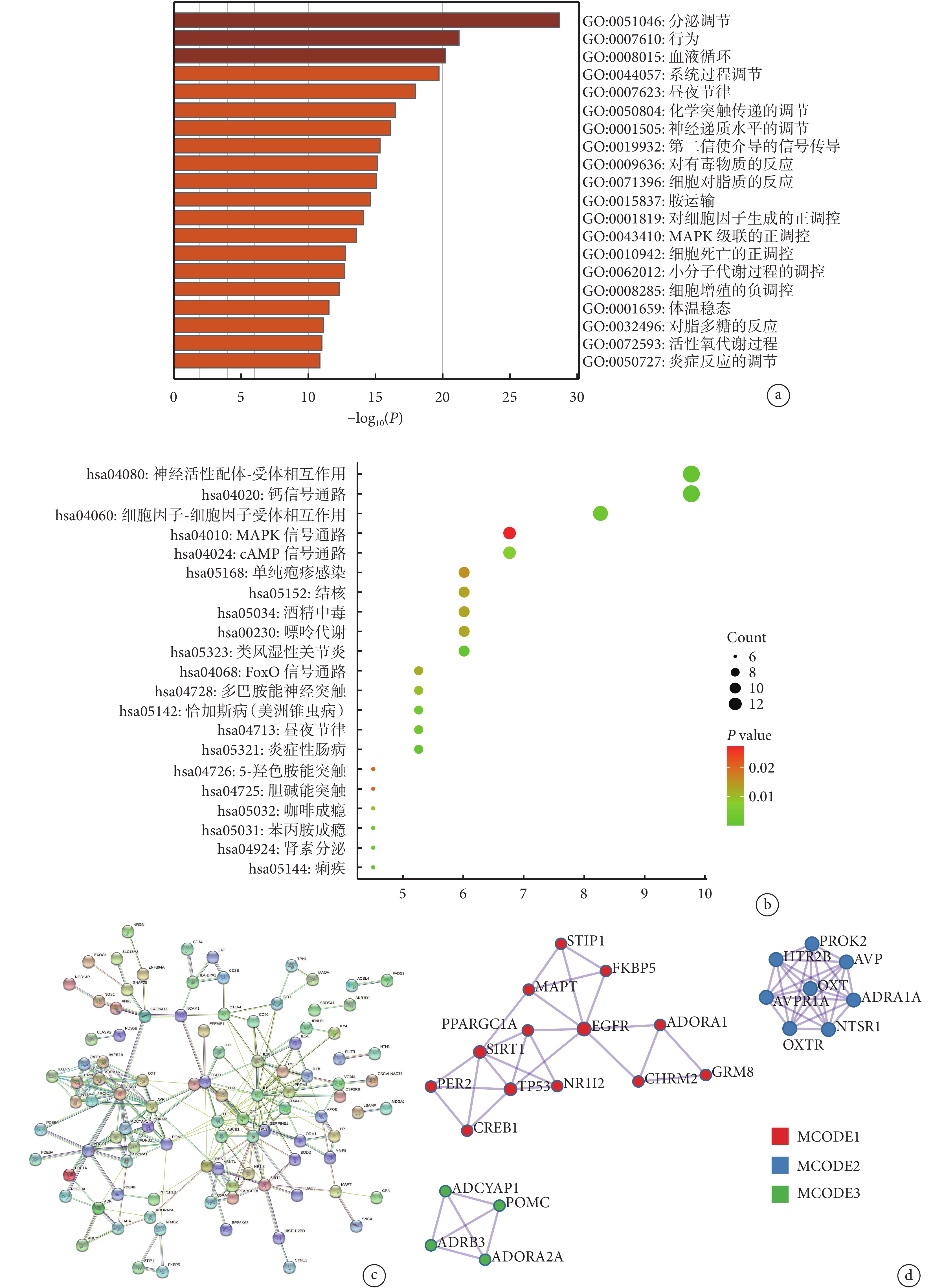
GO 分析結果顯示了重疊 DEG 的前 20 個富集項,涉及分泌調節、行為調節、血液循環調節和系統過程調節等(圖3a)。KEGG 通路分析結果如圖3b 所示,神經活性配體-受體相互作用、鈣信號通路、細胞因子-細胞因子受體相互作用、絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信號通路、環磷酸腺苷信號通路與抑郁癥和克羅恩病的重疊 DEG 高度相關。利用 STRING 工具構建可視化蛋白互作網絡,最終的網絡有 134 個節點和 154 條邊(圖3c)。
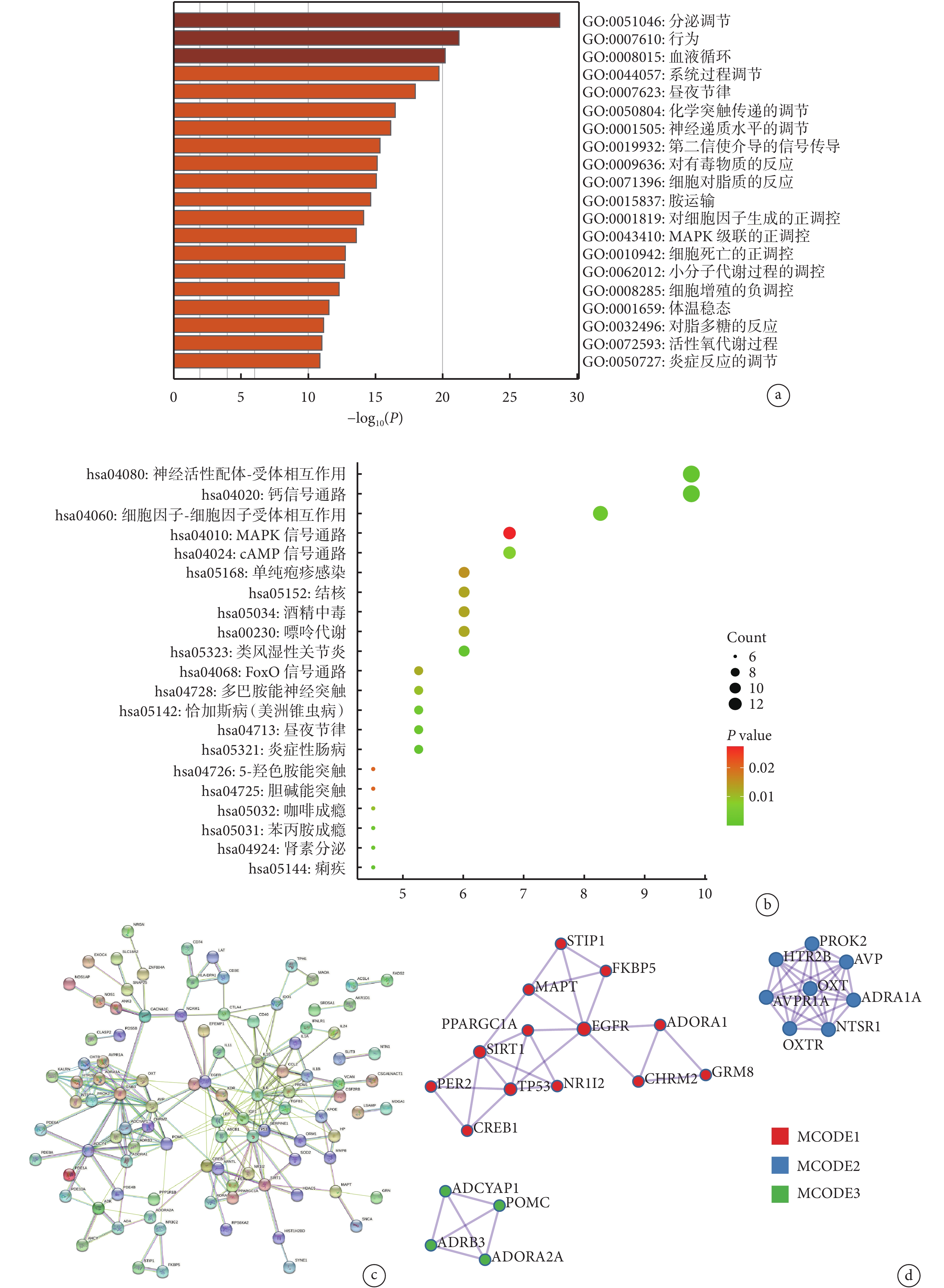 圖3
重疊差異表達基因分析及關鍵基因鑒定
圖3
重疊差異表達基因分析及關鍵基因鑒定
a. 富集分析的前 20 個富集項;b. KEGG 通路分析;c. STRING 構建可視化蛋白互作網絡;d. 前 3 個 MCODE。KEGG:京都基因與基因組百科全書;MAPK:絲裂原活化蛋白激酶;cAMP:環磷酸腺苷;FoxO:叉頭框蛋白 O;MCODE:分子復合物檢測
我們通過 MCODE 插件從 Cytoscape 創建的整個網絡中篩選出關鍵模塊,建立了 3 個 MCODE,鑒定出 25 個關鍵基因(圖3d),包括 EGFR、SIRT1、TP53、STIP1、FKBP5、MAPT、PPARGC1A、ADORA1、PER2、NR1I2、CHRM2、GRM8、CREB1、PROK2、AVP、ADRA1A、NTSR1、OXTR、AVPR1A、HTR2B、OXT、ADCYAP1、POMC、ADRB3 和 ADORA2A。
2.3 克羅恩病患者異常表達的關鍵基因與臨床病理參數的關聯性
我們進一步探討了上述篩選出的 25 個關鍵基因與不同臨床病理參數(CDEIS、局部 CDEIS、回腸絨毛長度、CRP、病程、確診年齡、內鏡活動度、胃腸道受累情況和抗 TNF 治療應答)的關聯性,最終鎖定了 16 個與不同臨床病理參數顯著關聯的關鍵基因,包括 ADCYAP1、AVP、CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、ADORA2A、CHRM2、NR1I2、HTR2B、PPARGC1A、TP53 和 ADORA1(表1)。其中,CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、HTR2B、PPARGC1A 與本研究中多個臨床參數均顯著關聯,意味著它們與克羅恩病的發生和發展有更強的關聯,提示它們可能可作為未來研究的關鍵基因。
2.4 關鍵基因的 ROC 曲線分析
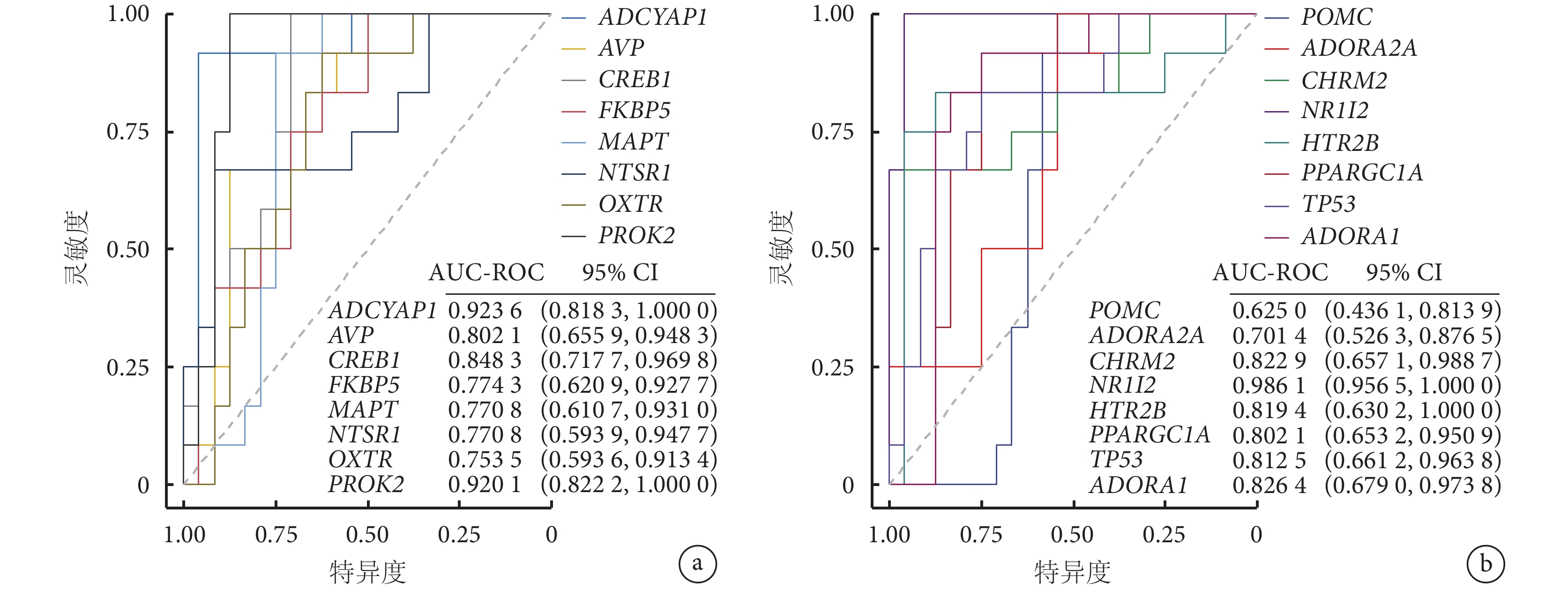
采用 ROC 曲線分析關鍵基因區分克羅恩病和正常組織的能力,16 個關鍵基因的 ROC 曲線下面積均大于 0.5,除 POMC 基因,其余 15 個關鍵基因的 ROC 曲線下面積的 95%CI 均不包括 0.5,并且這 15 個關鍵基因的 ROC 曲線下面積均大于 0.7,具有中等及以上的診斷價值(圖4)。
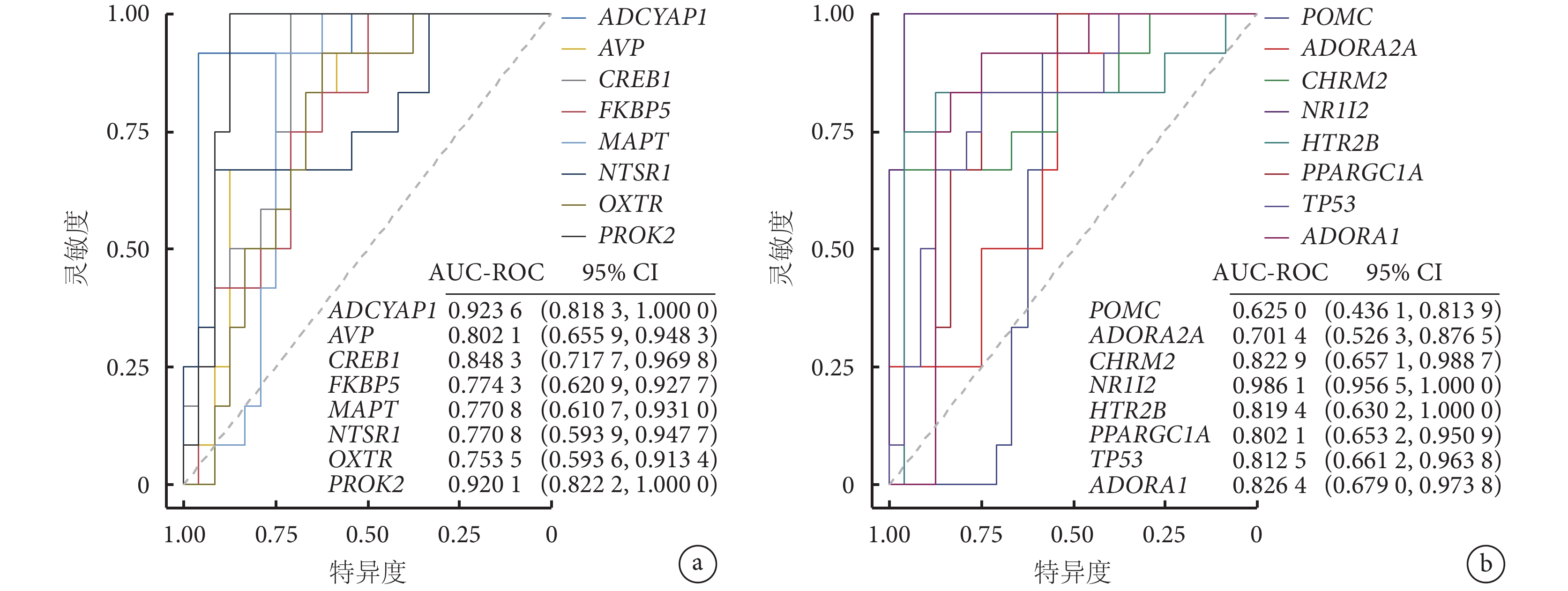 圖4
關鍵基因的 ROC 曲線分析
圖4
關鍵基因的 ROC 曲線分析
a.
2.5 PROK2 相關基因的鑒定及功能富集分析
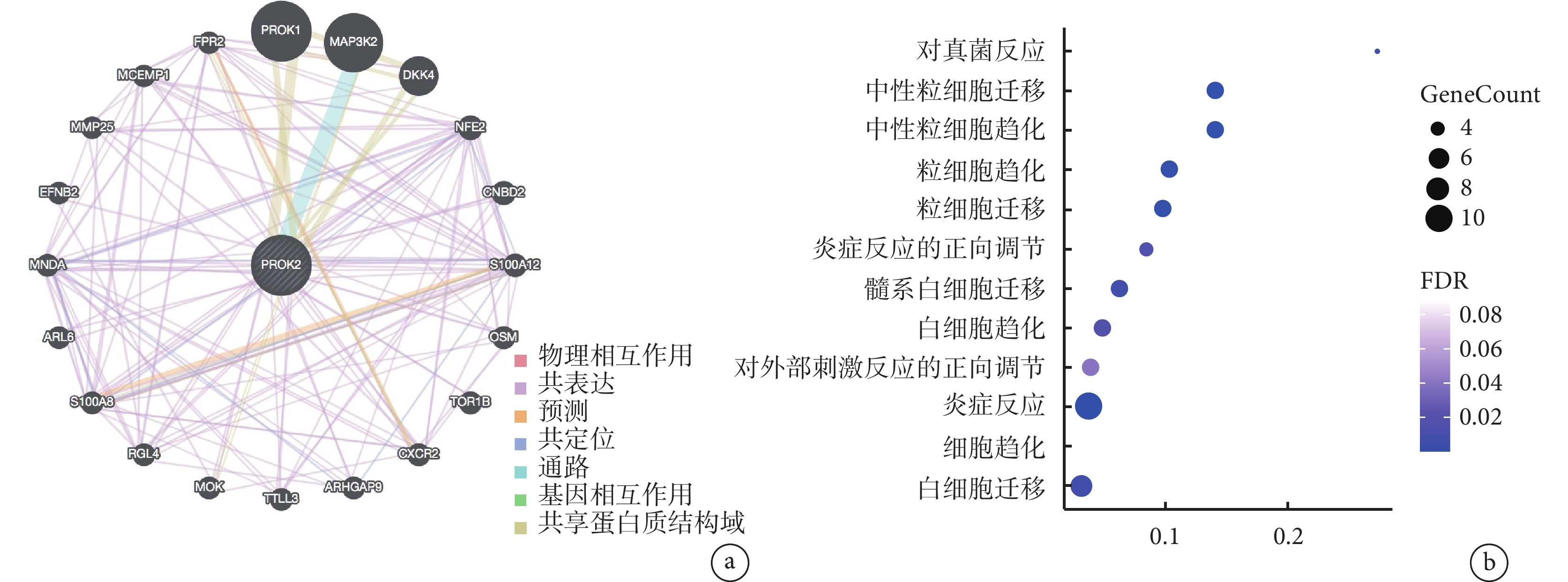
PROK2 與內鏡評分 CDEIS 和客觀的炎性指標 CRP 呈正相關,且在活動期克羅恩病患者中的轉錄水平明顯高于非活動期克羅恩病患者,此外,ROC 曲線分析表明 PROK2 對克羅恩病有優異的診斷價值。因此,我們對 PROK2 進行了更為豐富的數據分析。我們使用 GeneMANIA 插件探索 PROK2 的相關基因(圖5a),并對 PROK2 相關基因進行了富集分析,發現這些基因主要富集在對真菌的反應、中性粒細胞和粒細胞的遷移、中性粒細胞和粒細胞的趨化、炎癥反應的正向調節等方面(圖5b)。PROK2 和 PROK2 相關基因與炎癥反應的調節似乎有著重要的聯系,這種聯系很可能是通過調節免疫細胞,特別是中性粒細胞和粒細胞來實現的。接下來我們試圖比較克羅恩病患者和正常人的免疫細胞浸潤,以進一步驗證這一假設。
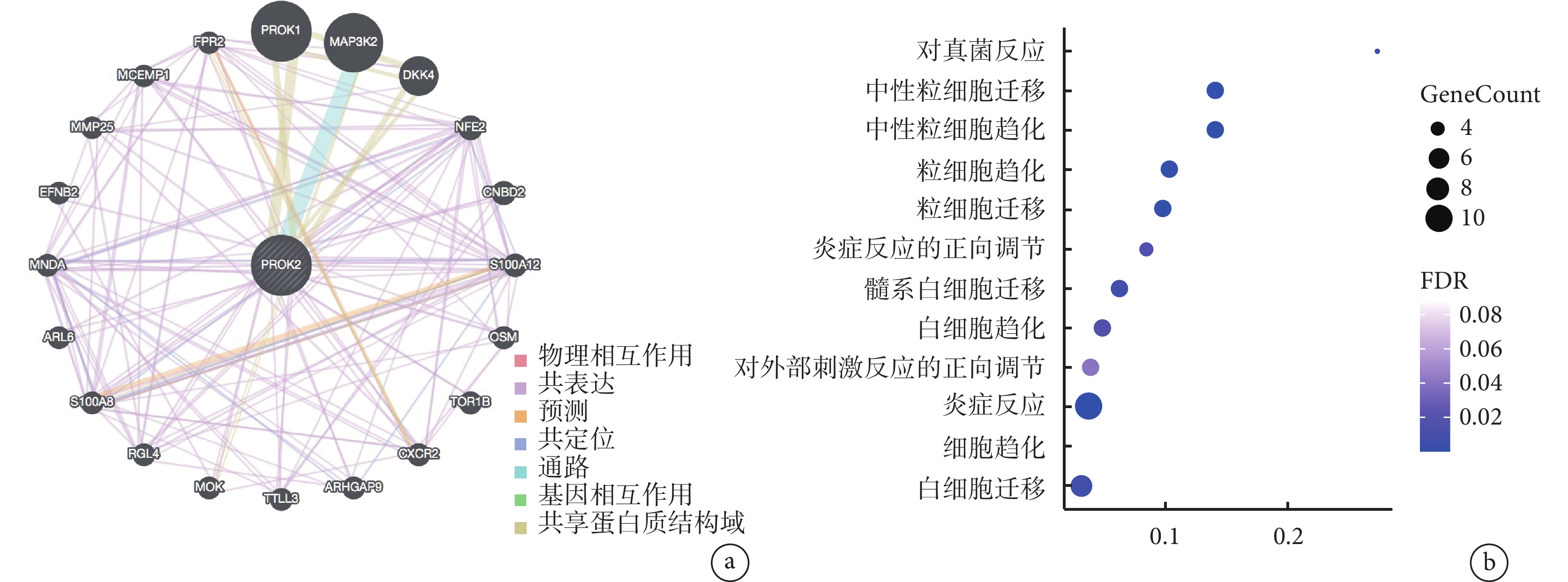 圖5
PROK2 相關基因的鑒定及功能富集分析
圖5
PROK2 相關基因的鑒定及功能富集分析
a. 與
2.6 EPIC 檢測免疫細胞浸潤
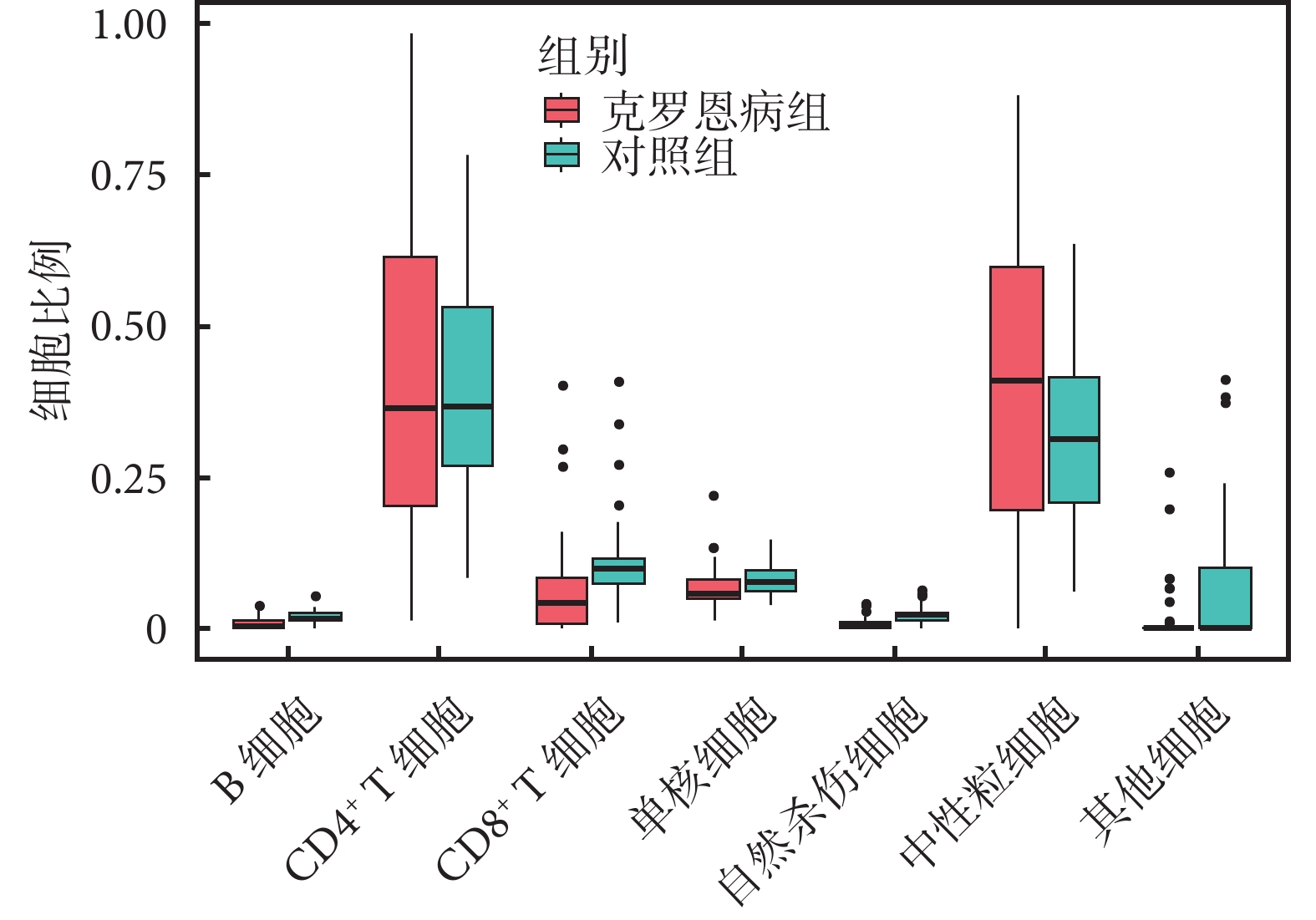
97 份樣本(48 份克羅恩病樣本和 47 份正常樣本)的 7 種免疫細胞的浸潤比例和 7 種細胞的熱圖見附件圖1。我們比較兩組人群的免疫細胞浸潤情況(圖6),發現克羅恩病患者的中性粒細胞比例高于對照組,而 CD8+ T 細胞比例低于對照組,但差異無統計學意義(P>0.05)。
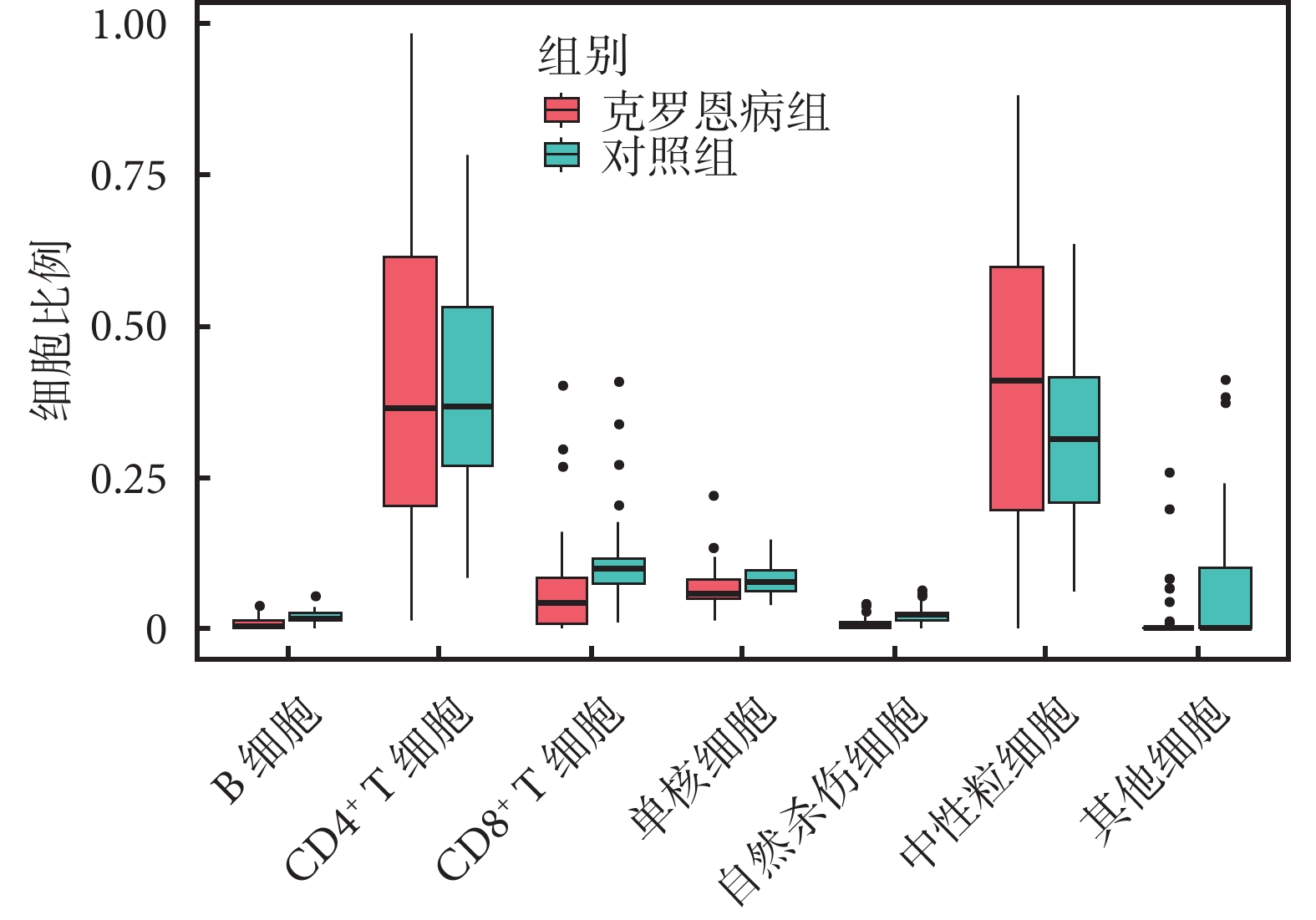 圖6
克羅恩病患者與正常人不同免疫細胞比例的差異
圖6
克羅恩病患者與正常人不同免疫細胞比例的差異
3 討論
克羅恩病是一種反復發作的胃腸道慢性非特異性的炎癥性疾病,可累及口腔到肛門整個消化道,目前尚不可治愈,給患者及其家庭帶來巨大的經濟及心理負擔[13]。多項研究報道,伴抑郁的克羅恩病患者生活質量更差,手術率、相關殘疾率、住院和臨床復發的風險更高[14-16]。以往的研究已經發現克羅恩病與抑郁癥之間密切相關,抑郁癥可能是克羅恩病惡化的原因,而不是結果[7]。因此,探討抑郁癥如何加重克羅恩病具有重要意義。本研究應用生物信息學綜合分析方法,對抑郁癥加重克羅恩病的關鍵基因、途徑、功能和免疫細胞進行了分析。
我們發現克羅恩病和抑郁癥之間共有 137 個重疊 DEG。KEGG 分析重疊 DEG 主要涉及神經活性配體-受體相互作用、鈣信號通路、細胞因子-細胞因子受體相互作用、MAPK 信號通路等,與先前在“腸-腦軸”以及 IBD 的發病、加重和復發方面的研究結果一致。既往的研究表明,神經活性配體,如 γ-氨基丁酸、多巴胺、去甲腎上腺素和谷氨酸,在“腸-腦軸”的相互交流中發揮著重要作用[17]。最近的一項研究發現鈣信號通路也參與調節 IBD 的腸道運動[18]。MAPK 信號通路和細胞因子網絡在腸道生理和病理條件中發揮關鍵作用,是腸道內穩態的重要基石[19]。因此,信號通路和細胞因子網絡的紊亂可能誘導 IBD 的發作。
根據富集和臨床關聯性的分析結果,我們共鑒定出 16 個關鍵基因,包括 ADCYAP1、AVP、CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、ADORA2A、CHRM2、NR1I2、HTR2B、PPARGC1A、TP53 和 ADORA1。CDEIS 通常用于評估克羅恩病嚴重程度[20]。FKBP5、NTSR1、PROK2 與 CDEIS 呈正相關,MAPT、HTR2B、TP53 與 CDEIS 呈負相關。此外,FKBP5、OXTR 與局部 CDEIS 呈正相關,MAPT、HTR2B 與局部 CDEIS 呈負相關。在克羅恩病患者中,腸道微絨毛長度的減少可能與上皮功能障礙和疾病的慢性進展有關[21]。POMC 和 NR1I2 的轉錄水平分別與腸道微絨毛長度呈負相關和正相關。作為一種非特異性生物標志物,CRP 水平的升高與炎癥反應密切相關[22]。PROK2、ADORA1 與 CRP 呈正相關,CREB1、CHRM2 與 CRP 呈負相關。內鏡下活動性病變的克羅恩病患者 AVP、CREB1、FKBP5、NTSR1、OXTR、PROK2 和 POMC 顯著高于內鏡下無活動性病變的克羅恩病患者,而 ADCYAP1、ADORA2A 和 MAPT 顯著低于無內鏡下活動性病變的克羅恩病患者。根據這些結果,FKBP5、NTSR1、OXTR、PROK2 和 POMC 的轉錄水平升高可能意味著更強烈炎癥反應和更差的疾病狀態,而 MAPT 和 HTR2B 的表達增加可能在克羅恩病的發生發展中起保護作用。關鍵基因 HTR2B 和 PPARGC1A 的表達差異,也提示著克羅恩病患者受累的腸道部位不同。此外,我們檢測到 PPARGC1A 的高表達與抗 TNF 藥物治療應答相關。
FKBP5 是位于 6 號染色體上的蛋白質編碼基因。FKBP5-核因子 κB(nuclear factor kappa-B, NF-κB)信號通路存在一個正反饋環路,較高的 FKBP5 可以通過加強 NF-κB 調節激酶的相互作用來促進炎癥[23]。MAPT 作為一種功能性候選基因,已被報道參與克羅恩病的易感性[24]。NTSR1,可以通過與神經降壓素結合介導結腸炎癥,NTSR1 在正常腸道黏膜中幾乎沒有表達,但在結腸炎中表達顯著增加,并且 NTSR1 拮抗劑可以抑制艱難梭菌引起的腸道炎癥[25]。此外,與野生型小鼠相比,NTSR1-/-小鼠對 DSS 誘導的死亡率有更強的抵抗力[26]。OXTR 是一種催產素受體,是一種急性時相蛋白,在巨噬細胞的細胞炎癥反應中發揮作用,可被催產素激活并受 NF-κB 調節[27]。OXTR 髓系缺陷小鼠對 DSS 誘導結腸炎的易感性高于野生型小鼠[28]。POMC 的基因產物黑皮質素參與抑制中性粒細胞遷移和趨化因子生成[29],根據其抗炎作用,黑皮質素具有潛在的治療作用,并且在臨床前研究中對急性、慢性和全身性炎癥性疾病有顯著的治療效果[30]。HTR2B 已經被發現可以通過調節巨噬細胞的表型和功能極化,維持抗炎狀態[31]。PPARGC1A 是克羅恩病易感性相關的候選基因[32]。CREB1 是一種轉錄因子,介導許多細胞反應,如增殖、存活和分化。CREB 可由炎癥信號誘導,在多種炎癥反應中發揮作用,包括抗巨噬細胞和中性粒細胞的凋亡,T 細胞和 B 細胞的增殖和存活以及調節不同輔助性 T 細胞的免疫反應[33]。
PROK2 主要由組織損傷部位的巨噬細胞和中性粒細胞產生,既往研究發現,在 IBD 患者和其他結腸炎模型的樣本中,炎癥期間 PROK2 在胃腸道中的表達顯著升高[34]。與此一致,我們的研究發現 PROK2 與 CDEIS 評分和 CRP 水平呈正相關,且在活動期克羅恩病患者中的表達水平明顯高于非活動期克羅恩病患者。此外,進一步的 ROC 分析表明 PROK2 對克羅恩病的診斷有優異價值,多篇研究也報道了相似的結果[35-36],因此,我們對 PROK2 進行了更為豐富的數據分析。前動力蛋白 2(prokineticin 2, PK2)是由 PROK2 編碼的趨化因子。PK2 首先被發現是一種有效調節腸道運動的因子,并進一步被發現參與多種生理活動,如血管生成、神經發生、腸道離子轉運等[37]。除此以外,PK2 會促進單核細胞/巨噬細胞的遷移以及中性粒細胞的趨化,并誘導巨噬細胞和 T 淋巴細胞向促炎譜分化[38],促進促炎細胞因子的產生并減少抗炎細胞因子的產生[39]。PROK2 的表達升高可能預示著更嚴重的胃腸道炎癥。在我們的研究中,PROK2 和 PROK2 相關基因功能主要富集于對真菌的反應、中性粒細胞遷移、中性粒細胞趨化、炎癥反應的正調控等。進一步的免疫細胞浸潤結果顯示,克羅恩病患者中性粒細胞比例高于對照組,CD8+ T 細胞比例低于對照組,雖差異無統計學意義(P>0.05,可能與樣本量少有關),但仍提示中性粒細胞和 CD8+ T 細胞可能參與了抑郁癥所致克羅恩病的發病、加重和復發,有待進一步研究。
綜上所述,本研究利用生物信息學方法探討了克羅恩病與抑郁癥共病的關鍵基因、通路、功能以及免疫細胞,并報道了關鍵基因 CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、HTR2B 和 PPARGC1A 可能參與抑郁癥所致的克羅恩病惡化,其中,PROK2 可能通過調節中性粒細胞和 CD8+ T 細胞的浸潤發揮作用。此外,本研究也存在著一些局限性:第一,本研究的發現沒有擴展到基礎實驗和臨床試驗;第二,本研究中使用的數據集并非來自同一平臺,這可能會引入一些錯誤。未來需要進一步的研究來證實和驗證這些發現。
利益沖突:所有作者聲明不存在利益沖突。
請掃描本文首頁二維碼后在“補充材料”中下載查看附件。
克羅恩病是一種慢性非特異性胃腸道炎癥性疾病,其發病機制不清,可能與環境因素、基因、微生物以及免疫因素有關[1]。現有研究發現,炎癥性腸病(inflammatory bowel disease, IBD)患者抑郁癥狀的發生率明顯高于一般人群,克羅恩病患者抑郁癥狀的發生率為 24.8%[95% 置信區間(confidence interval, CI)(20.7%,29.3%)][2],活動期 IBD 患者抑郁癥狀發生率更是高達 40.7%[95%CI(31.1%,50.3%)][3]。抑郁會加重 IBD 的病情[4],伴抑郁的 IBD 患者類固醇或生物制劑使用率、住院率、手術率、復發率和緊急資源使用率均更高[5-6]。一項樣本量近 600 萬、中位隨訪時間為 6.7 年的前瞻性研究發現,抑郁患者發展為克羅恩病的風險比為 2.11[95%CI(1.65,2.70)][7]。Ghia 等[8]在動物實驗中也得到了一致的結果,研究者通過葡聚糖硫酸鈉(dextran sodium sulfate, DSS)喂養小鼠建立慢性結腸炎模型,并通過嗅球切除或腦室注射利血平誘導小鼠抑郁,結果發現抑郁可誘導小鼠結腸炎復發。三環類抗抑郁藥可預防抑郁誘導的結腸炎復發,但對無抑郁的結腸炎小鼠無影響[8]。以上證據表明,抑郁與克羅恩病密切相關。然而,關于抑郁如何影響克羅恩病的發生、發展,目前還沒有深入系統的研究。本研究旨在篩選參與抑郁癥加重克羅恩病的關鍵基因,并進一步探討這些關鍵基因的功能,探索其在克羅恩病伴抑郁患者臨床治療中的意義。
1 資料與方法
1.1 數據收集
為研究抑郁癥與克羅恩病基因的重疊,于 2023 年 3 月從公共衛生基因組學知識庫(Public Health Genomics and Precision Health Knowledge Base, PHGKB)中下載抑郁癥相關基因;從基因表達綜合(Gene Expression Omnibus, GEO)數據庫中下載 GSE95095 的表達微陣列數據集和系列矩陣文件,后者包括 GSE112366、GSE107865、GSE94648 和 GSE119600[9]。GSE95095 包括 24 個克羅恩病樣本和 12 個正常樣本;GSE112366 包括 141 例克羅恩病患者和 26 例正常人的微絨毛長度及胃腸道受累情況;GSE107865 包括 17 例克羅恩病患者和 5 例正常人的 C 反應蛋白(C-reactive protein, CRP)和抗腫瘤壞死因子(tumor necrosis factor, TNF)應答數據;GSE94648 包括 50 例克羅恩病患者和 22 例正常人的臨床病理資料,包括克羅恩病內鏡嚴重程度指數(Crohn Disease Endoscopic Index of Severity, CDEIS)、局部 CDEIS、病程、診斷年齡和內鏡活動度;GSE119600 包括 48 個克羅恩病樣本和 47 個正常樣本。研究工作流程見圖1。
 圖1
研究的工作流程
圖1
研究的工作流程
PHGKB:公共衛生基因組學知識庫;GO:基因本體論;KEGG:京都基因與基因組百科全書;MCODE:分子復合物檢測;CDEIS:克羅恩病內鏡嚴重程度指數;TNF:腫瘤壞死因子;ROC:受試者操作特征
1.2 基因表達微陣列分析
通過在線工具 GEO2R 篩選 GSE95095 中克羅恩病患者與正常人的差異表達基因(differentially expressed gene, DEG)[9],以 P<0.05 和|log2FC|>1(FC:fold change,表示兩樣品間表達量的比值)作為本研究篩選 DEG 的臨界標準。使用 ImageGP 繪圖網站構建 GSE95095 的 DEG 火山圖。
1.3 富集分析及關鍵基因篩選
使用在線程序 Metascape 對 DEG 進行基因本體論(gene ontology, GO)和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes, KEGG)途徑富集分析。利用 STRING(Search Tool for the Retrieval of Interacting Genes/Proteins)檢索工具,檢索置信度>0.9 的交互基因數據庫,并隱藏斷開連接的節點,構建可視化的蛋白互作網絡[10]。
關鍵基因的篩選需首先鑒定抑郁癥與克羅恩病的重疊基因,進一步收集富集分析 P<0.01、最小計數為 3、富集因子>1.5 的術語,并根據其成員相似性分組。通過 Metascape 篩選出前 3 個分子復合物檢測(molecular complex detection, MCODE)模塊,鑒定出關鍵基因。最后,利用 GSE112366、GSE107865 和 GSE94648 對不同臨床病理參數(CDEIS、局部 CDEIS、回腸絨毛長度、CRP、病程、確診年齡、內鏡活動度、胃腸道受累情況和抗 TNF 治療應答)進行關聯性分析,鎖定與臨床病理參數顯著關聯的關鍵基因。
1.4 關鍵基因的受試者操作特征(receiver operating characteristic, ROC)曲線分析
采用 ROC 曲線分析關鍵基因區分克羅恩病和正常組織的能力,定義 ROC 曲線下面積>0.5 時具有診斷價值[11]。
1.5 EPIC 網站檢測免疫細胞浸潤
為了比較克羅恩病患者和正常人免疫細胞的浸潤情況,將來自 GSE119600 的 48 份克羅恩病樣本和 47 份正常樣本的基因表達譜上傳至 EPIC 門戶網站,并選擇“血液循環免疫細胞”作為參考譜[12]。用 EPIC 法檢測免疫細胞浸潤情況。
1.6 統計學方法
所有分析均在 R 3.5.3 軟件中進行。正態分布計量資料采用 Student t 檢驗進行統計分析,非正態分布計量資料采用 Mann-Whitney U 檢驗進行統計分析;對于關鍵基因與克羅恩病臨床病理參數關聯性的探討,臨床病理參數為計量資料時采用線性相關分析,臨床病理參數為二分類變量時,按照分類進行分組,并采用 Student t 檢驗或 Mann-Whitney U 檢驗進行差異性分析。檢驗水準為雙側 α=0.05。
2 結果
2.1 識別克羅恩病和抑郁癥之間的重疊 DEG
PHGKB 數據庫中下載抑郁癥相關基因共 628 個;GSE95095 中克羅恩病 DEG 共 3452 個(圖2a),其中 137 個 DEG 與抑郁癥相關基因重疊(圖2b)。
 圖2
篩選克羅恩病和抑郁癥之間的重疊差異表達基因
圖2
篩選克羅恩病和抑郁癥之間的重疊差異表達基因
a. 克羅恩病患者和對照組基因 mRNA 的差異表達;b. 克羅恩病基因和抑郁癥相關基因中的重疊差異表達基因
2.2 重疊 DEG 分析及關鍵基因鑒定
GO 分析結果顯示了重疊 DEG 的前 20 個富集項,涉及分泌調節、行為調節、血液循環調節和系統過程調節等(圖3a)。KEGG 通路分析結果如圖3b 所示,神經活性配體-受體相互作用、鈣信號通路、細胞因子-細胞因子受體相互作用、絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信號通路、環磷酸腺苷信號通路與抑郁癥和克羅恩病的重疊 DEG 高度相關。利用 STRING 工具構建可視化蛋白互作網絡,最終的網絡有 134 個節點和 154 條邊(圖3c)。
 圖3
重疊差異表達基因分析及關鍵基因鑒定
圖3
重疊差異表達基因分析及關鍵基因鑒定
a. 富集分析的前 20 個富集項;b. KEGG 通路分析;c. STRING 構建可視化蛋白互作網絡;d. 前 3 個 MCODE。KEGG:京都基因與基因組百科全書;MAPK:絲裂原活化蛋白激酶;cAMP:環磷酸腺苷;FoxO:叉頭框蛋白 O;MCODE:分子復合物檢測
我們通過 MCODE 插件從 Cytoscape 創建的整個網絡中篩選出關鍵模塊,建立了 3 個 MCODE,鑒定出 25 個關鍵基因(圖3d),包括 EGFR、SIRT1、TP53、STIP1、FKBP5、MAPT、PPARGC1A、ADORA1、PER2、NR1I2、CHRM2、GRM8、CREB1、PROK2、AVP、ADRA1A、NTSR1、OXTR、AVPR1A、HTR2B、OXT、ADCYAP1、POMC、ADRB3 和 ADORA2A。
2.3 克羅恩病患者異常表達的關鍵基因與臨床病理參數的關聯性
我們進一步探討了上述篩選出的 25 個關鍵基因與不同臨床病理參數(CDEIS、局部 CDEIS、回腸絨毛長度、CRP、病程、確診年齡、內鏡活動度、胃腸道受累情況和抗 TNF 治療應答)的關聯性,最終鎖定了 16 個與不同臨床病理參數顯著關聯的關鍵基因,包括 ADCYAP1、AVP、CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、ADORA2A、CHRM2、NR1I2、HTR2B、PPARGC1A、TP53 和 ADORA1(表1)。其中,CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、HTR2B、PPARGC1A 與本研究中多個臨床參數均顯著關聯,意味著它們與克羅恩病的發生和發展有更強的關聯,提示它們可能可作為未來研究的關鍵基因。
2.4 關鍵基因的 ROC 曲線分析
采用 ROC 曲線分析關鍵基因區分克羅恩病和正常組織的能力,16 個關鍵基因的 ROC 曲線下面積均大于 0.5,除 POMC 基因,其余 15 個關鍵基因的 ROC 曲線下面積的 95%CI 均不包括 0.5,并且這 15 個關鍵基因的 ROC 曲線下面積均大于 0.7,具有中等及以上的診斷價值(圖4)。
 圖4
關鍵基因的 ROC 曲線分析
圖4
關鍵基因的 ROC 曲線分析
a.
2.5 PROK2 相關基因的鑒定及功能富集分析
PROK2 與內鏡評分 CDEIS 和客觀的炎性指標 CRP 呈正相關,且在活動期克羅恩病患者中的轉錄水平明顯高于非活動期克羅恩病患者,此外,ROC 曲線分析表明 PROK2 對克羅恩病有優異的診斷價值。因此,我們對 PROK2 進行了更為豐富的數據分析。我們使用 GeneMANIA 插件探索 PROK2 的相關基因(圖5a),并對 PROK2 相關基因進行了富集分析,發現這些基因主要富集在對真菌的反應、中性粒細胞和粒細胞的遷移、中性粒細胞和粒細胞的趨化、炎癥反應的正向調節等方面(圖5b)。PROK2 和 PROK2 相關基因與炎癥反應的調節似乎有著重要的聯系,這種聯系很可能是通過調節免疫細胞,特別是中性粒細胞和粒細胞來實現的。接下來我們試圖比較克羅恩病患者和正常人的免疫細胞浸潤,以進一步驗證這一假設。
 圖5
PROK2 相關基因的鑒定及功能富集分析
圖5
PROK2 相關基因的鑒定及功能富集分析
a. 與
2.6 EPIC 檢測免疫細胞浸潤
97 份樣本(48 份克羅恩病樣本和 47 份正常樣本)的 7 種免疫細胞的浸潤比例和 7 種細胞的熱圖見附件圖1。我們比較兩組人群的免疫細胞浸潤情況(圖6),發現克羅恩病患者的中性粒細胞比例高于對照組,而 CD8+ T 細胞比例低于對照組,但差異無統計學意義(P>0.05)。
 圖6
克羅恩病患者與正常人不同免疫細胞比例的差異
圖6
克羅恩病患者與正常人不同免疫細胞比例的差異
3 討論
克羅恩病是一種反復發作的胃腸道慢性非特異性的炎癥性疾病,可累及口腔到肛門整個消化道,目前尚不可治愈,給患者及其家庭帶來巨大的經濟及心理負擔[13]。多項研究報道,伴抑郁的克羅恩病患者生活質量更差,手術率、相關殘疾率、住院和臨床復發的風險更高[14-16]。以往的研究已經發現克羅恩病與抑郁癥之間密切相關,抑郁癥可能是克羅恩病惡化的原因,而不是結果[7]。因此,探討抑郁癥如何加重克羅恩病具有重要意義。本研究應用生物信息學綜合分析方法,對抑郁癥加重克羅恩病的關鍵基因、途徑、功能和免疫細胞進行了分析。
我們發現克羅恩病和抑郁癥之間共有 137 個重疊 DEG。KEGG 分析重疊 DEG 主要涉及神經活性配體-受體相互作用、鈣信號通路、細胞因子-細胞因子受體相互作用、MAPK 信號通路等,與先前在“腸-腦軸”以及 IBD 的發病、加重和復發方面的研究結果一致。既往的研究表明,神經活性配體,如 γ-氨基丁酸、多巴胺、去甲腎上腺素和谷氨酸,在“腸-腦軸”的相互交流中發揮著重要作用[17]。最近的一項研究發現鈣信號通路也參與調節 IBD 的腸道運動[18]。MAPK 信號通路和細胞因子網絡在腸道生理和病理條件中發揮關鍵作用,是腸道內穩態的重要基石[19]。因此,信號通路和細胞因子網絡的紊亂可能誘導 IBD 的發作。
根據富集和臨床關聯性的分析結果,我們共鑒定出 16 個關鍵基因,包括 ADCYAP1、AVP、CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、ADORA2A、CHRM2、NR1I2、HTR2B、PPARGC1A、TP53 和 ADORA1。CDEIS 通常用于評估克羅恩病嚴重程度[20]。FKBP5、NTSR1、PROK2 與 CDEIS 呈正相關,MAPT、HTR2B、TP53 與 CDEIS 呈負相關。此外,FKBP5、OXTR 與局部 CDEIS 呈正相關,MAPT、HTR2B 與局部 CDEIS 呈負相關。在克羅恩病患者中,腸道微絨毛長度的減少可能與上皮功能障礙和疾病的慢性進展有關[21]。POMC 和 NR1I2 的轉錄水平分別與腸道微絨毛長度呈負相關和正相關。作為一種非特異性生物標志物,CRP 水平的升高與炎癥反應密切相關[22]。PROK2、ADORA1 與 CRP 呈正相關,CREB1、CHRM2 與 CRP 呈負相關。內鏡下活動性病變的克羅恩病患者 AVP、CREB1、FKBP5、NTSR1、OXTR、PROK2 和 POMC 顯著高于內鏡下無活動性病變的克羅恩病患者,而 ADCYAP1、ADORA2A 和 MAPT 顯著低于無內鏡下活動性病變的克羅恩病患者。根據這些結果,FKBP5、NTSR1、OXTR、PROK2 和 POMC 的轉錄水平升高可能意味著更強烈炎癥反應和更差的疾病狀態,而 MAPT 和 HTR2B 的表達增加可能在克羅恩病的發生發展中起保護作用。關鍵基因 HTR2B 和 PPARGC1A 的表達差異,也提示著克羅恩病患者受累的腸道部位不同。此外,我們檢測到 PPARGC1A 的高表達與抗 TNF 藥物治療應答相關。
FKBP5 是位于 6 號染色體上的蛋白質編碼基因。FKBP5-核因子 κB(nuclear factor kappa-B, NF-κB)信號通路存在一個正反饋環路,較高的 FKBP5 可以通過加強 NF-κB 調節激酶的相互作用來促進炎癥[23]。MAPT 作為一種功能性候選基因,已被報道參與克羅恩病的易感性[24]。NTSR1,可以通過與神經降壓素結合介導結腸炎癥,NTSR1 在正常腸道黏膜中幾乎沒有表達,但在結腸炎中表達顯著增加,并且 NTSR1 拮抗劑可以抑制艱難梭菌引起的腸道炎癥[25]。此外,與野生型小鼠相比,NTSR1-/-小鼠對 DSS 誘導的死亡率有更強的抵抗力[26]。OXTR 是一種催產素受體,是一種急性時相蛋白,在巨噬細胞的細胞炎癥反應中發揮作用,可被催產素激活并受 NF-κB 調節[27]。OXTR 髓系缺陷小鼠對 DSS 誘導結腸炎的易感性高于野生型小鼠[28]。POMC 的基因產物黑皮質素參與抑制中性粒細胞遷移和趨化因子生成[29],根據其抗炎作用,黑皮質素具有潛在的治療作用,并且在臨床前研究中對急性、慢性和全身性炎癥性疾病有顯著的治療效果[30]。HTR2B 已經被發現可以通過調節巨噬細胞的表型和功能極化,維持抗炎狀態[31]。PPARGC1A 是克羅恩病易感性相關的候選基因[32]。CREB1 是一種轉錄因子,介導許多細胞反應,如增殖、存活和分化。CREB 可由炎癥信號誘導,在多種炎癥反應中發揮作用,包括抗巨噬細胞和中性粒細胞的凋亡,T 細胞和 B 細胞的增殖和存活以及調節不同輔助性 T 細胞的免疫反應[33]。
PROK2 主要由組織損傷部位的巨噬細胞和中性粒細胞產生,既往研究發現,在 IBD 患者和其他結腸炎模型的樣本中,炎癥期間 PROK2 在胃腸道中的表達顯著升高[34]。與此一致,我們的研究發現 PROK2 與 CDEIS 評分和 CRP 水平呈正相關,且在活動期克羅恩病患者中的表達水平明顯高于非活動期克羅恩病患者。此外,進一步的 ROC 分析表明 PROK2 對克羅恩病的診斷有優異價值,多篇研究也報道了相似的結果[35-36],因此,我們對 PROK2 進行了更為豐富的數據分析。前動力蛋白 2(prokineticin 2, PK2)是由 PROK2 編碼的趨化因子。PK2 首先被發現是一種有效調節腸道運動的因子,并進一步被發現參與多種生理活動,如血管生成、神經發生、腸道離子轉運等[37]。除此以外,PK2 會促進單核細胞/巨噬細胞的遷移以及中性粒細胞的趨化,并誘導巨噬細胞和 T 淋巴細胞向促炎譜分化[38],促進促炎細胞因子的產生并減少抗炎細胞因子的產生[39]。PROK2 的表達升高可能預示著更嚴重的胃腸道炎癥。在我們的研究中,PROK2 和 PROK2 相關基因功能主要富集于對真菌的反應、中性粒細胞遷移、中性粒細胞趨化、炎癥反應的正調控等。進一步的免疫細胞浸潤結果顯示,克羅恩病患者中性粒細胞比例高于對照組,CD8+ T 細胞比例低于對照組,雖差異無統計學意義(P>0.05,可能與樣本量少有關),但仍提示中性粒細胞和 CD8+ T 細胞可能參與了抑郁癥所致克羅恩病的發病、加重和復發,有待進一步研究。
綜上所述,本研究利用生物信息學方法探討了克羅恩病與抑郁癥共病的關鍵基因、通路、功能以及免疫細胞,并報道了關鍵基因 CREB1、FKBP5、MAPT、NTSR1、OXTR、PROK2、POMC、HTR2B 和 PPARGC1A 可能參與抑郁癥所致的克羅恩病惡化,其中,PROK2 可能通過調節中性粒細胞和 CD8+ T 細胞的浸潤發揮作用。此外,本研究也存在著一些局限性:第一,本研究的發現沒有擴展到基礎實驗和臨床試驗;第二,本研究中使用的數據集并非來自同一平臺,這可能會引入一些錯誤。未來需要進一步的研究來證實和驗證這些發現。
利益沖突:所有作者聲明不存在利益沖突。
請掃描本文首頁二維碼后在“補充材料”中下載查看附件。