引用本文: 夏慶玲, 李艷, 康婷, 朱婷婷, 吳蔚樺, 歐三桃. 鳶尾素在腺嘌呤誘導慢性腎病大鼠模型中的表達及意義. 華西醫學, 2024, 39(2): 268-274. doi: 10.7507/1002-0179.202308009 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
腎纖維化(renal fibrosis, RF)是細胞外基質在腎臟廣泛沉積引起的病理改變,主要包括腎小球硬化、間質纖維化及動脈硬化等,是發展為終末期腎病的最主要病理改變和共同通路。延緩 RF 是防止各種慢性腎臟疾病進展的中心環節[1],但其發病機制目前仍不完全清楚,也缺乏針對的特異靶向治療。鳶尾素是一種新發現的肌細胞因子,Ⅲ型纖連蛋白結構域蛋白 5(recombinant fibronectin type Ⅲ domain containing protein 5, Fndc5)是鳶尾素的前體,其水解生成鳶尾素,后以同型二聚體形式存在于血液循環中[2]。鳶尾素與肝臟[3]、心臟[4]、胰腺纖維化[5]密切相關,但對 RF 的研究較少,僅少量研究發現鳶尾素可通過抑制轉化生長因子-β家族(transforming growth factor-β, TGF-β)/smad 途徑減輕 RF [6]。骨形態發生蛋白 7(bone morphogenetic protein 7, BMP7)是 TGF-β的成員之一,是一種重要的抗纖維化因子[7],以 TGF-β途徑依賴的方式,通過其下游的 Smad 信號通路參與調節 RF。BMP-7 可通過啟動 Smad1 抑制 TGF-β信號傳導減輕 RF [8]。目前尚無研究探討鳶尾素、BMP7/Smad1 信號通路與 RF 的相關性。因此,本研究探討了腺嘌呤誘導慢性腎病(chronic kidney disease, CKD)大鼠模型中鳶尾素的表達水平變化,及是否可通過調節 BMP7/Smad1 信號通路參與 RF 進程,從而為其防治提供新靶點。
1 材料與方法
1.1 材料
1.1.1 實驗動物
購自西南醫科大學實驗動物中心的 8 周齡雄性無特定病原體(SPF)級 SD 大鼠 20 只,體重(200±20)g,生產許可證號為 SCXK(川)2018-17,使用許可證號為 SYXK(川)2018-065,并遵循實驗動物的 3R 原則,已通過西南醫科大學實驗動物福利倫理審查(swmu20230062)。
1.1.2 主要試劑與儀器
腺嘌呤(美國 Sigma 公司);α-SMA 抗體(美國 CST 公司);Col-Ⅰ抗體(中國博士德生物公司);BMP7 抗體(中國武漢三鷹公司);Smad1 抗體(中國博士德生物公司);蘇木精-伊紅(hematoxylin-eosin staining, HE)染色試劑盒(中國碧云天公司);Masson 染色試劑盒(中國珠海貝索公司);兔二步法檢測試劑盒(中國中杉金橋公司);二氨基聯苯胺法顯色試劑盒(中國索萊寶公司);組織中總 RNA 提取、逆轉錄、實時熒光定量聚合酶鏈反應試劑盒(中國諾維贊公司);光學顯微鏡(日本尼康公司);全自動酶標儀(美國伯騰公司);RNA 逆轉錄儀、聚合酶鏈反應(polymerase chain reaction, PCR)核酸擴增儀(德國艾本德公司)。
1.2 方法
1.2.1 實驗動物分組與模型建立
20 只 SD 雄性大鼠經過適應喂養,采用簡單隨機法將其分為對照組和模型組(CKD 組),每組各 10 只。CKD 組給予 2.5%的腺嘌呤 250 mg/(kg·d)灌胃,對照組給予相應劑量 0.9%氯化鈉灌胃。
1.2.2 實驗標本的收集
于建模后第 2、4 周末分別從兩組大鼠中每組隨機選取 5 只于代謝籠中收集 24 h 尿液,用于檢測 24 h 蛋白尿定量;在戊巴比妥鈉麻醉狀態下經腹主動脈采血留取血液標本,用于檢測血清肌酐、尿素氮、鳶尾素、BMP7 水平;留取腎臟組織標本,將其縱切為 2 個部分,其中一部分置于 4%多聚甲醛液浸泡固定,用于石蠟包埋進行病理染色,另一部分即置于 RNA 保存液中保存,儲存于?80℃用于腎臟組織信使 RNA(messenger RNA, mRNA)檢測。
1.2.3 腎臟組織 HE 染色
石蠟包埋腎臟組織切 4 μm 薄片,置于 65℃烘箱 2 h,常規脫蠟至水,使用蘇木素染液染細胞核 5 min,伊紅染色液染細胞質 30 s,脫水透明后中性樹膠封片,最后于光鏡下(200 倍)觀察、拍片。
1.2.4 腎臟組織 Masson 染色
石蠟薄片 65℃烤 2 h,常規脫蠟至水,鐵蘇木素混合液染 8 min、麗春紅染 7 min、磷鉬酸分色 4 min、甲苯胺藍染 4 min,1%冰醋酸沖洗 2 min,脫水透明后中性樹膠封片,最后于光鏡下(200 倍)觀察、拍片。
1.2.5 免疫組織化學
將保存于 4%多聚甲醛液中的腎臟組織進行石蠟包埋,石蠟切片置于 65℃孵箱中 2 h,常規脫蠟至水,磷酸鹽緩沖液(phosphate buffered saline, PBS)沖洗,置于檸檬酸三鈉緩沖液中采取微波爐中火進行抗原修復,自然冷卻后滴加 3%過氧化物酶阻斷劑于切片上避光室溫孵育 10 min 阻斷內源性過氧化物酶,PBS 緩沖液沖洗,室溫下 10%山羊血清封閉 10 min 減少非特異染色,分別滴加一抗α-SMA、Col-Ⅰ、BMP7、Smad1,其稀釋倍數均為 1∶200,4℃過夜孵育一抗,PBS 沖洗,滴加二抗室溫孵育 20 min,辣根標記過氧化物酶 20 min,PBS 沖洗后使用二氨基聯苯胺法工作液鏡下控制顯色,終止顯色后蘇木素復染 20 s,經脫水、脫蠟、晾干后封片,最后于光鏡下(200 倍)進行觀察和拍片,采用 image J 軟件進行半定量分析。
1.2.6 腎臟組織總 RNA 提取及實時熒光定量 PCR
取 50 mg 腎組織塊加入 1 mL Trizol 充分裂解,按 RNA 提取說明書按步驟提取 RNA 并測定 RNA 濃度及質量,使用逆轉錄試劑逆轉錄為成 cDNA 后實時熒光定量 PCR 試劑盒進行 PCR 擴增。引物由上海生工公司合成,序列見表1。
1.2.7 基因表達驗證
利用基因表達綜合(Gene Expression Omnibus, GEO)數據庫搜索腺嘌呤誘導的 CKD 模型基因芯片驗證。
1.3 統計學方法
使用 GraphPad Prism 9.0 軟件進行數據分析。呈正態分布的計量資料以均數±標準差表示,采用獨立樣本 t 檢驗進行組間比較。血清鳶尾素分別與 α-SMA、Col-Ⅰ、血清 BMP7 的相關性,及腎臟組織 BMP7 與 Smad1 的相關性分析采用 Pearson 檢驗。計數資料以只數和百分比表示。雙側檢驗水準α=0.05。
2 結果
2.1 大鼠生化指標、血清鳶尾素和 BMP7 水平變化
兩組大鼠生化指標、血清鳶尾素和 BMP7 水平變化見表2。組間比較顯示,在建模后第 2、4 周末時,CKD 組大鼠的血清肌酐、尿素氮及 24 h 蛋白尿定量水平均高于對照組(P<0.05),血清鳶尾素和 BMP7 均低于對照組(P<0.05)。組內比較顯示,在建模后第 4 周末時,CKD 組的血清肌酐、尿素氮及 24 h 蛋白尿定量水平均高于建模后第 2 周末(P<0.05),血清鳶尾素和 BMP7 均低于建模后第 2 周末(P<0.05)。
2.2 大鼠腎臟病理情況
兩組大鼠腎臟組織染色彩色像見圖1。由圖1a 可見,對照組大鼠腎臟組織中各結構均未見明顯異常;CKD 組可見腎臟組織結構紊亂,并隨著時間進展,可見腎小球萎縮、數量減少,腎小管管腔明顯擴張、斷裂,管腔內棕黃色沉積增多。由圖1b 可見,對照組大鼠腎間質未見明顯膠原纖維沉積;CKD 組腎間質可見大量藍色膠原纖維沉積,并隨著時間進展加重。
 圖1
兩組大鼠腎臟組織染色彩色像(×200)
圖1
兩組大鼠腎臟組織染色彩色像(×200)
a. HE 染色;b. Masson 染色
2.3 大鼠腎臟組織α-SMA、Col-Ⅰ、BMP7、Smad1 蛋白表達水平變化
兩組大鼠腎臟組織 α-SMA、Col-Ⅰ、BMP7、Smad1 蛋白表達水平變化見圖2、表3。組間比較顯示,在建模后第 2、4 周末時,CKD 組的α-SMA、Col-Ⅰ蛋白表達水平均高于對照組(P<0.05),BMP7、Smad1 蛋白表達均低于對照組(P<0.05)。組內比較顯示,在建模后第 4 周末時,CKD 組的α-SMA、Col-Ⅰ 蛋白表達水平均高于建模后第 2 周末(P<0.05),BMP7、Smad1 蛋白表達水平均低于建模后第 2 周末(P<0.05)。
 圖2
兩組大鼠腎臟α-SMA、Col-Ⅰ、BMP7、Smad1 免疫組織化學染色圖
圖2
兩組大鼠腎臟α-SMA、Col-Ⅰ、BMP7、Smad1 免疫組織化學染色圖
a. α-SMA;b. Col-Ⅰ;c. BMP7;d. Smad1
2.4 大鼠腎臟組織α-SMA、Col-Ⅰ、BMP7、Smad1 mRNA 表達水平
兩組大鼠腎臟組織α-SMA、Col-Ⅰ、BMP7、Smad1 mRNA 表達水平見表4。組間比較顯示,在建模后第 2、4 周末,CKD 組大鼠的α-SMA、Col-Ⅰ mRNA 表達水平均高于對照組(P<0.05),BMP7、Smad1 mRNA 表達水平均低于對照組(P<0.05)。組內比較顯示,在建模后第 4 周末時,CKD 組的α-SMA、Col-Ⅰ mRNA 表達水平均高于建模后第 2 周末(P<0.05),BMP7、Smad1 mRNA 表達水平均低于建模后第 2 周末(P<0.05)。
2.5 大鼠各指標間相關性分析
血清鳶尾素與 α-SMA、 Col-Ⅰ 均呈負相關(r=?0.917、?0.902,P<0.001),與血清 BMP7 呈正相關(r=0.842,P<0.001);腎臟組織 BMP7 與 Smad1 呈正相關(r=0.884,P<0.001)。
2.6 CKD 基因數據分析
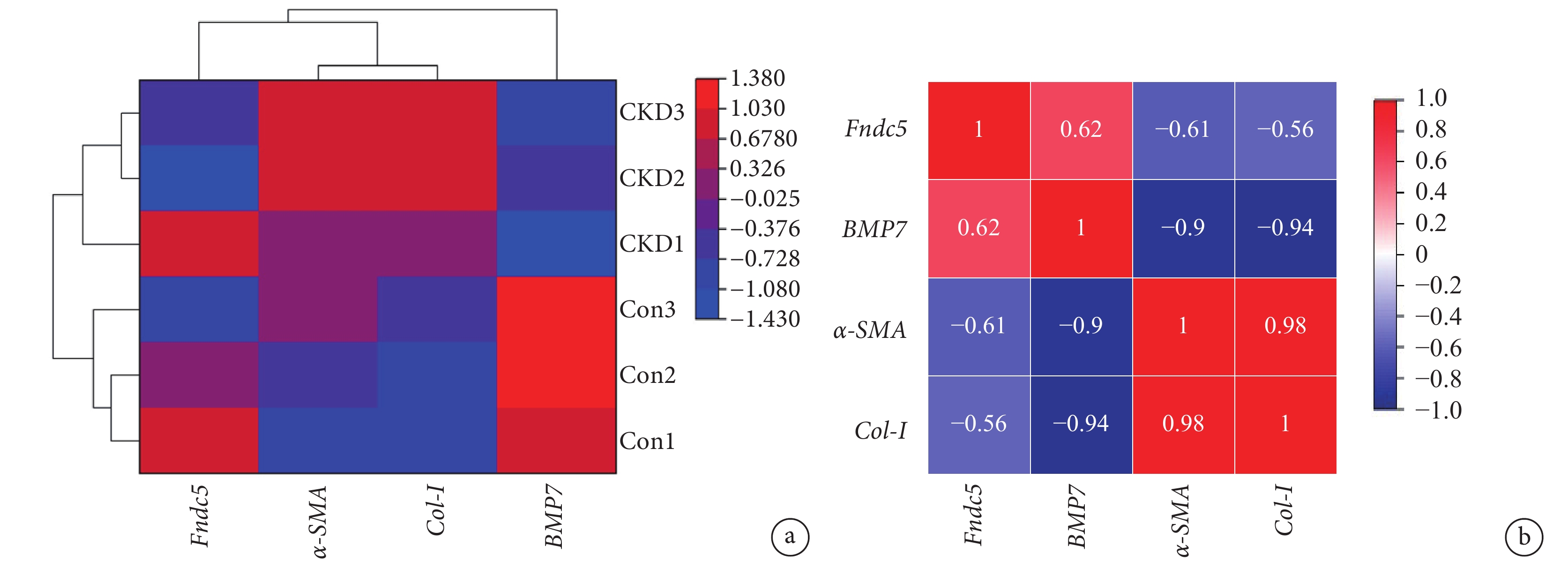
利用 GEO 數據庫下載腺嘌呤誘導的 CKD 模型 GSE221598 基因芯片進行驗證,篩選出目的基因進行熱圖分析結果(圖3)顯示,與對照組相比,CKD 組中 BMP7 及鳶尾素的前體 Fndc5 表達下調,α-SMA 和 Col-Ⅰ表達上調(圖3a);Fndc5 與 BMP7 呈正相關,與 Col-Ⅰ、α-SMA 呈負相關(圖3b)。
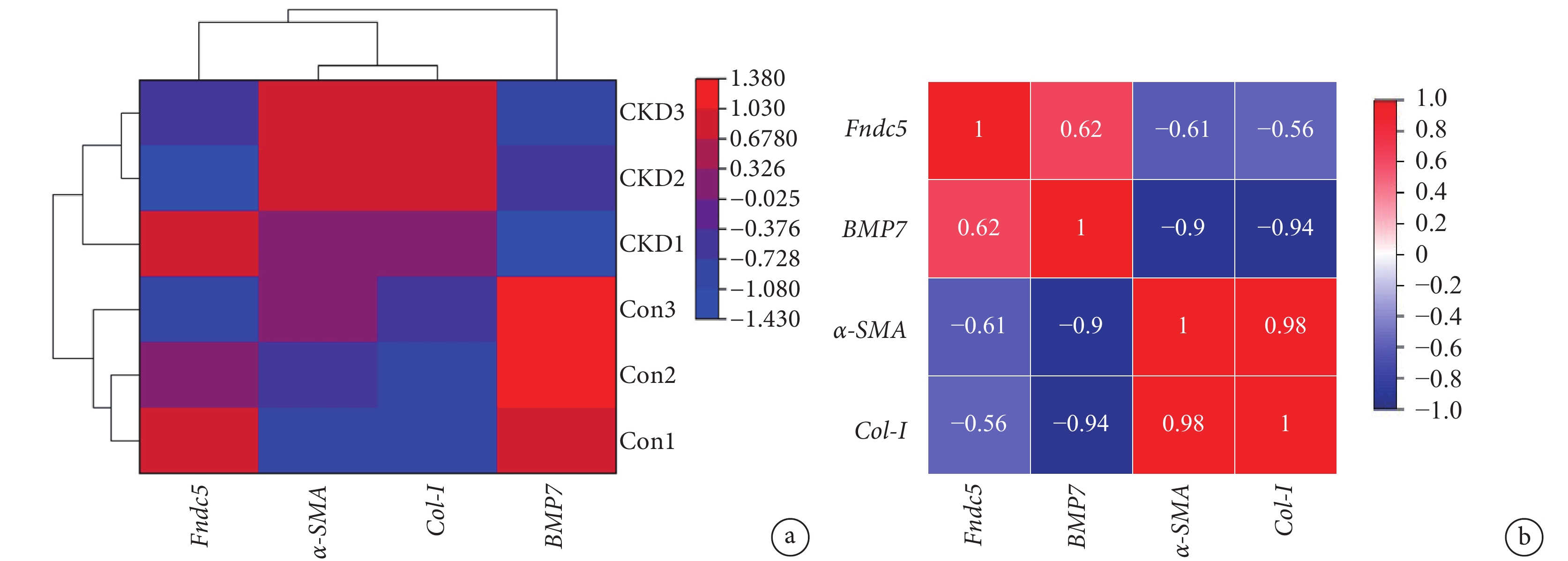 圖3
目的基因熱圖分析
圖3
目的基因熱圖分析
a. 各目的基因在腺嘌呤誘導的 CKD 模型中的表達情況;b. 腺嘌呤誘導的 CKD 模型中各目的基因相關性分析。熱圖中方格的紅色越深,表示相對豐度或相關性越強;藍色越深表示相對豐度或相關性越弱。CKD:慢性腎病
3 討論
RF 是由損傷、炎癥、缺氧等多種致病因素參與的多種類型的腎臟疾病的共同病理變化,主要表現為細胞外基質在腎間質、系膜等處的沉積[9-10],進行性的 RF 最終會導致嚴重且不可逆的腎臟功能衰竭。RF 的發病機制尚未明確,目前臨床上缺乏有效的手段逆轉,對新的相關信號通路進一步探索,有助于了解 RF 的發生機制,有助于發現防治 RF 的新方法。
采用低劑量腺嘌呤灌胃誘導 CKD 大鼠是研究病理機制理想的動物模型,其損傷更接近于臨床上 RF 的發生發展進程[11]。本研究采用該方法進行建模,可見與對照組相比,CKD 組大鼠血清肌酐和尿素氮水平明顯升高,Masson 染色見腎間質大量膠原纖維沉積,纖維化標志物α-SMA、Col-Ⅰ的蛋白及 mRNA 表達水平均升高,且隨著病程進展逐漸加重,表明成功建立了 CKD 的 RF 模型。
鳶尾素是一種釋放于血液循環中的新型肌細胞因子,參與糖脂代謝、氧化應激、炎癥、神經分化、腫瘤轉移等過程[12-13]。Zhang 等[14]研究發現鳶尾素可保護腎線粒體功能,改善腎臟能量代謝,并減少腎臟氧化應激和炎癥,提示其具有腎臟保護作用,并可能成為未來有效治療腎臟疾病的新靶點。有研究表明,鳶尾素可通過 TGF-β/Smad 信號通路改善肝臟、心臟、胰腺等臟器纖維化,但鳶尾素在 RF 中的研究相對較少。Jiang 等[15]發現鳶尾素可抑制腎臟細胞外基質的堆積。研究顯示在葉酸誘導的 RF 模型中,鳶尾素可通過抑制 TGF-β/Smad 信號通路,改善腎臟能量代謝并抑制 RF[6]。本研究亦發現,CKD 組大鼠血清鳶尾素水平低于對照組,并隨著時間進展降低;利用 GEO 數據庫對腺嘌呤誘導的 CKD 模型的 RNA 數據進行分析提示 CKD 組中鳶尾素的前體 Fndc5 表達下調,而α-SMA 和 Col-Ⅰ表達上調,提示鳶尾素可能參與 CKD 的 RF 發生發展,值得進一步深入探討。
BMP7 是 TGF-β超家族中 BMP 家族的一員,被認為是一種抗 TGF-β樣因子[16],外源性使用 BMP7 可減少腎小管上皮細胞凋亡及細胞外基質沉積,發揮一定的抗 RF 作用[17]。Smads 蛋白是 TGF-β家族下游的信號轉導蛋白,BMP7 主要通過 Smad 蛋白介導的經典途徑和獨立于 Smad 蛋白的非經典途徑發揮作用[18]。目前有研究表明,BMP7 可通過啟動 Smad1 減輕 RF[17,19-20]。本研究發現 CKD 組大鼠腎臟的 BMP7 和 Smad1 的蛋白和 mRNA 表達水平均低于對照組,血清鳶尾素和 BMP7 水平低于對照組,且在腺嘌呤誘導 RF 形成的早期即可檢測出血清鳶尾素水平在 CKD 組與對照組的顯著變化,表明在 RF 形成的早期階段,鳶尾素已可發揮防治作用,并其作用可持續到 RF 晚期。對腺嘌呤誘導的 CKD 模型的 RNA 測序結果進行分析同樣提示,與對照組相比,CKD 組鳶尾素的前體 Fndc5 和 BMP7 表達下調,α-SMA 和 Col-Ⅰ表達上調。對鳶尾素和 BMP7 進行相關性分析提示血清鳶尾素和 BMP7 水平呈正相關,而腎組織 BMP7 與 Smad1 呈正相關。因此,可推測鳶尾素可能通過影響 BMP7/Smad1 發揮抗 RF 作用。
綜上所述,本研究通過建立腺嘌呤誘導的 CKD 的 RF 模型,提示鳶尾素可能參與了 RF 的進程,并且可能通過調節 BMP7/smad1 信號通路發揮抗 RF 作用,有望成為 RF 防治的新靶點。
利益沖突:所有作者聲明不存在利益沖突。
腎纖維化(renal fibrosis, RF)是細胞外基質在腎臟廣泛沉積引起的病理改變,主要包括腎小球硬化、間質纖維化及動脈硬化等,是發展為終末期腎病的最主要病理改變和共同通路。延緩 RF 是防止各種慢性腎臟疾病進展的中心環節[1],但其發病機制目前仍不完全清楚,也缺乏針對的特異靶向治療。鳶尾素是一種新發現的肌細胞因子,Ⅲ型纖連蛋白結構域蛋白 5(recombinant fibronectin type Ⅲ domain containing protein 5, Fndc5)是鳶尾素的前體,其水解生成鳶尾素,后以同型二聚體形式存在于血液循環中[2]。鳶尾素與肝臟[3]、心臟[4]、胰腺纖維化[5]密切相關,但對 RF 的研究較少,僅少量研究發現鳶尾素可通過抑制轉化生長因子-β家族(transforming growth factor-β, TGF-β)/smad 途徑減輕 RF [6]。骨形態發生蛋白 7(bone morphogenetic protein 7, BMP7)是 TGF-β的成員之一,是一種重要的抗纖維化因子[7],以 TGF-β途徑依賴的方式,通過其下游的 Smad 信號通路參與調節 RF。BMP-7 可通過啟動 Smad1 抑制 TGF-β信號傳導減輕 RF [8]。目前尚無研究探討鳶尾素、BMP7/Smad1 信號通路與 RF 的相關性。因此,本研究探討了腺嘌呤誘導慢性腎病(chronic kidney disease, CKD)大鼠模型中鳶尾素的表達水平變化,及是否可通過調節 BMP7/Smad1 信號通路參與 RF 進程,從而為其防治提供新靶點。
1 材料與方法
1.1 材料
1.1.1 實驗動物
購自西南醫科大學實驗動物中心的 8 周齡雄性無特定病原體(SPF)級 SD 大鼠 20 只,體重(200±20)g,生產許可證號為 SCXK(川)2018-17,使用許可證號為 SYXK(川)2018-065,并遵循實驗動物的 3R 原則,已通過西南醫科大學實驗動物福利倫理審查(swmu20230062)。
1.1.2 主要試劑與儀器
腺嘌呤(美國 Sigma 公司);α-SMA 抗體(美國 CST 公司);Col-Ⅰ抗體(中國博士德生物公司);BMP7 抗體(中國武漢三鷹公司);Smad1 抗體(中國博士德生物公司);蘇木精-伊紅(hematoxylin-eosin staining, HE)染色試劑盒(中國碧云天公司);Masson 染色試劑盒(中國珠海貝索公司);兔二步法檢測試劑盒(中國中杉金橋公司);二氨基聯苯胺法顯色試劑盒(中國索萊寶公司);組織中總 RNA 提取、逆轉錄、實時熒光定量聚合酶鏈反應試劑盒(中國諾維贊公司);光學顯微鏡(日本尼康公司);全自動酶標儀(美國伯騰公司);RNA 逆轉錄儀、聚合酶鏈反應(polymerase chain reaction, PCR)核酸擴增儀(德國艾本德公司)。
1.2 方法
1.2.1 實驗動物分組與模型建立
20 只 SD 雄性大鼠經過適應喂養,采用簡單隨機法將其分為對照組和模型組(CKD 組),每組各 10 只。CKD 組給予 2.5%的腺嘌呤 250 mg/(kg·d)灌胃,對照組給予相應劑量 0.9%氯化鈉灌胃。
1.2.2 實驗標本的收集
于建模后第 2、4 周末分別從兩組大鼠中每組隨機選取 5 只于代謝籠中收集 24 h 尿液,用于檢測 24 h 蛋白尿定量;在戊巴比妥鈉麻醉狀態下經腹主動脈采血留取血液標本,用于檢測血清肌酐、尿素氮、鳶尾素、BMP7 水平;留取腎臟組織標本,將其縱切為 2 個部分,其中一部分置于 4%多聚甲醛液浸泡固定,用于石蠟包埋進行病理染色,另一部分即置于 RNA 保存液中保存,儲存于?80℃用于腎臟組織信使 RNA(messenger RNA, mRNA)檢測。
1.2.3 腎臟組織 HE 染色
石蠟包埋腎臟組織切 4 μm 薄片,置于 65℃烘箱 2 h,常規脫蠟至水,使用蘇木素染液染細胞核 5 min,伊紅染色液染細胞質 30 s,脫水透明后中性樹膠封片,最后于光鏡下(200 倍)觀察、拍片。
1.2.4 腎臟組織 Masson 染色
石蠟薄片 65℃烤 2 h,常規脫蠟至水,鐵蘇木素混合液染 8 min、麗春紅染 7 min、磷鉬酸分色 4 min、甲苯胺藍染 4 min,1%冰醋酸沖洗 2 min,脫水透明后中性樹膠封片,最后于光鏡下(200 倍)觀察、拍片。
1.2.5 免疫組織化學
將保存于 4%多聚甲醛液中的腎臟組織進行石蠟包埋,石蠟切片置于 65℃孵箱中 2 h,常規脫蠟至水,磷酸鹽緩沖液(phosphate buffered saline, PBS)沖洗,置于檸檬酸三鈉緩沖液中采取微波爐中火進行抗原修復,自然冷卻后滴加 3%過氧化物酶阻斷劑于切片上避光室溫孵育 10 min 阻斷內源性過氧化物酶,PBS 緩沖液沖洗,室溫下 10%山羊血清封閉 10 min 減少非特異染色,分別滴加一抗α-SMA、Col-Ⅰ、BMP7、Smad1,其稀釋倍數均為 1∶200,4℃過夜孵育一抗,PBS 沖洗,滴加二抗室溫孵育 20 min,辣根標記過氧化物酶 20 min,PBS 沖洗后使用二氨基聯苯胺法工作液鏡下控制顯色,終止顯色后蘇木素復染 20 s,經脫水、脫蠟、晾干后封片,最后于光鏡下(200 倍)進行觀察和拍片,采用 image J 軟件進行半定量分析。
1.2.6 腎臟組織總 RNA 提取及實時熒光定量 PCR
取 50 mg 腎組織塊加入 1 mL Trizol 充分裂解,按 RNA 提取說明書按步驟提取 RNA 并測定 RNA 濃度及質量,使用逆轉錄試劑逆轉錄為成 cDNA 后實時熒光定量 PCR 試劑盒進行 PCR 擴增。引物由上海生工公司合成,序列見表1。
1.2.7 基因表達驗證
利用基因表達綜合(Gene Expression Omnibus, GEO)數據庫搜索腺嘌呤誘導的 CKD 模型基因芯片驗證。
1.3 統計學方法
使用 GraphPad Prism 9.0 軟件進行數據分析。呈正態分布的計量資料以均數±標準差表示,采用獨立樣本 t 檢驗進行組間比較。血清鳶尾素分別與 α-SMA、Col-Ⅰ、血清 BMP7 的相關性,及腎臟組織 BMP7 與 Smad1 的相關性分析采用 Pearson 檢驗。計數資料以只數和百分比表示。雙側檢驗水準α=0.05。
2 結果
2.1 大鼠生化指標、血清鳶尾素和 BMP7 水平變化
兩組大鼠生化指標、血清鳶尾素和 BMP7 水平變化見表2。組間比較顯示,在建模后第 2、4 周末時,CKD 組大鼠的血清肌酐、尿素氮及 24 h 蛋白尿定量水平均高于對照組(P<0.05),血清鳶尾素和 BMP7 均低于對照組(P<0.05)。組內比較顯示,在建模后第 4 周末時,CKD 組的血清肌酐、尿素氮及 24 h 蛋白尿定量水平均高于建模后第 2 周末(P<0.05),血清鳶尾素和 BMP7 均低于建模后第 2 周末(P<0.05)。
2.2 大鼠腎臟病理情況
兩組大鼠腎臟組織染色彩色像見圖1。由圖1a 可見,對照組大鼠腎臟組織中各結構均未見明顯異常;CKD 組可見腎臟組織結構紊亂,并隨著時間進展,可見腎小球萎縮、數量減少,腎小管管腔明顯擴張、斷裂,管腔內棕黃色沉積增多。由圖1b 可見,對照組大鼠腎間質未見明顯膠原纖維沉積;CKD 組腎間質可見大量藍色膠原纖維沉積,并隨著時間進展加重。
 圖1
兩組大鼠腎臟組織染色彩色像(×200)
圖1
兩組大鼠腎臟組織染色彩色像(×200)
a. HE 染色;b. Masson 染色
2.3 大鼠腎臟組織α-SMA、Col-Ⅰ、BMP7、Smad1 蛋白表達水平變化
兩組大鼠腎臟組織 α-SMA、Col-Ⅰ、BMP7、Smad1 蛋白表達水平變化見圖2、表3。組間比較顯示,在建模后第 2、4 周末時,CKD 組的α-SMA、Col-Ⅰ蛋白表達水平均高于對照組(P<0.05),BMP7、Smad1 蛋白表達均低于對照組(P<0.05)。組內比較顯示,在建模后第 4 周末時,CKD 組的α-SMA、Col-Ⅰ 蛋白表達水平均高于建模后第 2 周末(P<0.05),BMP7、Smad1 蛋白表達水平均低于建模后第 2 周末(P<0.05)。
 圖2
兩組大鼠腎臟α-SMA、Col-Ⅰ、BMP7、Smad1 免疫組織化學染色圖
圖2
兩組大鼠腎臟α-SMA、Col-Ⅰ、BMP7、Smad1 免疫組織化學染色圖
a. α-SMA;b. Col-Ⅰ;c. BMP7;d. Smad1
2.4 大鼠腎臟組織α-SMA、Col-Ⅰ、BMP7、Smad1 mRNA 表達水平
兩組大鼠腎臟組織α-SMA、Col-Ⅰ、BMP7、Smad1 mRNA 表達水平見表4。組間比較顯示,在建模后第 2、4 周末,CKD 組大鼠的α-SMA、Col-Ⅰ mRNA 表達水平均高于對照組(P<0.05),BMP7、Smad1 mRNA 表達水平均低于對照組(P<0.05)。組內比較顯示,在建模后第 4 周末時,CKD 組的α-SMA、Col-Ⅰ mRNA 表達水平均高于建模后第 2 周末(P<0.05),BMP7、Smad1 mRNA 表達水平均低于建模后第 2 周末(P<0.05)。
2.5 大鼠各指標間相關性分析
血清鳶尾素與 α-SMA、 Col-Ⅰ 均呈負相關(r=?0.917、?0.902,P<0.001),與血清 BMP7 呈正相關(r=0.842,P<0.001);腎臟組織 BMP7 與 Smad1 呈正相關(r=0.884,P<0.001)。
2.6 CKD 基因數據分析
利用 GEO 數據庫下載腺嘌呤誘導的 CKD 模型 GSE221598 基因芯片進行驗證,篩選出目的基因進行熱圖分析結果(圖3)顯示,與對照組相比,CKD 組中 BMP7 及鳶尾素的前體 Fndc5 表達下調,α-SMA 和 Col-Ⅰ表達上調(圖3a);Fndc5 與 BMP7 呈正相關,與 Col-Ⅰ、α-SMA 呈負相關(圖3b)。
 圖3
目的基因熱圖分析
圖3
目的基因熱圖分析
a. 各目的基因在腺嘌呤誘導的 CKD 模型中的表達情況;b. 腺嘌呤誘導的 CKD 模型中各目的基因相關性分析。熱圖中方格的紅色越深,表示相對豐度或相關性越強;藍色越深表示相對豐度或相關性越弱。CKD:慢性腎病
3 討論
RF 是由損傷、炎癥、缺氧等多種致病因素參與的多種類型的腎臟疾病的共同病理變化,主要表現為細胞外基質在腎間質、系膜等處的沉積[9-10],進行性的 RF 最終會導致嚴重且不可逆的腎臟功能衰竭。RF 的發病機制尚未明確,目前臨床上缺乏有效的手段逆轉,對新的相關信號通路進一步探索,有助于了解 RF 的發生機制,有助于發現防治 RF 的新方法。
采用低劑量腺嘌呤灌胃誘導 CKD 大鼠是研究病理機制理想的動物模型,其損傷更接近于臨床上 RF 的發生發展進程[11]。本研究采用該方法進行建模,可見與對照組相比,CKD 組大鼠血清肌酐和尿素氮水平明顯升高,Masson 染色見腎間質大量膠原纖維沉積,纖維化標志物α-SMA、Col-Ⅰ的蛋白及 mRNA 表達水平均升高,且隨著病程進展逐漸加重,表明成功建立了 CKD 的 RF 模型。
鳶尾素是一種釋放于血液循環中的新型肌細胞因子,參與糖脂代謝、氧化應激、炎癥、神經分化、腫瘤轉移等過程[12-13]。Zhang 等[14]研究發現鳶尾素可保護腎線粒體功能,改善腎臟能量代謝,并減少腎臟氧化應激和炎癥,提示其具有腎臟保護作用,并可能成為未來有效治療腎臟疾病的新靶點。有研究表明,鳶尾素可通過 TGF-β/Smad 信號通路改善肝臟、心臟、胰腺等臟器纖維化,但鳶尾素在 RF 中的研究相對較少。Jiang 等[15]發現鳶尾素可抑制腎臟細胞外基質的堆積。研究顯示在葉酸誘導的 RF 模型中,鳶尾素可通過抑制 TGF-β/Smad 信號通路,改善腎臟能量代謝并抑制 RF[6]。本研究亦發現,CKD 組大鼠血清鳶尾素水平低于對照組,并隨著時間進展降低;利用 GEO 數據庫對腺嘌呤誘導的 CKD 模型的 RNA 數據進行分析提示 CKD 組中鳶尾素的前體 Fndc5 表達下調,而α-SMA 和 Col-Ⅰ表達上調,提示鳶尾素可能參與 CKD 的 RF 發生發展,值得進一步深入探討。
BMP7 是 TGF-β超家族中 BMP 家族的一員,被認為是一種抗 TGF-β樣因子[16],外源性使用 BMP7 可減少腎小管上皮細胞凋亡及細胞外基質沉積,發揮一定的抗 RF 作用[17]。Smads 蛋白是 TGF-β家族下游的信號轉導蛋白,BMP7 主要通過 Smad 蛋白介導的經典途徑和獨立于 Smad 蛋白的非經典途徑發揮作用[18]。目前有研究表明,BMP7 可通過啟動 Smad1 減輕 RF[17,19-20]。本研究發現 CKD 組大鼠腎臟的 BMP7 和 Smad1 的蛋白和 mRNA 表達水平均低于對照組,血清鳶尾素和 BMP7 水平低于對照組,且在腺嘌呤誘導 RF 形成的早期即可檢測出血清鳶尾素水平在 CKD 組與對照組的顯著變化,表明在 RF 形成的早期階段,鳶尾素已可發揮防治作用,并其作用可持續到 RF 晚期。對腺嘌呤誘導的 CKD 模型的 RNA 測序結果進行分析同樣提示,與對照組相比,CKD 組鳶尾素的前體 Fndc5 和 BMP7 表達下調,α-SMA 和 Col-Ⅰ表達上調。對鳶尾素和 BMP7 進行相關性分析提示血清鳶尾素和 BMP7 水平呈正相關,而腎組織 BMP7 與 Smad1 呈正相關。因此,可推測鳶尾素可能通過影響 BMP7/Smad1 發揮抗 RF 作用。
綜上所述,本研究通過建立腺嘌呤誘導的 CKD 的 RF 模型,提示鳶尾素可能參與了 RF 的進程,并且可能通過調節 BMP7/smad1 信號通路發揮抗 RF 作用,有望成為 RF 防治的新靶點。
利益沖突:所有作者聲明不存在利益沖突。