引用本文: 史睿, 邵亞新, 田小雨, 蔡玲玲. PINK1/Parkin信號通路介導的線粒體自噬在重癥肺炎中的作用研究. 華西醫學, 2024, 39(4): 567-572. doi: 10.7507/1002-0179.202308104 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
重癥肺炎是由肺部炎癥不斷發展惡化加重形成,可引起機體多器官功能障礙甚至死亡,其病死率極高,可達30%~50%[1]。目前,臨床中使用抗感染治療、生命支持等治療手段,但效果仍不理想,這提示重癥肺炎導致的肺組織損傷過程可能存在其他損傷機制。線粒體自噬可通過形成自噬體與溶酶體融合,從而清除已受損線粒體,在維持線粒體功能、調控細胞代謝以及防止損傷線粒體DNA突變中發揮重要作用[2-3]。PINK1(同源性磷酸酶張力蛋白誘導激酶1)/Parkin(帕金森蛋白)通路可介導線粒體自噬,微管相關蛋白1輕鏈3(microtubule-associated protein1 light chain 3, LC3)Ⅱ在該過程中也發揮重要作用[4]。既往研究顯示,線粒體自噬可能與特發性肺纖維化[5]、慢性阻塞性肺疾病[6]、急性肺損傷[7]等多種肺部疾病的發生發展有關。然而,尚不清楚其是否在重癥肺炎的發病機制中發揮重要作用。本研究通過建立重癥肺炎大鼠模型,探究PINK1/Parkin信號通路介導的線粒體自噬在重癥肺炎中的作用機制,以期為臨床上治療重癥肺炎提供新的研究思路。
1 材料與方法
1.1 材料
1.1.1 實驗動物
實驗動物為無特定病原體(specific pathogen free, SPF)級雄性SD(Sprague-Dawley)大鼠(成都達碩實驗動物有限公司),實驗動物許可證號為SCXK(京)2021-0043。本研究已獲得動物實驗倫理委員會批準,批號為2021第(27)號。
1.1.2 試劑與儀器
本研究主要使用的試劑與儀器包括PINK1抗體(英國Abcam公司)、Parkin抗體(美國Proteintech公司)、LC3 Ⅱ抗體(美國Affinity公司)、甘油醛-3-磷酸脫氫酶(glycera ldehyde-3-phosphate dehydrogenase, GAPDH)抗體(美國Proteintech公司)、山羊抗兔二抗(美國 Seracare 公司)、mdivi-1(上海皓元生物醫藥科技有限公司),以及高速冷凍離心機(德國 Thermo Scientific 公司)。
1.2 研究方法
1.2.1 研究設計及分組
本研究于2021年-2023年開展,研究設計為先研究重癥肺炎對大鼠肺功能、病理結構的影響,在確保影響成立的基礎上,進一步使用自噬抑制劑進行實驗,研究重癥肺炎對線粒體自噬指標的影響,為了避免不同批次實驗之間可能存在的誤差,將對照組和模型組同mdivi-1組一起進行了再次實驗。
根據實驗設計,首先使用隨機數字表法將20只大鼠,分為對照組及模型組(重癥肺炎模型),每組10只,以探討重癥肺炎對大鼠肺功能、病理的影響。之后再使用隨機數字表法將30只大鼠,分為對照組、模型組及mdivi-1(線粒體自噬抑制劑)組,每組10只,進一步探討重癥肺炎對大鼠線粒體自噬指標的影響。模型組、mdivi-1組大鼠用戊巴比妥鈉麻醉后固定于固定臺上,使用手術刀將其頸部皮膚切開,從而暴露出上段氣管,用1 mL注射器向氣管中注入含菌量1.2×109菌落形成單位/mL的肺炎克雷伯菌液0.35 mL,豎起放有大鼠的固定臺20 s,重復2次后縫合切口,通常5 d后可見大鼠出現明顯遲鈍、呼吸急促,動脈血氧飽和度<90%,模型即建立成功。mdivi-1組大鼠在上述模型建立成功后腹腔注射mdivi-1(0.5 mg/kg),對照組大鼠氣管內注射生理鹽水并縫合。
1.2.2 肺功能檢測
將大鼠麻醉后,使用手術刀將其頸部組織分離,并在氣管上切開一個小口后插入氣管插管,將大鼠置于體描箱,連接動物肺功能儀進行通氣,待各參數穩定后開始記錄并計算靜息通氣量、氣道阻力比值。
1.2.3 蘇木精-伊紅染色
將大鼠肺臟置于4%多聚甲醛固定12 h,用70%、80%、90%、95%、100%Ⅰ、100%Ⅱ不同濃度的酒精依次對肺組織進行梯度脫水,使用二甲苯Ⅰ和Ⅱ透明10 min,然后進行石蠟包埋及肺組織切片。染色前對組織樣本進行脫蠟、水化,先用蘇木素浸染肺組織,染色后進行水化返藍,流水沖洗,使用伊紅染色浸染肺組織,再將組織切片用不同濃度的下行梯度酒精進行脫水,二甲苯Ⅰ和Ⅱ透明肺組織,在載玻片上滴加少量中性樹脂封片,最后在顯微鏡下觀察各組大鼠肺組織病理學變化并拍照記錄。
1.2.4 蛋白質印跡法檢測大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達
取新鮮大鼠肺組織,剪碎后加入適量裂解液,利用組織研磨儀進行研磨破碎,使用離心機4℃、20000 r/min離心5 min,靜置10 min后提取總蛋白,高溫變性后,配制合適濃度的凝膠,先用80 V電壓電泳0.5 h,再用120 V電壓電泳至結束,使用80 V電壓轉膜后用快速封閉液封閉30 min,PBST(含0.05% tween-20的中性磷酸鹽緩沖液)清洗后加入Parkin(1∶1000)、PINK1(1∶1000)及LC3Ⅱ(1∶1000)一抗4℃孵育過夜,使用PBST清洗后加入二抗室溫孵育1 h,PBST清洗后后使用發光液曝光條帶,最后用ImageJ軟件進行分析。
1.2.5 實時定量聚合酶鏈反應(polymerase chain reaction, PCR)檢測大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達
提取大鼠肺組織總RNA后用PrimeScriPt RT Master Mix將RNA逆轉錄為cDNA。使用SYBR PremiexExTaq試劑盒進行定量PCR擴增目標cDNA,GAPDH為內參。PCR引物由上海生工生物工程有限公司設計和合成。引物序列為Parkin上游引物:5’-TGGGCTGTGGGTTCG-3’,Parkin下游引物:3’-CGGTATGCCTGAGAAG-5’;PINK1上游引物:5’-GTGTCTGACCCACTGGC-3’,PINK1下游引物:3'-CTGCTCCCTTTGAGACA-5’;LC3Ⅱ上游引物:5’-CGCCAGCTCAATGCTAAC-3’,LC3Ⅱ下游引物:GGGTACTTCACATGCTC;GAPDH上游引物5’-ACATCAAGACCTCTATG-3’,GAPDH下游引物3’-TACTCCTTGCTGATCCAC-5’。
1.3 統計學方法
采用SPSS 23.0軟件進行數據分析,所有計量數據均呈正態分布,以均數±標準差表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析(差異有統計學意義時,進一步的兩兩比較采用Tukey檢驗)。雙側檢驗水準α=0.05。
2 結果
2.1 重癥肺炎大鼠肺功能指標及肺組織病理學變化
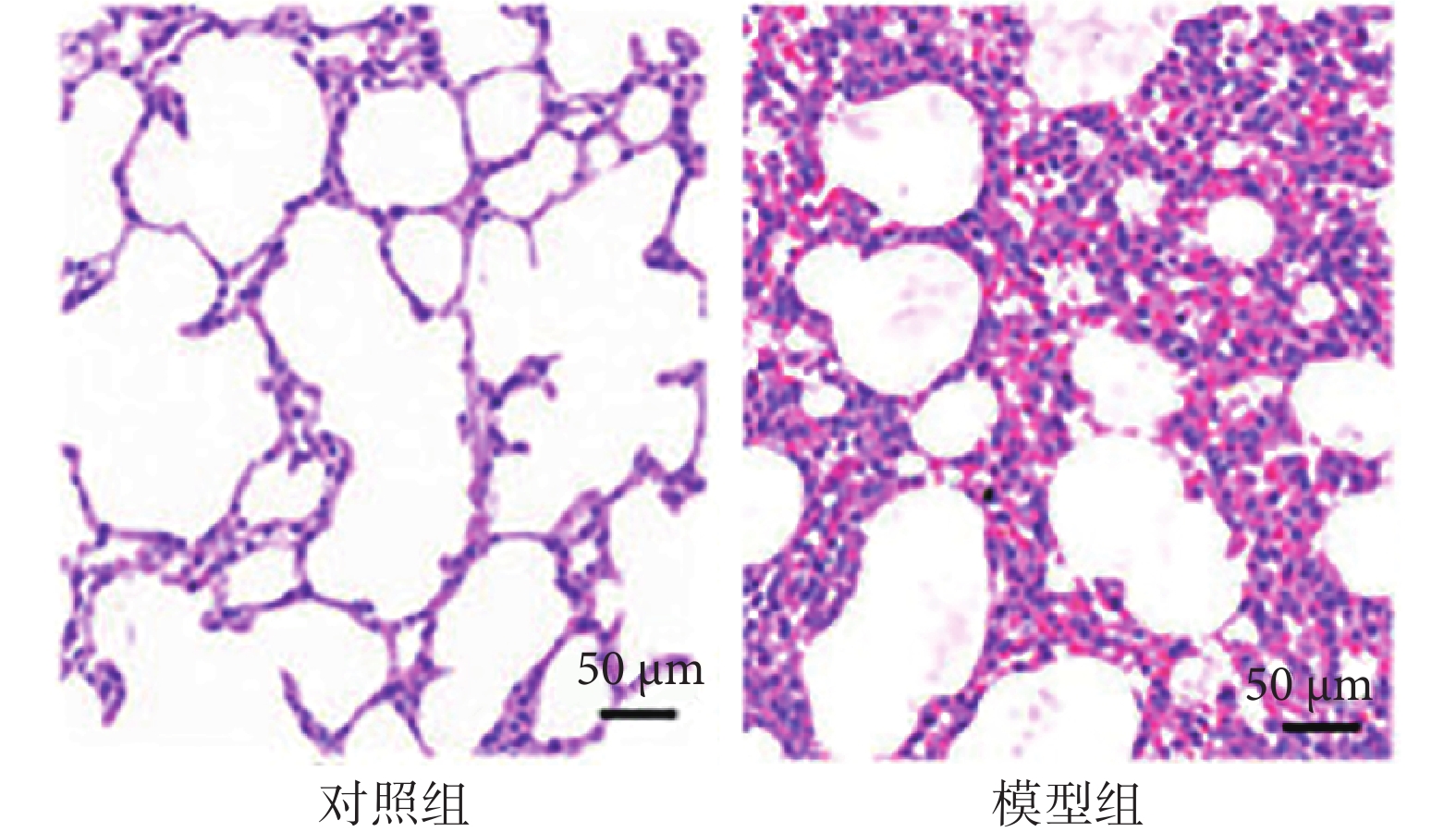
與對照組相比,模型組大鼠肺功能指標靜息通氣量及氣道阻力比值降低(P<0.05),見表1。與對照組相比,模型組大鼠肺組織損傷,可見大量炎性細胞浸潤(圖1)。
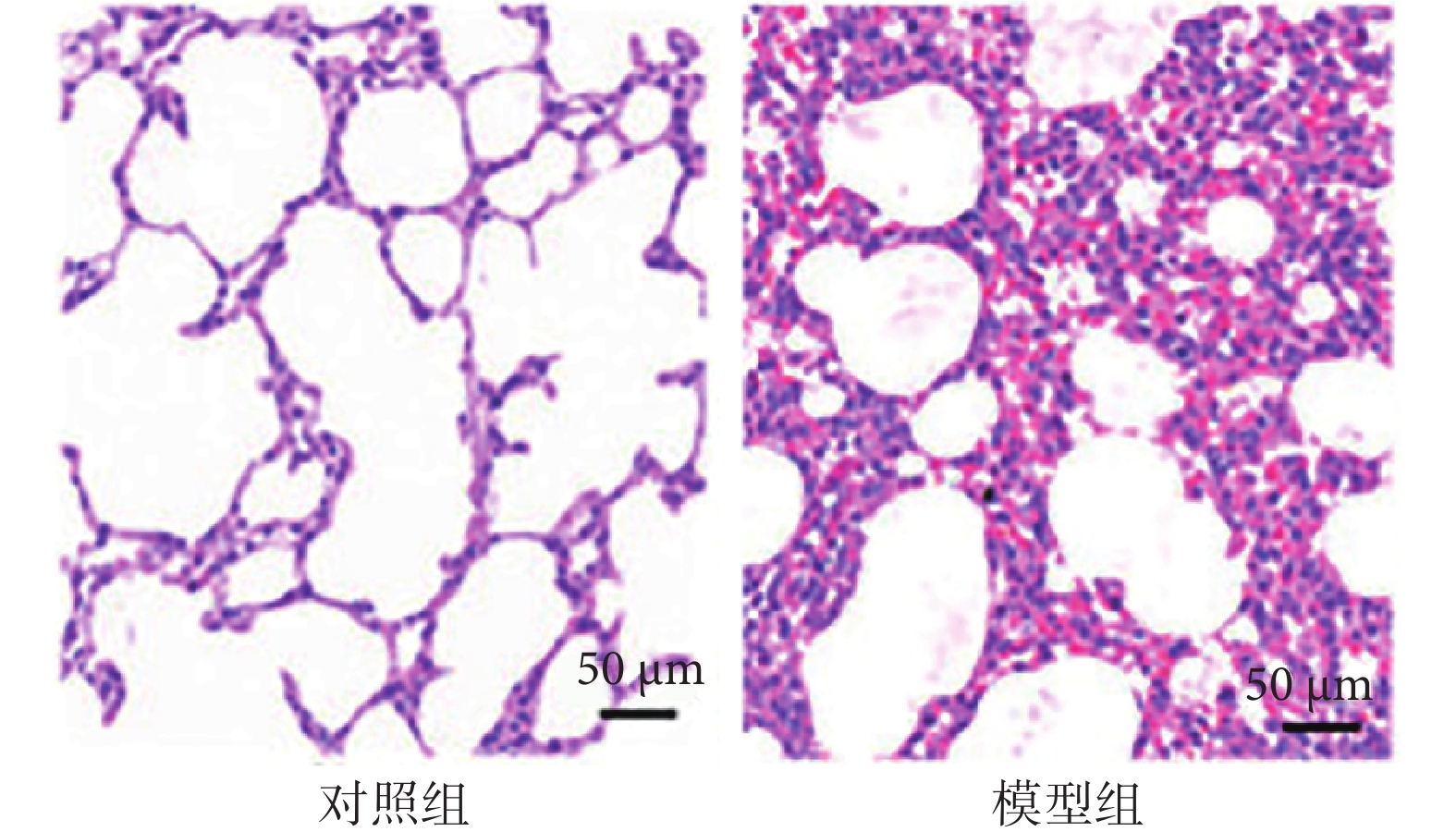 圖1
大鼠肺組織病理學變化
圖1
大鼠肺組織病理學變化
2.2 重癥肺炎大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達
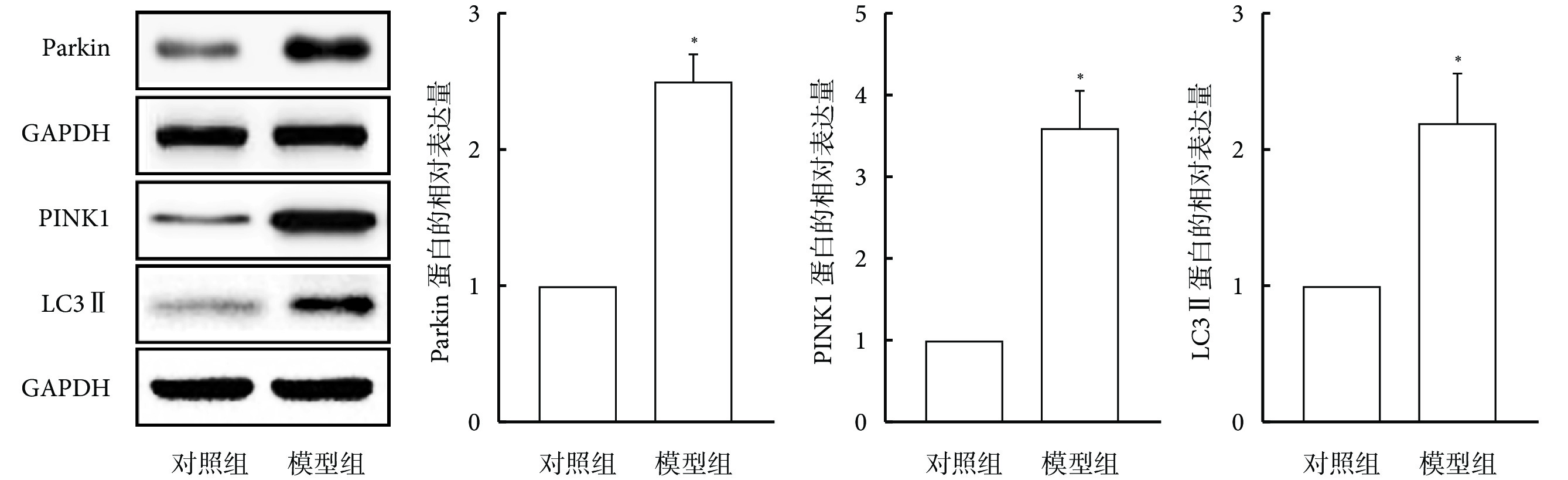
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平增加(P<0.05),見圖2。
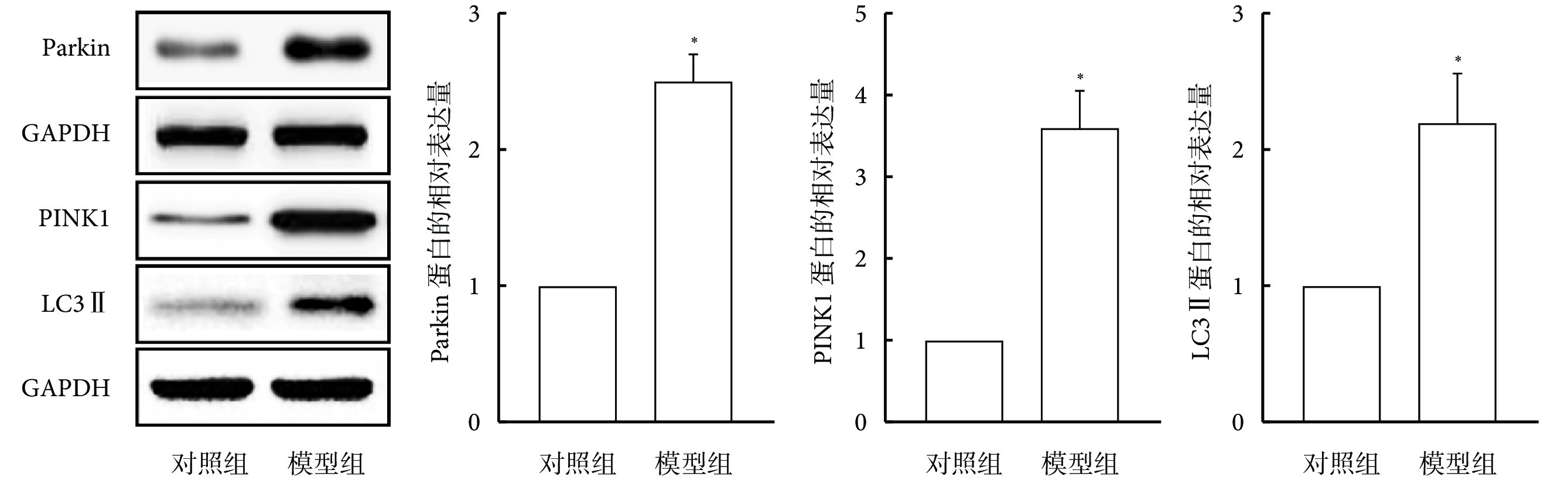 圖2
大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平(n=10)
圖2
大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平(n=10)
*與對照組相比,
2.3 重癥肺炎大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達
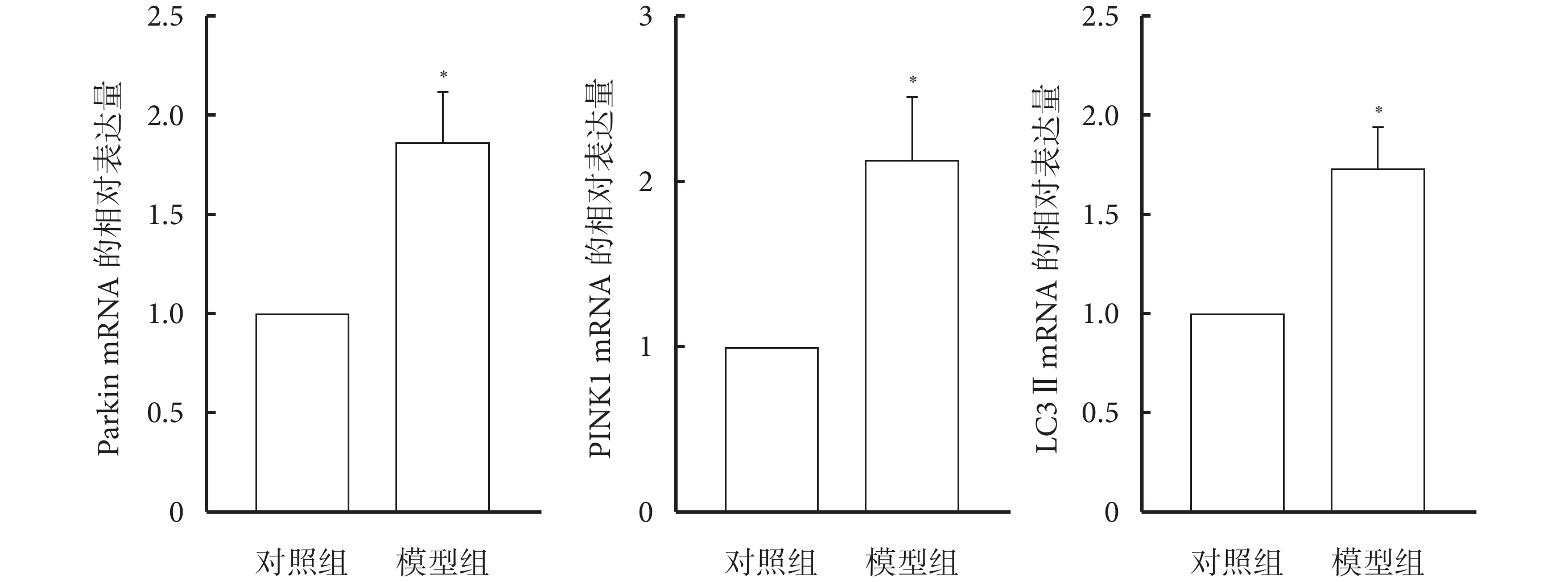
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達水平增加(P<0.05),見圖3。
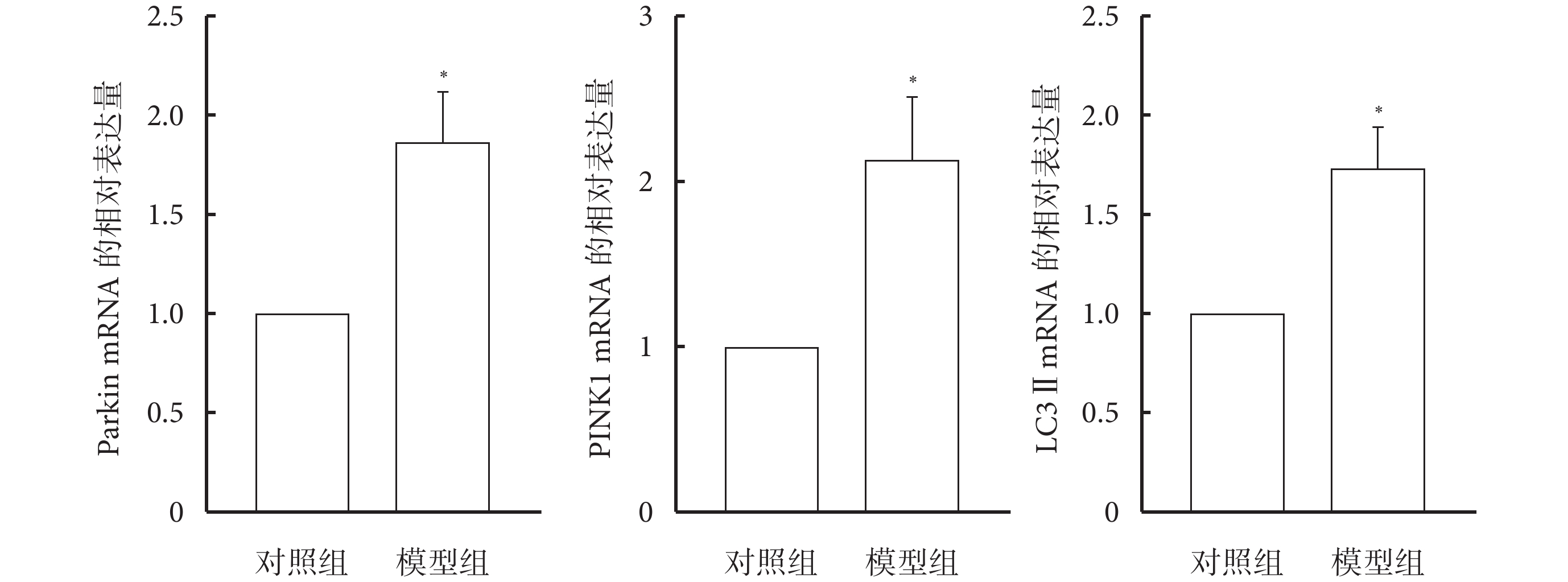 圖3
大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
圖3
大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
*與對照組相比,
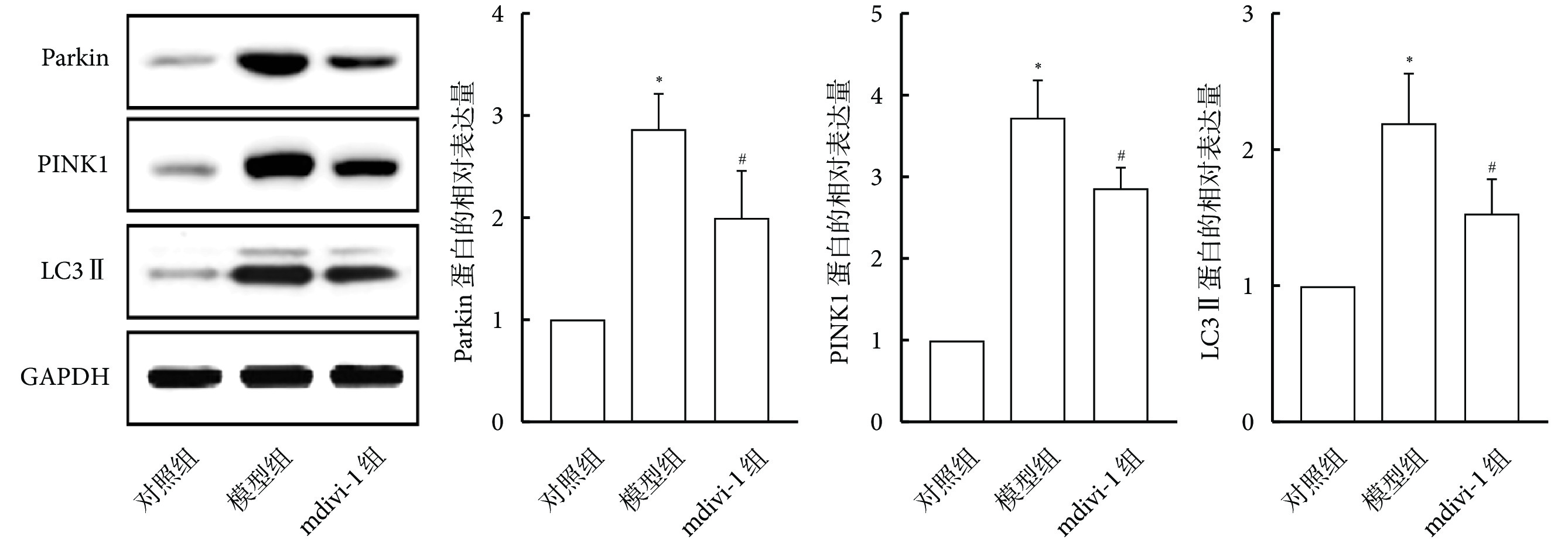
2.4 mdivi-1對重癥肺炎大鼠肺功能及肺組織病理學的影響
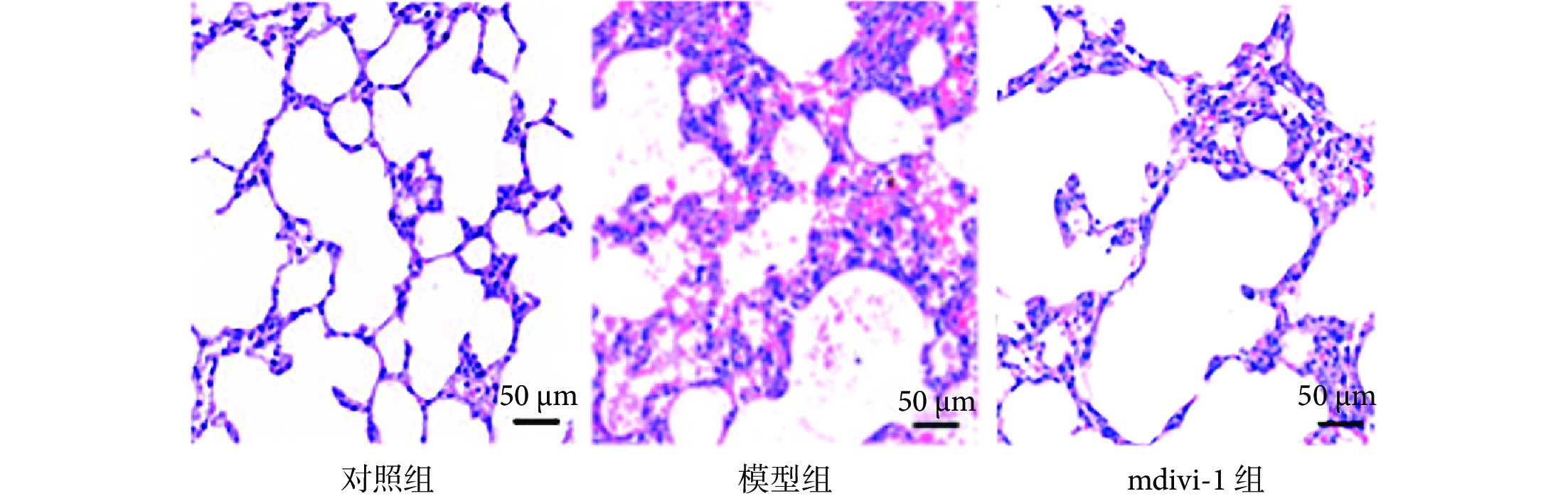
與對照組相比,模型組大鼠肺功能指標靜息通氣量和氣道阻力比值降低(P<0.05);與模型組相比,mdivi-1組大鼠肺功能指標靜息通氣量及氣道阻力比值增加(P<0.05),見表2、3。與對照組相比,模型組大鼠肺組織損傷,可見大量炎性細胞浸潤;與模型組相比,mdivi-1組大鼠肺組織損傷及炎性浸潤改善(圖4)。
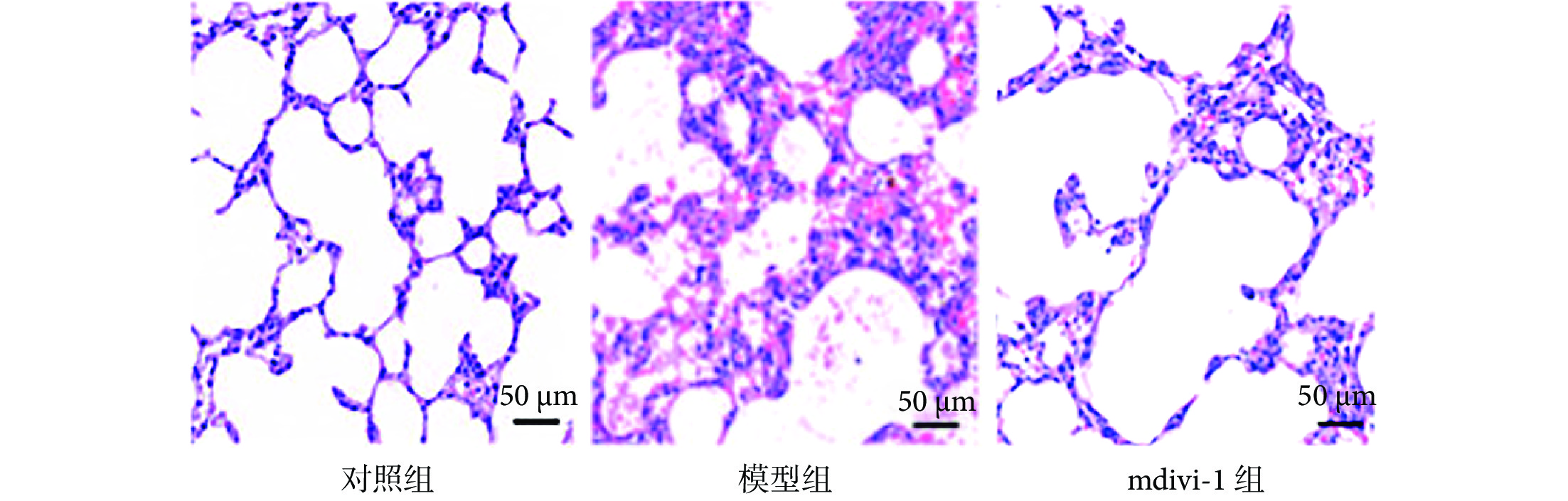 圖4
各組大鼠肺組織病理學變化
圖4
各組大鼠肺組織病理學變化
2.5 mdivi-1對重癥肺炎大鼠肺組織Parkin、PINK1及LC3 Ⅱ蛋白表達的影響
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平增加(P<0.05);與模型組相比,mdivi-1組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平減少(P<0.05)。見圖5。
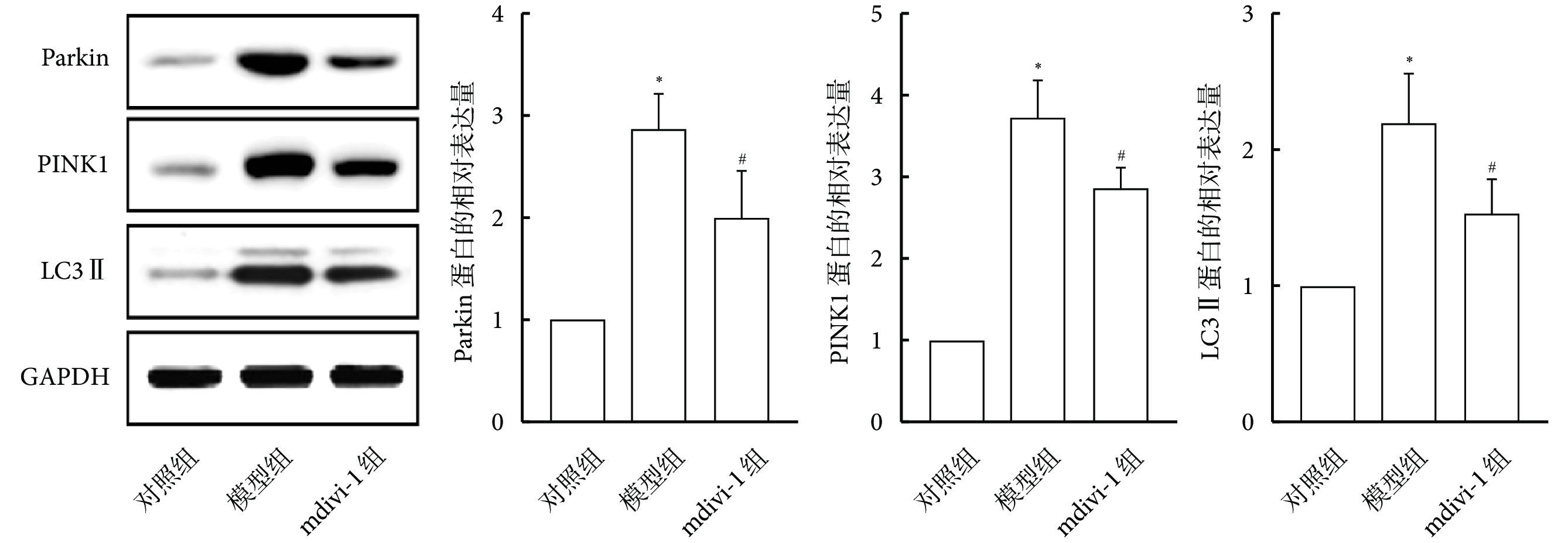 圖5
各組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達(n=10)
圖5
各組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達(n=10)
*與對照組相比,
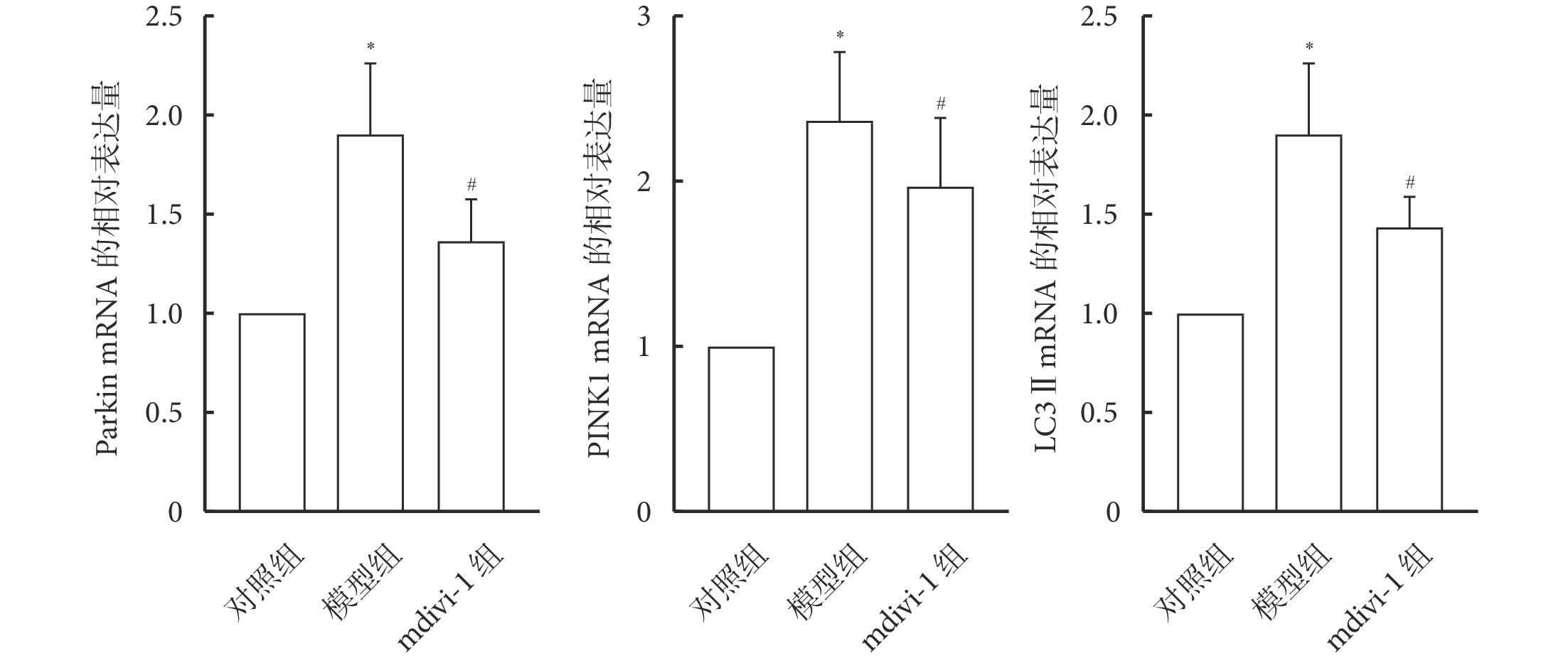
2.6 mdivi-1對重癥肺炎大鼠肺組織中Parkin、PINK1及LC3 ⅡmRNA表達的影響
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達水平增加(P<0.05);與模型組相比,mdivi-1組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的mRNA表達水平減少(P<0.05)。見圖6。
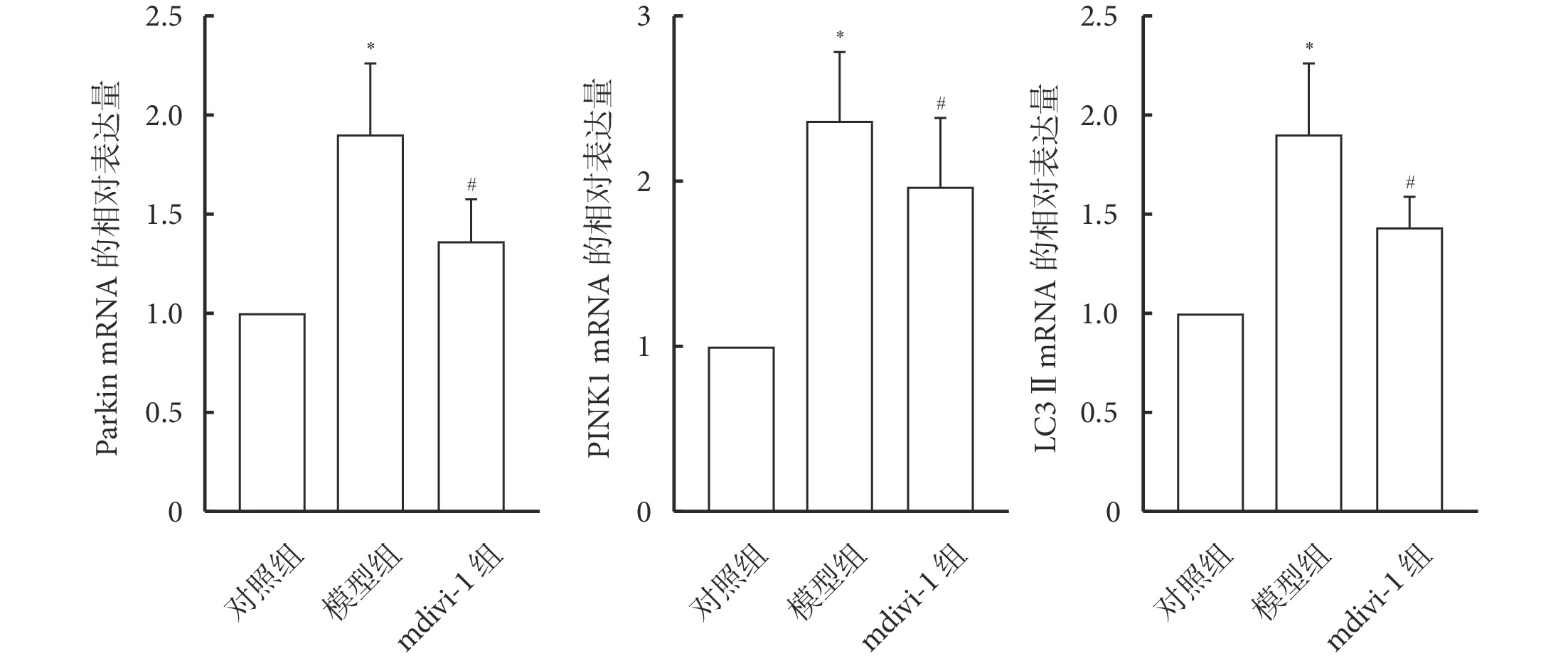 圖6
各組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
圖6
各組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
*與對照組相比,
3 討論
重癥肺炎屬于急危重癥,病情進展非常迅速。流行病學調查數據顯示,肺炎是感染性疾病死亡的重要病因之一,重癥肺炎占其10%~20%[8],這不得不引起人們的廣泛關注。臨床上利用多種手段治療,結果尚不理想,甚至治療不當時可導致感染性休克甚至可繼續發展為多器官功能障礙[9]。現階段大量研究顯示,炎癥反應、氧化應激及細胞凋亡等參與重癥肺炎的發生發展過程,并發揮重要作用[10-12]。然而,在重癥肺炎導致的肺組織損傷過程中可能還存在其他損傷機制。線粒體自噬可選擇性清除已經受損的線粒體或過量的線粒體,維持細胞氧化和抗氧化平衡。PINK1是線粒體損傷分子感受器的外膜蛋白,可招募并激活Parkin,進一步使被泛素標記的線粒體與LC3Ⅱ結合,最終形成線粒體自噬體溶酶體融合后被降解[13-14]。研究顯示,線粒體自噬可能與肺癌[15]、特發性肺纖維化[5]、慢性阻塞性肺疾病[6]、急性肺損傷[7]等多種肺部疾病的發生發展有關。然而,尚不明確其是否參與重癥肺炎導致的肺組織損傷。本研究顯示,重癥肺炎大鼠肺功能存在異常,肺組織受到嚴重損傷,檢測線粒體自噬相關指標Parkin、PINK1、LC3Ⅱ的蛋白及mRNA水平,結果顯示PINK1/Parkin信號通路在重癥肺炎導致的肺損傷中被激活,相關蛋白表達均增加。為了進一步證實我們的猜測,本研究使用線粒體自噬抑制劑mdivi-1干預重癥肺炎大鼠,結果顯示,mdivi-1干預可改善重癥肺炎大鼠肺功能的損傷及肺組織的結構異常。進一步檢測線粒體自噬相關指標Parkin、PINK1、LC3Ⅱ的蛋白及mRNA水平,結果顯示這些指標的異常得到改善,這提示PINK1/Parkin信號通路介導的線粒體自噬可能參與重癥肺炎導致的肺組織損傷過程。
綜上所述,本研究初步表明在重癥肺炎導致的肺組織損傷過程中PINK1/Parkin信號通路介導的線粒體自噬可能發揮重要作用,這可能為臨床中治療重癥肺炎提供新的研究策略。然而,本研究目前仍存在一些局限性,我們只是在動物水平上初步闡明PINK1/Parkin信號通路介導的線粒體自噬可能參與重癥肺炎導致的肺組織損傷過程,關于分子之間如何作用的具體機制仍有待進一步研究。
利益沖突:所有作者聲明不存在利益沖突。
重癥肺炎是由肺部炎癥不斷發展惡化加重形成,可引起機體多器官功能障礙甚至死亡,其病死率極高,可達30%~50%[1]。目前,臨床中使用抗感染治療、生命支持等治療手段,但效果仍不理想,這提示重癥肺炎導致的肺組織損傷過程可能存在其他損傷機制。線粒體自噬可通過形成自噬體與溶酶體融合,從而清除已受損線粒體,在維持線粒體功能、調控細胞代謝以及防止損傷線粒體DNA突變中發揮重要作用[2-3]。PINK1(同源性磷酸酶張力蛋白誘導激酶1)/Parkin(帕金森蛋白)通路可介導線粒體自噬,微管相關蛋白1輕鏈3(microtubule-associated protein1 light chain 3, LC3)Ⅱ在該過程中也發揮重要作用[4]。既往研究顯示,線粒體自噬可能與特發性肺纖維化[5]、慢性阻塞性肺疾病[6]、急性肺損傷[7]等多種肺部疾病的發生發展有關。然而,尚不清楚其是否在重癥肺炎的發病機制中發揮重要作用。本研究通過建立重癥肺炎大鼠模型,探究PINK1/Parkin信號通路介導的線粒體自噬在重癥肺炎中的作用機制,以期為臨床上治療重癥肺炎提供新的研究思路。
1 材料與方法
1.1 材料
1.1.1 實驗動物
實驗動物為無特定病原體(specific pathogen free, SPF)級雄性SD(Sprague-Dawley)大鼠(成都達碩實驗動物有限公司),實驗動物許可證號為SCXK(京)2021-0043。本研究已獲得動物實驗倫理委員會批準,批號為2021第(27)號。
1.1.2 試劑與儀器
本研究主要使用的試劑與儀器包括PINK1抗體(英國Abcam公司)、Parkin抗體(美國Proteintech公司)、LC3 Ⅱ抗體(美國Affinity公司)、甘油醛-3-磷酸脫氫酶(glycera ldehyde-3-phosphate dehydrogenase, GAPDH)抗體(美國Proteintech公司)、山羊抗兔二抗(美國 Seracare 公司)、mdivi-1(上海皓元生物醫藥科技有限公司),以及高速冷凍離心機(德國 Thermo Scientific 公司)。
1.2 研究方法
1.2.1 研究設計及分組
本研究于2021年-2023年開展,研究設計為先研究重癥肺炎對大鼠肺功能、病理結構的影響,在確保影響成立的基礎上,進一步使用自噬抑制劑進行實驗,研究重癥肺炎對線粒體自噬指標的影響,為了避免不同批次實驗之間可能存在的誤差,將對照組和模型組同mdivi-1組一起進行了再次實驗。
根據實驗設計,首先使用隨機數字表法將20只大鼠,分為對照組及模型組(重癥肺炎模型),每組10只,以探討重癥肺炎對大鼠肺功能、病理的影響。之后再使用隨機數字表法將30只大鼠,分為對照組、模型組及mdivi-1(線粒體自噬抑制劑)組,每組10只,進一步探討重癥肺炎對大鼠線粒體自噬指標的影響。模型組、mdivi-1組大鼠用戊巴比妥鈉麻醉后固定于固定臺上,使用手術刀將其頸部皮膚切開,從而暴露出上段氣管,用1 mL注射器向氣管中注入含菌量1.2×109菌落形成單位/mL的肺炎克雷伯菌液0.35 mL,豎起放有大鼠的固定臺20 s,重復2次后縫合切口,通常5 d后可見大鼠出現明顯遲鈍、呼吸急促,動脈血氧飽和度<90%,模型即建立成功。mdivi-1組大鼠在上述模型建立成功后腹腔注射mdivi-1(0.5 mg/kg),對照組大鼠氣管內注射生理鹽水并縫合。
1.2.2 肺功能檢測
將大鼠麻醉后,使用手術刀將其頸部組織分離,并在氣管上切開一個小口后插入氣管插管,將大鼠置于體描箱,連接動物肺功能儀進行通氣,待各參數穩定后開始記錄并計算靜息通氣量、氣道阻力比值。
1.2.3 蘇木精-伊紅染色
將大鼠肺臟置于4%多聚甲醛固定12 h,用70%、80%、90%、95%、100%Ⅰ、100%Ⅱ不同濃度的酒精依次對肺組織進行梯度脫水,使用二甲苯Ⅰ和Ⅱ透明10 min,然后進行石蠟包埋及肺組織切片。染色前對組織樣本進行脫蠟、水化,先用蘇木素浸染肺組織,染色后進行水化返藍,流水沖洗,使用伊紅染色浸染肺組織,再將組織切片用不同濃度的下行梯度酒精進行脫水,二甲苯Ⅰ和Ⅱ透明肺組織,在載玻片上滴加少量中性樹脂封片,最后在顯微鏡下觀察各組大鼠肺組織病理學變化并拍照記錄。
1.2.4 蛋白質印跡法檢測大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達
取新鮮大鼠肺組織,剪碎后加入適量裂解液,利用組織研磨儀進行研磨破碎,使用離心機4℃、20000 r/min離心5 min,靜置10 min后提取總蛋白,高溫變性后,配制合適濃度的凝膠,先用80 V電壓電泳0.5 h,再用120 V電壓電泳至結束,使用80 V電壓轉膜后用快速封閉液封閉30 min,PBST(含0.05% tween-20的中性磷酸鹽緩沖液)清洗后加入Parkin(1∶1000)、PINK1(1∶1000)及LC3Ⅱ(1∶1000)一抗4℃孵育過夜,使用PBST清洗后加入二抗室溫孵育1 h,PBST清洗后后使用發光液曝光條帶,最后用ImageJ軟件進行分析。
1.2.5 實時定量聚合酶鏈反應(polymerase chain reaction, PCR)檢測大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達
提取大鼠肺組織總RNA后用PrimeScriPt RT Master Mix將RNA逆轉錄為cDNA。使用SYBR PremiexExTaq試劑盒進行定量PCR擴增目標cDNA,GAPDH為內參。PCR引物由上海生工生物工程有限公司設計和合成。引物序列為Parkin上游引物:5’-TGGGCTGTGGGTTCG-3’,Parkin下游引物:3’-CGGTATGCCTGAGAAG-5’;PINK1上游引物:5’-GTGTCTGACCCACTGGC-3’,PINK1下游引物:3'-CTGCTCCCTTTGAGACA-5’;LC3Ⅱ上游引物:5’-CGCCAGCTCAATGCTAAC-3’,LC3Ⅱ下游引物:GGGTACTTCACATGCTC;GAPDH上游引物5’-ACATCAAGACCTCTATG-3’,GAPDH下游引物3’-TACTCCTTGCTGATCCAC-5’。
1.3 統計學方法
采用SPSS 23.0軟件進行數據分析,所有計量數據均呈正態分布,以均數±標準差表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析(差異有統計學意義時,進一步的兩兩比較采用Tukey檢驗)。雙側檢驗水準α=0.05。
2 結果
2.1 重癥肺炎大鼠肺功能指標及肺組織病理學變化
與對照組相比,模型組大鼠肺功能指標靜息通氣量及氣道阻力比值降低(P<0.05),見表1。與對照組相比,模型組大鼠肺組織損傷,可見大量炎性細胞浸潤(圖1)。
 圖1
大鼠肺組織病理學變化
圖1
大鼠肺組織病理學變化
2.2 重癥肺炎大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平增加(P<0.05),見圖2。
 圖2
大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平(n=10)
圖2
大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平(n=10)
*與對照組相比,
2.3 重癥肺炎大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達水平增加(P<0.05),見圖3。
 圖3
大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
圖3
大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
*與對照組相比,
2.4 mdivi-1對重癥肺炎大鼠肺功能及肺組織病理學的影響
與對照組相比,模型組大鼠肺功能指標靜息通氣量和氣道阻力比值降低(P<0.05);與模型組相比,mdivi-1組大鼠肺功能指標靜息通氣量及氣道阻力比值增加(P<0.05),見表2、3。與對照組相比,模型組大鼠肺組織損傷,可見大量炎性細胞浸潤;與模型組相比,mdivi-1組大鼠肺組織損傷及炎性浸潤改善(圖4)。
 圖4
各組大鼠肺組織病理學變化
圖4
各組大鼠肺組織病理學變化
2.5 mdivi-1對重癥肺炎大鼠肺組織Parkin、PINK1及LC3 Ⅱ蛋白表達的影響
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平增加(P<0.05);與模型組相比,mdivi-1組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達水平減少(P<0.05)。見圖5。
 圖5
各組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達(n=10)
圖5
各組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的蛋白表達(n=10)
*與對照組相比,
2.6 mdivi-1對重癥肺炎大鼠肺組織中Parkin、PINK1及LC3 ⅡmRNA表達的影響
與對照組相比,模型組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達水平增加(P<0.05);與模型組相比,mdivi-1組大鼠肺組織中Parkin、PINK1及LC3 Ⅱ的mRNA表達水平減少(P<0.05)。見圖6。
 圖6
各組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
圖6
各組大鼠肺組織中Parkin、PINK1及LC3Ⅱ的mRNA表達(n=10)
*與對照組相比,
3 討論
重癥肺炎屬于急危重癥,病情進展非常迅速。流行病學調查數據顯示,肺炎是感染性疾病死亡的重要病因之一,重癥肺炎占其10%~20%[8],這不得不引起人們的廣泛關注。臨床上利用多種手段治療,結果尚不理想,甚至治療不當時可導致感染性休克甚至可繼續發展為多器官功能障礙[9]。現階段大量研究顯示,炎癥反應、氧化應激及細胞凋亡等參與重癥肺炎的發生發展過程,并發揮重要作用[10-12]。然而,在重癥肺炎導致的肺組織損傷過程中可能還存在其他損傷機制。線粒體自噬可選擇性清除已經受損的線粒體或過量的線粒體,維持細胞氧化和抗氧化平衡。PINK1是線粒體損傷分子感受器的外膜蛋白,可招募并激活Parkin,進一步使被泛素標記的線粒體與LC3Ⅱ結合,最終形成線粒體自噬體溶酶體融合后被降解[13-14]。研究顯示,線粒體自噬可能與肺癌[15]、特發性肺纖維化[5]、慢性阻塞性肺疾病[6]、急性肺損傷[7]等多種肺部疾病的發生發展有關。然而,尚不明確其是否參與重癥肺炎導致的肺組織損傷。本研究顯示,重癥肺炎大鼠肺功能存在異常,肺組織受到嚴重損傷,檢測線粒體自噬相關指標Parkin、PINK1、LC3Ⅱ的蛋白及mRNA水平,結果顯示PINK1/Parkin信號通路在重癥肺炎導致的肺損傷中被激活,相關蛋白表達均增加。為了進一步證實我們的猜測,本研究使用線粒體自噬抑制劑mdivi-1干預重癥肺炎大鼠,結果顯示,mdivi-1干預可改善重癥肺炎大鼠肺功能的損傷及肺組織的結構異常。進一步檢測線粒體自噬相關指標Parkin、PINK1、LC3Ⅱ的蛋白及mRNA水平,結果顯示這些指標的異常得到改善,這提示PINK1/Parkin信號通路介導的線粒體自噬可能參與重癥肺炎導致的肺組織損傷過程。
綜上所述,本研究初步表明在重癥肺炎導致的肺組織損傷過程中PINK1/Parkin信號通路介導的線粒體自噬可能發揮重要作用,這可能為臨床中治療重癥肺炎提供新的研究策略。然而,本研究目前仍存在一些局限性,我們只是在動物水平上初步闡明PINK1/Parkin信號通路介導的線粒體自噬可能參與重癥肺炎導致的肺組織損傷過程,關于分子之間如何作用的具體機制仍有待進一步研究。
利益沖突:所有作者聲明不存在利益沖突。