引用本文: 董立慧, 張之君, 侯翠芳. 微 RNA 對非小細胞肺癌程序性死亡蛋白 1 抑制劑聯合同步化療療效的預測價值. 華西醫學, 2024, 39(1): 36-41. doi: 10.7507/1002-0179.202308221 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
肺癌是全球發病率、致死率最高的惡性腫瘤,預計到 2030 年,其死亡率會上升 40%[1]。大部分肺癌患者在發現時已是晚期,失去了手術治療機會,主要以放化療治療為主,但治療效果較差,5 年生存率較低,僅為 11%[2]。近年來,程序性死亡蛋白 1(programmed death-1, PD-1)的應用雖提高了肺癌的治療效果,但肺癌具有較強的腫瘤異質性,不同患者對藥物的敏感性差異較大,患者總體 5 年生存率仍處于較低水平,約為 15%[3]。有學者指出,有效的臨床療效評估標志物可為肺癌患者治療方案的確定提供理論支持[4],而微 RNA(microRNA, miRNA)可發揮原癌或抑癌基因作用,與腫瘤的發生發展密切相關[5-6]。另有學者指出,miR-218 可通過影響軸突導向因子分泌蛋白家族特異性受體 1 的表達抑制肺癌細胞的侵襲遷移[7];miR-329 可通過影響重組人叉頭框蛋白 L2/整合素 α-2 通路活化抑制肺癌細胞對化療藥物的耐藥性[8];miR-567 可通過影響周期蛋白依賴性激酶 8 的表達抑制肺癌細胞的侵襲能力及其對化療藥物的耐藥性[9]。基于此,本研究分析了血清 miR-218、miR-329、miR-567 水平對非小細胞肺癌(non-small cell lung cancer, NSCLC)患者 PD-1 抑制劑聯合同步化療臨床療效的預測價值,旨在為此類患者治療方案的制定提供參考。
1 對象與方法
1.1 研究對象
采用便利抽樣法前瞻性選取 2021 年 1 月—2023 年 1 月北京大學第一醫院太原醫院收治的 160 例行 PD-1 抑制劑聯合同步化療治療的 NSCLC 患者為研究對象進行巢式病例對照研究。納入標準:① 年齡 18~65 歲;② 符合 NSCLC 的診斷標準[10],首次確診,臨床分期為Ⅳ期;③ 預計生存期≥3 個月;④ 卡氏功能狀態評分≥70 分;⑤ 美國東部腫瘤協作組體力狀況評分 0~2 分;⑥ 對本研究知情同意。排除標準:① 合并有肝腎功能障礙等化療禁忌證;② 入選前 2 周內有激素類藥物應用史;③ 合并有嚴重免疫系統疾病;④ 入選前有抗癌治療史;⑤ 合并有嚴重血液系統疾病;⑥ 合并有其他系統惡性腫瘤;⑦ 合并有精神疾病,依從性較差;⑧ 對本研究所用藥物過敏;⑨ 有腹腔、心包、胸腔積液;⑩ 哺乳期及妊娠期女性。本研究獲得北京大學第一醫院太原醫院醫學倫理委員會批準,批件號:科研倫審 2021 第 008 號。
1.2 治療方法
PD-1 抑制劑治療:于化療前 1 d,靜脈滴注信迪利單抗注射液[信達生物制藥(蘇州)有限公司]200 mg+生理鹽水(石家莊四藥有限公司)100 mL 混合液,每 3 周 1 次,21 d 為 1 個周期,持續 6 個周期。
化療:靜脈滴注順鉑注射液[齊魯制藥(海南)有限公司]75 mg/m2+生理鹽水 500 mL 混合液,每 3 周 1 次。與此同時,鱗狀細胞癌(鱗癌)患者靜脈滴注注射用紫杉醇(白蛋白結合型)[齊魯制藥(海南)有限公司]100 mg/m2+生理鹽水 100 mL 混合液,第 1、8、15 天用藥;腺癌患者靜脈滴注注射用培美曲塞二鈉(齊魯制藥有限公司)500 mg/m2+生理鹽水 100 mL 混合液,第 1 天用藥。21 d 為 1 個周期,持續 6 個周期。
1.3 觀察指標
1.3.1 血清 miR-218、miR-329、miR-567 水平
治療前,抽取患者空腹肘靜脈血 5 mL,以 2500 r/min、離心半徑 15 cm 離心 10 min,取上清液,?80℃冰箱保存;將凍存血清在冰上溶解后,取 0.2 mL 依次加入 0.75 mL 總 RNA 抽提試劑、20 μL 醋酸(5 mol/L)混勻;靜置 5 min 后,加入 0.2 mL 氯仿;靜置 5 min 后,4℃條件下 12000 r/min、離心半徑 8.5 cm 離心 15 min,取上清液,加入異丙醇 0.5 mL 混勻;室溫下靜置 10 min 后,4℃溫度下以 12000 r/min、離心半徑 8.5 cm 離心 10 min,棄掉上清液,取下層 RNA 白色沉淀;加入 75% 無水乙醇 1 mL,4℃溫度下以 7500 r/min、離心半徑 10 cm 離心 5 min,再次棄掉上清液,取下層 RNA 沉淀;室溫下放置 5 min 后,加入雙蒸水進行充分攪拌;繼而,在 60℃溫度下孵育 10 min 后,采用 miRNeasy 微量提取試劑盒進行純化(紫外分光光度計檢測結果顯示 A260/A280 為 1.9~2.0 表示純度良好)。
取 5.5 μL 總 RNA、2 μL 脫氧核糖核苷三磷酸、0.3 μL RNA 酶抑制劑、0.5 μL 逆轉錄特異引物、0.4 μL 逆轉錄酶、2 μL 逆轉錄反應緩沖液,加超純水至 20 μL,16℃作用 30 min、42℃作用 30 min、85℃作用 5 min 逆轉錄合成互補 DNA;取 0.2 μL 的羧基-X-羅丹明參比染料、終濃度 0.25×10 μmol/L 的協同結合試劑綠色Ⅰ核酸染料、0.5 U Taq 聚合酶、0.6 μL 氯化鎂溶液、1.0 μL 緩沖液、1.0 μL 脫氧核糖核苷三磷酸、0.4 μL 下游特異引物、0.4 μL 上游特異引物,加超純水至 8 μL,95℃預變性 3 min 后,95、60、72、78℃分別作用 15、20、20、20 s(40 個循環)。內參為 U6,基因表達量采用 2?△△Ct 法進行分析。引物序列見表1。
1.3.2 臨床療效
6 個周期化療完成后再過 2 個周期時評估患者臨床療效。疾病進展:腫瘤直徑總和增大 20% 及其以上或有新發病灶;疾病穩定:腫瘤直徑總和縮小 30% 以下或無變化或腫瘤直徑總和增大 20% 以下,且無新發病灶;部分緩解:腫瘤直徑總和縮小 30% 及其以上,且無新發病灶;完全緩解:病灶完全消失[11]。
1.4 資料收集與分組
于患者入組時收集性別、年齡、病理類型等基線資料、臨床特征以及血清 miR-218、miR-329、miR-567 水平,隨訪時收集臨床療效,并根據臨床療效將患者分為緩解組(部分緩解與完全緩解)與未緩解組(疾病穩定與疾病進展)。
1.5 統計學方法
采用 SPSS 23.0 軟件進行統計分析。計數資料以頻數和/或百分數表示,二分類或無序資料組間比較采用 χ2 檢驗,等級資料組間比較采用 Mann-Whitney U 檢驗;正態分布計量資料以均數±標準差表示,組間比較采用 t 檢驗;PD-1 抑制劑聯合同步化療臨床療效的相關影響因素采用多因素 logistic 回歸分析,計算比值比(odds ratio, OR)及其 95% 置信區間(confidence interval, CI);血清 miR-218、miR-329、miR-567 水平及聯合檢測概率(擬合 logistic 回歸模型計算預測概率)對 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的預測價值采用受試者操作特征(receiver operating characteristic, ROC)曲線分析,并以部分緩解與完全緩解為陽性、疾病穩定與疾病進展為陰性計算陽性預測值為與陰性預測值。雙側檢驗水準 α=0.05。
2 結果
2.1 臨床療效
在 納入研究的160 例患者中,程序性死亡受體配體 1(programmed death-ligand 1, PD-L1)腫瘤細胞陽性表達分數(tumor cell proportion score, TPS)<1% 者 63 例,TPS≥1% 且<50% 者 67 例,TPS≥50% 者 30 例。化療完成后 2 周,160 例患者中疾病進展 34 例(21.2%),疾病穩定 85 例(53.1%),部分緩解 39 例(24.4%),完全緩解 2 例(1.2%),據此將患者分為緩解組 41 例,未緩解組 119 例。
2.2 兩組患者臨床特征分析
緩解組低分化患者比例明顯低于未緩解組(P<0.05),而性別、年齡、病理類型、腫瘤類型、腫瘤直徑、淋巴結轉移情況與未緩解組差異無統計學意義(P>0.05),見表2。
2.3 兩組患者血清 miR-218、miR-329、miR-567 水平對比
緩解組患者血清 miR-218、miR-329、miR-567 水平明顯高于未緩解組(P<0.05),見表3。
2.4 臨床療效的多因素 logistic 回歸分析
以臨床療效為因變量(0 表示疾病穩定/疾病進展;1 表示部分緩解/完全緩解),以性別(0 表示女;1 表示男)、年齡(連續變量)、病理類型(1 表示鱗癌;2 表示腺癌;3 表示其他。采用啞變量形式)、腫瘤類型(0 表示周圍型;1 表示中央型)、腫瘤直徑(連續變量)、分化程度(1 表示低分化;2 表示中分化;3 表示高分化。采用啞變量形式)、淋巴結轉移(0 表示否;1 表示是)以及血清 miR-218、miR-329、miR-567 水平(均為連續變量)為自變量強制輸入法進行多因素 logistic 回歸分析。結果顯示,分化程度較高以及血清 miR-218、miR-329、miR-567 高水平的 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效較好(P<0.05),見表4。
2.5 3 種 miRNA 對 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效預測價值分析
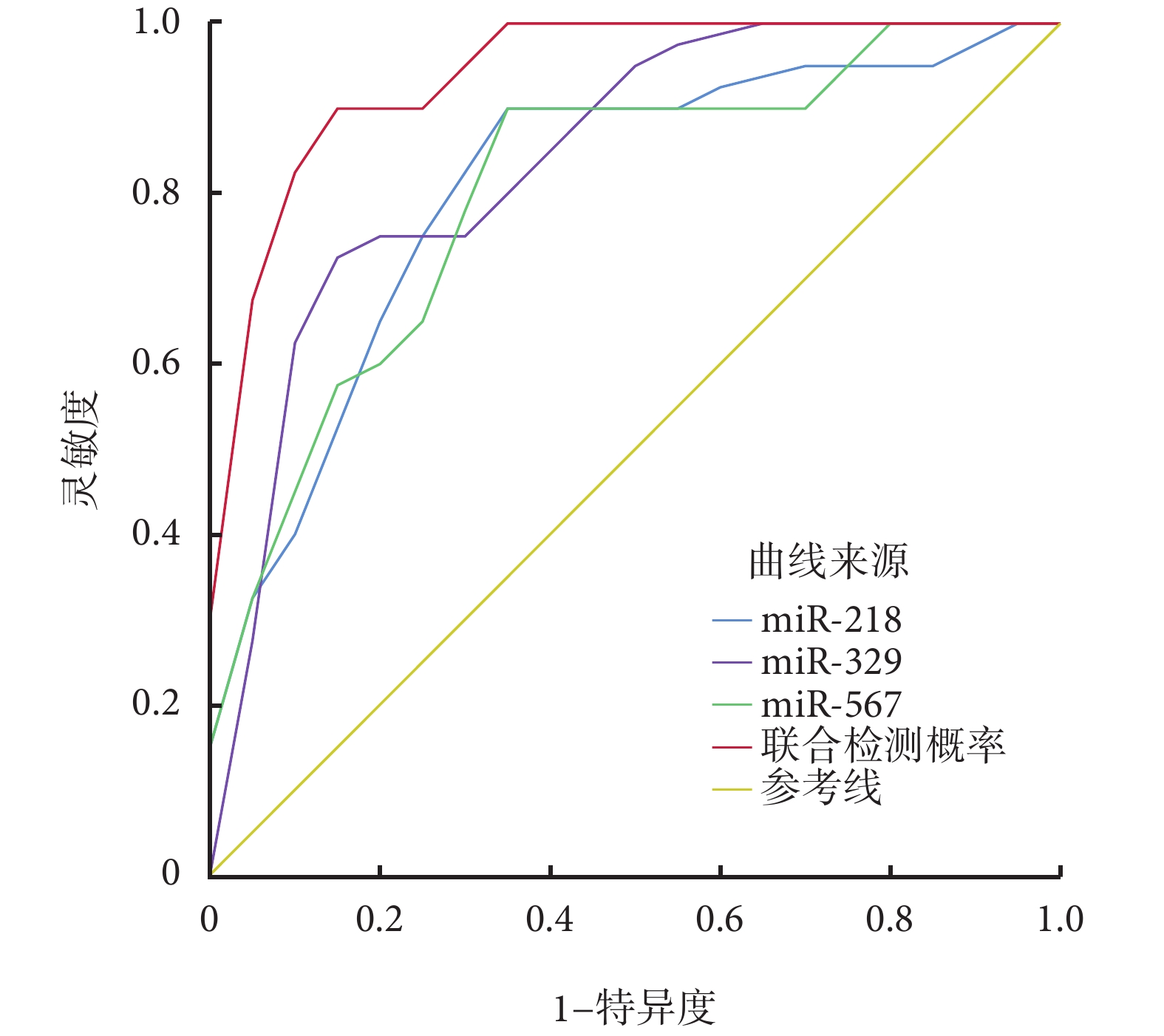
ROC 曲線分析結果顯示,根據聯合檢測血清 miR-218、miR-329、miR-567 的預測概率截斷值預測 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的曲線下面積為 0.938[95%CI(0.855,0.964)],靈敏度為 82.9%,特異度為 92.4%,陽性預測值為 79.1%,陰性預測值為 94.0%,見表5、圖1。
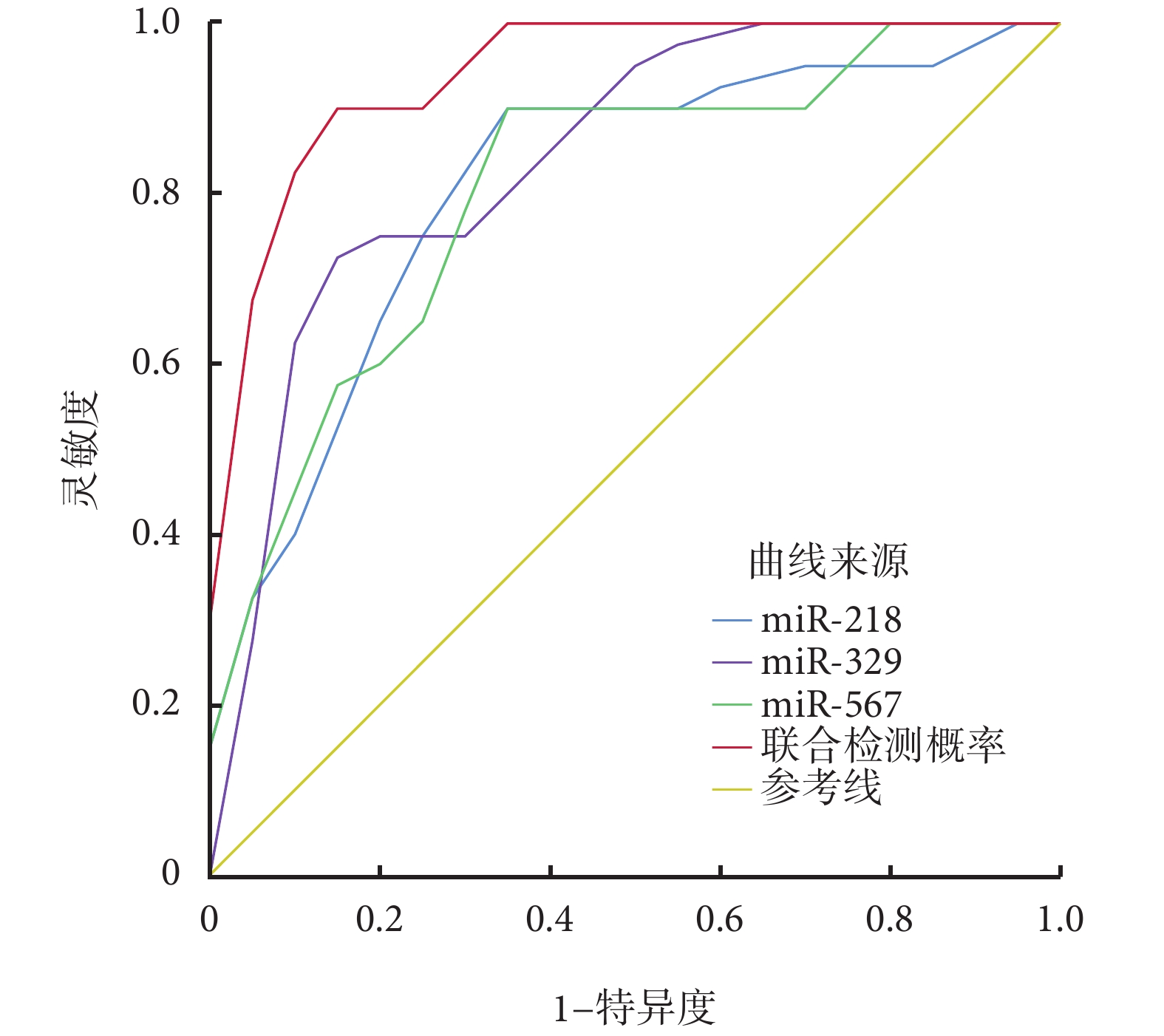 圖1
3 種 miRNA 預測 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的 ROC 曲線圖
圖1
3 種 miRNA 預測 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的 ROC 曲線圖
miRNA:微 RNA;NSCLC:非小細胞肺癌;PD-1:程序性死亡蛋白 1;ROC:受試者操作特征
3 討論
相關研究顯示,肺癌患者確診后僅 20%~30% 能夠通過手術根治,40% 在發現時已是晚期,晚期患者中位生存期僅 16~17 周,嚴重威脅著人類的生命健康及安全[12-13]。有學者指出,腫瘤細胞能夠通過封閉抗原、下調腫瘤抗原表達、調節腫瘤免疫相關抑制因子水平等各種機制直接或間接逃避免疫系統的識別與攻擊,在機體內存活,并不斷增殖、侵襲、遷移[14-15]。近年來有研究指出,表達于 B 細胞、T 細胞、自然殺傷細胞等細胞的 PD-1 能夠與其配體 PD-L1 結合增強免疫細胞功能,抑制腫瘤細胞免疫逃逸,并提高腫瘤細胞殺傷率,但 PD-1 抑制劑與同步化療聯合雖使得肺癌患者的生存期有所提高,部分患者卻受劑量限制、腫瘤負荷、耐藥性等影響,藥物敏感性較低,效果仍不理想[16-17]。因此,探索能夠預測 PD-1 抑制劑聯合同步化療臨床療效的定量指標以指導治療方案的制定,具有重要的臨床意義。
近年來諸多研究顯示,miRNA 作為內源性非編碼短鏈 RNA,能夠通過介導 mRNA 的降解、翻譯、斷裂等調控腫瘤細胞的增殖、分化、凋亡及藥物敏感性,在肺癌發生發展中發揮重要作用[18]。如 Tian 等[19]的研究顯示,miR-218 能夠抑制肺癌細胞的增殖、侵襲及遷移,在肺癌患者腫瘤細胞內呈異常低表達狀態,過表達 miR-218 可促進肺癌細胞凋亡,與患者預后密切相關;劉鑫等[8]的研究顯示,細胞周期相關轉錄因子作為一種促癌因子,可參與肺癌的發生及發展,而 miR-329 可通過靶向下調細胞周期相關轉錄因子增強肺癌細胞對多種化療藥物敏感性,抑制肺癌細胞的增殖、侵襲及遷移;Elkady 等[20]的研究顯示,周期蛋白依賴性激酶 8 的高表達可提高肺癌細胞增殖、侵襲、遷移能力及耐藥性,而 miR-567 能夠通過靶向下調周期蛋白依賴性激酶 8 抑制肺癌的病理進程,提高肺癌細胞藥物敏感性。鑒于 miR-218、miR-329、miR-567 均與肺癌細胞的藥物敏感性密切相關,但研究多處于實驗研究階段,與臨床療效相關性的研究鮮見報道,本研究分析了三者對肺癌患者 PD-1 抑制劑聯合同步化療療效的預測價值,結果顯示,緩解組患者血清 miR-218、miR-329、miR-567 水平明顯高于未緩解組,與既往的實驗研究結果相一致。本研究進一步通過多因素 logistic 回歸分析及 ROC 曲線分析發現,血清 miR-218、miR-329、miR-567 高水平的患者 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效更好,聯合檢測血清 miR-218、miR-329、miR-567 對于 NSCLC 患者 PD-1 抑制劑聯合同步化療的臨床療效有較高的預測價值,即,治療前對患者 miR-218、miR-329、miR-567 表達水平進行檢測,能夠為治療方案的制定提供參考。
綜上所述,聯合檢測血清 miR-218、miR-329、miR-567 水平對 NSCLC 患者 PD-1 抑制劑聯合同步化療的治療效果有較高的預測價值,能夠指導臨床治療方案的指定。但本研究樣本均選自同一家三級甲等醫院,其適用性仍需多中心大樣本研究予以驗證。
利益沖突:所有作者聲明不存在利益沖突。
肺癌是全球發病率、致死率最高的惡性腫瘤,預計到 2030 年,其死亡率會上升 40%[1]。大部分肺癌患者在發現時已是晚期,失去了手術治療機會,主要以放化療治療為主,但治療效果較差,5 年生存率較低,僅為 11%[2]。近年來,程序性死亡蛋白 1(programmed death-1, PD-1)的應用雖提高了肺癌的治療效果,但肺癌具有較強的腫瘤異質性,不同患者對藥物的敏感性差異較大,患者總體 5 年生存率仍處于較低水平,約為 15%[3]。有學者指出,有效的臨床療效評估標志物可為肺癌患者治療方案的確定提供理論支持[4],而微 RNA(microRNA, miRNA)可發揮原癌或抑癌基因作用,與腫瘤的發生發展密切相關[5-6]。另有學者指出,miR-218 可通過影響軸突導向因子分泌蛋白家族特異性受體 1 的表達抑制肺癌細胞的侵襲遷移[7];miR-329 可通過影響重組人叉頭框蛋白 L2/整合素 α-2 通路活化抑制肺癌細胞對化療藥物的耐藥性[8];miR-567 可通過影響周期蛋白依賴性激酶 8 的表達抑制肺癌細胞的侵襲能力及其對化療藥物的耐藥性[9]。基于此,本研究分析了血清 miR-218、miR-329、miR-567 水平對非小細胞肺癌(non-small cell lung cancer, NSCLC)患者 PD-1 抑制劑聯合同步化療臨床療效的預測價值,旨在為此類患者治療方案的制定提供參考。
1 對象與方法
1.1 研究對象
采用便利抽樣法前瞻性選取 2021 年 1 月—2023 年 1 月北京大學第一醫院太原醫院收治的 160 例行 PD-1 抑制劑聯合同步化療治療的 NSCLC 患者為研究對象進行巢式病例對照研究。納入標準:① 年齡 18~65 歲;② 符合 NSCLC 的診斷標準[10],首次確診,臨床分期為Ⅳ期;③ 預計生存期≥3 個月;④ 卡氏功能狀態評分≥70 分;⑤ 美國東部腫瘤協作組體力狀況評分 0~2 分;⑥ 對本研究知情同意。排除標準:① 合并有肝腎功能障礙等化療禁忌證;② 入選前 2 周內有激素類藥物應用史;③ 合并有嚴重免疫系統疾病;④ 入選前有抗癌治療史;⑤ 合并有嚴重血液系統疾病;⑥ 合并有其他系統惡性腫瘤;⑦ 合并有精神疾病,依從性較差;⑧ 對本研究所用藥物過敏;⑨ 有腹腔、心包、胸腔積液;⑩ 哺乳期及妊娠期女性。本研究獲得北京大學第一醫院太原醫院醫學倫理委員會批準,批件號:科研倫審 2021 第 008 號。
1.2 治療方法
PD-1 抑制劑治療:于化療前 1 d,靜脈滴注信迪利單抗注射液[信達生物制藥(蘇州)有限公司]200 mg+生理鹽水(石家莊四藥有限公司)100 mL 混合液,每 3 周 1 次,21 d 為 1 個周期,持續 6 個周期。
化療:靜脈滴注順鉑注射液[齊魯制藥(海南)有限公司]75 mg/m2+生理鹽水 500 mL 混合液,每 3 周 1 次。與此同時,鱗狀細胞癌(鱗癌)患者靜脈滴注注射用紫杉醇(白蛋白結合型)[齊魯制藥(海南)有限公司]100 mg/m2+生理鹽水 100 mL 混合液,第 1、8、15 天用藥;腺癌患者靜脈滴注注射用培美曲塞二鈉(齊魯制藥有限公司)500 mg/m2+生理鹽水 100 mL 混合液,第 1 天用藥。21 d 為 1 個周期,持續 6 個周期。
1.3 觀察指標
1.3.1 血清 miR-218、miR-329、miR-567 水平
治療前,抽取患者空腹肘靜脈血 5 mL,以 2500 r/min、離心半徑 15 cm 離心 10 min,取上清液,?80℃冰箱保存;將凍存血清在冰上溶解后,取 0.2 mL 依次加入 0.75 mL 總 RNA 抽提試劑、20 μL 醋酸(5 mol/L)混勻;靜置 5 min 后,加入 0.2 mL 氯仿;靜置 5 min 后,4℃條件下 12000 r/min、離心半徑 8.5 cm 離心 15 min,取上清液,加入異丙醇 0.5 mL 混勻;室溫下靜置 10 min 后,4℃溫度下以 12000 r/min、離心半徑 8.5 cm 離心 10 min,棄掉上清液,取下層 RNA 白色沉淀;加入 75% 無水乙醇 1 mL,4℃溫度下以 7500 r/min、離心半徑 10 cm 離心 5 min,再次棄掉上清液,取下層 RNA 沉淀;室溫下放置 5 min 后,加入雙蒸水進行充分攪拌;繼而,在 60℃溫度下孵育 10 min 后,采用 miRNeasy 微量提取試劑盒進行純化(紫外分光光度計檢測結果顯示 A260/A280 為 1.9~2.0 表示純度良好)。
取 5.5 μL 總 RNA、2 μL 脫氧核糖核苷三磷酸、0.3 μL RNA 酶抑制劑、0.5 μL 逆轉錄特異引物、0.4 μL 逆轉錄酶、2 μL 逆轉錄反應緩沖液,加超純水至 20 μL,16℃作用 30 min、42℃作用 30 min、85℃作用 5 min 逆轉錄合成互補 DNA;取 0.2 μL 的羧基-X-羅丹明參比染料、終濃度 0.25×10 μmol/L 的協同結合試劑綠色Ⅰ核酸染料、0.5 U Taq 聚合酶、0.6 μL 氯化鎂溶液、1.0 μL 緩沖液、1.0 μL 脫氧核糖核苷三磷酸、0.4 μL 下游特異引物、0.4 μL 上游特異引物,加超純水至 8 μL,95℃預變性 3 min 后,95、60、72、78℃分別作用 15、20、20、20 s(40 個循環)。內參為 U6,基因表達量采用 2?△△Ct 法進行分析。引物序列見表1。
1.3.2 臨床療效
6 個周期化療完成后再過 2 個周期時評估患者臨床療效。疾病進展:腫瘤直徑總和增大 20% 及其以上或有新發病灶;疾病穩定:腫瘤直徑總和縮小 30% 以下或無變化或腫瘤直徑總和增大 20% 以下,且無新發病灶;部分緩解:腫瘤直徑總和縮小 30% 及其以上,且無新發病灶;完全緩解:病灶完全消失[11]。
1.4 資料收集與分組
于患者入組時收集性別、年齡、病理類型等基線資料、臨床特征以及血清 miR-218、miR-329、miR-567 水平,隨訪時收集臨床療效,并根據臨床療效將患者分為緩解組(部分緩解與完全緩解)與未緩解組(疾病穩定與疾病進展)。
1.5 統計學方法
采用 SPSS 23.0 軟件進行統計分析。計數資料以頻數和/或百分數表示,二分類或無序資料組間比較采用 χ2 檢驗,等級資料組間比較采用 Mann-Whitney U 檢驗;正態分布計量資料以均數±標準差表示,組間比較采用 t 檢驗;PD-1 抑制劑聯合同步化療臨床療效的相關影響因素采用多因素 logistic 回歸分析,計算比值比(odds ratio, OR)及其 95% 置信區間(confidence interval, CI);血清 miR-218、miR-329、miR-567 水平及聯合檢測概率(擬合 logistic 回歸模型計算預測概率)對 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的預測價值采用受試者操作特征(receiver operating characteristic, ROC)曲線分析,并以部分緩解與完全緩解為陽性、疾病穩定與疾病進展為陰性計算陽性預測值為與陰性預測值。雙側檢驗水準 α=0.05。
2 結果
2.1 臨床療效
在 納入研究的160 例患者中,程序性死亡受體配體 1(programmed death-ligand 1, PD-L1)腫瘤細胞陽性表達分數(tumor cell proportion score, TPS)<1% 者 63 例,TPS≥1% 且<50% 者 67 例,TPS≥50% 者 30 例。化療完成后 2 周,160 例患者中疾病進展 34 例(21.2%),疾病穩定 85 例(53.1%),部分緩解 39 例(24.4%),完全緩解 2 例(1.2%),據此將患者分為緩解組 41 例,未緩解組 119 例。
2.2 兩組患者臨床特征分析
緩解組低分化患者比例明顯低于未緩解組(P<0.05),而性別、年齡、病理類型、腫瘤類型、腫瘤直徑、淋巴結轉移情況與未緩解組差異無統計學意義(P>0.05),見表2。
2.3 兩組患者血清 miR-218、miR-329、miR-567 水平對比
緩解組患者血清 miR-218、miR-329、miR-567 水平明顯高于未緩解組(P<0.05),見表3。
2.4 臨床療效的多因素 logistic 回歸分析
以臨床療效為因變量(0 表示疾病穩定/疾病進展;1 表示部分緩解/完全緩解),以性別(0 表示女;1 表示男)、年齡(連續變量)、病理類型(1 表示鱗癌;2 表示腺癌;3 表示其他。采用啞變量形式)、腫瘤類型(0 表示周圍型;1 表示中央型)、腫瘤直徑(連續變量)、分化程度(1 表示低分化;2 表示中分化;3 表示高分化。采用啞變量形式)、淋巴結轉移(0 表示否;1 表示是)以及血清 miR-218、miR-329、miR-567 水平(均為連續變量)為自變量強制輸入法進行多因素 logistic 回歸分析。結果顯示,分化程度較高以及血清 miR-218、miR-329、miR-567 高水平的 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效較好(P<0.05),見表4。
2.5 3 種 miRNA 對 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效預測價值分析
ROC 曲線分析結果顯示,根據聯合檢測血清 miR-218、miR-329、miR-567 的預測概率截斷值預測 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的曲線下面積為 0.938[95%CI(0.855,0.964)],靈敏度為 82.9%,特異度為 92.4%,陽性預測值為 79.1%,陰性預測值為 94.0%,見表5、圖1。
 圖1
3 種 miRNA 預測 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的 ROC 曲線圖
圖1
3 種 miRNA 預測 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效的 ROC 曲線圖
miRNA:微 RNA;NSCLC:非小細胞肺癌;PD-1:程序性死亡蛋白 1;ROC:受試者操作特征
3 討論
相關研究顯示,肺癌患者確診后僅 20%~30% 能夠通過手術根治,40% 在發現時已是晚期,晚期患者中位生存期僅 16~17 周,嚴重威脅著人類的生命健康及安全[12-13]。有學者指出,腫瘤細胞能夠通過封閉抗原、下調腫瘤抗原表達、調節腫瘤免疫相關抑制因子水平等各種機制直接或間接逃避免疫系統的識別與攻擊,在機體內存活,并不斷增殖、侵襲、遷移[14-15]。近年來有研究指出,表達于 B 細胞、T 細胞、自然殺傷細胞等細胞的 PD-1 能夠與其配體 PD-L1 結合增強免疫細胞功能,抑制腫瘤細胞免疫逃逸,并提高腫瘤細胞殺傷率,但 PD-1 抑制劑與同步化療聯合雖使得肺癌患者的生存期有所提高,部分患者卻受劑量限制、腫瘤負荷、耐藥性等影響,藥物敏感性較低,效果仍不理想[16-17]。因此,探索能夠預測 PD-1 抑制劑聯合同步化療臨床療效的定量指標以指導治療方案的制定,具有重要的臨床意義。
近年來諸多研究顯示,miRNA 作為內源性非編碼短鏈 RNA,能夠通過介導 mRNA 的降解、翻譯、斷裂等調控腫瘤細胞的增殖、分化、凋亡及藥物敏感性,在肺癌發生發展中發揮重要作用[18]。如 Tian 等[19]的研究顯示,miR-218 能夠抑制肺癌細胞的增殖、侵襲及遷移,在肺癌患者腫瘤細胞內呈異常低表達狀態,過表達 miR-218 可促進肺癌細胞凋亡,與患者預后密切相關;劉鑫等[8]的研究顯示,細胞周期相關轉錄因子作為一種促癌因子,可參與肺癌的發生及發展,而 miR-329 可通過靶向下調細胞周期相關轉錄因子增強肺癌細胞對多種化療藥物敏感性,抑制肺癌細胞的增殖、侵襲及遷移;Elkady 等[20]的研究顯示,周期蛋白依賴性激酶 8 的高表達可提高肺癌細胞增殖、侵襲、遷移能力及耐藥性,而 miR-567 能夠通過靶向下調周期蛋白依賴性激酶 8 抑制肺癌的病理進程,提高肺癌細胞藥物敏感性。鑒于 miR-218、miR-329、miR-567 均與肺癌細胞的藥物敏感性密切相關,但研究多處于實驗研究階段,與臨床療效相關性的研究鮮見報道,本研究分析了三者對肺癌患者 PD-1 抑制劑聯合同步化療療效的預測價值,結果顯示,緩解組患者血清 miR-218、miR-329、miR-567 水平明顯高于未緩解組,與既往的實驗研究結果相一致。本研究進一步通過多因素 logistic 回歸分析及 ROC 曲線分析發現,血清 miR-218、miR-329、miR-567 高水平的患者 NSCLC 患者 PD-1 抑制劑聯合同步化療臨床療效更好,聯合檢測血清 miR-218、miR-329、miR-567 對于 NSCLC 患者 PD-1 抑制劑聯合同步化療的臨床療效有較高的預測價值,即,治療前對患者 miR-218、miR-329、miR-567 表達水平進行檢測,能夠為治療方案的制定提供參考。
綜上所述,聯合檢測血清 miR-218、miR-329、miR-567 水平對 NSCLC 患者 PD-1 抑制劑聯合同步化療的治療效果有較高的預測價值,能夠指導臨床治療方案的指定。但本研究樣本均選自同一家三級甲等醫院,其適用性仍需多中心大樣本研究予以驗證。
利益沖突:所有作者聲明不存在利益沖突。