引用本文: 張師瑋, 陳俊杰. 基于高通量蛋白質組學分析的皮膚衰老與皮膚鱗狀細胞癌發生的相關機制研究. 華西醫學, 2024, 39(5): 763-770. doi: 10.7507/1002-0179.202310219 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
皮膚鱗狀細胞癌(cutaneous squamous cell carcinoma, cSCC)的發生是一個復雜的生物學過程,cSCC 的生長、局部侵襲和遠處轉移與其腫瘤微環境密不可分。細胞外基質(extracellular matrix, ECM)為腫瘤微環境的重要組成部分,其組分會隨著衰老發生改變,腫瘤的發生與 ECM 的改變密切相關[1-2]。因此檢測 ECM 蛋白的成分組成及排列結構的變化,有助于了解細胞周圍組織環境的生理情況,進一步探索可能與疾病相關的蛋白分子靶點。本研究嘗試應用基于壓力循環技術(pressure cycling technology, PCT)的蛋白質組學檢測技術,對不同年齡的正常皮膚組織及 cSCC 組織進行全蛋白質組的相對定性定量分析,通過組間對比,尋找與皮膚衰老相關的蛋白質及衰老相關蛋白與 cSCC 的相關性,以期為探索衰老導致的 ECM 改變和 cSCC 發生機制以及 cSCC 的治療靶標篩選提供新的依據。
1 對象與方法
1.1 研究對象
本研究通過四川大學華西醫院(以下簡稱“我院”)生物醫學倫理審查委員會批準(批件號:2021 年審 98 號)。隨機選取我院 2019 年 1 月—2020 年 12 月收治的 5 例老年 cSCC 患者皮膚樣本及 5 例年輕腹壁整形患者和 5 例老年腹壁整形患者手術中切除的多余正常皮膚組織樣本作為研究對象。納入標準:① 于我院手術,術后經石蠟病理結果證實為 cSCC 的老年患者,或于我院進行整形手術且愿意捐獻術中所切除的多余正常皮膚組織的患者;② 患者臨床資料完善;③ 患者有保存完好的病理石蠟標本。排除標準:① 患有嚴重全身性合并癥或其他惡性腫瘤;② 蠟塊質量不佳。根據世界衛生組織人類年齡劃分新標準,年齡<45 歲的患者納入年輕人組,年齡>65 歲的患者納入老年組,年齡>65 歲且診斷 cSCC 的患者納入 cSCC 組[3]。
1.2 主要試劑與儀器
iRT 標準肽段購于瑞士 Biognosys 公司;乙腈購于美國賽默飛世爾科技公司;庚烷、三羥甲基氨基甲烷鹽酸鹽(pH=10)、尿素、吲哚-3-乙酸、三(2-羧乙基)膦、三氟乙酸、乙二胺四乙酸鈉、碳酸氫銨均購于中國生工生物工程(上海)股份有限公司。用于研究的主要儀器包括 Tims Tof pro 質譜儀(美國 Bruker 公司)、Evosep one 液相(丹麥 Evosep 公司)、Barocycler PCT 儀(美國 Pressure BioSciences 公司)、Votext 旋渦震蕩儀(美國 Scientific Industries 公司)、NanoDrop 1000 分光光度計(美國賽默飛世爾科技公司)、高 pH 分離液相色譜儀(美國 Agilent 公司)、ImageScanner 掃描儀(美國 GE Healthcare 公司)、Agilent 1100 高效液相色譜系統(美國 Agilent 公司)。
1.3 蘇木精-伊紅染色
取已制備好的蠟塊 3 μm 連續切片備用。切片浸于二甲苯中脫蠟并通過梯度乙醇浸泡流水沖洗,經蘇木素染色后 2% 鹽酸乙醇分色,流水沖洗,伊紅染液染色后梯度乙醇脫水,二甲苯透明,中性樹膠封片。
1.4 蛋白多肽提取
將石蠟切片和庚烷混合震蕩后用梯度乙醇充分洗滌并離心,將沉淀和甲酸混合并離心吸去上清液后加入三羥甲基氨基甲烷鹽酸鹽(pH=10)緩沖液并慢速震蕩,待充分震蕩后加入裂解液放入 PCT 儀中充分反應。反應結束后加入碳酸氫銨溶液和胞內蛋白酶(酶∶蛋白=1∶40,m/m)并放于 PCT 儀中充分反應。反應結束后加入碳酸氫銨溶液和胰酶并放于 PCT 儀中反應。反應結束后加入 10% 三氟乙酸溶液終止胰酶酶切,并通過依次加入甲醇、乙腈并離心,活化 C18 微型柱。將上述肽段溶液約 160 μL 加入 C18 柱中,離心半徑 13.5 cm、轉速
1.5 蛋白多肽質譜檢測
將樣品和 iRT 標準肽段以 10∶1 進行混合,利用 Agilent 1100 高效液相色譜系統,在 pH=10 的流動相中進行組分分離。將樣品載入到 Evosep 液相中,以 1 μL/min 的流速上樣到 15 cm 分析柱上進行分離,然后繼續在 Tims Tof 質譜儀中進行質譜掃描,質譜范圍 100~
1.6 可信蛋白篩選
經 DDA 和 DIA 建庫后,利用所建數據庫檢索得到原始數據,保留任意一組樣品有表達值占比≥50% 的蛋白,用同組樣本均值填充,經中位數標準化及 log2 對數轉換,得到可信蛋白。
1.7 差異蛋白分析
用可信蛋白表達量進行主成分分析(principle component analysis, PCA),繪制 PCA 圖,PCA 圖中的每個點代表一個分組實驗中的一次,不同的顏色表示不同的分組,不同組別之間的點與點相距越遠表明差異顯著,反之亦然。在可信蛋白基礎上篩選差異蛋白,篩選條件為差異倍數為 2 倍且 t 檢驗 P<0.05。通過韋恩圖分析,篩選出各組間的共同差異蛋白。基于 Uniprot、京都基因和基因組數據庫(Kyoto Encyclopedia of Genes and Genomes, KEGG)、基因本體論(Gene Ontology, GO)、同源蛋白簇分析等數據庫,對所篩選出的共同差異蛋白實施生物信息學功能分析,主要包括 KEGG 通路分析和 GO 富集分析,并計算共同差異蛋白在生物信息學分析中各條目的富集程度[4]。通過 Python 3.6.8 軟件語言實現富集分析算法,Matplotlib 數據包(版本 3.2.2)實現繪圖。
1.8 統計學方法
采用 R 4.2.3 軟件進行統計分析。對正態分布的變量采用均數±標準差描述,組間比較進行單因素方差分析,兩兩比較采用 Bonferroni 法校正 P 值;分類變量采用例數描述,組間比較采用 Fisher 確切概率法。雙側檢驗水準 α=0.05。
2 結果
2.1 患者基線資料
共納入 15 例組織樣本,其中老年 cSCC 患者的 cSCC 組織、老年正常皮膚組織、年輕正常皮膚組織各 5 例。來源患者基線如表1 所示。
2.2 蘇木精-伊紅染色樣本組織結構變化
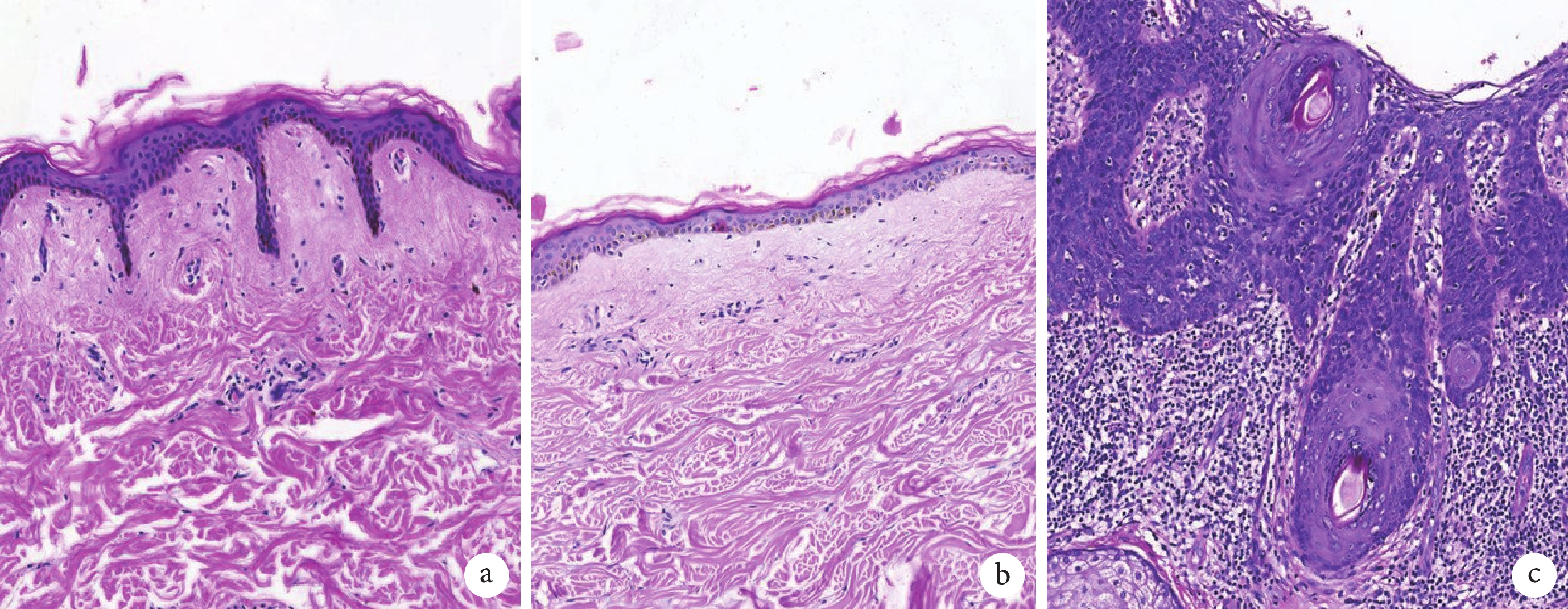
如圖1 所示,與年輕人相比,老年人正常皮膚組織表皮與真皮乳頭層組織細胞減少,組織層次相對變薄,其交界面乳狀突消失呈現扁平化,膠原纖維密度增加且其排列方向更加有序;與衰老的正常皮膚組織相比,cSCC 組織上皮細胞異型增生,核分裂異常伴深染,細胞擁擠排列呈癌巢狀,伴局部炎癥細胞浸潤,可見同心圓排列的角化珠形成。
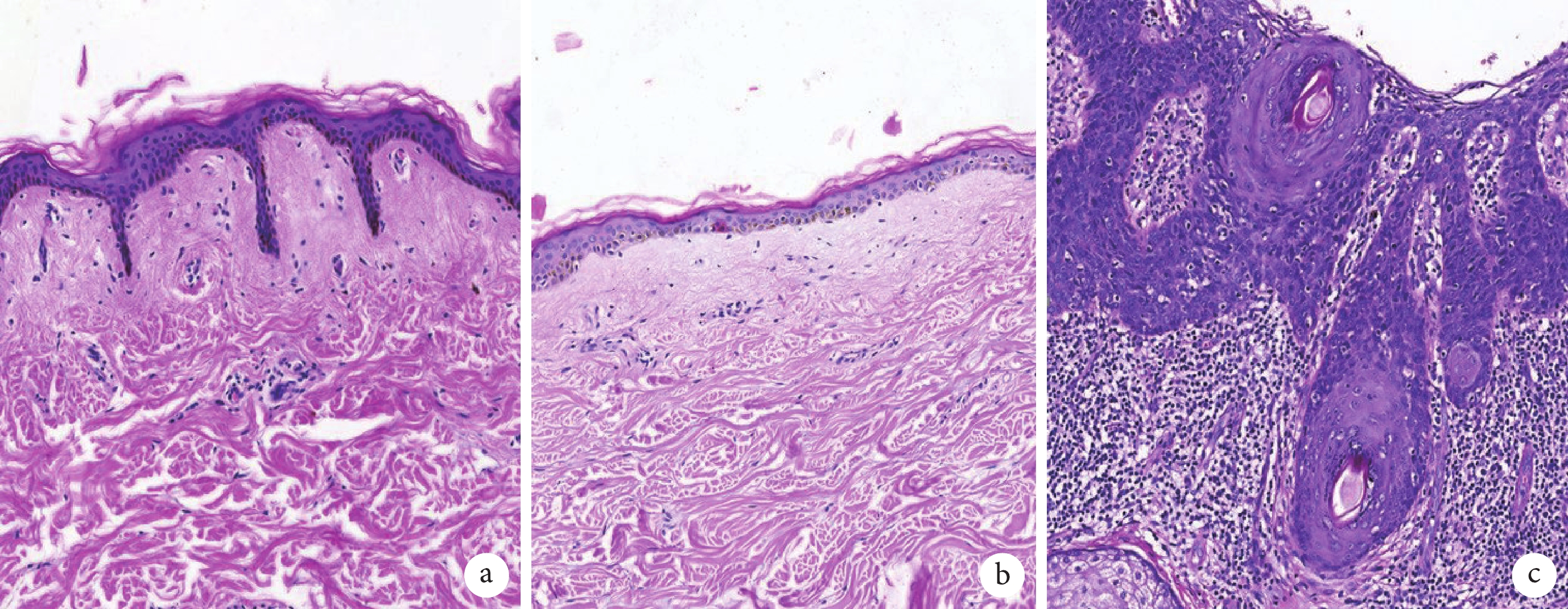 圖1
各組患者皮膚組織病理圖片(HE ×40)
圖1
各組患者皮膚組織病理圖片(HE ×40)
a. 年輕皮膚整形患者下腹部正常皮膚組織;b. 老年皮膚整形患者下腹部正常皮膚組織;c. 老年 cSCC 患者背部 cSCC 組織。HE:蘇木精-伊紅染色;cSCC:皮膚鱗狀細胞癌
2.3 石蠟樣本蛋白肽段的定量結果
各組石蠟樣本經過脫蠟、PCT 輔助裂解與酶切、肽段純化等方法處理后,最終各組樣品的肽段量均滿足蛋白質組學分析所需肽段量(表2)。
2.4 總體蛋白的鑒定和分析
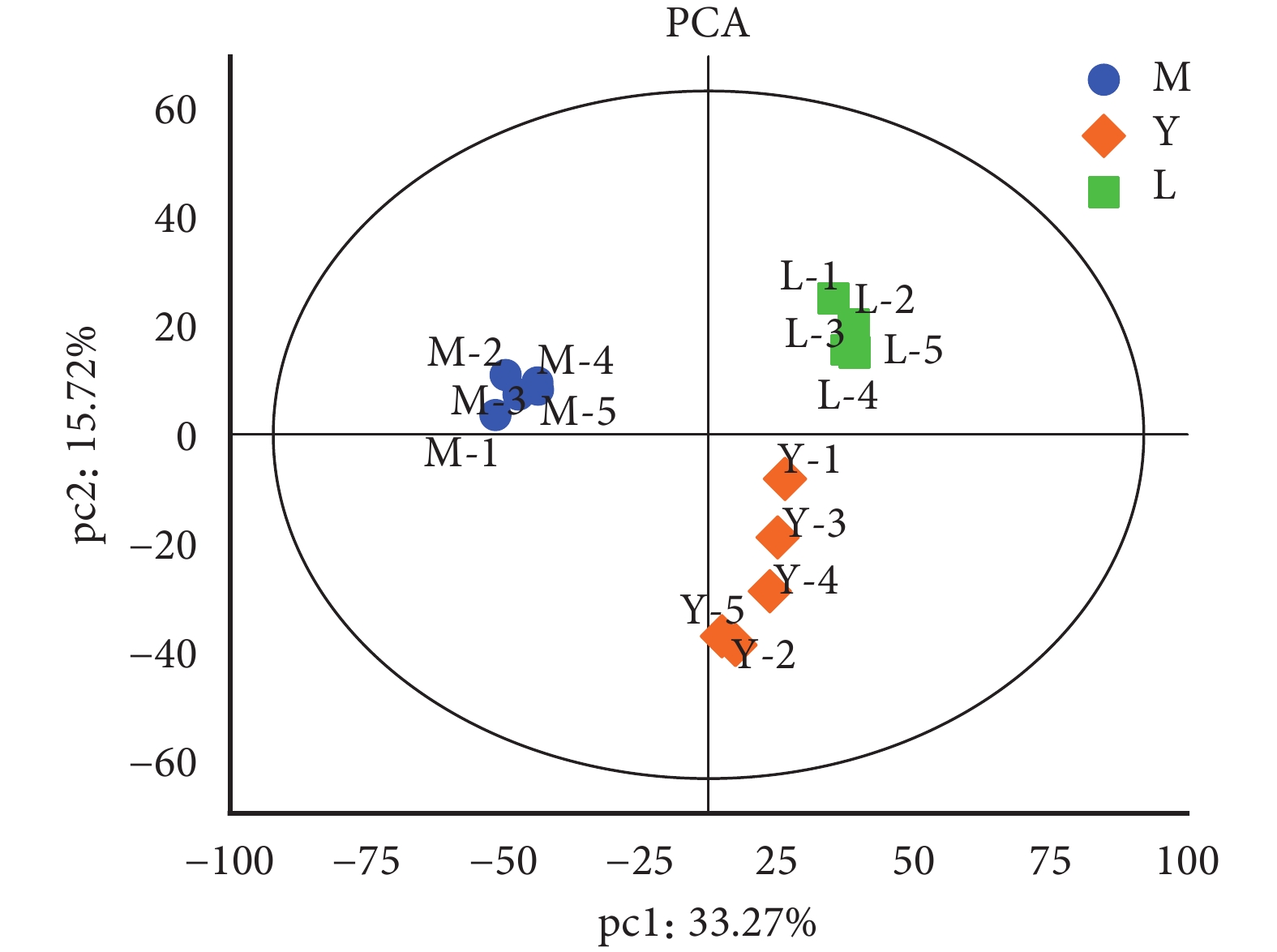
通過對年輕人組、老年人組、cSCC 組共 15 個組織樣本的蛋白質組學分析,共鑒別到
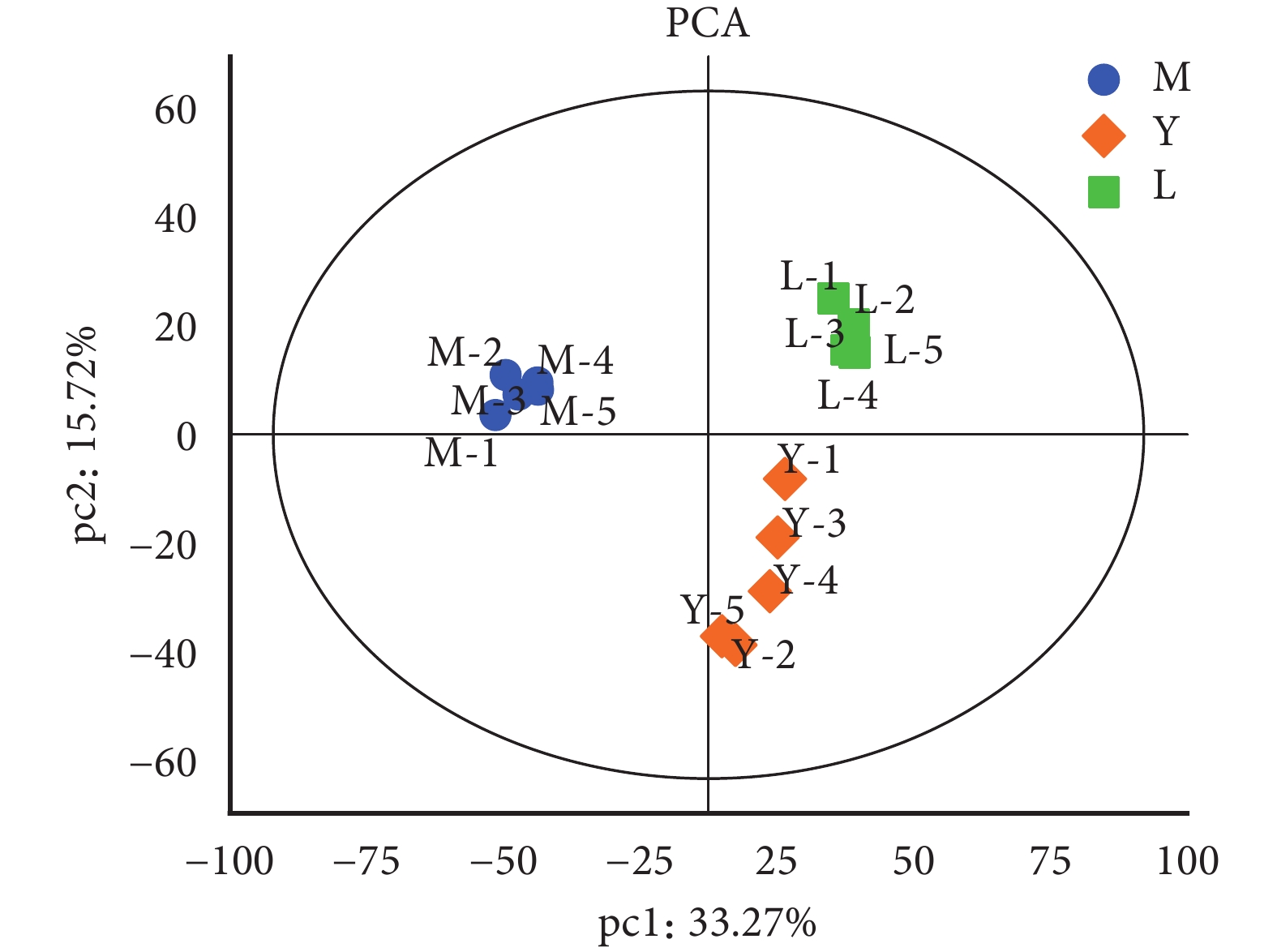 圖2
樣本間趨勢分布的 PCA 圖
圖2
樣本間趨勢分布的 PCA 圖
PCA:主成分分析;M:老年人組;Y:年輕人組;L:老年皮膚鱗狀細胞癌組
2.5 差異蛋白的篩選和功能分析
2.5.1 差異蛋白的篩選
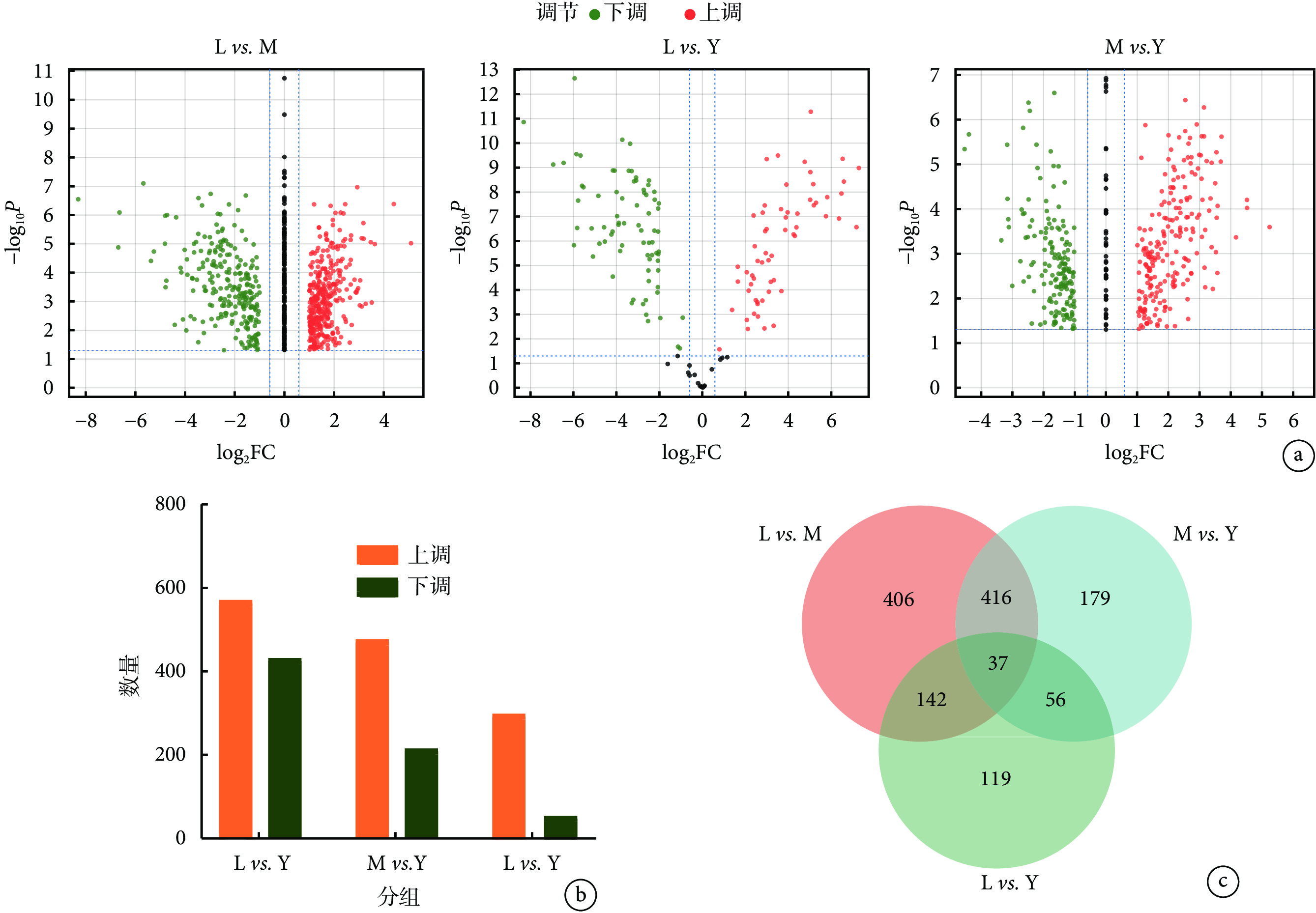
分別通過 cSCC 與老年人、老年人與年輕人及 cSCC 與年輕人的組間對比,篩選組間比較的差異蛋白(圖3a、3b)。cSCC 組織與老年人皮膚樣本相比共篩選得到
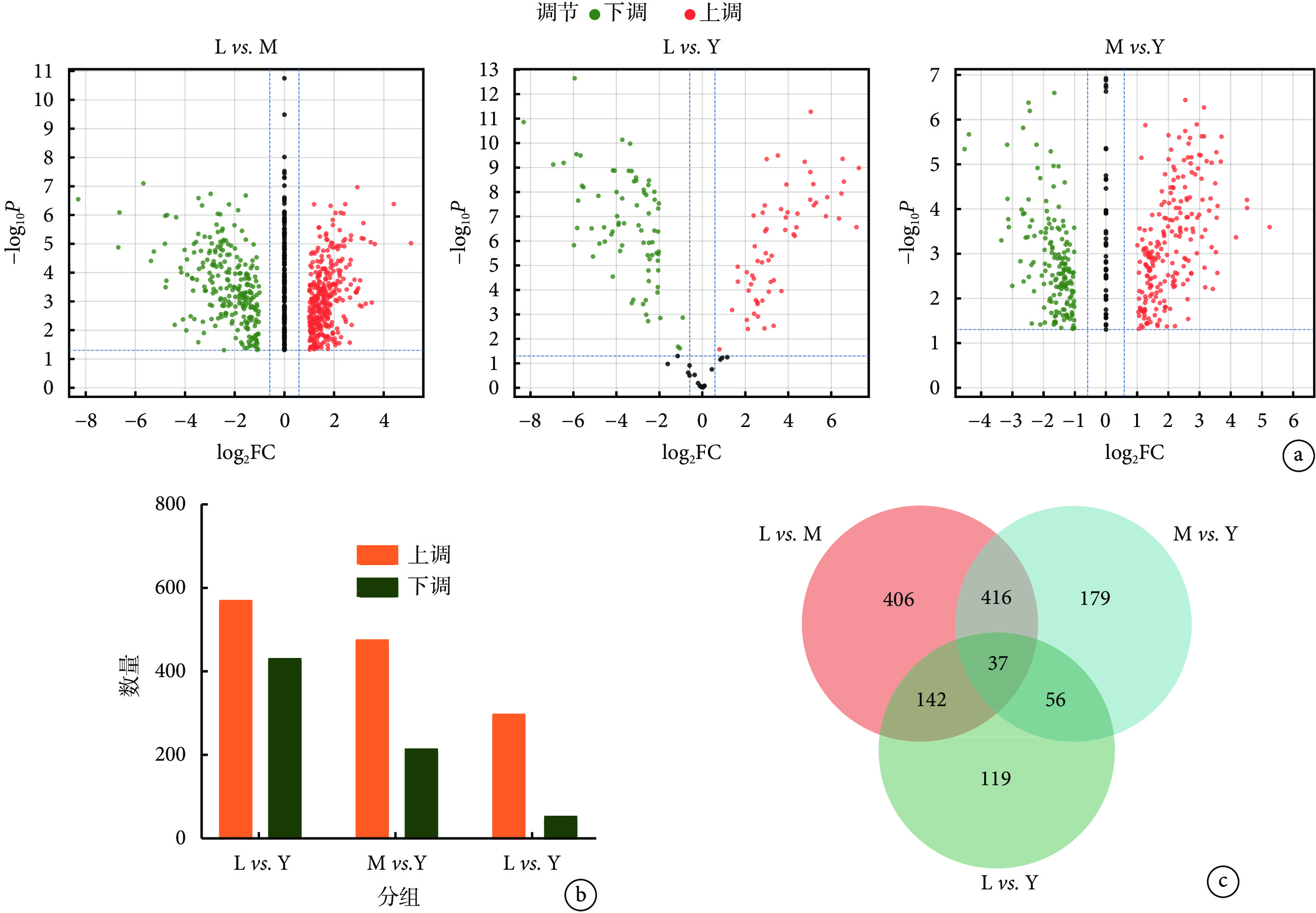 圖3
組間差異蛋白和共同差異蛋白分析
圖3
組間差異蛋白和共同差異蛋白分析
a. 組間差異蛋白的火山圖分析;b. 樣本間差異蛋白數量統計;c. 共同差異蛋白數量的韋恩圖分析。L:老年皮膚鱗狀細胞癌組;M:老年人組;Y:年輕人組;FC:差異倍數
有 37 種蛋白質在 cSCC 與老年人、老年人與年輕人及 cSCC 與年輕人的組間對比中呈共同差異性表達(圖3c)。通過篩查相關數據庫發現,37 種共同差異蛋白中有 8 種來源于 ECM,分別為 Ⅵ 型膠原蛋白 α6 鏈、α-1 抗胰蛋白酶、胰島素樣生長因子結合蛋白 7、Ⅱ型膠原蛋白 α1 鏈、組織蛋白酶 D、Decorin、Mimecan、Prolargin(表4)。胰島素樣生長因子結合蛋白 7 和組織蛋白酶 D 隨著衰老的發生在正常皮膚組織中表達量上調(P<0.001),而在 cSCC 組織中其表達量較衰老的正常皮膚組織高(P<0.001),Ⅵ型膠原蛋白 α6 鏈、α-1 抗胰蛋白酶、Ⅱ型膠原蛋白 α1 鏈、Decorin、Mimecan、Prolargin 隨衰老在正常皮膚組織中表達量下調(P<0.001),與衰老的正常皮膚組織相比,在 cSCC 組織中Ⅵ型膠原蛋白 α6 鏈、α-1 抗胰蛋白酶、Ⅱ型膠原蛋白 α1 鏈、Decorin、Mimecan、Prolargin 的表達量進一步下調(P<0.001)。
2.5.2 差異蛋白的功能分析
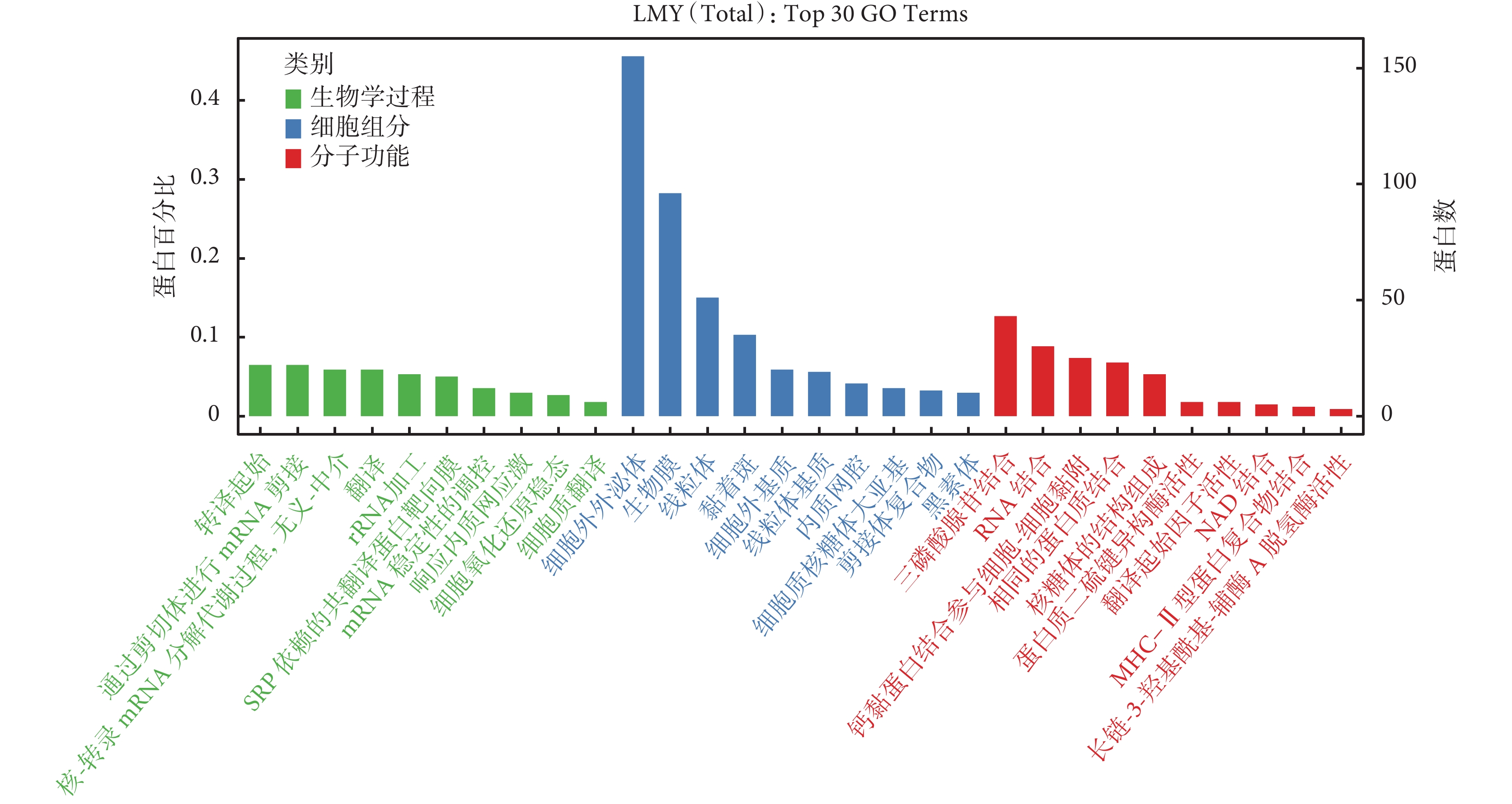
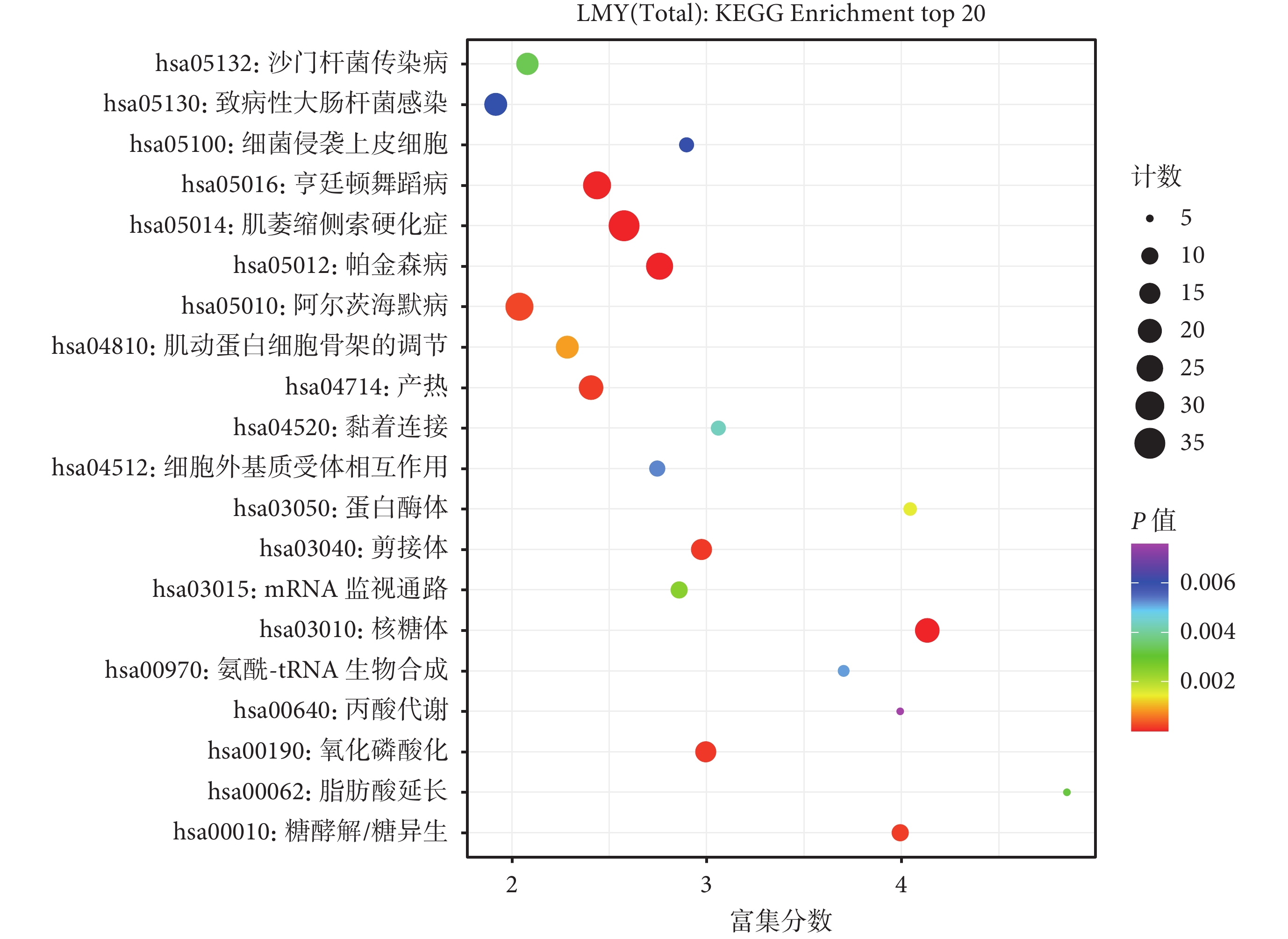
8 種來源于 ECM 的共同差異蛋白的 GO 富集分析結果如圖4 所示,其分子功能主要是參與 ECM 結構的形成、賦予 ECM 抗拉強度以及與血小板源性生長因子相結合等;涉及的生物學過程主要包括硫酸角質素分解代謝過程、硫酸角質素的生物合成過程及膠原的分解代謝過程等。KEGG 途徑富集分析表明,8 種來源于 ECM 的共同差異蛋白參與的代謝途徑主要包括 ECM 與受體的相互作用、蛋白質消化吸收和局部黏附(圖5)。
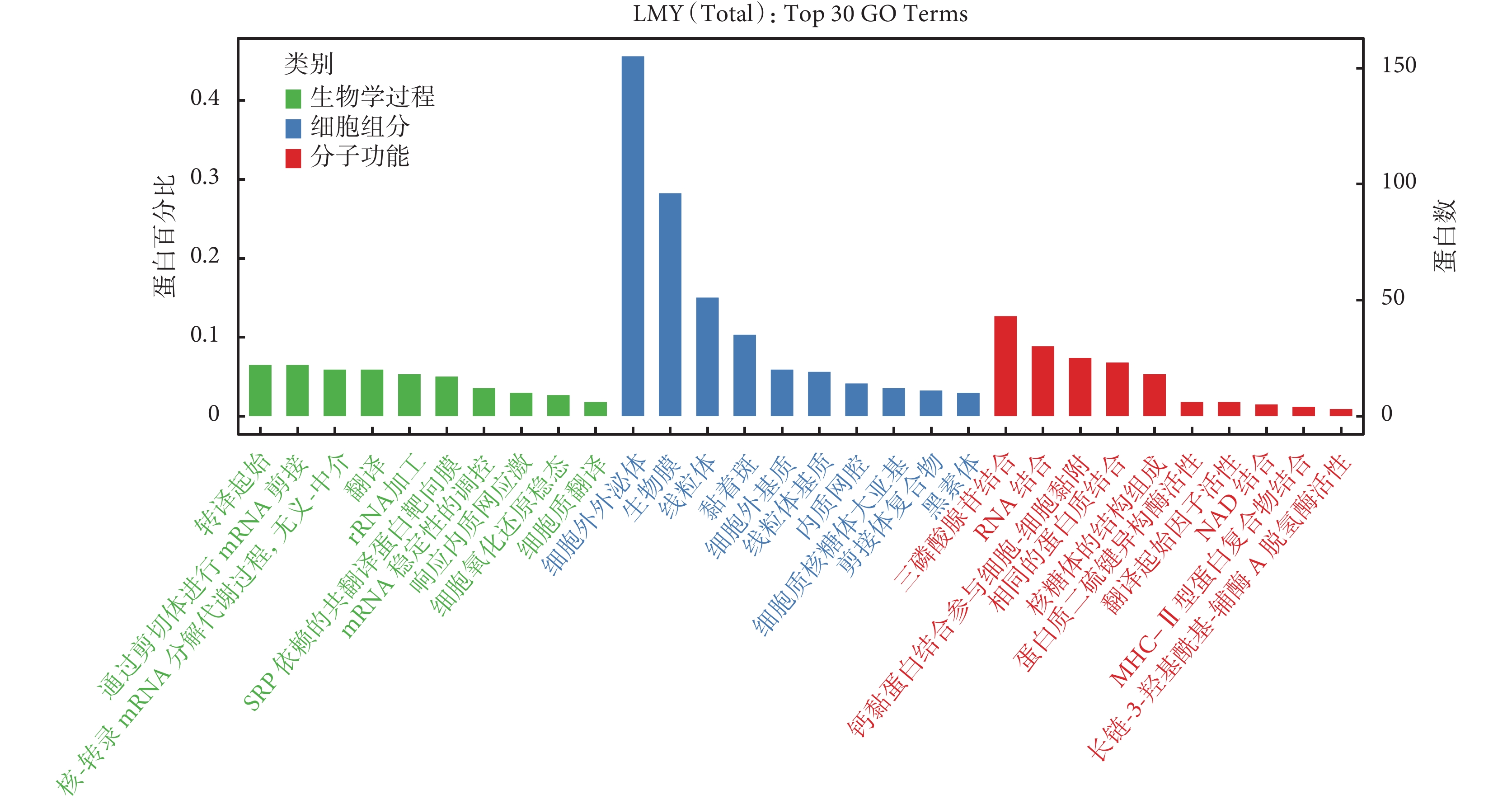 圖4
8 種來源于 ECM 的共同差異蛋白的 GO 富集分析結果
圖4
8 種來源于 ECM 的共同差異蛋白的 GO 富集分析結果
ECM:細胞外基質;GO:基因本體論;LMY(Total):皮膚鱗狀細胞癌組、老年人組、年輕人組共同差異蛋白;Top 30 GO Term:排名前 30 位的 GO 條目;SRP:信號識別顆粒;MHC:主要組織相容性復合體;NAD:煙酰胺腺嘌呤二核苷酸
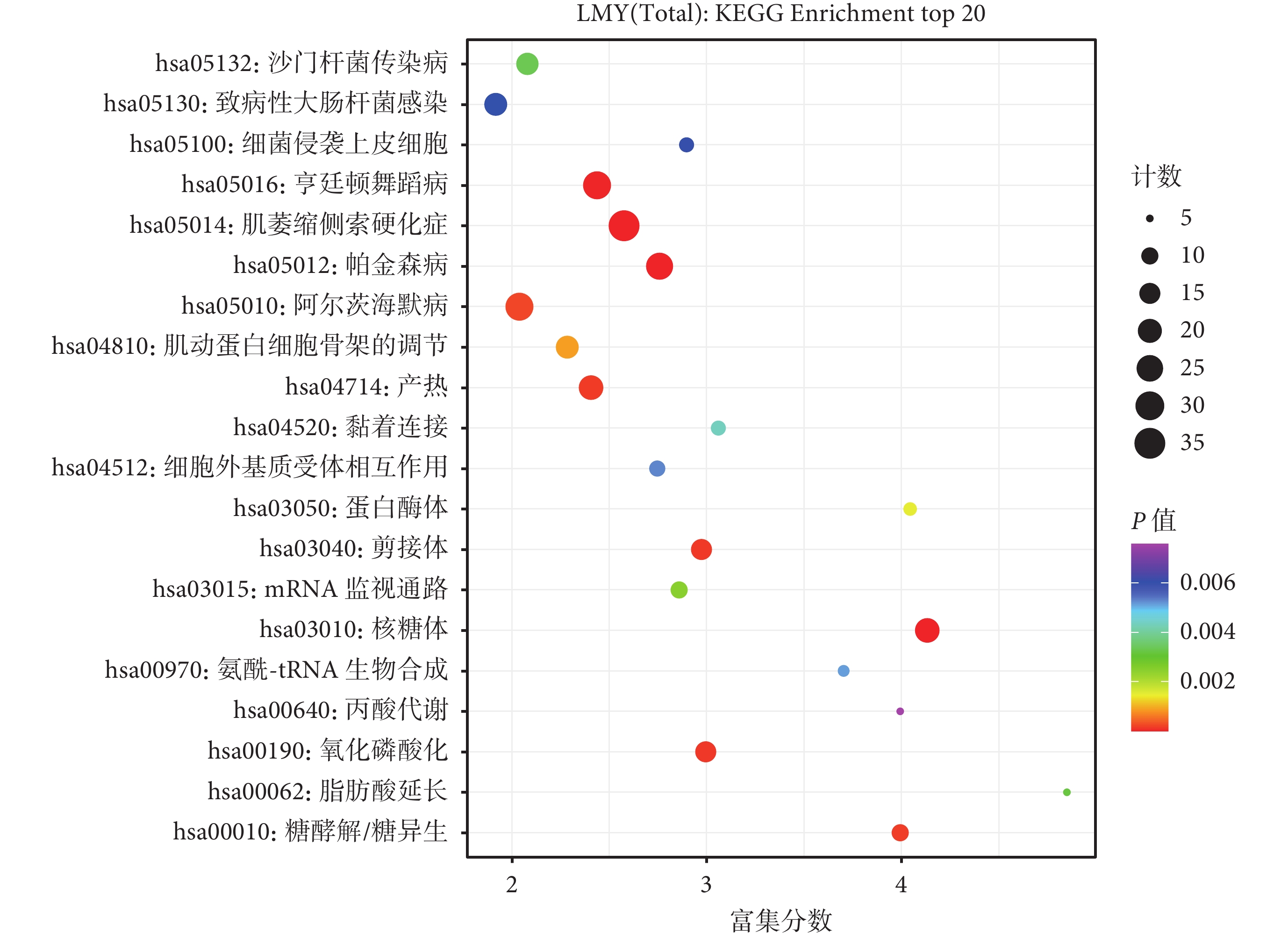 圖5
8 種來源于 ECM 的共同差異蛋白的 KEGG 富集分析結果
圖5
8 種來源于 ECM 的共同差異蛋白的 KEGG 富集分析結果
ECM:細胞外基質;KEGG:京都基因和基因組數據庫;LMY(Total):皮膚鱗狀細胞癌組、老年人組、年輕人組共同差異蛋白;KEGG Enrichment top 20: 排名前 20 位的 KEGG 富集結果
3 討論
皮膚是人體面積最大的器官,它充當身體敏感的內部組織和外部環境之間的屏障,機體衰老最容易在皮膚中表現出來。既往研究表明 cSCC 易發生于衰老皮膚中,年齡是 cSCC 發生的危險因素之一[5]。隨著年齡的增長,皮膚的屏障功能更易受損,衰老皮膚發生的組織結構改變可能也是 cSCC 發生的原因[5-6]。
隨著機體的衰老,表皮中的細胞數量減少,表皮周轉時間延長,角質形成細胞的形態由于表皮周轉率的降低而發生改變。真皮與表皮交界面乳狀突消失呈現扁平化,是在老年皮膚中發現的最常見的變化,這主要是由于真皮乳頭的變性、減少及上皮釘突的回縮。其扁平化減少了表皮與真皮之間的交錯,導致對剪切力的抵抗性降低,使皮膚更容易受到損傷。同時其扁平化減少了真皮和表皮之間的溝通,使細胞營養和氧氣的供應減弱[7],也增加了真皮與表皮分離的可能性,這一過程可能是皺紋形成的機制之一[8]。真皮主要由結締組織組成,但也含有汗腺等附屬器官以及血管和神經,它的主要作用是提供網狀結構支撐表皮并連接深層組織。真皮組織的成分結構與生理功能隨著機體的衰老而退化,組織層次相對變薄,血管生成減少。真皮膠原纖維在老化的皮膚中,膠原纖維的密度增加,失去了可伸展的結構,導致結締組織硬度增加,扭轉延伸性降低、彈性降低,同時也增加了對損傷的易感性[9]。cCSS 在組織病理學上表現為與非典型、多形性角質形成細胞聚集有關,表現為核異型性、角化不良和極性喪失,異型增生的上皮細胞擁擠排列形成癌巢,中間可見同心性排列的角化珠組成,部分惡性細胞可穿透基底膜向遠處侵襲[10]。在本研究中,組織病理學上觀察到隨著皮膚組織的衰老,皮膚變化與既往報道相同[7],衰老導致皮膚組織變薄、細胞數量減少,這種變化減弱了皮膚的再生能力和屏障能力,增強了腫瘤易感性,而膠原纖維的排列更加整齊則有利于 cSCC 的發生和局部侵襲。
既往研究表明,ECM 是腫瘤微環境的重要組分之一,腫瘤細胞和 ECM 所構成的微環境相互作用會使 ECM 中的蛋白發生改變,這些改變能促進腫瘤的增殖、轉移、耐藥性的產生[11-12]。本次研究通過基于 PCT 的蛋白質組學檢測技術,對年輕人皮膚組織、老年人皮膚組織及老年 cSCC 樣本進行了蛋白質的定性和定量分析,篩選組間差異蛋白,通過篩查相關數據庫發現,37 種共同差異蛋白中有 8 種來源于 ECM,包括 Mimecan、Prolargin、Ⅵ型膠原蛋白 α6 鏈、Ⅱ型膠原蛋白 α1 鏈、α-1 抗胰蛋白酶、胰島素樣生長因子結合蛋白 7、組織蛋白酶 D 和 Decorin;生物信息學功能分析表明,上述蛋白主要參與 ECM 的形態結構形成與抗拉強度、與血小板源性生長因子及受體的相互作用、膠原分解代謝、細胞黏附作用等。
Mimecan 是一種由 OGN 基因編碼的具有串聯重復序列的蛋白多糖,可與轉化生長因子 β 一起誘導異位骨形成,并可能調節成骨細胞的分化[13]。Mimecan 在上皮來源的正常細胞中廣泛表達,而有研究表明其在多種腫瘤細胞中的表達相對于正常組織有不同程度的降低,可通過抑制表皮生長因子受體/蛋白激酶 B/鋅指 E 盒結合同源蛋白1 信號通路的活化,限制腫瘤的進展和轉移,并與腫瘤患者的生存預后相關[14-15]。
Prolargin 是一種由 PRELP 基因編碼的存在于結締組織 ECM 中的重復蛋白,存在于多種 ECM 中,能夠結合骨膠原和膠原蛋白,并將基底膜錨定在結締組織下面[16]。有研究表明,Prolargin 在部分腫瘤中差異性表達,并可通過抑制核因子 κB 信號通路來延長胰腺導管腺癌患者的生存期[17]。同時也有研究表明在肝細胞癌中 Prolargin 能結合肝細胞和成纖維細胞生長因子并抑制其功能,從而抑制腫瘤細胞的生長[18]。
Ⅵ型膠原蛋白 α6 鏈是一種由 COL6A6 基因所編碼的前體膠原,主要參與 ECM 中Ⅵ型膠原蛋白的形成,在人皮膚中定位于真皮乳頭和網狀真皮血管周圍,真皮-表皮交界區下方不連續分布[19]。雖然Ⅵ型膠原蛋白 α6 鏈與腫瘤的相關研究較少,但有文獻指出 COL6A6 基因在部分腫瘤中差異性表達,并且 COL6A6 可以通過阻斷磷脂酰肌醇 3 激酶相關信號通路,進一步抑制惡性腫瘤的增殖與侵襲[20],而在非小細胞肺癌中 COL6A6 可以通過影響 JAK 信號通路從而抑制腫瘤的增殖和轉移[21]。
Ⅱ型膠原蛋白 α1 鏈是一種由 COL2A1 基因所編碼的前體膠原,主要參與 ECM 中Ⅱ型膠原蛋白的形成,主要分布于軟骨中,這種膠原纖維網絡允許軟骨包裹蛋白多糖聚合體,并為組織提供抗張強度[22]。有研究報道,COL2A1 是食管鱗狀細胞癌的潛在生物標志物之一,其在腫瘤中的差異性表達與患者的預后相關[23]。
α-1 抗胰蛋白酶是一種由 SERPINA1 基因編碼的糖蛋白。其生物學作用可以使多種蛋白酶失活,不僅限制結締組織中彈性蛋白酶活性以限制細胞外結締組織降解,還可以調高組織局部免疫反應活性[24]。部分文獻報道指出 α-1 抗胰蛋白酶缺乏與肝癌、膀胱癌、膽囊癌、惡性淋巴瘤和肺癌的風險增加有關[25]。同時,生物工程合成的 α1-抗胰蛋白酶可以通過阻斷與腫瘤相關的前蛋白轉化酶底物的活性來抑制鱗狀細胞癌的侵襲性[23]。
胰島素樣生長因子結合蛋白 7 是胰島素樣生長因子(insulin-like growth factor, IGF)的結合蛋白,由 IGFBP7 基因編碼。其主要功能是可通過與 IGF 的相互作用,調節 IGF 在體液和組織中的活性,并調節 IGF 與其受體的結合,還能刺激前列環素的產生和細胞的黏附作用。研究表明,IGFBP7 在肝細胞癌、消化道癌等多種惡性腫瘤中下調,IGFBP7 能抑制腫瘤內血管生成從而抑制腫瘤的生長,IGFBP7 的下調可能與腫瘤的發生相關[26-27]。
組織蛋白酶 D 是一種由 CTSD 基因編碼的具有酶活性的 ECM 蛋白,參與多種肽段和蛋白質的水解,主要功能是降解蛋白質并激活溶酶體前室中生物活性蛋白的前體[28]。有研究指出,活性的組織蛋白酶 D 通過阻止胱抑素 C 對蛋白酶的抑制作用,促進腫瘤間質中的 ECM 蛋白裂解,使癌細胞侵入局部組織,從而在腫瘤進展中發揮重要作用[29]。同時,組織蛋白酶 D 的過表達可刺激腫瘤的發生,并啟動腫瘤細胞凋亡,這種蛋白酶被認為是乳腺癌預后不良的獨立標志[30]。
Decorin 是一種由 DCN 基因編碼的 ECM 中的蛋白多糖,由含重復序列的蛋白核心和硫酸軟骨素等合成的糖胺聚糖鏈所聚集形成,主要參與細胞周期調節、ECM 膠原纖維合成代謝、基質血管形成、ECM 成分結構組裝等[31]。據報道,Decorin 的差異性表達在食管鱗狀細胞癌的發生發展起著重要作用,是檢測食管癌的潛在臨床標志物[32],且與口腔鱗狀細胞癌的化療耐藥機制及患者的預后相關[33]。
綜上所述,本次研究結果表明,隨著衰老的發生,皮膚組織結構及組成成分發生相應的變化。隨著機體的衰老,皮膚組織相應變薄,膠原纖維排列更加整齊,這些變化使皮膚更易受到內源性和外源性的損傷。同時在機體衰老的過程中皮膚組織局部蛋白質成分發生改變,在 ECM 中具有抑制腫瘤進展功能的蛋白表達下調,而具有促進腫瘤進展功能的蛋白表達上調。皮膚組織結構和組成成分的改變可能通過影響腫瘤微環境的調節機制,進而影響 cSCC 的發生與發展。
利益沖突:所有作者聲明不存在利益沖突。
皮膚鱗狀細胞癌(cutaneous squamous cell carcinoma, cSCC)的發生是一個復雜的生物學過程,cSCC 的生長、局部侵襲和遠處轉移與其腫瘤微環境密不可分。細胞外基質(extracellular matrix, ECM)為腫瘤微環境的重要組成部分,其組分會隨著衰老發生改變,腫瘤的發生與 ECM 的改變密切相關[1-2]。因此檢測 ECM 蛋白的成分組成及排列結構的變化,有助于了解細胞周圍組織環境的生理情況,進一步探索可能與疾病相關的蛋白分子靶點。本研究嘗試應用基于壓力循環技術(pressure cycling technology, PCT)的蛋白質組學檢測技術,對不同年齡的正常皮膚組織及 cSCC 組織進行全蛋白質組的相對定性定量分析,通過組間對比,尋找與皮膚衰老相關的蛋白質及衰老相關蛋白與 cSCC 的相關性,以期為探索衰老導致的 ECM 改變和 cSCC 發生機制以及 cSCC 的治療靶標篩選提供新的依據。
1 對象與方法
1.1 研究對象
本研究通過四川大學華西醫院(以下簡稱“我院”)生物醫學倫理審查委員會批準(批件號:2021 年審 98 號)。隨機選取我院 2019 年 1 月—2020 年 12 月收治的 5 例老年 cSCC 患者皮膚樣本及 5 例年輕腹壁整形患者和 5 例老年腹壁整形患者手術中切除的多余正常皮膚組織樣本作為研究對象。納入標準:① 于我院手術,術后經石蠟病理結果證實為 cSCC 的老年患者,或于我院進行整形手術且愿意捐獻術中所切除的多余正常皮膚組織的患者;② 患者臨床資料完善;③ 患者有保存完好的病理石蠟標本。排除標準:① 患有嚴重全身性合并癥或其他惡性腫瘤;② 蠟塊質量不佳。根據世界衛生組織人類年齡劃分新標準,年齡<45 歲的患者納入年輕人組,年齡>65 歲的患者納入老年組,年齡>65 歲且診斷 cSCC 的患者納入 cSCC 組[3]。
1.2 主要試劑與儀器
iRT 標準肽段購于瑞士 Biognosys 公司;乙腈購于美國賽默飛世爾科技公司;庚烷、三羥甲基氨基甲烷鹽酸鹽(pH=10)、尿素、吲哚-3-乙酸、三(2-羧乙基)膦、三氟乙酸、乙二胺四乙酸鈉、碳酸氫銨均購于中國生工生物工程(上海)股份有限公司。用于研究的主要儀器包括 Tims Tof pro 質譜儀(美國 Bruker 公司)、Evosep one 液相(丹麥 Evosep 公司)、Barocycler PCT 儀(美國 Pressure BioSciences 公司)、Votext 旋渦震蕩儀(美國 Scientific Industries 公司)、NanoDrop 1000 分光光度計(美國賽默飛世爾科技公司)、高 pH 分離液相色譜儀(美國 Agilent 公司)、ImageScanner 掃描儀(美國 GE Healthcare 公司)、Agilent 1100 高效液相色譜系統(美國 Agilent 公司)。
1.3 蘇木精-伊紅染色
取已制備好的蠟塊 3 μm 連續切片備用。切片浸于二甲苯中脫蠟并通過梯度乙醇浸泡流水沖洗,經蘇木素染色后 2% 鹽酸乙醇分色,流水沖洗,伊紅染液染色后梯度乙醇脫水,二甲苯透明,中性樹膠封片。
1.4 蛋白多肽提取
將石蠟切片和庚烷混合震蕩后用梯度乙醇充分洗滌并離心,將沉淀和甲酸混合并離心吸去上清液后加入三羥甲基氨基甲烷鹽酸鹽(pH=10)緩沖液并慢速震蕩,待充分震蕩后加入裂解液放入 PCT 儀中充分反應。反應結束后加入碳酸氫銨溶液和胞內蛋白酶(酶∶蛋白=1∶40,m/m)并放于 PCT 儀中充分反應。反應結束后加入碳酸氫銨溶液和胰酶并放于 PCT 儀中反應。反應結束后加入 10% 三氟乙酸溶液終止胰酶酶切,并通過依次加入甲醇、乙腈并離心,活化 C18 微型柱。將上述肽段溶液約 160 μL 加入 C18 柱中,離心半徑 13.5 cm、轉速
1.5 蛋白多肽質譜檢測
將樣品和 iRT 標準肽段以 10∶1 進行混合,利用 Agilent 1100 高效液相色譜系統,在 pH=10 的流動相中進行組分分離。將樣品載入到 Evosep 液相中,以 1 μL/min 的流速上樣到 15 cm 分析柱上進行分離,然后繼續在 Tims Tof 質譜儀中進行質譜掃描,質譜范圍 100~
1.6 可信蛋白篩選
經 DDA 和 DIA 建庫后,利用所建數據庫檢索得到原始數據,保留任意一組樣品有表達值占比≥50% 的蛋白,用同組樣本均值填充,經中位數標準化及 log2 對數轉換,得到可信蛋白。
1.7 差異蛋白分析
用可信蛋白表達量進行主成分分析(principle component analysis, PCA),繪制 PCA 圖,PCA 圖中的每個點代表一個分組實驗中的一次,不同的顏色表示不同的分組,不同組別之間的點與點相距越遠表明差異顯著,反之亦然。在可信蛋白基礎上篩選差異蛋白,篩選條件為差異倍數為 2 倍且 t 檢驗 P<0.05。通過韋恩圖分析,篩選出各組間的共同差異蛋白。基于 Uniprot、京都基因和基因組數據庫(Kyoto Encyclopedia of Genes and Genomes, KEGG)、基因本體論(Gene Ontology, GO)、同源蛋白簇分析等數據庫,對所篩選出的共同差異蛋白實施生物信息學功能分析,主要包括 KEGG 通路分析和 GO 富集分析,并計算共同差異蛋白在生物信息學分析中各條目的富集程度[4]。通過 Python 3.6.8 軟件語言實現富集分析算法,Matplotlib 數據包(版本 3.2.2)實現繪圖。
1.8 統計學方法
采用 R 4.2.3 軟件進行統計分析。對正態分布的變量采用均數±標準差描述,組間比較進行單因素方差分析,兩兩比較采用 Bonferroni 法校正 P 值;分類變量采用例數描述,組間比較采用 Fisher 確切概率法。雙側檢驗水準 α=0.05。
2 結果
2.1 患者基線資料
共納入 15 例組織樣本,其中老年 cSCC 患者的 cSCC 組織、老年正常皮膚組織、年輕正常皮膚組織各 5 例。來源患者基線如表1 所示。
2.2 蘇木精-伊紅染色樣本組織結構變化
如圖1 所示,與年輕人相比,老年人正常皮膚組織表皮與真皮乳頭層組織細胞減少,組織層次相對變薄,其交界面乳狀突消失呈現扁平化,膠原纖維密度增加且其排列方向更加有序;與衰老的正常皮膚組織相比,cSCC 組織上皮細胞異型增生,核分裂異常伴深染,細胞擁擠排列呈癌巢狀,伴局部炎癥細胞浸潤,可見同心圓排列的角化珠形成。
 圖1
各組患者皮膚組織病理圖片(HE ×40)
圖1
各組患者皮膚組織病理圖片(HE ×40)
a. 年輕皮膚整形患者下腹部正常皮膚組織;b. 老年皮膚整形患者下腹部正常皮膚組織;c. 老年 cSCC 患者背部 cSCC 組織。HE:蘇木精-伊紅染色;cSCC:皮膚鱗狀細胞癌
2.3 石蠟樣本蛋白肽段的定量結果
各組石蠟樣本經過脫蠟、PCT 輔助裂解與酶切、肽段純化等方法處理后,最終各組樣品的肽段量均滿足蛋白質組學分析所需肽段量(表2)。
2.4 總體蛋白的鑒定和分析
通過對年輕人組、老年人組、cSCC 組共 15 個組織樣本的蛋白質組學分析,共鑒別到
 圖2
樣本間趨勢分布的 PCA 圖
圖2
樣本間趨勢分布的 PCA 圖
PCA:主成分分析;M:老年人組;Y:年輕人組;L:老年皮膚鱗狀細胞癌組
2.5 差異蛋白的篩選和功能分析
2.5.1 差異蛋白的篩選
分別通過 cSCC 與老年人、老年人與年輕人及 cSCC 與年輕人的組間對比,篩選組間比較的差異蛋白(圖3a、3b)。cSCC 組織與老年人皮膚樣本相比共篩選得到
 圖3
組間差異蛋白和共同差異蛋白分析
圖3
組間差異蛋白和共同差異蛋白分析
a. 組間差異蛋白的火山圖分析;b. 樣本間差異蛋白數量統計;c. 共同差異蛋白數量的韋恩圖分析。L:老年皮膚鱗狀細胞癌組;M:老年人組;Y:年輕人組;FC:差異倍數
有 37 種蛋白質在 cSCC 與老年人、老年人與年輕人及 cSCC 與年輕人的組間對比中呈共同差異性表達(圖3c)。通過篩查相關數據庫發現,37 種共同差異蛋白中有 8 種來源于 ECM,分別為 Ⅵ 型膠原蛋白 α6 鏈、α-1 抗胰蛋白酶、胰島素樣生長因子結合蛋白 7、Ⅱ型膠原蛋白 α1 鏈、組織蛋白酶 D、Decorin、Mimecan、Prolargin(表4)。胰島素樣生長因子結合蛋白 7 和組織蛋白酶 D 隨著衰老的發生在正常皮膚組織中表達量上調(P<0.001),而在 cSCC 組織中其表達量較衰老的正常皮膚組織高(P<0.001),Ⅵ型膠原蛋白 α6 鏈、α-1 抗胰蛋白酶、Ⅱ型膠原蛋白 α1 鏈、Decorin、Mimecan、Prolargin 隨衰老在正常皮膚組織中表達量下調(P<0.001),與衰老的正常皮膚組織相比,在 cSCC 組織中Ⅵ型膠原蛋白 α6 鏈、α-1 抗胰蛋白酶、Ⅱ型膠原蛋白 α1 鏈、Decorin、Mimecan、Prolargin 的表達量進一步下調(P<0.001)。
2.5.2 差異蛋白的功能分析
8 種來源于 ECM 的共同差異蛋白的 GO 富集分析結果如圖4 所示,其分子功能主要是參與 ECM 結構的形成、賦予 ECM 抗拉強度以及與血小板源性生長因子相結合等;涉及的生物學過程主要包括硫酸角質素分解代謝過程、硫酸角質素的生物合成過程及膠原的分解代謝過程等。KEGG 途徑富集分析表明,8 種來源于 ECM 的共同差異蛋白參與的代謝途徑主要包括 ECM 與受體的相互作用、蛋白質消化吸收和局部黏附(圖5)。
 圖4
8 種來源于 ECM 的共同差異蛋白的 GO 富集分析結果
圖4
8 種來源于 ECM 的共同差異蛋白的 GO 富集分析結果
ECM:細胞外基質;GO:基因本體論;LMY(Total):皮膚鱗狀細胞癌組、老年人組、年輕人組共同差異蛋白;Top 30 GO Term:排名前 30 位的 GO 條目;SRP:信號識別顆粒;MHC:主要組織相容性復合體;NAD:煙酰胺腺嘌呤二核苷酸
 圖5
8 種來源于 ECM 的共同差異蛋白的 KEGG 富集分析結果
圖5
8 種來源于 ECM 的共同差異蛋白的 KEGG 富集分析結果
ECM:細胞外基質;KEGG:京都基因和基因組數據庫;LMY(Total):皮膚鱗狀細胞癌組、老年人組、年輕人組共同差異蛋白;KEGG Enrichment top 20: 排名前 20 位的 KEGG 富集結果
3 討論
皮膚是人體面積最大的器官,它充當身體敏感的內部組織和外部環境之間的屏障,機體衰老最容易在皮膚中表現出來。既往研究表明 cSCC 易發生于衰老皮膚中,年齡是 cSCC 發生的危險因素之一[5]。隨著年齡的增長,皮膚的屏障功能更易受損,衰老皮膚發生的組織結構改變可能也是 cSCC 發生的原因[5-6]。
隨著機體的衰老,表皮中的細胞數量減少,表皮周轉時間延長,角質形成細胞的形態由于表皮周轉率的降低而發生改變。真皮與表皮交界面乳狀突消失呈現扁平化,是在老年皮膚中發現的最常見的變化,這主要是由于真皮乳頭的變性、減少及上皮釘突的回縮。其扁平化減少了表皮與真皮之間的交錯,導致對剪切力的抵抗性降低,使皮膚更容易受到損傷。同時其扁平化減少了真皮和表皮之間的溝通,使細胞營養和氧氣的供應減弱[7],也增加了真皮與表皮分離的可能性,這一過程可能是皺紋形成的機制之一[8]。真皮主要由結締組織組成,但也含有汗腺等附屬器官以及血管和神經,它的主要作用是提供網狀結構支撐表皮并連接深層組織。真皮組織的成分結構與生理功能隨著機體的衰老而退化,組織層次相對變薄,血管生成減少。真皮膠原纖維在老化的皮膚中,膠原纖維的密度增加,失去了可伸展的結構,導致結締組織硬度增加,扭轉延伸性降低、彈性降低,同時也增加了對損傷的易感性[9]。cCSS 在組織病理學上表現為與非典型、多形性角質形成細胞聚集有關,表現為核異型性、角化不良和極性喪失,異型增生的上皮細胞擁擠排列形成癌巢,中間可見同心性排列的角化珠組成,部分惡性細胞可穿透基底膜向遠處侵襲[10]。在本研究中,組織病理學上觀察到隨著皮膚組織的衰老,皮膚變化與既往報道相同[7],衰老導致皮膚組織變薄、細胞數量減少,這種變化減弱了皮膚的再生能力和屏障能力,增強了腫瘤易感性,而膠原纖維的排列更加整齊則有利于 cSCC 的發生和局部侵襲。
既往研究表明,ECM 是腫瘤微環境的重要組分之一,腫瘤細胞和 ECM 所構成的微環境相互作用會使 ECM 中的蛋白發生改變,這些改變能促進腫瘤的增殖、轉移、耐藥性的產生[11-12]。本次研究通過基于 PCT 的蛋白質組學檢測技術,對年輕人皮膚組織、老年人皮膚組織及老年 cSCC 樣本進行了蛋白質的定性和定量分析,篩選組間差異蛋白,通過篩查相關數據庫發現,37 種共同差異蛋白中有 8 種來源于 ECM,包括 Mimecan、Prolargin、Ⅵ型膠原蛋白 α6 鏈、Ⅱ型膠原蛋白 α1 鏈、α-1 抗胰蛋白酶、胰島素樣生長因子結合蛋白 7、組織蛋白酶 D 和 Decorin;生物信息學功能分析表明,上述蛋白主要參與 ECM 的形態結構形成與抗拉強度、與血小板源性生長因子及受體的相互作用、膠原分解代謝、細胞黏附作用等。
Mimecan 是一種由 OGN 基因編碼的具有串聯重復序列的蛋白多糖,可與轉化生長因子 β 一起誘導異位骨形成,并可能調節成骨細胞的分化[13]。Mimecan 在上皮來源的正常細胞中廣泛表達,而有研究表明其在多種腫瘤細胞中的表達相對于正常組織有不同程度的降低,可通過抑制表皮生長因子受體/蛋白激酶 B/鋅指 E 盒結合同源蛋白1 信號通路的活化,限制腫瘤的進展和轉移,并與腫瘤患者的生存預后相關[14-15]。
Prolargin 是一種由 PRELP 基因編碼的存在于結締組織 ECM 中的重復蛋白,存在于多種 ECM 中,能夠結合骨膠原和膠原蛋白,并將基底膜錨定在結締組織下面[16]。有研究表明,Prolargin 在部分腫瘤中差異性表達,并可通過抑制核因子 κB 信號通路來延長胰腺導管腺癌患者的生存期[17]。同時也有研究表明在肝細胞癌中 Prolargin 能結合肝細胞和成纖維細胞生長因子并抑制其功能,從而抑制腫瘤細胞的生長[18]。
Ⅵ型膠原蛋白 α6 鏈是一種由 COL6A6 基因所編碼的前體膠原,主要參與 ECM 中Ⅵ型膠原蛋白的形成,在人皮膚中定位于真皮乳頭和網狀真皮血管周圍,真皮-表皮交界區下方不連續分布[19]。雖然Ⅵ型膠原蛋白 α6 鏈與腫瘤的相關研究較少,但有文獻指出 COL6A6 基因在部分腫瘤中差異性表達,并且 COL6A6 可以通過阻斷磷脂酰肌醇 3 激酶相關信號通路,進一步抑制惡性腫瘤的增殖與侵襲[20],而在非小細胞肺癌中 COL6A6 可以通過影響 JAK 信號通路從而抑制腫瘤的增殖和轉移[21]。
Ⅱ型膠原蛋白 α1 鏈是一種由 COL2A1 基因所編碼的前體膠原,主要參與 ECM 中Ⅱ型膠原蛋白的形成,主要分布于軟骨中,這種膠原纖維網絡允許軟骨包裹蛋白多糖聚合體,并為組織提供抗張強度[22]。有研究報道,COL2A1 是食管鱗狀細胞癌的潛在生物標志物之一,其在腫瘤中的差異性表達與患者的預后相關[23]。
α-1 抗胰蛋白酶是一種由 SERPINA1 基因編碼的糖蛋白。其生物學作用可以使多種蛋白酶失活,不僅限制結締組織中彈性蛋白酶活性以限制細胞外結締組織降解,還可以調高組織局部免疫反應活性[24]。部分文獻報道指出 α-1 抗胰蛋白酶缺乏與肝癌、膀胱癌、膽囊癌、惡性淋巴瘤和肺癌的風險增加有關[25]。同時,生物工程合成的 α1-抗胰蛋白酶可以通過阻斷與腫瘤相關的前蛋白轉化酶底物的活性來抑制鱗狀細胞癌的侵襲性[23]。
胰島素樣生長因子結合蛋白 7 是胰島素樣生長因子(insulin-like growth factor, IGF)的結合蛋白,由 IGFBP7 基因編碼。其主要功能是可通過與 IGF 的相互作用,調節 IGF 在體液和組織中的活性,并調節 IGF 與其受體的結合,還能刺激前列環素的產生和細胞的黏附作用。研究表明,IGFBP7 在肝細胞癌、消化道癌等多種惡性腫瘤中下調,IGFBP7 能抑制腫瘤內血管生成從而抑制腫瘤的生長,IGFBP7 的下調可能與腫瘤的發生相關[26-27]。
組織蛋白酶 D 是一種由 CTSD 基因編碼的具有酶活性的 ECM 蛋白,參與多種肽段和蛋白質的水解,主要功能是降解蛋白質并激活溶酶體前室中生物活性蛋白的前體[28]。有研究指出,活性的組織蛋白酶 D 通過阻止胱抑素 C 對蛋白酶的抑制作用,促進腫瘤間質中的 ECM 蛋白裂解,使癌細胞侵入局部組織,從而在腫瘤進展中發揮重要作用[29]。同時,組織蛋白酶 D 的過表達可刺激腫瘤的發生,并啟動腫瘤細胞凋亡,這種蛋白酶被認為是乳腺癌預后不良的獨立標志[30]。
Decorin 是一種由 DCN 基因編碼的 ECM 中的蛋白多糖,由含重復序列的蛋白核心和硫酸軟骨素等合成的糖胺聚糖鏈所聚集形成,主要參與細胞周期調節、ECM 膠原纖維合成代謝、基質血管形成、ECM 成分結構組裝等[31]。據報道,Decorin 的差異性表達在食管鱗狀細胞癌的發生發展起著重要作用,是檢測食管癌的潛在臨床標志物[32],且與口腔鱗狀細胞癌的化療耐藥機制及患者的預后相關[33]。
綜上所述,本次研究結果表明,隨著衰老的發生,皮膚組織結構及組成成分發生相應的變化。隨著機體的衰老,皮膚組織相應變薄,膠原纖維排列更加整齊,這些變化使皮膚更易受到內源性和外源性的損傷。同時在機體衰老的過程中皮膚組織局部蛋白質成分發生改變,在 ECM 中具有抑制腫瘤進展功能的蛋白表達下調,而具有促進腫瘤進展功能的蛋白表達上調。皮膚組織結構和組成成分的改變可能通過影響腫瘤微環境的調節機制,進而影響 cSCC 的發生與發展。
利益沖突:所有作者聲明不存在利益沖突。