引用本文: 何妮, 黃攀, 劉夢, 孟冰, 郝子龍. 全身炎癥反應指數與急性缺血性腦卒中患者早期神經功能惡化及預后的相關性研究. 華西醫學, 2024, 39(4): 580-587. doi: 10.7507/1002-0179.202311186 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
腦卒中已成為我國居民致死、致殘的首位病因[1-2]。雖經積極治療,缺血性腦卒中發病后 3 個月時死亡或致殘率仍高達 34.5%~37.1%[3]。研究發現,急性缺血性腦卒中患者可出現早期神經功能缺損癥狀加重,被稱為早期神經功能惡化(early neurological deterioration, END)或進展性卒中,其發生率可高達 40%[4-7],發生 END 的患者致殘率和病死率較未發生 END 的患者亦升高 4 倍[5-6]。目前 END 尚無統一定義或標準,常用的定義有缺血性腦卒中后 24 h、72 h、7 d 的 NIHSS 評分與基線 NIHSS 評分比較增加 2 分或 4 分以上,并排除出血轉化、新發梗死、腦水腫以及嚴重臟器功能障礙所致的病情加重[4-6,8]。然而,目前缺乏預測 END 發生的有效指標。因此,臨床亟需開發更為簡便、有效的指標對急性缺血性腦卒中是否發生進展以及預后結局進行良好預測的指標,從而做到早期干預改善患者的預后。一項納入 150 個生物標志物的 Meta 分析發現,一些生物標志物如基質金屬蛋白酶 9、S100 鈣結合蛋白 B、纖維連接蛋白、膠質纖維酸性蛋白等及其組合可以區分出血和缺血、預測出血轉化等[9]。一篇系統評價納入了 82 個預測溶栓后 END 的研究,分別從代謝性、炎性和細胞毒性以及凝血和血液系統指標等生物指標進行分析,發現上述指標與缺血性腦卒中 END 的發生相關,但缺乏非溶栓患者相關研究[10]。最新研究顯示,炎癥相關指標,如中性粒細胞計數/淋巴細胞計數比(neutrophil count/lymphocyte count ratio, NLR)、C反應蛋白、全身炎癥反應指數(systemic inflammation response idex, SIRI)等與卒中后死亡、殘疾相關[11],也有研究發現 NLR、SIRI 與神經重癥[12]及癌癥[13-15]患者預后不良相關,但缺乏早期神經功能惡化相關研究。綜上,本研究旨在探討 SIRI 與急性缺血性腦卒中患者 END 及發病后 3 個月預后結局的相關性,以期明確 SIRI 是否可作為 END 及發病后 3 個月預后結局的預測指標。
1 對象與方法
1.1 研究對象
選擇 2020 年 4 月—10 月于四川大學華西醫院和德陽市人民醫院住院診治的急性缺血性腦卒中患者。納入標準:① 缺血性腦卒中診斷標準符合世界衛生組織的腦卒中診斷標準[16],經 CT 或 MRI 排除出血性卒中和其他非卒中疾病;② 年齡 18~80 歲;③ 發病至入院≤48 h;④ 美國國立衛生研究卒中量表(National Institutes of Health stroke Scale, NIHSS)評分≤10 分。排除標準:① 發病前改良 Rankin 量表(modified Rankin Scale, mRS)≥2 分;② 接受血管內取栓治療;③ 存在嚴重心肝腎功能障礙;④ 伴血液病或其他嚴重的全身性疾病;⑤ 伴惡性腫瘤或正在進行抗腫瘤治療;⑥ 伴急慢性感染性疾病或入院時體溫≥38℃;⑦ 伴風濕免疫系統疾病;⑧ 3 個月內參加過其他干預性臨床研究,或正在參加其他干預性臨床研究;⑨ 入院 48 或 72 h 死亡或自動出院者;⑩ 不愿參加本項目。本研究得到了四川大學華西醫院生物醫學倫理審查委員會批準[2022 年審(298)號]。
樣本量估算:根據主要結局指標,需進行多因素 logistic 分析識別多個預測指標,按照 P=0.05 進行雙側檢驗,要求多因素 logistic 回歸事件數為自變量數的 5~10 倍。本研究預計樣本量為 20 個自變量×10 倍+20%失訪或退出或數據不完整,最終得出至少需納入患者 240 例。
1.2 研究方法
1.2.1 分組
本研究的 END 定義為入院后患者神經功能缺損癥狀仍在進展加重,且在入院 7 d 時 NIHSS 評分與入院時 NIHSS 評分比較,增加≥2 分(包括肢體、運動各 1 分),并排除新發梗死、嚴重感染、心功能不全等所致的癥狀加重[8]。根據本研究定義的 END 標準,將納入患者分為 END 組及非 END 組,即患者入院 7 d NIHSS 評分與入院 NIHSS 評分比較,如增加 2 分及以上為 END 組,<2 分為非 END 組。
1.2.2 觀察指標
采用統一病例登記表全面收集患者下列數據:① 年齡、性別、入院時血壓、入院時隨機血糖、入院 NIHSS 評分、危險因素[高血壓、糖尿病、血脂異常、冠心病、心房顫動(房顫)、卒中或短暫性腦缺血發作史、吸煙史、飲酒史]、血管狹窄程度、出血轉化、梗死部位、TOAST 病因分型、卒中后并發癥等。② 炎癥相關指標:采集入院時外周血,中心實驗室檢測白細胞計數、中性粒細胞計數、淋巴細胞計數、血小板計數等。計算相關炎癥指數:NLR、淋巴細胞計數/單核細胞計數比(lymphocyte count/monocyte count ratio, LMR)、單核細胞計數/高密度脂蛋白計數比(monocyte count/high-density lipoprotein count ratio, MHR)、血小板計數/淋巴細胞計數比(platelet count/lymphocyte count ratio, PLR)、SIRI。SIRI=(中性粒細胞計數×單核細胞計數)/淋巴細胞計數[17]。
1.2.3 研究結局
采用 mRS 評分進行發病后 3 個月結局隨訪評估。隨訪方式采用于發病后 90 d 進行電話隨訪或醫院就診,將 mRS>2 分定義為預后不良[18]。觀察患者不同 mRS 評分例數指標。
1.3 質量控制
① 減少選擇性偏倚:由經過統一培訓的神經內科住院醫師依據納入和排除標準連續性登記所有符合納入標準的病例。② 減少測量性偏倚:A. 對各種量表的使用進行統一培訓;B. 盲法隨訪。③ 減少失訪性偏倚:登記時詳細詢問和記錄多種聯系方式,隨訪過程中耐心回答患者及家屬咨詢,盡可能保證失訪率小于 10%。④ 控制混雜因素:采用多因素分析方法控制混雜因素的影響。⑤ 整個研究過程中確保方法科學、操作規范、數據真實、體系完整。
1.4 統計學方法
采用 SPSS 26.0 軟件進行數據分析。連續性變量采用均數±標準差表示,組間比較采用 t 檢驗;不符合正態分布的計量資料以中位數(下四分位數,上四分位數)表示,組間比較采用獨立樣本 Mann-Whitney U 檢驗或非參數檢驗。分類變量采用例數和百分比表示,組間采用χ2 檢驗或 Fisher 確切概率法。將單因素分析中 P<0.05 的相關變量帶入 logistic 回歸分析,自變量篩選選擇輸入法(Enter),計算比值比(odds ratio, OR)及其 95%置信區間(confidence interval, CI)。繪制接受者操作特征(receiver operating characteristic, ROC)曲線評估相關因素預測發生 END 及發病后 3 個月預后不良的診斷價值。雙側檢驗水準α=0.05。
2 結果
2.1 一般資料
共納入患者 260 例,其中失訪 12 例(9 例電話未接通也不能到院采集后續相關信息、3 例患者及家屬不再配合采集后續信息)、資料不全 6 例,最終納入患者 242 例。納入的患者平均年齡為(64.67±11.90)歲;男性 169 例(69.8%);入院中位 NIHSS 評分為 3(2,6)分;END 組 47 例,非 END 組 195 例。END 組與非 END 組一般資料比較見表1。可見,與非 END 組患者相比,入院時較高的 NIHSS 評分、有高血壓病史、伴有多個并發癥的患者更易發生 END(P<0.05)。
2.2 END 組與非 END 組實驗室指標及SIRI比較
END 組與非 END 實驗室指標及SIRI比較見表2。可見,兩組患者在中性粒細胞計數、淋巴細胞計數、尿素氮、肌酐、NLR、LMR、PLR、SIRI 方面,差異均有統計學意義(P<0.05),其余指標兩組比較差異均無統計學意義(P>0.05)。
2.3 END 影響因素的多因素分析
因并發癥可能發生于 END 之后,故參考以往經驗在預測 END 多因素分析時未納入并發癥,僅將表1、2 單因素分析中 P<0.05 的以下指標(肌酐、尿素氮、中性粒細胞計數、淋巴細胞計數、NLR、LMR、PLR、SIRI、年齡、性別、高血壓、入院 NIHSS 評分)作為自變量納入 logistic 回歸分析,變量賦值見表3。共線性結果顯示自變量間均無明顯多重共線性(容忍度均>0.1,方差膨脹因子均<10)。logisitic 結果(表4)顯示,入院 NIHSS 評分、高血壓、SIRI 及 NLR 是發生 END 的獨立預測因素(P<0.05)。
2.4 END 發生的預測效能
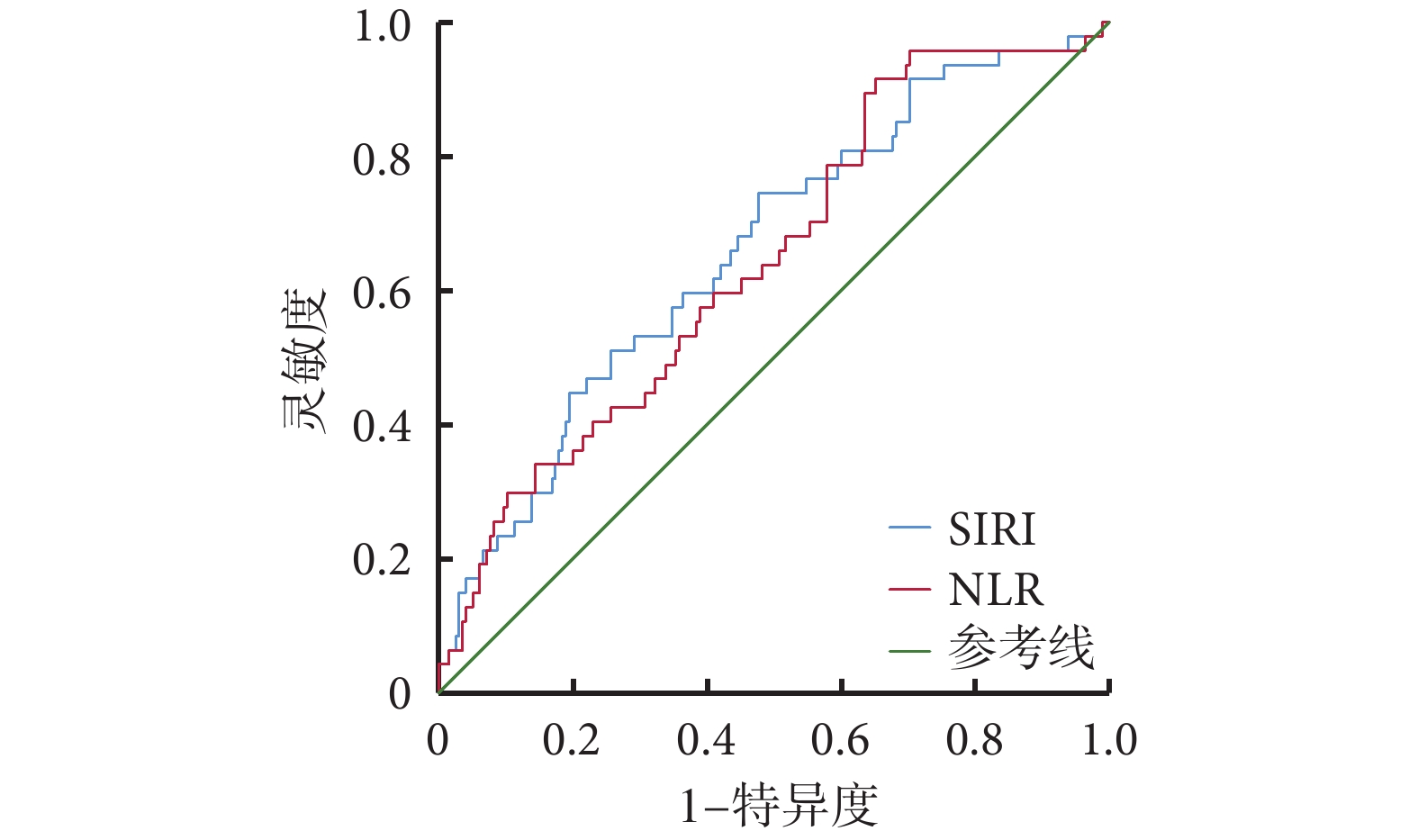
將 NLR、SIRI 為檢驗變量進行 ROC 曲線分析(圖1、表5)。可見,SIRI 較 NLR 對 END 的發生具有更佳的預測價值。NLR 對預測發生 END 的曲線下面積(area under curve, AUC)為 0.643(0.557,0.728),P=0.002;SIRI 對預測發生 END 的 AUC 為 0.659(0.573,0.746),P=0.001。
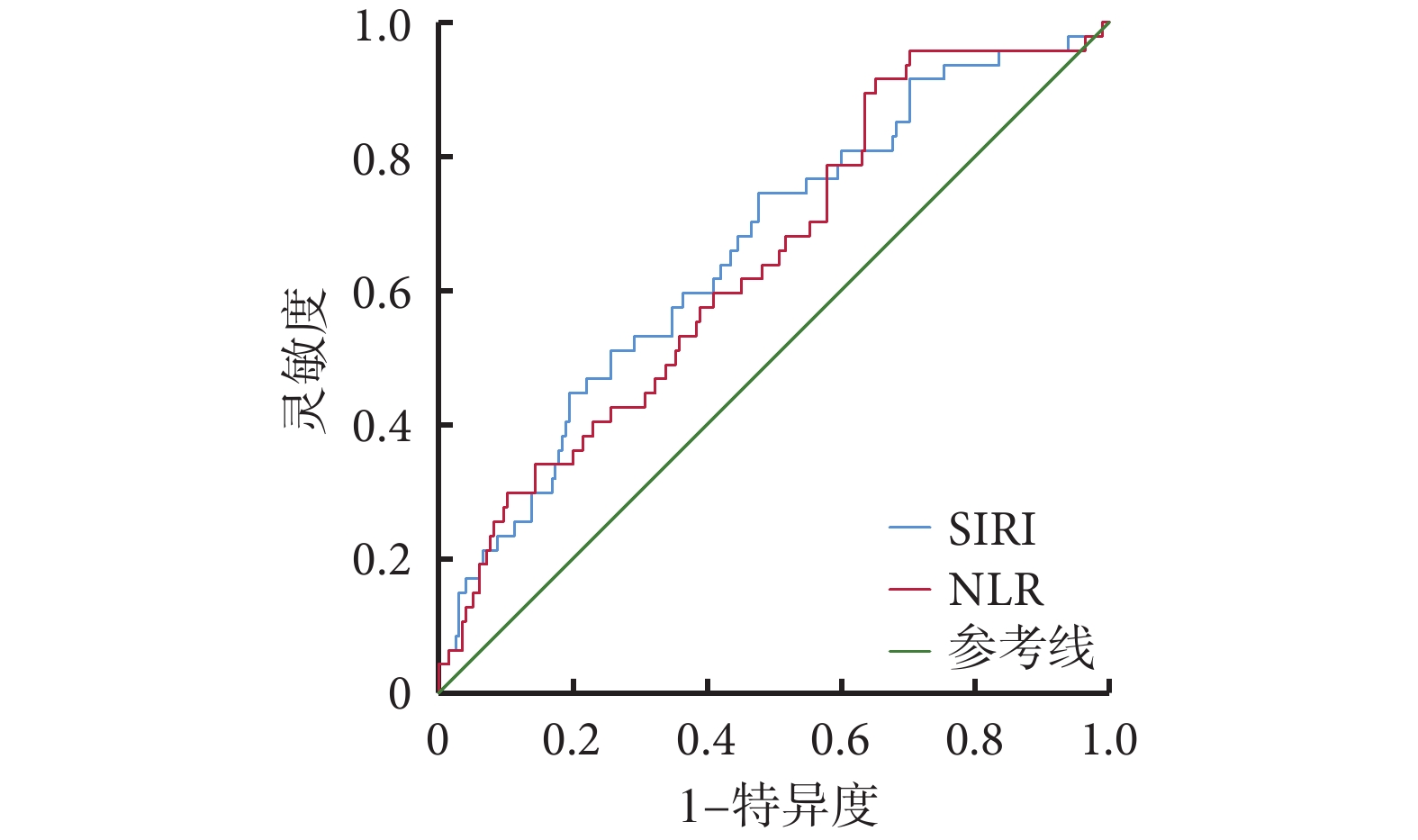 圖1
NLR、SIRI 預測 END 的 ROC 曲線
圖1
NLR、SIRI 預測 END 的 ROC 曲線
NLR:中性粒細胞計數/淋巴細胞計數比;SIRI:全身炎癥反應指數;END:早期神經功能惡化;ROC:接受者操作特征
2.5 END 組與非 END 組隨訪功能結局比較
與非 END 組比較,END 組患者發病后 3 個月的預后結局更差[44.7%(21/47) vs. 17.4%(34/195),P<0.05)]。其中,END 組 mRS 得分為 0~6 分分別為 10、10、6、11、5、2、3 例;非 END 組 mRS 得分為 0~6 分分別為 73、70、18、12、11、3、8 例。
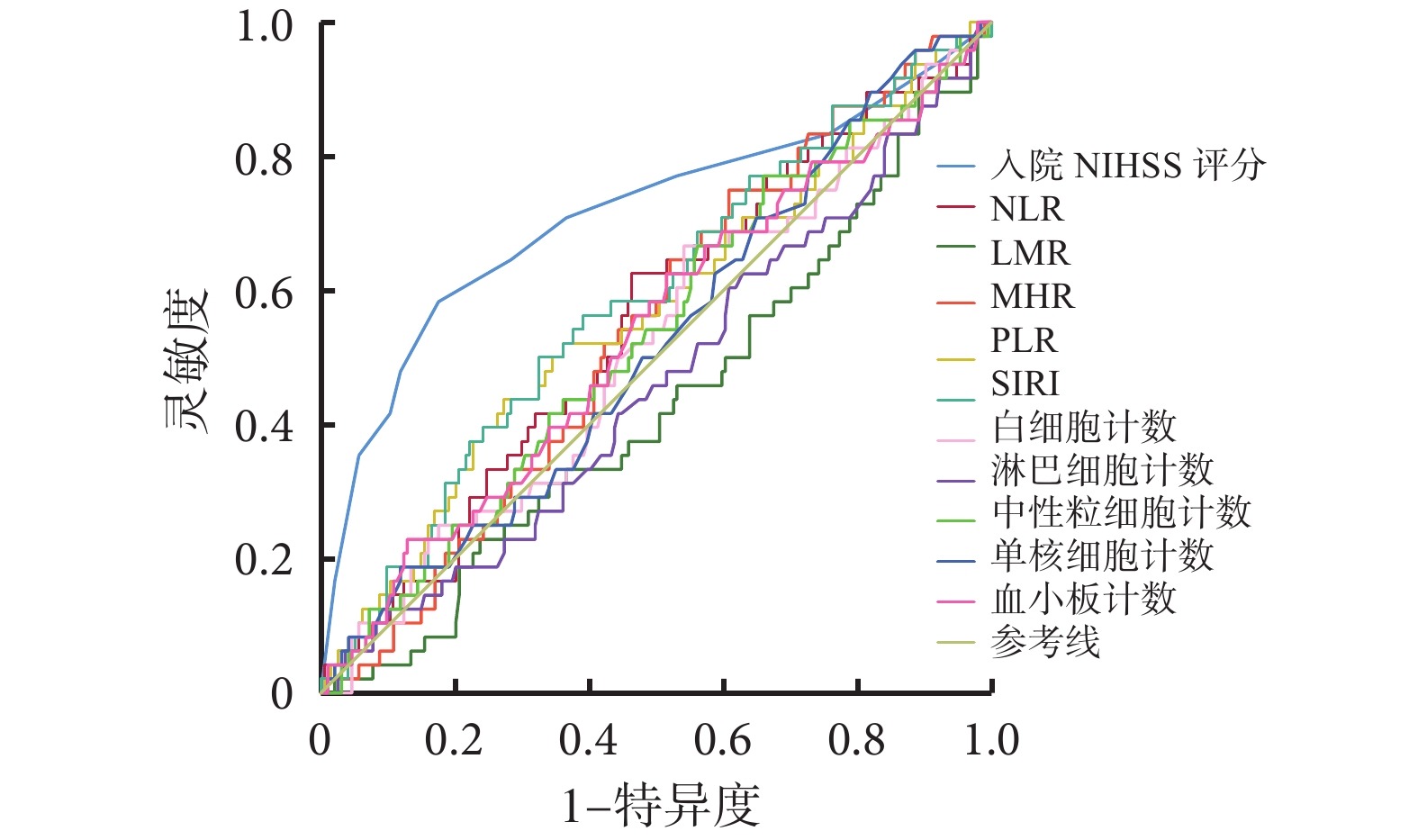
各指標預測發病后 3 個月時預后不良的 ROC 曲線分析見圖2、表6。可見,入院時 NIHSS 評分[95%CI(0.619,0.808),P=0.000]對急性缺血性腦卒中患者 3 個月時預后不良具有一定預測價值,但 SIRI 未顯示出預測價值。
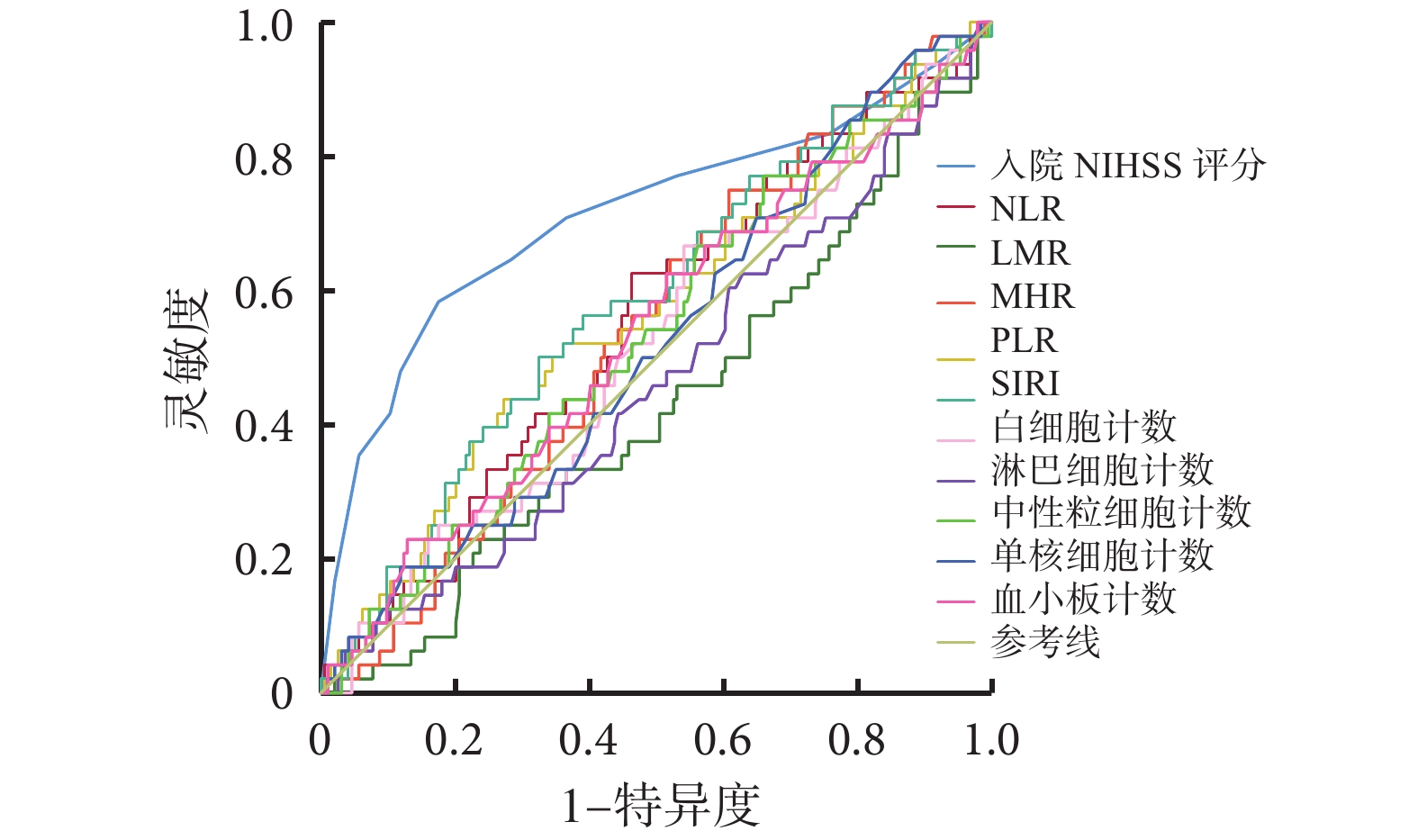 圖2
各指標預測發病后 3 個月時預后不良的 ROC 曲線分析
圖2
各指標預測發病后 3 個月時預后不良的 ROC 曲線分析
ROC:接受者操作特征;NIHSS:美國國立衛生研究院卒中量表;NLR:中性粒細胞計數/淋巴細胞計數比;LMR:淋巴細胞計數/單核細胞計數比;MHR:單核細胞計數/高密度脂蛋白計數比;PLR:血小板計數/淋巴細胞計數比;SIRI:全身炎癥反應指數
3 討論
目前腦卒中所致的死亡已經躍升至全球范圍內的第 2 大死亡原因,并成為我國的第 1 位死因[19]。該病雖經過積極治療,仍有患者發病 3 個月后遺留殘疾。降低急性缺血性腦卒中死亡或殘疾率都是急性期的救治難點。根據以往經驗,年齡、NIHSS 評分、END 等是 3 個月預后不良的影響因素。據統計,約有 1/3 的急性缺血性腦卒中患者會在發病后 1 周內出現神經功能惡化,如癱瘓加重、意識加深、吞咽及言語困難加重,甚至危及生命[20]。對于發生神經功能惡化的患者,人們將其歸為進展性卒中。目前,進展性卒中國內外雖無統一的臨床共識或指南,但眾多研究已表明進展性卒中是急性缺血性腦卒中患者預后不良的重要原因之一,且目前無較高特異度及靈敏度的預測標志物。因此,臨床亟需開發更為簡便、有效的指標對急性缺血性腦卒中是否發生進展以及預后進行良好預測的指標,從而做到早期干預改善患者的預后。然而,目前基層醫院可涉及到的檢驗指標相對單一,因此,具有預測價值的血液學指標可能更具應用前景,且該指標需滿足為絕大部醫院常規開展項目。此外,現已有的研究發現單個預測指標預測價值不高,可推測復合指標,如本研究中的 SIRI、NLR 等可能具有更好的潛在預測價值。本研究發現,19.4%的患者在發病 7 d 內出現了神經功能惡化,發生 END 的患者 3 個月預后不良比例更高(44.7% vs. 17.4%),除病情嚴重程度外,SIRI、NLR 是發生 END 的獨立危險因素,提示炎癥反應在卒中后病情惡化中起重要作用,早期炎癥反應的干預可能是治療干預的靶點,早期炎癥指數有助于識別神經功能惡化及功能結局不良患者。
另外,本研究發現,END 患者入院時具有較高的中性粒細胞計數及 NLR,提示中性粒細胞計數的增高與 END 的發生有關。NLR 是中性粒細胞計數與淋巴細胞計數的復合指標,是炎癥反應的重要參數[21]。在急性缺血性腦卒中發生后可即刻激活機體炎癥反應,病理表現為免疫細胞數量升高并向損傷腦組織浸潤,其中以中性粒細胞升高最為顯著[22-23]。升高的中性粒細胞可能通過以下途徑加重腦組織損害:中性粒細胞作為主要的免疫細胞,在缺血性事件發生后,最先通過遷移的方式進入缺血缺氧的腦組織中[24]。首先,中性粒細胞釋放多種黏附分子,引起血管發生痙攣造成血流動力學紊亂,從而加重、加速腦組織的缺血壞死[25-26]。其次,中性粒細胞還可以釋放基質金屬蛋白酶使得血腦屏障破壞更加劇烈,誘導產生活性氧自由基如活性氧和活性氮,從而加速神經細胞的死亡,導致神經功能缺損加重進展[27-28]。在局灶性腦缺血小鼠模型中,使用中和抗體去除中性粒細胞可以減少血-腦屏障的破壞,減輕腦損傷及炎性反應,可在急性缺血性腦卒中發生后發揮顯著的神經保護作用[24]。然而,有研究發現中性粒細胞也具有神經保護作用,主要體現在神經和血管新生以及提高神經可塑性、防御感染方面,這與中性粒細胞的表型有關,N1 表型中性粒細胞可通過分泌多種有害物質從而加重神經炎性反應。N2 表型中性粒細胞則通過促進小膠質細胞和中性粒細胞的吞噬功能,緩解卒中后炎性反應[25,29]。
其次,本研究發現與非 END 患者相比,入院時 END 患者具有更高的單核細胞計數趨勢(0.48±0.17 vs. 0.47±0.20)。急性缺血性腦卒中發生后,血管內皮細胞功能受損,引起損傷區域生長因子分泌釋放,進而吸引單核細胞黏附在血管內皮細胞下方并轉化為巨噬細胞。這些巨噬細胞會攝取脂質,形成泡沫細胞,進而加速脂紋病變和動脈粥樣斑塊的形成。此外,巨噬細胞和內皮細胞會分泌生長因子還會刺激血管平滑肌細胞增殖,并生成血小板源性生長因子,導致斑塊進一步發展,從而更容易發生斑塊增大、鈣化、出血、壞死或脫落,加重急性缺血性腦卒中的進展[30]。然而,在本研究中 END 患者外周血單核細胞計數雖然高于非 END 患者,但差異卻無統計學意義,可能原因為:急性缺血性腦卒中患者腦組織中的單核細胞聚集發生比中性粒細胞晚,大約在急性缺血性腦卒中發生后的 3~6 d,而本研究納入的血液樣本為發病 48 h 內的患者有關。
第三,本研究還發現淋巴細胞計數偏少或 NLR 更高的急性缺血性腦卒中患者更易發生 END。淋巴細胞計數作為總體健康狀況的指標,受到急性生理應激的影響,積極參與缺血腦損害的保護機制[31-32]。研究發現,淋巴細胞計數減少與早期神經炎癥和免疫功能惡化有關,預示著臨床預后可能不佳[33-34]。在急性缺血性腦卒中發作后的 24 h 內,機體的初次級淋巴器官便會被激活。在受傷和死亡的細胞釋放出損傷相關的分子引發炎癥反應后,這種炎癥反應會迅速擴散到大腦和全身,導致神經組織發生炎癥。同時,細胞因子、趨化因子和其他促炎介質在血液中的水平也會增高。然而,在急性缺血性腦卒中發作后的數小時內,免疫系統會逐漸疲勞并進入免疫抑制狀態,導致免疫功能逐漸減弱,特別是淋巴細胞(尤其是 CD4+ T 細胞)減少,次級淋巴器官(如脾臟)萎縮并且抗炎細胞因子水平升高,其特征的表現有 NLR 增加、單核細胞上 HLA-DR 抗原提呈分子表達下降等[35-38]。
第四,本研究探討了急性缺血性腦卒中患者多種炎癥指標與 END 的關系,發現 SIRI 較 NLR 對發生 END 具有更佳的預測價值,且當入院時 NLR> 3.67、SIRI >3.41 時,發生 END 的概率將明顯增加,這將有助于高風險人群的識別與分層管理。此外,本研究還對炎癥指標與急性缺血性腦卒中患者發病后 3 個月時臨床預后的關系進行了探討,發現 NLR 及 SIRI 對患者 3 個月時預后未顯示出預測作用,可能原因為樣本量小及排除了入院時合并有明顯感染的患者,這與既往文獻報道一致[39-41]。
本研究存在一定不足之處:本研究僅是 2 個中心的研究且樣本量較小,可能存在一定程度上的人口地域性選擇偏倚。本研究僅收集了患者入院時的外周血炎癥指標,缺少對外周血炎癥指標動態變化監測的相關分析。
綜上,急性缺血性腦卒中患者早期神經功能惡化并不少見,且與增加不良預后結局相關,SIRI、NLR 是發生 END 的獨立預測因素,SIRI 與 3 個月不良結局無獨立相關性。針對炎癥開發相關藥物可能是急性缺血性腦卒中 END 潛在治療靶點。
利益沖突:所有作者聲明不存在利益沖突。
腦卒中已成為我國居民致死、致殘的首位病因[1-2]。雖經積極治療,缺血性腦卒中發病后 3 個月時死亡或致殘率仍高達 34.5%~37.1%[3]。研究發現,急性缺血性腦卒中患者可出現早期神經功能缺損癥狀加重,被稱為早期神經功能惡化(early neurological deterioration, END)或進展性卒中,其發生率可高達 40%[4-7],發生 END 的患者致殘率和病死率較未發生 END 的患者亦升高 4 倍[5-6]。目前 END 尚無統一定義或標準,常用的定義有缺血性腦卒中后 24 h、72 h、7 d 的 NIHSS 評分與基線 NIHSS 評分比較增加 2 分或 4 分以上,并排除出血轉化、新發梗死、腦水腫以及嚴重臟器功能障礙所致的病情加重[4-6,8]。然而,目前缺乏預測 END 發生的有效指標。因此,臨床亟需開發更為簡便、有效的指標對急性缺血性腦卒中是否發生進展以及預后結局進行良好預測的指標,從而做到早期干預改善患者的預后。一項納入 150 個生物標志物的 Meta 分析發現,一些生物標志物如基質金屬蛋白酶 9、S100 鈣結合蛋白 B、纖維連接蛋白、膠質纖維酸性蛋白等及其組合可以區分出血和缺血、預測出血轉化等[9]。一篇系統評價納入了 82 個預測溶栓后 END 的研究,分別從代謝性、炎性和細胞毒性以及凝血和血液系統指標等生物指標進行分析,發現上述指標與缺血性腦卒中 END 的發生相關,但缺乏非溶栓患者相關研究[10]。最新研究顯示,炎癥相關指標,如中性粒細胞計數/淋巴細胞計數比(neutrophil count/lymphocyte count ratio, NLR)、C反應蛋白、全身炎癥反應指數(systemic inflammation response idex, SIRI)等與卒中后死亡、殘疾相關[11],也有研究發現 NLR、SIRI 與神經重癥[12]及癌癥[13-15]患者預后不良相關,但缺乏早期神經功能惡化相關研究。綜上,本研究旨在探討 SIRI 與急性缺血性腦卒中患者 END 及發病后 3 個月預后結局的相關性,以期明確 SIRI 是否可作為 END 及發病后 3 個月預后結局的預測指標。
1 對象與方法
1.1 研究對象
選擇 2020 年 4 月—10 月于四川大學華西醫院和德陽市人民醫院住院診治的急性缺血性腦卒中患者。納入標準:① 缺血性腦卒中診斷標準符合世界衛生組織的腦卒中診斷標準[16],經 CT 或 MRI 排除出血性卒中和其他非卒中疾病;② 年齡 18~80 歲;③ 發病至入院≤48 h;④ 美國國立衛生研究卒中量表(National Institutes of Health stroke Scale, NIHSS)評分≤10 分。排除標準:① 發病前改良 Rankin 量表(modified Rankin Scale, mRS)≥2 分;② 接受血管內取栓治療;③ 存在嚴重心肝腎功能障礙;④ 伴血液病或其他嚴重的全身性疾病;⑤ 伴惡性腫瘤或正在進行抗腫瘤治療;⑥ 伴急慢性感染性疾病或入院時體溫≥38℃;⑦ 伴風濕免疫系統疾病;⑧ 3 個月內參加過其他干預性臨床研究,或正在參加其他干預性臨床研究;⑨ 入院 48 或 72 h 死亡或自動出院者;⑩ 不愿參加本項目。本研究得到了四川大學華西醫院生物醫學倫理審查委員會批準[2022 年審(298)號]。
樣本量估算:根據主要結局指標,需進行多因素 logistic 分析識別多個預測指標,按照 P=0.05 進行雙側檢驗,要求多因素 logistic 回歸事件數為自變量數的 5~10 倍。本研究預計樣本量為 20 個自變量×10 倍+20%失訪或退出或數據不完整,最終得出至少需納入患者 240 例。
1.2 研究方法
1.2.1 分組
本研究的 END 定義為入院后患者神經功能缺損癥狀仍在進展加重,且在入院 7 d 時 NIHSS 評分與入院時 NIHSS 評分比較,增加≥2 分(包括肢體、運動各 1 分),并排除新發梗死、嚴重感染、心功能不全等所致的癥狀加重[8]。根據本研究定義的 END 標準,將納入患者分為 END 組及非 END 組,即患者入院 7 d NIHSS 評分與入院 NIHSS 評分比較,如增加 2 分及以上為 END 組,<2 分為非 END 組。
1.2.2 觀察指標
采用統一病例登記表全面收集患者下列數據:① 年齡、性別、入院時血壓、入院時隨機血糖、入院 NIHSS 評分、危險因素[高血壓、糖尿病、血脂異常、冠心病、心房顫動(房顫)、卒中或短暫性腦缺血發作史、吸煙史、飲酒史]、血管狹窄程度、出血轉化、梗死部位、TOAST 病因分型、卒中后并發癥等。② 炎癥相關指標:采集入院時外周血,中心實驗室檢測白細胞計數、中性粒細胞計數、淋巴細胞計數、血小板計數等。計算相關炎癥指數:NLR、淋巴細胞計數/單核細胞計數比(lymphocyte count/monocyte count ratio, LMR)、單核細胞計數/高密度脂蛋白計數比(monocyte count/high-density lipoprotein count ratio, MHR)、血小板計數/淋巴細胞計數比(platelet count/lymphocyte count ratio, PLR)、SIRI。SIRI=(中性粒細胞計數×單核細胞計數)/淋巴細胞計數[17]。
1.2.3 研究結局
采用 mRS 評分進行發病后 3 個月結局隨訪評估。隨訪方式采用于發病后 90 d 進行電話隨訪或醫院就診,將 mRS>2 分定義為預后不良[18]。觀察患者不同 mRS 評分例數指標。
1.3 質量控制
① 減少選擇性偏倚:由經過統一培訓的神經內科住院醫師依據納入和排除標準連續性登記所有符合納入標準的病例。② 減少測量性偏倚:A. 對各種量表的使用進行統一培訓;B. 盲法隨訪。③ 減少失訪性偏倚:登記時詳細詢問和記錄多種聯系方式,隨訪過程中耐心回答患者及家屬咨詢,盡可能保證失訪率小于 10%。④ 控制混雜因素:采用多因素分析方法控制混雜因素的影響。⑤ 整個研究過程中確保方法科學、操作規范、數據真實、體系完整。
1.4 統計學方法
采用 SPSS 26.0 軟件進行數據分析。連續性變量采用均數±標準差表示,組間比較采用 t 檢驗;不符合正態分布的計量資料以中位數(下四分位數,上四分位數)表示,組間比較采用獨立樣本 Mann-Whitney U 檢驗或非參數檢驗。分類變量采用例數和百分比表示,組間采用χ2 檢驗或 Fisher 確切概率法。將單因素分析中 P<0.05 的相關變量帶入 logistic 回歸分析,自變量篩選選擇輸入法(Enter),計算比值比(odds ratio, OR)及其 95%置信區間(confidence interval, CI)。繪制接受者操作特征(receiver operating characteristic, ROC)曲線評估相關因素預測發生 END 及發病后 3 個月預后不良的診斷價值。雙側檢驗水準α=0.05。
2 結果
2.1 一般資料
共納入患者 260 例,其中失訪 12 例(9 例電話未接通也不能到院采集后續相關信息、3 例患者及家屬不再配合采集后續信息)、資料不全 6 例,最終納入患者 242 例。納入的患者平均年齡為(64.67±11.90)歲;男性 169 例(69.8%);入院中位 NIHSS 評分為 3(2,6)分;END 組 47 例,非 END 組 195 例。END 組與非 END 組一般資料比較見表1。可見,與非 END 組患者相比,入院時較高的 NIHSS 評分、有高血壓病史、伴有多個并發癥的患者更易發生 END(P<0.05)。
2.2 END 組與非 END 組實驗室指標及SIRI比較
END 組與非 END 實驗室指標及SIRI比較見表2。可見,兩組患者在中性粒細胞計數、淋巴細胞計數、尿素氮、肌酐、NLR、LMR、PLR、SIRI 方面,差異均有統計學意義(P<0.05),其余指標兩組比較差異均無統計學意義(P>0.05)。
2.3 END 影響因素的多因素分析
因并發癥可能發生于 END 之后,故參考以往經驗在預測 END 多因素分析時未納入并發癥,僅將表1、2 單因素分析中 P<0.05 的以下指標(肌酐、尿素氮、中性粒細胞計數、淋巴細胞計數、NLR、LMR、PLR、SIRI、年齡、性別、高血壓、入院 NIHSS 評分)作為自變量納入 logistic 回歸分析,變量賦值見表3。共線性結果顯示自變量間均無明顯多重共線性(容忍度均>0.1,方差膨脹因子均<10)。logisitic 結果(表4)顯示,入院 NIHSS 評分、高血壓、SIRI 及 NLR 是發生 END 的獨立預測因素(P<0.05)。
2.4 END 發生的預測效能
將 NLR、SIRI 為檢驗變量進行 ROC 曲線分析(圖1、表5)。可見,SIRI 較 NLR 對 END 的發生具有更佳的預測價值。NLR 對預測發生 END 的曲線下面積(area under curve, AUC)為 0.643(0.557,0.728),P=0.002;SIRI 對預測發生 END 的 AUC 為 0.659(0.573,0.746),P=0.001。
 圖1
NLR、SIRI 預測 END 的 ROC 曲線
圖1
NLR、SIRI 預測 END 的 ROC 曲線
NLR:中性粒細胞計數/淋巴細胞計數比;SIRI:全身炎癥反應指數;END:早期神經功能惡化;ROC:接受者操作特征
2.5 END 組與非 END 組隨訪功能結局比較
與非 END 組比較,END 組患者發病后 3 個月的預后結局更差[44.7%(21/47) vs. 17.4%(34/195),P<0.05)]。其中,END 組 mRS 得分為 0~6 分分別為 10、10、6、11、5、2、3 例;非 END 組 mRS 得分為 0~6 分分別為 73、70、18、12、11、3、8 例。
各指標預測發病后 3 個月時預后不良的 ROC 曲線分析見圖2、表6。可見,入院時 NIHSS 評分[95%CI(0.619,0.808),P=0.000]對急性缺血性腦卒中患者 3 個月時預后不良具有一定預測價值,但 SIRI 未顯示出預測價值。
 圖2
各指標預測發病后 3 個月時預后不良的 ROC 曲線分析
圖2
各指標預測發病后 3 個月時預后不良的 ROC 曲線分析
ROC:接受者操作特征;NIHSS:美國國立衛生研究院卒中量表;NLR:中性粒細胞計數/淋巴細胞計數比;LMR:淋巴細胞計數/單核細胞計數比;MHR:單核細胞計數/高密度脂蛋白計數比;PLR:血小板計數/淋巴細胞計數比;SIRI:全身炎癥反應指數
3 討論
目前腦卒中所致的死亡已經躍升至全球范圍內的第 2 大死亡原因,并成為我國的第 1 位死因[19]。該病雖經過積極治療,仍有患者發病 3 個月后遺留殘疾。降低急性缺血性腦卒中死亡或殘疾率都是急性期的救治難點。根據以往經驗,年齡、NIHSS 評分、END 等是 3 個月預后不良的影響因素。據統計,約有 1/3 的急性缺血性腦卒中患者會在發病后 1 周內出現神經功能惡化,如癱瘓加重、意識加深、吞咽及言語困難加重,甚至危及生命[20]。對于發生神經功能惡化的患者,人們將其歸為進展性卒中。目前,進展性卒中國內外雖無統一的臨床共識或指南,但眾多研究已表明進展性卒中是急性缺血性腦卒中患者預后不良的重要原因之一,且目前無較高特異度及靈敏度的預測標志物。因此,臨床亟需開發更為簡便、有效的指標對急性缺血性腦卒中是否發生進展以及預后進行良好預測的指標,從而做到早期干預改善患者的預后。然而,目前基層醫院可涉及到的檢驗指標相對單一,因此,具有預測價值的血液學指標可能更具應用前景,且該指標需滿足為絕大部醫院常規開展項目。此外,現已有的研究發現單個預測指標預測價值不高,可推測復合指標,如本研究中的 SIRI、NLR 等可能具有更好的潛在預測價值。本研究發現,19.4%的患者在發病 7 d 內出現了神經功能惡化,發生 END 的患者 3 個月預后不良比例更高(44.7% vs. 17.4%),除病情嚴重程度外,SIRI、NLR 是發生 END 的獨立危險因素,提示炎癥反應在卒中后病情惡化中起重要作用,早期炎癥反應的干預可能是治療干預的靶點,早期炎癥指數有助于識別神經功能惡化及功能結局不良患者。
另外,本研究發現,END 患者入院時具有較高的中性粒細胞計數及 NLR,提示中性粒細胞計數的增高與 END 的發生有關。NLR 是中性粒細胞計數與淋巴細胞計數的復合指標,是炎癥反應的重要參數[21]。在急性缺血性腦卒中發生后可即刻激活機體炎癥反應,病理表現為免疫細胞數量升高并向損傷腦組織浸潤,其中以中性粒細胞升高最為顯著[22-23]。升高的中性粒細胞可能通過以下途徑加重腦組織損害:中性粒細胞作為主要的免疫細胞,在缺血性事件發生后,最先通過遷移的方式進入缺血缺氧的腦組織中[24]。首先,中性粒細胞釋放多種黏附分子,引起血管發生痙攣造成血流動力學紊亂,從而加重、加速腦組織的缺血壞死[25-26]。其次,中性粒細胞還可以釋放基質金屬蛋白酶使得血腦屏障破壞更加劇烈,誘導產生活性氧自由基如活性氧和活性氮,從而加速神經細胞的死亡,導致神經功能缺損加重進展[27-28]。在局灶性腦缺血小鼠模型中,使用中和抗體去除中性粒細胞可以減少血-腦屏障的破壞,減輕腦損傷及炎性反應,可在急性缺血性腦卒中發生后發揮顯著的神經保護作用[24]。然而,有研究發現中性粒細胞也具有神經保護作用,主要體現在神經和血管新生以及提高神經可塑性、防御感染方面,這與中性粒細胞的表型有關,N1 表型中性粒細胞可通過分泌多種有害物質從而加重神經炎性反應。N2 表型中性粒細胞則通過促進小膠質細胞和中性粒細胞的吞噬功能,緩解卒中后炎性反應[25,29]。
其次,本研究發現與非 END 患者相比,入院時 END 患者具有更高的單核細胞計數趨勢(0.48±0.17 vs. 0.47±0.20)。急性缺血性腦卒中發生后,血管內皮細胞功能受損,引起損傷區域生長因子分泌釋放,進而吸引單核細胞黏附在血管內皮細胞下方并轉化為巨噬細胞。這些巨噬細胞會攝取脂質,形成泡沫細胞,進而加速脂紋病變和動脈粥樣斑塊的形成。此外,巨噬細胞和內皮細胞會分泌生長因子還會刺激血管平滑肌細胞增殖,并生成血小板源性生長因子,導致斑塊進一步發展,從而更容易發生斑塊增大、鈣化、出血、壞死或脫落,加重急性缺血性腦卒中的進展[30]。然而,在本研究中 END 患者外周血單核細胞計數雖然高于非 END 患者,但差異卻無統計學意義,可能原因為:急性缺血性腦卒中患者腦組織中的單核細胞聚集發生比中性粒細胞晚,大約在急性缺血性腦卒中發生后的 3~6 d,而本研究納入的血液樣本為發病 48 h 內的患者有關。
第三,本研究還發現淋巴細胞計數偏少或 NLR 更高的急性缺血性腦卒中患者更易發生 END。淋巴細胞計數作為總體健康狀況的指標,受到急性生理應激的影響,積極參與缺血腦損害的保護機制[31-32]。研究發現,淋巴細胞計數減少與早期神經炎癥和免疫功能惡化有關,預示著臨床預后可能不佳[33-34]。在急性缺血性腦卒中發作后的 24 h 內,機體的初次級淋巴器官便會被激活。在受傷和死亡的細胞釋放出損傷相關的分子引發炎癥反應后,這種炎癥反應會迅速擴散到大腦和全身,導致神經組織發生炎癥。同時,細胞因子、趨化因子和其他促炎介質在血液中的水平也會增高。然而,在急性缺血性腦卒中發作后的數小時內,免疫系統會逐漸疲勞并進入免疫抑制狀態,導致免疫功能逐漸減弱,特別是淋巴細胞(尤其是 CD4+ T 細胞)減少,次級淋巴器官(如脾臟)萎縮并且抗炎細胞因子水平升高,其特征的表現有 NLR 增加、單核細胞上 HLA-DR 抗原提呈分子表達下降等[35-38]。
第四,本研究探討了急性缺血性腦卒中患者多種炎癥指標與 END 的關系,發現 SIRI 較 NLR 對發生 END 具有更佳的預測價值,且當入院時 NLR> 3.67、SIRI >3.41 時,發生 END 的概率將明顯增加,這將有助于高風險人群的識別與分層管理。此外,本研究還對炎癥指標與急性缺血性腦卒中患者發病后 3 個月時臨床預后的關系進行了探討,發現 NLR 及 SIRI 對患者 3 個月時預后未顯示出預測作用,可能原因為樣本量小及排除了入院時合并有明顯感染的患者,這與既往文獻報道一致[39-41]。
本研究存在一定不足之處:本研究僅是 2 個中心的研究且樣本量較小,可能存在一定程度上的人口地域性選擇偏倚。本研究僅收集了患者入院時的外周血炎癥指標,缺少對外周血炎癥指標動態變化監測的相關分析。
綜上,急性缺血性腦卒中患者早期神經功能惡化并不少見,且與增加不良預后結局相關,SIRI、NLR 是發生 END 的獨立預測因素,SIRI 與 3 個月不良結局無獨立相關性。針對炎癥開發相關藥物可能是急性缺血性腦卒中 END 潛在治療靶點。
利益沖突:所有作者聲明不存在利益沖突。