引用本文: 陳翔, 高曉東, 周春妹, 黃聲雷, 潘文彥, 劉霄, 梅靜驊, 史慶豐. 基于全基因組測序的外科重癥監護室患者定植與感染碳青霉烯類耐藥肺炎克雷伯菌分析. 華西醫學, 2024, 39(3): 412-417. doi: 10.7507/1002-0179.202312181 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
碳青霉烯類耐藥肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)是臨床感染的致病菌之一,也是導致重癥監護室長期住院患者發生院內感染的重要原因,其血流感染引起的全因死亡率高達48.3%[1],給醫院感染防控帶來巨大的挑戰。由于CRKP可在人體胃腸道無癥狀定植[2-3],臨床抗菌藥物的不合理使用常導致其大量增殖,并通過呼吸道分泌物或排泄物污染周邊環境,引起其他住院患者發生院內感染。因此,國內外相關指南均推薦對重癥監護室新入住患者進行主動篩查,以發現指示病例并及早采取干預措施,控制院內感染的發生[4-6]。基于全基因組測序(whole genome sequencing, WGS)的分子流行病學分析技術已成為近年來研究病原菌遺傳進化、種群遷移和流行病學分析的熱點[7],同時在醫院感染暴發調查、臨床感染菌株的同源性分析以及傳播路徑的識別方面發揮巨大的作用[8-11]。大外科重癥監護室(以下簡稱“大外監”)和肝外科重癥監護室(以下簡稱“肝外監”)是復旦大學附屬中山醫院(以下簡稱“我院”)最早對入住患者進行主動篩查的監護室,本研究基于 WGS 技術對這2個重癥監護室患者的CRKP感染和主動篩查定植樣本進行測序分析,對其攜帶的耐藥基因、毒力基因及同源性進行分析,為臨床CRKP的科學預防和控制提供參考依據。
1 材料與方法
1.1 菌株來源
菌株來自2021年3月我院大外監和肝外監分離的CRKP感染菌株和2021年1 月—3月我院大外監和肝外監分離的CRKP定植菌株。感染菌株納入標準:① 導致臨床感染且標本成功分離出CRKP的菌株;② 實驗室保存完好且成功復蘇;③ 患者臨床信息完整。感染菌株排除標準:① 同一患者重復分離的菌株;② 實驗室復蘇后,經實驗室鑒定為非CRKP菌株或混有其他細菌。定植菌株納入標準:① 入住重癥監護室≥48 h,且同意參與主動篩查患者的菌株;② 經實驗室分離且鑒定為CRKP的菌株。定植菌株排除標準:① 同一患者重復分離的菌株;② 實驗室復蘇后,經實驗室鑒定為非CRKP菌株或混有其他細菌。本研究通過復旦大學附屬中山醫院倫理委員會審核,倫理批號為B2018-271R。
1.2 研究方法
1.2.1 患者信息收集
回顧性收集CRKP感染和定植患者的入院時間、住院床號、標本類型、菌株分離時間等信息。
1.2.2 細菌DNA提取
將保存的CRKP復蘇至哥倫比亞血平板(江蘇科瑪嘉生物技術有限公司),使用干式恒溫金屬器(上海滬析實業有限公司)37℃培養24 h后挑取單菌落放置于LB(Luria-Bertani)液體培養基中,37℃培養24 h。取1 mL細菌上層清液轉移至1.5 mL EP管中,懸于100℃加熱儀中裂解30 min,隨后使用高速離心機(德國Sigma公司)13000 r/min離心10 min,取上層清液分裝于新EP管中,作為WGS的原始模板。
1.2.3 WGS
將CRKP細菌的DNA模板送至深圳華大基因科技有限公司進行測序。通過Illumina Hiseq2500第2代高通量測序平臺進行2×100 bp Paired-End測序,并進行建庫、擴增測序、質控。在Linux系統中運行SPAdes-2.0軟件將測序原始FASTQ結果拼接為FASTA文件。
1.2.4 全基因組分析
① 耐藥基因分析:使用耐藥基因在線篩選軟件ResFinder 4.1對所有菌株的測序結果進行耐藥基因的篩選和鑒定。使用R軟件對耐藥基因的攜帶情況進行聚類分析并制作熱圖,實現耐藥基因分布的可視化。
② 毒力基因分析:篩選使用毒力基因在線數據庫對所有菌株的測序結果進行毒力基因比對。
③ ST(sequence type)分型分析:使用分子分型和微生物基因組多樣性的公共數據庫對所有菌株的7對管家基因(gapA、rpoB、mdh、pgi、phoE、infB、tonB)進行比對,并獲得ST分型編號。
④ 同源性分析:使用CSI phylogeny 1.4在線工具對所有菌株構建進化樹。應用MEGA 6.0軟件對輸出結果進行調整。
1.3 統計學方法
使用SPSS 25.0軟件對數據進行統計分析。計數資料使用例數(百分比)表示,組間比較使用Fisher確切概率法。非正態分布的計量資料使用中位數(下四分位數,上四分位數)表示,組間比較使用Mann-Whitney U檢驗。雙側檢驗水準α=0.05。
2 結果
2.1 CRKP菌株情況
共納入16株CRKP菌株,其中10株為定植株,6株為感染株。5株定植株和2株感染株來自大外監,5株定植株和4株感染株來自肝外監。
2.2 CRKP菌株耐藥基因分析
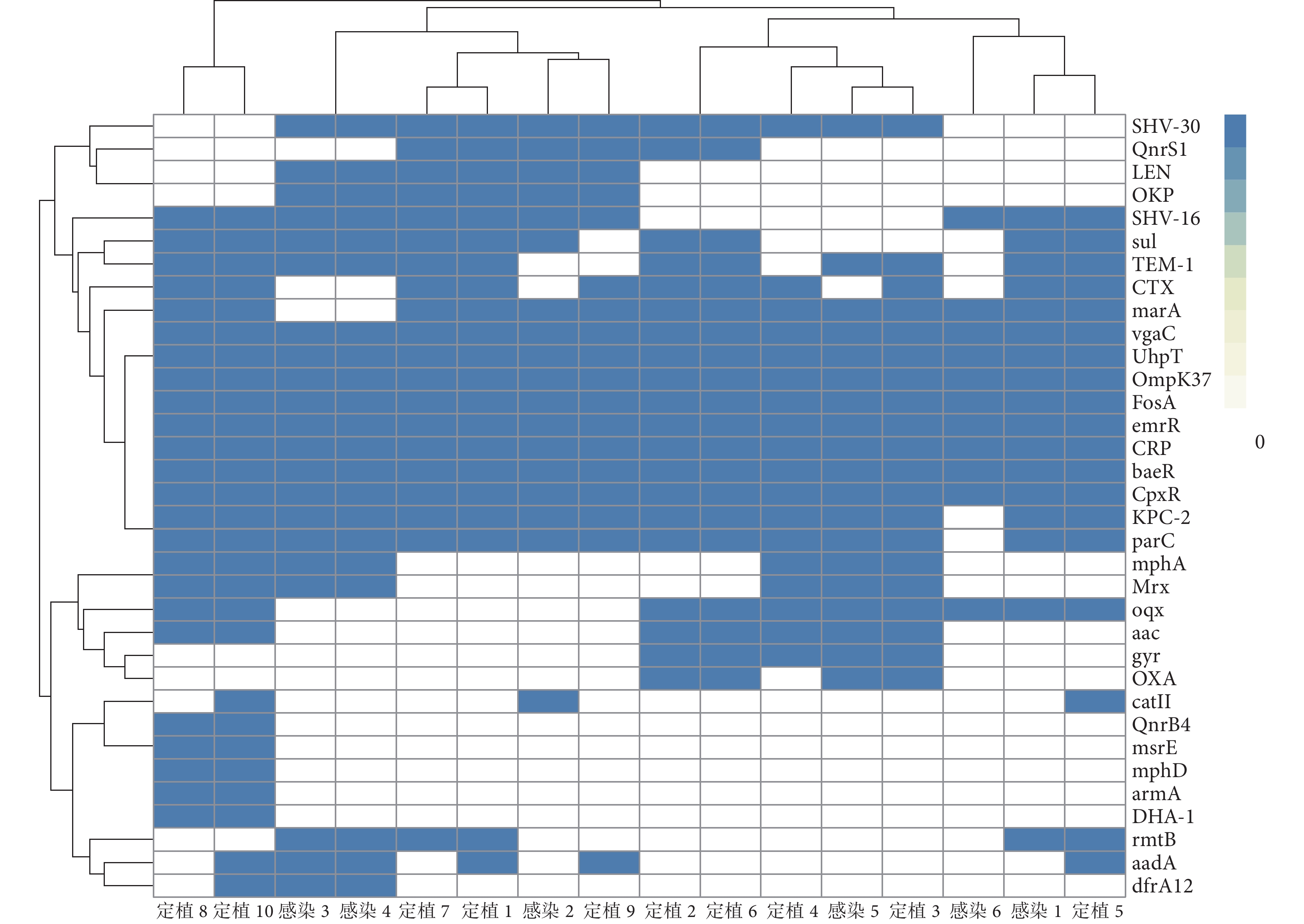
WGS結果顯示,除β-內酰胺酶類耐藥基因CTX外(P<0.05),CRKP感染株與定植株的其他耐藥基因檢出率差異均無統計學意義(P>0.05),見表1。定植株8與定植株10、定植株1與定植株7、定植株2與定植株6、感染株3與感染株4的耐藥基因聚類分析較為接近(圖1)。
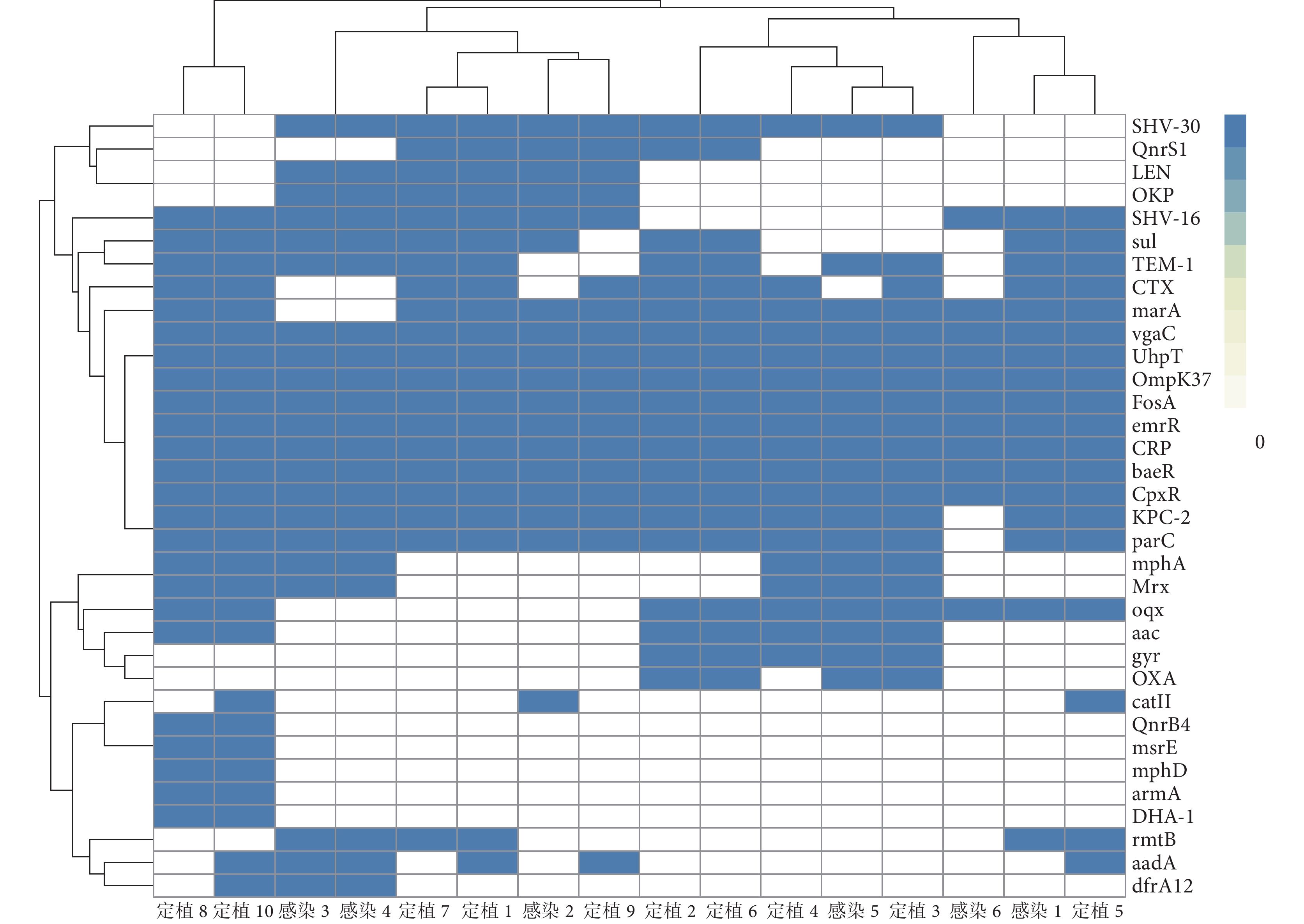 圖1
碳青霉烯類耐藥肺炎克雷伯菌菌株耐藥基因熱圖
圖1
碳青霉烯類耐藥肺炎克雷伯菌菌株耐藥基因熱圖
橫坐標為菌株的樣本編號,縱坐標為耐藥基因名稱;藍色表示橫坐標對應的菌株攜帶相應縱坐標指示的耐藥基因,白色表示橫坐標對應的菌株不攜帶相應縱坐標指示的耐藥基因
2.3 CRKP菌株毒力基因分析
WGS分析顯示,CRKP菌株均攜帶多種毒力基因,entB、irp2、iroN、黏液表型基因rmpA的檢出率分別為100.0%、87.5%、37.5%和62.5%。CRKP感染株與定植株的毒力基因檢出率差異均無統計學意義(P>0.05),見表2。
2.4 CRKP菌株ST分型與同源性分析
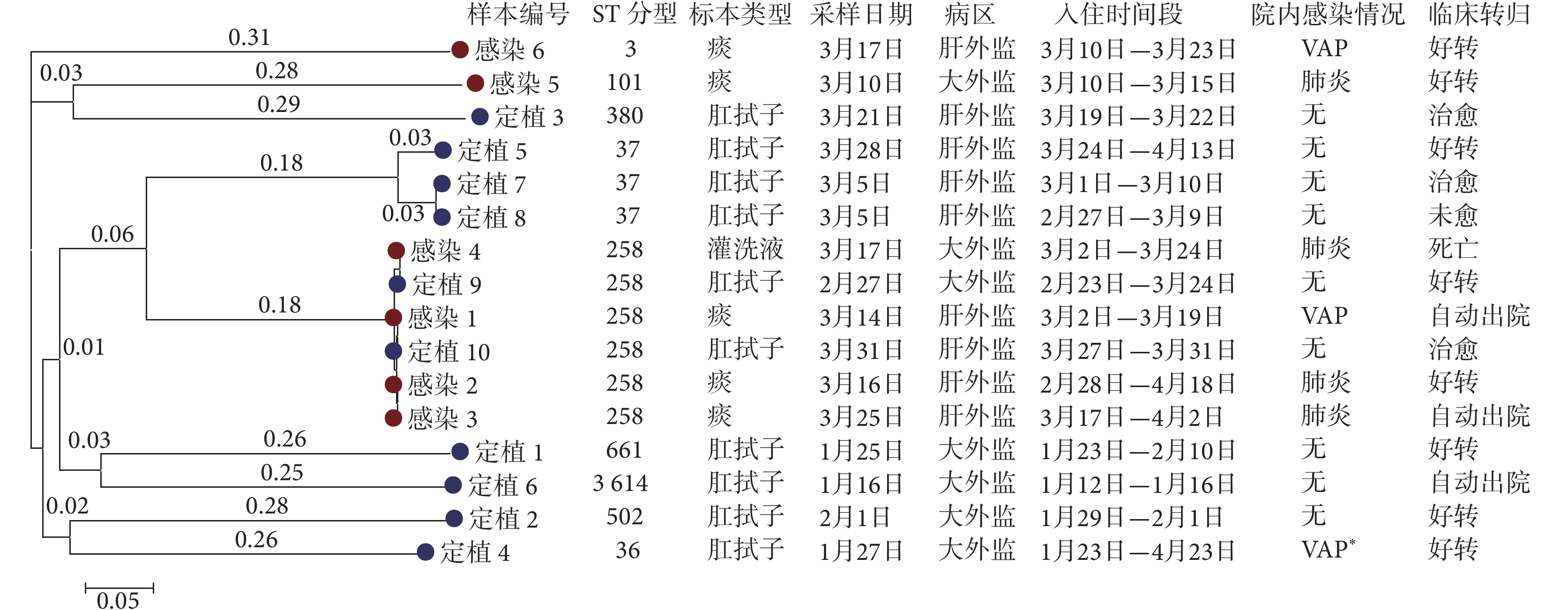
6株感染株中4株為ST 258型,10株定植株中僅有2株為ST 258型,CRKP感染株與定植株的ST 258分型占比差異無統計學差異(P=0.118)。基于最大似然比構建的系統發育樹顯示,定植株7與定植株8、感染株4與定植株9、感染株2與感染株3、感染株1與定植株10的ST分型和同源性關系較高,這些患者的臨床信息顯示,他們入住重癥監護室的時間存在一定的交集,病床的物理距離也較近,存在交叉傳播的可能。CRKP菌株最大似然樹及對應患者的樣本信息和臨床信息見圖2。
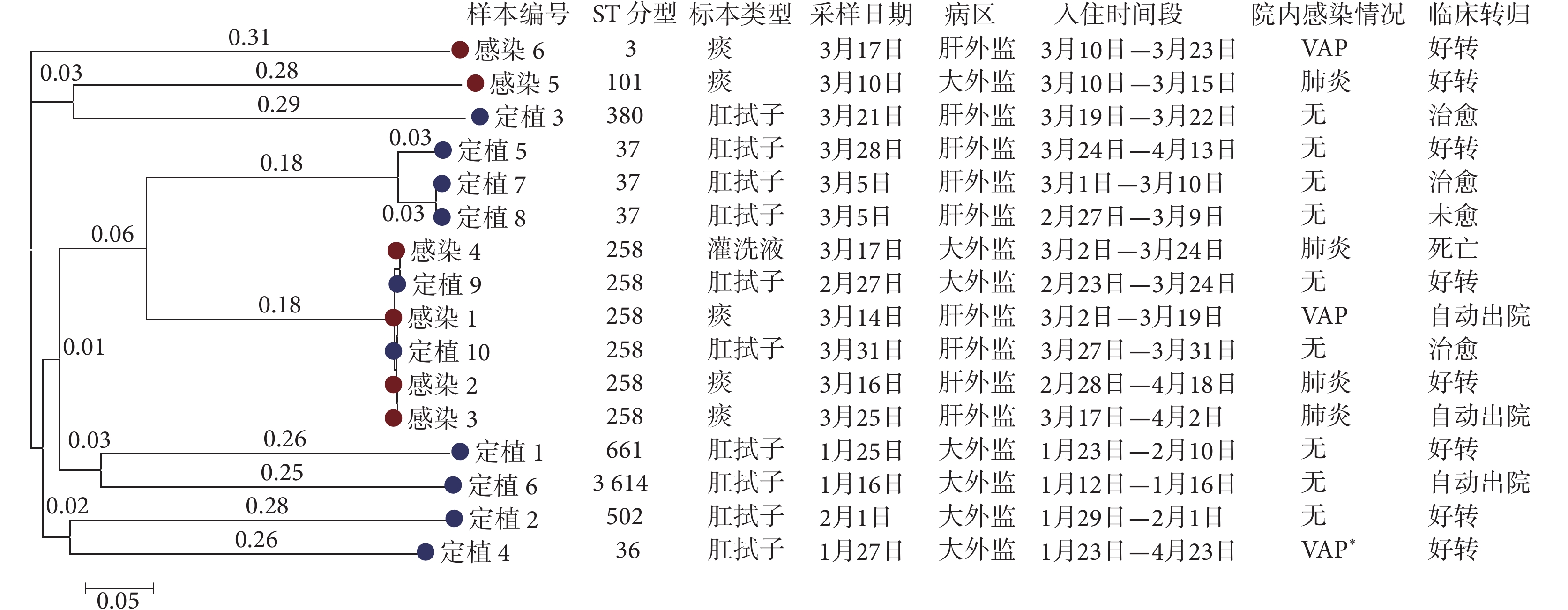 圖2
CRKP菌株最大似然樹及對應患者的樣本信息和臨床信息
圖2
CRKP菌株最大似然樹及對應患者的樣本信息和臨床信息
左側分支線上的數值代表進化變化的程度,分支線長度越短代表差距越小,進化距離越近;左下角標尺代表基因組的遺傳變異度為0.05;*該患者2021年4月發生VAP,本次研究未納入其感染樣本;肝外監:肝外科重癥監護室,大外監:大外科重癥監護室;VAP:呼吸機相關肺炎;CRKP:碳青霉烯類耐藥肺炎克雷伯菌
3 討論
肺炎克雷伯菌是一種存在于人體上呼吸道和胃腸道的條件致病菌。相關研究顯示,肺炎克雷伯菌在歐美社區人群的胃腸道定植率為5%~35%,亞洲人群的定植率為18.8%~87%[2-3]。一項系統評價顯示,0.13%~22%的CRKP定植患者可發生相關感染,以印度發生率最高,日本發生率最低[12]。康霞等[13]研究顯示,急診重癥監護室患者入科時CRKP定植率為4.08%(18/441)且CRKP引起的院內感染率為3.63%(16/441),且多因素回歸分析顯示,CRKP在直腸的定植是院內感染的獨立危險因素,因此提倡主動篩查并及早采取控制措施,以減少CRKP院內傳播風險。
本研究納入的6株CRKP感染株和10株CRKP定植株均對臨床常用的抗菌藥物呈現出較強的耐藥性。盡管16株CRKP來源于大外監和肝外監這2個獨立的科室,但部分臨床感染菌株和定植菌株的藥敏、耐藥基因分布以及同源性較為相似,存在交叉傳播的可能。肺炎克雷伯菌對碳青霉烯類抗菌藥物的耐藥機制主要包括四大類:① 產碳青霉烯水解酶;② 外排泵的高表達;③ 藥物結合位點的改變;④ 膜孔蛋白的缺失或改變,這些機制多由耐藥基因進行調控[14],且相同的耐藥機制中可以包含1種至多種耐藥基因。既往研究顯示,β-內酰胺酶類耐藥基因KPC-2和NDM是我國CRKP臨床分離株的主要流行基因[15],β-內酰胺酶類耐藥基因OXA-48近年來也呈明顯上升趨勢[16]。由于β-內酰胺酶類耐藥基因KPC-2、NDM、IMP、OXA-48和OXA-23等均可導致肺炎克雷伯菌對碳青霉烯類抗菌藥物耐藥,但不同國家和地區的此類耐藥基因流行強度不同,導致存在明顯的地域分布差異。本研究中16株CRKP菌株按照耐藥機制及基因類別可分為11種耐藥類型和28種耐藥基因型別,除了包含我國流行菌株最多見的β-內酰胺酶類耐藥基因KPC-2基因外,所有菌株還都包括氨基糖苷類耐藥基因BaeR、磷霉素類耐藥基因FosA和Uhpt,同時還有膜孔蛋白缺失基因OmpK、外排泵基因Cpx R、CRP和Emr R基因,但未能檢出β-內酰胺酶類耐藥基因NDM、IMP型金屬酶耐藥基因以及β-內酰胺酶類耐藥基因OXA-48和OXA-23等D類耐藥基因。黃雅軒等[17]對廣東省人民醫院血流感染的高毒力CRKP測序顯示,主要攜帶β-內酰胺酶類耐藥基因KPC-1、NDM-1,而陳森等[18]對湖北醫藥學院附屬太和醫院重癥醫學科的121株廣泛耐藥高毒力CRKP鑒定發現,耐藥基因主要為β-內酰胺酶類耐藥基因TEM-1、KPC、SHV,以及rmtB、qnrS、tetA,這些不同地區的CRKP耐藥基因分布差異提示CRKP的耐藥特性較為復雜,多由多種機制及基因共同介導。
高毒力肺炎克雷伯菌是近年來關注的熱點之一,具有高黏性、起病迅速、預后不良等特點,主要致病的毒力基因包括高黏液表型調節因子rmpA,鐵載體相關毒力基因iucB、iroNB、entB等[19]。有研究顯示,鐵載體是區分高毒力肺炎克雷伯菌和經典肺炎克雷伯菌的最準確和持久標志[20-21],尤其以aer、iroNB基因分布差異最大。本研究中16株CRKP菌株中entB、irp2、iroN、黏液表型基因rmpA檢出率分別為100%、87.5%、37.5%和62.5%,檢出比例略低于周浩澤等[22]對醫院分離的高毒力肺炎克雷伯菌的研究,但高于張冬梅等[23]對醫院分離的CRKP的研究。由于肺炎克雷伯菌遺傳物質中毒力基因通常與耐藥基因的遺傳位點互不重疊,且攜帶耐藥基因的質粒為適應環境而不會增加菌株毒力[24],本研究亦未發現攜帶耐藥基因數量多的CRKP菌株同時攜帶較多數量的毒力基因,提示CRKP的毒力特性與耐藥特性可能沒有正相關性。
ST分型是反映微生物進化和種群變異的技術手段,也是分析醫院內細菌流行與同源關系的關鍵技術。既往研究顯示ST 11型是我國醫院內肺炎克雷伯菌主要流行克隆型[25-27],但本研究中4株CRKP感染株為ST 258型,10株CRKP定植株的ST分型較多,但各菌株間系統發育同源性較低,可能是因為定植菌株的來源較為復雜,而臨床感染株有較為明確的院內傳播路徑。而定植株7與定植株8、感染株4與定植株9、感染株2與感染株3的同源性較高,對應患者住院病床的物理距離較近且重癥監護室住院時間具有一定的重疊,提示可能存在一定的院內傳播。有研究顯示,CRKP在胃腸道的定植與繼發的肝膿腫之間存在因果相關性[3],小鼠腸道定植模型已證實肺炎克雷伯菌通過特定的毒力基因導致肝臟感染[28],但本研究并沒有發現3月份的CRKP感染菌株與1 月—3月份的CRKP定植菌株存在強烈的時間因果關系,可能與本研究持續時間較短、進行測序分析的菌株樣本量偏少有關。此外,國外有研究顯示,僅20.54%的CRE定植患者在住院期間發生CRE感染,主要危險因素包含長期使用呼吸機,以及有碳青霉烯類、頭孢菌素類和喹諾酮類抗菌藥物使用史等[29],感染防控措施執行不到位可能是患者新發感染的主要原因。
綜上,本研究顯示,外科重癥監護室患者CRKP感染株與定植株的部分菌株有交叉傳播的風險,今后應加強醫院感染防控以降低感染的發生。然而,本研究同時存在以下局限:① 同期環境CRKP采樣為陰性,未能將環境作為傳播媒介納入研究;② 本次選用的CRKP菌株為2個監護室早期保存完整的菌株,納入研究的菌株數量較少,對主動篩查獲得CRKP菌株特性沒有較為全面的評估;③ 受限于研究經費,本次研究僅完成16株CRKP的WGS分析,對臨床感染菌株和主動篩查菌株的耐藥基因和毒力基因也僅從相關性進行探討,未能進行更深入的生物信息分析及機制探討。后續將收集更多科室的不同類型臨床感染菌株及主動篩查菌株,并采用多樣化技術手段對其耐藥性、毒力及同源性進行全面闡述,同時積極主動篩查,以降低CRKP在重癥監護室的流行與傳播。
利益沖突:所有作者聲明不存在利益沖突。
碳青霉烯類耐藥肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)是臨床感染的致病菌之一,也是導致重癥監護室長期住院患者發生院內感染的重要原因,其血流感染引起的全因死亡率高達48.3%[1],給醫院感染防控帶來巨大的挑戰。由于CRKP可在人體胃腸道無癥狀定植[2-3],臨床抗菌藥物的不合理使用常導致其大量增殖,并通過呼吸道分泌物或排泄物污染周邊環境,引起其他住院患者發生院內感染。因此,國內外相關指南均推薦對重癥監護室新入住患者進行主動篩查,以發現指示病例并及早采取干預措施,控制院內感染的發生[4-6]。基于全基因組測序(whole genome sequencing, WGS)的分子流行病學分析技術已成為近年來研究病原菌遺傳進化、種群遷移和流行病學分析的熱點[7],同時在醫院感染暴發調查、臨床感染菌株的同源性分析以及傳播路徑的識別方面發揮巨大的作用[8-11]。大外科重癥監護室(以下簡稱“大外監”)和肝外科重癥監護室(以下簡稱“肝外監”)是復旦大學附屬中山醫院(以下簡稱“我院”)最早對入住患者進行主動篩查的監護室,本研究基于 WGS 技術對這2個重癥監護室患者的CRKP感染和主動篩查定植樣本進行測序分析,對其攜帶的耐藥基因、毒力基因及同源性進行分析,為臨床CRKP的科學預防和控制提供參考依據。
1 材料與方法
1.1 菌株來源
菌株來自2021年3月我院大外監和肝外監分離的CRKP感染菌株和2021年1 月—3月我院大外監和肝外監分離的CRKP定植菌株。感染菌株納入標準:① 導致臨床感染且標本成功分離出CRKP的菌株;② 實驗室保存完好且成功復蘇;③ 患者臨床信息完整。感染菌株排除標準:① 同一患者重復分離的菌株;② 實驗室復蘇后,經實驗室鑒定為非CRKP菌株或混有其他細菌。定植菌株納入標準:① 入住重癥監護室≥48 h,且同意參與主動篩查患者的菌株;② 經實驗室分離且鑒定為CRKP的菌株。定植菌株排除標準:① 同一患者重復分離的菌株;② 實驗室復蘇后,經實驗室鑒定為非CRKP菌株或混有其他細菌。本研究通過復旦大學附屬中山醫院倫理委員會審核,倫理批號為B2018-271R。
1.2 研究方法
1.2.1 患者信息收集
回顧性收集CRKP感染和定植患者的入院時間、住院床號、標本類型、菌株分離時間等信息。
1.2.2 細菌DNA提取
將保存的CRKP復蘇至哥倫比亞血平板(江蘇科瑪嘉生物技術有限公司),使用干式恒溫金屬器(上海滬析實業有限公司)37℃培養24 h后挑取單菌落放置于LB(Luria-Bertani)液體培養基中,37℃培養24 h。取1 mL細菌上層清液轉移至1.5 mL EP管中,懸于100℃加熱儀中裂解30 min,隨后使用高速離心機(德國Sigma公司)13000 r/min離心10 min,取上層清液分裝于新EP管中,作為WGS的原始模板。
1.2.3 WGS
將CRKP細菌的DNA模板送至深圳華大基因科技有限公司進行測序。通過Illumina Hiseq2500第2代高通量測序平臺進行2×100 bp Paired-End測序,并進行建庫、擴增測序、質控。在Linux系統中運行SPAdes-2.0軟件將測序原始FASTQ結果拼接為FASTA文件。
1.2.4 全基因組分析
① 耐藥基因分析:使用耐藥基因在線篩選軟件ResFinder 4.1對所有菌株的測序結果進行耐藥基因的篩選和鑒定。使用R軟件對耐藥基因的攜帶情況進行聚類分析并制作熱圖,實現耐藥基因分布的可視化。
② 毒力基因分析:篩選使用毒力基因在線數據庫對所有菌株的測序結果進行毒力基因比對。
③ ST(sequence type)分型分析:使用分子分型和微生物基因組多樣性的公共數據庫對所有菌株的7對管家基因(gapA、rpoB、mdh、pgi、phoE、infB、tonB)進行比對,并獲得ST分型編號。
④ 同源性分析:使用CSI phylogeny 1.4在線工具對所有菌株構建進化樹。應用MEGA 6.0軟件對輸出結果進行調整。
1.3 統計學方法
使用SPSS 25.0軟件對數據進行統計分析。計數資料使用例數(百分比)表示,組間比較使用Fisher確切概率法。非正態分布的計量資料使用中位數(下四分位數,上四分位數)表示,組間比較使用Mann-Whitney U檢驗。雙側檢驗水準α=0.05。
2 結果
2.1 CRKP菌株情況
共納入16株CRKP菌株,其中10株為定植株,6株為感染株。5株定植株和2株感染株來自大外監,5株定植株和4株感染株來自肝外監。
2.2 CRKP菌株耐藥基因分析
WGS結果顯示,除β-內酰胺酶類耐藥基因CTX外(P<0.05),CRKP感染株與定植株的其他耐藥基因檢出率差異均無統計學意義(P>0.05),見表1。定植株8與定植株10、定植株1與定植株7、定植株2與定植株6、感染株3與感染株4的耐藥基因聚類分析較為接近(圖1)。
 圖1
碳青霉烯類耐藥肺炎克雷伯菌菌株耐藥基因熱圖
圖1
碳青霉烯類耐藥肺炎克雷伯菌菌株耐藥基因熱圖
橫坐標為菌株的樣本編號,縱坐標為耐藥基因名稱;藍色表示橫坐標對應的菌株攜帶相應縱坐標指示的耐藥基因,白色表示橫坐標對應的菌株不攜帶相應縱坐標指示的耐藥基因
2.3 CRKP菌株毒力基因分析
WGS分析顯示,CRKP菌株均攜帶多種毒力基因,entB、irp2、iroN、黏液表型基因rmpA的檢出率分別為100.0%、87.5%、37.5%和62.5%。CRKP感染株與定植株的毒力基因檢出率差異均無統計學意義(P>0.05),見表2。
2.4 CRKP菌株ST分型與同源性分析
6株感染株中4株為ST 258型,10株定植株中僅有2株為ST 258型,CRKP感染株與定植株的ST 258分型占比差異無統計學差異(P=0.118)。基于最大似然比構建的系統發育樹顯示,定植株7與定植株8、感染株4與定植株9、感染株2與感染株3、感染株1與定植株10的ST分型和同源性關系較高,這些患者的臨床信息顯示,他們入住重癥監護室的時間存在一定的交集,病床的物理距離也較近,存在交叉傳播的可能。CRKP菌株最大似然樹及對應患者的樣本信息和臨床信息見圖2。
 圖2
CRKP菌株最大似然樹及對應患者的樣本信息和臨床信息
圖2
CRKP菌株最大似然樹及對應患者的樣本信息和臨床信息
左側分支線上的數值代表進化變化的程度,分支線長度越短代表差距越小,進化距離越近;左下角標尺代表基因組的遺傳變異度為0.05;*該患者2021年4月發生VAP,本次研究未納入其感染樣本;肝外監:肝外科重癥監護室,大外監:大外科重癥監護室;VAP:呼吸機相關肺炎;CRKP:碳青霉烯類耐藥肺炎克雷伯菌
3 討論
肺炎克雷伯菌是一種存在于人體上呼吸道和胃腸道的條件致病菌。相關研究顯示,肺炎克雷伯菌在歐美社區人群的胃腸道定植率為5%~35%,亞洲人群的定植率為18.8%~87%[2-3]。一項系統評價顯示,0.13%~22%的CRKP定植患者可發生相關感染,以印度發生率最高,日本發生率最低[12]。康霞等[13]研究顯示,急診重癥監護室患者入科時CRKP定植率為4.08%(18/441)且CRKP引起的院內感染率為3.63%(16/441),且多因素回歸分析顯示,CRKP在直腸的定植是院內感染的獨立危險因素,因此提倡主動篩查并及早采取控制措施,以減少CRKP院內傳播風險。
本研究納入的6株CRKP感染株和10株CRKP定植株均對臨床常用的抗菌藥物呈現出較強的耐藥性。盡管16株CRKP來源于大外監和肝外監這2個獨立的科室,但部分臨床感染菌株和定植菌株的藥敏、耐藥基因分布以及同源性較為相似,存在交叉傳播的可能。肺炎克雷伯菌對碳青霉烯類抗菌藥物的耐藥機制主要包括四大類:① 產碳青霉烯水解酶;② 外排泵的高表達;③ 藥物結合位點的改變;④ 膜孔蛋白的缺失或改變,這些機制多由耐藥基因進行調控[14],且相同的耐藥機制中可以包含1種至多種耐藥基因。既往研究顯示,β-內酰胺酶類耐藥基因KPC-2和NDM是我國CRKP臨床分離株的主要流行基因[15],β-內酰胺酶類耐藥基因OXA-48近年來也呈明顯上升趨勢[16]。由于β-內酰胺酶類耐藥基因KPC-2、NDM、IMP、OXA-48和OXA-23等均可導致肺炎克雷伯菌對碳青霉烯類抗菌藥物耐藥,但不同國家和地區的此類耐藥基因流行強度不同,導致存在明顯的地域分布差異。本研究中16株CRKP菌株按照耐藥機制及基因類別可分為11種耐藥類型和28種耐藥基因型別,除了包含我國流行菌株最多見的β-內酰胺酶類耐藥基因KPC-2基因外,所有菌株還都包括氨基糖苷類耐藥基因BaeR、磷霉素類耐藥基因FosA和Uhpt,同時還有膜孔蛋白缺失基因OmpK、外排泵基因Cpx R、CRP和Emr R基因,但未能檢出β-內酰胺酶類耐藥基因NDM、IMP型金屬酶耐藥基因以及β-內酰胺酶類耐藥基因OXA-48和OXA-23等D類耐藥基因。黃雅軒等[17]對廣東省人民醫院血流感染的高毒力CRKP測序顯示,主要攜帶β-內酰胺酶類耐藥基因KPC-1、NDM-1,而陳森等[18]對湖北醫藥學院附屬太和醫院重癥醫學科的121株廣泛耐藥高毒力CRKP鑒定發現,耐藥基因主要為β-內酰胺酶類耐藥基因TEM-1、KPC、SHV,以及rmtB、qnrS、tetA,這些不同地區的CRKP耐藥基因分布差異提示CRKP的耐藥特性較為復雜,多由多種機制及基因共同介導。
高毒力肺炎克雷伯菌是近年來關注的熱點之一,具有高黏性、起病迅速、預后不良等特點,主要致病的毒力基因包括高黏液表型調節因子rmpA,鐵載體相關毒力基因iucB、iroNB、entB等[19]。有研究顯示,鐵載體是區分高毒力肺炎克雷伯菌和經典肺炎克雷伯菌的最準確和持久標志[20-21],尤其以aer、iroNB基因分布差異最大。本研究中16株CRKP菌株中entB、irp2、iroN、黏液表型基因rmpA檢出率分別為100%、87.5%、37.5%和62.5%,檢出比例略低于周浩澤等[22]對醫院分離的高毒力肺炎克雷伯菌的研究,但高于張冬梅等[23]對醫院分離的CRKP的研究。由于肺炎克雷伯菌遺傳物質中毒力基因通常與耐藥基因的遺傳位點互不重疊,且攜帶耐藥基因的質粒為適應環境而不會增加菌株毒力[24],本研究亦未發現攜帶耐藥基因數量多的CRKP菌株同時攜帶較多數量的毒力基因,提示CRKP的毒力特性與耐藥特性可能沒有正相關性。
ST分型是反映微生物進化和種群變異的技術手段,也是分析醫院內細菌流行與同源關系的關鍵技術。既往研究顯示ST 11型是我國醫院內肺炎克雷伯菌主要流行克隆型[25-27],但本研究中4株CRKP感染株為ST 258型,10株CRKP定植株的ST分型較多,但各菌株間系統發育同源性較低,可能是因為定植菌株的來源較為復雜,而臨床感染株有較為明確的院內傳播路徑。而定植株7與定植株8、感染株4與定植株9、感染株2與感染株3的同源性較高,對應患者住院病床的物理距離較近且重癥監護室住院時間具有一定的重疊,提示可能存在一定的院內傳播。有研究顯示,CRKP在胃腸道的定植與繼發的肝膿腫之間存在因果相關性[3],小鼠腸道定植模型已證實肺炎克雷伯菌通過特定的毒力基因導致肝臟感染[28],但本研究并沒有發現3月份的CRKP感染菌株與1 月—3月份的CRKP定植菌株存在強烈的時間因果關系,可能與本研究持續時間較短、進行測序分析的菌株樣本量偏少有關。此外,國外有研究顯示,僅20.54%的CRE定植患者在住院期間發生CRE感染,主要危險因素包含長期使用呼吸機,以及有碳青霉烯類、頭孢菌素類和喹諾酮類抗菌藥物使用史等[29],感染防控措施執行不到位可能是患者新發感染的主要原因。
綜上,本研究顯示,外科重癥監護室患者CRKP感染株與定植株的部分菌株有交叉傳播的風險,今后應加強醫院感染防控以降低感染的發生。然而,本研究同時存在以下局限:① 同期環境CRKP采樣為陰性,未能將環境作為傳播媒介納入研究;② 本次選用的CRKP菌株為2個監護室早期保存完整的菌株,納入研究的菌株數量較少,對主動篩查獲得CRKP菌株特性沒有較為全面的評估;③ 受限于研究經費,本次研究僅完成16株CRKP的WGS分析,對臨床感染菌株和主動篩查菌株的耐藥基因和毒力基因也僅從相關性進行探討,未能進行更深入的生物信息分析及機制探討。后續將收集更多科室的不同類型臨床感染菌株及主動篩查菌株,并采用多樣化技術手段對其耐藥性、毒力及同源性進行全面闡述,同時積極主動篩查,以降低CRKP在重癥監護室的流行與傳播。
利益沖突:所有作者聲明不存在利益沖突。