引用本文: 索朗玉珍, 胡倩, 楊月, 康鴻鑫, 張蜀, 萬美華. 骨髓間充質干細胞衍生的細胞外囊泡改善重癥急性胰腺炎小鼠肺組織損傷. 華西醫學, 2024, 39(11): 1718-1727. doi: 10.7507/1002-0179.202403090 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
急性胰腺炎是胰腺組織發生炎癥反應,以水腫、炎細胞浸潤、壞死、出血為特征,病情復雜,病程多變[1]。其中約有 20%的患者會發展為重癥急性胰腺炎(severe acute pancreatitis, SAP),其特點是伴有單個或多個器官功能衰竭,病死率高達 20%且預后不良[2]。急性肺損傷(acute lung injury, ALI)是 SAP 最首要的并發癥,也是 SAP 早期死亡的主要原因,SAP 合并 ALI 約占患者病死率的 70%[3-4]。盡管臨床上針對 ALI 及其伴隨的急性呼吸窘迫綜合征的支持性治療等方面取得了重大進展[5],例如限制性液體復蘇等[6],但患者的病死率仍高達 38%~46%[7]。因此,探索防治 SAP 相關 ALI 的有效手段仍是降低 SAP 病死率、改善預后亟待解決的問題。
間充質干細胞是一類具有自我更新及免疫調節功能的成體干細胞,其已被報道通過多種機制,如減少肺泡上皮和內皮細胞的通透性、改善肺泡液體清除、增強巨噬細胞吞噬能力等等,進而修復受損的肺組織[8]。并且越來越多證據表明間充質干細胞的治療作用主要依賴于旁分泌機制,如細胞因子和細胞外囊泡(extracellular vesicle, EV)等。EV 可以通過攜帶生物活性物質如信蛋白質、脂質等轉移到靶細胞,調節靶細胞行為并減輕炎癥反應[9-11]。同時骨髓來源的間充質干細胞即骨髓間充質干細胞(bone marrow mesenchymal stem cell, BMSC)分泌的 EV(BMSC derived EV, BMSC-EV)還避免了干細胞治療帶來的腫瘤風險,因而成為替代間充質干細胞的新型治療手段[12]。然而 BMSC-EV 對 SAP 及其肺組織損傷的效應少有報道。因此,本研究關注了 BMSC-EV 對 SAP 小鼠胰腺以及肺組織炎癥的效應,以幫助找到治療 SAP 相關 ALI 的有效治療手段。
1 材料與方法
1.1 實驗動物與材料
1.1.1 實驗動物
于四川大學動物中心購買 24 只 25 g 左右無特定病原體級雄性 C57BL/6 小鼠[生產許可證號:SCXK(川)2018-026,使用許可證號:001162068]。所有動物實驗均符合美國國家科學院發布的《實驗動物護理和使用指南》,該指南由美國國立衛生研究院出版。小鼠飼養于四川大學華西醫院科研院區動物中心,環境清潔,溫度恒定,為(22±2)℃,相對濕度 40%~70%,飼養環境晝夜規律,通風換氣良好,無菌水和飼料正常供應。本實驗經四川大學華西醫院實驗動物倫理委員會批準(2020233A)。
1.1.2 細胞及試劑
小鼠原代肺微血管內皮細胞(pulmonary microvascular endothelial cell, PMVEC)購買于湖南豐暉生物科技有限公司,牛磺膽酸鈉(sodium taurocholate, NaTC)[西格瑪奧德里奇(上海)貿易有限公司,編號 T4009],異氟烷(深圳市瑞沃德生命科技股份有限公司,型號 510-22),低濃度葡萄糖、含 L-谷氨酰胺和甲醛酸鈉的低糖培養基、胎牛血清、青霉素和鏈霉素購自于美國賽默飛世爾科技公司,成骨誘導培養基(貨號 CTCC-Y001)、成脂誘導培養基 A 液和 B 液(貨號 CTCC-Y003)、軟骨誘導培養基(貨號 CTCC-Y002)來自無錫菩禾生物醫藥技術有限公司公司。抗鈣黏蛋白 E(E-cadherin)(貨號 ab197751)單克隆抗體、抗緊密連接蛋白 ZO-1(貨號 ab216880)單克隆抗體、抗細胞間黏附分子(intercellular cell adhesion molecule-1, ICAM-1)(貨號 ab222736)單克隆抗體、抗甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)(貨號 ab8245)單克隆抗體、抗髓過氧化物酶(myeloperoxidase, MPO)(貨號 ab208670)單克隆抗體、抗 CD68(貨號 ab303565)單克隆抗體來自英國 Abcam 公司。二辛可寧酸(bicinchoninic acid, BCA)蛋白定量試劑盒購買于上海碧云天生物技術股份有限公司,小鼠轉化生長因子β(transforming growth factor β, TGF-β)(貨號 EK981-01)酶聯免疫吸附試驗(enzyme linked immunosorbent assay, ELISA)試劑盒購自杭州聯科生物技術有限公司,小鼠白細胞介素(interleukin, IL)-6(貨號 GEM0001)、IL-10(貨號 GEM0003)、腫瘤壞死因子-α(tumor necrosis factor α, TNF-α)(貨號 GEM0004)ELISA 試劑盒來自于武漢賽維爾生物有限公司。 Epon 812 包埋劑購買于北京新興百瑞技術有限公司。
1.1.3 儀器設備
賽默飛離心機(美國賽默飛世爾科技公司),投射電鏡(日本電子株式會社 JEOL 公司,型號 JEM-
1.2 研究方法
1.2.1 BMSC 提取、培養和鑒定
選擇 2 周大小 C57BL/6 小鼠,頸椎脫臼法處死。采用75%乙醇浸泡 5 min,無菌條件下取小鼠雙側股骨、脛骨,無菌剪鈍性剝離肌肉,將分離干凈的股骨、脛骨放入磷酸鹽緩沖液中清洗 2 次后放進預冷的低濃度葡萄糖、含 L-谷氨酰胺和甲醛酸鈉的低糖培養基中;將骨組織置于研缽,加入少許上述培養基進行研磨,研磨杵輕輕按壓破壞骨髓腔,使骨髓細胞流出,直到骨髓腔變白,研磨液經 70 μm 濾器過濾,過濾所得的濾液經
BMSC 成骨分化鑒定:按照密度為 5×103 個/cm2 接種在含蓋玻片 6 孔板中,待細胞融合到 60%~70%,開始誘導,加入成骨誘導培養基,每隔 3 d 更換新鮮的成骨誘導培養基,誘導 2 周后,茜素紅染色鑒定其分化的成骨細胞。
BMSC 成脂分化鑒定:按照密度為 5×104 個/cm2 接種在含蓋玻片 6 孔板中,待細胞融合到接近 100%,開始誘導,棄去培養基,加入成脂誘導培養基 A 液,誘導 48 h 后吸棄 A 液,換成成脂誘導培養基 B 液,再誘導 24 h,吸棄 B 液,換成 A 液繼續誘導,A、B 液交替作用 3~5 次后,繼續用 B 液維持培養直到細胞內油脂足夠大,然后使用油紅染色鑒定。
BMSC 成軟骨分化鑒定:按照密度 5×105 個/mL 用軟骨誘導培養基重懸 BMSC 細胞,吸取 0.5 mL 細胞懸液轉移到 15 mL 離心管中,
1.2.2 BMSC-EV 提取及鑒定
當第 4 代 BMSC 生長密度在 70%~80%,換用無血清的 DMEM-LG 培養基繼續培養細胞 24~48 h,然后收集細胞上清液,700×g 離心轉速,離心半徑為 144 mm,4℃ 離心 10 min,小心吸取上清液,2 000×g 離心轉速,離心半徑為 144 mm,4℃ 再次離心 15 min,確保去除細胞或細胞碎片,收集上清液,15 000×g 離心轉速,離心半徑為 109.7 mm,4℃ 離心 30 min,收集上清液用 0.22 μm 濾網過濾較大的懸浮顆粒,收集上清液于超高速離心機離心 120 000×g 離心轉速,離心半徑為 152.5 mm,4℃ 離心 70 min 收集 BMSC-EV 沉淀。
BMSC-EV 透射電鏡鑒定:在新鮮提取的 BMSC-EV 中,取出 10 μL 直接滴在銅網上沉淀 1 min,濾紙吸去浮液;然后將醋酸雙氧鈾銅滴加在銅網上沉淀 1 min,常溫干燥數分鐘,在加速電壓為 8、12 kV 的時候,置于透射電鏡樣品臺進行電鏡檢測成像。
BMSC-EV 納米直徑鑒定:將 BMSC-EV 混懸液按照 1∶1 000、1∶2 000、1∶5 000、1∶10 000 等不同倍數進行稀釋;先用標準品進行納米顆粒跟蹤分析儀性能測試合格后方可進行外泌體樣品上樣。待樣本完成檢測即可獲得儀器檢測外泌體的粒徑和濃度信息。
BMSC-EV 蛋白質印跡鑒定:用蛋白裂解液冰上裂解 BMSC-EV 樣本,然后用 BCA 法檢測蛋白濃度,確定蛋白上樣量,再用常規蛋白質印跡方法對 BMSC-EV 表面蛋白抗原(陽性抗原:CD63 和 TSG101,陰性抗原:Calnexin)進行定性定量檢測。
1.2.3 PMVEC 透射電鏡觀察及分組
用胰蛋白酶消化 PMVEC,收集細胞沉淀,先用 0.5%戊二醛溶液固定細胞 10 min,然后 1 200 r/min 離心 10 min,用 3%戊二醛溶液固定細胞沉淀(勿吹散)。這些樣品在 1%四氧化鋨中后固定,在系列丙酮中脫水,在 Epon 812 包埋劑中浸潤 12 h 以上,然后包埋。半薄切片用亞甲藍染色,超薄切片用金剛石刀切割,用乙酸鈾酰和檸檬酸鉛染色。切片用 JEM-
為了驗證 BMSC-EV 改善 SAP 小鼠肺屏障功能的效應,根據本課題組的前期研究基礎和已發表文獻[4, 13-14],本研究特選用 NaTC 刺激小鼠 PMVEC 作為模型組(NaTC 組),20 μg/mL BMSC-EV 體外治療 NaTC 干預的 1.5×106 個 PMVEC 作為治療組(BMSC-EV 組),相同體積的培養基刺激 PMBEC 作為對照組。
1.2.4 SAP 小鼠模型的建立及分組
將 24 只小鼠按照體重大小從 1~24 編號,然后根據隨機數字表法,確定隨機數字,除以 11,取余數,余數為 0 的分為假手術組,余數為 1 的分為 SAP 組,余數為 2 的分為 SAP 小鼠 BMSC-EV 治療組(BMSC 組),每組 8 只。
將需要造模的 SAP 和 BMSC 組小鼠,一共 16 只小鼠,用 2%的異氟烷吸入麻醉,然后仰臥位固定,行中線剖腹術,找到胰腺和十二指腸乳頭,在十二指腸對系膜緣用 24G 靜脈留置針箭頭造成穿刺傷,順著十二指腸穿進胰膽管,然后用微型血管夾夾住胰膽管靠近肝門處。參考 Perides 等[15]的操作步驟,通過靜脈留置針以 0.06 mL/h 速率微量泵泵入 2%的牛磺膽酸鈉 4 min,待牛磺膽酸鈉通過輸液管注入胰腺后靜置 1 min,然后取下導管、血管夾,用 7-0 縫合線縫合十二指腸穿刺傷,最后關腹縫合,皮下注射約 0.8 mL 生理鹽水,防止脫水。待小鼠復溫后放入籠子里。
根據課題組前期研究基礎和已發表文獻[4, 13-14],BMSC 組選擇在造模前 1 h 由尾靜脈注射 10 μL 含有 100 μg 的 BMSC-EV,觀察其對 SAP 小鼠胰腺組織的影響。造模 24 h 后取 3 組小鼠的血清和胰腺、肺組織。24 h 后,假手術組存活 8 只,死亡率為 0%;SAP 組小鼠存活 6 只,死亡率為 25%,BMSC 組存活 7 只,死亡率為 12.5%。
1.2.5 組織病理學分析
每組存活的小鼠取 6 例適量大小的胰腺和左上葉肺組織用 4%多聚甲醛固定后,將組織包埋在石蠟中并制成切片(5 μm 厚)。首先使用二甲苯進行組織切片脫蠟處理,然后放置在不同濃度梯度的乙醇(高濃度到低濃度)中洗去二甲苯;蘇木精染色 5 min,鹽酸乙醇進行分色后,5%伊紅液染色 2~3 min;接著用不同濃度梯度乙醇(低濃度到高濃度)進行組織脫水處理,二甲苯使之透明;最后滴上中性樹膠,蓋上蓋玻片封固。胰腺組織和肺組織損傷程度分別從以下內容進行評估:① 胰腺組織:小葉間水腫、炎細胞浸潤以及浸潤的數量、出血點/灶及其數量、胰管或者胰腺實質壞死面積和數量;② 肺組織:間質和肺泡內水腫、出血、炎細胞浸潤和肺泡壁纖維化情況。每個項目用 5 分制評分如下:0 分為最小損害,損傷面積<20%、1 分為輕度損害,損傷面積在 20%~40%、2 分為中度損害,損傷面積在 40%~60%;3 分為嚴重損害,損傷面積在 60%~80%;4 分為最大損害,損傷面積在 80%~100%。每個方面的病理評分分數的總和是胰腺和肺組織的病理學分數。
1.2.6 淀粉酶、脂肪酶和炎癥因子的測定
因 SAP 組和 BMSC 組小鼠死亡率原因,取各組小鼠 5 例血清樣本,每例大約 100 μL 血清,送至成都華西海圻醫藥科技有限公司進行自動化檢測淀粉酶和脂肪酶。
因各組小鼠肺組織要做組織病理、免疫組織化學、炎癥因子檢測和蛋白印跡測定,數量有限,故取每組小鼠 4 例肺組織做 TGF-β炎癥因子檢測,每組 5 例小鼠肺組織做 IL-6 炎癥因子檢測,小鼠左下葉肺組織按照組織重量和稀釋緩沖液體積 1∶9 的比例加入稀釋緩沖液進行研磨,然后收集組織研磨液上清液。取各組小鼠 6 例 100 μL 血清樣本直接檢測;PMVEC 細胞炎癥因子檢測,直接收集其干預后的細胞上清液進行檢測,每組選取6例細胞上清液。根據小鼠 TGF-β、IL-6、IL-10、TNF-α ELISA 試劑盒的操作手冊制備測試樣品。步驟為:在每個檢測孔中加入 100 μL 標準品或樣品,37℃下孵育 2 h;吸取并依次加入 100 μL 試劑盒里已經制備好的檢測試劑 A 和試劑 B 到每個檢測孔中,37℃孵育 1 h,然后吸棄液體并洗滌 5 次;向每個孔中加入 90 μL 底物溶液,37℃避光孵育 15~25 min,并向每個孔中加入 50 μL 終止液;最后運行酶標儀,立即在 450 nm 處進行讀數。
1.2.7 肺組織免疫組織化學
每組取 6 例小鼠左上葉肺組織 5 μm 的病理切片,使用二甲苯進行脫蠟,并在不同濃度的乙醇中再水合。在室溫下,3%過氧化氫淬滅內源性過氧化物酶活性 30 min,然后在磷酸鹽緩沖液中沖洗。在 10 mmol/L 檸檬酸鹽緩沖液(pH 值為 6.0)中于 94℃ 下回收抗原,10 min 后,將切片與封閉液在室溫下孵育 1 h,以封閉非特異性位點。然后將切片與 MPO(抗體原液和抗體稀釋液按照 1∶200 比例稀釋)和 CD68(抗體原液和抗體稀釋液按照 1∶400 比例稀釋)的抗體在 4℃孵育過夜(約 12 h)。3 次洗滌后,將切片與適量的、能覆蓋切片的抗鼠或抗兔的二抗在室溫下孵育 30 min,然后與鏈霉親和素-辣根過氧化物酶試劑和二氨基聯苯胺底物孵育。最后將切片浸入去離子水中,用蘇木精復染,洗滌并密封。在倒置顯微鏡放大倍數為 20、40 倍下進行觀察。2 位閱片師按照每個片在顯微鏡下選取 10 個視野進行觀察,并用 Image J 軟件進行分析和測定光密度值。最終取每張片子光密度值的平均值進行統計分析。
1.2.8 蛋白質印跡測定
取各組 3 例小鼠右葉肺組織或每組 4 管 PMVEC 沉淀,加入適量含有磷酸酶抑制劑、蛋白酶抑制劑的放射免疫沉淀法裂解緩沖液,混勻;冰上裂解 30 min,配置 BCA 液測蛋白濃度和標準品;算出待測樣本蛋白濃度和每個樣本 20、40 μg 蛋白的上樣體積,然后選擇合適濃度的十二烷基硫酸鈉-聚丙烯酰胺電泳膠,將蛋白樣品以及蛋白質常規分子量標記(Marker,10~180 kDa)按順序加入到電泳膠上的孔內開始電泳,先濃縮(80 V、30 min),后分離(120 V、60 min);電泳完畢后,開始轉膜、封閉、過夜孵一抗(E-cadherin、ZO-1 和 ICAM-1)、洗膜、根據一抗說明書對應地孵育羊抗兔或羊抗鼠的二抗、曝光。
1.3 統計學方法
使用 GraphPad Prism 8.0.2 軟件進行數據分析。正態分布的計量資料采用均數±標準差表示,多組間比較采用單因素方差分析,組間兩兩比較使用 Dunnett-t 檢驗。計數資料采用頻數表示。雙側檢驗水準α=0.05。
2 結果
2.1 BMSC 和 BMSC-EV
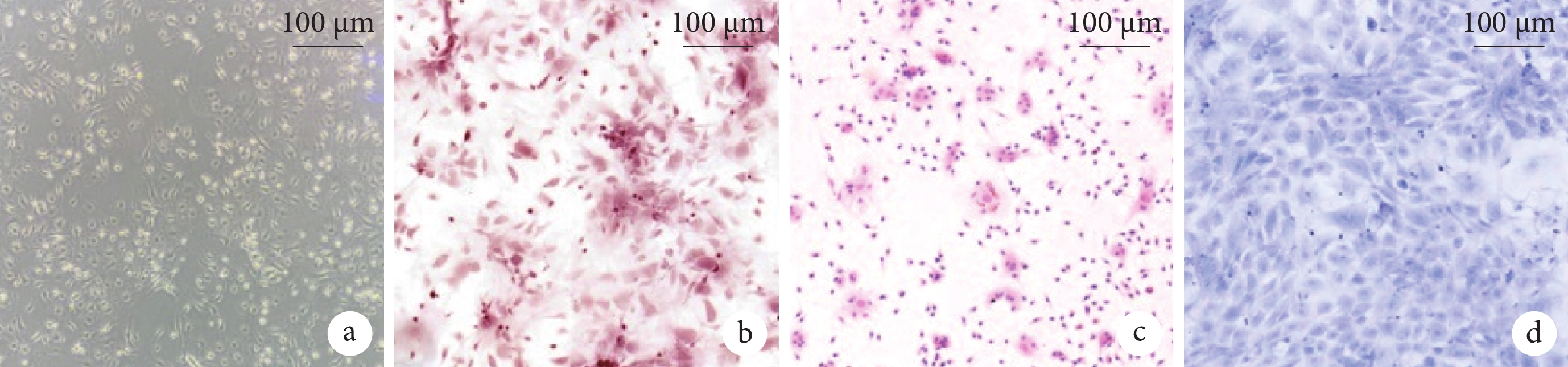
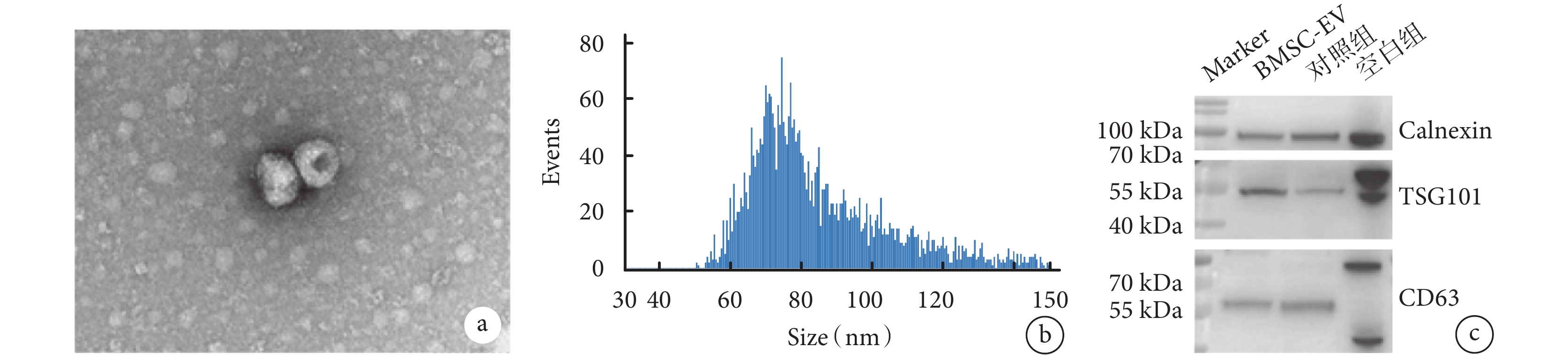
經過誘導分化,BMSC 表現出明顯具有成骨、成脂、成軟骨分化的潛力(圖1)。于是提取第 4 代及以后代系的 BMSC 上清液中 EV,透射電鏡證實其具有典型“杯狀”形態(圖2a),納米流式檢測 BMSC-EV 直徑在 60~100 nm(圖2b)。蛋白質印跡測定結果顯示,相比 BMSC,BMSC-EV 表達陽性蛋白 TSG101 和 CD63,不表達陰性蛋白 calnexin(圖2c)。
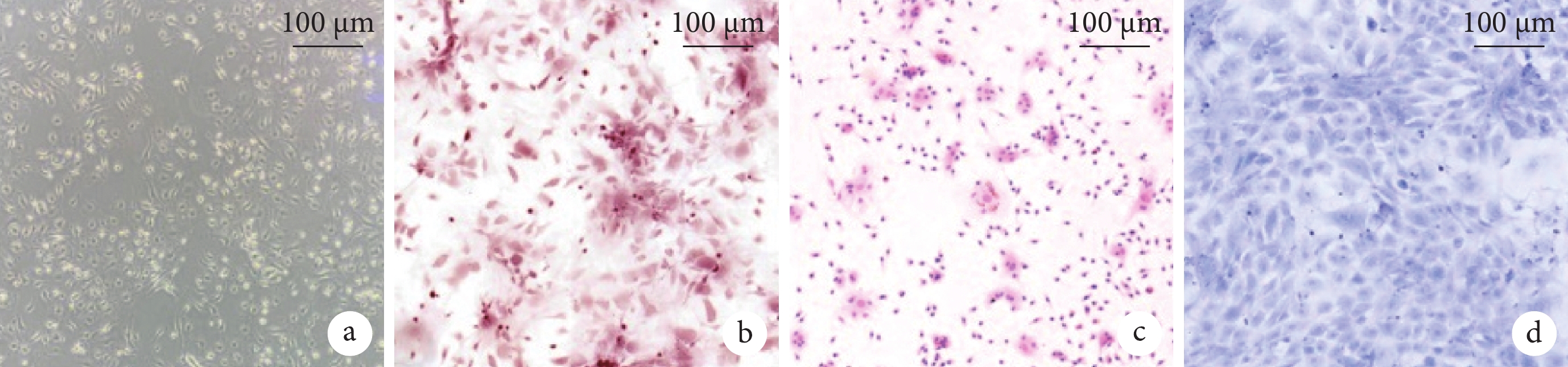 圖1
BMSC 分化鑒定像
圖1
BMSC 分化鑒定像
a. 明場;b. 成骨分化(茜素紅染色);c. 成脂分化(油紅染色);d. 成軟骨分化(甲苯胺藍染色)。BMSC:骨髓間充質干細胞
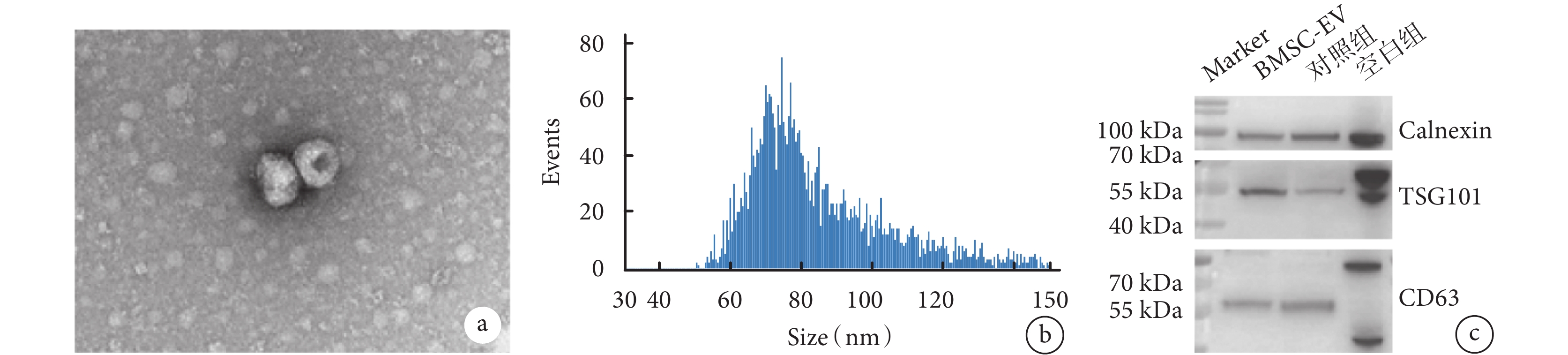 圖2
BMSC-EV 鑒定
圖2
BMSC-EV 鑒定
a. BMSC-EV 在加速電壓為 8 kV 的透射電鏡圖片,標尺為 100 nm;b. 提取的 BMSC-EV 的粒徑大小,縱坐標代表顆粒數,橫坐標代表粒徑大小;c. BMSC 作為空白組,其他來源的 EV 作為對照組,BMSC-EV 的 TSG101、CD63 和 calnexin 蛋白質表達圖。BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡;BMSC:骨髓間充質干細胞;EV:細胞外囊泡
2.2 BMSC-EV 改善 SAP 小鼠胰腺組織炎癥
假手術組、SAP 組、BMSC-EV 組在小鼠胰腺組織病理評分[(1.0±0.6) vs.(4.5±1.0) vs.(2.5±1.0)分;F=21.350,P<0.001]、淀粉酶[(193.2±155.5) vs.(1 458.0±572.8) vs.(428.8±213.4)U/L;F=17.050,P<0.001]、脂肪酶[(82.0±15.7) vs. (861.7±70.5) vs.(698.3±82.1)U/L;F=254.600,P<0.001]、IL-6[(0.5±0.5) vs.(428.5±236.0) vs. (156.9±146.2)pg/mL;F=10.960,P<0.001]、TNF-α[(10.2±0.1) vs.(30.2±20.7) vs.(12.0±1.2)pg/mL;F=5.113,P=0.020]、IL-10[(21.6±5.2) vs.(27.7±6.2) vs.(163.7±152.5)pg/mL;F=4.981,P=0.022]比較,差異均有統計學意義。
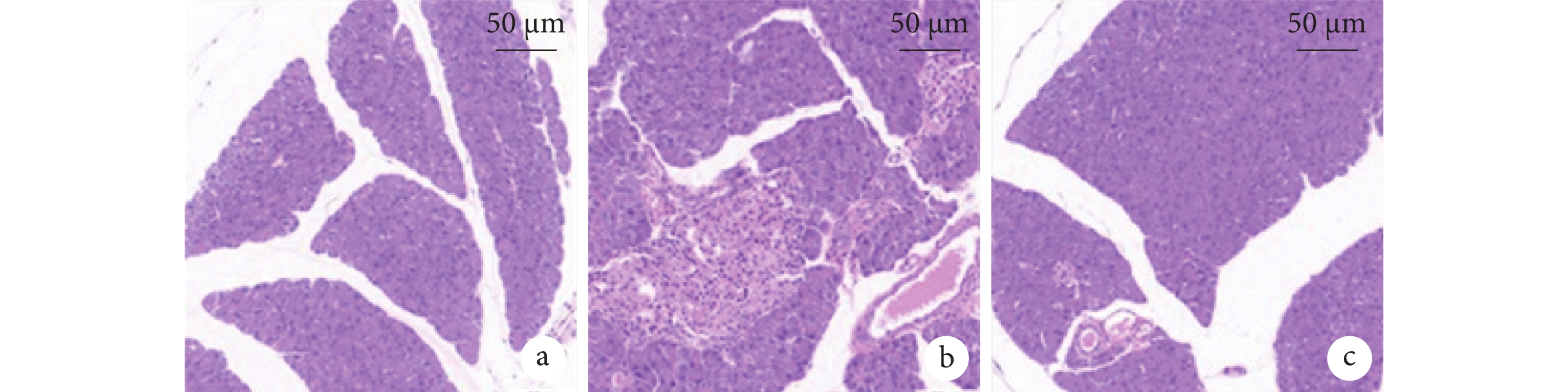
組間兩兩比較,SAP 組較假手術組小鼠胰腺出現了出血、壞死、炎細胞浸潤等病理改變,且血淀粉酶、脂肪酶、IL-6、TNF-α均上調(P<0.05),而 IL-10 差異無統計學意義(P>0.05)。但 BMSC-EV 下調了 SAP 小鼠 IL-6(P<0.05)、TNF-α(P<0.05)水平,及上調了抗炎因子 IL-10(P<0.05)水平;也改善了 SAP 小鼠胰腺組織損傷,降低其病理評分(P<0.05),并下調 SAP 小鼠血清淀粉酶、脂肪酶(P<0.05)。BMSC-EV 組、假手術組在淀粉酶、IL-6、TNF-α比較,差異均無統計學意義(P>0.05),然而在胰腺組織病理評分、脂肪酶和 IL-10 表達等方面上仍處于上調水平(P<0.05)。小鼠胰腺組織病理彩色像見圖3。
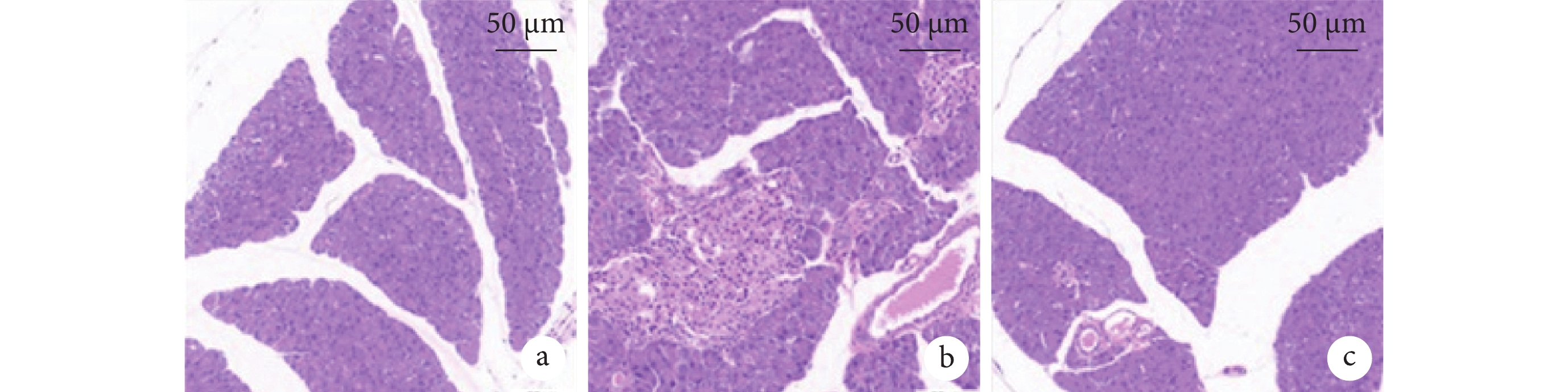 圖3
小鼠胰腺組織病理彩色像(蘇木精-伊紅染色)
圖3
小鼠胰腺組織病理彩色像(蘇木精-伊紅染色)
a. 假手術組;b. SAP 組;c. BMSC-EV 組。SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
2.3 BMSC-EV 改善 SAP 小鼠肺組織炎癥
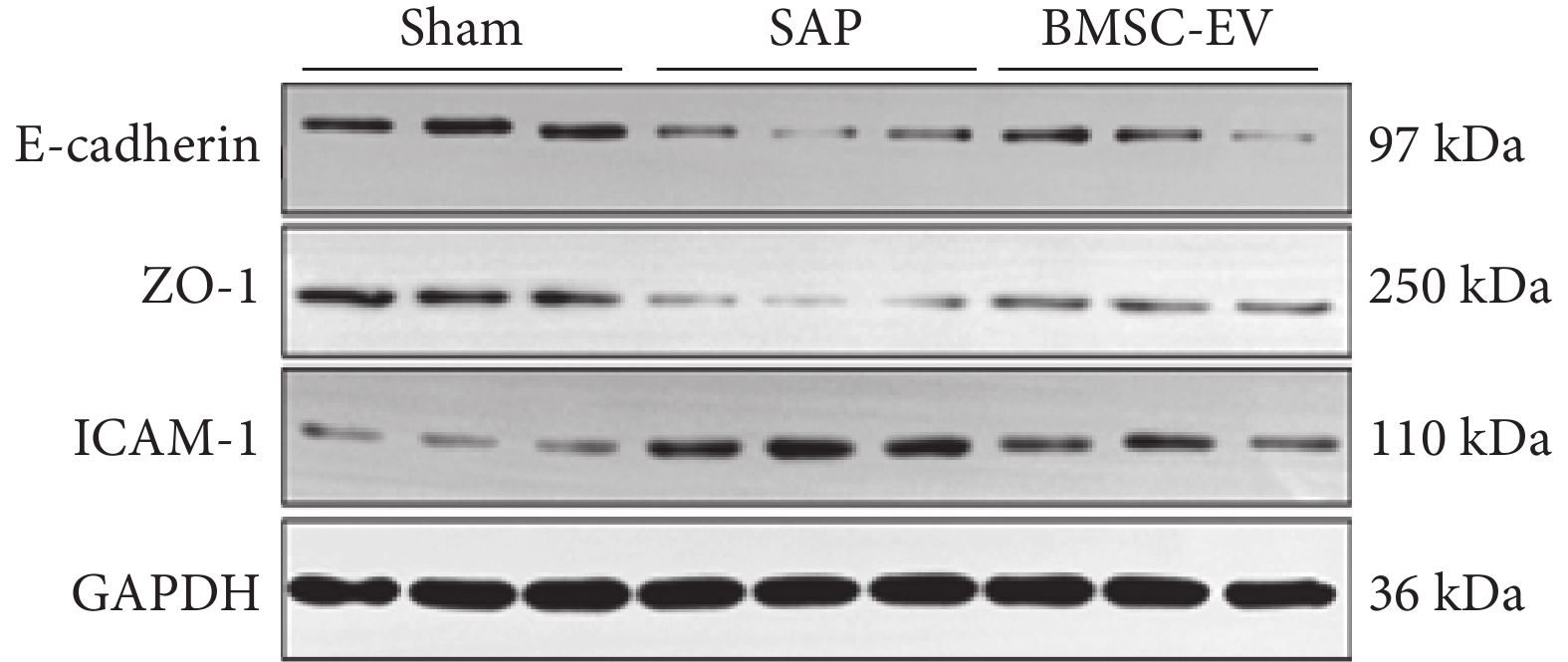
假手術組、SAP 組、BMSC-EV 組在小鼠肺組織病理評分[(1.2±0.8) vs.(5.38±1.58) vs.(2.7±1.2)分;F=18.640,P<0.001]、CD68(巨噬細胞陽性染色)(3.7±2.1 vs. 11.6±2.9 vs. 6.5±2.5;F=14.780,P<0.001)、MPO(中性粒細胞陽性染色)(5.4±3.5 vs. 23.9±5.8 vs. 12.4±4.7;F=23.180,P<0.001)、TGF-β[(415.6±61.4) vs.(687.9±105.1) vs.(321.6±170.9)pg/mL;F=9.866,P<0.001]、IL-6[(11.9±1.6) vs.(498.1±188.5) vs.(201.4±84.8)pg/mL;F=21.170,P<0.001]、E-cadherin/GAPDH(0.8±0.2 vs. 0.2±0.1 vs. 0.4±0.2;F=29.120,P<0.001)、ZO-1/GAPDH(0.7±0.2 vs. 0.1±0.0 vs. 0.4±0.0;F=48.230,P<0.001)、ICAM-1/GAPDH(0.4±0.2 vs. 0.9±0.2 vs. 0.6±0.1;F=12.950,P<0.001)比較,差異均有統計學意義。
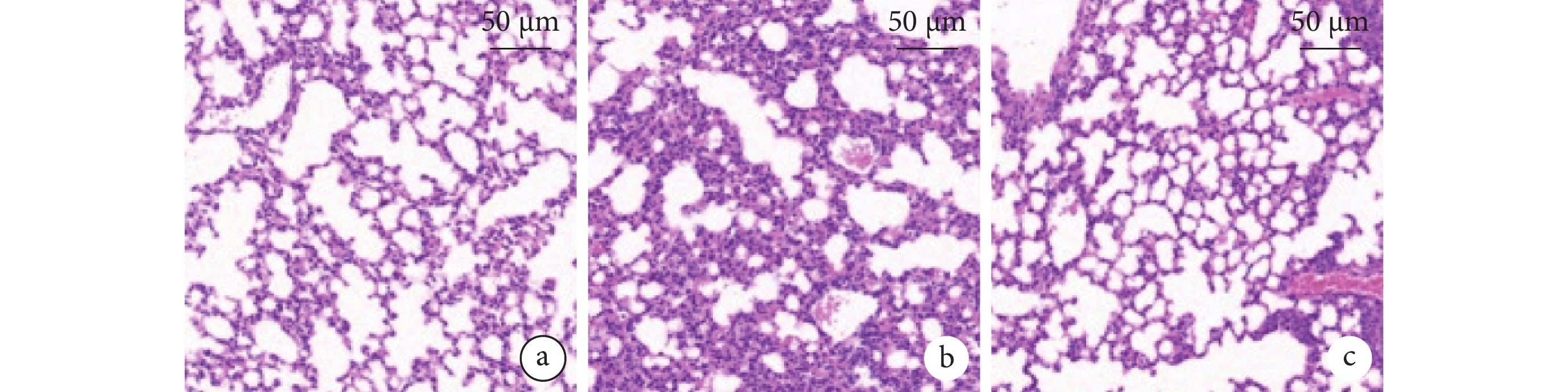
組間兩兩比較,SAP 組較假手術組小鼠肺組織間質和肺泡內水腫、出血、炎細胞浸潤,病理學評分升高,屏障蛋白 E-cadherin、ZO-1 蛋白下調,調控炎細胞黏附的 ICAM-1 蛋白上調,巨噬細胞(CD6 陽性標記)和中性粒細胞(MPO 陽性標記)浸潤數量高、TGF-β、IL-6 的水平上調(P<0.05);但 BMSC-EV 可改善 SAP 小鼠肺組織病理損傷,肺組織炎細胞浸潤數量減少、肺組織炎癥因子的水平降低,上調 E-cadherin、ZO-1 蛋白表達,抑制了 ICAM-1 蛋白水平(P<0.05)。BMSC-EV 組與假手術組在肺組織病理評分、CD68 陽性標記數量、MPO 陽性標記數量、TGF-β、IL-6、ICAM-1/GAPDH 蛋白表達比值比較,差異均無統計學意義(P>0.05),但在 BMSC-EV 可升高 E-cadherin/GAPDH 和 ZO-1/GAPDH 蛋白表達比值(P<0.05)。小鼠肺組織病理彩色像、小鼠肺組織 CD68 和 MPO 染色的典型組織化學彩色像、BMSC-EV 對 SAP 小鼠肺組織 E-cadherin、ZO-1、ICAM-1、GAPDH 蛋白水平見圖4~6。
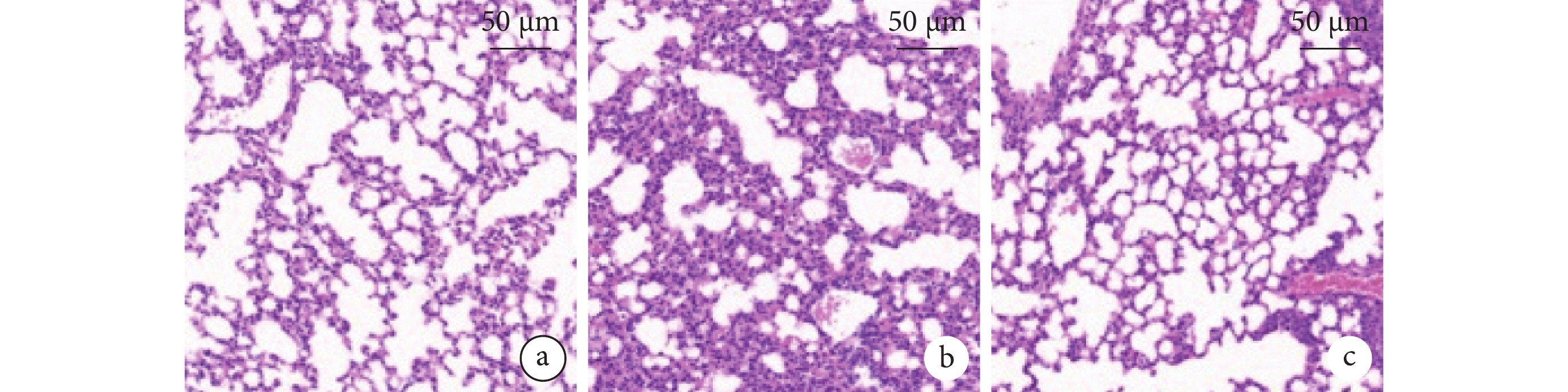 圖4
小鼠肺組織病理彩色像(蘇木精-伊紅染色)
圖4
小鼠肺組織病理彩色像(蘇木精-伊紅染色)
a. 假手術組;b. SAP 組;c. BMSC-EV 組。SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌細胞外囊泡
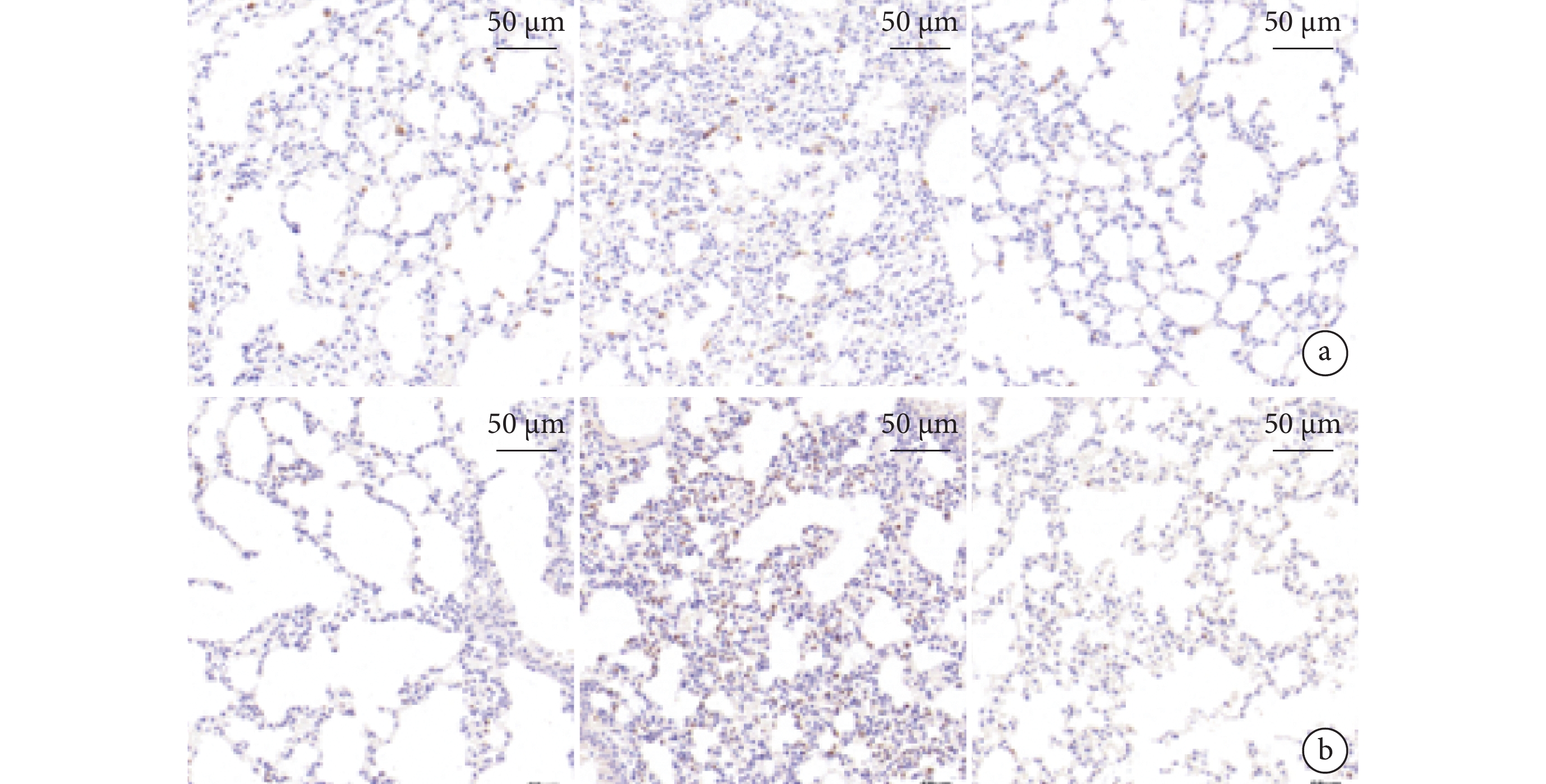
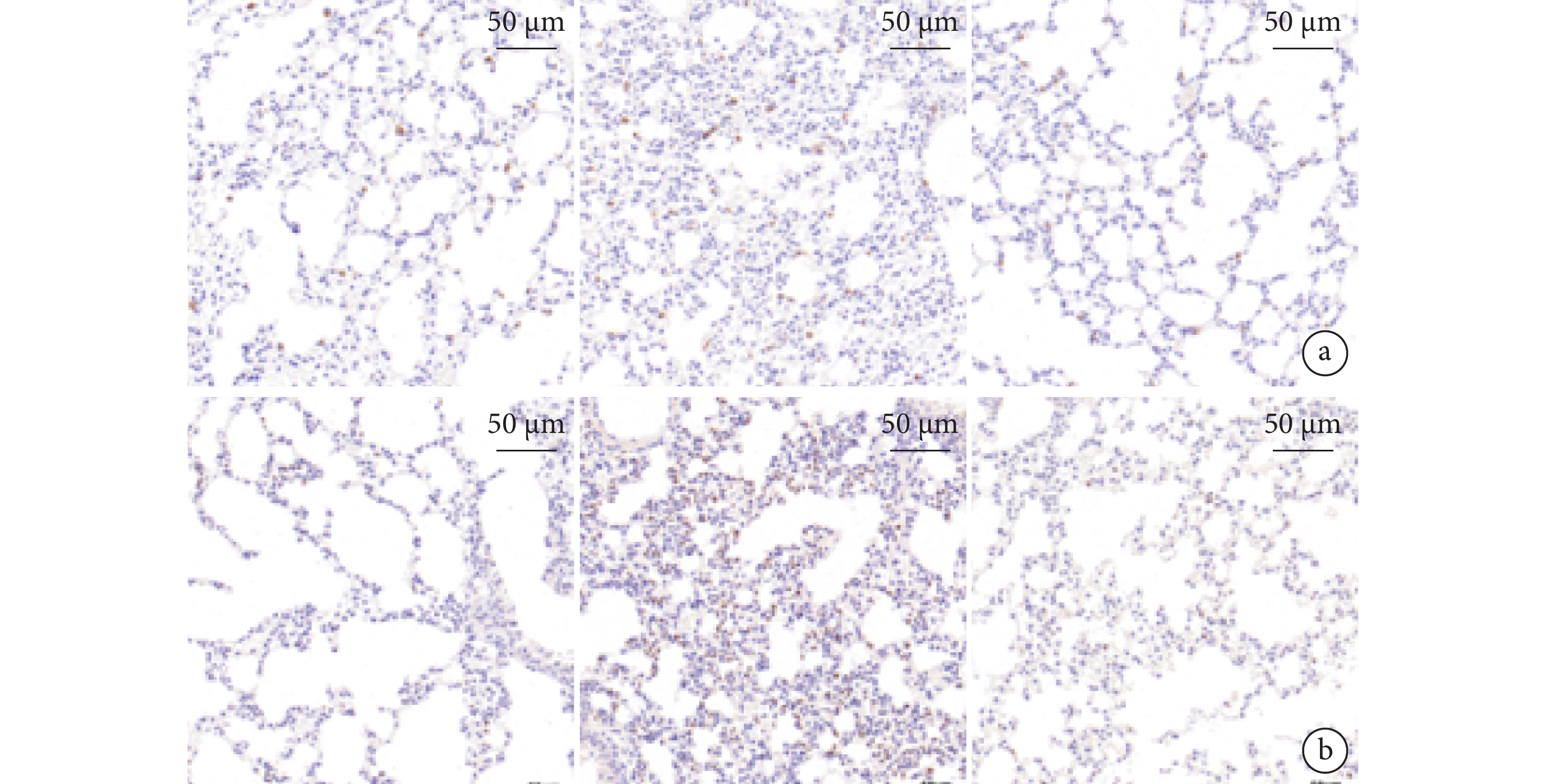 圖5
3 組小鼠肺組織 CD68 和 MPO 染色的典型組織化學彩色像
圖5
3 組小鼠肺組織 CD68 和 MPO 染色的典型組織化學彩色像
a. CD68(巨噬細胞染色);b. MPO(中性粒細胞染色)。從左到右依次為假手術組、SAP 組、BMSC-EV 組。MPO:抗髓過氧化物酶;SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
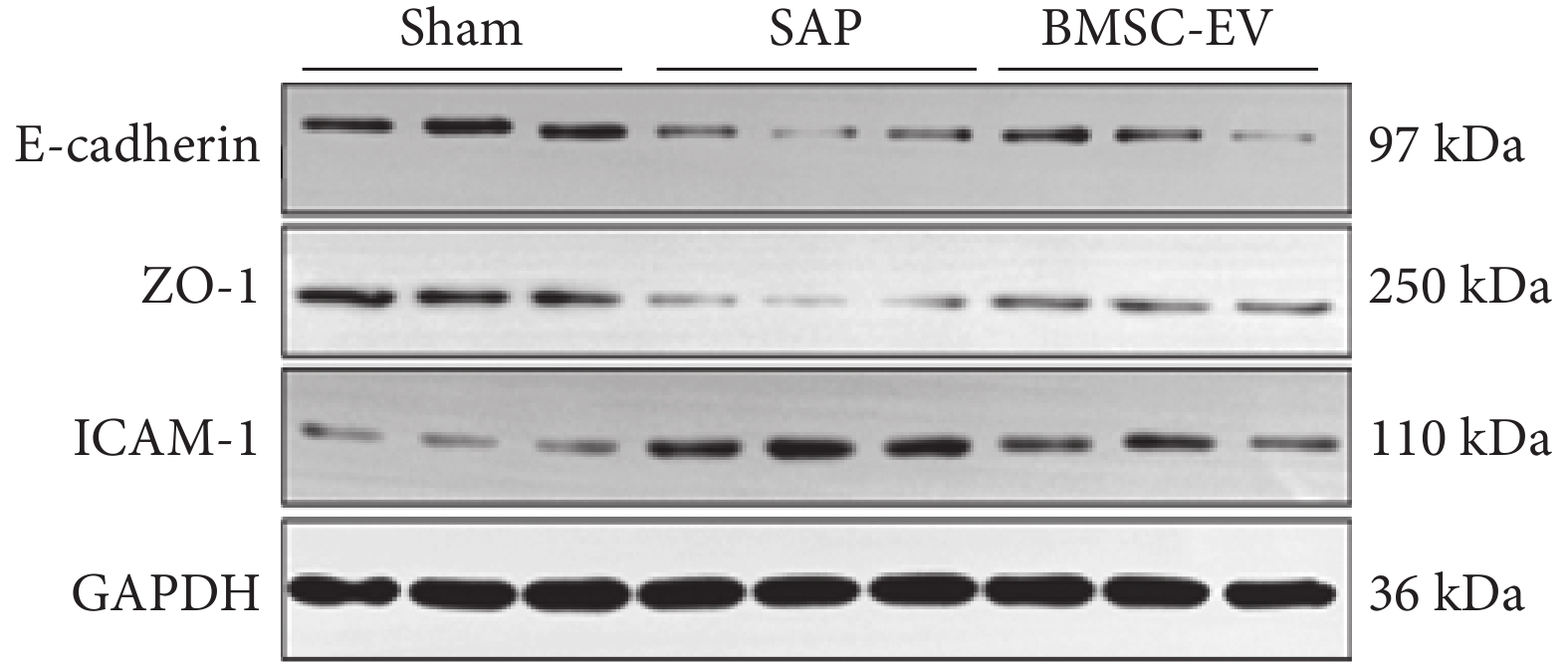 圖6
小鼠肺組織 E-cadherin、ZO-1、ICAM-1 蛋白的表達(n=3)
圖6
小鼠肺組織 E-cadherin、ZO-1、ICAM-1 蛋白的表達(n=3)
以 GAPDH 蛋白作為參照。E-cadherin:鈣黏蛋白 E;ZO-1:緊密連接蛋白;ICAM-1:細胞間黏附分子;GAPDH:抗甘油醛-3-磷酸脫氫酶;sham:假手術;SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
2.4 BMSC-EV 恢復 PMVEC 間緊密連接減輕炎癥
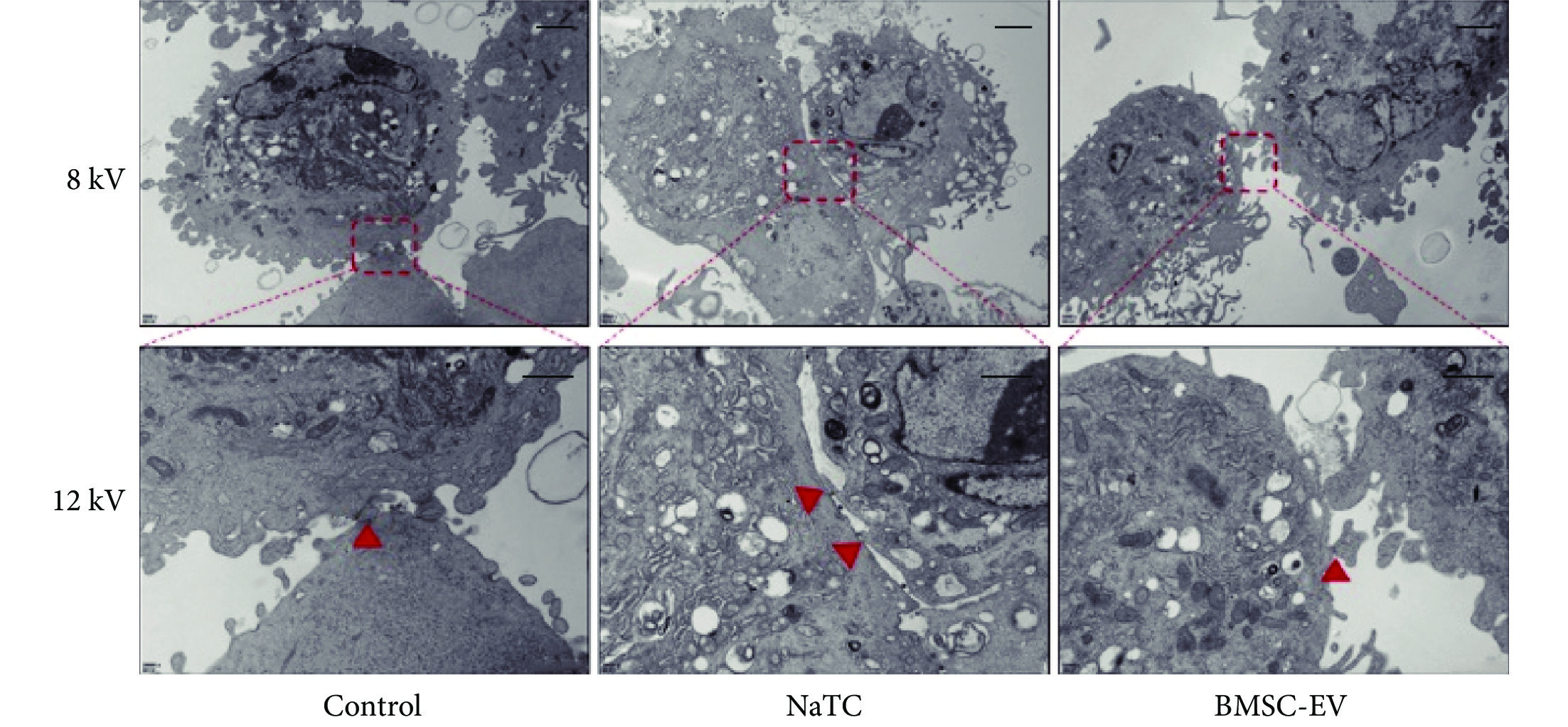
PMVEC 在不同刺激下透射電鏡下圖像見圖7。可見,相比對照組,NaTC 誘導 PMVEC 細胞核輕微壞死,細胞器(線粒體、內質網)腫脹、細胞間緊密連接斷裂;而 BMSC-EV 抑制了 NaTC 誘導的 PMVEC 細胞壞死和細胞器腫脹,且還恢復了其緊密連接。
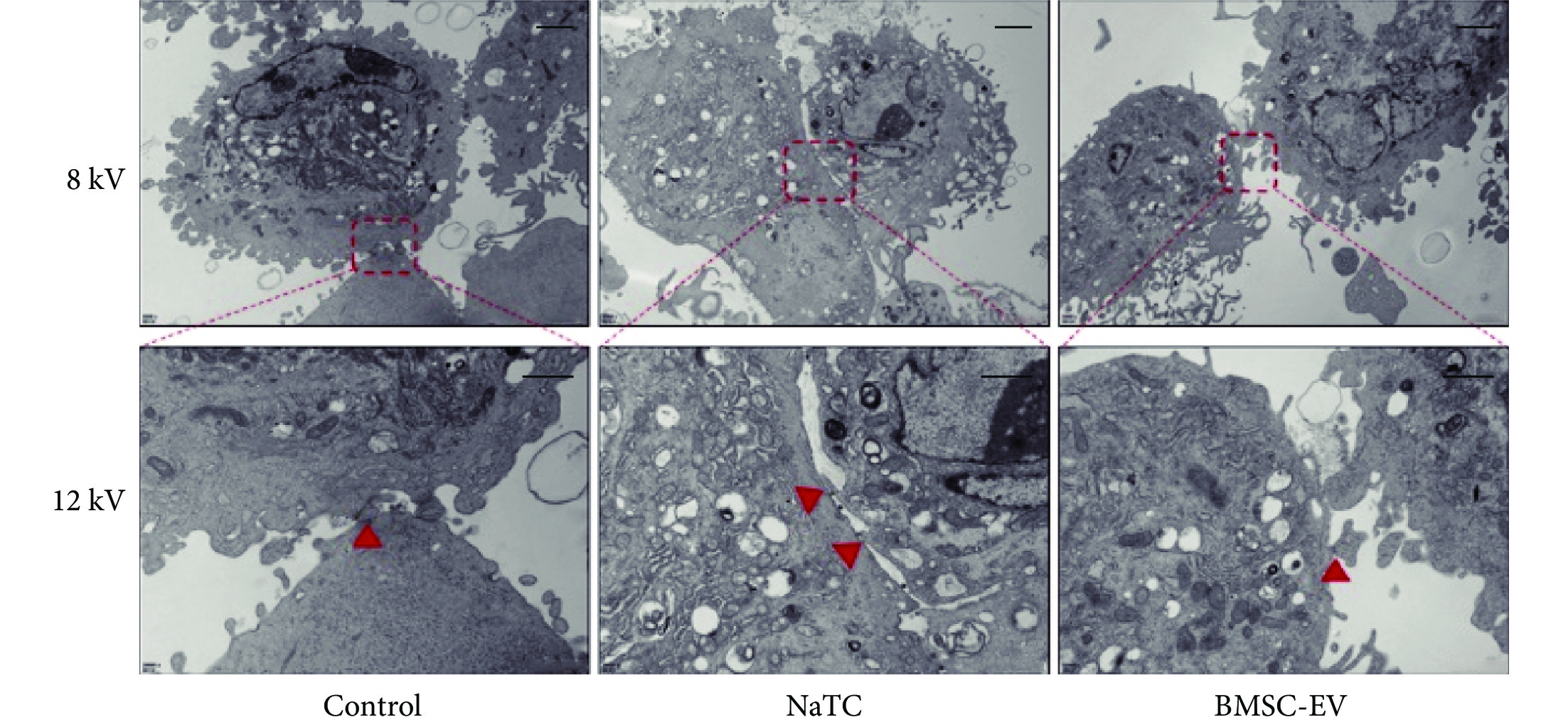 圖7
PMVEC 在不同刺激下透射電鏡下圖像
圖7
PMVEC 在不同刺激下透射電鏡下圖像
PMVEC 經過培養基、NaTC、NaTC和 BMSC-EV 刺激后,在加速電壓為 8 kV 和 12 kV 的時候,透射電鏡下典型的細胞形態圖片,12 kV的圖像是將 8 kV 圖像中紅色虛線圈出來的位置進行放大;可見 NaTC 組 PMVEC 細胞核輕微壞死,線粒體和內質網輕微腫脹、細胞間緊密連接斷裂;而對照組和 BMSC-EV 組 PMVEC 細胞核和細胞器形態完整,細胞間緊密連接;紅色▲指向細胞間緊密連接處。PMVEC:小鼠肺微血管內皮細胞;Control:對照(培養基);NaTC:牛磺膽酸鈉;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
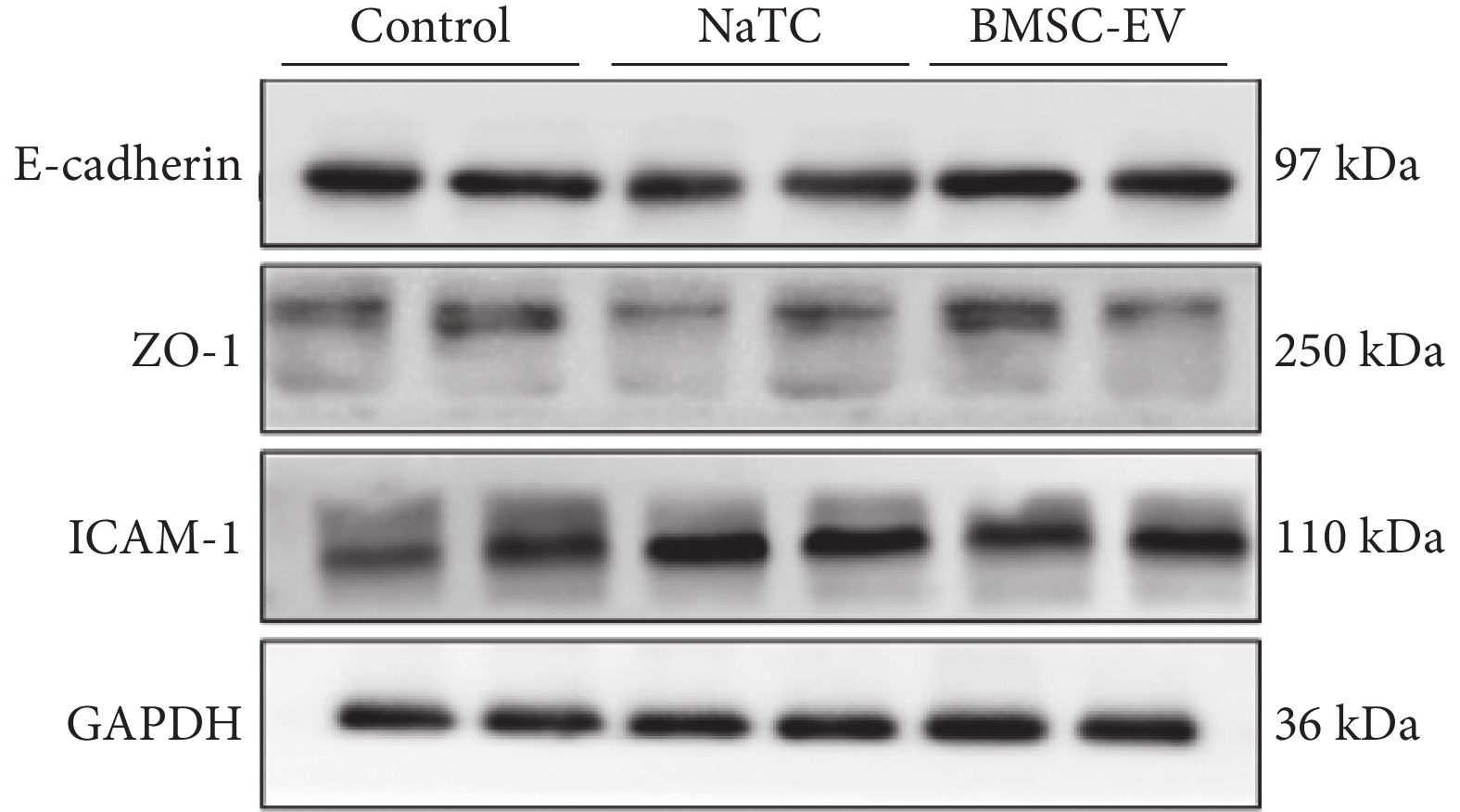
對照組、NaTC 組、BMSC-EV 組 PMVEC 炎癥因子 TNF-α[(12.8±4.2) vs.(31.6 ±9.0) vs. (12.2±5.59)pg/mL;F=17.040,P<0.001]、IL-6[(2.9±1.9) vs.(29.2 ±12.0) vs.(15.0±6.2)pg/mL;F=16.750,P<0.001]、E-cadherin/GAPDH(1.0 ±0.1 vs. 0.7±0.1 vs. 1.0±0.2;F=6.590,P<0.001)、ZO-1/GAPDH(0.2 ±0.0 vs. 0.1±0.0 vs. 0.2 ±0.0;F=9.717,P<0.001)、ICAM-1/GAPDH(0.7 ±0.2 vs. 1.1±0.1 vs. 0.9 ±0.1;F=16.840,P<0.001)比較,差異均有統計學意義。
組間兩兩比較,相比對照組,NaTC 組 TNF-α、IL-6、ICAM-1 蛋白水平上調,E-cadherin、ZO-1 蛋白下調(P<0.05);但 BMSC-EV 抑制了 TNF-α、IL-6 分泌和 ICAM-1 蛋白表達,上調了 E-cadherin、ZO-1(P<0.05)。BMSC-EV 組與對照組的 TNF-α、E-cadherin/GAPDH、ZO-1/GAPDH、ICAM-1/GAPDH 蛋白表達比值比較,差異均無統計學意義(P>0.05),但 BMSC-EV 可升高 IL-6(P<0.05)。PMVEC 細胞 E-cadherin、ZO-1、ICAM-1、GAPDH 蛋白水平見圖8。
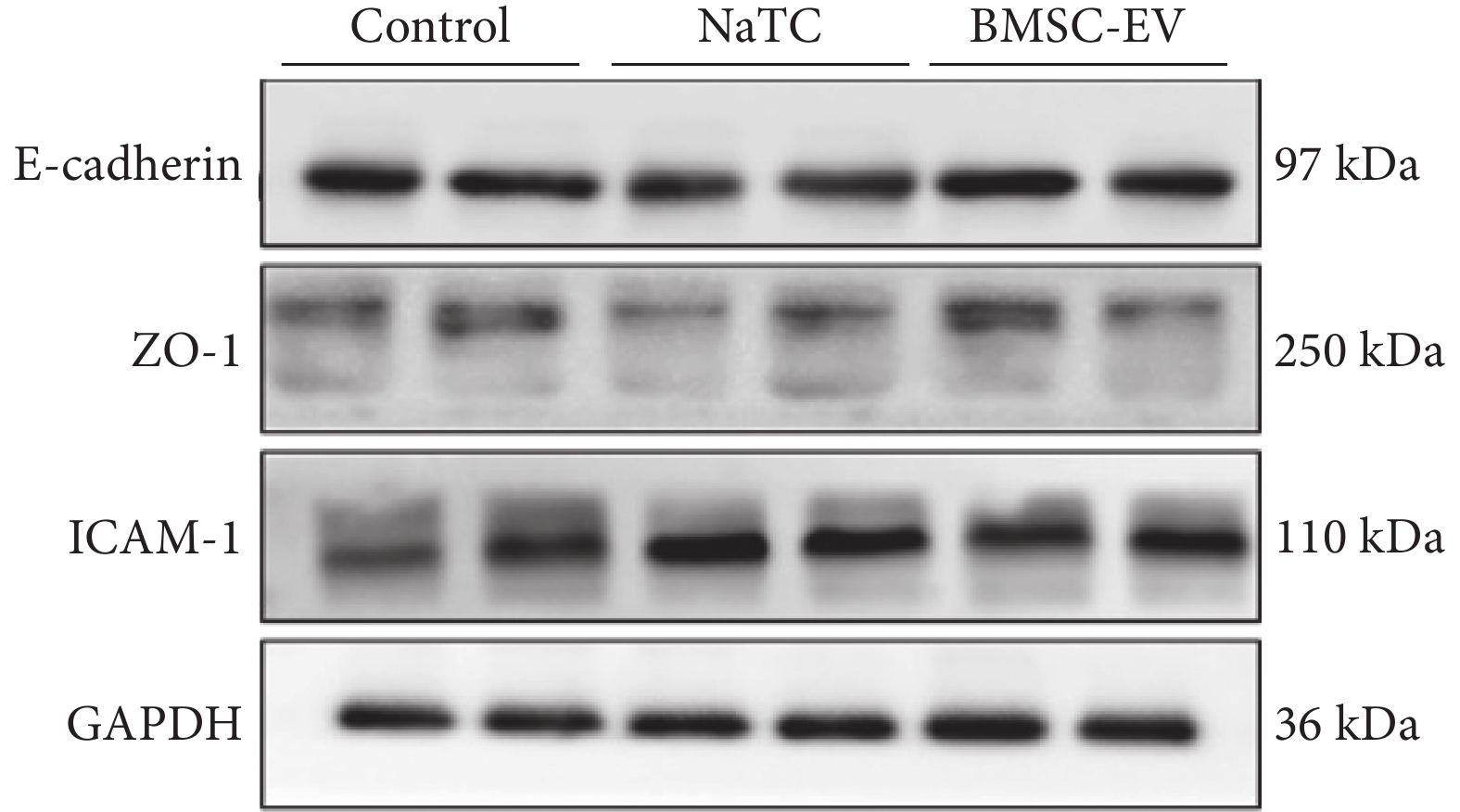 圖8
PMVEC 在不同刺激下 E-cadherin、ZO-1、ICAM-1 蛋白的表達(重復 2 次,n=4)
圖8
PMVEC 在不同刺激下 E-cadherin、ZO-1、ICAM-1 蛋白的表達(重復 2 次,n=4)
以 GAPDH 蛋白作為參照。PMVEC:小鼠肺微血管內皮細胞;E-cadherin:鈣黏蛋白 E;ZO-1:緊密連接蛋白;ICAM-1:細胞間黏附分子;GAPDH:抗甘油醛-3-磷酸脫氫酶;Control:對照;NaTC:牛磺膽酸鈉;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
3 討論
MSC 及其衍生的 EV 因其再生和免疫調節能力引起了廣泛關注,本研究發現小鼠 BMSC 具有成骨、成脂、成軟骨分化的三系分化的潛能,其分泌的 EV(BMSC-EV)經過鑒定,具有典型的杯狀形態、粒徑大小以及蛋白表達。為了探索 BMSC-EV 是否具有母細胞 BMSC 一樣的免疫調節能力,將其靜脈注射到 SAP 小鼠體內,結果發現 BMSC-EV 不僅降低了 SAP 小鼠胰腺血清淀粉酶、脂肪酶水平,改善 SAP 小鼠胰腺組織損傷,還下調了 SAP 小鼠血清中促炎因子 IL-6、TNF-α的水平和上調抗炎因子 IL-10 的水平,說明 BMSC-EV 可以改善 SAP 小鼠胰腺組織損傷和外周血循環炎癥環境。
ALI 是 SAP 最常見的并發癥[16],ALI 導致的低氧合會進一步誘發和加重其他器官損傷,是 SAP 患者早期死亡的主要原因[17]。BMSC-EV 在外源性病因(如細菌感染)誘導的 ALI 動物模型中表現出修復肺血管內皮屏障、改善內皮細胞通透性、減輕肺部炎癥等方面的治療潛力[9, 13]。但其在以肺血管內皮細胞損傷為起始事件的 SAP 相關 ALI 中的作用尚不清楚。因此,本研究進一步探索了 BMSC-EV 對 SAP 小鼠肺組織的影響。SAP 小鼠造模后出現了明顯肺組織病理損傷,但 BMSC-EV 改善了 SAP 小鼠肺組織損傷,并抑制了巨噬細胞(CD68 蛋白標記)和中性粒細胞(MPO 標記)浸潤。不同于外源性因素導致的 ALI,例如新型冠狀病毒,最先侵襲肺上皮細胞,進行大量病毒的復制和細胞器重構,激活上皮細胞抗病毒的免疫應答,間接誘導鄰近 PMVEC 的損傷,最終造成肺泡-毛細血管屏障功能受損[18]。SAP 相關 ALI 中內源性炎性介質誘發的 PMVEC 損傷被發現是最早發生的細胞事件[19]。本研究發現 SAP 小鼠血清 TNF-α促炎因子可以通過降低 E-cadherin 和 ZO-1 增加肺微血管內皮屏障的通透性[20],然后吸引炎癥細胞(如中性粒細胞和單核巨噬細胞)等物質則通過內皮屏障上的裂縫和通道進入肺泡腔,同時上調 ICAM-1 吸引更多炎癥細胞的浸潤[21],最終放大炎癥反應和促進 ALI 的發展。而 BMSC-EV 不僅上調了 SAP 小鼠肺組織中的 E-cadherin 和 ZO-1 蛋白,和下調 ICAM-1 蛋白,盡管相比假手術組,BMSC-EV 組小鼠肺組織 E-cadherin 和 ZO-1 蛋白的表達仍處于較高水平,但仍可推斷 BMSC-EV 可能是通過調節肺內皮細胞屏障、抑制炎細胞浸潤,進而改善 SAP 小鼠肺部炎癥。
為了驗證這一猜想,小鼠原代 PMVEC 被選用并進行體外驗證,1 mmol/L NaTC 干預作為模型組,模擬 SAP 小鼠肺組織損傷,NaTC 組 PMVEC 細胞間出現明顯的縫隙,細胞核輕微壞死,細胞器腫脹,炎癥因子 TNF-α、IL-6 水平升高;而 BMSC-EV 不僅下調了 NaTC 組 PMVEC 炎癥因子水平,還恢復了 PMVEC 細胞間緊密連接,且上調 PMVEC 的 E-cadherin、 ZO-1 和下調 ICAM-1,其 TNF-α、E-cadherin、ZO-1、ICAM-1 表達水平與對照組比較差異均無統計學意義(P>0.05),再次說明 BMSC-EV 可以改善肺微血管內皮屏障功能,抑制炎細胞浸潤,進而改善 NaTC 誘導的肺部炎癥。
綜上,小鼠骨髓來源 BMSC 衍生的 EV 可以減輕 SAP 炎癥之源——胰腺的炎癥和組織損傷,還能改善遠端器官肺組織的炎癥損傷,其機制可能是通過上調 PMVEC 的 E-cadherin、ZO-1 和下調 ICAM-1 的表達,恢復 PMVEC 內皮屏障功能以抑制炎癥因子和炎細胞肺遷移,進而減輕 SAP 小鼠肺組織炎癥,為臨床防治 SAP 相關 ALI 提供新的藥物選擇。
利益沖突:所有作者聲明不存在利益沖突。
急性胰腺炎是胰腺組織發生炎癥反應,以水腫、炎細胞浸潤、壞死、出血為特征,病情復雜,病程多變[1]。其中約有 20%的患者會發展為重癥急性胰腺炎(severe acute pancreatitis, SAP),其特點是伴有單個或多個器官功能衰竭,病死率高達 20%且預后不良[2]。急性肺損傷(acute lung injury, ALI)是 SAP 最首要的并發癥,也是 SAP 早期死亡的主要原因,SAP 合并 ALI 約占患者病死率的 70%[3-4]。盡管臨床上針對 ALI 及其伴隨的急性呼吸窘迫綜合征的支持性治療等方面取得了重大進展[5],例如限制性液體復蘇等[6],但患者的病死率仍高達 38%~46%[7]。因此,探索防治 SAP 相關 ALI 的有效手段仍是降低 SAP 病死率、改善預后亟待解決的問題。
間充質干細胞是一類具有自我更新及免疫調節功能的成體干細胞,其已被報道通過多種機制,如減少肺泡上皮和內皮細胞的通透性、改善肺泡液體清除、增強巨噬細胞吞噬能力等等,進而修復受損的肺組織[8]。并且越來越多證據表明間充質干細胞的治療作用主要依賴于旁分泌機制,如細胞因子和細胞外囊泡(extracellular vesicle, EV)等。EV 可以通過攜帶生物活性物質如信蛋白質、脂質等轉移到靶細胞,調節靶細胞行為并減輕炎癥反應[9-11]。同時骨髓來源的間充質干細胞即骨髓間充質干細胞(bone marrow mesenchymal stem cell, BMSC)分泌的 EV(BMSC derived EV, BMSC-EV)還避免了干細胞治療帶來的腫瘤風險,因而成為替代間充質干細胞的新型治療手段[12]。然而 BMSC-EV 對 SAP 及其肺組織損傷的效應少有報道。因此,本研究關注了 BMSC-EV 對 SAP 小鼠胰腺以及肺組織炎癥的效應,以幫助找到治療 SAP 相關 ALI 的有效治療手段。
1 材料與方法
1.1 實驗動物與材料
1.1.1 實驗動物
于四川大學動物中心購買 24 只 25 g 左右無特定病原體級雄性 C57BL/6 小鼠[生產許可證號:SCXK(川)2018-026,使用許可證號:001162068]。所有動物實驗均符合美國國家科學院發布的《實驗動物護理和使用指南》,該指南由美國國立衛生研究院出版。小鼠飼養于四川大學華西醫院科研院區動物中心,環境清潔,溫度恒定,為(22±2)℃,相對濕度 40%~70%,飼養環境晝夜規律,通風換氣良好,無菌水和飼料正常供應。本實驗經四川大學華西醫院實驗動物倫理委員會批準(2020233A)。
1.1.2 細胞及試劑
小鼠原代肺微血管內皮細胞(pulmonary microvascular endothelial cell, PMVEC)購買于湖南豐暉生物科技有限公司,牛磺膽酸鈉(sodium taurocholate, NaTC)[西格瑪奧德里奇(上海)貿易有限公司,編號 T4009],異氟烷(深圳市瑞沃德生命科技股份有限公司,型號 510-22),低濃度葡萄糖、含 L-谷氨酰胺和甲醛酸鈉的低糖培養基、胎牛血清、青霉素和鏈霉素購自于美國賽默飛世爾科技公司,成骨誘導培養基(貨號 CTCC-Y001)、成脂誘導培養基 A 液和 B 液(貨號 CTCC-Y003)、軟骨誘導培養基(貨號 CTCC-Y002)來自無錫菩禾生物醫藥技術有限公司公司。抗鈣黏蛋白 E(E-cadherin)(貨號 ab197751)單克隆抗體、抗緊密連接蛋白 ZO-1(貨號 ab216880)單克隆抗體、抗細胞間黏附分子(intercellular cell adhesion molecule-1, ICAM-1)(貨號 ab222736)單克隆抗體、抗甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)(貨號 ab8245)單克隆抗體、抗髓過氧化物酶(myeloperoxidase, MPO)(貨號 ab208670)單克隆抗體、抗 CD68(貨號 ab303565)單克隆抗體來自英國 Abcam 公司。二辛可寧酸(bicinchoninic acid, BCA)蛋白定量試劑盒購買于上海碧云天生物技術股份有限公司,小鼠轉化生長因子β(transforming growth factor β, TGF-β)(貨號 EK981-01)酶聯免疫吸附試驗(enzyme linked immunosorbent assay, ELISA)試劑盒購自杭州聯科生物技術有限公司,小鼠白細胞介素(interleukin, IL)-6(貨號 GEM0001)、IL-10(貨號 GEM0003)、腫瘤壞死因子-α(tumor necrosis factor α, TNF-α)(貨號 GEM0004)ELISA 試劑盒來自于武漢賽維爾生物有限公司。 Epon 812 包埋劑購買于北京新興百瑞技術有限公司。
1.1.3 儀器設備
賽默飛離心機(美國賽默飛世爾科技公司),投射電鏡(日本電子株式會社 JEOL 公司,型號 JEM-
1.2 研究方法
1.2.1 BMSC 提取、培養和鑒定
選擇 2 周大小 C57BL/6 小鼠,頸椎脫臼法處死。采用75%乙醇浸泡 5 min,無菌條件下取小鼠雙側股骨、脛骨,無菌剪鈍性剝離肌肉,將分離干凈的股骨、脛骨放入磷酸鹽緩沖液中清洗 2 次后放進預冷的低濃度葡萄糖、含 L-谷氨酰胺和甲醛酸鈉的低糖培養基中;將骨組織置于研缽,加入少許上述培養基進行研磨,研磨杵輕輕按壓破壞骨髓腔,使骨髓細胞流出,直到骨髓腔變白,研磨液經 70 μm 濾器過濾,過濾所得的濾液經
BMSC 成骨分化鑒定:按照密度為 5×103 個/cm2 接種在含蓋玻片 6 孔板中,待細胞融合到 60%~70%,開始誘導,加入成骨誘導培養基,每隔 3 d 更換新鮮的成骨誘導培養基,誘導 2 周后,茜素紅染色鑒定其分化的成骨細胞。
BMSC 成脂分化鑒定:按照密度為 5×104 個/cm2 接種在含蓋玻片 6 孔板中,待細胞融合到接近 100%,開始誘導,棄去培養基,加入成脂誘導培養基 A 液,誘導 48 h 后吸棄 A 液,換成成脂誘導培養基 B 液,再誘導 24 h,吸棄 B 液,換成 A 液繼續誘導,A、B 液交替作用 3~5 次后,繼續用 B 液維持培養直到細胞內油脂足夠大,然后使用油紅染色鑒定。
BMSC 成軟骨分化鑒定:按照密度 5×105 個/mL 用軟骨誘導培養基重懸 BMSC 細胞,吸取 0.5 mL 細胞懸液轉移到 15 mL 離心管中,
1.2.2 BMSC-EV 提取及鑒定
當第 4 代 BMSC 生長密度在 70%~80%,換用無血清的 DMEM-LG 培養基繼續培養細胞 24~48 h,然后收集細胞上清液,700×g 離心轉速,離心半徑為 144 mm,4℃ 離心 10 min,小心吸取上清液,2 000×g 離心轉速,離心半徑為 144 mm,4℃ 再次離心 15 min,確保去除細胞或細胞碎片,收集上清液,15 000×g 離心轉速,離心半徑為 109.7 mm,4℃ 離心 30 min,收集上清液用 0.22 μm 濾網過濾較大的懸浮顆粒,收集上清液于超高速離心機離心 120 000×g 離心轉速,離心半徑為 152.5 mm,4℃ 離心 70 min 收集 BMSC-EV 沉淀。
BMSC-EV 透射電鏡鑒定:在新鮮提取的 BMSC-EV 中,取出 10 μL 直接滴在銅網上沉淀 1 min,濾紙吸去浮液;然后將醋酸雙氧鈾銅滴加在銅網上沉淀 1 min,常溫干燥數分鐘,在加速電壓為 8、12 kV 的時候,置于透射電鏡樣品臺進行電鏡檢測成像。
BMSC-EV 納米直徑鑒定:將 BMSC-EV 混懸液按照 1∶1 000、1∶2 000、1∶5 000、1∶10 000 等不同倍數進行稀釋;先用標準品進行納米顆粒跟蹤分析儀性能測試合格后方可進行外泌體樣品上樣。待樣本完成檢測即可獲得儀器檢測外泌體的粒徑和濃度信息。
BMSC-EV 蛋白質印跡鑒定:用蛋白裂解液冰上裂解 BMSC-EV 樣本,然后用 BCA 法檢測蛋白濃度,確定蛋白上樣量,再用常規蛋白質印跡方法對 BMSC-EV 表面蛋白抗原(陽性抗原:CD63 和 TSG101,陰性抗原:Calnexin)進行定性定量檢測。
1.2.3 PMVEC 透射電鏡觀察及分組
用胰蛋白酶消化 PMVEC,收集細胞沉淀,先用 0.5%戊二醛溶液固定細胞 10 min,然后 1 200 r/min 離心 10 min,用 3%戊二醛溶液固定細胞沉淀(勿吹散)。這些樣品在 1%四氧化鋨中后固定,在系列丙酮中脫水,在 Epon 812 包埋劑中浸潤 12 h 以上,然后包埋。半薄切片用亞甲藍染色,超薄切片用金剛石刀切割,用乙酸鈾酰和檸檬酸鉛染色。切片用 JEM-
為了驗證 BMSC-EV 改善 SAP 小鼠肺屏障功能的效應,根據本課題組的前期研究基礎和已發表文獻[4, 13-14],本研究特選用 NaTC 刺激小鼠 PMVEC 作為模型組(NaTC 組),20 μg/mL BMSC-EV 體外治療 NaTC 干預的 1.5×106 個 PMVEC 作為治療組(BMSC-EV 組),相同體積的培養基刺激 PMBEC 作為對照組。
1.2.4 SAP 小鼠模型的建立及分組
將 24 只小鼠按照體重大小從 1~24 編號,然后根據隨機數字表法,確定隨機數字,除以 11,取余數,余數為 0 的分為假手術組,余數為 1 的分為 SAP 組,余數為 2 的分為 SAP 小鼠 BMSC-EV 治療組(BMSC 組),每組 8 只。
將需要造模的 SAP 和 BMSC 組小鼠,一共 16 只小鼠,用 2%的異氟烷吸入麻醉,然后仰臥位固定,行中線剖腹術,找到胰腺和十二指腸乳頭,在十二指腸對系膜緣用 24G 靜脈留置針箭頭造成穿刺傷,順著十二指腸穿進胰膽管,然后用微型血管夾夾住胰膽管靠近肝門處。參考 Perides 等[15]的操作步驟,通過靜脈留置針以 0.06 mL/h 速率微量泵泵入 2%的牛磺膽酸鈉 4 min,待牛磺膽酸鈉通過輸液管注入胰腺后靜置 1 min,然后取下導管、血管夾,用 7-0 縫合線縫合十二指腸穿刺傷,最后關腹縫合,皮下注射約 0.8 mL 生理鹽水,防止脫水。待小鼠復溫后放入籠子里。
根據課題組前期研究基礎和已發表文獻[4, 13-14],BMSC 組選擇在造模前 1 h 由尾靜脈注射 10 μL 含有 100 μg 的 BMSC-EV,觀察其對 SAP 小鼠胰腺組織的影響。造模 24 h 后取 3 組小鼠的血清和胰腺、肺組織。24 h 后,假手術組存活 8 只,死亡率為 0%;SAP 組小鼠存活 6 只,死亡率為 25%,BMSC 組存活 7 只,死亡率為 12.5%。
1.2.5 組織病理學分析
每組存活的小鼠取 6 例適量大小的胰腺和左上葉肺組織用 4%多聚甲醛固定后,將組織包埋在石蠟中并制成切片(5 μm 厚)。首先使用二甲苯進行組織切片脫蠟處理,然后放置在不同濃度梯度的乙醇(高濃度到低濃度)中洗去二甲苯;蘇木精染色 5 min,鹽酸乙醇進行分色后,5%伊紅液染色 2~3 min;接著用不同濃度梯度乙醇(低濃度到高濃度)進行組織脫水處理,二甲苯使之透明;最后滴上中性樹膠,蓋上蓋玻片封固。胰腺組織和肺組織損傷程度分別從以下內容進行評估:① 胰腺組織:小葉間水腫、炎細胞浸潤以及浸潤的數量、出血點/灶及其數量、胰管或者胰腺實質壞死面積和數量;② 肺組織:間質和肺泡內水腫、出血、炎細胞浸潤和肺泡壁纖維化情況。每個項目用 5 分制評分如下:0 分為最小損害,損傷面積<20%、1 分為輕度損害,損傷面積在 20%~40%、2 分為中度損害,損傷面積在 40%~60%;3 分為嚴重損害,損傷面積在 60%~80%;4 分為最大損害,損傷面積在 80%~100%。每個方面的病理評分分數的總和是胰腺和肺組織的病理學分數。
1.2.6 淀粉酶、脂肪酶和炎癥因子的測定
因 SAP 組和 BMSC 組小鼠死亡率原因,取各組小鼠 5 例血清樣本,每例大約 100 μL 血清,送至成都華西海圻醫藥科技有限公司進行自動化檢測淀粉酶和脂肪酶。
因各組小鼠肺組織要做組織病理、免疫組織化學、炎癥因子檢測和蛋白印跡測定,數量有限,故取每組小鼠 4 例肺組織做 TGF-β炎癥因子檢測,每組 5 例小鼠肺組織做 IL-6 炎癥因子檢測,小鼠左下葉肺組織按照組織重量和稀釋緩沖液體積 1∶9 的比例加入稀釋緩沖液進行研磨,然后收集組織研磨液上清液。取各組小鼠 6 例 100 μL 血清樣本直接檢測;PMVEC 細胞炎癥因子檢測,直接收集其干預后的細胞上清液進行檢測,每組選取6例細胞上清液。根據小鼠 TGF-β、IL-6、IL-10、TNF-α ELISA 試劑盒的操作手冊制備測試樣品。步驟為:在每個檢測孔中加入 100 μL 標準品或樣品,37℃下孵育 2 h;吸取并依次加入 100 μL 試劑盒里已經制備好的檢測試劑 A 和試劑 B 到每個檢測孔中,37℃孵育 1 h,然后吸棄液體并洗滌 5 次;向每個孔中加入 90 μL 底物溶液,37℃避光孵育 15~25 min,并向每個孔中加入 50 μL 終止液;最后運行酶標儀,立即在 450 nm 處進行讀數。
1.2.7 肺組織免疫組織化學
每組取 6 例小鼠左上葉肺組織 5 μm 的病理切片,使用二甲苯進行脫蠟,并在不同濃度的乙醇中再水合。在室溫下,3%過氧化氫淬滅內源性過氧化物酶活性 30 min,然后在磷酸鹽緩沖液中沖洗。在 10 mmol/L 檸檬酸鹽緩沖液(pH 值為 6.0)中于 94℃ 下回收抗原,10 min 后,將切片與封閉液在室溫下孵育 1 h,以封閉非特異性位點。然后將切片與 MPO(抗體原液和抗體稀釋液按照 1∶200 比例稀釋)和 CD68(抗體原液和抗體稀釋液按照 1∶400 比例稀釋)的抗體在 4℃孵育過夜(約 12 h)。3 次洗滌后,將切片與適量的、能覆蓋切片的抗鼠或抗兔的二抗在室溫下孵育 30 min,然后與鏈霉親和素-辣根過氧化物酶試劑和二氨基聯苯胺底物孵育。最后將切片浸入去離子水中,用蘇木精復染,洗滌并密封。在倒置顯微鏡放大倍數為 20、40 倍下進行觀察。2 位閱片師按照每個片在顯微鏡下選取 10 個視野進行觀察,并用 Image J 軟件進行分析和測定光密度值。最終取每張片子光密度值的平均值進行統計分析。
1.2.8 蛋白質印跡測定
取各組 3 例小鼠右葉肺組織或每組 4 管 PMVEC 沉淀,加入適量含有磷酸酶抑制劑、蛋白酶抑制劑的放射免疫沉淀法裂解緩沖液,混勻;冰上裂解 30 min,配置 BCA 液測蛋白濃度和標準品;算出待測樣本蛋白濃度和每個樣本 20、40 μg 蛋白的上樣體積,然后選擇合適濃度的十二烷基硫酸鈉-聚丙烯酰胺電泳膠,將蛋白樣品以及蛋白質常規分子量標記(Marker,10~180 kDa)按順序加入到電泳膠上的孔內開始電泳,先濃縮(80 V、30 min),后分離(120 V、60 min);電泳完畢后,開始轉膜、封閉、過夜孵一抗(E-cadherin、ZO-1 和 ICAM-1)、洗膜、根據一抗說明書對應地孵育羊抗兔或羊抗鼠的二抗、曝光。
1.3 統計學方法
使用 GraphPad Prism 8.0.2 軟件進行數據分析。正態分布的計量資料采用均數±標準差表示,多組間比較采用單因素方差分析,組間兩兩比較使用 Dunnett-t 檢驗。計數資料采用頻數表示。雙側檢驗水準α=0.05。
2 結果
2.1 BMSC 和 BMSC-EV
經過誘導分化,BMSC 表現出明顯具有成骨、成脂、成軟骨分化的潛力(圖1)。于是提取第 4 代及以后代系的 BMSC 上清液中 EV,透射電鏡證實其具有典型“杯狀”形態(圖2a),納米流式檢測 BMSC-EV 直徑在 60~100 nm(圖2b)。蛋白質印跡測定結果顯示,相比 BMSC,BMSC-EV 表達陽性蛋白 TSG101 和 CD63,不表達陰性蛋白 calnexin(圖2c)。
 圖1
BMSC 分化鑒定像
圖1
BMSC 分化鑒定像
a. 明場;b. 成骨分化(茜素紅染色);c. 成脂分化(油紅染色);d. 成軟骨分化(甲苯胺藍染色)。BMSC:骨髓間充質干細胞
 圖2
BMSC-EV 鑒定
圖2
BMSC-EV 鑒定
a. BMSC-EV 在加速電壓為 8 kV 的透射電鏡圖片,標尺為 100 nm;b. 提取的 BMSC-EV 的粒徑大小,縱坐標代表顆粒數,橫坐標代表粒徑大小;c. BMSC 作為空白組,其他來源的 EV 作為對照組,BMSC-EV 的 TSG101、CD63 和 calnexin 蛋白質表達圖。BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡;BMSC:骨髓間充質干細胞;EV:細胞外囊泡
2.2 BMSC-EV 改善 SAP 小鼠胰腺組織炎癥
假手術組、SAP 組、BMSC-EV 組在小鼠胰腺組織病理評分[(1.0±0.6) vs.(4.5±1.0) vs.(2.5±1.0)分;F=21.350,P<0.001]、淀粉酶[(193.2±155.5) vs.(1 458.0±572.8) vs.(428.8±213.4)U/L;F=17.050,P<0.001]、脂肪酶[(82.0±15.7) vs. (861.7±70.5) vs.(698.3±82.1)U/L;F=254.600,P<0.001]、IL-6[(0.5±0.5) vs.(428.5±236.0) vs. (156.9±146.2)pg/mL;F=10.960,P<0.001]、TNF-α[(10.2±0.1) vs.(30.2±20.7) vs.(12.0±1.2)pg/mL;F=5.113,P=0.020]、IL-10[(21.6±5.2) vs.(27.7±6.2) vs.(163.7±152.5)pg/mL;F=4.981,P=0.022]比較,差異均有統計學意義。
組間兩兩比較,SAP 組較假手術組小鼠胰腺出現了出血、壞死、炎細胞浸潤等病理改變,且血淀粉酶、脂肪酶、IL-6、TNF-α均上調(P<0.05),而 IL-10 差異無統計學意義(P>0.05)。但 BMSC-EV 下調了 SAP 小鼠 IL-6(P<0.05)、TNF-α(P<0.05)水平,及上調了抗炎因子 IL-10(P<0.05)水平;也改善了 SAP 小鼠胰腺組織損傷,降低其病理評分(P<0.05),并下調 SAP 小鼠血清淀粉酶、脂肪酶(P<0.05)。BMSC-EV 組、假手術組在淀粉酶、IL-6、TNF-α比較,差異均無統計學意義(P>0.05),然而在胰腺組織病理評分、脂肪酶和 IL-10 表達等方面上仍處于上調水平(P<0.05)。小鼠胰腺組織病理彩色像見圖3。
 圖3
小鼠胰腺組織病理彩色像(蘇木精-伊紅染色)
圖3
小鼠胰腺組織病理彩色像(蘇木精-伊紅染色)
a. 假手術組;b. SAP 組;c. BMSC-EV 組。SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
2.3 BMSC-EV 改善 SAP 小鼠肺組織炎癥
假手術組、SAP 組、BMSC-EV 組在小鼠肺組織病理評分[(1.2±0.8) vs.(5.38±1.58) vs.(2.7±1.2)分;F=18.640,P<0.001]、CD68(巨噬細胞陽性染色)(3.7±2.1 vs. 11.6±2.9 vs. 6.5±2.5;F=14.780,P<0.001)、MPO(中性粒細胞陽性染色)(5.4±3.5 vs. 23.9±5.8 vs. 12.4±4.7;F=23.180,P<0.001)、TGF-β[(415.6±61.4) vs.(687.9±105.1) vs.(321.6±170.9)pg/mL;F=9.866,P<0.001]、IL-6[(11.9±1.6) vs.(498.1±188.5) vs.(201.4±84.8)pg/mL;F=21.170,P<0.001]、E-cadherin/GAPDH(0.8±0.2 vs. 0.2±0.1 vs. 0.4±0.2;F=29.120,P<0.001)、ZO-1/GAPDH(0.7±0.2 vs. 0.1±0.0 vs. 0.4±0.0;F=48.230,P<0.001)、ICAM-1/GAPDH(0.4±0.2 vs. 0.9±0.2 vs. 0.6±0.1;F=12.950,P<0.001)比較,差異均有統計學意義。
組間兩兩比較,SAP 組較假手術組小鼠肺組織間質和肺泡內水腫、出血、炎細胞浸潤,病理學評分升高,屏障蛋白 E-cadherin、ZO-1 蛋白下調,調控炎細胞黏附的 ICAM-1 蛋白上調,巨噬細胞(CD6 陽性標記)和中性粒細胞(MPO 陽性標記)浸潤數量高、TGF-β、IL-6 的水平上調(P<0.05);但 BMSC-EV 可改善 SAP 小鼠肺組織病理損傷,肺組織炎細胞浸潤數量減少、肺組織炎癥因子的水平降低,上調 E-cadherin、ZO-1 蛋白表達,抑制了 ICAM-1 蛋白水平(P<0.05)。BMSC-EV 組與假手術組在肺組織病理評分、CD68 陽性標記數量、MPO 陽性標記數量、TGF-β、IL-6、ICAM-1/GAPDH 蛋白表達比值比較,差異均無統計學意義(P>0.05),但在 BMSC-EV 可升高 E-cadherin/GAPDH 和 ZO-1/GAPDH 蛋白表達比值(P<0.05)。小鼠肺組織病理彩色像、小鼠肺組織 CD68 和 MPO 染色的典型組織化學彩色像、BMSC-EV 對 SAP 小鼠肺組織 E-cadherin、ZO-1、ICAM-1、GAPDH 蛋白水平見圖4~6。
 圖4
小鼠肺組織病理彩色像(蘇木精-伊紅染色)
圖4
小鼠肺組織病理彩色像(蘇木精-伊紅染色)
a. 假手術組;b. SAP 組;c. BMSC-EV 組。SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌細胞外囊泡
 圖5
3 組小鼠肺組織 CD68 和 MPO 染色的典型組織化學彩色像
圖5
3 組小鼠肺組織 CD68 和 MPO 染色的典型組織化學彩色像
a. CD68(巨噬細胞染色);b. MPO(中性粒細胞染色)。從左到右依次為假手術組、SAP 組、BMSC-EV 組。MPO:抗髓過氧化物酶;SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
 圖6
小鼠肺組織 E-cadherin、ZO-1、ICAM-1 蛋白的表達(n=3)
圖6
小鼠肺組織 E-cadherin、ZO-1、ICAM-1 蛋白的表達(n=3)
以 GAPDH 蛋白作為參照。E-cadherin:鈣黏蛋白 E;ZO-1:緊密連接蛋白;ICAM-1:細胞間黏附分子;GAPDH:抗甘油醛-3-磷酸脫氫酶;sham:假手術;SAP:重癥急性胰腺炎;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
2.4 BMSC-EV 恢復 PMVEC 間緊密連接減輕炎癥
PMVEC 在不同刺激下透射電鏡下圖像見圖7。可見,相比對照組,NaTC 誘導 PMVEC 細胞核輕微壞死,細胞器(線粒體、內質網)腫脹、細胞間緊密連接斷裂;而 BMSC-EV 抑制了 NaTC 誘導的 PMVEC 細胞壞死和細胞器腫脹,且還恢復了其緊密連接。
 圖7
PMVEC 在不同刺激下透射電鏡下圖像
圖7
PMVEC 在不同刺激下透射電鏡下圖像
PMVEC 經過培養基、NaTC、NaTC和 BMSC-EV 刺激后,在加速電壓為 8 kV 和 12 kV 的時候,透射電鏡下典型的細胞形態圖片,12 kV的圖像是將 8 kV 圖像中紅色虛線圈出來的位置進行放大;可見 NaTC 組 PMVEC 細胞核輕微壞死,線粒體和內質網輕微腫脹、細胞間緊密連接斷裂;而對照組和 BMSC-EV 組 PMVEC 細胞核和細胞器形態完整,細胞間緊密連接;紅色▲指向細胞間緊密連接處。PMVEC:小鼠肺微血管內皮細胞;Control:對照(培養基);NaTC:牛磺膽酸鈉;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
對照組、NaTC 組、BMSC-EV 組 PMVEC 炎癥因子 TNF-α[(12.8±4.2) vs.(31.6 ±9.0) vs. (12.2±5.59)pg/mL;F=17.040,P<0.001]、IL-6[(2.9±1.9) vs.(29.2 ±12.0) vs.(15.0±6.2)pg/mL;F=16.750,P<0.001]、E-cadherin/GAPDH(1.0 ±0.1 vs. 0.7±0.1 vs. 1.0±0.2;F=6.590,P<0.001)、ZO-1/GAPDH(0.2 ±0.0 vs. 0.1±0.0 vs. 0.2 ±0.0;F=9.717,P<0.001)、ICAM-1/GAPDH(0.7 ±0.2 vs. 1.1±0.1 vs. 0.9 ±0.1;F=16.840,P<0.001)比較,差異均有統計學意義。
組間兩兩比較,相比對照組,NaTC 組 TNF-α、IL-6、ICAM-1 蛋白水平上調,E-cadherin、ZO-1 蛋白下調(P<0.05);但 BMSC-EV 抑制了 TNF-α、IL-6 分泌和 ICAM-1 蛋白表達,上調了 E-cadherin、ZO-1(P<0.05)。BMSC-EV 組與對照組的 TNF-α、E-cadherin/GAPDH、ZO-1/GAPDH、ICAM-1/GAPDH 蛋白表達比值比較,差異均無統計學意義(P>0.05),但 BMSC-EV 可升高 IL-6(P<0.05)。PMVEC 細胞 E-cadherin、ZO-1、ICAM-1、GAPDH 蛋白水平見圖8。
 圖8
PMVEC 在不同刺激下 E-cadherin、ZO-1、ICAM-1 蛋白的表達(重復 2 次,n=4)
圖8
PMVEC 在不同刺激下 E-cadherin、ZO-1、ICAM-1 蛋白的表達(重復 2 次,n=4)
以 GAPDH 蛋白作為參照。PMVEC:小鼠肺微血管內皮細胞;E-cadherin:鈣黏蛋白 E;ZO-1:緊密連接蛋白;ICAM-1:細胞間黏附分子;GAPDH:抗甘油醛-3-磷酸脫氫酶;Control:對照;NaTC:牛磺膽酸鈉;BMSC-EV:骨髓間充質干細胞分泌的細胞外囊泡
3 討論
MSC 及其衍生的 EV 因其再生和免疫調節能力引起了廣泛關注,本研究發現小鼠 BMSC 具有成骨、成脂、成軟骨分化的三系分化的潛能,其分泌的 EV(BMSC-EV)經過鑒定,具有典型的杯狀形態、粒徑大小以及蛋白表達。為了探索 BMSC-EV 是否具有母細胞 BMSC 一樣的免疫調節能力,將其靜脈注射到 SAP 小鼠體內,結果發現 BMSC-EV 不僅降低了 SAP 小鼠胰腺血清淀粉酶、脂肪酶水平,改善 SAP 小鼠胰腺組織損傷,還下調了 SAP 小鼠血清中促炎因子 IL-6、TNF-α的水平和上調抗炎因子 IL-10 的水平,說明 BMSC-EV 可以改善 SAP 小鼠胰腺組織損傷和外周血循環炎癥環境。
ALI 是 SAP 最常見的并發癥[16],ALI 導致的低氧合會進一步誘發和加重其他器官損傷,是 SAP 患者早期死亡的主要原因[17]。BMSC-EV 在外源性病因(如細菌感染)誘導的 ALI 動物模型中表現出修復肺血管內皮屏障、改善內皮細胞通透性、減輕肺部炎癥等方面的治療潛力[9, 13]。但其在以肺血管內皮細胞損傷為起始事件的 SAP 相關 ALI 中的作用尚不清楚。因此,本研究進一步探索了 BMSC-EV 對 SAP 小鼠肺組織的影響。SAP 小鼠造模后出現了明顯肺組織病理損傷,但 BMSC-EV 改善了 SAP 小鼠肺組織損傷,并抑制了巨噬細胞(CD68 蛋白標記)和中性粒細胞(MPO 標記)浸潤。不同于外源性因素導致的 ALI,例如新型冠狀病毒,最先侵襲肺上皮細胞,進行大量病毒的復制和細胞器重構,激活上皮細胞抗病毒的免疫應答,間接誘導鄰近 PMVEC 的損傷,最終造成肺泡-毛細血管屏障功能受損[18]。SAP 相關 ALI 中內源性炎性介質誘發的 PMVEC 損傷被發現是最早發生的細胞事件[19]。本研究發現 SAP 小鼠血清 TNF-α促炎因子可以通過降低 E-cadherin 和 ZO-1 增加肺微血管內皮屏障的通透性[20],然后吸引炎癥細胞(如中性粒細胞和單核巨噬細胞)等物質則通過內皮屏障上的裂縫和通道進入肺泡腔,同時上調 ICAM-1 吸引更多炎癥細胞的浸潤[21],最終放大炎癥反應和促進 ALI 的發展。而 BMSC-EV 不僅上調了 SAP 小鼠肺組織中的 E-cadherin 和 ZO-1 蛋白,和下調 ICAM-1 蛋白,盡管相比假手術組,BMSC-EV 組小鼠肺組織 E-cadherin 和 ZO-1 蛋白的表達仍處于較高水平,但仍可推斷 BMSC-EV 可能是通過調節肺內皮細胞屏障、抑制炎細胞浸潤,進而改善 SAP 小鼠肺部炎癥。
為了驗證這一猜想,小鼠原代 PMVEC 被選用并進行體外驗證,1 mmol/L NaTC 干預作為模型組,模擬 SAP 小鼠肺組織損傷,NaTC 組 PMVEC 細胞間出現明顯的縫隙,細胞核輕微壞死,細胞器腫脹,炎癥因子 TNF-α、IL-6 水平升高;而 BMSC-EV 不僅下調了 NaTC 組 PMVEC 炎癥因子水平,還恢復了 PMVEC 細胞間緊密連接,且上調 PMVEC 的 E-cadherin、 ZO-1 和下調 ICAM-1,其 TNF-α、E-cadherin、ZO-1、ICAM-1 表達水平與對照組比較差異均無統計學意義(P>0.05),再次說明 BMSC-EV 可以改善肺微血管內皮屏障功能,抑制炎細胞浸潤,進而改善 NaTC 誘導的肺部炎癥。
綜上,小鼠骨髓來源 BMSC 衍生的 EV 可以減輕 SAP 炎癥之源——胰腺的炎癥和組織損傷,還能改善遠端器官肺組織的炎癥損傷,其機制可能是通過上調 PMVEC 的 E-cadherin、ZO-1 和下調 ICAM-1 的表達,恢復 PMVEC 內皮屏障功能以抑制炎癥因子和炎細胞肺遷移,進而減輕 SAP 小鼠肺組織炎癥,為臨床防治 SAP 相關 ALI 提供新的藥物選擇。
利益沖突:所有作者聲明不存在利益沖突。