引用本文: 羅科, 唐華民. 基于網絡藥理學與分子對接的大柴胡湯治療急性胰腺炎的潛在作用機制探討. 華西醫學, 2024, 39(11): 1728-1737. doi: 10.7507/1002-0179.202409008 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
急性胰腺炎是臨床常見的急腹癥之一,約 1/4 的患者會發展為重癥急性胰腺炎[1]。重癥急性胰腺炎并發癥多,病死率高(30%~40%)[2]。部分急性胰腺炎具有復發傾向,復發率為 10%~30%,嚴重危及我國民眾的生命健康[3]。在中醫學中雖無“急性胰腺炎”這一病名,但急性胰腺炎的臨床表現及體征描述與脾心痛、膈痛、胃脘痛、結胸、厥心痛等非常相似[4]。急性胰腺炎的病變部位主要涉及中醫的肝、膽、脾、胃,多合并陽明、少陽病變,以肝膽濕熱、腑實內結為主[5]。大柴胡湯的方藥組成為柴胡、黃芩、大黃、枳實、生姜、半夏、大棗、白芍,主要用于治療膽囊炎、膽結石、胰腺炎等疾病,其方證規律主癥表現為便秘、口苦、惡心嘔吐、胃脹痛、胸脅不適、腹脹痛、發熱、肩背痛等,舌脈象特征包括舌紅、苔黃膩、脈弦或脈數[6]。大柴胡湯的腹征表現為心下滿痛,提示部位多在胃脘附近[7]。現有研究表明,大柴胡湯在急性胰腺炎治療中具有多重作用機制,包括修復腸黏膜屏障、調控炎性因子及相關信號通路、減輕氧化應激損傷、降低胰腺腺泡細胞鈣離子超載以及調控細胞凋亡等[8]。通過這些機制,大柴胡湯能有效地減少炎癥反應、減輕組織損傷并改善胰腺功能。由于其多成分、多靶點的特點,傳統的單一成分或單一靶點研究難以全面揭示其作用機制。網絡藥理學的出現為中藥多組分與復雜疾病的研究提供了系統性和綜合性的工具。它能夠通過整合多成分、多靶點的信息,系統性地解析中藥的多維度效應,尤其適用于像大柴胡湯這樣的復雜中藥方劑[9]。由于大柴胡湯藥效成分復雜,其對急性胰腺炎治療作用的分子機制仍不清楚。本研究基于網絡藥理學、分子對接的方式揭示大柴胡湯治療急性胰腺炎的潛在作用靶點和相關分子機制,以期為進一步的實驗研究提供理論依據。
1 材料與方法
1.1 大柴胡湯活性成分和靶點的篩選
2024 年 3 月—5 月,將大柴胡湯的 8 味中藥(柴胡、黃芩、大黃、枳實、生姜、半夏、大棗、白芍)逐個輸入到中藥系統藥理學數據庫與分析平臺,檢索設置:口服生物利用度≥30%、類藥性≥0.18,獲取有效成分、對應靶點,然后將匯總的靶點導入 Uniprot 數據庫,獲得相應的基因符號。
1.2 急性胰腺炎靶點篩選
以“acute pancreatitis”為檢索詞,在 GeneCards 數據庫中檢索疾病靶點,將關聯度(relevance)<5 的排除。
1.3 交集后獲取共同靶點并作圖
使用在線工具 Venny2.1 取大柴胡湯靶點基因符號與急性胰腺炎靶點基因符號的交集并作圖。
1.4 構建活性成分-共同靶點圖,篩選核心成分
將與共同靶點有交集的活性成分導入 Cytoscape 3.9.1 軟件構建復方活性成分-靶點作用網絡圖,并根據度值排前 5 位確定核心成分。
1.5 構建蛋白互作(protein-protein interaction, PPI)網絡,篩選核心蛋白
將大柴胡湯靶點基因與急性胰腺炎靶點基因的交集篩選出的靶點輸入到 STRING 數據庫,設置“Homo sapiens”,最小互作閾值設為“highest confidence”(0.9),保存 PPI 網絡和 TSV 格式的數據文件,將此文件導入 Cytoscape 軟件,繪制 PPI 網絡圖,并根據度值排前 5 位確定核心蛋白。
1.6 富集分析
將共同靶點導入 Metascape 數據庫分別進行基因本體(gene ontology, GO)功能富集分析以及京都基因和基因組數據庫(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析,然后將數據結果導入 Python 3.8 軟件制作富集分析氣泡圖。
1.7 分子對接
將核心蛋白導入蛋白質數據庫(Protein Data Bank, PDB),保存三維結構的 PDB 格式文件。將核心成分導入 PubChem 數據庫下載二維結構的 mol2 格式文件。使用 PyMol 2.6 軟件刪除蛋白質結構的水分子和小分子配體,導入 AutoDockTools 1.5.6 軟件進行加氫等預處理,將核心成分和核心蛋白均轉換成 pdbqt 格式文件,運行 AutoDockTools 軟件對核心成分和核心蛋白分別進行對接,保存最低結合能數據作為分子對接的結果,利用 PyMol 2.6 軟件對最低結合能的組合進行可視化。若核心成分與核心靶點的結合能值在?5.0 kJ/mol 以下,則說明結合程度高且構象穩定,有較好的結合活性。
2 結果
2.1 大柴胡湯的成分及靶點
本研究收集了大柴胡湯的 151 種藥物活性成分,去重后得到 66 個有效成分(表1)。通過對
2.2 急性胰腺炎靶點
通過 GeneCards 數據庫篩選后最終獲得
2.3 交集圖
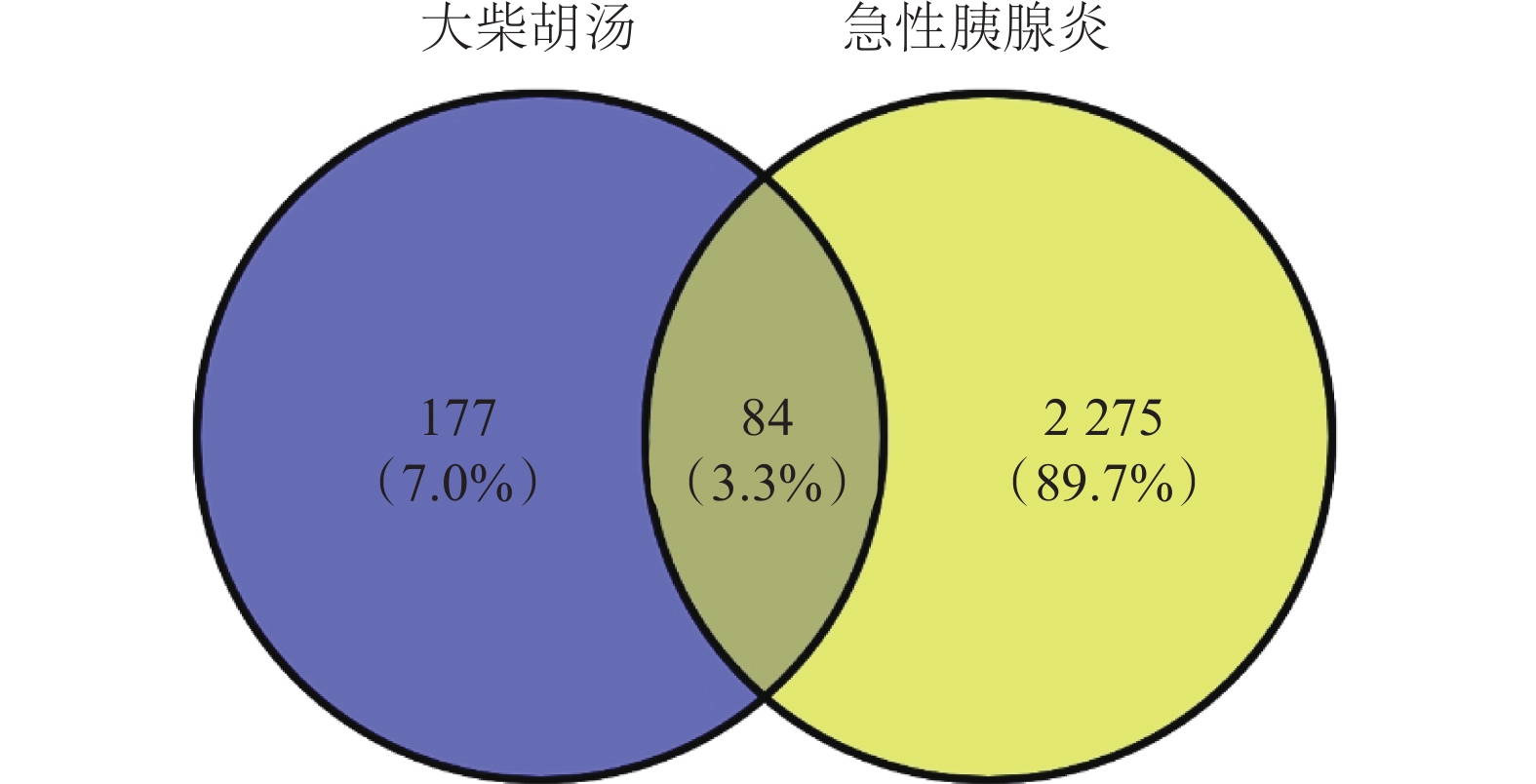
將大柴胡湯的 261 個有效成分靶點與急性胰腺炎的
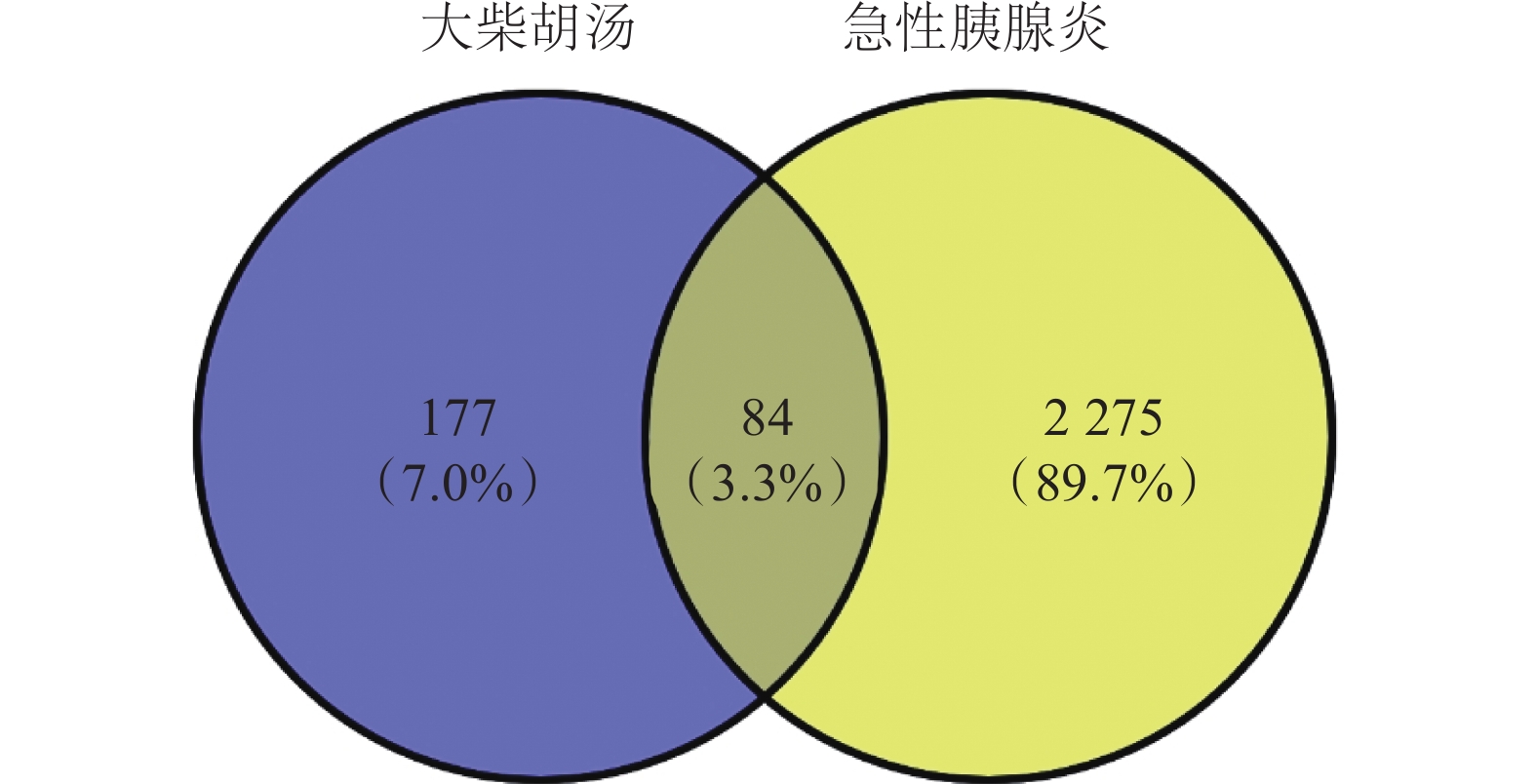 圖1
大柴胡湯與急性胰腺炎靶點交集圖
圖1
大柴胡湯與急性胰腺炎靶點交集圖
2.4 活性成分-共同靶點圖及核心成分分析
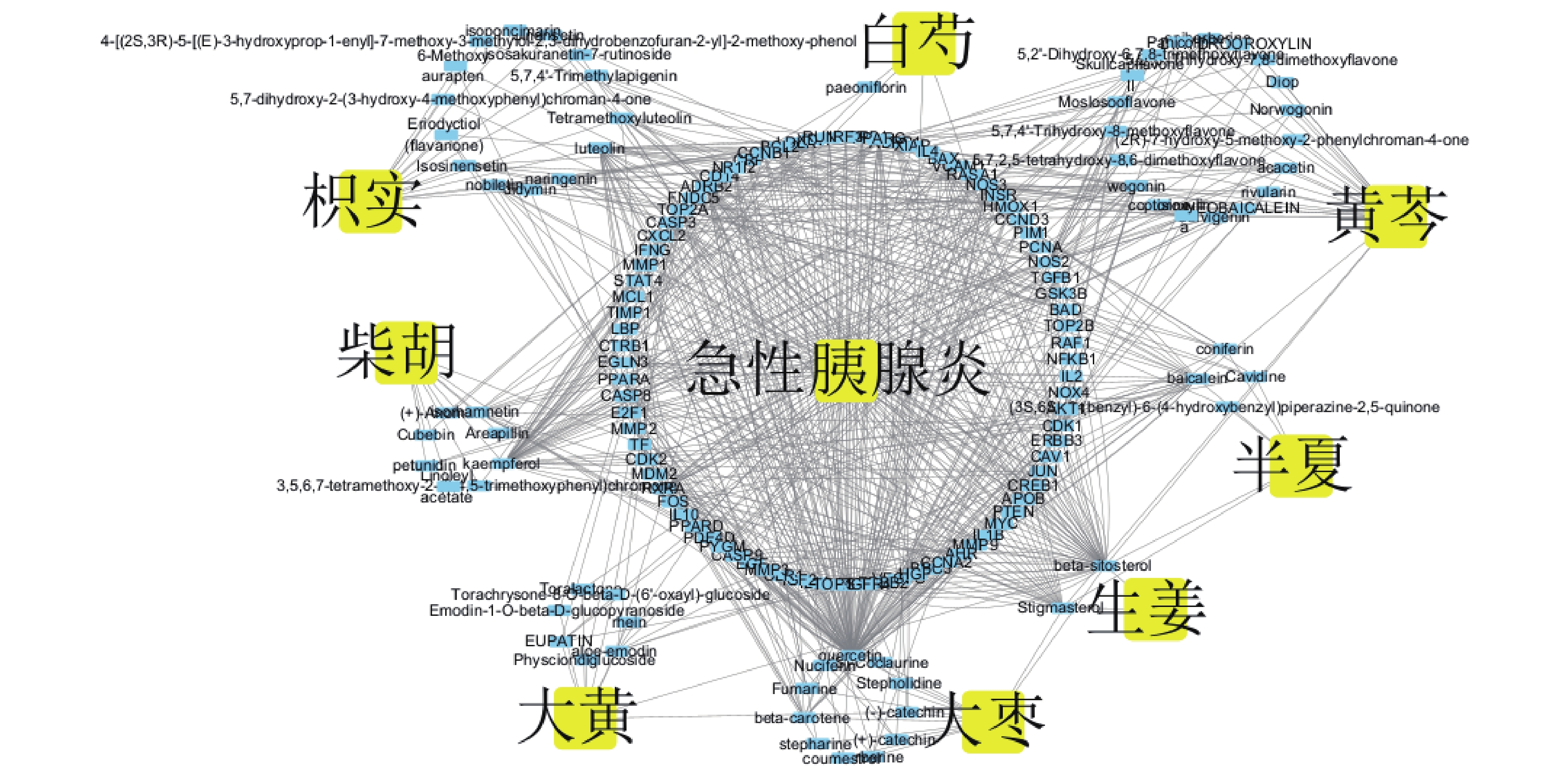
根據網絡分析,大柴胡湯核心成分度值排名前 5 位的分別為槲皮素(MOL000098,度值=118)、β-谷甾醇(MOL000358,度值=53)、山柰酚(MOL000422,度值=40)、木犀草素(MOL000006,度值=28)和黃芩素(MOL002714,度值=24)。這些成分與共同靶點的關聯性通過活性成分-靶點網絡圖呈現(圖2)。
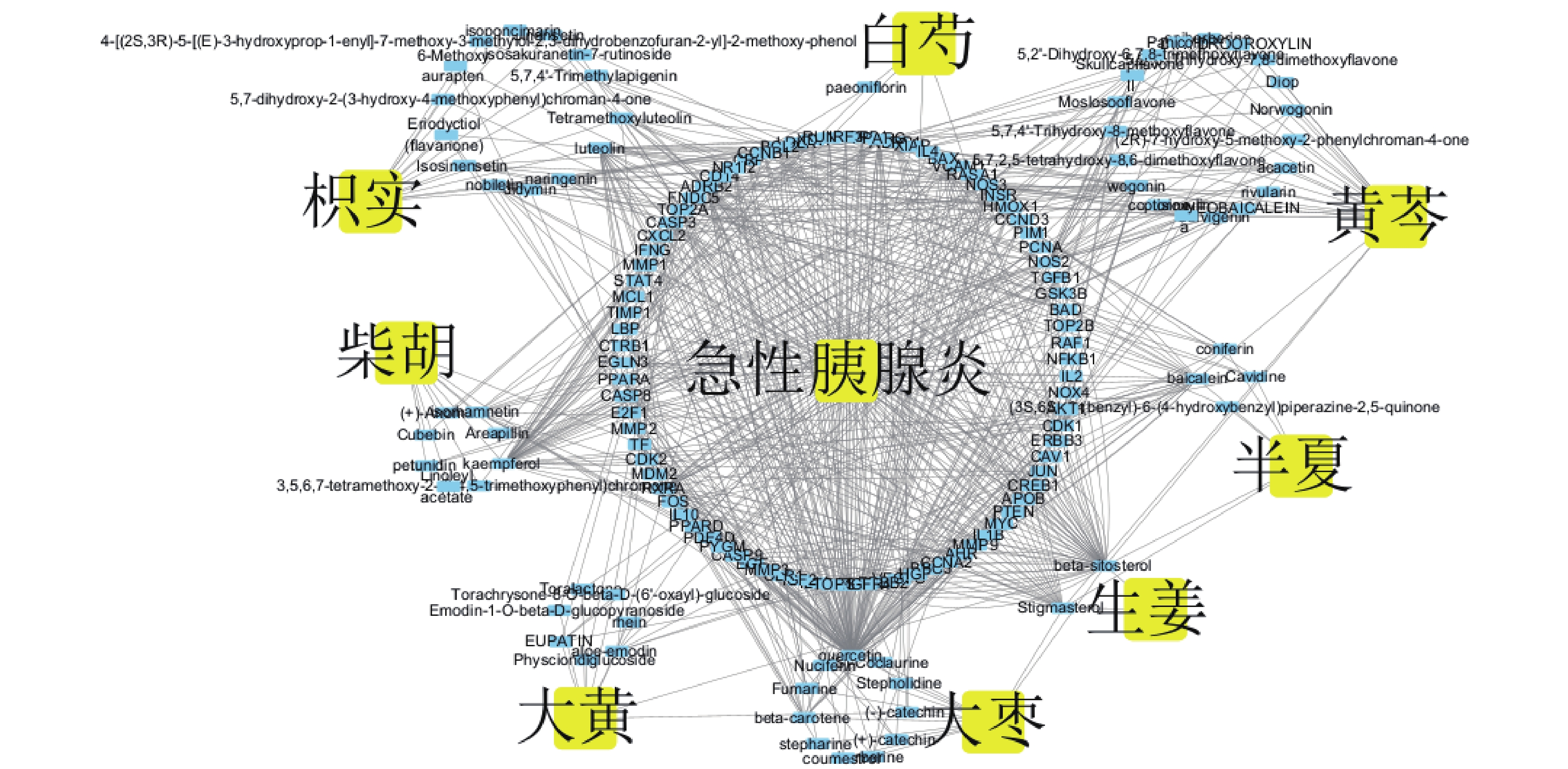 圖2
大柴胡湯核心成分與急性胰腺炎關聯性的活性成分-共同靶點網絡圖
圖2
大柴胡湯核心成分與急性胰腺炎關聯性的活性成分-共同靶點網絡圖
2.5 PPI 網絡及核心蛋白分析
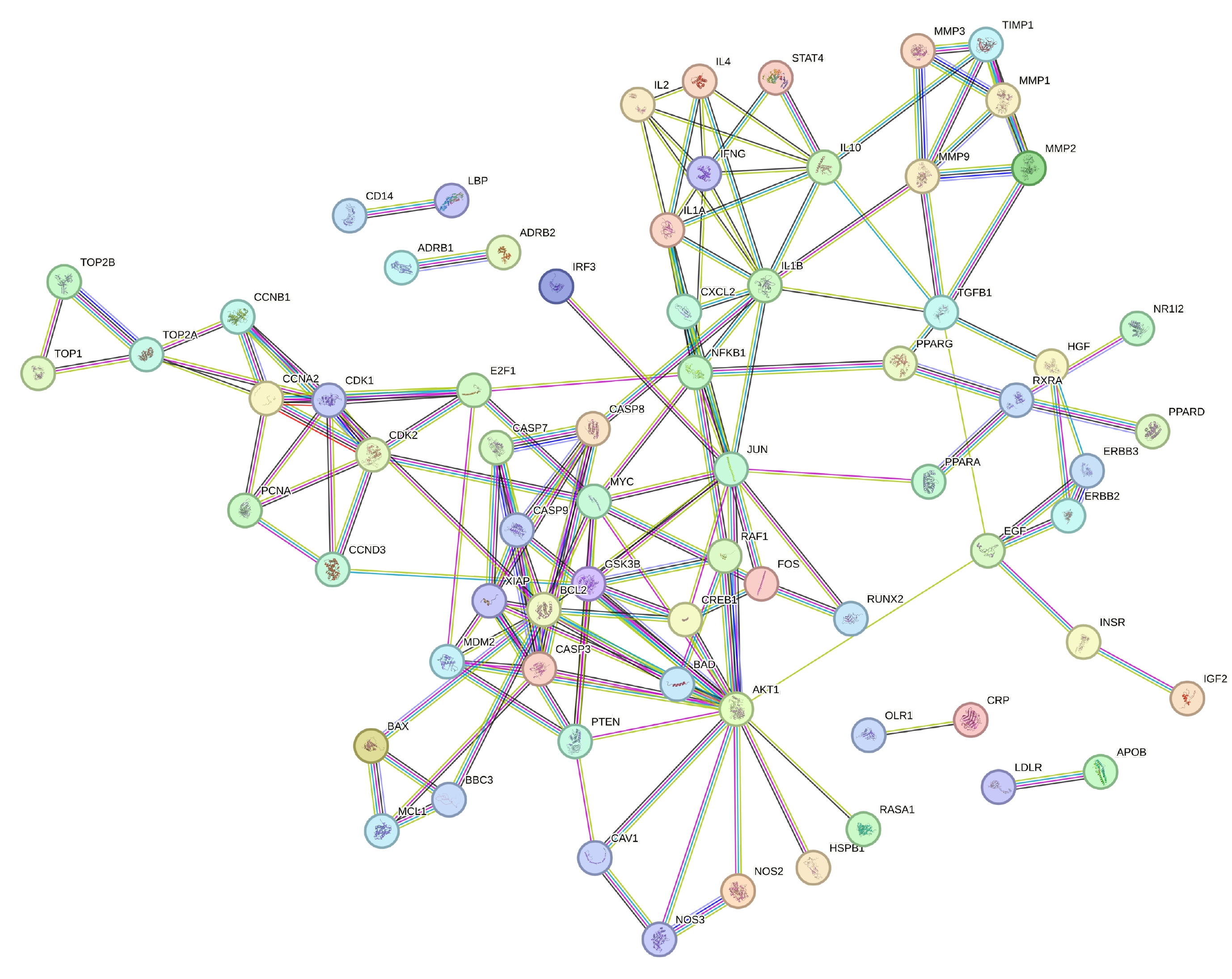
對 84 個共同靶點進行 PPI 分析后得到核心蛋白為 AKT1(度值=118)、B 細胞淋巴瘤蛋白 2(B-cell leukemia/lymphoma 2, BCL2)(度值=53)、Jun 原癌基因(Jun proto-oncogene, JUN)(度值=40)、白細胞介素 1β(interleukin 1 Beta, IL1B)(度值=28)、核因子 κB 亞基 1(nuclear factor kappa B subunit 1, NFKB1)(度值=24)。見圖3。
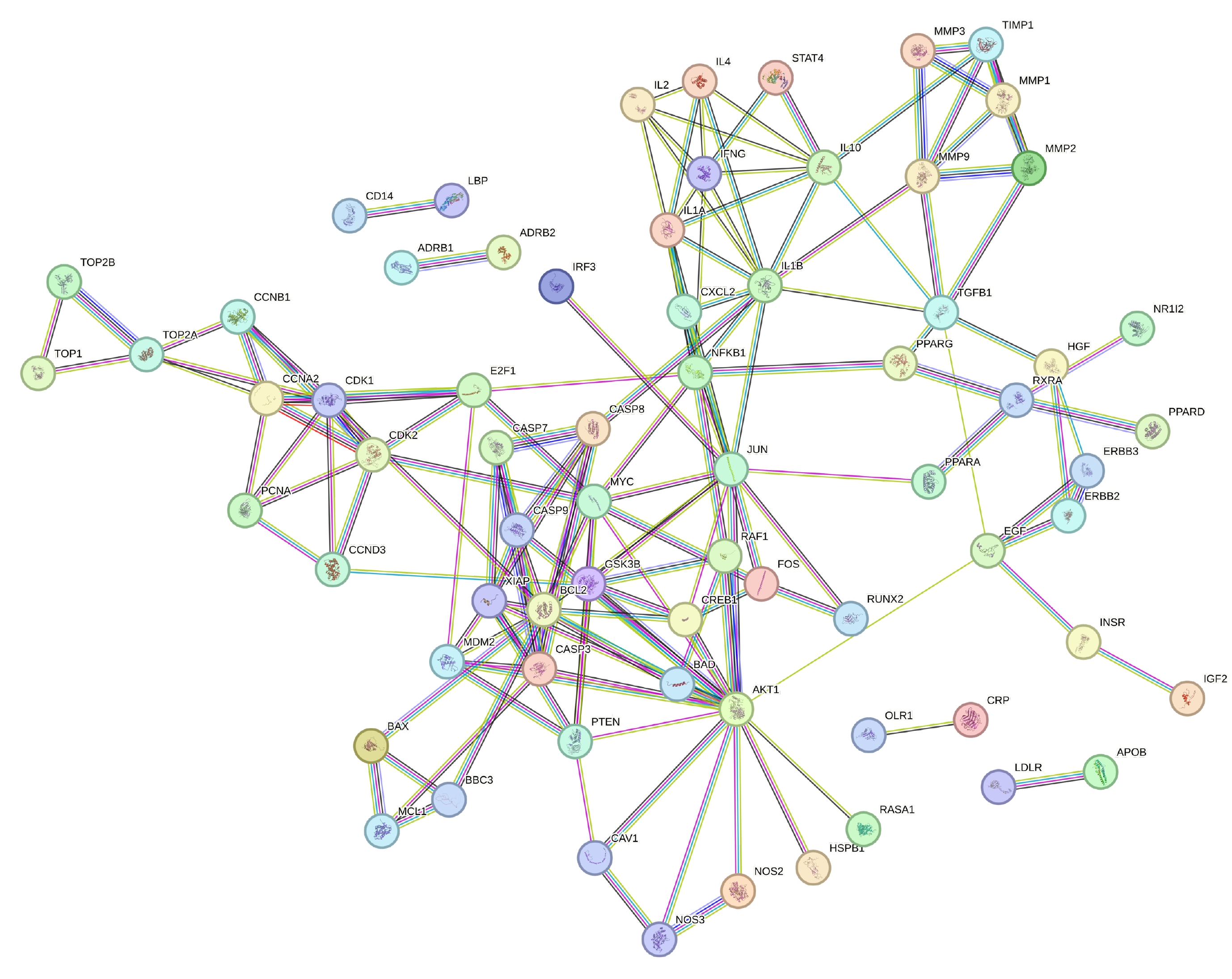 圖3
大柴胡湯與急性胰腺炎共同靶點的蛋白互作網絡圖
圖3
大柴胡湯與急性胰腺炎共同靶點的蛋白互作網絡圖
節點代表蛋白質,邊代表蛋白質間的相互作用,圖中包含 84 個節點和 157 條邊
2.6 GO 及 KEGG 通路的富集分析氣泡圖
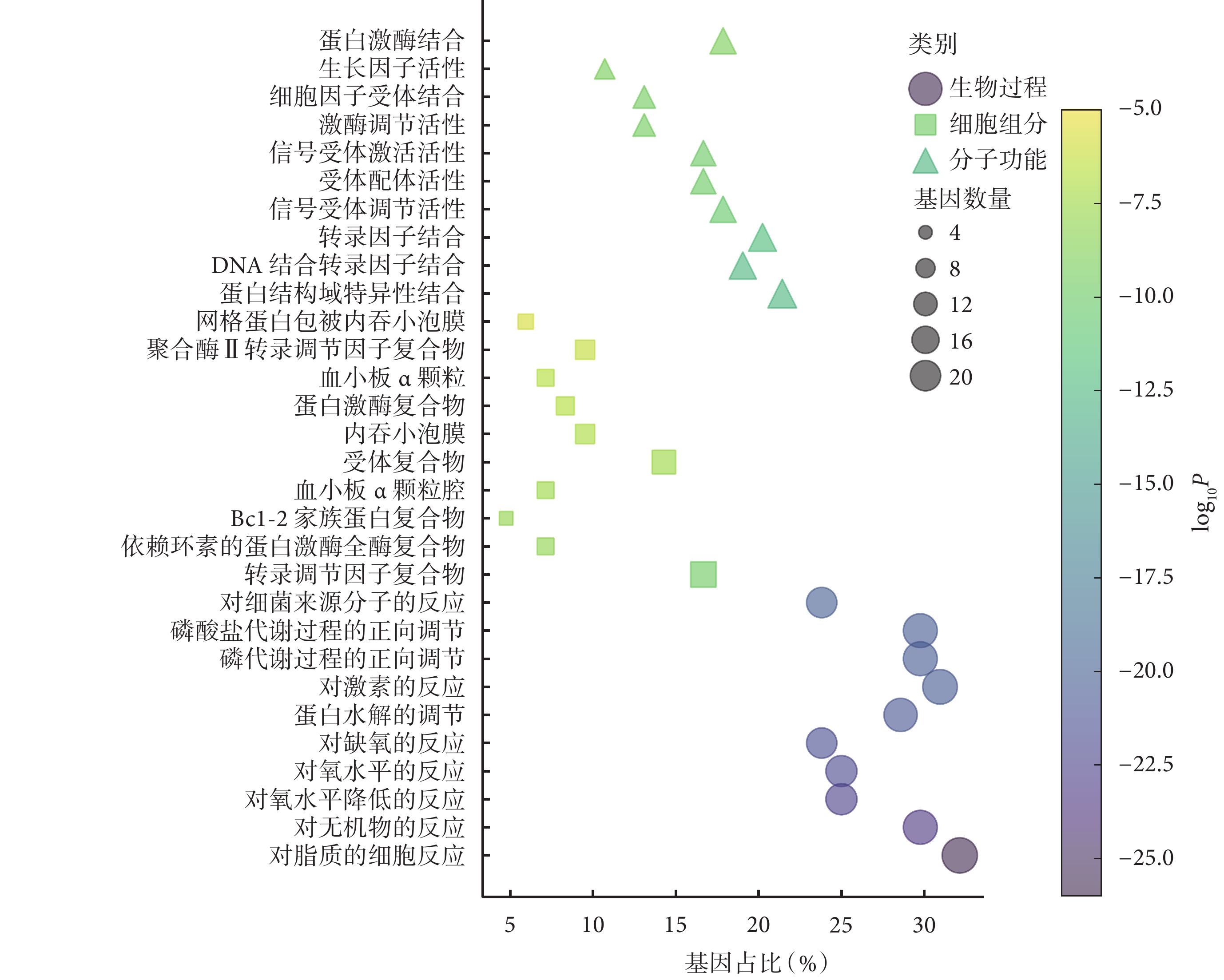
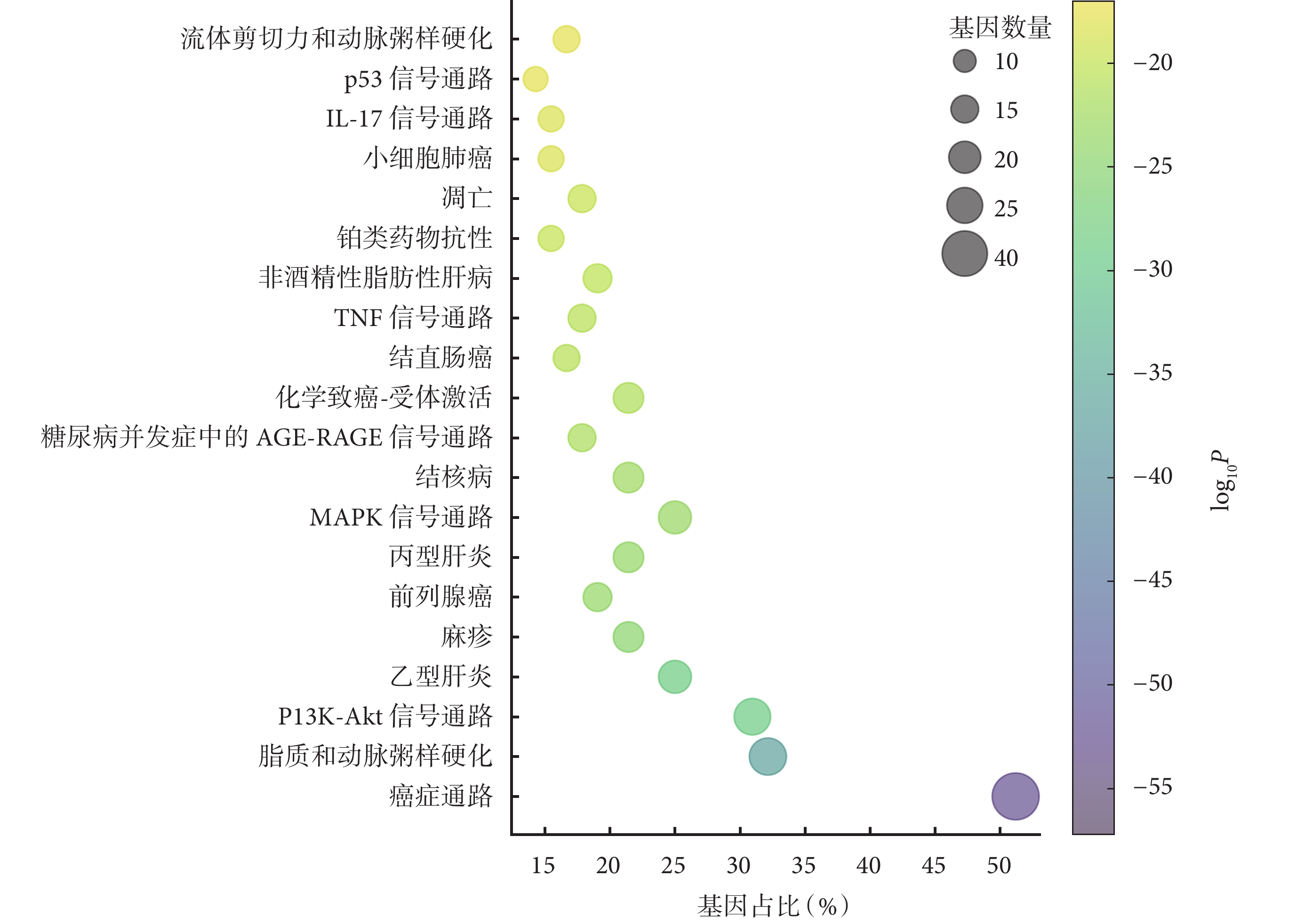
對 84 個共同靶點進行 GO 功能富集分析,結果顯示這些靶點涉及生物過程、細胞組分、分子功能三大類別,生物過程主要富集于脂質的細胞應答(GO:0071396)、對無機物質的應答(GO:0010035)以及對氧水平下降的應答(GO:0036293)等;細胞組分的富集路徑包括轉錄調控復合物(GO:0005667)、周期素依賴性蛋白激酶全酶復合物(GO:0000307)和 Bcl-2 家族蛋白復合物(GO:0097136)等;分子功能方面主要涉及蛋白質結構域特異性結合(GO:0019904)、DNA 結合轉錄因子結合(GO:0140297)以及轉錄因子結合(GO:0008134)等。圖4 展示了–log10P 值排名前 10 的 GO 功能富集條目。
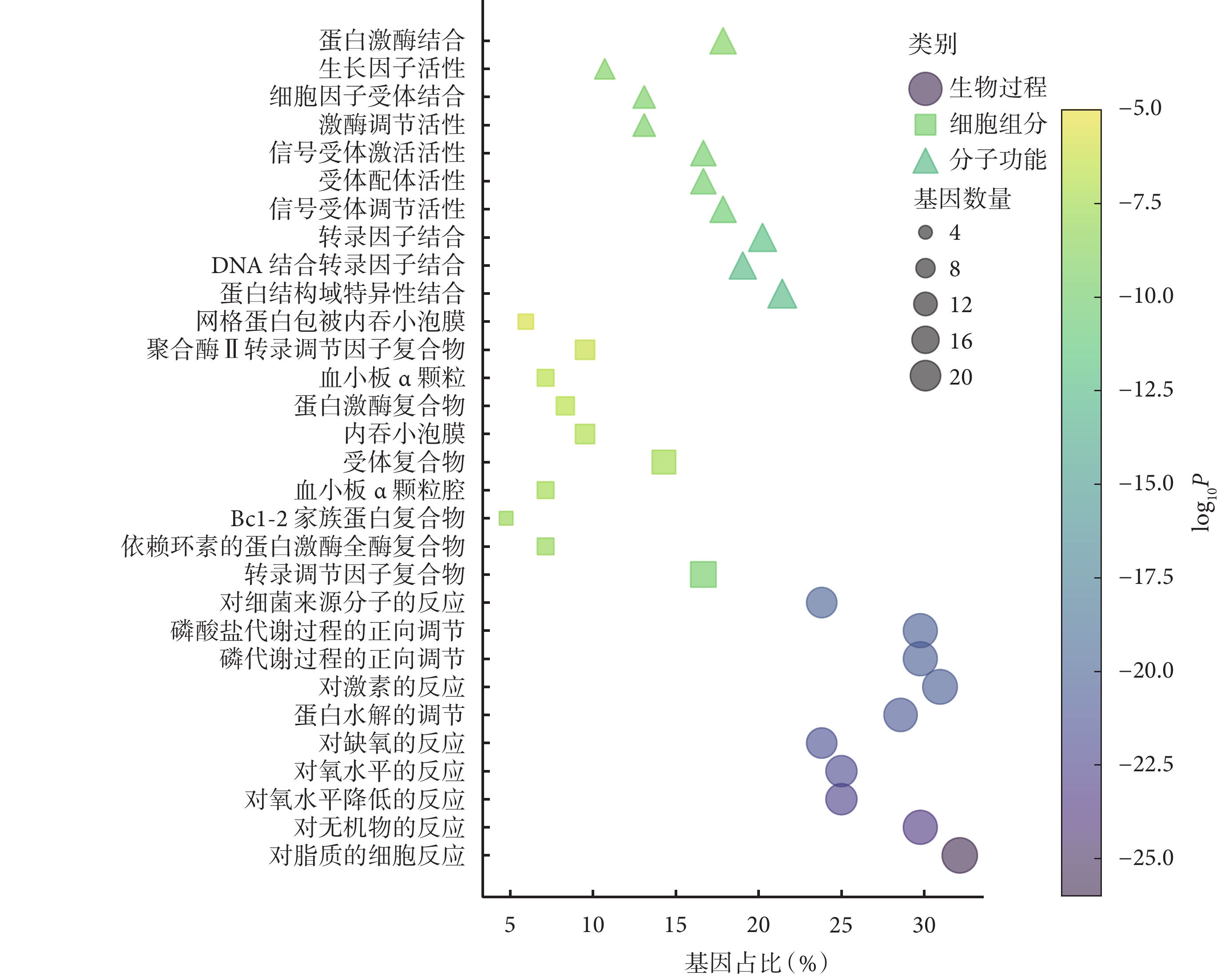 圖4
大柴胡湯與急性胰腺炎共同靶點的 GO 功能富集分析氣泡圖
圖4
大柴胡湯與急性胰腺炎共同靶點的 GO 功能富集分析氣泡圖
GO:基因本體
KEGG 通路富集分析結果則顯示了–log10P 值排名前 20 的相關通路(圖5)。結合通路富集分析結果與急性胰腺炎相關性的文獻回顧[10-14],篩選后得出大柴胡湯治療急性胰腺炎的關鍵基因主要富集于脂質與動脈粥樣硬化通路(hsa05417)、PI3K-Akt 信號通路(hsa04151)、絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信號通路(hsa04010)、腫瘤壞死因子(tumor necrosis factor, TNF)信號通路(hsa04668)、凋亡通路(hsa04210)等。
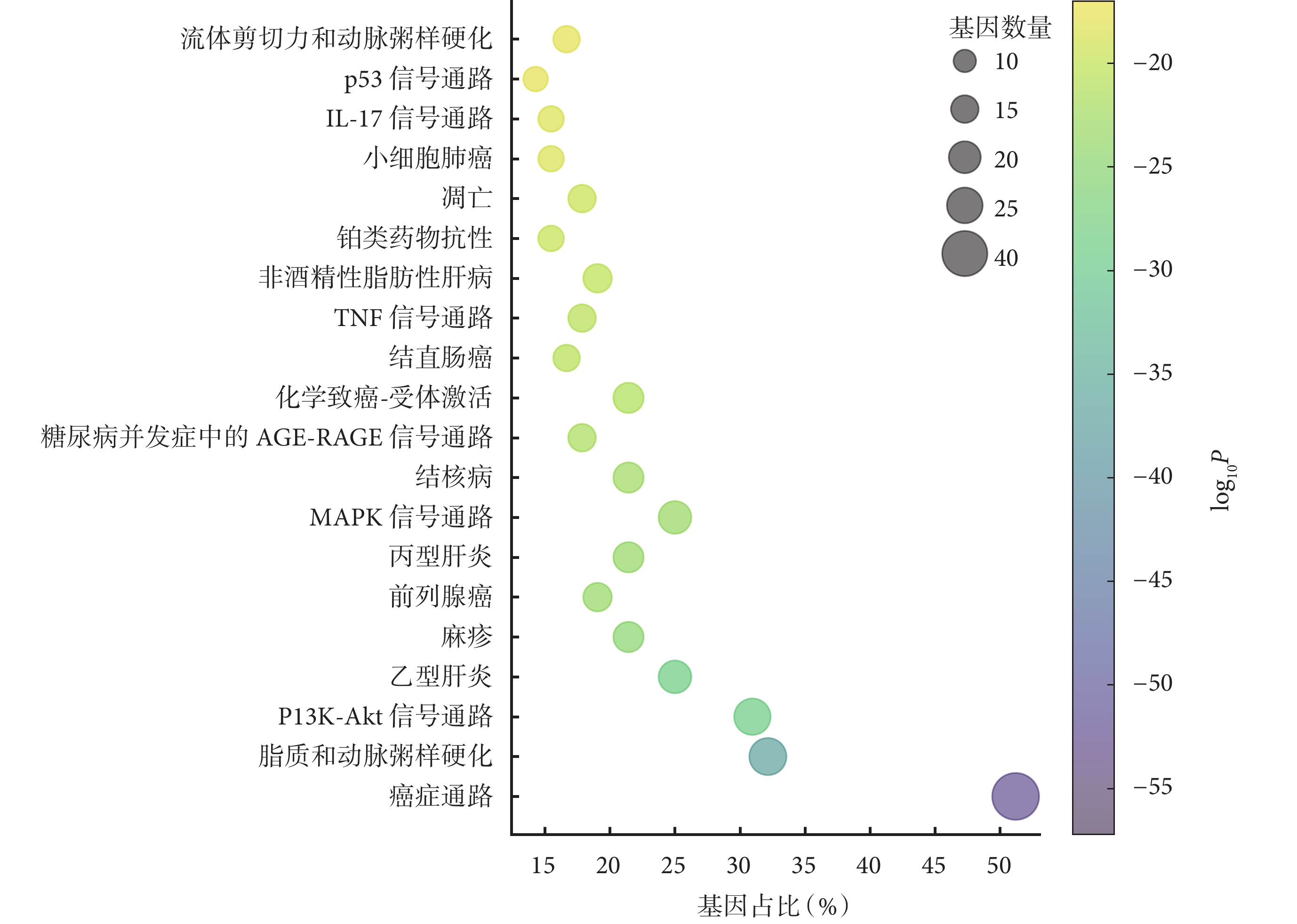 圖5
大柴胡湯與急性胰腺炎共同靶點的 KEGG 通路富集分析氣泡圖
圖5
大柴胡湯與急性胰腺炎共同靶點的 KEGG 通路富集分析氣泡圖
KEGG:京都基因和基因組數據庫;IL:白細胞介素;TNF:腫瘤壞死因子;AGE-RAGE:晚期糖基化終產物及其受體;MAPK:絲裂原活化蛋白激酶
2.7 分子對接
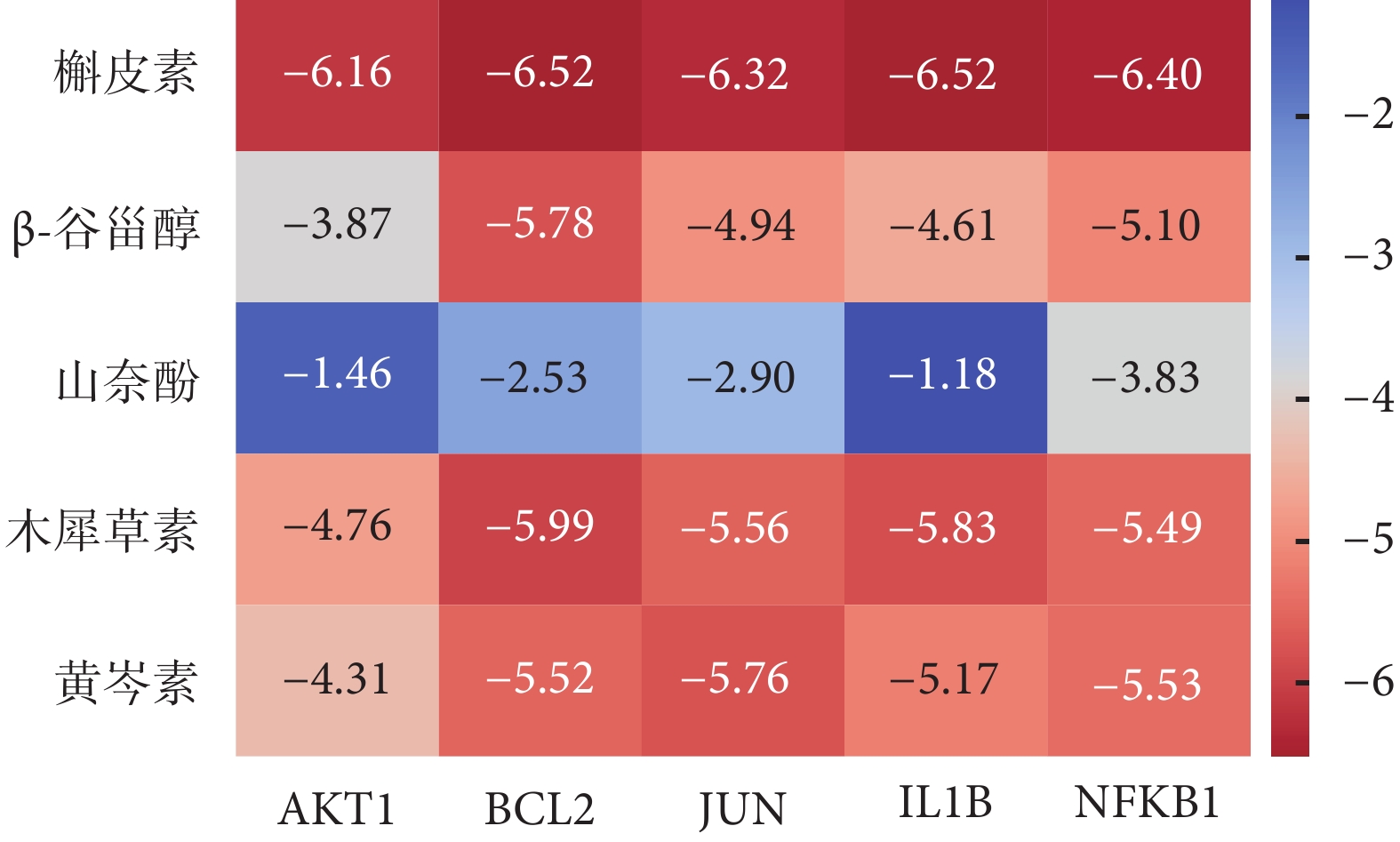
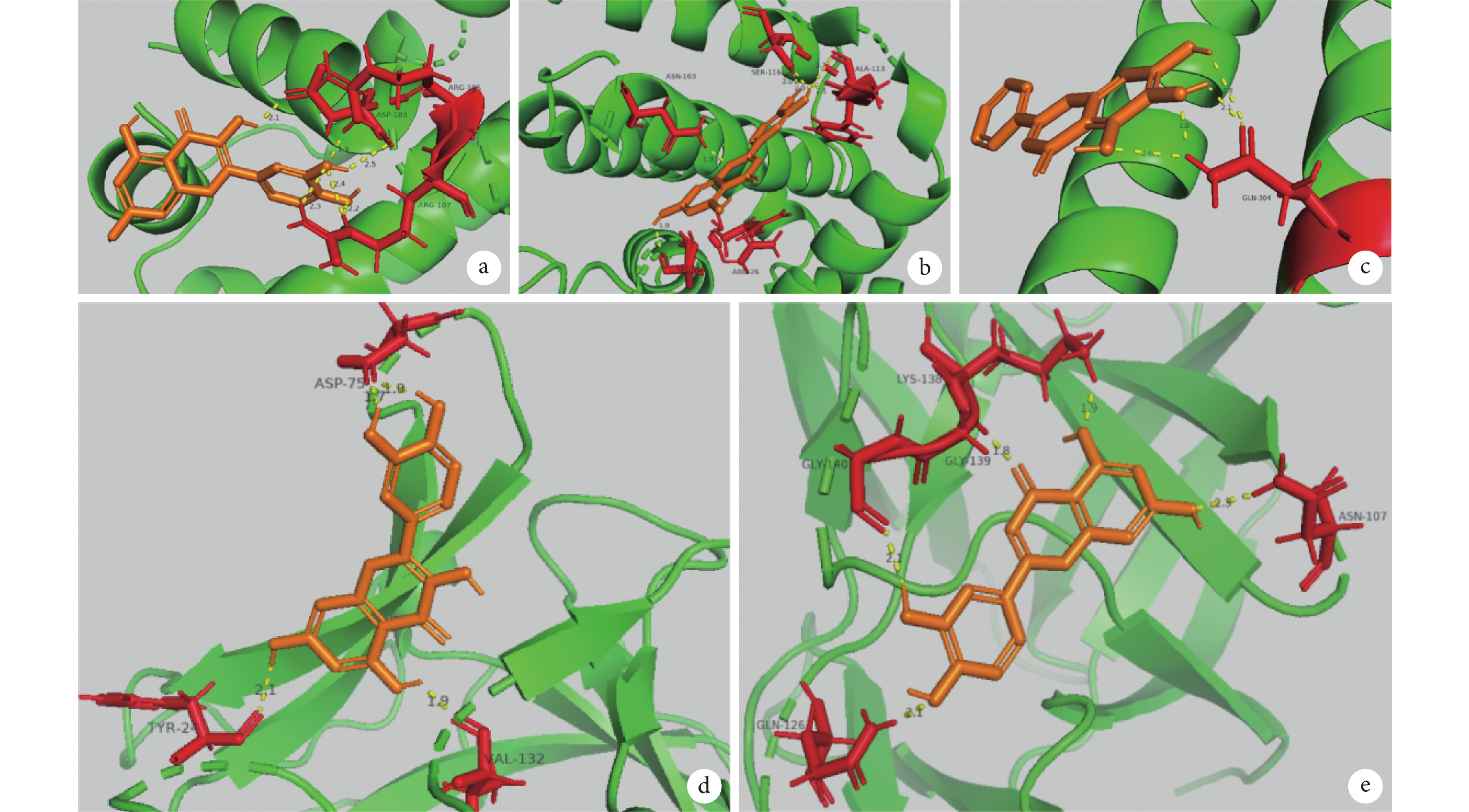
核心成分與核心蛋白分子對接的結果見圖6、7。在預測的分子與蛋白的結合能中,小于–5.0 kJ/mol 的組合包括:槲皮素與 AKT1、BCL2、JUN、IL1B、NFKB1 的結合,結合能分別為–6.16、–6.52、–6.32、–6.52 和–6.40 kJ/mol;β-谷甾醇與 BCL2 的結合,結合能為–5.78 kJ/mol;木犀草素與 BCL2、JUN、IL1B、NFKB1 的結合,結合能分別為–5.99、–5.56、–5.83 和–5.49 kJ/mol;黃芩素與 BCL2、JUN、IL1B、NFKB1 的結合,結合能分別為–5.52、–5.76、–5.17 和–5.43 kJ/mol。
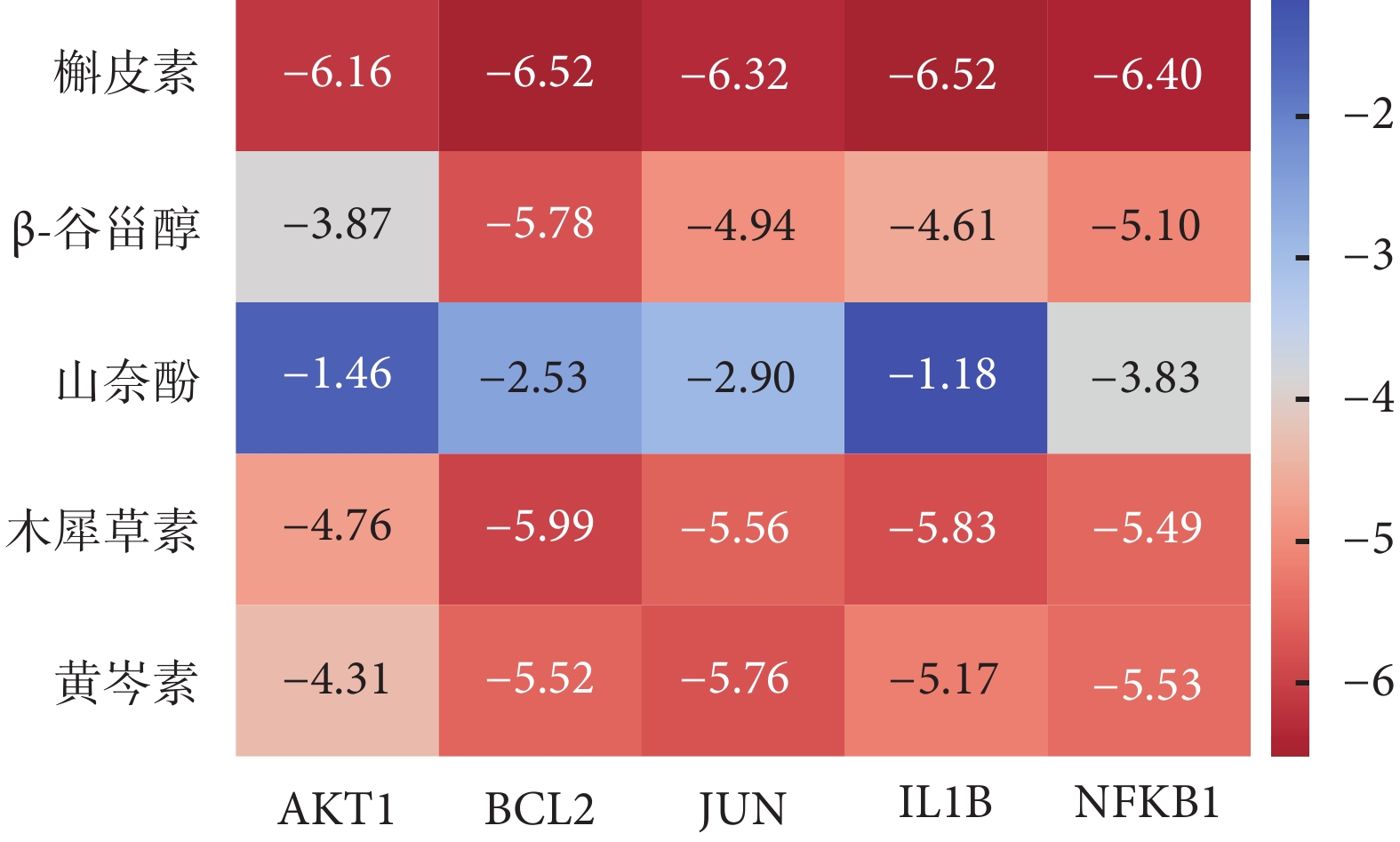 圖6
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果(kJ/mol)
圖6
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果(kJ/mol)
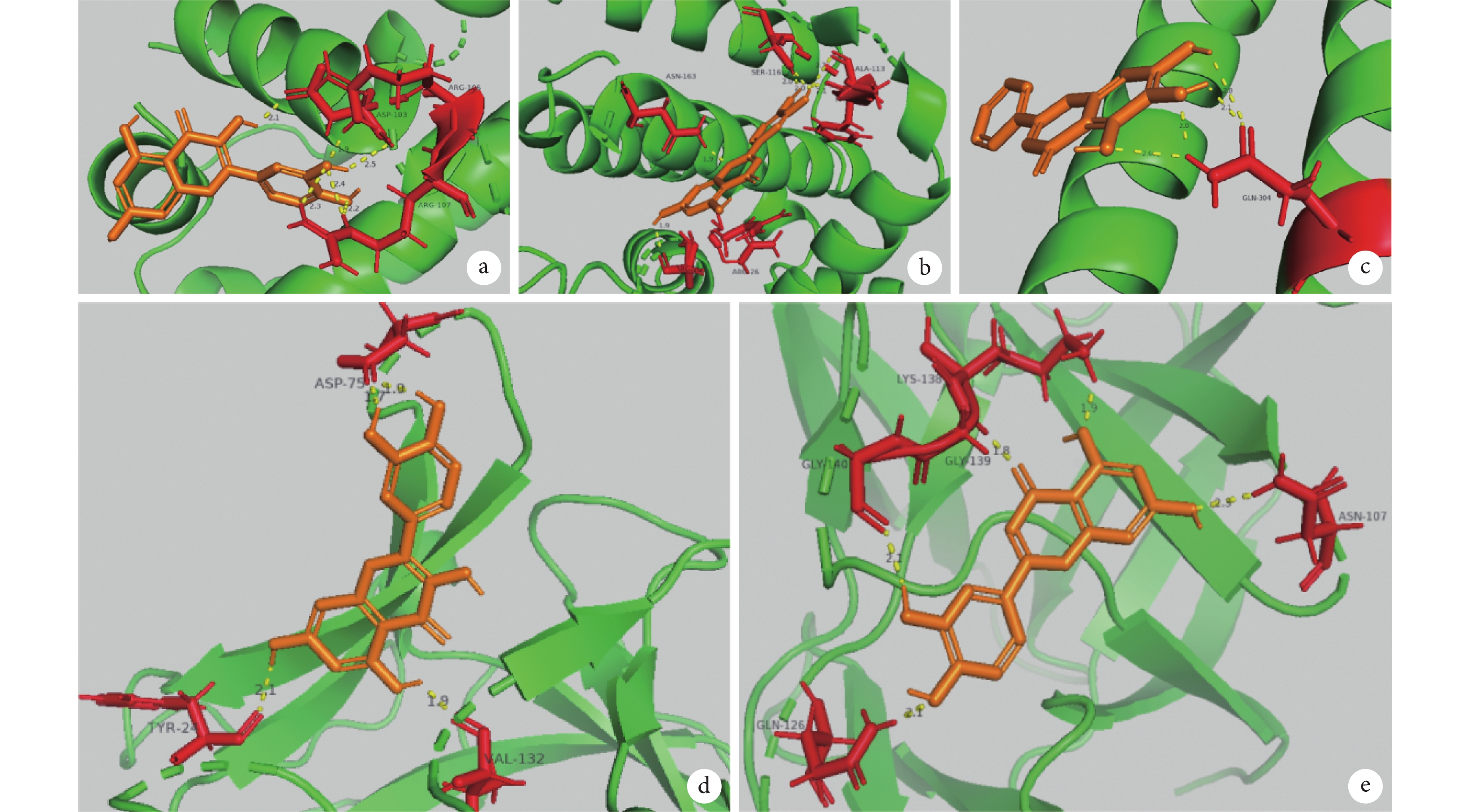 圖7
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果示意圖
圖7
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果示意圖
a. 槲皮素與 BCL2;b. 槲皮素與 IL1B;c. 木犀草素與 BCL2;d. 木犀草素與 IL1B;e. 黃芩素與 JUN。BCL2:B 細胞淋巴瘤蛋白 2;IL1B:白細胞介素 1β;JUN:Jun 原癌基因
3 討論
急性胰腺炎為臨床急腹癥之一,病情危重,病死率高,主要臨床表現為腹痛和大便不通。通腑泄熱類經方的使用,不僅快速緩解患者腹痛癥狀,還可明顯改善患者的預后[4]。現代方劑藥理學表明:大柴胡湯具有降血脂、調節免疫功能、抗炎抗菌、調節胃腸功能、保肝利膽護胃等作用;其臨床應用包括急性胰腺炎、急性膽囊炎、膽結石、反流性胃食管炎、肝炎、高脂血癥、發熱、感染性疾病等疾病[15]。
本研究結果顯示,大柴胡湯的核心成分為槲皮素、β-谷甾醇、山柰酚、木犀草素、黃芩素。槲皮素是一種強效的抗氧化劑和抗炎劑,可抑制脂多糖刺激下中性粒細胞的白細胞介素(interleukin, IL)-6 分泌、細胞內 IL-6 水平以及 IL-6 mRNA 的表達。實驗表明,未經處理的中性粒細胞在脂多糖刺激下會產生 IL-6,而槲皮素預處理后可顯著抑制這一過程[16]。槲皮素可以劑量依賴性地抑制 IL-1β 刺激下的視網膜色素上皮細胞中細胞間黏附分子-1、IL-6、IL-8 和單核細胞趨化蛋白-1 的表達。槲皮素通過阻斷 MAPK 和核因子 κB(nuclear factor kappa B, NF-κB)信號通路,減少這些炎癥因子的產生并減弱炎癥反應。此外,研究還顯示 MAPK 和 NF-κB 抑制劑可以減少部分炎癥因子的表達,與槲皮素的作用機制一致[17]。β-谷甾醇具有顯著的抗炎能力。通過大鼠足腫脹試驗、胸膜炎試驗以及小鼠耳腫脹和髓過氧化物酶活性試驗,β-谷甾醇在特異性和非特異性急性炎癥中可顯著抑制炎癥反應,炎癥抑制率為 50%~75%[18]。β-谷甾醇具有免疫調節作用。在體外實驗中,β-谷甾醇增加了豬外周血單核細胞數量,并激活了樹突狀細胞[19]。山柰酚具有抗炎和抗氧化活性。研究表明,山柰酚在 50、100 和 200 μmol/L 濃度下可減少一氧化氮濃度和吞噬作用,其抗氧化活性隨濃度增加而增強[20]。山柰酚能夠通過抑制 NF-κB 通路發揮作用,可抑制 NF-κB 的活性、阻止其核轉位,并與已知 NF-κB 抑制劑表現出相似的結合能,分子對接和體外實驗均支持其作為抗炎藥物的潛力[21]。木犀草素能夠減少細胞內活性氧水平并抑制炎癥反應。它通過抑制 IL-1 和 Toll 樣受體等炎癥介質的作用,減少促炎性細胞因子和趨化因子的產生,從而緩解炎癥[22]。木犀草素能夠通過調節巨噬細胞的 M1/M2 極化來抑制炎癥,減少 M1 型促炎因子的表達并增加 M2 型抗炎因子的表達。此外,木犀草素通過下調磷酸化信號轉導及轉錄活化因子 3 和上調磷酸化信號轉導及轉錄活化因子 6 信號通路發揮抗炎作用[23]。黃芩素具有抗炎作用。研究表明,黃芩素能夠顯著抑制 IL-1β 誘導的類風濕關節炎滑膜樣成纖維細胞增殖,并減少 ERK1/2 和 p38 的磷酸化以及 NF-κB p65 的核轉位,其抑制作用還可通過添加重組巨噬細胞遷移抑制因子部分逆轉[24]。黃芩素對骨關節炎具有潛在治療作用。在體外實驗中,黃芩苷顯著抑制了 IL-1β 誘導的人骨關節炎軟骨細胞中一氧化氮、前列腺素 E2、基質金屬蛋白酶及炎癥因子的產生,并抑制 NF-κB 的活化[25]。這些核心成分通過抑制炎癥介質的釋放和調節免疫反應,可能在治療急性胰腺炎中具有減輕炎癥和促進組織修復的潛力。
本研究結果顯示,大柴胡湯治療急性胰腺炎的核心蛋白分別為 AKT1、BCL2、JUN、IL1B、NFKB1。AKT1 在急性胰腺炎中起關鍵作用,調控腺泡細胞增殖和腺泡-導管化生形成。抑制 AKT1 的活性可能加重胰腺損傷,阻礙其再生過程[26]。BCL-2 通過穩定線粒體,保護胰腺腺泡細胞免于壞死,從而減輕急性胰腺炎的嚴重程度。抑制 BCL-2/BCL-xL 會加重壞死,而上調 BCL-2/BCL-xL 有助于預防或減輕急性胰腺炎中的壞死[27]。JUN 在急性胰腺炎中通過激活 JNK 信號通路促進炎癥反應,導致胰腺損傷。抑制 JNK 活性可減輕急性胰腺炎的炎癥反應和組織損傷[28]。IL-1β 在急性胰腺炎中作為促炎因子,其表達在胰腺損傷后迅速增加,加劇胰腺和肺部損傷。抑制 IL-1β 或其激活途徑(如胱天蛋白酶-1)能夠顯著減輕胰腺炎的組織損傷并改善相關器官的功能[29]。NF-κB 在急性胰腺炎中通過激活炎癥反應,促進促炎性細胞因子的釋放,從而加重疾病的嚴重程度。抑制 NF-κB 的活性能夠減少胰腺組織損傷和全身性炎癥反應,有助于緩解急性胰腺炎的癥狀[30]。這些核心蛋白均富集于脂質與動脈粥樣硬化通路、PI3K-Akt 信號通路、MAPK 信號通路、TNF 信號通路、凋亡通路。
大柴胡湯可能是通過多個關鍵通路來共同調控急性胰腺炎的病理過程。PI3K-Akt 信號通路在急性胰腺炎中通過調節炎癥反應起重要作用,抑制該通路能夠減少炎癥程度。然而,抑制 Akt 也會阻礙胰腺的再生,增加腺泡-導管化生的風險[31]。脂質代謝紊亂與急性胰腺炎的發生密切相關,特定脂質種類可能通過影響炎癥反應和細胞膜穩定性參與急性胰腺炎的進程。此外,脂質與動脈粥樣硬化通路的異常調控可能加劇胰腺損傷和系統性炎癥反應[32]。MAPK 信號通路在急性胰腺炎中通過激活促炎性細胞因子(如 TNF-α 和 IL-6)的轉錄和合成,促進炎癥反應的發生和加劇。p38 MAPK 的過度激活在急性壞死性胰腺炎中表現尤為顯著,與胰腺損傷的嚴重程度密切相關[33]。TNF 信號通路在急性胰腺炎中通過調控促炎性細胞因子和免疫細胞的激活,推動全身炎癥反應的擴展,并導致多器官功能障礙。TNF-α 的過度表達與急性胰腺炎的嚴重程度和并發癥的發展密切相關[12]。在急性胰腺炎中,腺泡細胞凋亡被認為是一種有利的細胞反應,能夠減少炎癥和組織損傷。與此相對,壞死性細胞死亡與疾病嚴重程度密切相關,促進凋亡通路的激活可能有助于減輕急性胰腺炎的病情[34]。
然而,本研究結果主要依賴于計算模型的預測,缺乏直接的實驗驗證,未來仍需通過臨床和基礎研究加以證實。在臨床上,可設計隨機對照試驗,觀察服用大柴胡湯后患者的炎癥標志物及病情改善情況,并通過多中心、大樣本量的試驗評估其安全性和有效性。在基礎研究方面,可使用急性胰腺炎的動物模型和細胞實驗,進一步探討大柴胡湯核心成分對 AKT1、BCL2、JUN、IL1B 和 NFKB1 等關鍵蛋白的調控作用及其在脂質與動脈粥樣硬化通路、PI3K-Akt 信號通路、MAPK 信號通路、TNF 信號通路和凋亡通路中的抗炎和抗凋亡機制。此外,還可以利用基因敲除或過表達技術,從分子水平上明確大柴胡湯中的活性成分如何通過這些靶點發揮潛在的治療作用。通過這些實驗驗證,將更全面地確認網絡藥理學預測的結果,為大柴胡湯在急性胰腺炎治療中的應用提供更有力的科學依據。
綜上所述,本研究通過網絡藥理學和分子對接方法初步探索了大柴胡湯治療急性胰腺炎的潛在分子機制,大柴胡湯可能通過核心成分槲皮素、β-谷甾醇、山柰酚、木犀草素和黃芩素調控脂質與動脈粥樣硬化通路、PI3K-Akt 信號通路、MAPK 信號通路、TNF 信號通路、凋亡通路的 AKT1、BCL2、JUN、IL1B、NFKB1 關鍵基因靶點從而發揮抗炎和抗凋亡作用潛力。本研究為大柴胡湯在急性胰腺炎治療中的作用機制提供了初步的理論依據,有必要通過進一步的體內外實驗對其作用進行驗證。
利益沖突:所有作者聲明不存在利益沖突。
急性胰腺炎是臨床常見的急腹癥之一,約 1/4 的患者會發展為重癥急性胰腺炎[1]。重癥急性胰腺炎并發癥多,病死率高(30%~40%)[2]。部分急性胰腺炎具有復發傾向,復發率為 10%~30%,嚴重危及我國民眾的生命健康[3]。在中醫學中雖無“急性胰腺炎”這一病名,但急性胰腺炎的臨床表現及體征描述與脾心痛、膈痛、胃脘痛、結胸、厥心痛等非常相似[4]。急性胰腺炎的病變部位主要涉及中醫的肝、膽、脾、胃,多合并陽明、少陽病變,以肝膽濕熱、腑實內結為主[5]。大柴胡湯的方藥組成為柴胡、黃芩、大黃、枳實、生姜、半夏、大棗、白芍,主要用于治療膽囊炎、膽結石、胰腺炎等疾病,其方證規律主癥表現為便秘、口苦、惡心嘔吐、胃脹痛、胸脅不適、腹脹痛、發熱、肩背痛等,舌脈象特征包括舌紅、苔黃膩、脈弦或脈數[6]。大柴胡湯的腹征表現為心下滿痛,提示部位多在胃脘附近[7]。現有研究表明,大柴胡湯在急性胰腺炎治療中具有多重作用機制,包括修復腸黏膜屏障、調控炎性因子及相關信號通路、減輕氧化應激損傷、降低胰腺腺泡細胞鈣離子超載以及調控細胞凋亡等[8]。通過這些機制,大柴胡湯能有效地減少炎癥反應、減輕組織損傷并改善胰腺功能。由于其多成分、多靶點的特點,傳統的單一成分或單一靶點研究難以全面揭示其作用機制。網絡藥理學的出現為中藥多組分與復雜疾病的研究提供了系統性和綜合性的工具。它能夠通過整合多成分、多靶點的信息,系統性地解析中藥的多維度效應,尤其適用于像大柴胡湯這樣的復雜中藥方劑[9]。由于大柴胡湯藥效成分復雜,其對急性胰腺炎治療作用的分子機制仍不清楚。本研究基于網絡藥理學、分子對接的方式揭示大柴胡湯治療急性胰腺炎的潛在作用靶點和相關分子機制,以期為進一步的實驗研究提供理論依據。
1 材料與方法
1.1 大柴胡湯活性成分和靶點的篩選
2024 年 3 月—5 月,將大柴胡湯的 8 味中藥(柴胡、黃芩、大黃、枳實、生姜、半夏、大棗、白芍)逐個輸入到中藥系統藥理學數據庫與分析平臺,檢索設置:口服生物利用度≥30%、類藥性≥0.18,獲取有效成分、對應靶點,然后將匯總的靶點導入 Uniprot 數據庫,獲得相應的基因符號。
1.2 急性胰腺炎靶點篩選
以“acute pancreatitis”為檢索詞,在 GeneCards 數據庫中檢索疾病靶點,將關聯度(relevance)<5 的排除。
1.3 交集后獲取共同靶點并作圖
使用在線工具 Venny2.1 取大柴胡湯靶點基因符號與急性胰腺炎靶點基因符號的交集并作圖。
1.4 構建活性成分-共同靶點圖,篩選核心成分
將與共同靶點有交集的活性成分導入 Cytoscape 3.9.1 軟件構建復方活性成分-靶點作用網絡圖,并根據度值排前 5 位確定核心成分。
1.5 構建蛋白互作(protein-protein interaction, PPI)網絡,篩選核心蛋白
將大柴胡湯靶點基因與急性胰腺炎靶點基因的交集篩選出的靶點輸入到 STRING 數據庫,設置“Homo sapiens”,最小互作閾值設為“highest confidence”(0.9),保存 PPI 網絡和 TSV 格式的數據文件,將此文件導入 Cytoscape 軟件,繪制 PPI 網絡圖,并根據度值排前 5 位確定核心蛋白。
1.6 富集分析
將共同靶點導入 Metascape 數據庫分別進行基因本體(gene ontology, GO)功能富集分析以及京都基因和基因組數據庫(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析,然后將數據結果導入 Python 3.8 軟件制作富集分析氣泡圖。
1.7 分子對接
將核心蛋白導入蛋白質數據庫(Protein Data Bank, PDB),保存三維結構的 PDB 格式文件。將核心成分導入 PubChem 數據庫下載二維結構的 mol2 格式文件。使用 PyMol 2.6 軟件刪除蛋白質結構的水分子和小分子配體,導入 AutoDockTools 1.5.6 軟件進行加氫等預處理,將核心成分和核心蛋白均轉換成 pdbqt 格式文件,運行 AutoDockTools 軟件對核心成分和核心蛋白分別進行對接,保存最低結合能數據作為分子對接的結果,利用 PyMol 2.6 軟件對最低結合能的組合進行可視化。若核心成分與核心靶點的結合能值在?5.0 kJ/mol 以下,則說明結合程度高且構象穩定,有較好的結合活性。
2 結果
2.1 大柴胡湯的成分及靶點
本研究收集了大柴胡湯的 151 種藥物活性成分,去重后得到 66 個有效成分(表1)。通過對
2.2 急性胰腺炎靶點
通過 GeneCards 數據庫篩選后最終獲得
2.3 交集圖
將大柴胡湯的 261 個有效成分靶點與急性胰腺炎的
 圖1
大柴胡湯與急性胰腺炎靶點交集圖
圖1
大柴胡湯與急性胰腺炎靶點交集圖
2.4 活性成分-共同靶點圖及核心成分分析
根據網絡分析,大柴胡湯核心成分度值排名前 5 位的分別為槲皮素(MOL000098,度值=118)、β-谷甾醇(MOL000358,度值=53)、山柰酚(MOL000422,度值=40)、木犀草素(MOL000006,度值=28)和黃芩素(MOL002714,度值=24)。這些成分與共同靶點的關聯性通過活性成分-靶點網絡圖呈現(圖2)。
 圖2
大柴胡湯核心成分與急性胰腺炎關聯性的活性成分-共同靶點網絡圖
圖2
大柴胡湯核心成分與急性胰腺炎關聯性的活性成分-共同靶點網絡圖
2.5 PPI 網絡及核心蛋白分析
對 84 個共同靶點進行 PPI 分析后得到核心蛋白為 AKT1(度值=118)、B 細胞淋巴瘤蛋白 2(B-cell leukemia/lymphoma 2, BCL2)(度值=53)、Jun 原癌基因(Jun proto-oncogene, JUN)(度值=40)、白細胞介素 1β(interleukin 1 Beta, IL1B)(度值=28)、核因子 κB 亞基 1(nuclear factor kappa B subunit 1, NFKB1)(度值=24)。見圖3。
 圖3
大柴胡湯與急性胰腺炎共同靶點的蛋白互作網絡圖
圖3
大柴胡湯與急性胰腺炎共同靶點的蛋白互作網絡圖
節點代表蛋白質,邊代表蛋白質間的相互作用,圖中包含 84 個節點和 157 條邊
2.6 GO 及 KEGG 通路的富集分析氣泡圖
對 84 個共同靶點進行 GO 功能富集分析,結果顯示這些靶點涉及生物過程、細胞組分、分子功能三大類別,生物過程主要富集于脂質的細胞應答(GO:0071396)、對無機物質的應答(GO:0010035)以及對氧水平下降的應答(GO:0036293)等;細胞組分的富集路徑包括轉錄調控復合物(GO:0005667)、周期素依賴性蛋白激酶全酶復合物(GO:0000307)和 Bcl-2 家族蛋白復合物(GO:0097136)等;分子功能方面主要涉及蛋白質結構域特異性結合(GO:0019904)、DNA 結合轉錄因子結合(GO:0140297)以及轉錄因子結合(GO:0008134)等。圖4 展示了–log10P 值排名前 10 的 GO 功能富集條目。
 圖4
大柴胡湯與急性胰腺炎共同靶點的 GO 功能富集分析氣泡圖
圖4
大柴胡湯與急性胰腺炎共同靶點的 GO 功能富集分析氣泡圖
GO:基因本體
KEGG 通路富集分析結果則顯示了–log10P 值排名前 20 的相關通路(圖5)。結合通路富集分析結果與急性胰腺炎相關性的文獻回顧[10-14],篩選后得出大柴胡湯治療急性胰腺炎的關鍵基因主要富集于脂質與動脈粥樣硬化通路(hsa05417)、PI3K-Akt 信號通路(hsa04151)、絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信號通路(hsa04010)、腫瘤壞死因子(tumor necrosis factor, TNF)信號通路(hsa04668)、凋亡通路(hsa04210)等。
 圖5
大柴胡湯與急性胰腺炎共同靶點的 KEGG 通路富集分析氣泡圖
圖5
大柴胡湯與急性胰腺炎共同靶點的 KEGG 通路富集分析氣泡圖
KEGG:京都基因和基因組數據庫;IL:白細胞介素;TNF:腫瘤壞死因子;AGE-RAGE:晚期糖基化終產物及其受體;MAPK:絲裂原活化蛋白激酶
2.7 分子對接
核心成分與核心蛋白分子對接的結果見圖6、7。在預測的分子與蛋白的結合能中,小于–5.0 kJ/mol 的組合包括:槲皮素與 AKT1、BCL2、JUN、IL1B、NFKB1 的結合,結合能分別為–6.16、–6.52、–6.32、–6.52 和–6.40 kJ/mol;β-谷甾醇與 BCL2 的結合,結合能為–5.78 kJ/mol;木犀草素與 BCL2、JUN、IL1B、NFKB1 的結合,結合能分別為–5.99、–5.56、–5.83 和–5.49 kJ/mol;黃芩素與 BCL2、JUN、IL1B、NFKB1 的結合,結合能分別為–5.52、–5.76、–5.17 和–5.43 kJ/mol。
 圖6
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果(kJ/mol)
圖6
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果(kJ/mol)
 圖7
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果示意圖
圖7
大柴胡湯核心成分與急性胰腺炎核心蛋白的分子對接結果示意圖
a. 槲皮素與 BCL2;b. 槲皮素與 IL1B;c. 木犀草素與 BCL2;d. 木犀草素與 IL1B;e. 黃芩素與 JUN。BCL2:B 細胞淋巴瘤蛋白 2;IL1B:白細胞介素 1β;JUN:Jun 原癌基因
3 討論
急性胰腺炎為臨床急腹癥之一,病情危重,病死率高,主要臨床表現為腹痛和大便不通。通腑泄熱類經方的使用,不僅快速緩解患者腹痛癥狀,還可明顯改善患者的預后[4]。現代方劑藥理學表明:大柴胡湯具有降血脂、調節免疫功能、抗炎抗菌、調節胃腸功能、保肝利膽護胃等作用;其臨床應用包括急性胰腺炎、急性膽囊炎、膽結石、反流性胃食管炎、肝炎、高脂血癥、發熱、感染性疾病等疾病[15]。
本研究結果顯示,大柴胡湯的核心成分為槲皮素、β-谷甾醇、山柰酚、木犀草素、黃芩素。槲皮素是一種強效的抗氧化劑和抗炎劑,可抑制脂多糖刺激下中性粒細胞的白細胞介素(interleukin, IL)-6 分泌、細胞內 IL-6 水平以及 IL-6 mRNA 的表達。實驗表明,未經處理的中性粒細胞在脂多糖刺激下會產生 IL-6,而槲皮素預處理后可顯著抑制這一過程[16]。槲皮素可以劑量依賴性地抑制 IL-1β 刺激下的視網膜色素上皮細胞中細胞間黏附分子-1、IL-6、IL-8 和單核細胞趨化蛋白-1 的表達。槲皮素通過阻斷 MAPK 和核因子 κB(nuclear factor kappa B, NF-κB)信號通路,減少這些炎癥因子的產生并減弱炎癥反應。此外,研究還顯示 MAPK 和 NF-κB 抑制劑可以減少部分炎癥因子的表達,與槲皮素的作用機制一致[17]。β-谷甾醇具有顯著的抗炎能力。通過大鼠足腫脹試驗、胸膜炎試驗以及小鼠耳腫脹和髓過氧化物酶活性試驗,β-谷甾醇在特異性和非特異性急性炎癥中可顯著抑制炎癥反應,炎癥抑制率為 50%~75%[18]。β-谷甾醇具有免疫調節作用。在體外實驗中,β-谷甾醇增加了豬外周血單核細胞數量,并激活了樹突狀細胞[19]。山柰酚具有抗炎和抗氧化活性。研究表明,山柰酚在 50、100 和 200 μmol/L 濃度下可減少一氧化氮濃度和吞噬作用,其抗氧化活性隨濃度增加而增強[20]。山柰酚能夠通過抑制 NF-κB 通路發揮作用,可抑制 NF-κB 的活性、阻止其核轉位,并與已知 NF-κB 抑制劑表現出相似的結合能,分子對接和體外實驗均支持其作為抗炎藥物的潛力[21]。木犀草素能夠減少細胞內活性氧水平并抑制炎癥反應。它通過抑制 IL-1 和 Toll 樣受體等炎癥介質的作用,減少促炎性細胞因子和趨化因子的產生,從而緩解炎癥[22]。木犀草素能夠通過調節巨噬細胞的 M1/M2 極化來抑制炎癥,減少 M1 型促炎因子的表達并增加 M2 型抗炎因子的表達。此外,木犀草素通過下調磷酸化信號轉導及轉錄活化因子 3 和上調磷酸化信號轉導及轉錄活化因子 6 信號通路發揮抗炎作用[23]。黃芩素具有抗炎作用。研究表明,黃芩素能夠顯著抑制 IL-1β 誘導的類風濕關節炎滑膜樣成纖維細胞增殖,并減少 ERK1/2 和 p38 的磷酸化以及 NF-κB p65 的核轉位,其抑制作用還可通過添加重組巨噬細胞遷移抑制因子部分逆轉[24]。黃芩素對骨關節炎具有潛在治療作用。在體外實驗中,黃芩苷顯著抑制了 IL-1β 誘導的人骨關節炎軟骨細胞中一氧化氮、前列腺素 E2、基質金屬蛋白酶及炎癥因子的產生,并抑制 NF-κB 的活化[25]。這些核心成分通過抑制炎癥介質的釋放和調節免疫反應,可能在治療急性胰腺炎中具有減輕炎癥和促進組織修復的潛力。
本研究結果顯示,大柴胡湯治療急性胰腺炎的核心蛋白分別為 AKT1、BCL2、JUN、IL1B、NFKB1。AKT1 在急性胰腺炎中起關鍵作用,調控腺泡細胞增殖和腺泡-導管化生形成。抑制 AKT1 的活性可能加重胰腺損傷,阻礙其再生過程[26]。BCL-2 通過穩定線粒體,保護胰腺腺泡細胞免于壞死,從而減輕急性胰腺炎的嚴重程度。抑制 BCL-2/BCL-xL 會加重壞死,而上調 BCL-2/BCL-xL 有助于預防或減輕急性胰腺炎中的壞死[27]。JUN 在急性胰腺炎中通過激活 JNK 信號通路促進炎癥反應,導致胰腺損傷。抑制 JNK 活性可減輕急性胰腺炎的炎癥反應和組織損傷[28]。IL-1β 在急性胰腺炎中作為促炎因子,其表達在胰腺損傷后迅速增加,加劇胰腺和肺部損傷。抑制 IL-1β 或其激活途徑(如胱天蛋白酶-1)能夠顯著減輕胰腺炎的組織損傷并改善相關器官的功能[29]。NF-κB 在急性胰腺炎中通過激活炎癥反應,促進促炎性細胞因子的釋放,從而加重疾病的嚴重程度。抑制 NF-κB 的活性能夠減少胰腺組織損傷和全身性炎癥反應,有助于緩解急性胰腺炎的癥狀[30]。這些核心蛋白均富集于脂質與動脈粥樣硬化通路、PI3K-Akt 信號通路、MAPK 信號通路、TNF 信號通路、凋亡通路。
大柴胡湯可能是通過多個關鍵通路來共同調控急性胰腺炎的病理過程。PI3K-Akt 信號通路在急性胰腺炎中通過調節炎癥反應起重要作用,抑制該通路能夠減少炎癥程度。然而,抑制 Akt 也會阻礙胰腺的再生,增加腺泡-導管化生的風險[31]。脂質代謝紊亂與急性胰腺炎的發生密切相關,特定脂質種類可能通過影響炎癥反應和細胞膜穩定性參與急性胰腺炎的進程。此外,脂質與動脈粥樣硬化通路的異常調控可能加劇胰腺損傷和系統性炎癥反應[32]。MAPK 信號通路在急性胰腺炎中通過激活促炎性細胞因子(如 TNF-α 和 IL-6)的轉錄和合成,促進炎癥反應的發生和加劇。p38 MAPK 的過度激活在急性壞死性胰腺炎中表現尤為顯著,與胰腺損傷的嚴重程度密切相關[33]。TNF 信號通路在急性胰腺炎中通過調控促炎性細胞因子和免疫細胞的激活,推動全身炎癥反應的擴展,并導致多器官功能障礙。TNF-α 的過度表達與急性胰腺炎的嚴重程度和并發癥的發展密切相關[12]。在急性胰腺炎中,腺泡細胞凋亡被認為是一種有利的細胞反應,能夠減少炎癥和組織損傷。與此相對,壞死性細胞死亡與疾病嚴重程度密切相關,促進凋亡通路的激活可能有助于減輕急性胰腺炎的病情[34]。
然而,本研究結果主要依賴于計算模型的預測,缺乏直接的實驗驗證,未來仍需通過臨床和基礎研究加以證實。在臨床上,可設計隨機對照試驗,觀察服用大柴胡湯后患者的炎癥標志物及病情改善情況,并通過多中心、大樣本量的試驗評估其安全性和有效性。在基礎研究方面,可使用急性胰腺炎的動物模型和細胞實驗,進一步探討大柴胡湯核心成分對 AKT1、BCL2、JUN、IL1B 和 NFKB1 等關鍵蛋白的調控作用及其在脂質與動脈粥樣硬化通路、PI3K-Akt 信號通路、MAPK 信號通路、TNF 信號通路和凋亡通路中的抗炎和抗凋亡機制。此外,還可以利用基因敲除或過表達技術,從分子水平上明確大柴胡湯中的活性成分如何通過這些靶點發揮潛在的治療作用。通過這些實驗驗證,將更全面地確認網絡藥理學預測的結果,為大柴胡湯在急性胰腺炎治療中的應用提供更有力的科學依據。
綜上所述,本研究通過網絡藥理學和分子對接方法初步探索了大柴胡湯治療急性胰腺炎的潛在分子機制,大柴胡湯可能通過核心成分槲皮素、β-谷甾醇、山柰酚、木犀草素和黃芩素調控脂質與動脈粥樣硬化通路、PI3K-Akt 信號通路、MAPK 信號通路、TNF 信號通路、凋亡通路的 AKT1、BCL2、JUN、IL1B、NFKB1 關鍵基因靶點從而發揮抗炎和抗凋亡作用潛力。本研究為大柴胡湯在急性胰腺炎治療中的作用機制提供了初步的理論依據,有必要通過進一步的體內外實驗對其作用進行驗證。
利益沖突:所有作者聲明不存在利益沖突。