引用本文: 吳傳吉, 仇學梅, 袁培養, 江潞. 一例兒童口腔扁平苔蘚的單核苷酸多態性分析. 華西醫學, 2025, 40(1): 157-161. doi: 10.7507/1002-0179.202403253 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患兒,女,4 歲,因“反復口腔潰瘍半年”于 2018 年 9 月 18 日于四川大學華西口腔醫院(以下簡稱“我院”)門診就診。就診前半年,患兒出現嘴皮反復起皰化膿,口腔內多區域反復糜爛,糜爛期間疼痛明顯,進食時疼痛加劇,影響進食,未行積極治療。就診前 1 個月,患兒外陰部出現紅腫,無皮膚潰瘍,手指甲和腳趾甲出現裂紋和表層脫落,未處理。就診前 1 周,患兒面部和手背皮膚出現紅色丘疹伴有瘙癢,未處理。家長訴患兒既往無相關口腔黏膜和皮膚病史,無家族疾病史,但患兒平素體質較差。
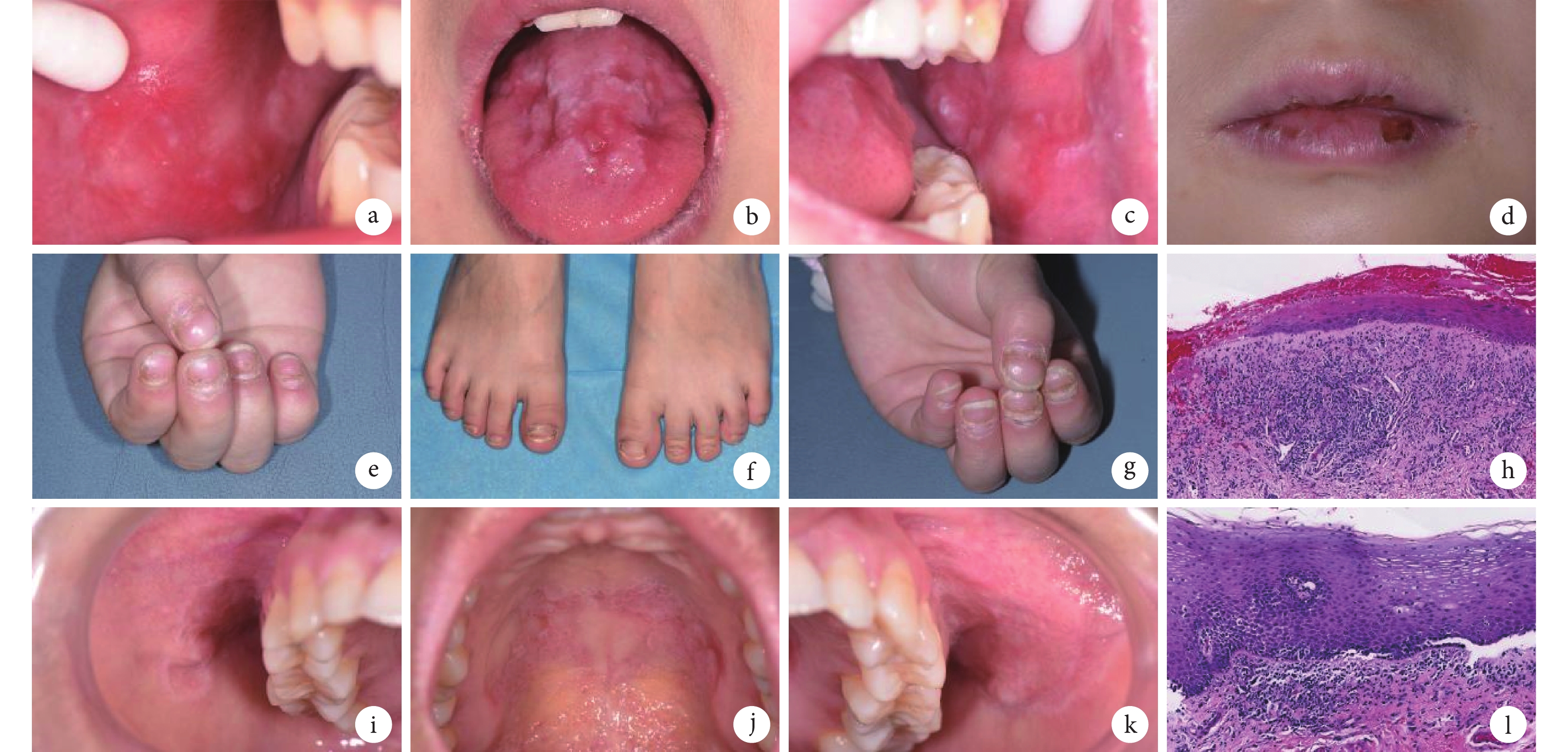
體格檢查:體溫 36.2℃,心率 78 次/min,血壓 86/53 mm Hg(1 mm Hg=0.133 kPa)。患兒身體發育和智力均表現正常。患兒的手指甲和腳趾甲存在典型的扁平苔蘚特征,包括甲面粗糙、有光澤但伴有凹陷和裂紋(圖1a~1g)。口腔檢查顯示患兒頰黏膜和舌背存在明顯白色網紋,下唇處有血痂和分散的白色斑紋。患兒家長稱患兒病變部位存在疼痛,尤其是進食時癥狀加重。血常規、血糖、肝腎功能、免疫功能(抗可溶性抗原抗體譜、T 細胞亞群 CD3/CD4/CD8、免疫球蛋白 E/G/A/M、循環免疫復合物、抗核抗體、類風濕因子、補體 3/4、B 因子)、甲狀腺功能及甲狀腺抗體檢測(抗甲狀腺過氧化物酶自身抗體、促甲狀腺激素受體抗體、甲狀腺球蛋白抗體)、常規染色體檢查、G 帶核型分析、針對病毒(甲肝病毒、乙肝病毒、丙肝病毒、人類免疫缺陷病毒)和微生物(蒼白螺旋體、白色念珠菌)的感染篩查結果均未見明顯異常。切取患兒左側頰黏膜病損部位組織進行活檢,顯示病損口腔黏膜上皮部分上皮萎縮、角化過度、基底細胞變性,以及固有層淋巴細胞和漿細胞浸潤。綜合患兒的臨床表現和病理特征(圖1a~圖1h),最終診斷為伴有指甲損害的兒童口腔扁平苔蘚(oral lichen planus, OLP)。
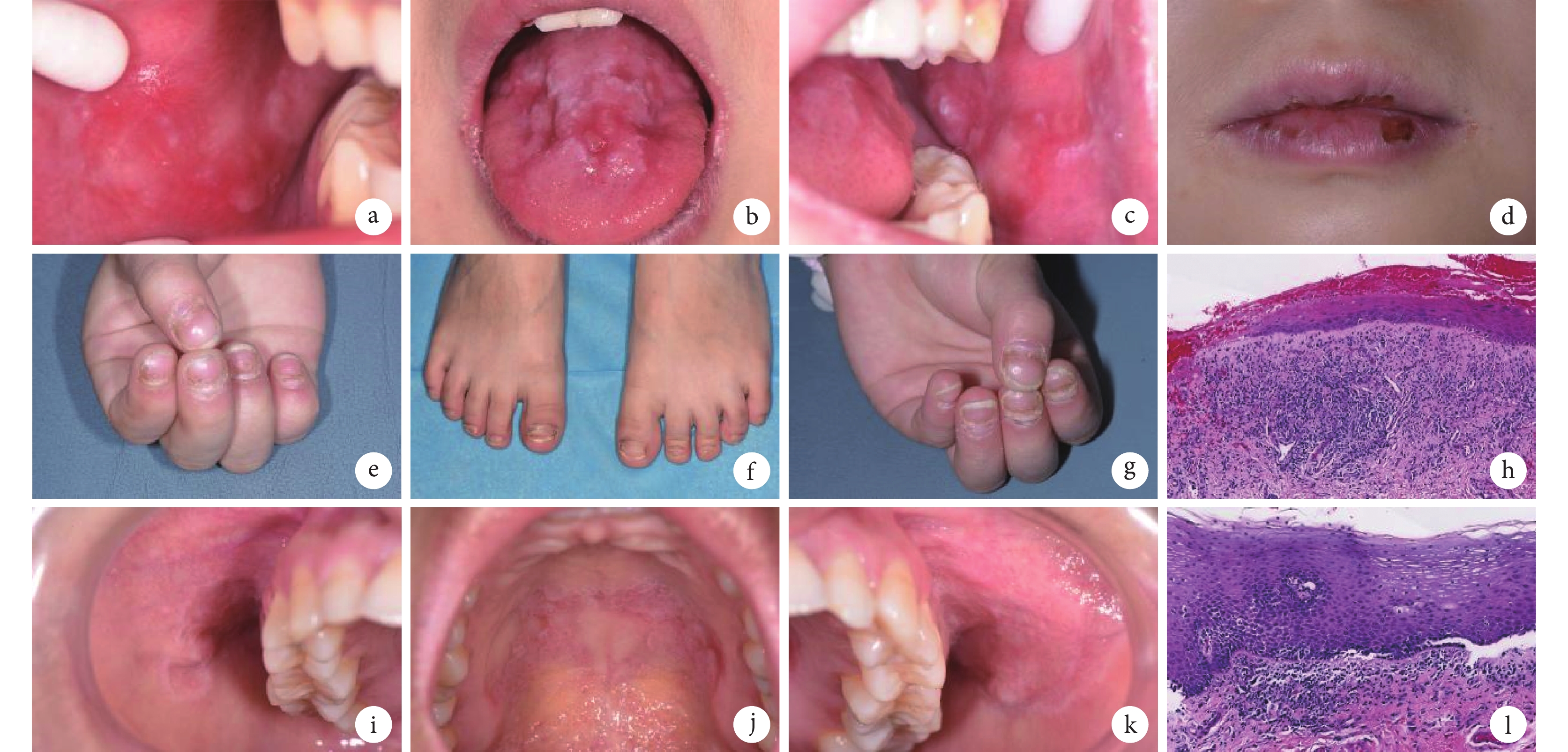 圖1
OLP 患兒及其母親(OLP 成年患者)的臨床表現和組織病理學特征
圖1
OLP 患兒及其母親(OLP 成年患者)的臨床表現和組織病理學特征
a~d. 患兒的口腔病變,特征包括舌背、雙側頰黏膜和嘴唇上有白色網紋和糜爛斑塊,提示存在 OLP 病變;e~g. 患兒的手指甲和腳趾甲變化,存在糙甲癥的典型表現,即光澤外觀伴有凹陷和甲裂,為指甲扁平苔蘚的表現形式;h. 患兒左側頰黏膜病變的組織病理學圖像,表現為部分上皮萎縮、角化過度、基底細胞變性以及固有層淋巴細胞和漿細胞浸潤(蘇木精-伊紅染色×200);i~k. 患兒母親的口腔病變,表現為硬腭和頰黏膜上有白色網紋和糜爛斑塊,提示存在 OLP 病變;l. 患兒母親右側頰黏膜病變的組織病理學圖像,表現為部分上皮萎縮、輕度局灶性上皮發育不良、基底細胞變性以及固有層的慢性炎癥細胞浸潤(蘇木精-伊紅染色×200)。OLP:口腔扁平苔蘚
針對患兒主要采用局部治療方法,即局部 0.03%他克莫司軟膏治療皮膚和指甲病變;口腔病變行黏膜下局部封閉注射復方倍他米松注射液(5 mg/mL)與鹽酸利多卡因注射液(0.02 g/mL)1∶1 混合液 1 次,并采用局部涂抹 0.03%他克莫司軟膏、1 次/d 生理鹽水 1∶5 稀釋復方倍他米松注射液(5 mg/mL)后局敷口腔黏膜病損部位、復方氯己定含漱液含漱。經過 18 個月的治療,患兒癥狀緩解,但口腔糜爛病損愈合效果有限,病情時有復發。后進行復方倍他米松+利多卡因局部封閉注射 2 次,并將局部用藥更改為口腔病損糜爛復發期間,每日于糜爛病損部位局部夜間涂抹 0.1%曲安奈德口腔軟膏+日間醋酸地塞米松口腔貼片(0.3 mg)敷蓋。
患兒確診 2 年后,患兒母親也因出現進食后口腔疼痛等類似癥狀前來我院門診就診。2020 年 11 月 3 日對患兒母親的口腔檢查顯示雙側頰黏膜、硬腭和下唇處存在白色網紋狀病變,硬腭部位有一約 5 mm×10 mm 萎縮性病變,未見皮膚或指甲損傷。綜合患兒母親的臨床和病理檢查結果(圖1i~1l),診斷為 OLP。針對患兒母親的病變,局部使用復方倍他米松注射液(5 mg/mL)與鹽酸利多卡因注射液(0.02 g/mL)1∶1 混合液局部封閉注射 1 次,并使用生理鹽水 1∶5 稀釋復方倍他米松注射液(5 mg/mL)后 1 次/d 局敷,持續 2 周。經過上述治療后,患兒母親的癥狀得到顯著緩解。
因患兒及其母親均出現 OLP,為進一步探究其家族病史,2021 年 7 月 20 日對患兒父親進行口腔黏膜、指甲和皮膚檢查,未發現任何病變。同時收集患兒及其父母的全血樣本,進行平均深度為 30×的全基因組測序(trioWGS)。該測序在 Chigene 轉化醫學研究中心完成,包括單核苷酸多態性(single nucleotide polymorphism, SNP)和短插入缺失的分析。測序結果顯示,患兒及其母親的基因組中存在與 OLP 相關的已知 SNP,即腫瘤壞死因子受體超家族成員 1B(tumor necrosis factor receptor superfamily member 1B, TNFRSF1B) 基因中的 c.587(exon6)T>G(rs1061622);此外,發現 2 個新的單核苷酸變異(single nucleotide variant, SNV),即 Toll 樣受體 4(Toll-like receptor 4, TLR4)基因的 c.157(exon4)A>G(rs56302444)和白細胞介素(interleukin, IL)-32 基因的 c.11(exon1)C>T(rs755307247),這 2 個變異導致氨基酸改變,患兒父親的基因組中未發現這 2 個 SNV(圖2)。對于上述基因測序結果,利用 1000 Genomes Project、dbSNP、ESP、ExAC、MAFs 等數據庫,以及 Provean、Sift、PolyPhen2、Mutation Taster、M-Cap、Revel 等軟件包進行遺傳變異的計算分析(變異注釋、致病性預測和拷貝數變異分析),以評估其對蛋白質功能的潛在影響(圖2)。
 圖2
OLP 患兒及其母親(OLP 成年患者)和父親的基因組測序及遺傳變異計算分析結果
圖2
OLP 患兒及其母親(OLP 成年患者)和父親的基因組測序及遺傳變異計算分析結果
a.
患兒及其父母的基因組測序及遺傳變異計算分析結果顯示,遺傳因素可能是導致該患兒在幼年 OLP 發病的重要原因。若患兒成年后懷孕并進行產前遺傳檢測,發現患兒后代具有與患兒及其母親相同的 OLP 相關遺傳變異,則應密切關注患兒后代的口腔狀況,一旦出現兒童 OLP 癥狀則需及時對癥治療,以提高患兒后代的生活質量。后續患兒及其母親持續在我院門診隨訪復診治療。最近 1 次復診時間為 2024 年 7 月 30 日,患兒自覺口內無明顯不適,進食辛辣刺激食物時也無激發痛,口腔檢查見病損以白色斑紋樣病損為主,但仍伴有局部淺糜爛,家長訴患兒仍偶有口腔黏膜糜爛加重復發;患兒母親口內病損幾乎消失,且無明顯癥狀。
討論 口腔 OLP 作為一種慢性炎癥性自身免疫疾病,主要見于成人,而在兒童中則較為罕見。迄今為止,兒童 OLP 的發病機制尚未完全明確。然而,在深入探索 OLP 病因學的過程中,遺傳因素被認為在其發病機制中扮演著至關重要的角色,尤其是現有研究對于炎癥相關基因如 TNFRSF1B、TNF、TLR 等的多種 SNP 及 SNV 的分析[1-4],進一步堅固了 OLP 作為一種自身免疫及炎癥性疾病的遺傳學基礎,其涉及細胞因子信號傳導、先天免疫及抗原呈遞的基因變異,揭示了由遺傳因素導致的 OLP 中免疫反應的失調。
本病例中,在受 OLP 影響的家族成員基因中發現了 TNFRSF1B 基因內的一個重要 SNP 變異即 c.587(exon6)T>G(rs1061622)。這一發現與先前的研究結果[1]相吻合,均指出該 SNP 在 OLP 的發病機制中具有關鍵作用。該 SNP 使胸腺嘧啶(T)核苷酸被替換為鳥嘌呤(G)核苷酸,引起氨基酸由甲硫氨酸變為精氨酸。盡管使用生物信息學工具的功能預測分析顯示,這種變異對 TNFRSF1B 蛋白的功能影響可能相對有限,但結合先前關于日本 OLP 患者群體中 TNFRSF1B(+587G )等位基因頻率顯著增加的研究[1],仍提示 TNFRSF1B 基因的遺傳變異在 OLP 的病因學中占重要地位。
此外,本病例患兒及其母親(OLP 成年患者)的基因組測序發現了 2 種 SNV,檢索 PubMed 數據庫,收集從建庫至 2024 年 12 月 31 日的所有 OLP 研究[1-15](表1),均未見曾報道這 2 種 SNV,而這些變異在患兒父親的基因組中并未檢測到。這 2 種新的 SNV 包括位于 TLR4 基因的 c.157(exon4)A>G(rs56302444)和位于 IL-32 基因的 c.11(exon1)C>T(rs755307247)。TLR4 基因編碼的 TLR4 在識別病原體及激活先天免疫反應中起到至關重要的作用,能夠觸發促炎反應;OLP 患者口腔黏膜上皮中 TLR4 水平顯著增加,TLR4 通過激活核因子κB 通路,并在口腔角質形成細胞中調節程序性死亡受體配體 1/B7 同源物 1 的表達,進而影響 OLP 中特異性 T 細胞的增殖和凋亡[16-18]。本病例中,TLR4 基因中的 SNV 使腺嘌呤(A)核苷酸被替換為鳥嘌呤(G)核苷酸,導致氨基酸由異亮氨酸變為纈氨酸,這一變化可能對 TLR4 的功能產生顯著影響,并可能增加 OLP 特征性的上皮細胞凋亡。考慮到 IL-17 在 OLP 中的作用以及 TLR4 與 IL-17 在多種免疫和炎癥性疾病中的相互作用,推測 TLR4 可能通過調節 IL-17 參與 OLP 的發病機制。因此,TLR4 基因中的這一 SNV 引起的功能變化在 OLP 發病機制中可能起到關鍵作用。
同時,本病例中 IL-32 基因中鑒定出的 SNV rs755307247 展現了胞嘧啶(C)核苷酸向胸腺嘧啶(T)的替換,導致編碼蛋白在特定位點上脯氨酸向亮氨酸的突變。該發現為深入解析 OLP 的發病機制提供了新的視角。IL-32 在激活 T 細胞和自然殺傷細胞中高表達,并在免疫反應調節中扮演重要角色[19],它能誘導單核細胞分化為巨噬細胞,激發關鍵促炎細胞因子如 IL-1β、IL-6、IL-8 和腫瘤壞死因子α的產生[20-21]。這些因子在 OLP 的病理過程中發揮核心作用,主要通過核因子κB 和絲裂原激活蛋白激酶途徑在巨噬細胞中產生作用。由 SNV 引起的 IL-32 蛋白結構改變,可能顯著影響其在細胞因子激活中的功能,特別是在 OLP 的炎癥反應中。鑒于 IL-32 在口腔等多種組織中廣泛表達,這種遺傳變異可能增強 OLP 的炎癥特性。因此,對 IL-32 功能的這種可能影響,提示了進一步研究 rs755307247 等遺傳變異與 OLP 進展之間的復雜關系很重要。
檢索 PubMed 數據庫,收集建庫至 2024 年 12 月 31 日的兒童 OLP(出生到 12 歲診斷為 OLP )的病例分析[22-30](表2),結果顯示兒童 OLP 的發病年齡范圍較廣,并呈現出多樣化的臨床表型,包括網紋型、潰瘍/糜爛型和萎縮型等。值得一提的是,部分病例除了口腔病變外,還伴有口外病變及全身性疾病。主要治療手段為局部使用皮質類固醇,其治療效果不一,從部分緩解至完全緩解均有報道。這些研究結果突顯了兒童 OLP 在臨床表現上的異質性,提示制定個體化治療計劃的必要性。本病例中,OLP 患兒及其母親在臨床表現上存在顯著差異。患兒經歷了嚴重的糜爛性病變和顯著的疼痛感,而其母親的病變相對較輕,不適感也較輕。特別是,患兒對常規治療反應較差,而患兒母親對治療反應較好。這一臨床表現的差異性提示需要進一步研究以揭示其背后的原因。OLP 的治療目標主要是減輕黏膜炎癥和糜爛、緩解癥狀、盡量降低患者發展為口腔癌的風險。對于兒童 OLP 患者,若無癥狀或癥狀輕微,可能不需積極治療,因癥狀和病變有可能自行緩解,因此,定期隨訪成為治療中的重要環節[22-24, 31]。對于癥狀明顯的兒童 OLP 患者,標準治療方案主要為局部治療,有時需配合全身使用皮質類固醇,具體的治療方案需要根據患兒的年齡、健康狀況及病變的嚴重程度來個體化制定[32]。然而,本病例顯示,患兒對局部類固醇涂抹和病灶內類固醇注射的反應并不理想,提示遺傳因素可能對疾病的表現和治療反應有潛在影響。
綜上,本病例中,通過對 OLP 及其罕見的兒童變異形式的遺傳學基礎進行深入探討,理解這一疾病及其在兒童中的表現形式提供了重要視角。特別是本病例中,在 TNFRSF1B 基因中發現特定 SNP,以及在兒童 OLP 患者的 TLR4 和 IL-32 基因中新鑒定出 SNV,明確了遺傳因素在成人及兒童 OLP 發病機制中起到復雜而關鍵的作用。這些遺傳學發現不僅加深了我們對成人及兒童 OLP 病理機制的理解,也為未來基于遺傳背景的精準治療策略的開發奠定了基礎。隨著對成人及兒童 OLP 遺傳復雜性的進一步揭示,期待能夠推動更為有效和個體化的治療方法的發展。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患兒,女,4 歲,因“反復口腔潰瘍半年”于 2018 年 9 月 18 日于四川大學華西口腔醫院(以下簡稱“我院”)門診就診。就診前半年,患兒出現嘴皮反復起皰化膿,口腔內多區域反復糜爛,糜爛期間疼痛明顯,進食時疼痛加劇,影響進食,未行積極治療。就診前 1 個月,患兒外陰部出現紅腫,無皮膚潰瘍,手指甲和腳趾甲出現裂紋和表層脫落,未處理。就診前 1 周,患兒面部和手背皮膚出現紅色丘疹伴有瘙癢,未處理。家長訴患兒既往無相關口腔黏膜和皮膚病史,無家族疾病史,但患兒平素體質較差。
體格檢查:體溫 36.2℃,心率 78 次/min,血壓 86/53 mm Hg(1 mm Hg=0.133 kPa)。患兒身體發育和智力均表現正常。患兒的手指甲和腳趾甲存在典型的扁平苔蘚特征,包括甲面粗糙、有光澤但伴有凹陷和裂紋(圖1a~1g)。口腔檢查顯示患兒頰黏膜和舌背存在明顯白色網紋,下唇處有血痂和分散的白色斑紋。患兒家長稱患兒病變部位存在疼痛,尤其是進食時癥狀加重。血常規、血糖、肝腎功能、免疫功能(抗可溶性抗原抗體譜、T 細胞亞群 CD3/CD4/CD8、免疫球蛋白 E/G/A/M、循環免疫復合物、抗核抗體、類風濕因子、補體 3/4、B 因子)、甲狀腺功能及甲狀腺抗體檢測(抗甲狀腺過氧化物酶自身抗體、促甲狀腺激素受體抗體、甲狀腺球蛋白抗體)、常規染色體檢查、G 帶核型分析、針對病毒(甲肝病毒、乙肝病毒、丙肝病毒、人類免疫缺陷病毒)和微生物(蒼白螺旋體、白色念珠菌)的感染篩查結果均未見明顯異常。切取患兒左側頰黏膜病損部位組織進行活檢,顯示病損口腔黏膜上皮部分上皮萎縮、角化過度、基底細胞變性,以及固有層淋巴細胞和漿細胞浸潤。綜合患兒的臨床表現和病理特征(圖1a~圖1h),最終診斷為伴有指甲損害的兒童口腔扁平苔蘚(oral lichen planus, OLP)。
 圖1
OLP 患兒及其母親(OLP 成年患者)的臨床表現和組織病理學特征
圖1
OLP 患兒及其母親(OLP 成年患者)的臨床表現和組織病理學特征
a~d. 患兒的口腔病變,特征包括舌背、雙側頰黏膜和嘴唇上有白色網紋和糜爛斑塊,提示存在 OLP 病變;e~g. 患兒的手指甲和腳趾甲變化,存在糙甲癥的典型表現,即光澤外觀伴有凹陷和甲裂,為指甲扁平苔蘚的表現形式;h. 患兒左側頰黏膜病變的組織病理學圖像,表現為部分上皮萎縮、角化過度、基底細胞變性以及固有層淋巴細胞和漿細胞浸潤(蘇木精-伊紅染色×200);i~k. 患兒母親的口腔病變,表現為硬腭和頰黏膜上有白色網紋和糜爛斑塊,提示存在 OLP 病變;l. 患兒母親右側頰黏膜病變的組織病理學圖像,表現為部分上皮萎縮、輕度局灶性上皮發育不良、基底細胞變性以及固有層的慢性炎癥細胞浸潤(蘇木精-伊紅染色×200)。OLP:口腔扁平苔蘚
針對患兒主要采用局部治療方法,即局部 0.03%他克莫司軟膏治療皮膚和指甲病變;口腔病變行黏膜下局部封閉注射復方倍他米松注射液(5 mg/mL)與鹽酸利多卡因注射液(0.02 g/mL)1∶1 混合液 1 次,并采用局部涂抹 0.03%他克莫司軟膏、1 次/d 生理鹽水 1∶5 稀釋復方倍他米松注射液(5 mg/mL)后局敷口腔黏膜病損部位、復方氯己定含漱液含漱。經過 18 個月的治療,患兒癥狀緩解,但口腔糜爛病損愈合效果有限,病情時有復發。后進行復方倍他米松+利多卡因局部封閉注射 2 次,并將局部用藥更改為口腔病損糜爛復發期間,每日于糜爛病損部位局部夜間涂抹 0.1%曲安奈德口腔軟膏+日間醋酸地塞米松口腔貼片(0.3 mg)敷蓋。
患兒確診 2 年后,患兒母親也因出現進食后口腔疼痛等類似癥狀前來我院門診就診。2020 年 11 月 3 日對患兒母親的口腔檢查顯示雙側頰黏膜、硬腭和下唇處存在白色網紋狀病變,硬腭部位有一約 5 mm×10 mm 萎縮性病變,未見皮膚或指甲損傷。綜合患兒母親的臨床和病理檢查結果(圖1i~1l),診斷為 OLP。針對患兒母親的病變,局部使用復方倍他米松注射液(5 mg/mL)與鹽酸利多卡因注射液(0.02 g/mL)1∶1 混合液局部封閉注射 1 次,并使用生理鹽水 1∶5 稀釋復方倍他米松注射液(5 mg/mL)后 1 次/d 局敷,持續 2 周。經過上述治療后,患兒母親的癥狀得到顯著緩解。
因患兒及其母親均出現 OLP,為進一步探究其家族病史,2021 年 7 月 20 日對患兒父親進行口腔黏膜、指甲和皮膚檢查,未發現任何病變。同時收集患兒及其父母的全血樣本,進行平均深度為 30×的全基因組測序(trioWGS)。該測序在 Chigene 轉化醫學研究中心完成,包括單核苷酸多態性(single nucleotide polymorphism, SNP)和短插入缺失的分析。測序結果顯示,患兒及其母親的基因組中存在與 OLP 相關的已知 SNP,即腫瘤壞死因子受體超家族成員 1B(tumor necrosis factor receptor superfamily member 1B, TNFRSF1B) 基因中的 c.587(exon6)T>G(rs1061622);此外,發現 2 個新的單核苷酸變異(single nucleotide variant, SNV),即 Toll 樣受體 4(Toll-like receptor 4, TLR4)基因的 c.157(exon4)A>G(rs56302444)和白細胞介素(interleukin, IL)-32 基因的 c.11(exon1)C>T(rs755307247),這 2 個變異導致氨基酸改變,患兒父親的基因組中未發現這 2 個 SNV(圖2)。對于上述基因測序結果,利用 1000 Genomes Project、dbSNP、ESP、ExAC、MAFs 等數據庫,以及 Provean、Sift、PolyPhen2、Mutation Taster、M-Cap、Revel 等軟件包進行遺傳變異的計算分析(變異注釋、致病性預測和拷貝數變異分析),以評估其對蛋白質功能的潛在影響(圖2)。
 圖2
OLP 患兒及其母親(OLP 成年患者)和父親的基因組測序及遺傳變異計算分析結果
圖2
OLP 患兒及其母親(OLP 成年患者)和父親的基因組測序及遺傳變異計算分析結果
a.
患兒及其父母的基因組測序及遺傳變異計算分析結果顯示,遺傳因素可能是導致該患兒在幼年 OLP 發病的重要原因。若患兒成年后懷孕并進行產前遺傳檢測,發現患兒后代具有與患兒及其母親相同的 OLP 相關遺傳變異,則應密切關注患兒后代的口腔狀況,一旦出現兒童 OLP 癥狀則需及時對癥治療,以提高患兒后代的生活質量。后續患兒及其母親持續在我院門診隨訪復診治療。最近 1 次復診時間為 2024 年 7 月 30 日,患兒自覺口內無明顯不適,進食辛辣刺激食物時也無激發痛,口腔檢查見病損以白色斑紋樣病損為主,但仍伴有局部淺糜爛,家長訴患兒仍偶有口腔黏膜糜爛加重復發;患兒母親口內病損幾乎消失,且無明顯癥狀。
討論 口腔 OLP 作為一種慢性炎癥性自身免疫疾病,主要見于成人,而在兒童中則較為罕見。迄今為止,兒童 OLP 的發病機制尚未完全明確。然而,在深入探索 OLP 病因學的過程中,遺傳因素被認為在其發病機制中扮演著至關重要的角色,尤其是現有研究對于炎癥相關基因如 TNFRSF1B、TNF、TLR 等的多種 SNP 及 SNV 的分析[1-4],進一步堅固了 OLP 作為一種自身免疫及炎癥性疾病的遺傳學基礎,其涉及細胞因子信號傳導、先天免疫及抗原呈遞的基因變異,揭示了由遺傳因素導致的 OLP 中免疫反應的失調。
本病例中,在受 OLP 影響的家族成員基因中發現了 TNFRSF1B 基因內的一個重要 SNP 變異即 c.587(exon6)T>G(rs1061622)。這一發現與先前的研究結果[1]相吻合,均指出該 SNP 在 OLP 的發病機制中具有關鍵作用。該 SNP 使胸腺嘧啶(T)核苷酸被替換為鳥嘌呤(G)核苷酸,引起氨基酸由甲硫氨酸變為精氨酸。盡管使用生物信息學工具的功能預測分析顯示,這種變異對 TNFRSF1B 蛋白的功能影響可能相對有限,但結合先前關于日本 OLP 患者群體中 TNFRSF1B(+587G )等位基因頻率顯著增加的研究[1],仍提示 TNFRSF1B 基因的遺傳變異在 OLP 的病因學中占重要地位。
此外,本病例患兒及其母親(OLP 成年患者)的基因組測序發現了 2 種 SNV,檢索 PubMed 數據庫,收集從建庫至 2024 年 12 月 31 日的所有 OLP 研究[1-15](表1),均未見曾報道這 2 種 SNV,而這些變異在患兒父親的基因組中并未檢測到。這 2 種新的 SNV 包括位于 TLR4 基因的 c.157(exon4)A>G(rs56302444)和位于 IL-32 基因的 c.11(exon1)C>T(rs755307247)。TLR4 基因編碼的 TLR4 在識別病原體及激活先天免疫反應中起到至關重要的作用,能夠觸發促炎反應;OLP 患者口腔黏膜上皮中 TLR4 水平顯著增加,TLR4 通過激活核因子κB 通路,并在口腔角質形成細胞中調節程序性死亡受體配體 1/B7 同源物 1 的表達,進而影響 OLP 中特異性 T 細胞的增殖和凋亡[16-18]。本病例中,TLR4 基因中的 SNV 使腺嘌呤(A)核苷酸被替換為鳥嘌呤(G)核苷酸,導致氨基酸由異亮氨酸變為纈氨酸,這一變化可能對 TLR4 的功能產生顯著影響,并可能增加 OLP 特征性的上皮細胞凋亡。考慮到 IL-17 在 OLP 中的作用以及 TLR4 與 IL-17 在多種免疫和炎癥性疾病中的相互作用,推測 TLR4 可能通過調節 IL-17 參與 OLP 的發病機制。因此,TLR4 基因中的這一 SNV 引起的功能變化在 OLP 發病機制中可能起到關鍵作用。
同時,本病例中 IL-32 基因中鑒定出的 SNV rs755307247 展現了胞嘧啶(C)核苷酸向胸腺嘧啶(T)的替換,導致編碼蛋白在特定位點上脯氨酸向亮氨酸的突變。該發現為深入解析 OLP 的發病機制提供了新的視角。IL-32 在激活 T 細胞和自然殺傷細胞中高表達,并在免疫反應調節中扮演重要角色[19],它能誘導單核細胞分化為巨噬細胞,激發關鍵促炎細胞因子如 IL-1β、IL-6、IL-8 和腫瘤壞死因子α的產生[20-21]。這些因子在 OLP 的病理過程中發揮核心作用,主要通過核因子κB 和絲裂原激活蛋白激酶途徑在巨噬細胞中產生作用。由 SNV 引起的 IL-32 蛋白結構改變,可能顯著影響其在細胞因子激活中的功能,特別是在 OLP 的炎癥反應中。鑒于 IL-32 在口腔等多種組織中廣泛表達,這種遺傳變異可能增強 OLP 的炎癥特性。因此,對 IL-32 功能的這種可能影響,提示了進一步研究 rs755307247 等遺傳變異與 OLP 進展之間的復雜關系很重要。
檢索 PubMed 數據庫,收集建庫至 2024 年 12 月 31 日的兒童 OLP(出生到 12 歲診斷為 OLP )的病例分析[22-30](表2),結果顯示兒童 OLP 的發病年齡范圍較廣,并呈現出多樣化的臨床表型,包括網紋型、潰瘍/糜爛型和萎縮型等。值得一提的是,部分病例除了口腔病變外,還伴有口外病變及全身性疾病。主要治療手段為局部使用皮質類固醇,其治療效果不一,從部分緩解至完全緩解均有報道。這些研究結果突顯了兒童 OLP 在臨床表現上的異質性,提示制定個體化治療計劃的必要性。本病例中,OLP 患兒及其母親在臨床表現上存在顯著差異。患兒經歷了嚴重的糜爛性病變和顯著的疼痛感,而其母親的病變相對較輕,不適感也較輕。特別是,患兒對常規治療反應較差,而患兒母親對治療反應較好。這一臨床表現的差異性提示需要進一步研究以揭示其背后的原因。OLP 的治療目標主要是減輕黏膜炎癥和糜爛、緩解癥狀、盡量降低患者發展為口腔癌的風險。對于兒童 OLP 患者,若無癥狀或癥狀輕微,可能不需積極治療,因癥狀和病變有可能自行緩解,因此,定期隨訪成為治療中的重要環節[22-24, 31]。對于癥狀明顯的兒童 OLP 患者,標準治療方案主要為局部治療,有時需配合全身使用皮質類固醇,具體的治療方案需要根據患兒的年齡、健康狀況及病變的嚴重程度來個體化制定[32]。然而,本病例顯示,患兒對局部類固醇涂抹和病灶內類固醇注射的反應并不理想,提示遺傳因素可能對疾病的表現和治療反應有潛在影響。
綜上,本病例中,通過對 OLP 及其罕見的兒童變異形式的遺傳學基礎進行深入探討,理解這一疾病及其在兒童中的表現形式提供了重要視角。特別是本病例中,在 TNFRSF1B 基因中發現特定 SNP,以及在兒童 OLP 患者的 TLR4 和 IL-32 基因中新鑒定出 SNV,明確了遺傳因素在成人及兒童 OLP 發病機制中起到復雜而關鍵的作用。這些遺傳學發現不僅加深了我們對成人及兒童 OLP 病理機制的理解,也為未來基于遺傳背景的精準治療策略的開發奠定了基礎。隨著對成人及兒童 OLP 遺傳復雜性的進一步揭示,期待能夠推動更為有效和個體化的治療方法的發展。
利益沖突:所有作者聲明不存在利益沖突。