引用本文: 段曉婭, 左云霞. 體外膜肺氧合支持下修補嚴重氣管食管瘺一例. 華西醫學, 2024, 39(11): 1830-1832. doi: 10.7507/1002-0179.202404138 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患者,女,21 歲,因“食管化學性燒傷 12+ 個月,吞咽困難伴嗆咳 11+ 個月”于 2023 年 12 月 7 日入四川大學華西醫院(以下簡稱“我院”)。入院前 12+ 個月,患者誤食氫氧化鈉溶液,立即就診于當地醫院,予以對癥治療后出院。入院前 11+ 個月,患者出現吞咽困難,進食稍有哽咽感,伴飲水嗆咳,就診于當地醫院,行胃鏡檢查提示腐蝕性食管炎、腐蝕性胃炎,予以食管擴張處理后出院。出院后患者吞咽困難伴嗆咳逐漸加重,再次就診于當地醫院,胃鏡檢查提示氣管食管瘺(tracheoesophageal fistula, TEF),行食管支架安置術后出院。出院后患者逐漸出現進食困難,無法吞咽伴咳嗽,于當地醫院行暫時性氣管切開術及氣管切口封閉,并行顯微支撐喉鏡下激光喉狹窄粘連松解術+會厭重建術,癥狀無明顯改善。患者 2023 年 6 月 4 日于我院再次行氣管切開、內鏡下食管擴張術+營養管安置術等治療后出院,但癥狀仍無明顯改善。患者為進一步治療前來就診,門診以“氣管食管瘺、食管狹窄”收入胸外科。患者既往無其他特殊病史。
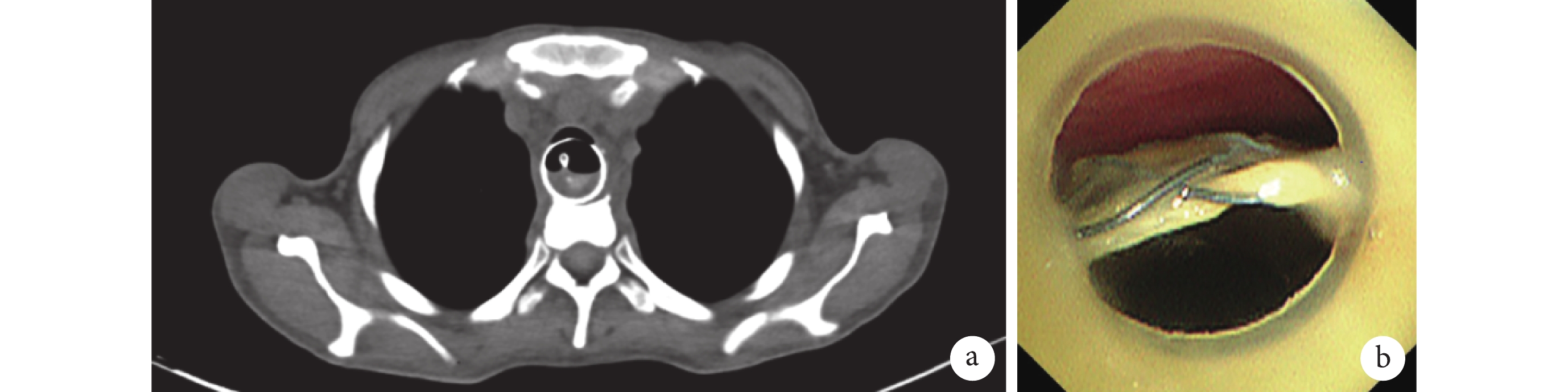
入院體格檢查:體溫 36.9℃,脈搏 74 次/min,呼吸頻率 18 次/min,血壓 135/91 mm Hg(1 mm Hg=0.133 kPa),身高 163 cm,體重 44 kg。患者意識清楚,氣管呈切開狀態,頸正中帶套囊氣管切開導管在位,患者呼吸平穩,偶有嗆咳,無呼吸困難及呼吸道梗阻表現,可平臥。心律齊,雙肺呼吸音稍粗,可聞及散在濕啰音。2023 年 12 月 7 日胸部 CT(圖1a)提示胸段食管(平第 3~7 胸椎椎體水平)內支架影,食管近端前方氣管后壁菲薄、顯示不清,局部氣管與食管相通可能;支架后上部局部向后突;左主支氣管局部稍受壓變窄;左肺下葉及右肺中葉炎癥。12 月 11 日支氣管鏡檢查(圖1b)顯示氣管導管下緣氣管中段后壁可見 TEF 瘺口及食管支架上緣,食管支架經瘺口突入氣管腔內,存在食管-氣管中段瘺口和食管-左主支氣管中上段瘺口。
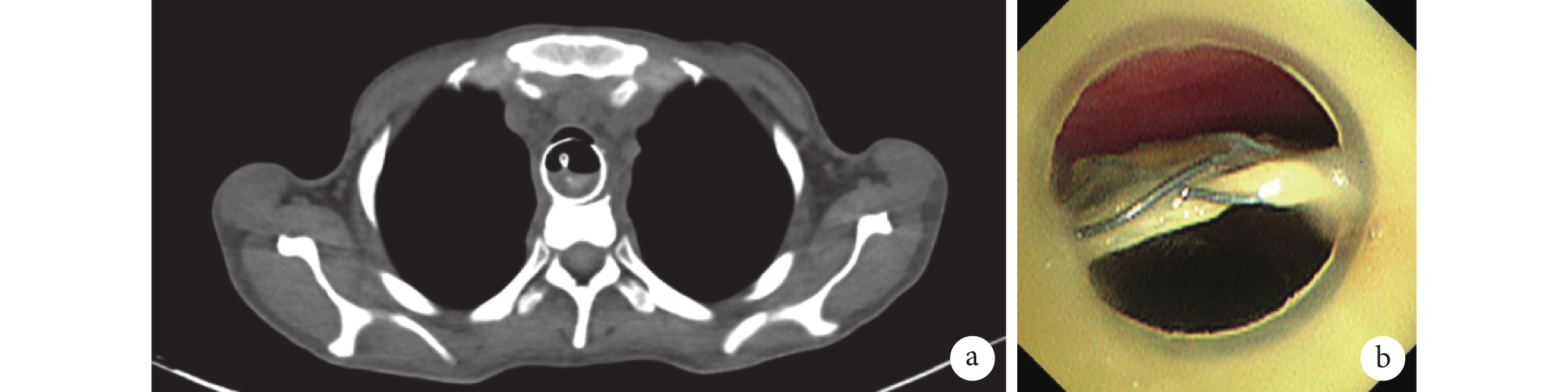 圖1
患者診療相關圖像
圖1
患者診療相關圖像
a. 胸部 CT 顯示食管支架突入氣管;b. 支氣管鏡檢查圖像
入院后患者先后實施全身麻醉下支氣管鏡檢查和無痛胃鏡檢查,2 次檢查期間都出現了緊急搶救情況(突發通氣困難、嚴重低氧血癥)。結合患者病情,擬行食管支架取出術+主氣管瘺修補術,以及肌瓣修補左主支氣管瘺術+空腸造瘺術。術前多學科討論達成共識,考慮先在體外膜肺氧合(extracorporeal membrane oxygenation, ECMO)支持下完成食管支架取出術+主氣管瘺修補術,以及肌瓣修補左主支氣管瘺手術,然后再逐漸減停 ECMO,并經氣管切開處氣管切開導管機械通氣完成后續手術。
患者于 12 月 19 日進行手術,具體麻醉及手術過程:患者入手術室后常規行心電監護,無創血壓 133/97 mm Hg,心率 79 次/min,血氧飽和度 98%(吸入氧濃度 21%),入手術室后經氣管切開導管予以 60%左右氧氣吸入,予鹽酸戊乙奎醚注射液 0.5 mg+枸櫞酸舒芬太尼注射液 2.5 μg,間斷靜脈推注 10~20 mg 丙泊酚注射液,并予以鹽酸右美托咪定注射液 0.5 μg/(kg·h)靜脈持續泵注,期間保留患者自主呼吸,呈嗜睡狀態,呼之可應。全憑靜脈淺鎮靜下行右側橈動脈穿刺置管,予連續有創動脈血壓監測;行左側頸內靜脈穿刺置管留作靜脈輸液大通道;穿刺點予鹽酸利多卡因注射液局部麻醉后,行右側股靜脈及右側頸內靜脈穿刺置入靜脈插管,建立靜脈-靜脈 ECMO(veno-venous ECMO, V-V ECMO),建立 V-V ECMO 用時 28 min,期間患者生命體征平穩,未出現缺氧表現。靜脈給予肝素鈉注射液
討論 TEF 是由各種因素導致食管與氣管和/或支氣管之間破潰形成的病理性交通。食管置入金屬支架是許多獲得性 TEF 的原因[1]。獲得性非惡性 TEF 主要與醫源性損傷相關,包括機械性通氣的并發癥、氣管食管相關手術并發癥、肉芽腫性縱隔感染、外傷、腐蝕性損傷、異物、結核分枝桿菌等病原微生物感染或支氣管局部炎癥等,而對于此類 TEF,目前主要選擇外科手術治療。對于因惡性或良性肺、食管疾病引起的氣管阻塞及瘺管,置入多種不同材料制成的氣管或食管支架也是一種重要的治療方法[2-3]。對于本例患者來說,既往已行食管支架置入作為替代治療方法,此次入院檢查發現食管支架經瘺口突入氣管腔內,食管基本與氣管形成共用通道,遂此次入院擬行食管支架取出+TEF 修補術。
氣管管理通常是 TEF 手術中最大的難點。對于 TEF 患者的麻醉氣管管理,可依據瘺口部位選擇不同的氣管導管。瘺口位于主支氣管平面以下者選雙腔氣管導管行健側單肺通氣,瘺口平面位于氣管近喉端、瘺口直徑大、氣管受壓或狹窄者選單腔氣管導管。依據瘺口直徑不同還可選擇不同的誘導方式,如快速誘導插管、表面麻醉清醒下氣管插管[4]。但臨床上病變累及主氣管的情況下,有時氣管控制是非常困難的或幾乎是不可能的,一旦氣管失控則可能威脅患者生命。這些情況常見于因氣管本身病變或氣管外腫物導致嚴重氣管狹窄時。有的患者在術前就已處于強迫體位或者休息狀態下氧飽和度就已經不能維持,麻醉給予任何鎮靜藥物都存在氣管塌陷的風險。通常這種情況下推薦清醒氣管插管,但當氣管狹窄到一定程度時,清醒插管也很難保障氣管導管能通過。結合本例患者的纖維支氣管鏡檢查及胸部 CT,可知患者氣管切開導管下緣與食管支架上端距離較近,基本形成氣管與食管共用通道,氣管內可容納氣管插管通過的位置有限,很難在氣管內繞過食管支架插管,且患者在術前就靠氣管切開維持通氣,說明其上呼吸道的狹窄程度也相當嚴重。對于本例患者,通過氣管切開導管通氣是一個備選方案,但因為患者的 TEF 瘺口過大,甚至出現食管氣管共用一個通道的情況,這就很難保證打斷自主呼吸后,正壓通氣能使氣體進入雙肺而不是進入消化道。若大量氣體進入消化道,可引起急性胃膨脹、胃內壓增高,大量胃內容物反流導致窒息、吸入性肺炎等風險。本例患者在入院后支氣管鏡檢查和胃腸鏡檢查中都因為自主呼吸抑制,正壓通氣期間出現雙肺通氣不良(可能是食管支架移位導致其經 TEF 瘺口完全突出氣管內所致),發生了嚴重的低氧血癥,幾乎危急患者生命。因此,本例患者的手術目標是避免再次發生類似危急生命的緊急情況。
ECMO 是一種特殊方式的體外循環,其可將血液從靜脈引出,經過膜肺氧合后排出二氧化碳而形成動脈血,之后在泵的推動下回到靜脈或動脈,常用于體外呼吸支持及心臟支持[5]。近年來 ECMO 用于氣管創傷、困難氣管、TEF 患者的報道逐漸增多[6-8]。ECMO 作為一種體外生命支持的方式,是圍手術期胸外科醫生的重要輔助工具,可用于擴展氣管手術或內鏡下氣管操作;同時使用 ECMO 代替機械通氣可以更好地觀察手術部位,避免了氣管內插管和積極通氣及其所有潛在后果。最重要的是,ECMO 使得可以在完全穩定的條件下進行復雜的手術。而本例患者為年輕女性,既往無特殊病史,心功能良好,在本次手術中最大的風險即為通氣與氧合的問題,且已因此發生過緊急搶救的情況,因此選擇在體外循環支持下行手術治療對該患者來說尤為重要。同時由于 ECMO 管道系統有肝素涂層,術中 ACT 僅需維持在 160~220 s。相比常規體外循環,患者術中出血風險更小,甚至與常規手術過程中觀察到的出血沒有明顯不同;其中 V-V ECMO 僅利用靜脈插管部位,其可以通過有效的二氧化碳去除和氧合為肺功能提供完整的支持,同時降低動脈插管帶來的出血、動脈瘤或假性動脈瘤、肢體缺血和栓塞等不良事件,可專門用于呼吸系統疾病患者[9-10]。近年來,V-V ECMO 已被證明是可行和安全的術中支持方式,有利于特定患者的各種氣管和胸部手術[11]。故本例患者選擇了 V-V ECMO 模式下進行手術治療。
盡管圍手術期使用 ECMO 可以提供體外呼吸及心臟支持,以保證手術安全穩定地進行,但 ECMO 技術本身是一種創傷大、高風險的生命支持形式,加強 ECMO 期間的麻醉管理是患者獲得最佳治療效果的必要手段。在血流動力學管理方面,ECMO 建立人工循環時,可能因為體外循環的啟動導致血壓下降,此時需要密切監測患者的血壓和血流動力學狀態,并根據需要調整血管活性藥物如去甲腎上腺素和多巴胺的使用。目標血壓應結合患者的組織、器官灌注和氧代謝情況來設定,以滿足重要臟器的灌注。本例患者使用了小劑量去甲腎上腺素 0.01~0.05 μg/(kg·min)來維持循環及灌注。容量管理方面,嚴格限制液體入量,并積極處理容量超負荷。V-V ECMO 在循環穩定的前提下,可維持液體負平衡,有利于減輕肺部滲出,減少術后肺部相關不良事件的發生。血氣管理方面,定時檢測動脈血氣,通過調節血流量和氣流量來保持動脈血二氧化碳分壓在 40 mm Hg 左右,中心靜脈血氧飽和度維持在 70%~75%為宜。本例患者定時進行血氣分析,并根據結果調整 ECMO 參數。如在流量恒定的情況下出現靜脈血氧飽和度下降,則可能出現機體代謝率增加,此時可以通過增加灌注流量或鎮靜、使用肌松藥等方法緩解。此外,在抗凝管理方面,ECMO 運行期間需要使用抗凝措施以預防血栓形成。肝素是 ECMO 期間最常用的抗凝劑。通常在 ECMO 插管前首次給予肝素,使 ACT 維持在 140~220 s 范圍內。運行過程中可持續泵注肝素,將 ACT 控制在 160~180 s 為宜。但不同個體對肝素的敏感性差異較大,靜脈輸注速度也存在很大不同。需要注意的是,肝素由尿液排泄,且可以與血小板結合,因此當尿量增加或輸血小板時,需相應增加肝素劑量,而當血小板減少或腎功能損傷時需減少劑量[12-13]。
總之,本例 TEF 患者在全身麻醉及 V-V ECMO 技術的輔助下,安全有效地進行了食管支架取出術+食管狹窄切除術+食管殘端修補術,既保證了患者有足夠的氧合,防止術中發生通氣困難、缺氧、搶救等不良事件,又避免了通氣漏氣進入胃內導致胃膨脹、胃內容物反流,盡量避免了誤吸風險。雖然與常規手術相比,ECMO 輔助手術可能導致出血等嚴重并發癥,但對于在 ECMO 輔助下解決氣管插管困難的問題后可以進行手術的患者,仍是較好的選擇。希望本病例能為獲得性非惡性 TEF 合并通氣和/或插管困難患者提供一種新的麻醉管理方法。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,女,21 歲,因“食管化學性燒傷 12+ 個月,吞咽困難伴嗆咳 11+ 個月”于 2023 年 12 月 7 日入四川大學華西醫院(以下簡稱“我院”)。入院前 12+ 個月,患者誤食氫氧化鈉溶液,立即就診于當地醫院,予以對癥治療后出院。入院前 11+ 個月,患者出現吞咽困難,進食稍有哽咽感,伴飲水嗆咳,就診于當地醫院,行胃鏡檢查提示腐蝕性食管炎、腐蝕性胃炎,予以食管擴張處理后出院。出院后患者吞咽困難伴嗆咳逐漸加重,再次就診于當地醫院,胃鏡檢查提示氣管食管瘺(tracheoesophageal fistula, TEF),行食管支架安置術后出院。出院后患者逐漸出現進食困難,無法吞咽伴咳嗽,于當地醫院行暫時性氣管切開術及氣管切口封閉,并行顯微支撐喉鏡下激光喉狹窄粘連松解術+會厭重建術,癥狀無明顯改善。患者 2023 年 6 月 4 日于我院再次行氣管切開、內鏡下食管擴張術+營養管安置術等治療后出院,但癥狀仍無明顯改善。患者為進一步治療前來就診,門診以“氣管食管瘺、食管狹窄”收入胸外科。患者既往無其他特殊病史。
入院體格檢查:體溫 36.9℃,脈搏 74 次/min,呼吸頻率 18 次/min,血壓 135/91 mm Hg(1 mm Hg=0.133 kPa),身高 163 cm,體重 44 kg。患者意識清楚,氣管呈切開狀態,頸正中帶套囊氣管切開導管在位,患者呼吸平穩,偶有嗆咳,無呼吸困難及呼吸道梗阻表現,可平臥。心律齊,雙肺呼吸音稍粗,可聞及散在濕啰音。2023 年 12 月 7 日胸部 CT(圖1a)提示胸段食管(平第 3~7 胸椎椎體水平)內支架影,食管近端前方氣管后壁菲薄、顯示不清,局部氣管與食管相通可能;支架后上部局部向后突;左主支氣管局部稍受壓變窄;左肺下葉及右肺中葉炎癥。12 月 11 日支氣管鏡檢查(圖1b)顯示氣管導管下緣氣管中段后壁可見 TEF 瘺口及食管支架上緣,食管支架經瘺口突入氣管腔內,存在食管-氣管中段瘺口和食管-左主支氣管中上段瘺口。
 圖1
患者診療相關圖像
圖1
患者診療相關圖像
a. 胸部 CT 顯示食管支架突入氣管;b. 支氣管鏡檢查圖像
入院后患者先后實施全身麻醉下支氣管鏡檢查和無痛胃鏡檢查,2 次檢查期間都出現了緊急搶救情況(突發通氣困難、嚴重低氧血癥)。結合患者病情,擬行食管支架取出術+主氣管瘺修補術,以及肌瓣修補左主支氣管瘺術+空腸造瘺術。術前多學科討論達成共識,考慮先在體外膜肺氧合(extracorporeal membrane oxygenation, ECMO)支持下完成食管支架取出術+主氣管瘺修補術,以及肌瓣修補左主支氣管瘺手術,然后再逐漸減停 ECMO,并經氣管切開處氣管切開導管機械通氣完成后續手術。
患者于 12 月 19 日進行手術,具體麻醉及手術過程:患者入手術室后常規行心電監護,無創血壓 133/97 mm Hg,心率 79 次/min,血氧飽和度 98%(吸入氧濃度 21%),入手術室后經氣管切開導管予以 60%左右氧氣吸入,予鹽酸戊乙奎醚注射液 0.5 mg+枸櫞酸舒芬太尼注射液 2.5 μg,間斷靜脈推注 10~20 mg 丙泊酚注射液,并予以鹽酸右美托咪定注射液 0.5 μg/(kg·h)靜脈持續泵注,期間保留患者自主呼吸,呈嗜睡狀態,呼之可應。全憑靜脈淺鎮靜下行右側橈動脈穿刺置管,予連續有創動脈血壓監測;行左側頸內靜脈穿刺置管留作靜脈輸液大通道;穿刺點予鹽酸利多卡因注射液局部麻醉后,行右側股靜脈及右側頸內靜脈穿刺置入靜脈插管,建立靜脈-靜脈 ECMO(veno-venous ECMO, V-V ECMO),建立 V-V ECMO 用時 28 min,期間患者生命體征平穩,未出現缺氧表現。靜脈給予肝素鈉注射液
討論 TEF 是由各種因素導致食管與氣管和/或支氣管之間破潰形成的病理性交通。食管置入金屬支架是許多獲得性 TEF 的原因[1]。獲得性非惡性 TEF 主要與醫源性損傷相關,包括機械性通氣的并發癥、氣管食管相關手術并發癥、肉芽腫性縱隔感染、外傷、腐蝕性損傷、異物、結核分枝桿菌等病原微生物感染或支氣管局部炎癥等,而對于此類 TEF,目前主要選擇外科手術治療。對于因惡性或良性肺、食管疾病引起的氣管阻塞及瘺管,置入多種不同材料制成的氣管或食管支架也是一種重要的治療方法[2-3]。對于本例患者來說,既往已行食管支架置入作為替代治療方法,此次入院檢查發現食管支架經瘺口突入氣管腔內,食管基本與氣管形成共用通道,遂此次入院擬行食管支架取出+TEF 修補術。
氣管管理通常是 TEF 手術中最大的難點。對于 TEF 患者的麻醉氣管管理,可依據瘺口部位選擇不同的氣管導管。瘺口位于主支氣管平面以下者選雙腔氣管導管行健側單肺通氣,瘺口平面位于氣管近喉端、瘺口直徑大、氣管受壓或狹窄者選單腔氣管導管。依據瘺口直徑不同還可選擇不同的誘導方式,如快速誘導插管、表面麻醉清醒下氣管插管[4]。但臨床上病變累及主氣管的情況下,有時氣管控制是非常困難的或幾乎是不可能的,一旦氣管失控則可能威脅患者生命。這些情況常見于因氣管本身病變或氣管外腫物導致嚴重氣管狹窄時。有的患者在術前就已處于強迫體位或者休息狀態下氧飽和度就已經不能維持,麻醉給予任何鎮靜藥物都存在氣管塌陷的風險。通常這種情況下推薦清醒氣管插管,但當氣管狹窄到一定程度時,清醒插管也很難保障氣管導管能通過。結合本例患者的纖維支氣管鏡檢查及胸部 CT,可知患者氣管切開導管下緣與食管支架上端距離較近,基本形成氣管與食管共用通道,氣管內可容納氣管插管通過的位置有限,很難在氣管內繞過食管支架插管,且患者在術前就靠氣管切開維持通氣,說明其上呼吸道的狹窄程度也相當嚴重。對于本例患者,通過氣管切開導管通氣是一個備選方案,但因為患者的 TEF 瘺口過大,甚至出現食管氣管共用一個通道的情況,這就很難保證打斷自主呼吸后,正壓通氣能使氣體進入雙肺而不是進入消化道。若大量氣體進入消化道,可引起急性胃膨脹、胃內壓增高,大量胃內容物反流導致窒息、吸入性肺炎等風險。本例患者在入院后支氣管鏡檢查和胃腸鏡檢查中都因為自主呼吸抑制,正壓通氣期間出現雙肺通氣不良(可能是食管支架移位導致其經 TEF 瘺口完全突出氣管內所致),發生了嚴重的低氧血癥,幾乎危急患者生命。因此,本例患者的手術目標是避免再次發生類似危急生命的緊急情況。
ECMO 是一種特殊方式的體外循環,其可將血液從靜脈引出,經過膜肺氧合后排出二氧化碳而形成動脈血,之后在泵的推動下回到靜脈或動脈,常用于體外呼吸支持及心臟支持[5]。近年來 ECMO 用于氣管創傷、困難氣管、TEF 患者的報道逐漸增多[6-8]。ECMO 作為一種體外生命支持的方式,是圍手術期胸外科醫生的重要輔助工具,可用于擴展氣管手術或內鏡下氣管操作;同時使用 ECMO 代替機械通氣可以更好地觀察手術部位,避免了氣管內插管和積極通氣及其所有潛在后果。最重要的是,ECMO 使得可以在完全穩定的條件下進行復雜的手術。而本例患者為年輕女性,既往無特殊病史,心功能良好,在本次手術中最大的風險即為通氣與氧合的問題,且已因此發生過緊急搶救的情況,因此選擇在體外循環支持下行手術治療對該患者來說尤為重要。同時由于 ECMO 管道系統有肝素涂層,術中 ACT 僅需維持在 160~220 s。相比常規體外循環,患者術中出血風險更小,甚至與常規手術過程中觀察到的出血沒有明顯不同;其中 V-V ECMO 僅利用靜脈插管部位,其可以通過有效的二氧化碳去除和氧合為肺功能提供完整的支持,同時降低動脈插管帶來的出血、動脈瘤或假性動脈瘤、肢體缺血和栓塞等不良事件,可專門用于呼吸系統疾病患者[9-10]。近年來,V-V ECMO 已被證明是可行和安全的術中支持方式,有利于特定患者的各種氣管和胸部手術[11]。故本例患者選擇了 V-V ECMO 模式下進行手術治療。
盡管圍手術期使用 ECMO 可以提供體外呼吸及心臟支持,以保證手術安全穩定地進行,但 ECMO 技術本身是一種創傷大、高風險的生命支持形式,加強 ECMO 期間的麻醉管理是患者獲得最佳治療效果的必要手段。在血流動力學管理方面,ECMO 建立人工循環時,可能因為體外循環的啟動導致血壓下降,此時需要密切監測患者的血壓和血流動力學狀態,并根據需要調整血管活性藥物如去甲腎上腺素和多巴胺的使用。目標血壓應結合患者的組織、器官灌注和氧代謝情況來設定,以滿足重要臟器的灌注。本例患者使用了小劑量去甲腎上腺素 0.01~0.05 μg/(kg·min)來維持循環及灌注。容量管理方面,嚴格限制液體入量,并積極處理容量超負荷。V-V ECMO 在循環穩定的前提下,可維持液體負平衡,有利于減輕肺部滲出,減少術后肺部相關不良事件的發生。血氣管理方面,定時檢測動脈血氣,通過調節血流量和氣流量來保持動脈血二氧化碳分壓在 40 mm Hg 左右,中心靜脈血氧飽和度維持在 70%~75%為宜。本例患者定時進行血氣分析,并根據結果調整 ECMO 參數。如在流量恒定的情況下出現靜脈血氧飽和度下降,則可能出現機體代謝率增加,此時可以通過增加灌注流量或鎮靜、使用肌松藥等方法緩解。此外,在抗凝管理方面,ECMO 運行期間需要使用抗凝措施以預防血栓形成。肝素是 ECMO 期間最常用的抗凝劑。通常在 ECMO 插管前首次給予肝素,使 ACT 維持在 140~220 s 范圍內。運行過程中可持續泵注肝素,將 ACT 控制在 160~180 s 為宜。但不同個體對肝素的敏感性差異較大,靜脈輸注速度也存在很大不同。需要注意的是,肝素由尿液排泄,且可以與血小板結合,因此當尿量增加或輸血小板時,需相應增加肝素劑量,而當血小板減少或腎功能損傷時需減少劑量[12-13]。
總之,本例 TEF 患者在全身麻醉及 V-V ECMO 技術的輔助下,安全有效地進行了食管支架取出術+食管狹窄切除術+食管殘端修補術,既保證了患者有足夠的氧合,防止術中發生通氣困難、缺氧、搶救等不良事件,又避免了通氣漏氣進入胃內導致胃膨脹、胃內容物反流,盡量避免了誤吸風險。雖然與常規手術相比,ECMO 輔助手術可能導致出血等嚴重并發癥,但對于在 ECMO 輔助下解決氣管插管困難的問題后可以進行手術的患者,仍是較好的選擇。希望本病例能為獲得性非惡性 TEF 合并通氣和/或插管困難患者提供一種新的麻醉管理方法。
利益沖突:所有作者聲明不存在利益沖突。